1.本发明属于纳米复合材料合成技术领域,具体涉及一种二氧化钼/二氧化钛纳米复合材料及其制备方法和应用。
背景技术:
2.现代工业的快速发展导致了严重的能源和环境危机。辐射到地球上1小时内的太阳能量超过了人类全年消耗总能量,因此有效利用太阳能可以缓解当前面临的能源和环境压力。其中有效利用太阳能的重要途径是光催化效应和光伏发电。光催化效应自20世纪70年代被发现至今已经被用于生物医学、环境保护等多个领域。在光催化过程中,光催化剂吸收大于其带隙的光子能量产生电子-空穴对,具有较高活性的光生电子和光生空穴迁移至催化剂表面引发氧化还原反应。典型的光催剂是半导体材料,其光催化过程包括三个步骤:(i)半导体材料在光激发下产生电子-空穴对,(ii)电子-空穴对发生分离和(iii)催化剂表面发生氧化还原反应。激发态载流子可以与多种物质发生氧化还原反应,如h2o、co2、o2和n2,因此广泛应用于能源生产和环境净化中。顾名思义,“光催化”是在光照下发生的氧化还原反应,这大大限制了光催化剂在弱光或黑暗环境中的应用。在光照减弱或者晚上,光催化剂将失去活性,研究一种能够进行昼夜工作的催化剂引起了研究者们的关注,具有多种工作机理的
‘
昼夜催化剂’应运而生,然而该方面研究刚刚起步,功能属性有待提升。
3.另一方面,可昼夜工作的光伏器件也有着广泛的应用前景。目前是将太阳电池和蓄电池结合起来以便夜间利用太阳电池的电能,这是一种行之有效的方法,然而也存在固有的不足,如双器件的制备成本较高,蓄电池存在安全隐患,且蓄电池容易丢失和损害等等。
技术实现要素:
4.为改善上述技术问题,本发明提供了一种二氧化钼/二氧化钛(moo2/tio2)纳米复合材料,所述二氧化钼和二氧化钛均以纳米晶形式存在,二氧化钼纳米晶原位生长在二氧化钛纳米晶上。优选地,所述二氧化钼纳米晶至少原位生长在二氧化钛纳米晶的外表面。
5.根据本发明的实施方案,所述纳米复合材料中,二氧化钼和二氧化钛的摩尔比为1:0.1-5,例如为1:0.5-2,示例性为1:1。
6.根据本发明的实施方案,所述moo2以层状形式生长在所述tio2的表面。
7.根据本发明的实施方案,所述moo2纳米晶的粒径为5-40nm,例如为10-30nm,示例性为20nm。
8.根据本发明的实施方案,所述纳米复合材料中,所述二氧化钛为实心晶体球或空心晶体球;当所述二氧化钛为实心晶体球时,记为moo2/实心球tio2纳米复合材料;当所述二氧化钛为空心晶体球时,记为moo2/空心球tio2纳米复合材料。
9.根据本发明的实施方案,所述moo2/实心球tio2纳米复合材料中,所述moo2原位生长在所述二氧化钛实心晶体球表面。
10.根据本发明的实施方案,所述moo2/实心球tio2纳米复合材料中,所述实心球tio2的粒径为0.1-2μm,例如为0.2-1μm,示例性为0.52μm、0.67μm、0.50μm、0.38μm、0.32μm。
11.根据本发明的实施方案,所述moo2/实心球tio2纳米复合材料中钛元素的原子质量分数为40%-56%,例如为44%-52%,示例性为48%。
12.根据本发明的实施方案,所述moo2/实心球tio2纳米复合材料中钼元素的原子质量分数为9%-25%,例如为13%-21%,示例性为17%。
13.根据本发明的实施方案,所述moo2/实心球tio2纳米复合材料具有基本如图6所示的形貌。
14.根据本发明的实施方案,所述moo2/空心球tio2纳米复合材料中,所述moo2原位生长在空心球tio2的内表面和外表面。
15.根据本发明的实施方案,所述moo2/空心球tio2纳米复合材料中,所述空心球tio2的粒径为0.1-2μm,例如为0.2-1μm,示例性为0.45μm、0.46μm、0.57μm、0.80μm。
16.根据本发明的实施方案,所述moo2/空心球tio2纳米复合材料中钛元素的原子质量分数为18%-34%,例如为22%-30%,示例性为26%。
17.根据本发明的实施方案,所述moo2/空心球tio2纳米复合材料中钼元素的原子质量分数26%-42%,例如为30%-38%,示例性为34%。
18.根据本发明的实施方案,所述moo2/空心球tio2纳米复合材料具有基本如图7所示的形貌。
19.本发明还提供所述moo2/tio2纳米复合材料的制备方法,所述制备方法包括以下步骤:采用水热法,使moo2纳米晶原位生长在tio2纳米晶的表面,得到所述moo2/tio2纳米复合材料;
20.优选地,所述tio2纳米晶可以为实心tio2纳米晶或空心tio2纳米晶;
21.当为实心tio2纳米晶时,所述moo2纳米晶原位生长在实心tio2纳米晶的外表面;
22.当为空心tio2纳米晶时,所述moo2纳米晶原位生长在空心tio2纳米晶的外表面和内表面。
23.根据本发明的实施方案,所述制备方法包括如下步骤:
24.1)将钛源分散至溶剂a中,得到前驱体溶液,将所述前驱体溶液倒入溶剂b中,收集得到的沉淀物;
25.2)步骤1)中得到的沉淀物进行水热反应,得到tio2纳米晶;
26.3)将步骤2)中得到的tio2纳米晶与钼源混合,进行水热反应,得到所述纳米复合材料。
27.根据本发明的实施方案,步骤1)中所述钛源选自硫酸氧钛、异丙醇钛和钛酸四丁酯中的至少一种,例如为钛酸四丁酯。
28.根据本发明的实施方案,步骤1)中所述钛源在所述溶剂a中的摩尔浓度为0.1-8mm,例如为0.5-4mm,示例性为0.68mm、0.85mm、1.03mm、1.21mm、2.30mm、3.5mm。
29.根据本发明的实施方案,步骤1)中所述溶剂a为选自甲醇、乙醇、乙二醇或丙二醇中的至少一种,例如为乙二醇。
30.根据本发明的实施方案,步骤1)所述前驱体溶液与所述溶剂b的体积比为1:2-5,例如为1:3-4.5,示例性为1:2、1:3、1:4、1:5。
31.根据本发明的实施方案,步骤1)中所述溶剂b选择能够将前驱体沉淀出的溶剂,例如选自丙酮、乙醚、甲基叔丁基醚和乙腈中的至少一种,优选为丙酮。
32.根据本发明的实施方案,步骤1)还包括对所述沉淀物进行干燥的过程。
33.根据本发明的实施方案,所述步骤2)中,当水热反应的反应物不包括含氟试剂时,得到实心tio2纳米晶。
34.根据本发明的实施方案,所述步骤2)中,当水热反应的反应物包括含氟试剂时,得到空心tio2纳米晶。
35.根据本发明的实施方案,步骤2)中,所述含氟试剂为能够提供氟离子的试剂,例如选自氟化铵、氟化钾和氟化钠中的至少一种,示例性为氟化铵。优选地,所述沉淀物中的ti元素和含氟试剂中的f元素的摩尔比为1:0.1-3,例如为1:0.3-2,例如1:0.3、1:0.5、1:1。
36.根据本发明的实施方案,步骤2)中,制备空心tio2纳米晶时的反应物还可以包括尿素,所述沉淀物中的ti元素与尿素的摩尔比为1:0.5-5,例如为1:0.8-3,示例性为1:2。
37.根据本发明的实施方案,步骤2)中,所述沉淀物与水热反应的溶剂的质量体积比为0.34-27mg/ml,例如为1-10mg/ml,示例性为4.7mg/ml。
38.根据本发明的实施方案,步骤3)中所述tio2纳米晶与水热反应的溶剂的质量体积比为0.34-27mg/ml,例如为1-10mg/ml,示例性为1mg/ml。
39.根据本发明的实施方案,步骤3)中所述钼源为乙酰丙酮钼和钼酸铵中的至少一种,优选为乙酰丙酮钼。
40.根据本发明的实施方案,步骤3)中所述tio2纳米晶中的钛元素和所述钼源中的钼元素的摩尔比为1:0.1-5,例如为1:0.2-2,示例性为1:0.5、1:1、1:2、1:3。
41.根据本发明的实施方案,步骤2)和步骤3)中所述水热反应的溶剂相同或不同,例如为水、或者水与有机溶剂的混合溶剂。其中,所述有机溶剂选自乙醇、乙二醇、丙二醇和异丙醇等中的至少一种,优选为乙醇;例如,所述水与有机溶剂的体积比为1:0-3,例如为1:0-1,示例性为1:0、1:0.5、1:1。
42.示例性地,步骤2)中,制备所述实心tio2纳米晶时,所述水热反应的溶剂为体积比1:1的乙醇与水的混合溶剂。
43.示例性地,步骤2)中,制备所述空心tio2纳米晶时,所述水热反应的溶剂为水。
44.示例性地,步骤3)中,所述水热反应的溶剂为体积比为4:1的水与乙醇的混合溶剂。
45.根据本发明的实施方案,步骤2)和步骤3)中所述水热反应的反应温度相同或不同,例如温度为120-240℃,比如为160-200℃,示例性为180℃。
46.根据本发明的实施方案,步骤2)和步骤3)中所述水热反应的反应时间相同或不同,例如时间为6-24h,比如为8-16h,示例性为8h、12h、16h、24h。
47.根据本发明的实施方案,moo2/实心球tio2纳米复合材料的制备方法包括如下步骤:
48.1)将钛源分散至乙二醇中,得到前驱体溶液,将所述前驱体溶液倒入丙酮,收集得到的沉淀物;
49.2)步骤1)中得到的沉淀物分散于乙醇与水的混合溶剂中,进行水热反应,得到实心tio2纳米晶;
50.3)将步骤2)中得到的实心tio2纳米晶与钼源分散于乙醇与水的混合溶剂中,进行水热反应,得到所述moo2/实心球tio2纳米复合材料。
51.根据本发明的实施方案,moo2/空心球tio2纳米复合材料的制备方法包括如下步骤:
52.1)将钛源分散至乙二醇中,得到前驱体溶液,将所述前驱体溶液倒入丙酮,收集得到的沉淀物;
53.2)步骤1)中得到的沉淀物、含氟试剂和尿素分散于去离子水中,进行水热反应,得到空心tio2纳米晶;
54.3)将步骤2)中得到的空心tio2纳米晶与钼源分散于乙醇与水的混合溶剂中,进行水热反应,得到所述moo2/空心球tio2纳米复合材料。
55.本发明还提供由上述方法制备得到的纳米复合材料。
56.根据本发明的实施方案,所述纳米复合材料可以为moo2/实心球tio2纳米复合材料和moo2/空心球tio2纳米复合材料。
57.本发明还提供所述moo2/tio2纳米复合材料在吸附、昼夜光催化、储电子或储能等领域中的应用。例如,所述moo2/tio2纳米复合材料可以用于吸附和降解有机污染物,作为昼夜光催化剂;进一步地,所述有机污染物可以为染料,优选为亚甲基蓝。再如,所述moo2/tio2纳米复合材料还可以作为储能器件,优选为昼夜发电的光伏器件。
58.本发明还提供一种昼夜光催化剂,其含有所述moo2/tio2纳米复合材料。
59.本发明还提供一种储能器件,其含有所述moo2/tio2纳米复合材料。优选地,所述储能器件为昼夜发电的光伏器件。
60.有益效果
61.本发明提供的moo2/tio2纳米复合材料:(1)其具有高效吸附和昼夜光催化的能力;(2)该纳米复合材料在能量的产生和储存方面也有着良好的应用前景;(3)在去除水中染料时,该纳米复合材料吸附染料后快速下沉,使得染料从液相中分离出来,有利于对分离后的染料进行光催化降解和光催化剂的回收;(4)该材料可以在黑暗环境下催化降解,具备昼夜光催化降解有机物的功能,比起单纯的tio2只能在紫外光照射下光催化降解有机物要更胜一筹;(5)该材料在实际应用中可以将白天产生的活性载流子储存起来,用于光伏器件中有望实现其夜间发电。
62.本发明提供的moo2/tio2纳米复合材料不同于moo2材料中掺杂ti或者在tio2掺杂mo。moo2中掺杂ti或者在tio2掺杂mo,是将杂质原子嵌入被掺杂晶格中,在保持原有晶格结构中引入非自身原子,从而达到对被掺杂材料改性的作用。而本发明中的moo2/tio2纳米复合粒子则是同时包含moo2纳米晶和tio2纳米晶,从而不但兼备moo2和tio2自身功能属性,而且moo2和tio2之间存在能量转移、传输和耦合等,例如载流子转移、光场耦合、热场传递,从而它赋有更加丰富的物理性能。
63.本发明纳米复合材料的制备方法,首先合成二氧化钛纳米晶,之后在二氧化钛纳米晶上原位生长二氧化钼纳米晶。在合成二氧化钼过程中,二氧化钛纳米晶能够保持其形貌和尺寸不变。该方法不但操作简单、成本低,而且所得纳米复合材料纯度较高、分散性较好、尺寸可控。
附图说明
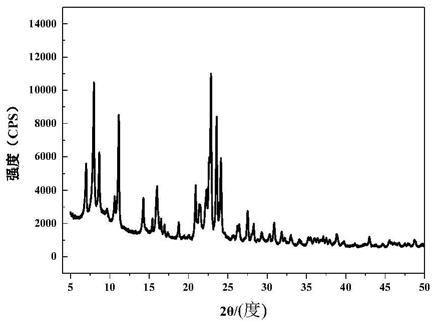
64.图1是实施例1中氧化钼的xrd表征图。
65.图2是实施例1中水热法制备的二氧化钼的sem图。
66.图3是实施例1中实心球tio2的sem图。
67.图4是实施例1中空心球tio2的sem图。
68.图5是实施例1中不同水热反应时间获得的tio2纳米晶体球的xrd衍射测试。
69.图6是实施例1中moo2/实心球tio2纳米复合材料的tem图和mo、ti、o元素分布情况。
70.图7是实施例1中moo2/空心球tio2纳米复合材料的tem图和mo、ti、o元素分布情况。
71.图8是moo2/实心球tio2纳米复合材料对染料的吸附实验:(a)纳米复合材料吸附亚甲基蓝不同时间后的吸收光谱;(b)比较二氧化钛和纳米复合材料吸附亚甲基蓝后的吸收光谱。
72.图9是实施例1中黑暗环境下二氧化钼吸附亚甲基蓝实验:(a)亚甲基蓝吸收光谱随二氧化钼对其吸附时间的变化情况;(b)黑色方块曲线表示溶液中亚甲基蓝浓度相对值随着二氧化钼对其吸附时间的变化情况;灰色圆形图表示吸附能力曲线。
73.图10是实施例2中moo2/实心球tio2纳米复合材料与纳米tio2实心球光催化亚甲基蓝的对比图。
74.图11是实施例2中二氧化钼光催化亚甲基蓝的浓度随催化时间的变化曲线。圆形标注是可见光下的光催化曲线,三角形标注是紫外光下的光催化曲线,正方形标注是不加moo2的亚甲基蓝在光照下的自降解曲线。
75.图12是实施例2中在黑暗环境中moo2/实心球tio2纳米复合材料对亚甲基蓝的催化作用:(a)未经过光照;(b)经过光照。
具体实施方式
76.下文将结合具体实施例对本发明的技术方案做更进一步的详细说明。应当理解,下列实施例仅为示例性地说明和解释本发明,而不应被解释为对本发明保护范围的限制。凡基于本发明上述内容所实现的技术均涵盖在本发明旨在保护的范围内。
77.除非另有说明,以下实施例中使用的原料和试剂均为市售商品,或者可以通过已知方法制备。
78.实施例1
79.moo2/tio2纳米复合材料的合成方法:首先制备出tio2纳米晶体球,然后再通过水热法在其上面原位生长纳米moo2。
80.(一)tio2纳米晶体球的制备
81.(1)tio2纳米晶体实心球的制备过程如下:在强烈搅拌下,将一定量的钛酸四丁酯滴加到480ml乙二醇中,配制不同浓度钛酸四丁酯的乙二醇溶液,在室温下连续搅拌8个小时,得到前驱体溶液。然后将该前驱体溶液迅速倒入1960ml丙酮中,在室温下搅拌1小时后静置,离心,收集白色沉淀并干燥。
82.将所制备的235mg白色样品放入50ml混合溶剂(水:乙醇的体积比=1:1)充分搅拌,之后将反应物置入100ml高压反应釜中,进行水热反应,反应温度为180℃,时间12h,得到tio2纳米晶体实心球。
83.具体地,乙二醇溶剂中钛酸四丁酯(ti(obu)4)的摩尔浓度与tio2实心球尺寸的对应关系如下:0.85mm的ti(obu)4制备得到的tio2实心球直径为0.52μm;1.03mm的ti(obu)4制备得到的tio2实心球直径为0.67μm;1.21mm的ti(obu)4制备得到的tio2实心球直径为0.50μm;2.30mm的ti(obu)4制备得到的tio2实心球直径为0.38μm;3.5mm的ti(obu)4制备得到的tio2实心球直径为0.32μm。tio2实心球的sem形貌如图3所示,可以看出产品为球形,且尺寸均匀,乙二醇溶液中钛盐含量对实心球tio2尺寸的影响。
84.(2)tio2纳米晶体空心球的制备过程如下:在强烈搅拌下,将一定量的钛酸四丁酯滴加到480ml乙二醇中,配制不同浓度钛酸四丁酯的乙二醇溶液,在室温下连续搅拌8个小时,得到前驱体溶液。然后将该前驱体溶液迅速倒入1960ml丙酮中,在室温下搅拌1小时后静置,离心,收集白色沉淀并干燥。
85.在50ml去离子水中加入上述方法制备的白色样品235mg、氟化铵和尿素,三者摩尔比为1:1:2,将反应物置入100ml高压反应釜中,进行水热反应,反应温度为180℃,时间12h,得到tio2纳米晶体空心球。
86.乙二醇溶剂中钛酸四丁酯(ti(obu)4)的摩尔浓度与tio2空心球尺寸的对应关系如下:0.85mm的钛酸四丁酯制备得到的空心球直径为0.46μm,1.03mm的钛酸四丁酯制备得到的空心球直径为0.80μm,1.21mm的钛酸四丁酯制备得到的空心球直径为0.57μm,2.30mm的钛酸四丁酯制备得到的空心球直径为0.45μm,3.5mm的钛酸四丁酯制备得到的空心球直径为0.46μm。tio2空心球的sem形貌如图4所示,表现出乙二醇溶液中钛盐含量对空心球tio2尺寸的影响。经过水热反应,tio2胶体结晶化,呈现出tio2小晶粒结构。在水热溶剂中加入氟化铵后,引入的f-会和tio2发生反应,致使tio2球体内的小晶粒被f-腐蚀掉,从而在tio2内部形成空心腔体。
87.图5是前驱体浓度为2.30mm下合成的tio2空心球的xrd衍射测试图,表现出了经过12h、15h和18h水热反应后都获得了单一的锐钛矿晶体结构。
88.(二)原位生长纳米moo2的实验过程如下:取步骤(1)或(2)所制备的二氧化钛晶体球50mg,按照钛:钼的摩尔比=1:1量取乙酰丙酮钼将两种样品加入到含有40ml去离子水和10ml乙醇混合溶液的高压釜中进行水热反应,水热反应温度为180℃,时间为16h。最后利用离心机收集固体样品,离心速率为10000转/分钟,时间为10min,得到moo2/实心球tio2纳米复合材料或moo2/空心球tio2纳米复合材料。
89.(三)为验证步骤(二)中在tio2表面原位生长的是纳米moo2。发明人合成了纯二氧化钼:称取0.15g的乙酰丙酮钼淡黄色粉末,边搅拌边将其缓慢加入到40ml去离子水和10ml无水乙醇的混合溶剂中,在室温下搅拌1h;随后,将上述溶液转移到高温高压水热反应釜中密封,放入烘干箱中以6℃/min的速率加热到180℃并保持24h;通过离心(12000rad/min,20min)收集黑色沉淀,用乙醇和去离子水分别洗3次,并在60℃下干燥,最终收集得到足量的二氧化钼晶粒。图1对水热法制备的纯二氧化钼进行了xrd表征,通过与标准pdf卡片对比可知,图中的峰值与二氧化钼的标准峰位相吻合,因此证明在该实验条件下所合成的产物是二氧化钼,且晶型为单斜相。这也说明,本实施例纳米复合材料中含有晶型为单斜相的二氧化钼。
90.图2是通过水热法制备的纯二氧化钼的sem照片,反应温度设定为180℃,反应时间16h,观察到在该反应条件下制备的氧化钼纳米粒子的平均尺寸小于20nm,尺寸和形貌分布
较为均匀,没有明显的团聚现象。
91.在下文中提及的moo2/实心球tio2纳米复合材料,其是以前驱体浓度为3.50mm的钛酸四丁酯制备得到的tio2纳米晶体实心球(平均尺寸为320nm)为原位生长载体的。
92.(四)moo2/tio2纳米复合材料的表征
93.图6是moo2/实心球tio2纳米复合材料的tem图和mo、ti、o元素分布情况。从tem图中可看出,其内部是二氧化钛晶体实心球,外面包覆着moo2纳米晶层。选取纳米粒子一块区域观察mo、o、ti的原子含量占比,o原子含量约是mo和ti原子之和的二倍,见表1,这与tio2和moo2的分子式相吻合。
94.表1复合材料中的各元素占比
[0095][0096]
利用3.50mm前驱体浓度合成的空心球tio2纳米晶制备moo2/tio2复合材料。图7是该moo2/空心球tio2纳米复合材料的tem图和mo、ti、o元素分布情况。从tem图中可看出空心球tio2内外都存在moo2。从mo、o、ti的原子分布图可以看出,与纳米moo2/实心球tio2相比,moo2/空心球tio2纳米中二氧化钼的含量明显增多。
[0097]
(五)复合材料的吸附能力
[0098]
在黑暗环境中做吸附实验。所用的染料为亚甲基蓝溶液,其浓度为90mg/l,体积为50ml,向其中加入20mg moo2/实心球tio2纳米复合材料,并搅拌进行吸附实验。在吸附过程中的取样时间分别为1min,3min,16min和21min。
[0099]
图8中的(a)表示经历不同吸收时间后溶液中亚甲基蓝的吸收光谱,可以看出在16min后基本达到饱和吸收。利用611nm处吸收峰可以计算出纳米复合材料吸附作用对亚甲基蓝的去除率
[0100]
更重要的是,发明人发现,moo2/实心球tio2纳米复合材料对亚甲基蓝吸附3min后,亚甲基蓝的吸收光谱发生了变化,即位于663nm处的吸收峰消失,同时处于611nm的吸收峰也发生蓝移。这说明moo2/实心球tio2纳米复合材料在黑暗中已经使得亚甲基蓝分解。
[0101]
此外,发明人对比了纳米tio2实心球(步骤(1)中前驱体浓度为3.50mm的钛酸四丁酯制备得到的tio2纳米晶体实心球,平均尺寸为320nm)和moo2/实心球tio2纳米复合材料吸附亚甲基蓝的能力。将20mg两种物质分别放到浓度为90mg/l和体积为50ml的亚甲基蓝溶液中,进行24h的搅拌吸附,从而达到饱和吸附。图8中的(b)中对比了原亚甲基蓝溶液、被tio2实心球和moo2/实心球tio2饱和吸附后的亚甲基蓝溶液的吸收光谱。与moo2/实心球tio2材料相比,单质tio2实心球对染料的吸附能力弱到可以忽略的程度。这说明复合材料的吸附能力主要是源于moo2的强吸附能力。
[0102]
为了对比分析,发明人研究了单质moo2的吸附能力。
[0103]
在黑暗环境下进行纳米moo2(平均粒径约为20nm)吸附亚甲基蓝的实验,配制50ml,100mg
·
l-1
亚甲基蓝溶液,加入6.21mg moo2。从图9中的(a)可知,随着吸附时间的增加,亚甲基蓝的浓度不断降低,在最开始的1min内,吸附速率最高,亚甲基蓝的浓度有一个陡然下降。结合图9(b),吸附能力定义为:
[0104][0105]
q
t
在5min后达到平衡,其值高达788mg
·
g-1
。通过图9中的(b)可以得到吸附效率(其中,是溶液中亚甲基蓝的初始浓度,c
t
是t时刻溶液中亚甲基蓝的浓度,m=6.21mg是moo2的质量)。吸附1分钟的溶液中亚甲基蓝的去除率为84.14%,而吸附80分钟的去除率为97.1%。
[0106]
由上所述,moo2/实心球tio2材料所具有的高吸附能力源于moo2。更重要地对比图8中的(a)和图9中的(a),发明人发现在黑暗中经过moo2/实心球tio2纳米复合材料处理过的亚甲基蓝,其吸收光谱不但在吸收度上有了大幅度降低,而且吸收光谱峰值和曲线形状都发生了显著变化,这说明了复合材料在黑暗中就已经分解了亚甲基蓝分子。与之相比,在黑暗中经过单质moo2处理的亚甲基蓝溶液,只发现了其吸收度大幅度下降,而吸收峰和曲线形状都没有变化,这说明黑暗中moo2对染料仅起到吸附作用,而没有分解亚甲基蓝。
[0107]
实施例2
[0108]
(1)moo2/实心球tio2纳米复合材料的光催化
[0109]
纳米复合材料和二氧化钛的光催化实验:浓度为90mg/l和体积为50ml的亚甲基蓝溶液,纳米tio2实心球(步骤(1)中前驱体浓度为3.50mm的钛酸四丁酯制备得到的tio2纳米晶体实心球,平均尺寸为320nm)和moo2/实心球tio2纳米复合材料各20mg。在光催化实验之前将两种材料分别放入亚甲基蓝溶液中,在黑暗环境饱和吸附24h。光催化所用的光源(泊菲莱科技有限公司,pls-sxe300d模拟太阳灯)波长范围320~780nm,强度约1.4w/cm2。
[0110]
单质moo2(平均粒径约为20nm)的光催化实验:配制体积为100ml,浓度为100mg/l的亚甲基蓝溶液,添加4mg moo2光催化剂。首先在黑暗环境中搅拌24h,使得moo2对亚甲基蓝吸附达到饱和,之后再进行光催化实验。光催化所用的光源(泊菲莱科技有限公司,pls-sxe300d模拟太阳灯)波长范围320~780nm,强度约1.4w/cm2。利用滤波片,分别在可见光波段400~760nm和紫外光波段320~400nm进行二氧化钼光催化实验。
[0111]
在图10中黑点方块表示tio2实心球对亚甲基蓝的光催化,被光催化的亚甲基蓝溶液浓度与光催化时间满足线性关系y=-0.00376x 0.9882;灰色方块表示moo2/实心球tio2对亚甲基蓝的光催化,可以看出其光催化效果明显优于纳米tio2实心球。分析moo2/实心球tio2纳米复合材料比纳米tio2实心球光催化效果更加优异主要有以下两个原因:1)在moo2/实心球tio2纳米复合材料中,tio2在光照下产生电子-空穴对,由于tio2导带高于moo2导带,因此电子向moo2输运,将电子与空穴分离,降低电子和空穴的复合几率。这会有利于光催化效应;2)moo2/实心球tio2纳米复合材料对染料有强大的吸附能力。当其表面亚甲基蓝分子被光催化降解后,从moo2/实心球tio2纳米材料表面脱离出来,暴露出的表面会再次对亚甲基蓝进行显著的吸附,因此与吸附效应弱的纳米tio2实心球相比,moo2/实心球tio2纳米复合材料对亚甲基蓝具有更强的吸附能力。
[0112]
另外,单质tio2只能在紫外光下(<400nm)降解亚甲基蓝分子,而moo2/实心球tio2实现了在可见光下降解亚甲基蓝分子,这是由于在可见光下moo2对亚甲基蓝的有良好的光降解能力,从而使得moo2/实心球tio2具有可见光降解有机物的作用。为了证明这一点,发明人测试了二氧化钼在可见光和紫外光下的光催化能力。由图11可知,在光照射下,亚甲基蓝的浓度不断降低,一直到240min时,二氧化钼仍然有光催化能力。更有趣的是,二氧化钼在可见光下(波长范围400-760nm)的光催化效果优于紫外光(320-400nm)的光催化效果,通过实验发明人推测这与二氧化钼在可见光下具有更强的表面局域等离子增强效应有关系。为了严格起见,图中还给出了不添加moo2催化剂的亚甲基蓝溶液在光照下的自降解曲线。
[0113]
(2)moo2/实心球tio2纳米复合材料夜间催化能力(储能降解)
[0114]
夜间光催化实验,实验过程如下:准备两份质量相等的moo2/实心球tio2纳米复合材料样品(每份20mg)进行对比实验,其中一份平铺在石英玻璃片之间,利用pls-sxe300d模拟太阳灯波长范围320~780nm,强度约1.4w/cm2,照射2h。另一份不经光照处理。之后将光照处理的和未经过光照处理的样品放到黑暗环境中进行催化亚甲基蓝实验,为了保证可对比性,在催化实验中对两个样品的催化时间、取样量等操作过程完全相同。
[0115]
如图12中的(a)所示,在没有光照的条件下,亚甲基蓝的浓度随着时间的增加,有降低趋势,但降低的幅度较小,其可能原因是复合材料对亚甲基蓝的剩余吸附作用。如图12中的(b)所示,在光照2h后在黑暗中复合材料对亚甲基蓝的催化作用。可以看到亚甲基蓝浓度随着催化时间增加出现显著降低趋势。导致图12中的(a)和图12中的(b)曲线不同的唯一变量是复合材料在催化亚甲基蓝之前的光照处理。根据实验结果推测其催化反应过程如下:在光照下tio2产生电子-空穴对,由于tio2导带高于半金属moo2导带,使得一部分电子输运给moo2并储存起来,在无光照射下释放出来催化有机物。
[0116]
以上,对本发明的实施方式进行了说明。但是,本发明不限定于上述实施方式。凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。