1.本发明属于有机荧光分子探针领域,具体涉及一种检测汞离子的比色/荧光探针及其制备方法与应用。
背景技术:
2.汞(hg)是一种剧毒重金属元素。由于汞的亲硫特性,易与含硫化合物结合,并且难以降解。随着汞离子进入生态系统,经过逐级积累,会引起一系列的中毒现象。例如,hg
2
离子可以与体内含有巯基的酶或蛋白质结合,影响生物酶的活性以及蛋白质的功能,从而危害到中枢神经系统、消化系统、肾脏等。因此,实现对环境和生物体内hg
2
的快速、灵敏和无损检测显得十分重要。
3.与传统的检测方法(电化学方法、原子吸收光谱法、电感耦合等离子体质谱法、原子发射光谱法、微电极法、核磁共振法、气相/液相色谱法和比色法等)相比,荧光探针具有成本低、操作简单、灵敏度高、选择性好以及无损实时原位多重监测等优点,从而引起广泛的关注,其已广泛应用于金属离子、非金属离子和分子的分析检测、细胞成像以及医学诊断等领域。然而,在荧光探针的发展过程中仍然存在着一些需要解决的问题和需求:1)传统荧光基团表现出聚集荧光淬灭(acq)现象,在某些检测环境下如以水为主要介质(细胞、生物组织等)条件下,探针处于无荧光发射聚集状态,导致应用受到限制;2)荧光探针在生物成像和疾病检测领域表现出巨大的发展潜力,但生物体普遍存在蓝色荧光的背景干扰。为有效避免背景干扰,红色荧光探针成为研究热点。基于红色发光母体进行调控设计合成新型红色荧光探针成为一条有效途径;3)荧光探针的选择性与灵敏度是荧光探针的关键指标,设计合成具有更高的选择性和灵敏度的荧光探针是荧光探针开发的重要目标。
4.目前,根据荧光探针与hg
2
结合方式以及对荧光探针分子电子结构的影响,常见的荧光探针的识别机理可以归纳为:光诱导电子转移(pet)、分子内电荷转移(ict)、激发态分子内质子转移(esipt)、荧光共振能量转移(fret)、跨键能量转移(tbet)以及聚集诱导发光机制(aie)等。目前文献所报导的检测hg
2
的荧光探针大多数都是基于以上几种机理,而基于荧光共振能量转移(fret)和暗场能量转移(dret)机制共同作用以实现hg
2
的检测的研究的报道相对较少。
技术实现要素:
5.本发明的目的之一是提供一种基于荧光共振能量转移和暗场能量转移机制的检测汞离子的比色/荧光探针,该探针兼具选择性高和灵敏度高的优点。
6.本发明的目的之二是提供上述检测汞离子的比色/荧光探针的制备方法,该制备工艺简单,合成路线短。
7.本发明的目的之三是提供上述检测汞离子的比色/荧光探针的应用,拓宽探针的应用范围。
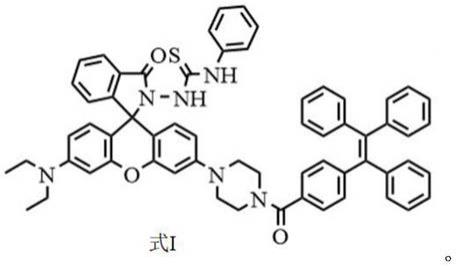
8.为实现上述目的,本发明采用的技术方案如下:一种检测汞离子的比色/荧光探
针,所述荧光探针命名为tpe
‑
rh
‑
ns,对应的化学结构式如式i所示:
[0009][0010]
上述检测检测汞离子的比色/荧光探针的制备方法,包括以下步骤:
[0011]
(1)将1
‑
(4
‑
甲酸苯基)
‑
1,2,2
‑
三苯乙烯溶于二氯甲烷中,再依次加入催化剂hobt和edci,室温下搅拌2h后,加入罗丹明化合物b,1
‑
(4
‑
甲酸苯基)
‑
1,2,2
‑
三苯乙烯与罗丹明化合物b的摩尔比为1:1,室温下搅拌反应8
‑
12h后得到反应液,将反应液进行萃取、合并有机相,将有机相减压蒸馏除去溶剂,通过硅胶柱色谱法纯化,得到tpe
‑
rh
‑
nh2,对应的结构式如式ⅱ所示:
[0012][0013]
所述罗丹明化合物b的结构式如式ⅲ所示:
[0014][0015]
(2)在惰性气氛保护下,将tpe
‑
rh
‑
nh2溶于n,n
‑
二甲基甲酰胺中,再依次加入三乙胺和异硫氰酸苯酯,室温下反应8
‑
12h后得到反应液,将反应液进行萃取、合并有机相,将有机相减压蒸馏除去溶剂,通过硅胶柱色谱法纯化,得到探针分子tpe
‑
rh
‑
ns;tpe
‑
rh
‑
nh2与异硫氰酸苯酯的摩尔比为1:1.9。
[0016]
进一步的,步骤(1)中,萃取过程为:向反应液中倒入去离子水,再用二氯甲烷萃取三次。
[0017]
优选的,步骤(1)中,柱色谱法纯化采用的洗脱剂为体积比20:1的二氯甲烷/甲醇溶液。
[0018]
进一步的,步骤(2)中,萃取过程为:向反应液中倒入去离子水,再用乙酸乙酯萃取三次。
[0019]
优选的,步骤(2)中,柱色谱法纯化采用的洗脱剂为体积比30:1的二氯甲烷/甲醇
溶液。
[0020]
具体的合成路线如下:
[0021][0022]
本发明还提供上述荧光探针在检测汞离子含量中的应用。
[0023]
与现有技术相比,本发明具有以下优点:
[0024]
本发明基于荧光共振能量转移(fret)和暗场能量转移(dret)机理,选择具有聚集诱导固体发光(aie)特性的1
‑
(4
‑
甲酸苯基)
‑
1,2,2
‑
三苯乙烯作为能量供体,罗丹明为能量受体,哌嗪为连接单元,酰胺硫脲作为hg
2
识别基团合成了反应比率型荧光探针tpe
‑
rh
‑
ns。由于四苯乙烯的存在,tpe
‑
rh
‑
ns表现出aie特性,并且在溶液状态和聚集状态下同时显示出对hg
2
高选择性、高灵敏性的(最低检出限可以达到0.157nm)识别特性。tpe
‑
rh
‑
ns是基于荧光共振能量转移(fret)和暗场能量转移(dret)机制的荧光探针,其在溶液状态下,发生dret过程,有利于hg
2
结合反应,适合环境中hg
2
检测;在聚集状态下,发生fret过程,表现出比率型荧光性质,更加适合细胞成像应用,并将tpe
‑
rh
‑
ns成功的应用于hela细胞中hg
2
成像。该荧光探针的制备工艺简单、合成路线短。将该探针应用于检测汞离子中,从而拓宽了探针的应用范围。
附图说明
[0025]
图1是化合物tpe
‑
rh
‑
nh2的核磁氢谱图;
[0026]
图2是化合物tpe
‑
rh
‑
nh2的质谱图;
[0027]
图3是探针分子tpe
‑
rh
‑
ns的核磁氢谱图;
[0028]
图4是探针分子tpe
‑
rh
‑
ns的质谱图;
[0029]
图5是tpe
‑
rh
‑
ns(1μm)在不同含水量的dmso
‑
h2o溶液中的荧光发射谱图;
[0030]
图6是tpe
‑
rh
‑
ns(1μm)在不同含水量的dmso
‑
h2o溶液中荧光峰值随含水量的变化趋势图;
[0031]
图7是tpe
‑
rh
‑
ns(1μm)在不同含水量的dmso
‑
h2o溶液中对hg
2
的荧光发射谱图;
[0032]
图8是tpe
‑
rh
‑
ns(1μm)在不同含水量的dmso
‑
h2o溶液中对hg
2
的荧光峰值随含水量的变化趋势图;
[0033]
图9是tpe
‑
rh
‑
ns(1μm)在40%dmso
‑
h2o体系下对不同金属离子响应的紫外吸收光
谱图;
[0034]
图10是tpe
‑
rh
‑
ns(1μm)在40%dmso
‑
h2o体系下对不同金属离子和加入hg
2
后的紫外吸收光谱图;
[0035]
图11是tpe
‑
rh
‑
ns(1μm)在40%dmso
‑
h2o体系下对不同金属离子响应的荧光光谱图;
[0036]
图12是tpe
‑
rh
‑
ns(1μm)在40%dmso
‑
h2o体系下对不同金属离子和加入hg
2
后的荧光光谱图;
[0037]
图13是tpe
‑
rh
‑
ns(1μm)在50%dmso
‑
h2o体系下对不同金属离子响应的荧光光谱图;
[0038]
图14是tpe
‑
rh
‑
ns(1μm)在50%dmso
‑
h2o体系下对不同金属离子和加入hg
2
后的荧光光谱图;图15是tpe
‑
rh
‑
ns(1μm)在40%dmso
‑
h2o体系下荧光滴定光谱图;
[0039]
图16是tpe
‑
rh
‑
ns(1μm)在40%dmso
‑
h2o体系下荧光强度与hg
2
浓度的线性关系图;
[0040]
图17是tpe
‑
rh
‑
ns(1μm)在50%dmso
‑
h2o体系下荧光滴定光谱图;
[0041]
图18是tpe
‑
rh
‑
ns(1μm)在50%dmso
‑
h2o体系下荧光强度比值与hg
2
浓度的线性关系图;
[0042]
图19是ttpe
‑
rh
‑
ns(1μm)在40%dmso
‑
h2o体系下紫外吸收滴定光谱图;
[0043]
图20是tpe
‑
rh
‑
ns(1μm)在40%dmso
‑
h2o体系下紫外吸收强度与hg
2
浓度的线性关系图;
[0044]
图21是在不同ph条件下,tpe
‑
rh
‑
ns(1μm)在50%dmso
‑
h2o体系下的荧光光谱图;
[0045]
图22是在不同ph条件下,tpe
‑
rh
‑
ns(1μm)在50%dmso
‑
h2o体系下与hg
2
(5eq)作用后的荧光光谱图;
[0046]
图23是tpe
‑
rh
‑
ns的hela细胞毒性实验结果统计图;
[0047]
图24是tpe
‑
rh
‑
ns的hela细胞荧光成像图:(a)hela细胞在tpe
‑
rh
‑
ns明场中细胞成像图;(b)hela细胞在tpe
‑
rh
‑
ns绿色通道中细胞成像图;(c)hela细胞在tpe
‑
rh
‑
ns和20μm hg
2
红色通道中细胞成像图;(d)图b和图c叠加图。
具体实施方式
[0048]
下面结合附图和具体实施例对本发明作进一步说明。
[0049]
以下实施例中所用的原料和试剂,如无特殊说明,均为市售商品,纯度为分析纯及以上。
[0050]
以下实施例中使用到的罗丹明化合物b通过以下合成步骤合成:4
‑
二乙氨基酮酸与间羟基苯基哌嗪在强酸作用下发生环化反应获得含有哌嗪的罗丹明化合物a,再与水合肼反应,获得罗丹明化合物b。
[0051][0052]
具体步骤如下:
[0053]
(1)罗丹明化合物a的合成
[0054]4‑
二乙胺基酮酸(10mmol,3g)和间羟基苯基哌嗪(10mmol,1.77g)溶于3ml浓硫酸中,90℃加热3h,然后冷却到室温,在冰水浴条件下,加入4ml高氯酸,不停搅拌得到粗产品,产率80%;
[0055]
(2)罗丹明化合物b的合成
[0056]
将罗丹明化合物a(2.5g,5mmol)溶于20ml乙醇中,滴加80%水合肼5ml,加热回流反应3h,用tcl板检测反应,反应完全后,减压蒸馏,旋干溶剂后得粗产品,并用硅胶柱进行分离提纯,洗脱剂配比为二氯甲烷/甲醇=20:1,产率85%。1h nmr(400mhz,(cd3)2so)δ7.77(dd,j=5.6,2.8hz,1h),7.53
‑
7.42(m,2h),6.97(dd,j=5.6,2.6hz,1h),6.68(d,j=2.3hz,1h),6.62(dd,j=8.8,2.4hz,1h),6.41
‑
6.36(m,4h),4.31(s,2h),3.32(q,j=6.9hz,4h),3.15
‑
3.11(m,4h),2.94
‑
2.79(m,4h),1.08(t,j=6.9hz,6h).
13
c nmr(75mhz,(cd3)2so)δ165.35,152.88,152.63,151.88,151.65,148.18,132.42,129.50,128.21,127.66,127.37,123.43,122.20,111.30,109.32,107.98,105.27,101.56,97.37,64.63,48.28,47.95,44.91,43.65,12.40.hrms:m/zcalculated for c
28
h
31
n5o2:470.2556,found:470.2550[m h].
[0057]
实施例1:探针化合物tpe
‑
rh
‑
ns的合成
[0058]
(1)tpe
‑
rh
‑
nh2的合成
[0059]
称量1
‑
(4
‑
甲酸苯基)
‑
1,2,2
‑
三苯乙烯0.1882g(0.5mmol)溶于20ml二氯甲烷中,称量hobt0.068g(0.5mmol)、edci 0.096g(0.5mmol)加入到上述反应液中,室温下反应2h;再称量罗丹明化合物b 0.23g(0.5mmol)加入到反应液中,室温反应8
‑
12h。反应完毕后,倒入20ml去离子水,用二氯甲烷萃取三次,合并有机相,减压蒸出溶剂,得到粗产品,用体积比为20:1的二氯甲烷:甲醇溶液过硅胶柱提纯,得到0.25g纯品tpe
‑
rh
‑
nh2,产率:60%,熔点:199
‑
202℃。氢谱如图1所示,质谱如图2所示,1h nmr(600mhz,dmso
‑
d6)δ7.78(ddt,j=6.7,4.5,2.2hz,1h),7.50
–
7.46(m,2h),7.23
–
7.19(m,2h),7.18
–
7.11(m,9h),7.05
–
6.97(m,9h),6.73(d,j=2.5hz,1h),6.65(dd,j=8.9,2.5hz,1h),6.36(dd,j=6.0,1.7hz,3h),4.34(s,2h),3.34(s,12h),1.09(t,j=7.0hz,6h)。maldi
‑
ms:m/zcalcd for c
55
h
49
n5o
3 828.0093,found:828.3380[m]
。
[0060]
(2)化合物tpe
‑
rh
‑
ns的合成
[0061]
称量tpe
‑
rh
‑
nh
2 0.39g(0.47mmol)溶于20ml n,n
‑
二甲基甲酰胺中,加入0.1ml三乙胺;称量异氰酸苯酯0.25g(0.88mmol)加入到反应液中,氮气保护,室温反应过夜。反应完毕后,反应液倒入20ml水中,乙酸乙酯萃取三次,合并有机相,减压蒸干,得到粗品。以体积比为30:1的二氯甲烷和甲醇溶液作为洗脱剂,过硅胶柱,得到0.21g tpe
‑
rh
‑
ns纯品,产率:
46.4%,熔点:238
‑
240℃。氢谱如图3所示,质谱如图4所示,1h nmr(600mhz,dmso
‑
d6)δ9.42(s,1h),8.86(s,1h),7.98
–
7.90(m,1h),7.69
–
7.58(m,2h),7.31
–
6.91(m,25h),6.66(d,j=56.6hz,2h),6.32(d,j=41.3hz,2h),3.68(s,2h),3.34(s,12h),1.07(d,j=7.4hz,6h).maldi
‑
ms:m/z calcd for c
62
h
54
n6o3s:963.1956,found 963.4014[m]
。
[0062]
实施例2:探针tpe
‑
rh
‑
ns的aie性质
[0063]
如图5和图6所示,tpe
‑
rh
‑
ns(1μm)的aie性质是在dmso
‑
h2o溶液中,365nm激发波长下,测试溶液的荧光发射变化。探针tpe
‑
rh
‑
ns在溶液含水量为0~40%之间,没有明显荧光发射,当溶液含水量达到50%时,tpe
‑
rh
‑
ns出现聚集(平均粒径:342nm),在波长475nm处出现明显的荧光发射峰,其为典型的四苯乙烯荧光发射峰,荧光增强近30倍;随着含水量的增加,荧光强度出现下降,可能是由于溶液的含水量增大,探针tpe
‑
rh
‑
ns的聚集速度较快,形成无定形态固体颗粒,导致荧光强度减弱。
[0064]
实施例3:探针tpe
‑
rh
‑
ns的溶剂配比选择
[0065]
如图7和图8所示,将探针tpe
‑
rh
‑
ns(1μm)配制为含水量(体积比)分别为0%、10%、20%、30%、40%、50%、60%、70%、80%、90%的dmso
‑
h2o溶液,然后加入20μl的hg
2
(1x10
‑2m)溶液,测试其荧光强度,绘图得到tpe
‑
rh
‑
ns不同含水量的荧光光谱图。由图7和图8可知,探针tpe
‑
rh
‑
ns在溶液含水量为0
‑
50%对hg
2
均有响应,溶液颜色由无色变成红色,在365nm紫外灯照射下发出红色荧光。由荧光光谱强度分析可知,含水量在0
‑
40%之间时,探针tpe
‑
rh
‑
ns在598nm下的荧光发射强度随着溶液含水量的增大而增强,在含水量40%时达到最大值;随后,荧光强度开始下降,当溶液含水量达到60%时,荧光发射强度已经较弱,溶液含水量达到70%以后,荧光发射非常微弱,说明此时探针tpe
‑
rh
‑
ns对hg
2
几乎没有响应。综上所述,探针tpe
‑
rh
‑
ns在溶液状态下对hg
2
最佳响应溶剂配比为:40%的dmso
‑
h2o溶液;聚集状态下最佳溶剂配比为:50%的dmso
‑
h2o溶液。
[0066]
实施例4:探针tpe
‑
rh
‑
ns对hg
2
识别的选择性与抗离子干扰能力
[0067]
tpe
‑
rh
‑
ns溶液的制备:取实施例1制备的tpe
‑
rh
‑
ns,配制1.0
×
10
‑3moll
‑1溶液(溶剂dmso),称量计算量的探针样品加入到3ml容量瓶中,用dmso定容,摇晃、超声,直至样品完全溶解,密封保存,以备使用。
[0068]
hg
2
以及干扰离子溶液的配制:用na
、k
、mg
2
、ni
2
、mn
2
、cd
2
、co
2
、zn
2
、ag
、cr
3
、fe
3
、al
3
、cu
2
和hg
2
溶解于去离子水中,配制金属离子溶液。金属离子溶液浓度为1.0
×
10
‑2moll
‑1,称量计算量的金属离子盐放入5ml容量瓶中,用去离子水定容到容量品刻度线,摇晃、超声,使金属离子盐完全溶解,密封保存,以备使用。
[0069]
首先,在溶液状态下,在探针tpe
‑
rh
‑
ns(1μm)的40%的dmso
‑
h2o中,分别加入10倍当量的金属离子,通过紫外吸收光谱和荧光光谱研究其选择性。如图9所示,tpe
‑
rh
‑
ns在40%dmso
‑
h2o体系中的紫外吸收光谱图可知:探针tpe
‑
rh
‑
ns只在hg
2
存在下,溶液由无色变成红色;在上述探针溶液中再加入10倍当量的hg
2
,研究探针的抗离子干扰能力。在其他离子共存条件下,探针tpe
‑
rh
‑
ns对hg
2
也具有很高的选择性(如图10所示)。同样条件下,探针tpe
‑
rh
‑
ns在荧光光谱中在也表现出对hg
2
的高选择性(如图11所示)以及较强的抗离子干扰能力(如图12所示)。
[0070]
其次,探针tpe
‑
rh
‑
ns(1μm)在聚集状态下,分别加入10倍当量的金属离子,测试荧光光谱强度研究探针的选择性。如图13所示,tpe
‑
rh
‑
ns在50%的dmso
‑
h2o体系中,365nm激
发波长激发下,最大荧光发射波长出现在476nm处,这是四苯乙烯的荧光发射特征峰。当加入hg
2
溶液后,发出红色荧光,最大荧光发射波长为596nm,加入其它金属离子的探针溶液,荧光光谱仍然在476nm出现。为了研究hg
2
与其他离子共存环境下的影响,继续在上述探针溶液中加入10倍当量的hg
2
,依然表现处明显的hg
2
识别特性(如图14所示),说明在其他离子共存条件下,探针tpe
‑
rh
‑
ns表现出较强的抗干扰能力。
[0071]
实施例5:探针tpe
‑
rh
‑
ns的hg
2
荧光光谱滴定
[0072]
探针tpe
‑
rh
‑
ns在溶液状态下(40%的dmso
‑
h2o溶液),荧光强度与hg
2
浓度的变化趋势如图15所示。向tpe
‑
rh
‑
ns(1μm)40%的dmso
‑
h2o溶液,每次加入0.5μl的hg
2
溶液测试其荧光强度。由图15可知,tpe
‑
rh
‑
ns空白溶液荧光较弱,当加入hg
2
后,在596nm处出现新的荧光发射峰,随着hg
2
浓度的增加,荧光强度逐渐增强;当hg
2
浓度达到2倍当量以后,荧光强度增速放缓。结果表明:当hg
2
浓度达到2倍当量后,达到饱和状态(如图16所示)。hg
2
浓度在1.5μm到5μm时,探针tpe
‑
rh
‑
ns的荧光强度与hg
2
浓度呈现出良好的线性关系。经过线性拟合,得到荧光强度与hg
2
浓度关系为:y=381620.29x
‑
469738.27,r2=0.997。由最低检出限公式lod=3σ/k可计算出探针tpe
‑
rh
‑
ns在40%dmso
‑
h2o体系中的最低检出限为:0.44nm。
[0073]
探针tpe
‑
rh
‑
ns在聚集状态下(50%的dmso
‑
h2o溶液),荧光强度与hg
2
浓度的变化趋势如图17所示。tpe
‑
rh
‑
ns空白溶液时荧光光谱出现四苯乙烯的荧光发射特征峰峰(最大发射波长:476nm),当加入hg
2
后,荧光光谱在476nm处强度降低,596nm处出现新的荧光发射峰;随着hg
2
浓度的增加,596nm处发射峰强度逐渐增强,当hg
2
浓度达到2倍当量以后,476nm荧光发射强度基本不再降低,596nm荧光发射强度增速也几乎停止。说明当hg
2
浓度达到2倍当量后,达到饱和状态(如图18所示),该现象为典型的比率型荧光性质。探针tpe
‑
rh
‑
ns在596nm荧光强度与476nm荧光强度比值(i
596
/i
476
)在hg
2
浓度2μm到5μm区间内呈现出良好的线性关系。经过线性拟合,得到i
596
/i
476
与hg
2
浓度关系为:y=44.965x
‑
98.63,r2=0.983。由最低检出限公式lod=3σ/k可知探针tpe
‑
rh
‑
ns在50%dmso
‑
h2o体系中的最低检出限为:0.157nm。
[0074]
实施例6:探针tpe
‑
rh
‑
ns的hg
2
紫外吸收光谱滴定
[0075]
探针tpe
‑
rh
‑
ns在溶液状态下(40%的dmso
‑
h2o溶液),紫外吸收强度与hg
2
浓度的变化趋势如图19所示。tpe
‑
rh
‑
ns空白溶液的紫外吸收光谱在569nm没有吸收峰,溶液呈现出无色;加入hg
2
后,紫外吸收光谱在569nm处出现吸收峰,随着hg
2
浓度的增加,吸收峰强度逐渐增强,hg
2
浓度达到2倍当量时,紫外吸收峰强度增速放缓。实验结果表明,hg
2
浓度达到2倍当量后,达到饱和状态(如图20所示)。hg
2
浓度在2μm到7μm时,探针tpe
‑
rh
‑
ns荧光强度与hg
2
浓度呈现出良好的线性关系。经过线性拟合,得到紫外吸收光谱强度与hg
2
浓度关系为:y=0.1195x
‑
0.1196,r2=0.998。由最低检出限公式lod=3σ/k可计算出探针tpe
‑
rh
‑
ns在40%的dmso
‑
h2o体系中的最低检出限为:3.5nm。
[0076]
实施例7:探针tpe
‑
rh
‑
ns的ph值研究
[0077]
tpe
‑
rh
‑
ns在50%的dmso
‑
h2o体系中处于聚集状态。如图21所示,tpe
‑
rh
‑
ns在不同ph的dmso
‑
h2o溶液中,其荧光强度变化较小,最大发射波长均在475nm,说明探针tpe
‑
rh
‑
ns本身受ph影响较小。在不同ph的50%的dmso
‑
h2o体系中加入5倍当量hg
2
,ph在4
‑
6之间时,探针tpe
‑
rh
‑
ns的最大发射峰依然在475nm,且强度没有减小,在596nm处出现较弱的发
射峰(属于罗丹明开环后的荧光发射特征峰),这表明探针tpe
‑
rh
‑
ns在ph在4
‑
6之间时,对hg
2
几乎没有响应。当ph=7
‑
10时,探针tpe
‑
rh
‑
ns在475nm的聚集诱导荧光发射峰消失,在596nm的罗丹明开环反应的发射峰明显增强,并且荧光强度相对稳定。结果表明:探针tpe
‑
rh
‑
ns在ph=7
‑
10时,对hg
2
表现出较高的识别灵敏性,细胞液的ph也在此范围内,因此探针tpe
‑
rh
‑
ns具有成为细胞成像材料的潜质。
[0078]
实施例8:探针tpe
‑
rh
‑
ns的hg
2
细胞毒性研究
[0079]
细胞培养:细胞成像的宫颈癌细胞(hela细胞)购置于生物公司,hela细胞培养过程:将购买的hela细胞转移至装有2ml的10%胎牛血清的dmem培养液的培养皿中,将培养皿放入二氧化碳含量保持在5%、37℃恒温、无菌的培养箱中,培养24小时,以备用于细胞成像。
[0080]
细胞毒性测试:将hela细胞转移至96孔的含有100μl培养液的培养皿中,在二氧化碳含量5%,37℃恒温的环境中孵育24h,然后,用上述培养液配制100μl的0μm、5μm、10μm、20μm和30μm浓度的探针溶液,分别放入有标记的96孔培养皿中,为了实验的准确性,每个浓度的探针都做5组平行实验,继续培养24h。然后在每个实验孔内加入20μl的mtt(mg/ml),再培养4h。最后,加入100μl的二甲基亚砜溶液混合均匀后,最后加入酶标仪,通过测定其在570nm处的紫外吸收强度来算出细胞存活率,进而反映出荧光探针的毒性强弱。
[0081]
探针tpe
‑
rh
‑
ns经过hela细胞毒性试验(mtt)结果如图23所示。hela细胞在不同浓度(0μm、5μm、10μm、20μm和30μm)探针tpe
‑
rh
‑
ns中孵育相同时间,观察细胞存活率。由图23所示,细胞存活率随着tpe
‑
rh
‑
ns浓度的增加而小幅降低,当探针浓度达到30μm,细胞存活率95%以上。细胞毒性实验结果表明探针tpe
‑
rh
‑
ns细胞毒性较小,适合用于细胞成像技术。
[0082]
实施例9:探针tpe
‑
rh
‑
ns的hg
2
细胞成像研究
[0083]
细胞成像主要用于检测外源性hg
2
细胞成像实验。分两组用于细胞成像。第一组将hela细胞放入含有培养液的培养皿中培养24h,用ph=7.4的pbs缓冲溶液洗涤三次,然后将20μl的荧光探针标准溶液加入到细胞培养液中,继续培养1h,最后用ph=7.4的pbs缓冲溶液洗涤三次,洗去细胞代谢物以及死亡的细胞,剩下的细胞用于细胞成像;第二组将hela细胞放入含有培养液的培养皿中培养24h,用ph=7.4的pbs缓冲溶液洗涤三次,然后将20μl的荧光探针标准溶液加入到细胞培养液中,继续培养1h,加入10μl的hg
2
标准溶液,继续培养1h,用ph=7.4的pbs缓冲溶液洗涤三次,洗去细胞代谢物以及死亡的细胞,剩下的细胞用于细胞成像。
[0084]
如图24所示,探针tpe
‑
rh
‑
ns溶液加入到hela细胞培养液中培养后,将细胞转移至共聚焦显微镜上,用405nm紫外激发,通过观察蓝色通道(425nm
‑
475nm)可以看出:探针tpe
‑
rh
‑
ns已经进入细胞内,并且发出微弱的黄绿色荧光(如图24
‑
b所示)。当加入20μm hg
2
后,继续培养,再次放入共聚焦显微镜下拍照观察,发现细胞发出红色荧光(如图24
‑
c所示),结果表明探针tpe
‑
rh
‑
ns在细胞内可以灵敏的检测hg
2
。因此,探针tpe
‑
rh
‑
ns能够实现对hela活细胞内hg
2
检测,并且可以实现比率型细胞荧光成像。
[0085]
综上,探针tpe
‑
rh
‑
ns由于具有aie特性,其在溶液状态(40%的dmso
‑
h2o)与hg
2
作用,既可以在可见光下“裸眼”观察到探针由无色变成红色;也可以在365nm紫外激发下,观察到探针溶液从没有荧光到发出红色荧光。在该过程中,探针tpe
‑
rh
‑
ns经过dret机理,暗
场能量由四苯乙烯转移到罗丹明结构上,并且表现出高的选择性和超高灵敏度(紫外吸收光谱最低检出限为:3.5nm;荧光光谱最低检出限为:0.44nm)。探针tpe
‑
rh
‑
ns在聚集状态下(50%dmso
‑
h2o),基于fret机理,其表现出优异的比率型荧光探针特性。探针在hg
2
作用下,四苯乙烯的聚集状态下的荧光(发射波长:476nm)逐渐消失,罗丹明开环反应的荧光(发射波长:596nm)逐渐增强,以596nm处荧光强度与475nm荧光强度比值(i
596nm
/i
475nm
)与hg
2
浓度关系曲线可以计算出其最低检出限为:0.157nm。此外,tpe
‑
rh
‑
ns探针成功的应用于hela细胞内hg
2
的检测,并且在细胞成像中表现出较高的灵敏度。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。

