具有多种遗传修饰的自然杀伤细胞及其制备方法和用途与流程
- 国知局
- 2024-06-20 10:56:11
本发明涉及生物,特别是涉及具有多种遗传修饰的自然杀伤细胞及其制备方法和用途。
背景技术:
1、肿瘤属于全身性疾病,人体细胞免疫功能的破坏是肿瘤复发、扩散和转移的重要原因,可以说只要能够阻止肿瘤的转移和复发,就解决了癌症的根本问题。
2、一些癌症的发生与功能失调的nk细胞有关。因此,修复这种nk细胞可能是抗肿瘤免疫治疗的一个潜在选择。这种修复的一种方法是抑制免疫检查点(如cd96、nkg2a等),即癌细胞通过控制免疫细胞表面的抑制受体进行免疫逃逸;减少肿瘤tme对nk细胞的免疫抑制,从而增强nk细胞的肿瘤杀伤力和持久性,增强肿瘤的免疫应答,减少肿瘤的侵袭和迁移,具有良好的临床应用前景。
3、nk细胞又称自然杀伤细胞(natural killer cell),是机体的一类固有免疫细胞,作为人体抵抗癌细胞和病毒感染的第一道防线,具有对肿瘤的直接溶解活性,可非特异性直接杀伤肿瘤细胞,这种天然杀伤活性既不需要抗原致敏,也不需要抗体参与,但目前nk细胞的杀伤效果还有待进一步的提高,需要研发杀伤效果更优异、安全性更高、副作用更小的nk细胞。
4、nk细胞的抗肿瘤效应取决于激活和抑制受体信号之间的平衡。激活受体识别在转化或感染细胞上选择性表达的各种配体,并且这些信号通过多种不同的细胞内信号通路传递。抑制受体包括识别mhc i类(主要是hla-c/b)多形区域的抑制性杀伤免疫球蛋白样受体(ikirs)和识别非经典hla-e/g的nkg2a。抑制性配体的下调或缺失(“自我缺失”)促进nk细胞活化。nk细胞受体的表达可以随着激活而改变或受肿瘤微环境的影响,从而诱导nk细胞表达抑制性检查点分子。
5、同种异体nk细胞疗法与car-t细胞疗法相比具有多种优势:(1)异体nk细胞不会引起移植物抗宿主病(gvhd),crs反应和nt等不良事件发生率也比较低;(2)除了靶向识别之外,可以直接启动adcc和细胞毒效应,多种方式识别肿瘤从而减少抗原逃逸;(3)nk细胞的来源更为广泛,也容易通过crispr/cas9等基因编辑的手段提高nk细胞的反应持久性并降低免疫原性。
6、尽管经典的crispr/cas9基因编辑技术实现了对nk细胞的高效遗传操作,但经典的crispr/cas9基因编辑技术以dna双链断裂为基础的遗传操作可能导致百万碱基级别的染色体缺失,影响人类细胞基因组的完整性和稳定性。另外,双链断裂可引起p53诱导的细胞凋亡,阳性编辑的细胞更倾向于富集p53突变的细胞,这种编辑的细胞注射到体内无疑增加了癌变风险。因此,利用更安全的基因编辑工具应用于构建安全风险更小的基因编辑nk细胞是当下亟需解决的问题。
技术实现思路
1、鉴于以上所述现有技术的缺点,本发明的目的在于提供一种遗传修饰的自然杀伤细胞及其制备方法和用途,用于解决现有技术中经以dna双链断裂遗传操作的nk细胞可能导致百万碱基级别的染色体缺失以及癌变风险增加的问题。
2、为实现上述目的及其他相关目的,本发明第一方面提供一种自然杀伤细胞,所述自然杀伤细胞的基因经过碱基编辑以在不引入dna双链断裂的情况下进行基因编辑,所述基因选自tigit基因、tgfbr2基因、nkg2a基因、cd96基因或pvrig基因中的任一个或多个。
3、本发明第二方面提供一种碱基编辑系统,所述碱基编辑系统包括:i)融合蛋白或编码融合蛋白的核苷酸;ii)引导rna或编码引导rna的核苷酸,用于上述第一方面的自然杀伤细胞的碱基编辑。
4、本发明第三方面提供上述的第一方面的自然杀伤细胞的制备方法,所述制备方法为将上述第二方面的碱基编辑系统导入自然杀伤细胞进行编辑,获得所述自然杀伤细胞。
5、本发明第四方面提供一种产品,所述产品包含上述第一方面的自然杀伤细胞、或上述第二方面的碱基编辑系统。
6、本发明第五方面提供上述第一方面的自然杀伤细胞、上述第二方面的碱基编辑系统、上述第三方面的制备方法、上述第四方面的产品的用途,所述用途选自以下任一项或多项:
7、1)制备用于预防和/或治疗自身免疫疾病的药物;
8、2)制备用于预防和/或治疗肿瘤的药物;
9、3)制备用于预防和/或治疗病毒感染性疾病的药物;
10、4)制备用于预防和/或治疗细菌感染性疾病的药物。
11、如上所述,本发明的一种自然杀伤细胞、及其制备方法和用途,具有以下有益效果:
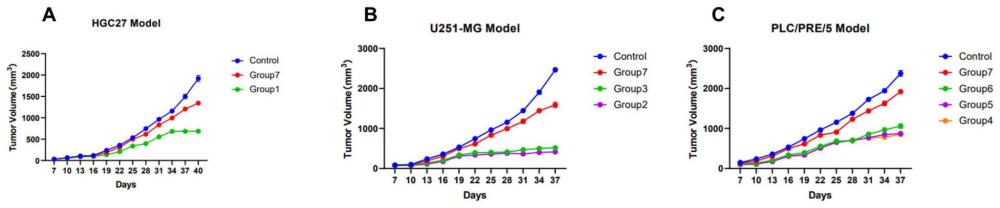
12、本发明的研究结果显示:利用修饰的sgrna和碱基编辑融合蛋白,以电穿孔转染的方式将sgrna/be蛋白复合物(rnp)导入经体外扩增的原代nk细胞,可以高效敲除nkg2a、cd96、pvrig、tigit和tgfbr2基因,从而在不引入dna双链断裂的情况下进行基因编辑,避免现有技术中经以dna双链断裂遗传操作的nk细胞可能导致百万碱基级别的染色体缺失以及癌变风险增加的问题。利用本发明可解除nkg2a、cd96、pvrig、tigit和tgfbr2对nk细胞的免疫抑制作用。本发明的nk细胞相对于野生型nk细胞和现有的碱基编辑nk细胞在体内、体外实验中均展现出更强的抗肿瘤活性,且具有更高的安全性,副作用更小。本发明的nk细胞可以作为药物及时有效地应用于临床免疫治疗,可以为建立碱基编辑技术联合过继免疫在肿瘤及病毒感染性疾病(例如hiv/aids)的治疗提供新的选择,还可以为新的有效基因靶点的研究提供支持,同时为相关疾病治疗的研究奠定坚实的技术基础,因此具有明显的应用前景和临床应用价值。
技术特征:1.一种自然杀伤细胞,所述自然杀伤细胞的基因经过碱基编辑以在不引入dna双链断裂的情况下进行基因编辑,所述基因选自tigit基因、tgfbr2基因、nkg2a基因、cd96基因或pvrig基因中的多个。
2.根据权利要求1所述的自然杀伤细胞,其特征在于,所述基因至少包括3个。
3.根据权利要求1所述的自然杀伤细胞,其特征在于,至少包括以下任一项或多项特征:
4.根据权利要求1所述的自然杀伤细胞,其特征在于,所述碱基编辑将自然杀伤细胞中tigit基因、tgfbr2基因、nkg2a基因、cd96基因或pvrig基因上的至少部分碱基c突变至t;
5.根据权利要求4所述的自然杀伤细胞,其特征在于,所述自然杀伤细胞还包括以下任一项或多项特征:
6.一种碱基编辑系统,所述碱基编辑系统包括:i)编辑核苷酸的碱基的融合蛋白或编码融合蛋白的核苷酸;ii)引导rna或编码引导rna的核苷酸,用于权利要求1-5任一项所述的自然杀伤细胞的碱基编辑。
7.根据权利要求6所述的碱基编辑系统,其特征在于,所述融合蛋白的结构包括:nh2-[核定位信号]-[第一ncas9片段]-[连接肽a]-[胞嘧啶脱氨酶片段]-[连接肽a]-[第二ncas9片段]-[gs肽段]-[ugi肽段]-[ugi肽段]-[核定位信号]-cooh或nh2-[核定位信号]-[第一ncas9片段]-[连接肽a]-[腺嘌呤脱氨酶片段]-[连接肽a]-[第二ncas9片段]-[gs肽段]-[核定位信号]-cooh。
8.根据权利要求6所述的碱基编辑系统,其特征在于,所述碱基编辑系统还包括以下任一项或多项特征:
9.一种权利要求1-5任一项所述的自然杀伤细胞的制备方法,所述制备方法为将权利要求6-8任一项所述的碱基编辑系统导入自然杀伤细胞进行编辑,获得所述自然杀伤细胞。
10.根据权利要求9所述的制备方法,其特征在于,所述将碱基编辑系统通过电穿孔法、病毒转导、显微注射法、粒子轰击法或基因枪转化法中的一种或多种导入自然杀伤细胞进行编辑;优选的,将碱基编辑系统通过电穿孔法导入自然杀伤细胞进行编辑;更优选的,所述电穿孔法中使用的电转仪系统选自lonza系统、thermo的neon转染系统或gibco ctsxenon电转染系统中的一种或多种;更优选的,所述电穿孔法中使用的电转仪系统为lonza系统、型号为4d-nucleofector的电转仪时,电转程序选自cm137、cm158或cm189;或电穿孔法中使用的电转仪系统为thermo电转染系统、型号为neon电转染仪或cts xenon电转染仪时,电转程序选自以下任一程序:
11.一种产品,所述产品包含权利要求1-5任一项所述的自然杀伤细胞、或权利要求6-8任一项所述的碱基编辑系统。
12.权利要求1-5任一所述的自然杀伤细胞、权利要求6-8任一项所述的碱基编辑系统、权利要求9-10任一项所述的制备方法、权利要求11所述的产品的用途,所述用途选自以下任一项或多项:
13.根据权利要求12所述的用途,其特征在于,所述自身免疫性疾病选自系统性红斑狼疮、类风湿关节炎、银屑病关节炎、狼疮性肾炎、视神经脊髓炎、系统性硬化症、口眼干燥综合征、多发性肌炎中的一种或多种;
技术总结本发明涉及生物技术领域,特别是涉及含有多种遗传修饰的自然杀伤细胞及其制备方法和用途。本发明中自然杀伤细胞即NK细胞通过碱基编辑系统安全高效地敲除NK细胞的TIGIT基因、TGFBR2基因、NKG2A基因、CD96基因或PVRIG基因。本发明中碱基编辑的NK细胞具有高效的杀伤肿瘤细胞的作用,可望开发成为一种安全而有效的抗癌药物,具有广阔的临床应用前景和开发价值。技术研发人员:范文文,徐天宏,王骊灵,张爽受保护的技术使用者:上海贝斯昂科生物科技有限公司技术研发日:技术公布日:2024/6/18本文地址:https://www.jishuxx.com/zhuanli/20240619/686.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表