一种靶向奶山羊CSN2基因座制备重组人丁酰胆碱酯酶定向整合的山羊胎儿成纤维细胞株的方法
- 国知局
- 2024-09-05 14:49:08
本发明涉及动物乳腺生物反应器,具体地说,涉及一种靶向奶山羊csn2基因座制备重组人丁酰胆碱酯酶定向整合的山羊胎儿成纤维细胞株的方法。
背景技术:
1、有机磷(organophosphorus,op)中毒是化学中毒相关死亡的最常见原因之一。
2、丁酰胆碱酯酶(butyrylcholinesterase,bche)又称伪胆碱酯酶、假胆碱酯酶和血浆胆碱酯酶,与乙酰胆碱酯酶(acetyl cholinesterase,ache)的氨基酸序列同源性接近55%,是一种非特异性胆碱酯酶,可水解包括乙酰胆碱在内的多种胆碱,广泛存在于肝脏、大脑、心脏、血浆等多种组织器官中。自1991年broomfield等人发现马血清中纯化的丁酰胆碱酯酶可以有效抵御沙林、梭曼等有机磷神经性毒剂对猴子的的毒害作用开始,丁酰胆碱酯酶在有效防御有机磷神经性毒剂如塔崩、沙林、梭曼和维埃克斯中毒的重要前景逐步在啮齿类动物、小型猪和非人灵长类等动物体内和体外实验中被证实,且使用丁酰胆碱酯酶可明显提高vx中毒后的生存率。目前,丁酰胆碱酯酶因具有较长的生物半衰期、良好的安全性、高反应性和广泛性被认为是最有前景的有机磷清除剂。然而,丁酰胆碱酯酶是一种化学计量生物清除剂,需要较高的剂量才能预防和治疗有机磷中毒,血清纯化法提取的天然丁酰胆碱酯酶无法满足大规模应用。在酵母、cho等真核生物细胞等各种蛋白质表达平台中生产重组人丁酰胆碱酯酶(rhbche)通常缺乏了其关键特征,例如四聚体结构和必要的翻译后修饰等,也不能实现人丁酰胆碱酯酶循环半衰期的关键属性,影响其治疗效果。
3、动物乳腺生物反应器是基于转基因技术平台,使外源基因导入动物基因组中并定位表达于动物乳腺,利用动物乳腺天然、高效合成并分泌蛋白的能力,在动物的乳汁中生产一些具有重要价值产品的转基因动物的总称。利用乳腺生物反应器生产重组蛋白活性高、可人源化、不影响动物正常生理代谢,且生产周期短、耗能低、无污染、效益高,在生产药用蛋白和生物材料领域具有十分广阔的发展前景。利用上述生物反应器技术已经成功制备了多种功能蛋白,如:重组人凝血因子、重组人抗凝血酶(atryn)、重组人乳铁蛋白、单克隆抗体、重组人α-乳清白蛋白、重组人溶菌酶等。其中,重组人抗凝血酶已经通过美国fda批准上市。
4、制备乳腺生物反应器的关键是保证目的蛋白在乳腺中的特异性、高效性表达,传统的表达载体都是选用乳蛋白基因的调控序列作为启动子元件,如:β-乳球蛋白(blg)基因、αs1-酪蛋白基因、β-酪蛋白(β-casein)基因(也称csn2基因)、乳清酸蛋白(wap)基因以及乳清白蛋白基因等。目前,利用csn2基因改造成的重组蛋白乳汁表达系统pbc1是最常用的乳腺特异性表达载体。
5、虽然利用转基因动物生物反应器可以规模化制备人类所需的药用蛋白,但传统的转基因技术多为随机整合,插入位点随机且不可控,可能影响其表达以及稳定性,同时也可能会造成动物基因组的突变从而对动物本身造成伤害;另外,使用的乳腺特异表达载体pbc1骨架比较大,容易产生载体突变影响表达功能,同时载体过大也会影响转染效率,增加生产转基因动物的难度,这也阻碍了该技术的发展和应用。
6、与小鼠、兔子、猪等相比,反刍动物可能是最适合生产大量蛋白质的物种,它们产奶量远远大于小鼠、兔子和猪,且不像兔子和猪那样糖基化蛋白质。在反刍动物中,羊是更适合用作乳腺生物反应器的动物。虽然其产奶量相对略少,但其价格更低,繁殖周期大约是牛的一半,因此饲养成本更低。
7、《recombinant human butyrylcholinesterase from milk of transgenicanimals to protect against organophosphate poisoning》[1]报道了:从转基因动物的乳汁中提取重组人丁酰胆碱酯酶,以保护有机磷中毒,使用传统转基因技术在山羊乳腺中表达人bche(recombinant human butyrylcholinesterase,rhbche)基因用于有机磷毒剂的解毒。该技术存在的问题是:外源基因是随机插入到基因组中的,通常会造成位置效应和基因沉默导致其不能持续稳定的表达,且外源基因插入位置的不确定可能会造成受体动物基因组的插入突变,给受体动物本身带来危害。
8、《improving the efficiency of precise genome editing with crispr/cas9to generate goats overexpressing human butyrylcholinesterase》[2]报道了:提高了利用crispr/cas9精确编辑基因组生成过表达人丁酰胆碱酯酶的山羊的效率,利用了crispr/cas9基因编辑技术进行了外源目的基因单拷贝形式的定点插入,保证了外源目的基因持续稳定的表达且对动物受体自身的基因组没有影响,保证了受体动物的安全。该技术存在的问题是:其采用的是利用cmv启动子驱动全身强表达的策略,而血液等组织中的生物活性蛋白可能会改变动物的健康,据报道该转基因动物在出生三个月后死亡,因此全身强表达外源蛋白对动物本身可能是一种威胁。目前已有研究表明,在反刍动物中,选择在牛、绵羊和山羊奶中进行转基因表达人bche是更有利于后续bche蛋白分离的。
9、申请号201811160145.2的中国专利《人gdnf基因在牛β-casein基因座定位整合的载体及其应用》公开了:人gdnf基因在牛β-casein基因座上定位整合的打靶载体和特异性断裂打靶位点序列的crispr/cas9表达载体。该技术的存在的问题是:采用牛这种反刍动物构建乳腺生物反应器表达人gdnf基因,其繁殖周期长(约9个月),从获得第一代克隆牛开始到可以产生乳汁从中分离目的蛋白大约需要32个月的时间,饲养成本大大提高。与牛相比,羊的繁殖周期短(约5个月),从获得第一代克隆羊开始到可以产生乳汁从中分离目的蛋白大约需要14个月的时间,大大缩短了育种周期,降低了饲养成本。因此羊是更适合用作乳腺生物反应器的动物。该技术方案中公布的序列仅可用于牛这个物种,采用更适合的羊构建乳腺生物反应器表达目的蛋白需要设计新的技术方案。
10、申请号201610156838.9的中国专利《利用山羊乳腺生物反应器制备犬瘟热融合蛋白基因重组疫苗的方法》公开了:一种利用山羊乳腺生物反应器制备犬瘟热融合蛋白基因重组疫苗的方法,具体步骤包括:(1)构建含有两个同源臂5-arm和3-arm的乳腺生物反应器表达载体;(2)talens载体的构建;(3)cdvf阳性细胞克隆的制备及筛选;和(4)cdvf阳性细胞克隆的核移植,靶克隆阳性个体和目的蛋白表达鉴定。通过上述犬瘟热融合蛋白基因乳腺生物反应器表达载体的构建,并利用talens将犬瘟热融合蛋白基因定点敲入至奶山羊成纤维细胞β-casein中,并通过体细胞核移植技术获得克隆胚,为犬瘟热重组疫苗的生产开辟的新的路径。其针对奶山羊csn2基因第二外显子序列设计了一对talens,作用位点的核苷酸序列为5′-cctcatccttgcctgtctggtggctctggccattgcaagagaggtaaa tacaga-3。该技术的缺陷是:采用了talens的技术,与crispr/cas9技术相比,其模块组装过程繁琐,且talens具有一定的细胞毒性,在构建过程中具有一定的困难和挑战。crispr/cas的设计难度和构建难度都要小的多,成本更低,开发周期更短,靶向修饰效率更高,此外crispr/cas还具有可以多靶点编辑和可以编辑rna的优势,这是talens技术所不具备的。因此,该方法在简单、快捷、低成本、高效率方面均有待提高,需要基于crispr/cas9技术开发新的方案。
11、目前尚未有利用crispr/cas9技术在奶山羊csn2基因座进行定位整合制备奶山羊乳腺生物反应器的方法,没有利用crispr/cas9技术在奶山羊csn2基因座成功定位整合重组人bche基因,用于有机磷化合物的解毒。
12、参考文献:
13、[1]huang yj,huang y,baldassarre h,wang b,lazaris a,leduc m,bilodeauas,bellemare a,m,herskovits p,touati m,turcotte c,valeanu l,lemée n,wilgus h,bégin i,bhatia b,rao k,neveu n,brochu e,pierson j,hockley dk,cerasoli dm,lenz de,karatzas cn,langermann s.recombinant humanbutyrylcholinesterase from milk of transgenic animals to protect againstorganophosphate poisoning.proc natl acad sci usa.2007aug 21;104(34):13603-8.doi:10.1073/pnas.0702756104.epub 2007jul 27.pmid:17660298;pmcid:pmc1934339.
14、[2]wang jh,wu sj,li y,zhao y,liu zm,deng sl,lian zx.improving theefficiency of precise genome editing with crispr/cas9 to generate goatsoverexpressing human butyrylcholinesterase.cells.2023jul 10;12(14):1818.doi:10.3390/cells12141818.pmid:37508483;pmcid:pmc10378061
技术实现思路
1、针对现有技术尚未有利用crispr/cas9技术在奶山羊csn2基因座进行定位整合制备奶山羊乳腺生物反应器的方法,本发明提供了一种在奶山羊csn2基因座进行定位整合制备奶山羊乳腺生物反应器的方法,并利用crispr/cas9技术在奶山羊csn2基因座成功定位整合重组人bche基因,可用于有机磷化合物的解毒,本发明具体技术方案如下:
2、第一方面、在山羊乳腺上皮细胞中确认靶向奶山羊csn2基因座制备目的基因定向整合细胞株的可行性
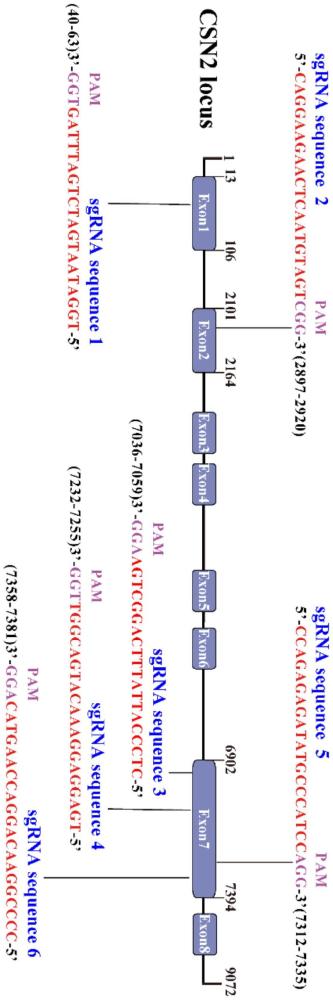
3、1、山羊csn2基因crispr/cas9靶点设计及打靶载体构建
4、选择sgrna4构建px458-sgrna打靶载体,质粒测序结果显示,目的载体构建成功。
5、2、sgrna4是山羊csn2基因的有效靶点
6、将px458-sgrna4载体转染至gmecs,利用px458载体自带的绿色荧光egfp进行流式分选获得单克隆细胞,通过靶点位置的ta克隆和sanger测序,发现sgrna4作用的细胞发生了明显切割,挑选的18个单克隆中有5个发生突变,该靶点的切割效率为27.78%,可用于后续目的基因的插入。
7、3、靶向山羊csn2基因sgrna4的同源定向修复模板载体构建
8、has-p2a-mcherry载体可实现csn2和红色荧光报告基因共同表达,用于在gmecs中评价sgrna4的同源修复效率。质粒测序结果表明,目的载体构建成功。
9、4、靶向山羊csn2基因sgrna4的同源修复模板has-p2a-mcherry转染及修复效率评价
10、将px458-sgrna4载体和has-p2a-mcherry载体共同转染至gmecs后,荧光显微镜下可观察到明显的绿色荧光egfp表达,初步提示载体转染成功。进一步的流式细胞术检测结果表明,载体转染效率最高可达24.40%,可进行后续实验。
11、将分别转染px458-sgrna4载体或has-p2a-mcherry载体的gmecs作为对照组1和对照组2,将共同转染px458-sgrna4载体和has-p2a-mcherry载体的gmecs作为实验组,利用流式细胞术分别检测各组的红色荧光表达。结果显示,实验组mcherry+细胞比例高于两个对照组,提示has-p2a-mcherry载体靶向sgrna4定向整合成功,可以用于后续表达rhbche的gffs的制备。
12、第二方面、本发明采用同源重组的方法,将目的基因rhbche定位整合到山羊csn2基因启动子的下游,借助奶山羊csn2基因天然启动子使得目的基因高效表达
13、1、山羊胎儿成纤维细胞的纯化和鉴定
14、由于gffs来源于原代分离的传代后细胞,其中混有少量其他类型的细胞,利用细胞对胰酶敏感性的差异,通过差速贴壁法对细胞进行纯化。vimentin免疫荧光染色结果显示,几乎所有细胞都呈vimentin阳性,适合后续实验。
15、2、打靶载体和同源定向修复模板构建
16、has-p2a-rhbche载体可实现csn2和rhbche共同表达,用于构建rhbche定向整合的gffs。质粒测序结果表明,目的载体构建成功。
17、3、rhbche定向整合山羊胎儿成纤维细胞株制备
18、鉴于gffs可传代次数多、转基因效率高,是生产转基因克隆动物的首选体细胞系,后续我们拟采用gffs进行体细胞核移植,制备表达opnas解毒剂rhbche的奶山羊乳腺生物反应器。因而,选择gffs进行rhbche定向整合细胞株的制备。
19、将px458-sgrna4载体和has-p2a-rhbche载体共同转染至gffs,利用流式分选获得egfp+单克隆细胞并扩增培养后,跨模板序列和基因组序列设计两对引物(图9a)。pcr扩增结果显示,共有3株细胞扩增出目的条带,编号分别为11、49、53(图9b)。pcr产物测序结果显示,目的条带序列与预期完全一致(图9c),表明rhbche定向整合gffs制备成功,可用于后续表达rhbche奶山羊乳腺生物反应器的制备。
20、与现有技术相比,本技术的有益效果在于:
21、1、本发明首次利用crispr/cas9基因编辑技术在奶山羊csn2基因座上设计了供定点整合目的基因的位点,既解决了插入位点不确定引起的表达稳定性和生物安全性的问题,又解决了大片段载体容易突变和影响转染效率的问题,同时,将目的蛋白序列直接插入奶山羊csn2基因中,避免了大段外源序列的插入,也最大程度保证了生物的安全性;
22、2、利用本发明的技术方法成功制备了3株靶向奶山羊csn2基因座定向整合rhbche的山羊胎儿成纤维细胞株。
本文地址:https://www.jishuxx.com/zhuanli/20240905/288251.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表