一种混菌发酵联产灵菌红素和β-胡萝卜素的方法
- 国知局
- 2024-09-11 14:14:53
本发明属于生物工程,具体涉及一株粘质沙雷氏菌与一株乙酰微小杆菌在联产灵菌红素和β-胡萝卜素中的应用。
背景技术:
1、灵菌红素(prodigiosins,pg)是一种由微生物天然产生的重要红色素,是微生物的次级代谢产物。由于其具有多种生物活性和免疫抑制,在抗菌、抗疟疾和抗肿瘤等方面具有显著功效因而受到人们的广泛关注并被应用于多个领域。
2、β-胡萝卜素是类胡萝卜素的一种,是自然界普遍存在的最稳定的色素。研究表明,β-胡萝卜素是一种强大的抗氧化剂,在维持健康的皮肤、视力和神经功能方面起着至关重要的作用,同时具有解毒和一定的抗肿瘤作用,因而其在化妆品、食品、医药等领域有着广泛的应用。
3、当前生产灵菌红素的主要方法是微生物发酵法,但有着稳定性不高、生产周期长和生产成本高等弊端;生产β-胡萝卜素的主要方法为化学合成法、天然产物提取法和微生物发酵法,但化学合成法制得的产品的活性低、天然产物提取法制得产物的成本较高,而采用微生物发酵生产的β-胡萝卜素活性高、产量高、稳定性强。此方法中将两种菌按一定比例进行混合发酵,能够得到高产量的灵菌红素和β-胡萝卜素的同时也大大减少了生产成本,缩短了生产周期。
4、经检索,目前未见有使用粘质沙雷氏菌和乙酰微小杆菌混菌发酵联产灵菌红素和β-胡萝卜素的报道。此外,目前报道灵菌红素存在生产成本和提取成本高、工艺复杂等问题,工业化生产困难。而本发明首次报道了粘质沙雷氏菌和乙酰微小杆菌混菌发酵联产灵菌红素和β-胡萝卜素的新方法,不仅降低了合成灵菌红素和β-胡萝卜素成本,也提高了灵菌红素和β-胡萝卜素合成效率。
技术实现思路
1、发明目的:本发明要解决的技术问题是提供一种混菌发酵联产灵菌红素和β-胡萝卜素的方法,已解决现有技术中灵菌红素和β-胡萝卜素发酵成本高、稳定性不高、生产周期长的问题和β-胡萝卜素。
2、技术方案:为了解决上述问题,本发明采取的技术方案如下:
3、本发明筛选得到一株粘质沙雷氏菌,分类命名为粘质沙雷氏菌lt-7(serratiamarcescens lt-7),已保藏于“中国典型培养物保藏中心”(简称cctcc),保藏地址:湖北省武汉市,洪山区八一路,武汉大学山国典型培养物保藏中心,邮编:430072,保藏编号为cctcc no:m20231646,保藏日期为2023年9月7日。
4、本发明筛选得到一株乙酰微小杆菌,分类命名为乙酰微小杆菌lt-38(exiguobacterium acetylicum lt-38),已保藏于“中国典型培养物保藏中心”(简称cctcc),保藏地址:湖北省武汉市,洪山区八一路,武汉大学山国典型培养物保藏中心,邮编:430072,保藏编号为cctcc no:m20231647,保藏日期为2023年9月7日。以下内容均以此两种菌株作为生产菌株。
5、所属菌株有以下性质:
6、粘质沙雷氏菌lt-7(serratia marcescens lt-7)的16s rdna基因的核苷酸序列长度为1471bp,其基因序列如seq id no:1所示。将所测序列从gene bank数据库中使用blast程序进行同源性比较,构建16s rdna全序列为基础的系统发育树。结果表明:菌株与粘质沙雷氏菌s.marcescens jw-cz2达到100%同源性。根据菌株形态学观察和生理生化实验分析结果认定本发明所使用的是粘质沙雷氏菌。。
7、乙酰微小杆菌lt-38(exiguobacterium acetylicum lt-38)的16s rdna基因的核苷酸序列长度为1427bp,其基因序列如seq id no:2所示。将所测序列从gene bank数据库中使用blast程序进行同源性比较,构建16s rdna全序列为基础的系统发育树。结果表明:菌株与乙酰微小杆菌e.acetylicum k1达到100%同源性。根据菌株形态学观察和生理生化实验分析结果认定本发明所使用的是乙酰微小杆菌。
8、一种混菌发酵联产灵菌红素和β-胡萝卜素的方法,分别将粘质沙雷氏菌s.marcescens lt-7和乙酰微小杆菌e.acetylicum lt-38在固体培养基上活化,转接到种子液中,分别按2%(v/v)、1%(v/v)的比例接种到发酵液中培养,发酵富集灵菌红素和β-胡萝卜素。
9、本发明所述的混菌发酵联产灵菌红素和β-胡萝卜素的方法,包括以下步骤:
10、1.培养基的配置:
11、(1a)斜面培养基成分为:胰蛋白胨10g/l、氯化钙8g/l、酵母浸粉5g/l、琼脂粉20g/l,ph值5.0~7.0,优选为6.0;
12、(1b)活化培养基成分为:哥伦比亚血琼脂基础培养基3.9g/100ml,ph值5.0~7.0,优选为6.0;
13、(1c)液体种子培养基成分为:胰蛋白胨10g/l、氯化钙8g/l、酵母浸粉5g/l,ph值5.0~7.0,优选为6.0;
14、(1d)固体种子培养基成分为:胰蛋白胨10g/l、氯化钙8g/l、酵母浸粉5g/l、琼脂粉20g/l,ph值5.0~7.0,优选为6.0;
15、(1e)发酵培养基:碳源20~30g/l,氮源15~20g/l,金属盐1~8g/l,黄豆粉2~4g/l,ph值5.0~7.0,余量为水。ph值5.0~7.0,优选为6.0;
16、其中所述碳源为丙三醇,蔗糖,淀粉,乳糖,麦芽糖,果糖,葡萄糖,柠檬酸的任意一种或几种的组合;所述碳源的添加量为5~35g/l;所述碳源优选蔗糖,所述蔗糖的添加量优选为10g/l;
17、所述的有机氮源为菜籽饼粉,花生饼粉,大豆蛋白胨,酵母浸粉,蛋白胨,胰蛋白胨,玉米浆干粉,牛肉浸膏的任意一种或几种的组合;所述氮源添加量为3~24g/l,所述氮源;优选酵母浸粉,所述酵母浸粉的添加量优选为18g/l;
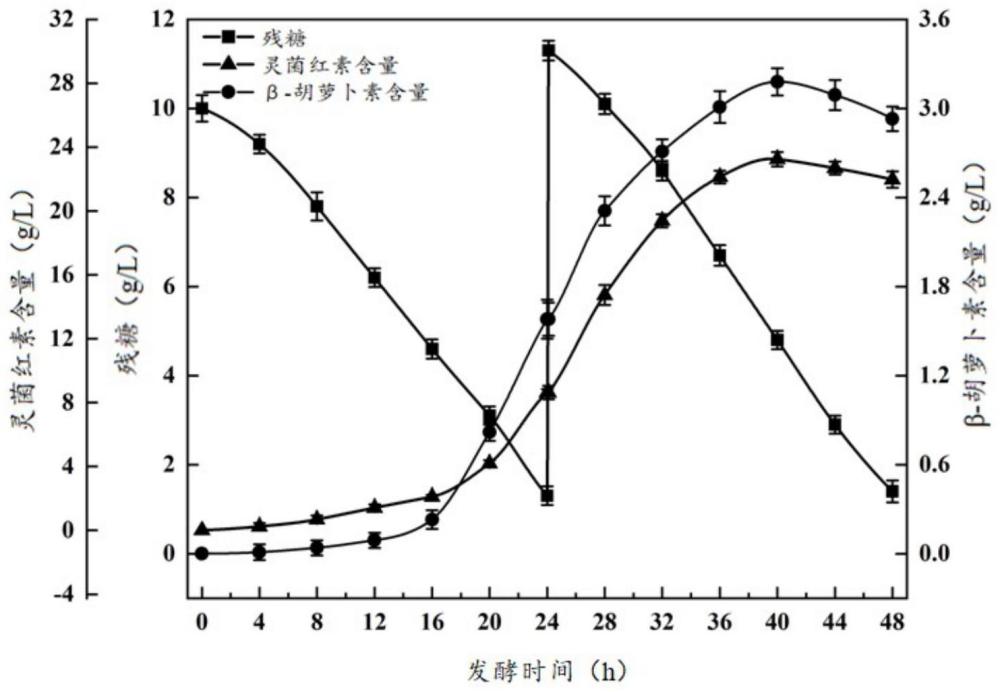
18、所述金属盐为氯化镍、硫酸锌、硫酸亚铁、硫酸锰、硫酸镁、氯化钙、磷酸氢二钾中的一种或几种的组合;优选氯化钙,所述氯化钙的添加量优选为8g/l;
19、最优选的发酵培养基包含如下组分:蔗糖10g/l、酵母浸粉18g/l、氯化钙8g/l、吐温-80 15g/l。利用氢氧化钠将发酵液初始ph调至6.0。
20、2.菌种选择:
21、选择已保藏菌种粘质沙雷氏菌s.marcescens lt-7和乙酰微小杆菌e.acetylicumlt-38。
22、3.菌种活化:
23、首先将菌株接种于斜面上置于30℃培养箱中培养24h,然后从斜面上挑取菌落到羊血培养基上三区划线进行活化,静置培养24h,再从活化板上挑取单菌于普通的平板上进行三区划线备用,静置培养24h,最后从普通板上挑取单菌落进行满划。
24、4.种子液培养:
25、取步骤3中活化好的菌种,无菌条件下使用接种环分别刮取1~2环菌泥于液体种子培养基中,放置于温度为30℃,转速为200rpm的摇床上培养12h得到种子液。
26、5.摇瓶发酵培养:
27、取步骤4中粘质沙雷氏菌s.marcescens lt-7种子液以2%为接种量,乙酰微小杆菌e.acetylicum lt-38种子液以1%为接种量接种至发酵液中,放置于温度为30℃、转速为200rpm的摇床上,培养32h~48h时补料;当发酵液中灵菌红素和β-胡萝卜素浓度基本不再上升时,发酵停止。
28、6.发酵罐发酵培养:
29、将步骤4中粘质沙雷氏菌s.marcescens lt-7和乙酰微小杆菌e.acetylicum lt-38发酵种子液在无菌条件下以2%:1%(v/v)的接种量接种于发酵罐中,装液量为3l/5l,转速为200~300rpm,通气比为0.9~1.6vvm,培养温度为25~32℃,初始ph为5.0~7.0,培养时间为12~48h;当发酵液中微灵菌红素和β-胡萝卜素浓度不再上升时,停止发酵。
30、7.灵菌红素和β-胡萝卜素的提取:
31、(7a)粗品制备
32、取步骤5或步骤6中的发酵液于9000rpm条件下离心,取沉淀菌体,加入甲醇(ph3)溶液超声辅助浸提20min后浸提过夜,得到菌体处理液,将其浓缩至膏状,加入浓缩液2倍体积的乙酸乙酯溶解,经过滤去除沉淀,上清液浓缩冷冻干燥得到色素粗品。
33、(7b)分离
34、将步骤(7a)所得的色素粗品溶解于2倍体积甲醇中待用。采用硅胶层析柱分离提纯灵菌红素和β-胡萝卜素。流动相采用石油醚:丙酮(3:2),硅胶采用200~300目,收集各组分过0.22μm的滤膜置于进样瓶中待用。样品采用高效液相色谱法检测,色谱柱:sepax c18;流动相:乙腈:乙酸铵(85:15);流速:1.00ml/min;进样量:10μl;柱温:30℃。
35、(7c)提纯
36、根据步骤(7b)所得液相色谱图分析,将分别含有灵菌红素和β-胡萝卜素的组分混合浓缩、冷冻干燥后得到灵菌红素粉末和胡萝卜素粉末。
37、8.色素的鉴定:
38、采用高效液相色谱仪、红外光谱仪和核磁共振仪来鉴定粘质沙雷氏菌s.marcescens lt-7和乙酰微小杆菌e.acetylicum lt-38的混合发酵产物。
39、(8a)红色素的鉴定
40、取步骤7所得灵菌红素粉末100mg溶于100ml甲醇,调节ph至3,得到灵菌红素甲醇溶液其液相色谱结果如图3(a)所示。在相同色谱条件下,该物质与灵菌红素标准品对比,在同一处均有吸收峰出现,说明发酵液中含有灵菌红素。
41、取步骤7所得灵菌红素粉末0.2mg与少量kbr研磨压片制样,然后用红外光谱仪测定样品的红外图谱,扫描范围4000~400cm-1,结果如图4(a)所示。
42、(8b)黄色素的鉴定
43、取步骤7所得胡萝卜素粉末10mg溶于10ml甲醇中,调节ph至6.8,得到其液相色谱结果如图3(b)所示。在相同色谱条件下,该物质与β-胡萝卜素标准品对比,在同一处均有吸收峰出现,说明发酵液中含有β-胡萝卜素。
44、取步骤7所得β-胡萝卜素粉末0.2mg与少量kbr研磨压片制样,然后用红外光谱仪测定样品的红外图谱,扫描范围4000~400cm-1,结果如图4(b)所示。
45、9.色素含量测定
46、(9a)灵菌红素含量测定
47、(9a-1)标准曲线的绘制
48、精密称取干燥恒重的灵菌红素标准品,在酸性(ph 3)条件下,配置成0.05、0.10、0.15、0.20、0.25、0.30mg/ml的标准甲醇溶液,使用酶联免疫检测仪测定535nm处的吸光度。以吸光度为纵坐标,浓度为横坐标,绘制标准曲线,得回归方程,如图5(a)所示,并依据该标准曲线计算灵菌红素的含量。
49、(9a-2)发酵液中灵菌红素含量的测定
50、在酸性(ph 3)条件下,发酵液中加入甲醇浸提20min,将浸提液于9000rpm离心3min;取离心上清液,使用酶联免疫检测仪测定535nm处的吸光度,每个离心管重复测三次取平均值,导出数据,参照灵菌红素标准曲线,求出灵菌红素的含量。
51、(9b)β-胡萝卜素含量测定
52、(9b-1)标准曲线的绘制
53、精密称取干燥恒重的灵菌红素标准品,在酸性(ph 3)条件下,配置成0.00、0.05、0.10、0.15、0.20、0.25、0.30mg/ml的标准甲醇溶液,使用酶联免疫检测仪测定450nm处的吸光度。以吸光度为纵坐标,浓度为横坐标,绘制标准曲线,得回归方程,如图5(b)所示,并依据该标准曲线计算β-胡萝卜素的含量。
54、(9b-2)发酵液中灵菌红素含量的测定
55、在酸性(ph 3)条件下,发酵液中加入甲醇浸提20min,将浸提液于9000rpm离心3min;取离心上清液,使用酶联免疫检测仪测定535nm处的吸光度,每个离心管重复测三次取平均值,导出数据,参照灵菌红素标准曲线,求出灵菌红素的含量。
56、有益效果:
57、本发明首次公开了一种混菌发酵联产灵菌红素和β-胡萝卜素的方法。此次方法可得最大灵菌红素产量达到23.24g/l,生产速率高达0.48g/l/h;β-胡萝卜素产量达到3.68g/l,生产速率高达0.07g/l/h,显著降低了生产成本,缩短了生长周期。本发明工艺简单,成本低廉,活性高、稳定性强、产量高、发酵周期短,具有良好的推广前景。
本文地址:https://www.jishuxx.com/zhuanli/20240911/289774.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表