一种用于诱导NK细胞精准杀伤肿瘤的跨膜DNA孔道细胞靶点标签的制备方法及应用
- 国知局
- 2024-10-09 16:38:56
本发明涉及生物医药,特别是基于dna纳米技术的诱导nk细胞精准杀伤肿瘤过继性免疫药物的一种用于诱导nk细胞精准杀伤肿瘤的跨膜dna孔道细胞靶点标签的制备方法及应用。
背景技术:
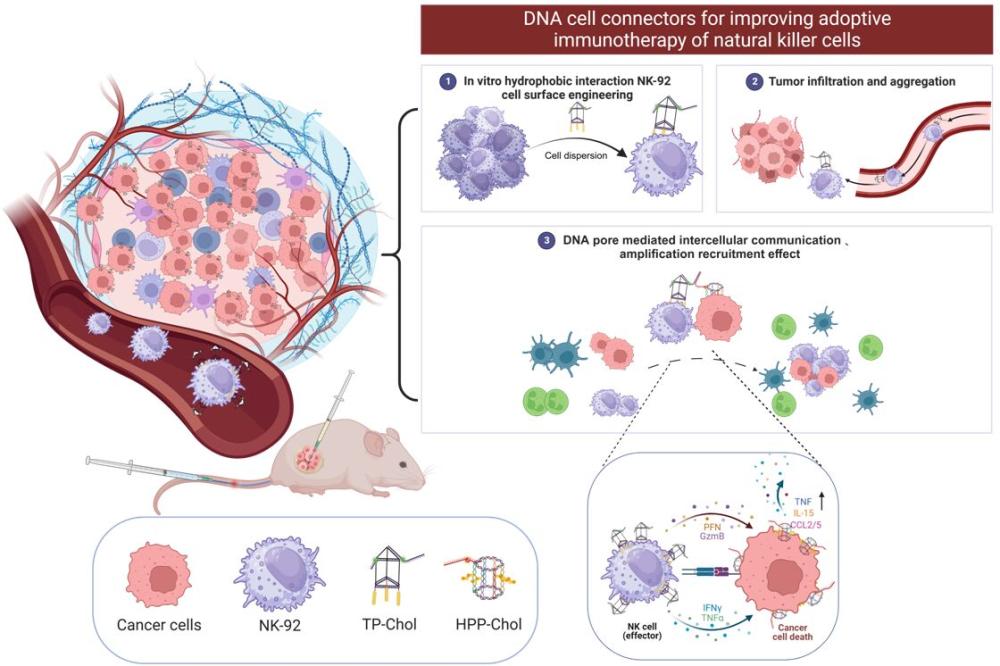
1、与以往的标准肿瘤治疗相比,癌症免疫治疗显著改善了患者的生存和生活质量,并被确立成为癌症治疗的新支柱。而在用于癌症免疫治疗的各种细胞来源中,自然杀伤细胞(nk)表现出独特的肿瘤免疫监测特征,可以通过抗体依赖性细胞介导的细胞毒性(adcc)作用迅速杀死对致癌表面标记物应激的肿瘤细胞。活化的nk细胞释放穿孔素和颗粒酶b直接杀死靶细胞,同时分泌炎性细胞因子和趋化因子发挥间接抗肿瘤活性,使其成为肿瘤免疫治疗的理想效应细胞。然而,在肿瘤微环境中普遍存在的nk细胞的抑制信号和较少的抗原受体,往往导致肿瘤微环境(tmes)中免疫细胞治疗药物的功能恶化和衰竭。
2、研究表明,在实体肿瘤中检测到的肿瘤相关抗原(tumor-associated antigens,taas)很少具有严格的肿瘤特异性。特别是在实体瘤中,由于细胞间显著的抗原异质性和高频率的突变率,识别出在多种肿瘤类型中均稳定表达的通用肿瘤抗原变得极具挑战性。这一现象限制了自然杀伤(nk)细胞针对特定肿瘤的精准激活和杀伤能力。因此,为了提高nk细胞针对实体瘤的特异性靶向能力以及增强实体瘤的免疫原性,进而促进有效的nk细胞介导的抗肿瘤反应,实现更高效的nk细胞招募。
3、针对靶向肿瘤抗原的nk细胞疗法中异质性实体瘤上的靶点丰度及特异性不足这一障碍,人们做出了许多努力,例如利用基因工程等技术重编程nk过继性免疫疗法、以及生物材料膜表面工程增强nk细胞的靶向丰度及精准度(包括但不限于点击化学、代谢标记以及脂质偶联物等工程膜靶向性;dna适配体工程膜表面抗原受体等),这些膜表面工程技术虽然提高了nk细胞肿瘤识别、免疫相互作用和nk细胞浸润到肿瘤部位的能力,但绝大多数肿瘤相关抗原也在正常组织中表达,且探索新的肿瘤细胞表面特异性抗原的已被证明具有较高挑战性。因此,需要一种可实现高特异性靶向并且安全通用的肿瘤细胞“抗原”靶点标签药物,提高实体瘤的“人工抗原活性”以及改善nk细胞对异质性实体瘤的敏感性,但至今未见有公开报道。
技术实现思路
1、针对上述情况,为克服现有技术之缺陷,本发明之目的就是提供一种用于诱导nk细胞精准杀伤肿瘤的跨膜dna孔道细胞靶点标签的制备方法及应用,可有效制备用于诱导nk细胞精准杀伤肿瘤的跨膜dna孔道细胞靶点标签,实现在制备抗肿瘤药物中的应用问题。
2、本发明解决的技术方案是,一种用于诱导nk细胞精准杀伤肿瘤的跨膜dna孔道细胞靶向标签的制备方法,首先构建类六棱柱状的dna孔道肿瘤细胞标签以及膜表面修饰有类三棱柱状的dna细胞标签的nk-92细胞,再利用胆固醇修饰基本框架链进行膜表面锚定和仿生孔道构建,通过dna衔接域链间碱基互补配对,实现nk-92细胞精准聚集、激活和杀伤实体肿瘤,制备方法具体步骤如下:
3、(1)六棱柱孔道标签合成:将dna引物链-1至dna引物链-6溶液均匀混合,在混合前,先将线性dna引物链-2和线性dna引物链-5分别置于1 × tee buffer反应缓冲液中溶解;其余5'端修饰有胆固醇的线性dna引物链-1、dna引物链-3、dna引物链-4、dna引物链-6分别用ddh2o溶解;
4、所述的dna引物链-1、dna引物链-2、dna引物链-3、dna引物链-4、dna引物链-5、dna引物链-6的初浓度均为20μm,混合均匀后置于pcr仪中进行梯度反应,其中:95℃ 恒温反应5 min,80℃反应1 min,然后以每个循环-1.5℃/1 min,经10个循环梯度降温至65℃;再以每个循环-0.6℃/4 min,循环41次梯度降温至40℃;以每个循环-1℃/1.5 min经16个循环梯度降温至24.4℃;此后以24.4℃恒温反应30 min,最后以4℃恒温反应2 h结束,得六棱柱孔道结构,加入浓度20μm的dna衔接域链-1,合成六棱柱孔道标签;
5、(2)三棱柱标签合成:将dna引物链-7、dna引物链-8、dna引物链-9溶液均匀混合,再置于1 × tee buffer反应缓冲液中溶解,得到浓度为20μm的线性dna引物链溶液;
6、所述的线性dna引物链-7、dna引物链-8、dna引物链-9的浓度均为20μm,混合均匀后置于pcr仪中进行梯度反应,其中:95℃ 恒温反应5 min,80℃反应1 min,然后以每个循环-1.5℃/1 min,经10个循环梯度降温至65℃;再以每个循环-0.6℃/4 min,循环41次梯度降温至40℃;以每个循环-1℃/1.5 min经16个循环梯度降温至24.4℃;此后以24.4℃恒温反应30 min,最后以4℃恒温反应2 h结束,得三棱柱基本框架结构,加入浓度为20μm的 dna衔接域链-2,以及3'端胆固醇修饰的线性dna引物链-10作为锚定结构域,合成三棱柱孔道标签;
7、(3)利用原子力显微镜(afm)表征产物三棱柱标签以及六棱柱孔道标签的形貌,并使用质量浓度8%的天然聚丙烯酰胺凝胶电泳表征六棱柱孔道结构的成功合成(见图2);
8、所述的六棱柱孔道标签,是由四条修饰有胆固醇的dna框架链、两条基本框架连以及dna衔接域链-1碱基互补配对结合而成类六棱柱的dna孔道结构;
9、所述的三棱柱孔道标签,包含三条基本框架dna链,两端分别与修饰有胆固醇的锚点dna链和dna衔接域链-2通过碱基互补配对形成类三棱柱的dna孔道nk-92细胞标签;
10、依据dna互补方式的方向性,实现两种孔道标签拉链式结合,其中dna六棱柱孔道标签利用胆固醇疏水作用在肿瘤原位形成2 nm的仿生孔道,通过释放肿瘤内容物,实现对nk-92细胞的招募、聚集并精准杀伤肿瘤细胞。
11、本发明方法制备的用于诱导nk细胞精准杀伤肿瘤的跨膜dna孔道细胞靶点标签在制备体外nk细胞回输相关过继性免疫疗法的药物中的应用。
12、所述的用于诱导nk细胞精准杀伤肿瘤的跨膜dna孔道细胞靶点标签分别呈现类三棱柱以及类六棱柱状结构,大小可达纳米级别。
13、所述的肿瘤细胞为黑色素瘤细胞以及人宫颈癌细胞和其他病理学上的实体肿瘤。
14、本发明原料丰富,制备方法易操作,产品质量好,胆固醇修饰的dna棱柱细胞标签,基于碱基互补配对介导nk细胞标记、追踪、聚集杀伤肿瘤细胞;仿生dna孔原位插入肿瘤细胞,创建人工跨膜通道,实现肿瘤相关抗原释放;聚集的nk-92细胞被原位更加精准激活并杀伤肿瘤细胞,改善过继性免疫,为诱导nk细胞精准杀伤肿瘤提供技术支持,可有效应用于制备体外nk细胞回输相关过继性免疫疗法的药物,适用于广泛的实体肿瘤治疗,经济和社会效益显著,是nk过继性免疫疗法治疗药物上的创新。
技术特征:1.一种用于诱导nk细胞精准杀伤肿瘤的跨膜dna孔道细胞靶向标签的制备方法,首先构建类六棱柱状的dna孔道肿瘤细胞标签以及膜表面修饰有类三棱柱状的dna细胞标签的nk-92细胞,再利用胆固醇修饰基本框架链进行膜表面锚定和仿生孔道构建,通过dna衔接域链间碱基互补配对,实现nk-92细胞精准聚集、激活和杀伤实体肿瘤,具体步骤如下:
2.根据权利要求1所述的用于诱导nk细胞精准杀伤肿瘤的跨膜dna孔道细胞靶点标签的制备方法,首先构建类六棱柱状的dna孔道肿瘤细胞标签以及膜表面修饰有类三棱柱状的dna细胞标签的nk-92细胞,再利用胆固醇修饰基本框架链进行膜表面锚定和仿生孔道构建,通过dna衔接域链间碱基互补配对,实现nk-92细胞精准聚集、激活和杀伤实体肿瘤,制备方法具体步骤如下:
3.根据权利要求1或2所述用于诱导nk细胞精准杀伤肿瘤的跨膜dna孔道细胞靶向标签的制备方法,其特征在于,所述的用于诱导nk细胞精准杀伤肿瘤的跨膜dna孔道细胞靶点标签为类三棱柱和类六棱柱状结构,大小为纳米级。
4.权利要求1或2、3任一项所述的方法制备的用于诱导nk细胞精准杀伤肿瘤的跨膜dna孔道细胞靶点标签在制备诱导nk细胞精准杀伤肿瘤的跨膜dna孔道细胞靶点标签药物中的应用。
5.权利要求1或2、3任一项所述的方法制备的用于诱导nk细胞精准杀伤肿瘤的跨膜dna孔道细胞靶点标签在制备抗肿瘤细胞药物中的应用。
6.根据权利要求5所述的在制备抗肿瘤细胞药物中的应用,其特征在于,所述的肿瘤细胞为黑色素瘤细胞以及人宫颈癌细胞。
7.权利要求1或2、3任一项所述的方法制备的用于诱导nk细胞精准杀伤肿瘤的跨膜dna孔道细胞靶点标签在制备体外nk细胞回输相关过继性免疫疗法药物中的应用。
技术总结一种用于诱导NK细胞精准杀伤肿瘤的跨膜DNA孔道细胞靶向标签的制备方法,首先构建类六棱柱状的DNA孔道肿瘤细胞标签以及膜表面修饰有类三棱柱状的DNA细胞标签的NK‑92细胞,再利用胆固醇修饰基本框架链进行膜表面锚定和仿生孔道构建,通过DNA衔接域链间碱基互补配对,实现NK‑92细胞精准聚集、激活和杀伤实体肿瘤,本发明原料丰富,制备方法易操作,产品质量好,为诱导NK细胞精准杀伤肿瘤提供技术支持,可有效应用于制备体外NK细胞回输相关过继性免疫疗法的药物,适用于广泛的实体肿瘤治疗,经济和社会效益显著,是NK过继性免疫疗法治疗药物上的创新。技术研发人员:郭振振,王丹钰,易桦,张开翔,高华,张振中受保护的技术使用者:郑州大学技术研发日:技术公布日:2024/9/26本文地址:https://www.jishuxx.com/zhuanli/20240929/313655.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表