一种髓系白血病治疗药物的制备方法与流程
- 国知局
- 2024-10-09 14:57:54
发明领域本发明属于化学药物领域,具体涉及一种复发难治性髓系白血病(aml)治疗药物奎扎替尼(quizartinib)新的制备方法。
背景技术:
1、急性髓性白血病(aml)是一种常见的血液恶性肿瘤,约占所有白血病病例的三分之一,是成人最常见的白血病类型之一。该疾病可发生于任何年龄,起病快,进展迅速,已成为严重威胁人的生命健康的一种凶险性疾病。作为一种进展迅速的血液和骨髓癌症,aml患者的癌变白细胞迅速增长,它们不但不能行使正常功能,而且影响正常血细胞的生成。aml患者的5年生存率约为30.5%。
2、flt3基因突变是急性髓性白血病患者中常见的基因变异,flt3-itd是最常见的flt3基因突变。flt3蛋白是在造血干细胞上发现的一种酪氨酸激酶受体。flt3基因在帮助白细胞生长方面发挥着重要作用,其突变可能会导致这些细胞过度生长,并导致侵袭性白血病。而在急性髓性白血病(aml)中,约1/4的患者携带flt3-itd基因突变,itd为内部串联重复。该突变与不良预后相关,包括复发风险增加和总生存期缩短。
3、奎扎替尼属于第二代flt3抑制剂,该药是一种口服小分子受体酪氨酸激酶抑制剂,选择性靶向抑制flt3。适用于与标准阿糖胞苷和蒽环类抗生素诱导和阿糖胞苷巩固治疗联合使用,并作为巩固化疗后的维持单药治疗,用于治疗经fda批准的试验检测为flt3内部串联重复(itd)阳性的新诊断急性髓细胞白血病(aml)成年患者。奎扎替尼及其主要活性代谢物ac886以相当的亲和力与flt3的三磷酸腺苷(atp)结合结构域结合,并且在结合试验中与flt3相比,两者对flt3-itd突变的亲和力低10倍。奎扎替尼和ac886抑制flt3激酶活性,防止受体的自磷酸化,从而抑制下游flt3受体信号传导并阻断flt3-itd依赖性细胞增殖。奎扎替尼在flt3-itd依赖性白血病小鼠模型中显示出抗肿瘤活性。
4、奎扎替尼片作为第二代flt3抑制剂,通过抑制癌细胞中的特定酪氨酸激酶信号通路,阻断癌细胞的生长和扩散,其安全性和耐受性良好,为急性髓系白血病患者的治疗提供了新的选择,具有里程碑意义。
5、奎扎替尼中文化学名为1-(5-叔丁基-1,2-恶唑-3-基)-3-(4-{7-[2-(吗啉-4-基)乙氧基]咪唑并[2,1-b][1,3]苯并噻唑-2-基}苯基)脲,分子式:c29h32n6o4s,分子量:560.67,cas号:950769-58-1,化学结构式如下:
6、
7、现有技术文件专利cn200780017760报道了奎扎替尼的合成路线1,具体如下:
8、路线1:
9、
10、该路线以对甲氧基苯胺、2-溴-4'-硝基苯乙酮、4-(3-氯丙基)吗啉以及5-(叔丁基)异恶唑-3-胺为起始原料,经7步反应制备得到奎扎替尼,该路线较长,收率较低。
11、现有技术文件专利cn201410734161报道的奎扎替尼合成路线与路线1基本相同,区别在于起始物料5-(叔丁基)异恶唑-3-胺先制备得到中间体(5-(叔丁基)异恶唑-3-基)氨基甲酸苯酯,再与中间体式a对接反应得到奎扎替尼,具体如下:
12、
13、现有技术文件journal of medicinal chemistry,2009,vol.52,#23,p.7808-7816报道了奎扎替尼的合成路线2,具体如下:
14、路线2:
15、
16、该路线以苯并[d]噻唑-2-胺、2-溴-4'-硝基苯乙酮、3-吗啉代丙-1-醇以及5-(叔丁基)-3-异氰酸异恶唑为起始原料,经5步反应制备得到奎扎替尼,该路线最后一步反应收率较低。
技术实现思路
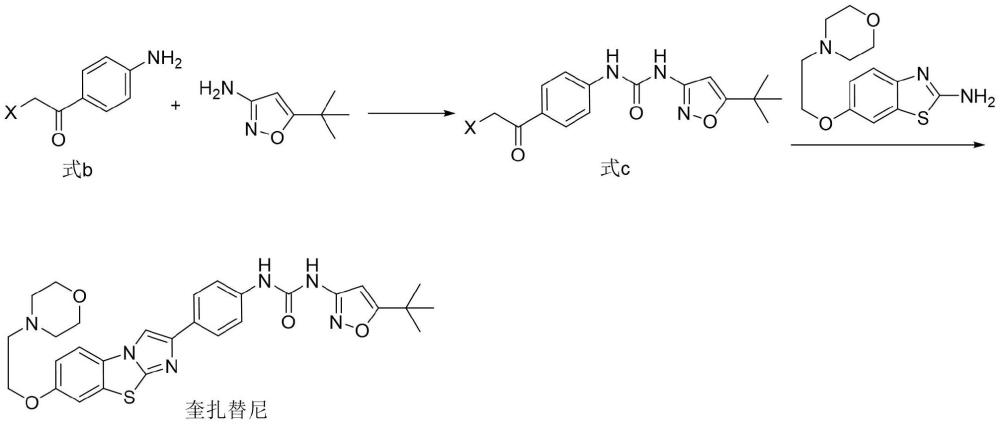
1、本发明的目的在于克服现有技术的不足,提供一种高危或复发性急性髓系白血病(aml)治疗药物奎扎替尼新的制备方法,所述方法为:
2、
3、步骤1、式b和5-(叔丁基)异恶唑-3-胺经酰化对接反应制备得到中间体式c化合物;
4、步骤2、中间体式c化合物和6-(2-吗啉乙氧基)苯并[d]噻唑-2-胺经环合反应制备得到奎扎替尼;
5、其中式b和式c化合物中x基团为氯、溴或碘。
6、本发明路线不同于现有技术文件专利cn200780017760中报道的奎扎替尼合成路线。本发明的目的是提供一种经2步反应制备高纯度的奎扎替尼的新方法,其显著特点产品纯度高,总收率高,起始原料价廉易购,操作安全简单,环境友好等优点。
7、本发明步骤1式b化合物和5-(叔丁基)异恶唑-3-胺化合物进行酰胺化对接反应的酰化剂为n,n′-二琥珀酰亚胺碳酸酯(dsc)或n,n'-羰基二咪唑(cdi)。该酰化反应中,可式b化合物先与酰化剂反应完全,再与5-(叔丁基)异恶唑-3-胺反应,也可5-(叔丁基)异恶唑-3-胺先与酰化剂反应完全,再与式b化合物反应;上述反应条件除投料顺序、反应时间不同外,其他并无显著差异。本发明步骤1反应中式b中x基团的不同对反应进程的影响不大。
8、步骤1反应当酰化剂为n,n'-羰基二咪唑时,无需加入有机碱作为缚酸,式b、5-(叔丁基)异恶唑-3-胺以及n'n-羰基二咪唑摩尔投料比为1:0.95~1.05:0.95~1.05,优选1:1:1。当酰化剂为n,n′-二琥珀酰亚胺基碳酸酯(dsc)时,需加入有机碱作为缚酸剂,有机碱选自三乙胺、n,n-二异丙基乙胺、4-二甲氨基吡啶(dmap)或n-甲基吗啉,优选三乙胺;式b、5-(叔丁基)异恶唑-3-胺以及n,n′-二琥珀酰亚胺碳酸酯(dsc)及有机碱摩尔投料比为1:0.95~1.05:0.95~1.05:2~4,优选1:1:1:3。以上优选反应条件能够保证反应完全,且反应副产物较少,并通过后处理无水乙醇-正己烷混合溶剂重结晶能够得到高纯度的式c化合物。
9、本发明步骤2环合反应的催化剂为无机碱,无机碱选自碳酸氢钠、碳酸氢钾、碳酸钠或碳酸钾,优选碳酸氢钠或碳酸氢钾。式c化合物、6-(2-吗啉乙氧基)苯并[d]噻唑-2-胺以及无机碱的摩尔投料比为1:0.95~1.05:0.95~1.05,优选1:1:1投料比能够保证得到高纯度的奎扎替尼,该纯度的奎扎替尼在成盐酸结晶后,纯度进一步提高,可满足药物要求。
10、本发明提供一条较具优势的、高纯度,高收率,环境友好的合成奎扎替尼的新路线,该方法相对现有技术文件优势明显,并可从其中获益。
技术特征:1.一种髓系白血病治疗药物的制备方法,其特征在于,所述方法为:
2.根据权利要求1所述的制备方法,其特征在于,所述步骤1反应的酰化剂为n,n′-二琥珀酰亚胺碳酸酯(dsc)或n'n-羰基二咪唑(cdi)。
3.根据权利要求1和2所述的制备方法,其特征在于,所述步骤1反应当酰化剂为羰基二咪唑时,无需加入有机碱作为缚酸剂,式b、5-(叔丁基)异恶唑-3-胺以及n'n-羰基二咪唑摩尔投料比为1:0.95~1.05:0.95~1.05,优选1:1:1。
4.根据权利要求1、2和3所述的制备方法,其特征在于,所述步骤1反应当酰化剂为n,n′-二琥珀酰亚胺基碳酸酯(dsc)时,需加入有机碱作为缚酸剂,有机碱选自三乙胺、n,n-二异丙基乙胺、4-二甲氨基吡啶(dmap)或n-甲基吗啉,优选三乙胺;式b、5-(叔丁基)异恶唑-3-胺以及n,n′-二琥珀酰亚胺碳酸酯(dsc)及有机碱摩尔投料比为1:0.95~1.05:0.95~1.05:2~4,优选1:1:1:3。
5.根据权利要求1所述的制备方法,其特征在于,所述步骤2环合反应的催化剂为无机碱,无机碱选自碳酸氢钠、碳酸氢钾、碳酸钠或碳酸钾,优选碳酸氢钠或碳酸氢钾。式c化合物、6-(2-吗啉乙氧基)苯并[d]噻唑-2-胺以及无机碱的摩尔投料比为1:0.95~1.05:0.95~1.05,优选1:1:1。
技术总结本发明提供一种髓系白血病治疗药物新的制备方法,经2步反应制备高纯度的奎扎替尼的新方法。技术研发人员:程刚受保护的技术使用者:北京康立生医药技术开发有限公司技术研发日:技术公布日:2024/9/29本文地址:https://www.jishuxx.com/zhuanli/20241009/307123.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表