1.本发明涉及提高烟叶品质的烟草植物体、制备该烟草植物体的方法、以及由该烟草植物体得到的收获物及该收获物的加工物。
背景技术:
2.类胡萝卜素是呈现红色、黄色或橙色的生物色素的总称,作为植物类胡萝卜素,可以举出β-胡萝卜素及叶黄素。类胡萝卜素的分解物总称为脱辅基类胡萝卜素。作为类胡萝卜素的分解物的脱辅基类胡萝卜素包含香气成分(β-大马酮(damascenone)、β-紫罗兰酮(ionone)及巨豆三烯酮(megastigmatrienone)等)。
3.类胡萝卜素作为保持生物体功能正常的有益物质(作为营养素的维生素a前体及抗氧化物质)而备受关注。因此,通过基因重组技术(gm技术)增加了类胡萝卜素蓄积量的各种作物是为了商业利用及提高植物体的胁迫耐性而制备的。
4.作为在烟草植物中增加类胡萝卜素蓄积量的例子,已知有对植物体施用药物、以及通过gm技术使与类胡萝卜素的生物合成或代谢相关的基因过量表达(专利文献1)。但是,对于使用药物而言,存在将药物从植物体及制品中排除的问题。另外,在使用gm技术将外源性的基因导入植物的情况下,无法控制其在基因组上的插入位置。
5.类胡萝卜素氧化裂解酶ccd是以类胡萝卜素作为底物进行切断而生成脱辅基类胡萝卜素的氧化酶。基于其序列同源性,已知有9种(有的根据编号不同而表示为nced)ccd基因被广泛保存于高等植物。其中,报告了ccd1及ccd4在多个植物种中参与类胡萝卜素量的调节和/或脱辅基类胡萝卜素的生成。
6.例如,在茄科植物(包含烟草)中有与矮牵牛(petunia)ccd1、番茄ccd1及马铃薯ccd4相关的报告。报告了在矮牵牛及番茄中ccd1基因的表达抑制使花中的β-紫罗兰酮减少,在马铃薯中ccd4基因的功能抑制使类胡萝卜素蓄积于花及块茎。除茄科植物以外,也报告了ccd4基因的表达抑制使类胡萝卜素蓄积于植物体的一部分。
7.对于烟草而言,有通过使用了同源检索的全基因组信息的全面分析而对烟草中的ccd基因家族进行了调查的报告(非专利文献1)。非专利文献1中报告了在烟草中存在3个ccd4基因、以及在3个ccd4基因的烟草植物中的表达。
8.现有技术文献
9.专利文献
10.专利文献1:美国专利公开第us2014/0289901号说明书
11.非专利文献
12.非专利文献1:zhou et al(2019)carotenoid cleavage dioxygenases:identification,expression,and evolutionary analysis of this gene family in tobacco,international journal of molecular sciences,vol.20,no.22.article number 5796
技术实现要素:
13.发明要解决的课题
14.烟草制品的香吸味是诉诸于人类的感觉器官的复杂品质,可以认为是建立在作为材料的烟叶中包含的各种成分的平衡之上的。植物中存在负责类似功能的多种基因,因此,按照目的而控制各种成分是非常困难的。
15.本发明的一个方式的目的在于实现能够提高烟草制品的品质的烟草植物体。
16.解决课题的方法
17.鉴于上述课题,本发明人等对于将特定的内源基因进行了功能抑制的烟草植物体中的成分详细地进行了分析,并且实际确认了烟草制品的品质,结果完成了本发明。
18.为了解决上述课题,本发明的一个方式的烟草植物体在基因组中导入了引起以下至少一个内源基因的功能抑制的突变,所述内源基因为:包含编码相对于序列号1所示的氨基酸序列具有80%以上的序列同一性的多肽的多核苷酸作为编码区域的内源基因、包含编码相对于序列号2所示的氨基酸序列具有80%以上的序列同一性的多肽的多核苷酸作为编码区域的内源基因、以及包含编码相对于序列号3所示的氨基酸序列具有80%以上的序列同一性的多肽的多核苷酸作为编码区域的内源基因。
19.另外,本发明的一个方面的烟草植物体的制备方法包括:在烟草植物体的基因组中导入引起以下至少一个内源基因的功能抑制的突变,所述内源基因为:包含编码相对于序列号1所示的氨基酸序列具有80%以上的序列同一性的多肽的多核苷酸作为编码区域的内源基因、包含编码相对于序列号2所示的氨基酸序列具有80%以上的序列同一性的多肽的多核苷酸作为编码区域的内源基因、以及包含编码相对于序列号3所示的氨基酸序列具有80%以上的序列同一性的多肽的多核苷酸作为编码区域的内源基因。
20.发明的效果
21.根据本发明的一个方式,可以提高由烟草植物体收获的烟叶的品质。
附图说明
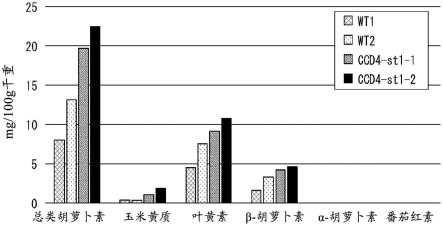
22.图1是示出了将实施例中制备的植物体中的类胡萝卜素的含量进行比较的结果的图。
23.图2是示出了将实施例中制备的林烟草植物体中的类胡萝卜素的含量进行比较的结果的图。
24.图3是示出了将实施例中制备的植物体的干叶中的类胡萝卜素的含量进行比较的结果的图。
25.图4是示出了将温室栽培的其它突变体植物中的类胡萝卜素的含量进行比较的结果的图。
26.图5是示出了将田地栽培的上述其它突变体植物的干叶中的类胡萝卜素的含量进行比较的结果的图。
具体实施方式
27.〔1.烟草植物体〕
28.本发明的一个实施方式提供一种烟草植物体,其在基因组中导入了引起以下至少
一个内源基因的功能抑制的突变,所述内源基因为:包含编码相对于序列号1所示的氨基酸序列具有80%以上的序列同一性的多肽的多核苷酸作为编码区域的内源基因、包含编码相对于序列号2所示的氨基酸序列具有80%以上的序列同一性的多肽的多核苷酸作为编码区域的内源基因、以及包含编码相对于序列号3所示的氨基酸序列具有80%以上的序列同一性的多肽的多核苷酸作为编码区域的内源基因。
29.上述烟草植物体与野生型植物相比,在类胡萝卜素和/或脱辅基类胡萝卜素的含量方面发生了变化(增加及减少)。如后述的实施例所示,上述烟草植物体在其叶(鲜叶及干叶)中的类胡萝卜素和/或脱辅基类胡萝卜素的含量方面发生了变化(增加及减少)。因此,该烟草植物体中包含的各种成分的平衡与现有的烟草植物体相比发生了变化,该平衡提高了由该烟草植物体得到的烟草制品的香吸味(品质)。这里,香吸味(品质)提高的烟草制品可以是香烟、雪茄、加热式烟草(非燃烧型烟草香味抽吸器)、以及无烟烟草中的任一种。另外,由该烟草植物体得到的烟叶的加工品也可以作为电子香烟等的香味源而使用。
30.只要可提高由上述烟草植物体生产的烟草制品的香吸味(品质),该烟草植物体中各个类胡萝卜素及脱辅基类胡萝卜素的含量可以增加,也可以减少。在能够生产香吸味提高的烟草制品的烟草植物体的优选实施方式中,与野生型烟草植物体相比,该烟草植物体具有增加的总类胡萝卜素含量。本说明书中使用的用语“总类胡萝卜素含量”是指使用吸光光度法定量的烟草属植物体中的全部类胡萝卜素的含量。上述烟草植物体的总类胡萝卜素含量为野生型烟草属植物体中的总类胡萝卜素含量的例如1.2倍以上、1.5倍以上、1.7倍以上、1.8倍以上、1.9倍以上、优选为2倍以上、2.5倍以上、进一步优选为3倍以上。
31.在上述优选实施方式中,更优选上述烟草植物体的叶黄素、β-胡萝卜素及玉米黄质中的至少1者具有比野生型烟草植物体增加的含量。上述烟草植物体中的这些类胡萝卜素含量为野生型的烟草属植物体中的相应类胡萝卜素含量的例如1.2倍以上、1.5倍以上、1.7倍以上、1.8倍以上、1.9倍以上、优选为2倍以上、2.5倍以上、进一步优选为3倍以上。这些类胡萝卜素量可以使用高效液相色谱法等公知的方法进行定量。
32.在上述优选实施方式中,更优选上述烟草植物体的β-紫罗兰酮及二氢猕猴桃内酯(dihydroactinidiolide)(均为脱辅基类胡萝卜素)中的至少一者具有比野生型烟草植物体增加的含量。这些脱辅基类胡萝卜素作为花的香气成分而为人所知。
33.部分允许含量减少的脱辅基类胡萝卜素可以为例如作为香气成分而已知的脱辅基类胡萝卜素(β-大马酮、巨豆三烯酮(的结构异构体)及3-羟基-β-二氢大马酮)。其中,该脱辅基类胡萝卜素可以为β-大马酮、巨豆三烯酮(的结构异构体)及3-羟基-β-二氢大马酮。
34.对于由上述烟草植物体得到的烟叶或其加工品而言,根据类胡萝卜素的含量,可以呈现与由未发生上述内源基因的至少任一种的功能抑制的烟草植物体得到的烟叶或其加工品不同的颜色(特别是黄色或橙色)。特别是无烟烟草有很多被使用者直接辨识烟叶或其加工品的机会。因此,具有上述不同颜色的烟叶或其加工品能够在不着色的情况下给使用者在视觉上留下与以往不同的印象。
35.在一个实施方式中,具有比野生型植物增加的含量的叶黄素、β-胡萝卜素或玉米黄质的上述烟草植物体可以成为抑制了tsna的生成量的烟叶及烟草制品的原料。叶黄素、β-胡萝卜素及玉米黄质作为抗氧化物质而为人所知。抗氧化物质抑制烟草特有亚硝胺(tobacco-specific nitrosamines:tsnas)的生成。tsna[n
’‑
nitrosonornicotine(nnn)、n’‑
nitrosoanatabine(nat)、n
’‑
nitrosoanabasine(nab)、4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone(nnk)等]通过降烟碱、新烟草碱、毒藜碱或尼古丁的与亚硝酸等的非酶促反应(亚硝基化)而生成。该反应可以被抗氧化物质之一的类胡萝卜素抑制。即,叶黄素、β-胡萝卜素或玉米黄质可以减少由烟叶及烟草制品生成的tsna量。这里,tsna量减少的烟草制品可以为香烟、雪茄、加热式烟草(非燃烧型烟草香味抽吸器)、以及无烟烟草中的任一者。
[0036]
本说明书中使用的情况下,“烟草植物体”及“烟草”包括所有个体(例如,成熟体、苗及种子)、组织(例如,叶、茎、花、根、生殖器官、胚及它们的一部分等)、以及它们的干燥物。
[0037]
本说明书中使用的情况下,“(氨基酸序列的)序列同一性”是指,相对于作为基准的(氨基酸)序列,所述的(氨基酸)序列一致的比例。这里,序列中不一致的部分为存在(氨基酸残基的)置换、添加、缺失或插入的部分。
[0038]
这里,使用序列表中记载的氨基酸序列确定多肽的记载“相对于~所示的氨基酸序列具有80%以上的序列同一性的多肽”是指野生型多肽。该野生型多肽是指后述的烟草属植物中通常存在的多肽。野生型多肽例如为具有序列号1、2或3中记载的氨基酸序列的蛋白质、或该蛋白质在烟草属植物中的同源分子种。在本说明书中,“多肽”及“蛋白质”具有实质上相同的含义,可以交换使用。
[0039]
本说明书中使用的情况下,“内源基因”是指在烟草属植物的基因组上原本存在的基因。即,内源基因不是存在于除烟草属植物以外的植物的外源基因。
[0040]
因此,烟草植物体中存在量减少的多肽只要是与序列表所示的各氨基酸序列具有80%以上的序列同一性的多肽即可,该序列同一性优选为更高的比例(例如,81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、或99%以上)。
[0041]
在烟草属植物中,相当于通过上述突变而受到功能抑制的上述内源基因的各基因具有很高的序列同一性,高度保守。即,上述各基因所编码的多肽(上述内源基因所编码的多肽在烟草属植物中的同源分子种(orthologue)具有上述的序列同一性。将上述内源基因在烟草属植物及其以外的植物中的同源分子种所具有的序列同一性的例子总结于表1。在表1中,以烟草ccd4-s蛋白质(序列号1)、烟草ccd4-t1蛋白质(序列号2)及烟草ccd4-t2蛋白质(序列号3)为基准示出了各植物所具有的同源分子种的序列同一性。在本说明书中,“野生型烟草植物”可以是未导入抑制烟草ccd4-s基因、烟草ccd4-t1基因及烟草ccd4-t2基因的表达的因子、且在这些基因中不具有突变的植物,但并不限定于此。
[0042][0043]
多肽的“存在量减少”是指以野生型多肽的存在量为基准,存在70%以下、60%以下、50%以下、40%以下、30%以下、20%以下、10%以下、5%以下、或1%以下的该多肽。以
上述野生型多肽的存在量为基准的上述多肽的存在量可以从使至少1种以上的类胡萝卜素或脱辅基类胡萝卜素在烟草植物体中的含量发生变化的上述值中适当选择。
[0044]
需要说明的是,上述烟草植物体中的上述多肽的存在量的减少优选在由该烟草植物体得到的培养细胞、愈伤组织、原生质体、种子及后代中遗传稳定地得到继承。因此,上述烟草植物体可以是由借助人工操作生成的培养细胞、愈伤组织、原生质体、种子及后代产生的个体,用于得到该个体的这些材料也包含于本发明的范围。
[0045]
上述烟草植物体可以进一步包含通过交配而得到的育种后代。以稻、小麦、大麦、大豆为代表,在多个植物种类中进行了使用突变体的育种。例如,在从用突变原进行了处理的突变体群中分离出的突变体的情况下,除了作为对象的基因以外,还具有多个突变。因此,通常为了除去多余的突变而进行回交。在该杂交中,通过使具有优良性状的栽培品种与上述突变体进行交配,可以将突变体所具有的期望性状(经过改变的类胡萝卜素和/或脱辅基类胡萝卜素的含量)导入现有的栽培品种。这样得到的育种后代可以是对现有的栽培品种赋予了高附加值的品种。
[0046]
这里,上述突变体的期望性状来自于导入至基因组上的多个位置(例如,多个基因)的突变。因此,预先进行具有该突变的个体的筛选对于高效地回交而言是必需的。在个体的筛选中,如果能够简便地检测个体中的上述突变的有无、以及该突变为纯合型或杂合型,则是有利的。该检测可以按照用于检测基因的突变的后述的方法而实施。与以上观点不同,优选通过更少的杂交次数而得到返回栽培品种的比率(来自于栽培品种的基因组区域占基因组全部区域的比例)高的品系。作为实现更少的杂交次数的方法,可以举出使用了在上述突变体与现有的栽培品种之间显示出多态性的背景标志物的mas(marker assisted selection)。作为显示出多态性的背景标志物,可以利用烟草中公知的snp或ssr(simple sequence repeat)。除了现有的标志物以外,只要能够确定杂交所使用的突变体及现有的栽培品种的基因组序列、并且通过比较而确定核苷酸序列的差异及存在于基因组上的重复序列的数量的差异,也可以利用这些差异作为新的标志物。
[0047]
在以下的说明中,关于内源基因及基因组,以nicotiana tabacum(红花烟草、n.tabacum)为基准进行说明。作为以下说明的基准的红花烟草(n.tabacum),是双二倍体,有来自于作为祖先种的林烟草(nicotiana sylvestris)的基因组(s基因组)及来自于绒毛状烟草(nicotiana tomentosiformis)的基因组(t基因组)这两者。已知上述的受到功能抑制的3个内源基因在s基因组中存在1个(以下记载为ccd4-s基因),在t基因组中存在2个(以下分别记载为ccd4-t1基因及ccd4-t2基因)。
[0048]
需要说明的是,在烟草植物体中,对于编码在种间实质上发挥相同功能的多肽的基因的一部分(并非全部)的编码区域中的核苷酸序列而言,在栽培品种间可以举出1~数%的差异,在栽培品种与亲缘野生种之间可以具有约10%以下的差异。
[0049]
具有序列号1所示的氨基酸序列的多肽例如由具有序列号4所示的核苷酸序列的多核苷酸(ccd4-s基因的编码区域(cds))编码。具有序列号2所示的氨基酸序列的多肽例如由具有序列号5所示的核苷酸序列的多核苷酸(ccd4-t1基因的编码区域(cds))编码。具有序列号3所示的氨基酸序列的多肽例如由具有序列号6所示的核苷酸序列的多核苷酸(ccd4-t2基因的编码区域(cds))编码。
[0050]
这里,作为用于分离同源基因的本领域技术人员公知的方法,可以举出:杂交技术
(southern,e.m.,journal of molecular biology,vol.98,503,1975)、聚合酶链式反应(pcr)技术(saiki,r.k.,et al.science,vol.230,1350-1354,1985,saiki,r.k.et al.science,vol.239,487-491,1988)。因此,对于本领域技术人员而言,例如,以具有序列号4所示的核苷酸序列的多核苷酸或其一部分作为探针、或者以与该多核苷酸在严格条件下进行杂交的寡核苷酸作为引物,可以从各种植物中容易地分离ccd4-s的同源基因。只要是接触到以上说明的本领域技术人员,可以基于序列号5的核苷酸序列(的一部分)而容易地分离ccd4-t1基因的同源基因,可以基于序列号6(的一部分)而容易地分离ccd4-t2基因的同源基因。
[0051]
这里,严格条件是指,所谓的可形成对核苷酸序列特异性的双链的多核苷酸、但非特异性的双链的多核苷酸的形成显著受到抑制的条件。换言之,可以认为是同源性高的核酸彼此杂交的条件,例如为在比与探针完全一致的双链多核苷酸的熔解温度(tm值)至低15℃、优选低10℃、进一步优选低5℃的温度范围的温度下进行杂交的条件。例如,可以举出在一般的杂交用缓冲液中,在68℃、20小时的条件下进行杂交的条件。示出一例,可以举出在包含0.25m na2hpo4、ph7.2、7%sds、1mm edta、1
×
邓哈特(denhardt’s)溶液的缓冲液中于温度为60~68℃、优选为65℃、进一步优选为68℃的条件下进行16~24小时杂交,并进一步在包含20mm na2hpo4、ph7.2、1%sds、1mm edta的缓冲液中于温度为60~68℃、优选为65℃、进一步优选为68℃的条件下进行2次15分钟的清洗的条件。作为其它例子,在25%甲酰胺、更严格的条件下,在包含50%甲酰胺、4
×
ssc(氯化钠/柠檬酸钠)、50mm hepes ph7.0、10
×
邓哈特溶液、20μg/ml改性鲑鱼精子dna的杂交溶液中于42℃下进行预杂交过夜后,添加经标记的探针,在42℃下保温过夜,由此进行杂交。随后的清洗时的清洗液及温度条件为“1
×
ssc、0.1%sds、37℃”左右,作为更严格的条件,可以为“0.5
×
ssc、0.1%sds、42℃”左右,作为进一步严格的条件,可以在“0.2
×
ssc、0.1%sds、65℃”左右下实施。越这样地使杂交的清洗条件变得严格,越可以期待具有与探针序列高的同源性的dna的分离。其中,上述ssc、sds及温度的条件的组合为示例,本领域技术人员可以通过将确定杂交的严格性的上述或其它要素(例如,探针浓度、探针的长度、杂交反应时间等)进行适当组合,从而实现与上述相同的严格性。例如,本领域技术人员可以通过参照molecular cloning(sambrook,j.et al.,molecular cloning:a laboratory manual 2nd ed.,cold spring harbor laboratory press,10skyline drive plainview,ny(1989))等而容易地获得这样的基因。
[0052]
作为确定内源基因的说明,在本说明书中使用的情况下,“(第1个)
···
内源基因、(第2个)
···
内源基因、以及(第3个)
···
内源基因的至少任一者”是指以下的1~7的任一者。如实施例所证明的那样,在一个实施方式中,下述1~3中的1者以上受到了功能抑制,在优选的实施方式中,下述4~6的至少任一者受到了功能抑制,在更优选的实施方式中,下述7受到了功能抑制。
[0053]
1.(第1个)内源基因(ccd4-s基因);
[0054]
2.(第2个)内源基因(ccd4-t1基因);
[0055]
3.(第3个)内源基因(ccd4-t2基因);
[0056]
4.(第1个)内源基因及(第2个)内源基因;
[0057]
5.(第1个)内源基因及(第3个)内源基因;
[0058]
6.(第2个)内源基因及(第3个)内源基因;以及
[0059]
7.(第1个)内源基因、(第2个)内源基因及(第3个)内源基因的组合。
[0060]
本说明书中使用的情况下,“(内源)基因的功能抑制”是指位于基因组上的基因不发挥原本的功能的状态。因此,“(内源)基因的功能抑制”是包括“(内源)基因的突变”、“(内源)基因的破坏”、以及基于该(内源)基因以外(包含外源基因的)的该“(内源)基因的表达抑制”的用语。
[0061]“(内源)基因的破坏”是指,原本位于基因组上的基因不存在、或者不能由位于基因组上的基因生成转录产物。“(内源)基因的突变”是指,不生成原本的功能性多肽的基因突变(功能的降低或缺损)、尽管生成功能性多肽但生成的量降低的基因突变、或者尽管生成功能性多肽但该多肽的稳定性降低的基因突变等。“(内源)基因的表达抑制”是指,该(内源)基因的碱基虽然没有发生变化,但借助其它因子对基因的转录或翻译功能(从向mrna的转录至随后的向多肽的翻译)进行修饰而使多肽的生成量降低、或不发生多肽的生成的状态等。“(内源)基因的表达抑制”例如可以通过由该(内源)基因转录的mrna的分解而实现。
[0062]
本说明书中使用的情况下,“突变”具有本技术所属的技术领域中通常理解的含义,例如,是指位于野生型的基因组上的碱基、或位于野生型多肽的氨基酸残基的任意变化(例如,置换、缺失、插入、添加、重复、倒位或易位等)。因此,“(内源)基因的突变”是指,不生成原本的功能性多肽的基因突变(包含生成功能降低或缺损的多肽的突变)、尽管生成多肽但生成的量降低的基因突变、尽管生成多肽但多肽的稳定性降低的基因突变、基因(包含编码区域或非翻译区域的基因组dna序列)的丧失、或者来自基因的转录受到抑制的突变(转录控制区域或转录起始区域的缺失等)等。
[0063]
在通过置换而使功能缺损的情况下,该置换可以存在于启动子序列(可举出以编码区域为基准位于上游(5’侧)的序列)、以及位于下游(3’侧)的序列)、5’非翻译区域及3’非翻译区域、位于内含子的两端的保守序列(例如5’末端的gt及3’末端的ag)、以及编码区域中的至少一者。
[0064]
例如,位于某个基因的启动子序列、5’非翻译区域及3’非翻译区域的对基因表达调节非常重要的核苷酸序列的置换会降低该基因的转录活性或降低来自该基因的转录产物的稳定性。这些降低均会导致来自上述基因的转录产物的减少,会发生翻译产物的减少。内含子的上述保守序列的置换(剪接突变)通过引起mrna的剪接异常而产生添加或插入了不需要的内含子的异常mrna。异常mrna例如通过移码而产生异常的翻译产物或不终止翻译。
[0065]
在位于编码区域的核苷酸置换为错义突变的情况下,由于通过该置换而生成与原本的氨基酸不同的氨基酸,因此会产生原本的功能降低或缺损的多肽。
[0066]
另外,位于编码区域的置换会产生不完整长度的翻译产物或没有保持原本功能的翻译产物。不完整长度的翻译产物是由于编码氨基酸的密码子向终止密码子的由该置换导致的转变(无义突变)而产生的。与原本的翻译产物相比,不完整长度的翻译产物缺失了包含c末端的氨基酸残基的连续1个以上的氨基酸残基。无义突变发生于位于原本的终止密码子的上游的任意密码子,优选位于从原本的终止密码子起夹隔1个以上密码子的上游。因此,来自具有无义突变的基因的翻译产物为不完整长度。原本功能受损的翻译产物通过氨基酸置换而产生。在该情况下,转录物的量与野生型植物相比可以为同等水平。该翻译产物发生了立体结构的变化、或作为功能域的功能的降低等。本发明的突变的优选方式之一为
产生这样的原本功能受损的翻译产物的氨基酸置换。上述氨基酸置换优选为具有使翻译产物的功能发生改变的可能性高的非保守置换。非保守置换可以列举向电荷或疏水性不同的氨基酸的置换(例如,由碱性氨基酸向酸性氨基酸的置换、由碱性或酸性氨基酸向中性氨基酸的置换、由中性氨基酸向碱性或酸性氨基酸的置换、由极性氨基酸向非极性氨基酸的置换)、以及向具有不同体积(立体大小)的侧链的氨基酸的置换等。
[0067]
作为由无义突变产生的现象的其它例子,在ccd4基因的蛋白质编码区域具有无义突变的情况下,会发生无义介导的mrna降解(nonsense-mediated mrna decay)(brogna and wen(2009)nat.structural mol.biol.16:107-113)。由于无义介导的mrna降解会引起转录物的分解,因此,有时无义突变会使转录物量降低。在对象基因包含多个外显子的情况下,为了发生无义介导的mrna降解,优选至少存在一个具有无义突变的外显子,更优选该具有无义突变的外显子不是构成对象基因的最下游(3’侧)的外显子。野生型的烟草属植物的ccd4基因具有2个外显子和1个内含子。因此,发生无义介导的mrna降解的无义突变的优选实施方式为在第1外显子存在至少一个无义突变。
[0068]
置换以外的突变(缺失及插入等)发生在启动子序列、5’非翻译区域和/或3’非翻译区域内时,结果是与置换同样地会发生转录活性或稳定性的降低所导致的转录产物量的减少、以及多肽的量的减少。另外,对内含子的保守序列的置换以外的突变也与置换同样,会发生具有与原本不同的氨基酸序列的多肽的翻译。另外,对编码区域的置换以外的突变会发生氨基酸残基的缺失或插入(通过3的倍数的连续的碱基的缺失或插入而产生)、或者因移码而发生具有与原本不同的氨基酸序列的多肽的翻译。另外,包含该基因整体的大幅的缺失或向该基因插入很大的片段会使该基因的表达本身丧失。
[0069]
作为上述内源基因的突变或破坏的结果而产生的个体,在本说明书中被称为烟草植物体的突变体(简称为突变体)。需要说明的是,用于使功能缺损的突变可以在1个基因具有1种突变,也可以具有多个突变,突变的种类没有限定。
[0070]
上述突变体优选处于状态(i)~(iii)中任一者。处于状态(i)~(iii)的任一者的突变体中,如后述的实施例所证明的那样,至少1个内源基因的功能实质上丧失,可充分且可靠地实现上述突变或破坏的目的(生成与野生型植物相比类胡萝卜素和/或脱辅基类胡萝卜素的含量发生了变化(增加及减少)的烟草植物体)。
[0071]
(i)对于至少1个上述内源基因的2个等位基因具有上述突变(相同或不同);
[0072]
(ii)该个2等位基因被破坏;以及
[0073]
(iii)该2个等位基因中的一者具有突变,且另一者被破坏。
[0074]
上述内源基因的表达抑制包括由该内源基因向mrna的转录的抑制、mrna介导的由该内源基因向多肽的翻译的抑制(例如,该mrna的分解)、以及翻译得到的多肽的功能的抑制。mrna的分解可以由上述无义介导的mrna降解而发生。转录的抑制可以通过促进来自上述内源基因的转录的转录因子的抑制、以及转录起始因子与上述内源基因连接的抑制等而实现。翻译的抑制可以使用反义rna分子、rnai分子、或共抑制分子而实现。多肽的功能的抑制可以通过利用与功能性多肽的结合而抑制该多肽的功能的分子(例如,诱饵(decoy)核酸、核酶、抗体及抑制肽)来实现。
[0075]
上述(转录、翻译或多肽的功能的)抑制例如可以通过将用于实现该抑制的分子直接导入植物体、或将编码该分子的核酸分子导入植物体(植物体的转化)而实现。这里,作为
植物体的转化的结果,上述核酸分子可被导入该植物体的基因组中的1个以上的任意区域。只要能够实现上述抑制,作为植物体的转化的结果,上述核酸分子并不需要导入s基因组及t基因组这两者。
[0076]
在上述烟草植物体中,优选上述功能抑制为:与野生型植物相比,作为上述内源基因的表达产物的多肽的存在量减少。详细而言,该存在量通过引起编码上述野生型多肽的内源基因的功能抑制而减少。
[0077]
相对于序列号1、2或3所示的氨基酸序列具有80%以上的序列同一性的多肽为野生型植物中存在的多肽(或其变体)。因此,对于上述烟草植物体而言,由于上述多肽的存在量比野生型植物减少,因此比野生型植物所具有的上述功能差。该功能例如为分解1种以上类胡萝卜素的功能。
[0078]
在上述烟草植物体中,优选上述功能抑制为:与野生型植物相比,作为上述内源基因的表达产物的多肽的翻译量减少。多肽的翻译是基于mrna的减少(mrna自身的不稳定性、mrna的分解促进或mrna的转录的抑制等mrna存在量等所引起)或来自mrna的翻译量的减少(翻译构成要素(trna及核糖体)的缺乏、募集(recruit)的抑制、或功能性的缺损等所引起)而发生的。
[0079]
在上述烟草植物体中,优选上述功能抑制为:与野生型植物相比,由上述内源基因转录得到的mrna的存在量减少。mrna的存在量减少例如通过抑制由基因向mrna的转录而发生。转录的抑制可以通过作为对上述内源基因导入突变的结果而发生的、转录起始因子与该内源基因结合的抑制等而实现。
[0080]
在上述烟草植物体中,优选上述功能抑制为:促进由上述内源基因转录得到的mrna的分解。mrna的分解可以通过产生无义介导的mrna降解的无义突变在内源基因中的存在、分解mrna的外来因子的存在、分解mrna的内源性的构成要素的活化、或mrna中的分解促进序列的存在等而引起。在烟草属植物体中,由上述内源基因转录得到的mrna的分解受到促进时,上述烟草属植物体内的上述mrna减少。即,在上述烟草属植物体中,上述功能抑制可以是由上述内源基因转录得到的mrna量与野生型植物相比减少。这里,“由内源基因转录得到的mrna的存在量的减少”是指,以野生型植物中该内源基因的转录物的存在量作为基准,存在70%以下、60%以下、50%以下、40%以下、30%以下、20%以下、10%以下、5%以下、或1%以下的该转录物。
[0081]
在上述烟草植物体中,上述突变可以是表达促进由上述内源基因转录得到的mrna的分解的因子的多核苷酸向存在上述内源基因的区域外的插入。
[0082]
上述因子优选为反义rna分子、rnai分子或共抑制(co-suppression)分子。
[0083]
在上述烟草植物体中,上述内源基因的突变或破坏是作为例如自然突变、突变原处理、基因重组、基因组编辑或基因敲除的结果而产生的。上述内源基因的自然突变通常因复制错误和基因损伤而产生。该损伤的原因为暴露于天然存在的公知的突变原(例如,放射线、紫外线等)等。上述内源基因的突变原处理可以通过使上述突变原人工地作用于烟草植物体(并且根据需要与基因修复功能的抑制组合)而实施。作为突变原的种类,可以使用例如甲基磺酸乙酯(ems)、叠氮化钠、溴化乙锭、以及亚硝酸等化学药剂,只要是使烟草属植物的基因组dna发生突变的化学药剂即可,并不限定于此。另外,作为突变原,可以列举例如:γ射线、重离子束、x射线、中子射线、或uv等,只要是使烟草属植物体的基因组dna发生突变
rotundifolia)、黄花烟草(nicotiana rustica)(黄花烟)、赛特氏烟草(nicotiana setchellii)、拟似烟草(nicotiana simulans),茄叶烟草(nicotiana solanifolia)、斯佩格茨烟草(nicotiana spegauinii)、斯托克通氏烟草(nicotiana stocktonii)、香甜烟草(nicotiana suaveolens)、林烟草(nicotiana sylvestris)、红花烟草(nicotiana tabacum)、蓝烟草(nicotiana thyrsiflora)、绒毛烟草(nicotiana tomentosa)、绒毛状烟草(nicotiana tomentosifomis)、三角叶烟草(nicotiana trigonophylla)、荫生烟草(nicotiana umbratica)、波叶烟草(nicotiana undulata)、颤毛烟草(nicotiana velutina)、芹叶烟草(nicotiana wigandioides)、以及烟草属植物的杂交种等。其中,更优选为本塞姆氏烟草、黄花烟草及红花烟草,特别优选为作为烟叶生产的原料而使用的黄花烟草及红花烟草。
[0086]
〔2.烟草植物体的制备方法〕
[0087]
本发明的一个实施方式提供一种烟草植物体的制备方法,该方法包括:在烟草植物体的基因组中导入引起以下至少一个内源基因的功能抑制的突变,所述内源基因为:包含编码相对于序列号1所示的氨基酸序列具有80%以上的序列同一性的多肽的多核苷酸作为编码区域的内源基因、包含编码相对于序列号2所示的氨基酸序列具有80%以上的序列同一性的多肽的多核苷酸作为编码区域的内源基因、以及包含编码相对于序列号3所示的氨基酸序列具有80%以上的序列同一性的多肽的多核苷酸作为编码区域的内源基因。
[0088]
作为上述导入的步骤的结果,通过上述内源基因的功能抑制而使上述烟草植物体中的类胡萝卜素和/或脱辅基类胡萝卜素的含量发生改变。对于使类胡萝卜素和/或脱辅基类胡萝卜素的含量发生改变的概要,如上所述。因此,作为用于实施上述步骤的具体例,以下举出使用了基因组编辑技术向上述内源基因导入突变进行说明。作为可利用的基因组编辑技术,可以举出crispr/cas9 system、talen及zfn。在crispr/cas9 system的情况下,如果靶细胞内存在向导rna及cas9蛋白质,就可以进行基因组编辑,在talen及zfn的情况下,如果靶细胞内存在融合蛋白(dna结合域及核酸酶融合),就可以进行基因组编辑。因此,上述向导rna及cas9蛋白质、以及上述融合蛋白均可以直接导入靶细胞。作为将它们直接导入靶细胞的方法,可以列举:peg法、电穿孔法、以及粒子轰击法等。另外,可以借助土壤杆菌等将插入了构建体(包括向导rna及编码cas9蛋白的多核苷酸、以及任意的启动子和/或终止子)的载体导入靶细胞及组织。
[0089]
在crispr/cas9 system中,位于基因组上紧邻xgg的上游的核苷酸序列的互补序列与向导rna的一部分形成碱基对,在该核苷酸序列内双链的基因组dna被cas9切断。该核苷酸序列例如为:编码具有序列号1、2或3所示的氨基酸序列的多肽的多核苷酸(可以具有0.1~1%的置换)、或者具有序列号4、5或6的多核苷酸(可以具有0.1~1%的置换)的一部分中,位于紧邻xgg的上游的连续的10个碱基以上(例如,15个碱基以上、优选为17个碱基以上、更优选为18个碱基以上、更进一步优选为19个碱基以上、最优选为20个碱基以上)。
[0090]
在talen中,形成二聚体的人工核酸酶的一对dna结合域分别与夹隔5~20个碱基间隔存在于foki切断结构域的两端的核苷酸序列结合。该核苷酸序列存在于双链基因组dna的一条链及另一条链,因此,上述一对dna结合域的一者与该一条链结合,另一者与另一条链结合。上述dna结合域以33~34个氨基酸残基作为重复单元(模块),由与结合的碱基数相对应的数量的模块构成。通过dna结合域结合的核苷酸序列为:编码具有序列号1、2或3所
示的氨基酸序列的多肽的多核苷酸(可以具有0.1~1%的置换)、或者具有序列号4、5或6的多核苷酸(可以具有0.1~1%的置换)及与该多核苷酸形成互补链的多核苷酸的一部分中,在foki切断结构域的两端分别夹隔5~20个碱基间隔存在的连续的10个碱基以上、优选为14个碱基以上、更优选为18个碱基以上。
[0091]
在zfn中,与talen同样,形成二聚体的人工核酸酶的一对dna结合域分别与夹隔5~20个碱基间隔存在于foki切断结构域的两端的核苷酸序列结合。该dna结合域由多个锌指模块构成。该核苷酸序列为:编码具有序列号1、2或3所示的氨基酸序列的多肽的多核苷酸(可以具有0.1~1%的置换)、或者具有序列号4、5或6的多核苷酸(可以具有0.1~1%的置换)及与该多核苷酸形成互补链的多核苷酸的一部分中,在foki切断结构域的两端分别夹隔5~20个碱基间隔存在的连续的9个碱基以上、优选为12个碱基以上、更优选为18个碱基以上。
[0092]
对于crispr/cas9 system、talen及zfn、以及后述的rnai的各自的说明可以按照全部项目的记载将具有序列号1、2或3所示的氨基酸序列的多肽替换为与该多肽具有80%以上序列同一性的烟草属所包含的其它种类中存在的同源分子种的多肽。另外,同样地,前面段落的记载可以将具有序列号4、5或6的多核苷酸替换为与该多核苷酸具有80%以上序列同一性的烟草属所包含的其它种类中存在的同源基因的多核苷酸。
[0093]
如上所述,引起上述内源基因的功能抑制的被导入上述烟草植物体的突变优选遗传稳定地得到继承。但是,为了基因组编辑而导入烟草植物体的外源性的多核苷酸优选在确认到期望的突变被导入烟草植物体后从该烟草植物体排除。这是由于,如果上述外源性的多核苷酸保持于烟草植物体,则会因(持续)导入不期望的突变而失去期望的性状(类胡萝卜素和/或脱辅基类胡萝卜素的含量的改变)。
[0094]
对烟草植物体的上述内源基因导入突变、或该内源基因的破坏可以通过其它的生物工程方法(例如,利用了转座子或土壤杆菌的方法)而实施。该方法的具体例为将烟草的反转录转座子tnt1或其它植物中的转座子、或土壤杆菌的ti质粒中的t-dna导入烟草植物体的方法。
[0095]
或者,上述导入或破坏可以通过其它方法(烟草植物体的突变原处理)而实施。作为突变源的例子,可以列举:小分子的化合物(例如,甲基磺酸乙酯(ems)、n-亚硝基-n-乙基脲(enu)、叠氮化钠等)、以及放射线(例如,γ射线、重离子束、x射线、中子射线、紫外线等)。
[0096]
突变可以导入可再生的任意的烟草植物体。该烟草植物体的例子为种子、根、叶、花、生殖器官或胚,优选为种子。
[0097]
通过以上方法得到的是具有各种突变(或不具有突变的)的植物体的突变体集团。因此,可以从该突变体集团进一步筛选显示出期望的表型的个体。作为筛选个体的例子,对于从使用突变原进行了处理的情况下得到的突变体集团(panel)筛选期望的个体的步骤进行说明。
[0098]
t基因组、s基因组两者合计4个等位基因中具有突变的功能缺损的烟草突变体例如可以通过以下的方法获得。如上所述,用突变原对烟草进行处理,制作使烟草基因组整体发生了突变的烟草的突变体集团(panel),提取基因组dna。利用s基因组、t基因组各自的基因特异性引物从panel的基因组dna中扩增靶基因(多核苷酸),确定其产物的核苷酸序列,筛选具有纯合型的突变的品系。首先,获得在s基因组、t基因组分别具有纯合型突变的品系
(m2),制备将它们交配而得到的f1。进一步,培育其自体繁殖后代(f2),从其中获得s、t两基因组均具有纯合型的突变的品系(由于双因子隐性(二因子劣性),因此以1/16的概率得到)。
[0099]
另外,在t基因组上的2个基因座、s基因组上的1个基因座中总计6个等位基因具有突变的功能缺损的烟草突变体例如可以通过以下的方法获得。使如上所述得到的s、t两基因组均具有纯合型突变的品系与在t基因组上的另一个等位基因具有纯合型突变的品系交配而制备f1。进一步,培育其自体繁殖后代(f2),从其中获得s、t、另一个t均具有纯合型突变的品系(由于三因子隐性(三因子劣性),因此以1/64的概率得到)。
[0100]
作为实施上述导入的步骤的其它例子,可以举出借助使用了载体的烟草植物体的转化抑制基因的表达及对基因导入突变。
[0101]
作为以抑制基因的表达或对基因导入突变为目的的烟草植物的转化所使用的载体,只要是能够使插入至载体内的多核苷酸在植物细胞内表达的载体即可,没有特别限定。作为该载体,例如,可以优选使用能够借助土壤杆菌将目标的多核苷酸导入植物细胞的pbi系、ppzp系及psma系的载体等。特别优选为双元载体系(pbig、pbin19、pbi101、pbi121、pbi221及ppzp202等)的质粒。
[0102]
在通过rnai实现基因的表达抑制的情况下,用于通过rnai抑制靶基因的表达所使用的触发器(trigger)序列可插入上述载体。该触发器序列例如为:作为编码具有序列号1、2或3所示的氨基酸序列的多肽的多核苷酸(可以具有0.1~1%的置换)的一部分、或具有序列号4、5或6的多核苷酸(可以具有0.1~1%的置换)的一部分的、连续至少21~30个碱基(例如,21个碱基以上、22个碱基以上、23个碱基以上、24个碱基以上、25个碱基以上、26个碱基以上、27个碱基以上、28个碱基以上、29个碱基以上、以及30个碱基以上)的核苷酸序列所示的多核苷酸(正义rna部分)、以及与该多核苷酸互补的碱基序列所示的多核苷酸(反义rna部分)。更具体而言,上述的“连续的至少21~30个碱基”的核苷酸序列是指连续的21个碱基以上、23个碱基以上、25个碱基以上、30个碱基以上、35个碱基以上、40个碱基以上、45个碱基以上、50个碱基以上、60个碱基以上、70个碱基以上、80个碱基以上、90个碱基以上、或100个碱基以上的核苷酸序列。
[0103]
如上所述,上述烟草植物体中的内源基因的表达抑制优选遗传稳定地得到继承。因此,上述触发器序列优选被导入上述烟草植物体的基因组。
[0104]
通过将不同的内源基因的表达受到了抑制的2个烟草植物体进行交配,可以得到同时使多个内源基因的表达受到了抑制的烟草植物体。另外,在实施了能够同时将多个不同的内源基因进行表达抑制的转化之后,对多个不同的内源基因的表达同时受到了抑制的烟草植物体进行筛选,由此可以得到多个内源基因的表达同时受到了抑制的烟草植物体。
[0105]
需要说明的是,在利用交配得到多个内源基因的功能受到了抑制的烟草植物体的情况下,进行交配的一种烟草植物体可以通过内源基因的突变或破坏而制备,另一种烟草植物体可以通过基于转化的内源基因的表达抑制而制备。
[0106]
上述内源基因的突变或破坏可以通过检测该内源基因中有无突变来确定。作为检测内源基因中的突变的方法只要是能够判断有无突变的方法即可,可以是以下方法:(1)通过pcr等将市售的该包含突变的dna序列进行扩增后,利用测序仪等直接解读dna核苷酸序列的方法;(2)使用sscp(single strand conformation polymorphism)法根据电泳距离的
不同检测序列中的不同的方法;(3)使用cycleavepcr法检测snp(single nucleotide polymorphism)的方法;(4)通过使用t7 endonucleasei等切断错配部位而检测有无突变的方法;(5)根据基于限制酶处理的切断的有无可以判断有无突变的caps(cleaved amplified polymorphic sequence)法;(6)通过使用有意包含错配的引物组,从而根据有无利用限制酶进行的切断来判断有无突变的dcaps(derived caps)法;(7)根据使用对突变序列特异性杂交的探针检测探针是否杂交,从而判断有无突变的方法(使用了taqman探针的pcr法、massarray分析法);(8)在缺失、插入的情况下,根据电泳的移动程度的差别来检测突变的方法等。或者,基因的突变可以通过将作为基因的改变结果而产生的多肽的大小、表达量与野生型蛋白质的大小、表达量进行比较而确定。具体而言,例如可以通过进行蛋白质印迹法(western blotting)来进行这样的比较。
[0107]
〔3.其它〕
[0108]
本发明的其它方面提供一种用于调节烟草植物体中的脱辅基类胡萝卜素的含量的方法。该方法包括以下的步骤(a)~(c)。
[0109]
(a)对上述烟草植物中的类胡萝卜素氧化裂解酶的表达或活性进行调节的步骤,其包含以下的(i)~(iii):
[0110]
(i)包含以下序列的多核苷酸、由以下序列构成(consisting of)的多核苷酸、或本质上由以下序列构成(essentially consisting of)的多核苷酸,所述序列与编码类胡萝卜素氧化裂解酶的由序列号4、5或6表示的多核苷酸具有至少80%的序列同一性;
[0111]
(ii)由(i)所示的多核苷酸编码的多肽;或者
[0112]
(iii)包含与序列号1、2或3具有至少80%的序列同一性或与序列号7具有至少80%的序列同一性的多肽的类胡萝卜素氧化裂解酶。
[0113]
(b)对步骤(a)中得到的突变、非天然型或转基因植物的至少一部分、或者其燃烧时或加热时产生的气溶胶中的脱辅基类胡萝卜素含量进行测定的步骤。
[0114]
(c)与类胡萝卜素氧化裂解酶的表达或活性未调节的对照植物进行比较,对改变了脱辅基类胡萝卜素含量的突变、非天然型或转基因植物进行鉴定的步骤。
[0115]
在上述方法中,上述脱辅基类胡萝卜素可以为β-紫罗兰酮及二氢猕猴桃内酯,含量的调节可以为含量的增加。在上述方法中,上述脱辅基类胡萝卜素可以为β-大马酮、巨豆三烯酮(的结构异构体)及3-羟基-β-二氢大马酮,含量的调节可以为含量的减少。
[0116]
本发明的一个实施方式提供由上述烟草属植物体的烟叶、上述烟叶得到的干燥叶(干燥烟草)。干燥叶是通过将烟叶干燥而得到的。作为干燥方法,可以使用任意的方法,作为例子,可以列举自然干燥、暖风干燥、热风干燥等,但并不限定于此。需要说明的是,在本说明书中,干燥叶包括由干燥叶得到的去筋烟丝、粉末、片、叶脉、颗粒及提取物。
[0117]
本发明的一个实施方式提供使用了上述干燥叶的烟草制品。烟草制品可以为任意的形态,作为例子,可以列举:烟丝、雪茄、管烟、卷烟、电子烟、水烟、鼻烟(唇烟(snus)、鼻烟(snuff))、以将烟草加热而产生的气溶胶作为气溶胶源而使用的非燃烧加热型烟草制品、不将烟草加热而抽吸其香味的非加热型烟草制品等,但并不限定于此。
[0118]
(总结)
[0119]
将以上的各实施方式进行总结,本发明可以概括如下。
[0120]
(1)一种烟草植物体,其在基因组中导入了引起以下内源基因中的至少任一者的
功能抑制的突变,所述内源基因为:
[0121]
包含以编码相对于序列号1所示的氨基酸序列具有80%以上的序列同一性的多肽的多核苷酸作为编码区域的内源基因、
[0122]
包含以编码相对于序列号2所示的氨基酸序列具有80%以上的序列同一性的多肽的多核苷酸作为编码区域的内源基因、以及
[0123]
包含以编码相对于序列号3所示的氨基酸序列具有80%以上的序列同一性的多肽的多核苷酸作为编码区域的内源基因。
[0124]
(2)根据(1)所述的烟草植物体,其中,上述功能抑制为:与野生型植物相比,上述多肽的存在量减少。
[0125]
(3)根据(2)所述的烟草植物体,其中,上述功能抑制为:与野生型植物相比,上述多肽的翻译量减少。
[0126]
(4)根据(2)所述的烟草植物体,其中,上述功能抑制为:与野生型植物相比,来自上述内源基因的mrna的转录量减少。
[0127]
(5)根据(2)所述的烟草植物体,其中,上述功能抑制为:由上述内源基因转录得到的mrna的分解受到促进。
[0128]
(6)根据(1)~(5)中任一项所述的烟草植物体,其中,在上述内源基因导入了上述突变。
[0129]
(7)根据(6)所述的烟草植物体,其中,通过自然突变、突变原处理、基因组编辑或基因敲除导入了上述突变。
[0130]
(8)根据(5)所述的烟草植物体,其中,上述突变为表达促进上述mrna的分解的因子的多核苷酸向存在上述内源基因的区域外的插入。
[0131]
(9)根据(8)所述的烟草植物体,其中,上述因子为反义rna分子、rnai分子或共抑制分子。
[0132]
(10)根据(1)~(9)中任一项所述的烟草植物体,其属于红花烟草或黄花烟草。
[0133]
(11)一种烟草植物体的制备方法,该方法包括:
[0134]
在烟草植物体的基因组中导入引起以下内源基因中的至少任一者的功能抑制的突变的步骤,所述内源基因为:
[0135]
包含以编码相对于序列号1所示的氨基酸序列具有80%以上的序列同一性的多肽的多核苷酸作为编码区域的内源基因、
[0136]
包含以编码相对于序列号2所示的氨基酸序列具有80%以上的序列同一性的多肽的多核苷酸作为编码区域的内源基因、以及
[0137]
包含以编码相对于序列号3所示的氨基酸序列具有80%以上的序列同一性的多肽的多核苷酸作为编码区域的内源基因。
[0138]
(12)根据(11)所述的制备方法,其中,上述功能抑制为:与野生型植物相比,上述多肽的存在量减少。
[0139]
(13)根据(12)所述的制备方法,其中,上述功能抑制为:与野生型植物相比,上述多肽的翻译量减少。
[0140]
(14)根据(12)所述的制备方法,其中,上述功能抑制为:与野生型植物相比,来自上述内源基因的mrna的转录量减少。
[0141]
(15)根据(12)所述的制备方法,其中,上述功能抑制为:由上述内源基因转录得到的mrna的分解受到促进。
[0142]
(16)根据(12)~(15)中任一项所述的制造方法,其中,上述进行导入的步骤包括在上述内源基因中导入上述突变。
[0143]
(17)根据(16)所述的制备方法,其中,上述进行导入的步骤通过自然突变、突变原处理、基因的重组、基因组编辑或基因敲除而实施。
[0144]
(18)根据(12)~(15)中任一项所述的制造方法,其中,上述进行导入的步骤包括在存在该内源基因的区域外插入表达促进由上述内源基因转录得到的mrna的分解的因子的多核苷酸。
[0145]
(19)根据(18)所述的制备方法,其中,上述因子为反义rna分子、rnai分子或共抑制分子。
[0146]
(20)(1)~(10)中任一项所述的烟草植物体或通过(11)~(19)中任一项所述的制造方法得到的烟草植物体的后代、或者由该烟草植物体的交配而得到的育种后代。
[0147]
(21)一种烟叶,其是从(1)~(10)中任一项所述的烟草植物体、通过(11)~(19)中任一项所述的制造方法得到的烟草植物体、或者(20)所述的后代或育种后代收获而得到的。
[0148]
(22)一种干燥叶,其是由(21)所述的烟叶制成的。
[0149]
(23)一种烟草制品,其包含(22)所述的干燥叶。
[0150]
以上的各实施方式或者也可以概括如下。
[0151]
(1)一种烟草属植物体,其在基因组中导入了引起以下内源基因中的至少任一者的功能抑制的突变,所述内源基因为:
[0152]
包含以编码相对于序列号1所示的氨基酸序列具有80%以上的序列同一性的多肽的多核苷酸作为编码区域的内源基因、
[0153]
包含以编码相对于序列号2所示的氨基酸序列具有80%以上的序列同一性的多肽的多核苷酸作为编码区域的内源基因、以及
[0154]
包含以编码相对于序列号3所示的氨基酸序列具有80%以上的序列同一性的多肽的多核苷酸作为编码区域的内源基因。
[0155]
(2)根据(1)所述的烟草属植物体,其中,
[0156]
上述功能抑制为:与野生型植物相比,由上述内源基因转录得到的mrna的存在量减少。
[0157]
(3)根据(1)或(2)所述的烟草属植物体,其中,
[0158]
上述功能抑制为:由上述内源基因转录得到的mrna的分解受到促进。
[0159]
(4)根据(1)~(3)中任一项所述的烟草属植物体,其中,
[0160]
在上述内源基因中导入了上述突变。
[0161]
(5)根据(4)所述的烟草属植物体,其中,
[0162]
通过突变原处理、基因组编辑或基因敲除导入了上述突变。
[0163]
(6)根据(5)所述的烟草属植物体,其中,
[0164]
通过上述突变原处理导入了上述突变。
[0165]
(7)根据(3)所述的烟草属植物体,其中,
[0166]
上述突变为表达促进上述mrna的分解的因子的多核苷酸向存在上述内源基因的区域外的插入。
[0167]
(8)根据(7)所述的烟草属植物体,其中,
[0168]
上述因子为反义rna分子、rnai分子或共抑制分子。
[0169]
(9)根据(1)~(8)中任一项所述的烟草属植物体,其中,
[0170]
上述功能抑制为:与野生型植物相比,原来的功能性的上述多肽的存在量减少。
[0171]
(10)根据(9)所述的烟草属植物体,其中,
[0172]
上述功能抑制为:与野生型植物相比,原本的功能性的上述多肽的翻译量减少。
[0173]
(11)根据(1)~(10)中任一项所述的烟草属植物体,其属于红花烟草、黄花烟草或林烟草。
[0174]
(12)一种烟草植物体的制备方法,该方法包括:
[0175]
在烟草植物体的基因组中导入引起以下内源基因中的至少任一者的功能抑制的突变的步骤,所述内源基因为:
[0176]
包含以编码相对于序列号1所示的氨基酸序列具有80%以上的序列同一性的多肽的多核苷酸作为编码区域的内源基因、
[0177]
包含以编码相对于序列号2所示的氨基酸序列具有80%以上的序列同一性的多肽的多核苷酸作为编码区域的内源基因、以及
[0178]
包含以编码相对于序列号3所示的氨基酸序列具有80%以上的序列同一性的多肽的多核苷酸作为编码区域的内源基因。
[0179]
(13)根据(12)所述的制备方法,其中,
[0180]
上述功能抑制为:与野生型植物相比,由上述内源基因转录得到的mrna的存在量减少。
[0181]
(14)根据(12)或(13)所述的制备方法,其中,
[0182]
上述功能抑制为:由上述内源基因转录得到的mrna的分解受到促进。
[0183]
(15)根据(12)~(14)中任一项所述的制造方法,其中,
[0184]
上述进行导入的步骤包括在上述内源基因中导入上述突变。
[0185]
(16)根据(15)所述的制备方法,其中,
[0186]
上述进行导入的步骤通过突变原处理、基因组编辑或基因敲除而实施。
[0187]
(17)根据(16)所述的制备方法,其中,
[0188]
通过上述突变原处理导入了上述突变。
[0189]
(18)根据(12)~(15)中任一项所述的制造方法,其中,
[0190]
上述进行导入的步骤包括在存在该内源基因的区域外插入表达促进由上述内源基因转录得到的mrna的分解的因子的多核苷酸。
[0191]
(19)根据(18)所述的制备方法,其中,
[0192]
上述因子为反义rna分子、rnai分子或共抑制分子。
[0193]
(20)根据(12)~(19)中任一项所述的制造方法,其中,
[0194]
上述功能抑制为:与野生型植物相比,原本的功能性的上述多肽的存在量减少。
[0195]
(21)根据(20)所述的制备方法,其中,
[0196]
上述功能抑制为:与野生型植物相比,原本的功能性的上述多肽的翻译量减少。
[0197]
(22)(1)~(11)中任一项所述的烟草属植物体或通过(12)~(21)中任一项所述的制造方法得到的烟草属植物体的后代、或者由该烟草属植物体的交配而得到的育种后代。
[0198]
(23)一种烟草属植物体的烟叶,其在基因组中导入了引起以下内源基因中的至少任一者的功能抑制的突变,所述内源基因为:
[0199]
包含以编码相对于序列号1所示的氨基酸序列具有80%以上的序列同一性的多肽的多核苷酸作为编码区域的内源基因、
[0200]
包含以编码相对于序列号2所示的氨基酸序列具有80%以上的序列同一性的多肽的多核苷酸作为编码区域的内源基因、以及
[0201]
包含以编码相对于序列号3所示的氨基酸序列具有80%以上的序列同一性的多肽的多核苷酸作为编码区域的内源基因,
[0202]
与野生型的烟草属植物体的烟叶相比,所述烟草属植物体的烟叶具有更高的总类胡萝卜素含量。
[0203]
(24)一种烟草属植物体的干燥叶,其在基因组中导入了引起以下内源基因中的至少任一者的功能抑制的突变,所述内源基因为:
[0204]
包含以编码相对于序列号1所示的氨基酸序列具有80%以上的序列同一性的多肽的多核苷酸作为编码区域的内源基因、
[0205]
包含以编码相对于序列号2所示的氨基酸序列具有80%以上的序列同一性的多肽的多核苷酸作为编码区域的内源基因、以及
[0206]
包含以编码相对于序列号3所示的氨基酸序列具有80%以上的序列同一性的多肽的多核苷酸作为编码区域的内源基因,
[0207]
与野生型的烟草属植物体的干燥叶相比,所述烟草属植物体的干燥叶具有更高的总类胡萝卜素含量。
[0208]
(25)一种烟草制品,其包含(24)所述的干燥叶。
[0209]
以下,示出实施例对本发明的实施方式进行详细说明。当然,本发明并不限定于以下的实施例,对于细节部分可以有各种方式。另外,本发明并不限定于上述的实施方式,可以在权利要求所示的范围进行各种变更,将各公开的技术方式适当组合而得到的实施方式也包含于本发明的技术范围。另外,参考并援引本说明书中记载的全部文献。
[0210]
实施例
[0211]
〔1.通过ccd4基因的表达抑制而在烟草植物中表现出的变化〕
[0212]
制备ccd4基因的表达受到了抑制的重组体(以下简称为重组体),鉴定了通过ccd4基因的表达抑制而在烟草植物中表现出的变化。
[0213]
(1a)转化的准备
[0214]
为了制备重组体,首先,如下所述准备了转化用的载体。
[0215]
作为用于抑制红花烟草中存在的全部3个ccd4基因(ccd4-s基因、ccd4-t1基因及ccd4-t2基因)的表达的rnai触发器序列,选择了序列号4~6中同一性高的区域(323bp)。以ccd4-t2基因的cdna作为模板,通过使用了primestar(注册商标)max dna polymerase(takara bio公司)的pcr对该区域进行了扩增。pcr的条件及引物如下所述。需要说明的是,在序列号9的5’末端添加了与序列号4~6不一致的cacc。
[0216]
(pcr条件)
[0217]
94℃下30秒钟
[0218]
以98℃下10秒钟、55℃下5秒钟及72℃下10秒钟作为1个循环,30~40个循环
[0219]
72℃下10秒钟
[0220]
(引物组)
[0221]
正向引物ntccd4-f1:5
’‑
caccgcgtacatccgaaatggccc-3’(序列号9)
[0222]
反向引物ntccd4-r1:5
’‑
agtttgcctccgaataaagc-3’(序列号10)。
[0223]
将得到的pcr产物克隆至pentr(商标)/d-topo(商标)载体(thermo fisher scientific公司),确认了rnai触发器序列的核苷酸序列(序列号11)之后,使用gateway(商标)lr clonase(商标)ii enzyme mix(thermo fisher scientific公司)将rnai触发器序列导入psp231载体。为了确认被导入的序列,对于导入至psp231载体的rnai触发器序列,分别通过pcr对各正义链及反义链进行扩增,确认了各核苷酸序列。psp231载体为一种双元载体,其中,(i)在phellsgate12(参照文献:wesley et al.,2001,plant j.,27,581-590)的saci部位插入有gfp(green fluorescent protein基因)表达盒,(ii)触发器序列的倒位反复序列被pdk/cat内含子包夹而配置,(iii)其能够通过花椰菜花叶病毒35srna基因启动子表达rnai触发器序列。使用包含rnai触发器序列的psp231载体通过电穿孔对土壤杆菌(agrobacterium tumefaciens)lba4404进行了转化。在得到的转化土壤杆菌中,通过pcr确认了rnai触发器序列的存在之后,将该土壤杆菌用于烟草的转化。
[0224]
(1b)重组体的制备
[0225]
使用红花烟草的4个品种(petit havana sr-1、tsukuba 1号、k326及coker319),如下所述,通过一般的方法进行了烟草的转化。使转化后的上述土壤杆菌感染烟草叶的切片,在包含卡那霉素(50μg/ml)的linsmaier and skoog培养基中进行培养,从由此得到的愈伤组织中得到了卡那霉素耐受性的再分化个体。从这些再分化个体中筛选出确认到叶整体的gfp荧光的个体。将筛选到的个体(t0个体)移植于3号盆,在23~25℃的封闭体系温室中在一定条件下进行栽培。基于实时rt-pcr表达分析的结果,将ccd4基因的表达与非转化体(原始品种petit havana sr-1、tsukuba 1号、k326或coker319)相比降低至约20%的品系筛选为重组体。由上述4个品种分别制备的该重组体显示出与原始品种不同的表型(下位叶明显黄化)。
[0226]
(1c)类胡萝卜素的定量分析
[0227]
在由petit havana sr-1制备的上述重组体(t0代)中,将分别从3个品系(rnai-1-3、1-8、1-15)及2个个体的原始品种收获的各5~6片下位叶进行冷冻干燥、粉碎,将得到的试样供于叶黄素(类胡萝卜素)分析。在30ml螺口玻璃离心管中,向上述试样1.0g中加入提取液(丙酮∶乙醇=1∶1)10ml,用螺纹盖盖上盖子后,进行了30分钟的超声波提取。在超声波提取后,将离心管静置20分钟,供于离心分离机(3000rpm、10min)。用ptfe过滤器(孔径0.45μm)过滤上清,供于液相色谱分析。分析所使用的装置、器具及条件如下所述。
[0228]
·
高效液相色谱:lc-2000plus(日本分光株式会社、东京)
[0229]
·
pda检测器:md-2010plus(日本分光株式会社、东京)
[0230]
·
色谱柱:develosil(注册商标)(ods-hg-5、内径4.6mm、长度250mm、野村化学株式会社、爱知)
[0231]
·
柱箱温度:40℃
[0232]
·
洗脱液流速:1.0ml/min
[0233]
·
洗脱液a:甲醇
[0234]
·
洗脱液b:四氢呋喃(不含稳定剂)
[0235]
·
洗脱条件:单一组成溶剂溶出(洗脱液a∶洗脱液b=9∶1)
[0236]
·
注入量:10μl
[0237]
·
pda检测波长:455nm。
[0238]
通过使用了在455nm光波长下检测到的吸收光谱的峰面积值的校准曲线法,计算出单位干燥重量所包含的叶黄素的量。使用了基于通过液相色谱对1、5、10及20μg/ml的叶黄素标准品溶液进行分析而得到的结果所制成的校准曲线(以0.9999的相关系数在1~20μg/ml的范围显示出线性)。将结果示于表2。如表2所示,上述3个品系(rnai-1-3、1-8、1-15)包含相当于2个个体的原始品种(对照1及2)的约3倍的量的叶黄素(主要为类胡萝卜素)。
[0239]
[表2]
[0240] 叶黄素(μg/g干重)对照1128.0对照2142.7rnai-1-3418.2rnai-1-8429.1rnai-1-15442.3
[0241]
如上所述,烟草植物中的ccd4基因的表达抑制显示出叶中的类胡萝卜素的蓄积。需要说明的是,报告了在作为其它茄科植物的马铃薯中,尽管在叶中ccd4基因高表达,但ccd4基因表达的向下控制并不影响叶中的类胡萝卜素的蓄积(campbell et al.,plant physiology,2010,vol.154,pp.656-664)。
[0242]
〔2.ccd4基因中具有突变的烟草植物体的制备〕
[0243]
为了得到发生上述变化的其它烟草植物体,制备了ccd4基因中具有突变的烟草植物体。
[0244]
按照基于扩增子(amplicon)测序的序列确定,从烟草栽培品种(tsukuba 1号)的ems突变体集团(m2代、约2000个品系)中筛选出在ccd4-s基因或ccd4-t1基因中具有突变的品系。作为ccd4-s基因中具有突变的品系,得到了ccd4-s基因中以纯合型产生了1个无义突变(编码ccd4-s蛋白质的第72位的谷氨酰胺(q)的密码子通过核苷酸置换而改变为终止密码子)的ccd4-s-1(0844品系)。作为ccd4-t1基因中具有突变的品系,得到了在ccd4-t1基因中以纯合型产生了1个无义突变的2个品系(ccd4-t1-1:0283品系及ccd4-t1-2:0135品系)。在ccd4-t1-1中,编码ccd4t1蛋白质的第46位的谷氨酰胺(q)的密码子通过核苷酸置换改变为终止密码子。在ccd4-tl-2中,编码ccd4t1蛋白质的第187位的精氨酸(r)的密码子通过核苷酸置换改变为终止密码子。
[0245]
使用上述的3个品系,如下所述制备了在2个ccd4基因中具有突变的烟草植物(双突变体)。使ccd4-s-1和ccd4-t1-1通过借助人工授粉的交配而得到的f1植物进行自体繁殖,得到了f2代集团。按照基于扩增子测序的序列确定,从f2代集团中筛选出在2个ccd4基因中分别以纯合方式具有突变的品系(ccd4-st1-1)、以及2个ccd4基因以纯合方式为野生型的品系(wt1)。使ccd4-s-1和ccd4-t1-2通过借助人工授粉的交配而得到的f1植物进行自
体繁殖,得到了f2代集团。按照基于扩增子测序的序列确定,从f2代集团中筛选出在2个ccd4基因中分别以纯合方式具有突变的分离品系(ccd4-st1-2)、以及2个ccd4基因以纯合方式为野生型的品系(wt2)。需要说明的是,以下,将作为对双突变体的对照物的2个ccd4基因以纯合方式为野生型的品系(wt1及wt2)称为“纯合野生型”。
[0246]
按照基于扩增子测序的序列确定,从烟草野生种(林烟草)的ems突变体集团(m2代、约4000个品系)筛选出ccd4基因中具有突变的品系。需要说明的是,林烟草在基因组上仅具有1个ccd4基因。作为ccd4基因中具有突变的品系,得到了ccd4基因中以纯合型产生了1个无义突变的2个品系(08n-465品系及06n-7039品系)。在08n-465品系中,编码ccd4蛋白质的第72位的谷氨酰胺(q)的密码子通过核苷酸置换改变为终止密码子。在06n-7039品系中,编码ccd4蛋白质的第150位的精氨酸(r)的密码子通过核苷酸置换改变为终止密码子。
[0247]
将上述扩增子测序所使用的引物示于以下。
[0248]
烟草ccd4-s正向引物:tcatcttctccttctcttaaa(序列号12)
[0249]
烟草ccd4-s反向引物:cggagaatacatttggcaa(序列号13)
[0250]
烟草ccd4-t1正向引物:tcatcttctcttgctcttaag(序列号14)
[0251]
烟草ccd4-t1反向引物:cagagaatacatttgggat(序列号15)
[0252]
林烟草ccd4正向引物:cctttctacattatcacaacacccta(序列号16)
[0253]
林烟草ccd4反向引物:tcaccatctggggctaattt(序列号17)。
[0254]
需要说明的是,温室内培育的ccd4-st1-1及ccd4-st1-2显示出在ccd4-s-1、ccd4-t1-1、ccd4-t1-2、wt1及wt2中未观察到的表型(下位叶的黄化)。该表型与实施例1的重组体所显示出的表型非常类似。另外,08n-465品系及06n-7039品系显示出在野生型的林烟草中未观察到的上述表型(下位叶的黄化)。
[0255]
〔3.类胡萝卜素及脱辅基类胡萝卜素的定量分析〕
[0256]
(3a)温室栽培的双突变体中的主要的类胡萝卜素的量
[0257]
将实施例2中得到的2个品系的双突变体(ccd4-st1-1及ccd4-st1-2)及2个品系的纯合野生型(wt1及wt2)的各2个个体在23~25℃的温室内进行栽培。在掐尖起7~17天后,将从1株收获各4-5片的下位叶(每1个品系8~10片)用液氮冷冻,在-80℃下保管。进一步将下位叶冷冻干燥及粉碎之后,将相同品系的2个个体量的混合物作为1个试样使用。委托一般财团法人日本食品分析中心进行了各试样中包含的主要的类胡萝卜素的量的分析。将从一般财团法人日本食品分析中心收到的结果总结于图1。图1的“总类胡萝卜素”基于利用吸光光度法(叶黄素的吸光系数:e
1%
1cm=2550、吸光波长:455nm、溶剂:乙醇)得到的上述试样中的总类胡萝卜素量的实测值。图1的玉米黄质”、“叶黄素”、“α-胡萝卜素”、“β-胡萝卜素”及“番茄红素”为基于玉米黄质、叶黄素、α-胡萝卜素、β-胡萝卜素及番茄红素在上述试样中的各自含量利用高效液相色谱法得到的实测值。
[0258]
如图1所示,与纯合野生型相比,ccd4-st1-1及ccd4-st1-2包含1.4~2.1倍的叶黄素、1.4~2.7倍的β-胡萝卜素、以及2.5~4.0倍的玉米黄质(均为主要的类胡萝卜素)。另外,与纯合野生型相比,ccd4-st1-1及ccd4-st1-2显示出1.7~2.5倍的总类胡萝卜素量。未检测到α-胡萝卜素及番茄红素。
[0259]
(3b)田地栽培的林烟草的ccd4突变体中的主要的类胡萝卜素的量
[0260]
使实施例2中得到的08n-465品系及其野生型品系(wt)的移植用苗在温室内生长。
在移植至田地之后,在烟叶的一般栽培条件下实施了生长及收获为止的管理。在掐尖起约一个月后,将从各品系的各约15株收获各2~3片的下位叶进行冷冻干燥、粉碎,制成试样。委托一般财团法人日本食品分析中心进行了各试样中包含的主要的类胡萝卜素的量的分析。将从一般财团法人日本食品分析中心收到的结果总结于图2。
[0261]
如图2所示,与wt相比,08n-465包含1.4倍的叶黄素、1.3倍的β-胡萝卜素、以及3.3倍的玉米黄质。另外,与wt相比,08n-465显示出1.7~1.8倍的总类胡萝卜素量。未检测到α-胡萝卜素及番茄红素。
[0262]
(3c)田地栽培的双突变体的干叶中的类胡萝卜素量
[0263]
使实施例2中得到的2个品系的双突变体(ccd4-st1-1及ccd4-st1-2)、2个品系的纯合野生型(wt1及wt2)、以及原始品种(tsukuba 1号)的移植用苗在温室内生长。在移植至田地之后,在烟叶的一般栽培条件下实施。在掐尖起第25天,对于从1株收获各5片的合叶实施了使用热风干燥机的通常的黄色干燥处理。去除得到的干叶的叶脉部分,将叶片部分进行粉碎处理,制成粉碎试样。在14ml螺口玻璃离心管中加入粉碎试样0.1g、提取液(加入了作为抗氧化物质的2,6-二叔丁基羟基苯(0.1%)的丙酮∶乙醇=1∶1)5.0ml、作为内标物质的反式视黄醇5μg,用螺纹盖盖上盖子后,使用中型恒温振荡培养器bioshaker(注册商标)br-43fh
·
mr(taitec corp.)进行了振荡提取(250rpm、25℃、1小时)。用ptfe过滤器(孔径0.45μm)过滤提取溶液,供于带有光电二极管阵列检测器(pda)的液相色谱串联质谱仪(lc-ms/ms)分析。分析所使用的装置、器具及条件如下所述。
[0264]
(色谱)
[0265]
·
高效液相色谱:1260infinity(agilent technologies公司、东京)
[0266]
·
pda检测器:1260infinity diode array detector(agilent technologies公司、东京)
[0267]
·
色谱柱:acquity uplc(注册商标)behc18(内径2.1mm、长度100mm、粒径1.7μm;waters japan公司、东京)
[0268]
·
柱温:35℃
[0269]
·
洗脱液a:乙腈∶甲醇=7∶3(v/v)
[0270]
·
洗脱液b:超纯水
[0271]
·
洗脱条件:
[0272]
(1)0~4分钟:洗脱液a及洗脱液b(85∶15的混合液4分钟)
[0273]
(2)4~6分钟:洗脱液a及洗脱液b(85∶15~100∶0的线性浓度梯度的混合液2分钟)
[0274]
(3)6~28.2分钟:仅洗脱液a(22.2分钟)
[0275]
·
流速:0.2ml/min
[0276]
·
注入量:2.0μl
[0277]
·
pda检测波长:325nm(反式视黄醇)、450nm(类胡萝卜素)
[0278]
(质量分析)
[0279]
·
质量分析装置:6470triple quad lc/ms(agilent technologies公司、东京)
[0280]
·
离子源参数
[0281]
离子化法:电喷雾离子化(esi)
[0282]
雾化气:氮
[0283]
雾化气温度:300℃
[0284]
雾化气流量:10l/min
[0285]
喷雾器压力:35psi
[0286]
鞘气:400℃
[0287]
鞘气流量:12l/min
[0288]
毛细管电压:3500v
[0289]
·
质谱仪参数
[0290]
离子极性:正
[0291]
碰撞气体:氮
[0292]
测定模式:选择反应监测(srm)。
[0293]
如表3所示,设定了在srm中分析的各类胡萝卜素的先驱离子及产物离子的组合(srm转换(transition))。在表3中,各化合物的滞留时间为42msec,单位加速电压为3v。
[0294][0295]
通过将由pda及srm分析检测到的峰的保留时间与标准物质进行比较,鉴定了各类胡萝卜素成分。将各类胡萝卜素在450nm光波长下检测到的吸收光谱的面积值相对于作为
内标物质的反式视黄醇在325nm光波长下检测到的吸收光谱的面积值的相对值作为半定量值,计算出各类胡萝卜素的含量。将各品系中包含的各类胡萝卜素量总结于图3。在图3中,1个品系中的1种胡萝卜素量以表示由田地的3个分区得到的3个试样中的类胡萝卜素含量的值的平均值表示。如图3所示,与对照的3个品系(wt1、wt2、及tsukuba 1号)相比,ccd4-st1-1及ccd4-st1-2包含2.0倍以上的叶黄素、2.1倍以上的β-胡萝卜素、3.8倍以上的玉米黄质。
[0296]
(3d)田地栽培的双突变体的干叶中的脱辅基类胡萝卜素量
[0297]
如下所述,调查了(3c)所述的粉碎试样中的17种脱辅基类胡萝卜素的量。在14ml的螺口玻璃离心管中加入粉碎试样0.1g、提取液(加入有作为内标物质的1,3-二甲氧基苯(5.4μg/ml)的甲醇)6.0ml,用螺纹盖盖上盖子后,使用中型恒温振荡培养器bioshaker(注册商标)br-43fh
·
mr(taitec corp.)进行振荡提取(250rpm、70℃、1小时)。用孔径0.45μm的ptfe过滤器过滤提取溶液,供于气相色谱/质谱仪(gc/ms)分析。分析所使用的装置、器具及条件如下所述。
[0298]
·
气相色谱/质谱仪:gc/ms 5977a msd(agilent technologies公司、东京)
[0299]
·
色谱柱:hp-1ms(内径0.25mm、长度30m、膜厚0.25μm;agilent technologies公司、东京)
[0300]
·
插入衬管:装有非活性玻璃棉的不分流用衬管(agilent technologies公司、东京)
[0301]
·
氦气流速:1.0ml/min
[0302]
·
注入量:1.0μl
[0303]
·
注入模式:不分流
[0304]
·
插入物温度:280℃
[0305]
·
aux温度:280℃
[0306]
·
色谱柱升温条件:
[0307]
(1)50℃保持1min
[0308]
(2)50℃至100℃以10℃/min升温
[0309]
(3)100℃至200℃以2℃/min升温
[0310]
(4)200℃至300℃以20℃/min升温
[0311]
(5)300℃保持19min
[0312]
·
分析模式:tic/sim模式。
[0313]
以m/z:30-500的范围分析tic。如表4所示设定了sim中分析的各脱辅基类胡萝卜素的半定量离子及定性离子的组合(sim参数)。在表4中,末尾示出了带有括号的数字的化合物表示结构异构体。
[0314]
[表4]
[0315][0316]
在通过sim模式检测半定量离子及定性离子的保留时间中,使tic模式下得到的全质谱与文献信息及数据库内的信息进行对照,由此鉴定了各脱辅基类胡萝卜素成分。以各脱辅基类胡萝卜素的半定量离子的色谱面积值相对于作为内部标准物质的1,3-二甲氧基苯的半定量离子的色谱面积值的相对值作为半定量值,计算出各脱辅基类胡萝卜素的含量。将各品系中包含的各类胡萝卜素量总结于表5。在表5中,1个品系中的1种胡萝卜素量以表示由田地的3个分区得到的3个试样中的类胡萝卜素含量的值的平均值表示,“nd”表示not detected。如表5所示,与对照的3个品系(wt1、wt2、及tsukuba 1号)相比,ccd4-st1-1及ccd4-st1-2包含增加至约2~3倍的β-紫罗兰酮及二氢猕猴桃内酯(第1~2行的化合物)、减少至约1/2~1/3的脱辅基类胡萝卜素(第3~8行的化合物)、以及没有很大变化的脱辅基类胡萝卜素(第9~17行的化合物)。显示出增加的脱辅基类胡萝卜素(β-紫罗兰酮及二氢猕猴桃内酯)、以及显示出减少的脱辅基类胡萝卜素(第3~8行的化合物)均作为香气脱辅基类胡萝卜素而已知。
[0317]
[表5]
[0318] wt1wt2ccd4-st1-1ccd4-st1-2tsukuba1二氢猕猴桃内酯0.00680.00440.01240.01250.0036β-紫罗兰酮0.00290.00270.00600.00530.0019β-大马酮0.00690.00710.00370.00360.0062巨豆三烯酮(1)0.02340.02570.01490.01330.0261
巨豆三烯酮(2)0.06370.07100.03720.03220.0721巨豆三烯酮(3)0.09500.10470.05540.04980.1088巨豆三烯酮(4)0.05540.05700.01900.01750.03793-羟基-b-二氢大马酮0.04730.04960.02320.02390.05333-羟基-5,6-环氧-b-紫罗兰醇0.03030.01700.02810.00850.01014-(3-羟基亚丁基)-3,5,5-三甲基0.00670.00400.00630.00180.0024oxo-eduran-10.0003nd0.0003ndndβ-环柠檬醛0.00070.00080.00110.00080.00053-羟基-7,8-脱氢-b-紫罗兰醇0.00400.00190.00310.00150.0012布卢门醇a0.04370.02720.04420.01650.0159布卢门醇c0.00810.00530.01060.00320.00293-氧代-α-紫罗兰醇0.12600.06500.15710.04720.0360β-二氢大马酮0.00320.00410.00310.00290.0031
[0319]
nd:未检测到
[0320]
〔4.干叶的感官评价试验〕
[0321]
(4a)对于纸卷香烟的感官评价试验
[0322]
使用从田地中栽培的2个品系的双突变体(ccd4-st1-1及ccd4-st1-2)、3个品系的单突变体(ccd4-s-1、ccd4-t1-1及ccd4-t1-2)、以及3个品系的对照植物体(wt1、wt2及tsukuba 1号)收获到的真叶的干叶,利用卷烟器制作了纸卷香烟。根据经训练的10名评审员的感官评价对这些纸卷香烟的香吸味进行了评分。评审员以通过对照植物体的纸卷香烟的吸烟而感到的感官性作为基准,回答了通过双突变体及单突变体的纸卷香烟的吸烟而感到的感官性。回答的种类为(与对照相比)“良好”、“稍好”、“无差别”、“稍差”及“差”。“良好”评为2分,“稍好”评为1分,“无差别”、“稍差”及“差”评为0分,对各纸卷香烟的香吸味进行了评分。将分数的统计结果示于表6。如表6所示,10名中的7名将ccd4-st1-1及ccd4-st1-2的香吸味评价为“良好”或“稍好”。ccd4-st1-1及ccd4-st1-2的合计分数高于ccd4-s-1、ccd4-t1-1及ccd4-t1-2中的任一者。以上的结果表明,与从单突变体及对照植物体收获的真叶的干叶相比,从上述双突变体收获的真叶的干叶,对人类的感觉器官带来了令人愉快的刺激。
[0323]
[表6]
[0324][0325]
(4b)对于微粉碎试样的感官评价试验
[0326]
将(4a)中得到的干叶粉碎,并进一步微粉碎处理后,分散于聚乙二醇(微粉碎处理后的干叶的3倍质量)中,制成微粉碎试样。实施了由熟练的3名熟练评审员(比上述的评审员进行了进一步训练,并且具有更多的经验)进行的感官评价(试验物与对照物的比较)。对
照物为mevius(商标)的未加香品,试验物是使各微粉碎试样分散附着于mevius(商标)的未加香品而成的。使评审员吸烟对照物及试验物,对于试验物与对照物的香吸味差异进行回答。将熟练受试者的“确认到花的香吸味的提高”的回答作为1分,将“未确认到花的香吸味的提高”的回答作为0分,将对各试验物评分的结果总结于表7。如表7所示,在ccd4-st1-1中,评审员全员确认到了花的香吸味的提高,在ccd4-st1-2中,3名中的2名确认到了花的香吸味的提高。以上的结果表明,从双突变体收获的真叶的干叶可以对现有的烟草制品添加良好的香吸味。
[0327]
[表7]
[0328] wt1wt2ccd4-st1-1ccd4-st1-2tsukuba1合计分数00320
[0329]
〔5.ccd4基因的单突变体(ccd4-t2)、双突变体(ccd4-st2及ccd4-t1t2)及三突变体(ccd4-tm)的进一步制备〕
[0330]
对于ccd4-t2基因中具有突变的以下3个品系分析了烟草(tsukuba 1号)的ems突变体集团(m2世代、约个2000品系)的dna序列,进行了基于扩增子测序的序列确定,进行了筛选。
[0331]
品系名:1795品系(以下称为ccd4-t2-1)
[0332]
品系名:0799品系(以下称为ccd4-t2-2)
[0333]
品系名:1352品系(以下称为ccd4-t2-3)。
[0334]
ccd4-t2-1在ccd4-t2基因中具有无义突变(编码第190位的精氨酸(r)的密码子改变为终止密码子的核苷酸置换)。ccd4-t2-2在ccd4-t2基因中具有剪接突变(第一内含子中的5’末端的碱基g被置换为a)。ccd4-t2-3在ccd4-t2基因中具有剪接突变(ccd4-t2-3的第一内含子的3’末端的碱基g被置换为a)。使筛选到的上述3个品系生长,结果是在任意品系中均未在成熟(老化)的下位叶观察到黄化。将ccd4-t2-3用于ccd4基因的三突变体的制备。
[0335]
接着,经过2步交配及自体繁殖,制备了以纯合型具有目标突变的ccd4基因的双突变体及三突变体。
[0336]
第1步:通过ccd4-s-1及ccd4-t1-2(实施例2)的交配进行ccd4-st1-2(在ccd4-s及ccd4-t1基因分别具有纯合型的突变)的制备
[0337]
第2步:通过ccd4-st1-2及ccd4-t2-3的交配进行预突变体品系(在ccd4-s、ccd4-t1及ccd4-t2基因分别具有杂合型的突变)的制备
[0338]
自体繁殖:通过上述突变体品系的自体繁殖进行ccd4-058(在后面说明确认到的基因型)的制备
[0339]
通过序列确定鉴定了由品系ccd4-058的种子培育的360个个体的苗的基因组中存在的ccd4基因的突变。根据鉴定,确认了品系ccd4-058的后代360个个体中存在2个ccd4基因中具有纯合型突变的双突变体(ccd4-st1、ccd4-st2及ccd4-t1t2)、及3个ccd4基因中具有纯合型突变的三突变体(ccd4-tm)(由这些突变体得到了自体繁殖后代的种子)。需要说明的是,使用以下的引物对ccd4-t2基因中包含突变的区域进行了扩增。
[0340]
烟草ccd4-t2正向引物:caaactccagcggagata(序列号22)
[0341]
烟草ccd4-t2反向引物:ggcacgccactatgcaat(序列号23)。
[0342]
将得到的双突变体(ccd4-st1、ccd4-st2及ccd4-t1t2)及三突变体(ccd4-tm)在温
室内培育,通过肉眼观察成熟(老化)的下位叶的颜色。在ccd4-st2、ccd4-t1t2及ccd4-tm中,该颜色为橙色~黄色,在色彩的强度方面,随ccd4基因型而在品系间存在差异。色彩按照(i)ccd4-tm、(ii)ccd4-st1、以及(iii)ccd4-st2和ccd4-t1t2(同等程度)的顺序增强。
[0343]
〔6.ccd4双突变体及三突变体中的成熟(老化)的叶的叶颜色的色彩分析〕
[0344]
(6a)鲜叶的色彩分析
[0345]
将6个品系(3基因型
×
2个品系)的双突变体(ccd4-st1-a、ccd4-st1-2(参照实施例3及4)、ccd4-st2-a、ccd4-st2-c、ccd4-t1t2-a及ccd4-t1t2-c)、2个品系的三突变体(ccd4-tm-a及ccd4-tm-c)、以及1个品系的对照植物(tsukuba 1号)在23~25℃下的温室中进行栽培。在从播种起第94天(从掐尖起第8天)采集成熟(老化)的下位叶的鲜叶(每1个品系从3个个体采集各1片),使用色彩色差仪cr-20(konica minolta公司、东京)测定了其色彩。色彩的数值化使用了国际照明委员会(commission internationale de l’eclairage)及jis采用的l*a*b*系统。色彩色差仪cr-20输出构成l*a*b*系统(国际照明委员会(commission internationale de l’eclairage)及jis采用)的值。将色彩分析的结果示于表8。
[0346]
[表8]
[0347] l*a*b*ccd4-tm-a76.419.064.4ccd4-tm-c76.219.563.6ccd4-st1-a78.714.059.5ccd4-st1-278.414.860.6ccd4-st2-a82.06.543.4ccd4-st2-c83.34.237.6ccd4-t1t2-a82.34.837.6ccd4-t1t2-c84.62.733.7tsukuba184.22.333.6
[0348]
表8所示的数值为每1个品系(3片鲜叶)对18个测定点输出的测定值的平均值。测定点的详细情况为1片鲜叶的表面的6点(以主脉作为对称轴将叶左右分开时,各自的上部、中部及下部)
×
3片。a*的负值表示绿色的强度,正值表示红色/品红的强度。b*中的负值表示蓝色的强度,正值表示黄色的强度。l*的值表示亮度(的高度)。
[0349]
如表8所示,在三突变体中确认到比双突变体更强的黄化(橙~黄的显色)。在双突变体中,在ccd4-s及ccd4-t1基因中具有突变的品系(ccd4-stl)中确认到最强的黄化。在除此以外的品系(ccd4-st2及ccd4-tlt2)中,确认到稍弱的黄化(比作为对象的tsukuba 1号更强)。这些结果与上述基于目视的观察一致。
[0350]
(6b)干叶的色彩分析
[0351]
使(6a)中使用的各品系的移植用苗在温室内生长。向田地的移植、生长及收获为止的管理采用了一般的烟叶的栽培条件。在掐尖起第16天,使用热风干燥机对每1株收获各5片的合叶实施了通常的黄色干燥处理。在基于目视的观察中,在干叶中也确认到了与实施例5中的鲜叶的观察同样的倾向。
[0352]
除测定点的位置及数量以外,与(6a)同样地实施了干叶的色彩分析。每1个品系的
测定点为24(将每1个品系4片(从4个试验区采集了各1片叶)干叶供于分析)。将色彩分析的结果示于表9。如表8及9所述表明,对于黄化,鲜叶及干叶(由双突变体及三突变体得到)显示出相同的倾向。
[0353]
[表9]
[0354] l*a*b*ccd4-tm-a68.118.050.6ccd4-tm-c65.820.353.4ccd4-st1-a69.016.750.1ccd4-st1-268.817.251.1ccd4-st2-a68.214.547.8ccd4-st2-c68.215.547.4ccd4-t1t2-a69.214.848.2ccd4-t1t2-c69.813.344.4tsukuba170.511.138.6
[0355]
〔7.ccd4双突变体及三突变体的类胡萝卜素及脱辅基类胡萝卜素的定量分析〕
[0356]
(7a)温室栽培的双突变体及三突变体中的主要的类胡萝卜素的量
[0357]
下述9个品系(括号内记载的品系各1个)在23~25℃下的温室中进行栽培。
[0358]
st1中具有突变的双突变体(ccd4-st1-a及ccd4-st1-2)
[0359]
st2中具有突变的双突变体(ccd4-st2-a及ccd4-st2-c)
[0360]
t1t2中具有突变的双突变体(ccd4-t1t2-a及ccd4-t1t2-c)
[0361]
三突变体(ccd4-tm-a及ccd4-tm-c)、以及
[0362]
对照(tsukuba 1号)
[0363]
用液氮冷冻在从掐尖起第8~10天收获的4~5片的下位叶,在-80℃下保管。将进一步处理(冷冻干燥及粉碎)后的下位叶供于主要类胡萝卜素分析。委托一般财团法人日本食品分析中心进行了分析。将分析结果示于图4。图4中的条表示下部所示的成分的含量的平均值(3个个体量)。ccd4-tm-a的条表示1个个体的含量,ccd4-st2-c的条表示2个个体量的含量的平均值。
[0364]
如图4所示,双突变体及三突变体显示出比tsukuba 1号更高的类胡萝卜素含量。类胡萝卜素含量的上升程度随遗传型(ccd4-s、-t1及t2基因中突变的有无)而不同。关于各成分(总类胡萝卜素、叶黄素、玉米黄质及β-胡萝卜素),根据基因型的不同程度差别的倾向是同样的。作为一例,叶黄素的含量按照ccd4-tm(3.4~4.0倍)、ccd4-st1(2.1~2.8倍)、ccd4-st2(1.6~1.8倍)、ccd4-t1t2(1.2~1.7倍)增加。括号内的倍率为将tsukuba 1号的成分含量设为1时的倍率。
[0365]
(7b)田地栽培的双突变体及三突变体的干叶中的类胡萝卜素量
[0366]
与(7a)同样地使9个品系在温室内生长。向田地的移植、生长及收获为止的管理采用了一般的烟叶的栽培条件。在掐尖起第16天,使用热风干燥机对每1株收获各5片的合叶着位实施了通常的黄色干燥处理。将得到的干叶的叶脉去除后残留的叶片部分进行粉碎处理,用作半定量分析的试样。按照(3c)中的记载实施了类胡萝卜素的半定量分析。将结果示于图5。图5中的条表示下部所示的成分的含量的平均值(3个个体量)。
[0367]
如图5所示,半定量分析的结果与图4的结果一致。作为一例,叶黄素的含量按照ccd4-tm(5.5~5.7倍)、ccd4-st1(3.1~3.8倍)、ccd4-st2(2.2~2.4倍)、ccd4-t1t2(2.0倍)增加。括号内的倍率为将tsukuba 1号的成分含量设为1时的倍率。
[0368]
(7c)田地栽培的双突变体及三突变体的干叶中的脱辅基类胡萝卜素量
[0369]
将干叶试样中的17种脱辅基类胡萝卜素进行了半定量分析。干叶试样的制备方法按照(7b)进行,分析按照(3c)进行。将半定量分析的结果示于表10。表10所示的数值为1个品系(3个个体)的平均值。
[0370]
[0371]
如表10所示,三突变体在脱辅基类胡萝卜素量方面以tsukuba 1号为基准发生了最明显的变化。β-紫罗兰酮及二氢猕猴桃内酯与实施例3同样地显示出与突变体共通地增加。详细而言,β-紫罗兰酮的量(括号内的倍率将tsukuba 1号设为1)在ccd4-tm中为3.5~3.6倍,在ccd4-st1中为2.3~2.9倍,在ccd4-st2中为1.2倍,在ccd4-t1t2中为1.2~1.9倍。二氢猕猴桃内酯的量在ccd4-tm中为4.8~5.4倍,在ccd4-st1中为2.5~2.7倍,在ccd4-st2中为1.4~1.6倍,在ccd4-t1t2中为1.4~1.9倍。另一方面,在三突变体的干叶中,与tsukuba 1号相比,多种脱辅基类胡萝卜素减少至约1/3~1/10。
[0372]
工业实用性
[0373]
本发明可以用于烟草制品的品质提高。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
