1.本发明涉及一株分泌氟啶胺单克隆抗体的杂交瘤细胞株及其应用,属于食品安全免疫检测领域。
背景技术:
2.氟啶胺是由日本石原株式会社开发的2,6
‑
二硝基苯胺类杀菌剂,常用来防治番茄晚疫病,柑橘灰霉病,大豆菌核病,辣椒疫病以及十字花科植物的根肿病等。氟啶胺不内吸,不具治疗作用,但极耐雨水冲刷、残效长,是一种很好的叶面喷洒剂,并能兼治叶螨。但氟啶胺环境毒性让人担忧,有研究表明,氟啶胺可以引发哮喘病以及皮炎等破坏人体免疫系的疾病。因此,建立有效的氟啶胺残留检测方法,对有效促进环境保护,保障广大人民群众的身体健康,具有深远的意义。
3.目前,氟啶胺检测方法主要为仪器检测,常用的有气相色谱法、液相色谱法和气相色谱
‑
质谱法。如hplc
‑
ms/ms法快速测定氟啶胺在马铃暮和土壤中残留(冯义志,金杰,潘金菊,齐晓雪,梁林,刘伟)pesticide science and adminstration 2017,38(12);其采用hplc
‑
ms/ms法建立了马铃薯和土壤中氟啶胺的分析残留方法。尽管这些基于色谱的方法具有很高的灵敏度和特异性,存在一些缺点,例如需要彻底的样品净化,高溶剂消耗,昂贵的设备以及熟练的技术人员。因此,需要一种快速,简单的分析氟啶胺残留物的方法。
4.酶联免疫法(elisa)是一种极为高效、敏感、快速的检测方法,检测时对样本的前处理简单、纯化步骤少、分析容量大、检测成本低而且操作简便,适用于大量样本的现场快速检测,因此在农药残留分析中得到了广泛应用。而使用酶联免疫法检测氟啶胺的前提是得到对氟啶胺具有高特异性和高灵敏度的单克隆抗体,因此,找到一种制备对氟啶胺具有高特异性和高灵敏度的单克隆抗体的方法十分关键。
5.cn 110498766a公开了一种氟啶胺半抗原、人工抗原和抗体及其制备方法和应用,其以2,4
‑
二氯
‑
3,5
‑
二硝基三氟甲苯和2
‑
氨基丁酸甲 酯
‑3‑
氯
‑5‑
三氟甲基吡啶反应生成中间体,然后在水解获得氟啶胺半抗原,半抗原结构特征是在氟啶胺中间亚氨基的位置衍生出羧基。而本发明是直接在氟啶胺的基础上利用cl取代在氟啶胺的基础上衍生出羧基用于偶联蛋白。两个半抗原羧基的位置不同,因此暴露出的特异识别位点不同,因此也将产生亲和力,特异性和灵敏度不同的抗体。本发明的半抗原可以更好的暴露出氟啶胺的特异部分,实验结果也证明,本发明的抗体具有良好的亲和力,特异性和高灵敏度。
技术实现要素:
6.本发明的目的是克服上述不足之处,提供一种能分泌氟啶胺单克隆抗体的杂交瘤细胞株。此杂交瘤细胞株分泌的氟啶胺单克隆抗体对氟啶胺具有较好的检测灵敏度(ic
50
值为2.68 ng/ml),可以用于建立氟啶胺的免疫学检测方法,检测食品中氟啶胺的残留。
7.本发明的技术方案,一株分泌氟啶胺单克隆抗体的杂交瘤细胞株ckg,已保藏于中国微生物菌种保藏管理委员会普通微生物中心cgmcc,地址北京市朝阳区北辰西路1号院3
号中国科学院微生物研究所,分类命名为单克隆细胞株,保藏日期2020年9月27日,保藏编号cgmcc no.20790。
8.本发明提供了上述一种分泌氟啶胺单克隆抗体的杂交瘤细胞株的制备方法,包含如下步骤:(1)制备氟啶胺半抗原及氟啶胺完全抗原,将获得的氟啶胺完全抗原制备成弗氏佐剂与不完全弗氏佐剂;(2)将得到的弗氏佐剂通过背部皮下注射,注射进入balb/c小鼠体内进行多次免疫,首次免疫采用完全弗氏佐剂,加强免疫采用不完全弗氏佐剂;(3)将经过上述免疫过程的小鼠进行采血,通过间接elisa检测小鼠血清免疫效价和免疫抑制能力,筛选出血清中氟啶胺抗体含量高的获得免疫的小鼠;(4)将筛选出的小鼠用不完全弗氏佐剂再进行最后一次加强免疫,然后通过腹腔注射进行冲刺免疫,冲刺免疫采用不含弗氏佐剂的氟啶胺完全抗原进行;(5)将进行冲刺免疫后的balb/c小鼠的脾细胞和骨髓瘤细胞融合,将融合的细胞通过培养基培养,利用间接elisa检测阳性细胞孔,并进一步利用间接竞争elisa法测定阳性细胞孔的抑制效果,通过有限稀释法对有最好抑制的阳性细胞孔进行亚克隆,最终筛选出获得能分泌氟啶胺单克隆抗体的杂交瘤细胞株ckg。
9.在本发明的一种实施方式中,所述步骤(2)、(4)中的首次免疫与加强免疫之间间隔一个月,加强免疫之间间隔21天,加强免疫与冲刺免疫之间间隔18~21天。
10.在本发明的一种实施方式中,所述步骤(2)、(4)中的首次免疫剂量为100μg/只,加强免疫剂量为50μg/只,冲刺免疫剂量为25μg/只。
11.在本发明的一种实施方式中,所述步骤(2)、(4)中的免疫过程,包含1次首次免疫、4次加强免疫和1次冲刺免疫;在本发明的一种实施方式中,所述步骤(3)中的采血为第3次免疫过程结束后第7天进行采血。
12.在本发明的一种实施方式中,所述步骤(5)中的细胞融合是在冲刺免疫结束3天后进行。
13.在本发明的一种实施方式中,所述步骤(5)中的细胞融合是通过聚乙二醇(peg4000)法进行的。
14.在本发明的一种实施方式中,所述步骤(5)中的培养基为rpmi
‑
1640培养基。
15.在本发明的一种实施方式中,所述步骤(5)中的亚克隆次数为3次。
16.所述氟啶胺半抗原的分子式如下:
;所述氟啶胺半抗原的制备方法,步骤如下:称取氟啶胺于反应容器中,用dmso溶解,再加入koh;另称取β
‑
巯基丙酸,用dmso溶解;在搅拌下将β
‑
巯基丙酸溶液缓慢滴加到溶解后的氟啶胺中,于油浴上使之缓慢升温,保温后,撤去油浴;待产物自然冷却至室温后,加入水,采用hcl溶液调节ph值;将此混合液转移到分液漏斗中,用二氯甲烷分次提取,收集有机相;用nahco3水溶液分次洗涤二氯甲烷提取液,收集水相;用少量乙醚洗涤水相,弃去乙醚层;再用hcl溶液调节水相ph值,然后用乙酸乙酯分次萃取水相,合并乙酸乙酯提取液;用少量蒸馏水洗涤乙酸乙酯,弃水层;提取液经无水硫酸钠干燥后,减压浓缩,得少量黄色粘稠液体;加入少量丙酮溶液溶解,静置过夜,有黄色晶体析出,过滤即得到氟啶胺半抗原。
17.进一步地,具体步骤如下:称取氟啶胺9.30g于反应容器中,用20ml dmso溶解,再加入koh 2.25g;另称取β
‑
巯基丙酸2.10g,用10ml dmso溶解并转移至50ml恒压滴液漏斗中;在搅拌下将β
‑
巯基丙酸溶液缓慢滴加到反应容器中,于油浴上使之缓慢升温至100℃,保温2h后,撤去油浴;待产物自然冷却至室温后,加入50ml水,以6 mol
ּ l
‑
1 hcl溶液调节ph值为3;将此混合液转移到250ml分液漏斗中,用90ml 二氯甲烷分3次提取,收集有机相;用75ml 1mol
ּ l
‑
1 nahco3水溶液分3次洗涤二氯甲烷提取液,收集水相;用少量乙醚洗涤水相,弃去乙醚层;再用 6mol
ּ l
‑
1 hcl溶液调节水相ph值为3,然后用90ml乙酸乙酯分3次萃取水相,合并乙酸乙酯提取液;用少量蒸馏水洗涤乙酸乙酯,弃水层;提取液经无水硫酸钠干燥后,减压浓缩,得少量黄色粘稠液体;加入少量丙酮溶液溶解,静置过夜,有黄色晶体析出,过滤即得到氟啶胺半抗原。
18.所述氟啶胺完全抗原,其结构简式如下:
。
19.氟啶胺完全抗原的制备方法:将氟啶胺半抗原、n
‑
羟基琥珀酰亚胺nhs及1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐edc溶解于无水n,n
‑
二甲基甲酰胺dmf中,搅拌进行反应,得到氟啶胺半抗原溶液,即a液;将牛血清蛋白用碳酸盐缓冲溶液cbs稀释,得到b液;将a液加入到b液中进行反应,得到反应液;用磷酸盐缓冲液pbs透析反应液,得到氟啶胺完全抗原。
20.进一步地,氟啶胺完全抗原的制备方法,具体步骤为:称取5
‑
10 mg 氟啶胺半抗原,4
‑
6 mg n
‑
羟基琥珀酰亚胺(nhs),溶解于300
‑
500μl n,n
‑
二甲基甲酰胺(dmf)中,室温搅拌反应10
‑
15 min;再称取10
‑
15 mg 1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐(edc),用100
‑
200μl dmf充分溶解后,加入到氟啶胺半抗原溶液中,室温搅拌反应6
‑
8h (称为a液)。取6
‑
8mg bsa,用0.01 m碳酸盐缓冲液(cbs)稀释至2
‑
4mg/ml(称为b液),再逐滴将a液缓慢加入到b液中,室温反应过夜;然后用0.01m pbs溶液透析,除去未反应的小分子半抗原,得到完全抗原,并通过紫外吸收扫描方法进行鉴定。
21.氟啶胺包被原的制备方法:将氟啶胺半抗原、n
‑
羟基琥珀酰亚胺nhs溶解于无水n,n
‑
二甲基甲酰胺dmf中,室温搅拌反应,得到氟啶胺半抗原溶液;将1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐edc溶解于无水dmf后,加入到氟啶胺半抗原溶液中,室温搅拌进行反应,得到a液;将鸡卵白蛋白ova用碳酸盐缓冲液cbs稀释,得到b液;将逐滴将a液缓慢加入到b液中进行反应,得到反应液;用pbs溶液透析反应液,除去未反应的小分子半抗原,得到包被原。
22.进一步地,氟啶胺包被原的制备方法,具体步骤为:将5
‑
10 mg氟啶胺半抗原、4
‑
6 mg n
‑
羟基琥珀酰亚胺(nhs)溶解于300
‑
500μl无水n,n
‑
二甲基甲酰胺(dmf)中,室温搅拌反应10
‑
15 min,得到氟啶胺半抗原溶液;将5
‑
10 mg 1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐(edc)溶解于100
‑
200μl无水dmf后,加入到氟啶胺半抗原溶液中,室温搅拌进行反应6
‑
8h,得到a液;将5
‑
10mg鸡卵白蛋白(ova)用1ml浓度为0.01mmol/l的碳酸盐缓冲液(cbs)稀释,得到b液;将逐滴将a液缓慢加入到b液中进行反应,得到反应液;用pbs溶液透析反应
液,除去未反应的小分子半抗原,得到包被原。
23.氟啶胺单克隆抗体,由所述保藏编号为cgmcc no. 20790的杂交瘤细胞株ckg分泌产生。
24.本发明提供了上述一种氟啶胺单克隆抗体的制备方法,所述方法为取balb/c小鼠,腹腔注射石蜡油,再腹腔注射保藏编号为cgmcc no. 20790的杂交瘤细胞株,注射后收集腹水,将腹水纯化,将获得的单抗低温保存。
25.在本发明的一种实施方式中,所述方法为取8
‑
10周龄balb/c小鼠,每只小鼠腹腔注射石蜡油1ml,7天后每只小鼠腹腔注射1
×
106保藏编号为cgmcc no. 20790的杂交瘤细胞株,从第7天开始收集腹水,将腹水通过辛酸
‑
硫酸铵法纯化,获得的单抗置于
‑
20℃保存。
26.本发明提供了上述一种氟啶胺单克隆抗体或上述一种氟啶胺单克隆抗体的制备方法在识别氟啶胺方面的应用。
27.本发明的有益效果:本发明获得的保藏编号为cgmcc no. 20790的杂交瘤细胞株ckg分泌所得的氟啶胺单克隆抗体,对氟啶胺有较好的检测灵敏度(ic
50
值为2.68 ng/ml);可以用于食品中氟啶胺的残留检测。
28.生物材料样品保藏:一株分泌氟啶胺单克隆抗体的杂交瘤细胞株ckg,已保藏于中国微生物菌种保藏管理委员会普通微生物中心cgmcc,地址北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,分类命名为单克隆细胞株,保藏日期2020年9月27日,保藏编号cgmcc no.20790。
附图说明
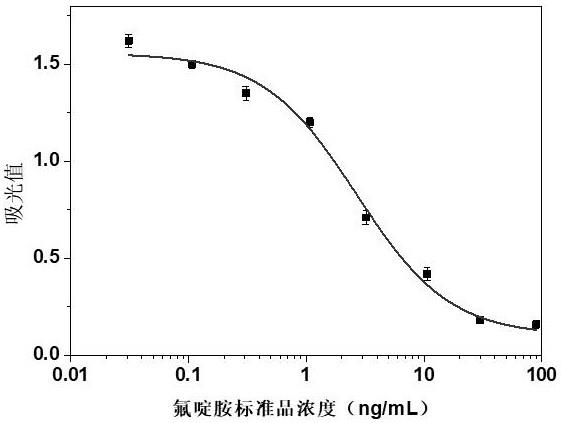
29.图1本发明氟啶胺单克隆抗体对氟啶胺的抑制标准曲线。
具体实施方式
30.本发明下面的实施例仅作为本发明内容的进一步说明,不能作为本发明的限定内容或范围。下面通过实施例对本发明作进一步说明。
31.下述实施例中涉及的培养基如下:rpmi
‑
1640培养基(mg/l):l
‑
精氨酸290、l
‑
门冬酰胺50、l
‑
门冬氨酸20、l
‑
胱氨酸二盐酸盐65.15、l
‑
谷氨酸20、甘氨酸10、l
‑
组氨酸15、l
‑
羟脯氨酸20、l
‑
异亮氨酸50、l
‑
亮氨酸50、l
‑
赖氨酸盐酸盐40、l
‑
甲硫氨酸15、l
‑
苯丙氨酸15、l
‑
脯氨酸20、l
‑
丝氨酸30、l
‑
苏氨酸20、l
‑
色氨酸5、l
‑
酪氨酸23.19、l
‑
缬氨酸20、对氨基苯甲酸1、硝酸钙100、无水硫酸镁48.84、无水磷酸二氢钠676.13、氯化钾400、氯化钠6000、葡萄糖2000、还原谷胱甘肽1、酚红5、l
‑
谷氨酰胺300、生物素0.2、d
‑
泛酸钙0.25、叶酸1、i
‑
肌醇35、烟酰胺1、氯化胆碱3、盐酸吡哆醇1、核黄素0.2、盐酸硫胺素1、维生素b12 0.005、碳酸氢钠2000。
32.下述实施例中涉及的试剂如下:碳酸盐缓冲液(cbs):称取na2co
3 1.59 g,nahco
3 2.93 g,分别溶于少量双蒸水后混合,加双蒸水至约800ml混匀,调ph值至9.6,加双蒸水定容至1000ml,4℃贮存备用。
33.磷酸盐缓冲液(pbs):8.00 g nacl,0.2 g kcl,0.2 g kh2po4,2.9g na2hpo4·
12 h2o,溶于800ml纯水中,用naoh或hcl调ph到7.2~7.4,定容至1000ml;pbst:含0.05 % 吐温20的pbs;
抗体稀释液:含 0.1%明胶的pbs;tmb显色液:a液:na2hpo
4.
12h2o 18.43g,柠檬酸 9.33g,纯水定容至1000ml;b液:60mg tmb 溶于100ml乙二醇中。a、b液按5:1混合即为tmb显色液,现用现混。
34.下述实施例中涉及的检测方法如下:氟啶胺抑制率检测方法:通过棋盘试验选择ic
‑
elisa中最合适的抗原和抗体浓度。用碳酸盐缓冲液(cbs)将抗原稀释至0.01,0.03,0.1和0.3μg/ ml,并用抗体稀释液将抗体稀释至0.03,0.1,0.3和1μg/ ml。选择最佳工作点后,将氟啶胺标准品稀释为8个浓度(0.03,0.1,0.3,1,3,10,30,90 ng/ml),按照ic
‑
elisa操作步骤,最后用originpro 8.5做图(结果如图1所示),获得氟啶胺标准抑制曲线,计算ic
50
。
35.实施例1:氟啶胺半抗原的合成由于氟啶胺小分子不具有免疫原性,不能刺激小鼠产生免疫应答,进而产生抗体,因此需通过蛋白连接技术将氟啶胺偶联到蛋白上,使其获得免疫原性;蛋白偶联技术中常用的活泼基团有氨基,羧基,羟基,巯基等,鉴于氟啶胺分子结构式中不含有这些活泼基团,因此需要衍生。
36.称取氟啶胺9.30 g(20 mmol)于100 ml 三口烧瓶中,用20 ml dmso 溶解,再加入koh 2.25 g (40 mmol)。另称取β
‑
巯基丙酸2.10 g(20 mmol),用10 ml dmso 溶解并转移至50 ml 恒压滴液漏斗中。在搅拌下将β
‑
巯基丙酸溶液缓慢滴加到三口烧瓶中,于油浴上使之缓慢升温至100℃,保温2 h后,撤去油浴。待产物自然冷却至室温后,加入50 ml水,以6 mol
ּ l
‑
1 hcl溶液调节ph 值为3。将此混合液转移到250 ml分液漏斗中,用90 ml二氯甲烷分3次提取,收集有机相。用75ml 1 mol
ּ l
‑
1 nahco3水溶液分3 次洗涤二氯甲烷提取液,收集水相。用少量乙醚洗涤水相,弃去乙醚层。再用 6 mol
ּ l
‑
1 hcl溶液调节水相ph值为3,然后用90 ml乙酸乙酯分3次萃取水相,合并乙酸乙酯提取液。用少量蒸馏水洗涤乙酸乙酯,弃水层。提取液经无水硫酸钠干燥后,减压浓缩,得少量黄色粘稠液体。加入少量丙酮溶液溶解,静置过夜,有黄色晶体析出。过滤即得到氟啶胺半抗原。
37.实施例2:氟啶胺完全抗原的合成称取8.5 mg 氟啶胺半抗原,4.2 mg n
‑
羟基琥珀酰亚胺(nhs),溶解于300μl n,n
‑
二甲基甲酰胺(dmf)中,室温搅拌反应10 min;再称取6.9 mg 1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐(edc),用100μl dmf充分溶解后,加入到氟啶胺半抗原溶液中,室温搅拌反应6
‑
8h(称为a液)。取8mg bsa,用0.01 m碳酸盐缓冲液(cbs)稀释至4mg/ml(称为b液),再逐滴将a液缓慢加入到b液中,室温反应过夜;然后用0.01m pbs溶液透析,除去未反应的小分子半抗原,得到完全抗原,并通过紫外吸收扫描方法进行鉴定。
38.实施例3:氟啶胺包被原的合成将5.0mg氟啶胺半抗原、2.3 mgn
‑
羟基琥珀酰亚胺(nhs)溶解于300μl无水n,n
‑
二甲基甲酰胺(dmf)中,室温搅拌反应10 min,得到氟啶胺半抗原溶液;将3.8 mg 1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐(edc)溶解于100μl无水dmf后,加入到氟啶胺半抗原溶液中,室温搅拌进行反应6
‑
8h,得到a液;将10mg鸡卵白蛋白(ova)用1ml浓度为0.01mmol/l的碳酸盐缓冲液(cbs)稀释,得到b液;将逐滴将a液缓慢加入到b液中进行反应,得到反应液;用pbs溶液透析反应液,除去未反应的小分子半抗原,得到包被原。
39.实施例4:分泌氟啶胺单克隆抗体的杂交瘤细胞株的制备
1、动物免疫的获得:将氟啶胺完全抗原与等量弗氏佐剂混合乳化后,对balb/c小鼠进行颈背部皮下多点注射免疫(冲刺免疫除外);首次免疫用完全弗氏佐剂,剂量为100μg/只;多次加强免疫用不完全弗氏佐剂且剂量减半即为50μg /只;冲刺免疫不用佐剂,直接用生理盐水稀释后腹腔注射,剂量再减半即为25μg /只;首次免疫与第二次加强免疫之间间隔一个月,多次加强免疫之间间隔21天,冲刺免疫与最后一次加强免疫之间间隔18
‑
21天;通过间接竞争酶联免疫法(ic
‑
elisa)观测小鼠免疫效果即检测小鼠血清的效价和抑制;2、细胞融合:在冲刺免疫三天后,按照常规peg(聚乙二醇,分子量为4000)方法进行细胞融合,具体步骤如下:a、断尾取血,颈椎脱臼法处死小鼠后,立即放入75%酒精中消毒,浸泡5 min左右,无菌操作取出小鼠的脾脏,用注射器的胶头适度研磨并通过200目细胞筛网得到脾细胞悬液,收集,离心(1200rpm,8min),用rpmi
‑
1640培养基洗涤脾细胞三次,最后一次离心后,将脾细胞稀释到一定体积,计数,备用;b、收集sp2/0细胞:融合前7
‑
10天,将sp2/0瘤细胞用含10% fbs(胎牛血清)rpmi
‑
1640 培养基在5% co2培养箱中,融合前要求sp2/0瘤细胞数量达到1~4
×
107,保证融合前sp2/0瘤细胞处于对数生长期,融合时,收集瘤细胞,悬浮于rpmi
‑
1640基础培养液中,进行细胞计数;c、融合过程7 min:第1 min,将1ml的peg 1500由慢到快滴加到细胞中;第2 min,静置;第3 min和第4 min,在1min内滴加1ml rpmi
‑
1640培养基;第5 min和第6 min,在1 min内滴加2 ml rpmi
‑
1640培养基;第7 min,每10 s滴加1ml的rpmi
‑
1640培养基;然后37℃温浴5 min;离心(800 rpm,8 min),弃上清,重悬入含20%胎牛血清,2%的50
×
hat的rpmi
‑
1640筛选培养液中,按照200 μl/孔加到96孔细胞板,置于37℃,5% co2培养箱中培养。
40.3、细胞筛选与细胞株建立:在细胞融合的第3天对融合细胞进行rpmi
‑
1640筛选培养液半换液,第5天进行用含20% 胎牛血清,1%的100
×
ht的rpmi
‑
1640过渡培养液进行全换液,在第7天取细胞上清进行筛选。
41.筛选分两步:第一步先用ic
‑
elisa法筛选出阳性细胞孔,第二步选用氟啶胺为标准品,用ic
‑
elisa法对阳性细胞进行抑制效果测定。
42.选择对氟啶胺标准品有较好抑制的细胞孔,采用有限稀释法进行亚克隆,七天后用同样的方法进行检测。
43.按上述方法进行三次亚克隆,最终获得氟啶胺单克隆抗体细胞株。
44.实施例5:氟啶胺单克隆抗体的制备与鉴定取8
‑
10周龄balb/c小鼠,每只小鼠腹腔注射无菌石蜡油1 ml;7天后每只小鼠腹腔注射1
×
106氟啶胺杂交瘤细胞,从第七天开始收集腹水,将腹水通过辛酸
‑
饱和硫酸铵法进行抗体纯化。
45.在偏酸条件下,正辛酸可以沉淀腹水中除igg免疫球蛋白外的其他杂蛋白,然后离心,弃沉淀;再用等量饱和度的硫酸铵溶液沉淀igg型的单克隆抗体,离心,弃上清,用0.01 m的pbs溶液(ph 7.4)溶解后,透析脱盐,最终得到纯化后的单克隆抗体置于
‑
20℃保存。
46.使用间接竞争elisa,测得氟啶胺单克隆抗体的ic
50
值为2.68ng/ml,说明对氟啶胺有很好的灵敏度,可用于氟啶胺免疫分析检测。
47.实施例6:氟啶胺单克隆抗体的应用将杂交瘤细胞株通过体内腹水制备的单克隆抗体应用于氟啶胺的elisa添加回收试验,具体步骤如下:(1)将用碳酸盐缓冲液(cbs)稀释好的浓度为0.3μg/ml的包被原包被96孔酶标板,每孔100μl,37℃包被2h后,用pbst洗液洗板三次,每次每孔200μl,每次3min,拍干;(2)用含0.2%明胶的cbs进行封闭,每孔200μl,37℃封闭2 h,用pbst洗液洗板三次,每次每孔200μl,每次3min,拍干;(3)用磷酸盐缓冲液(pbs)分别配置0.03,0.1,0.3,1,3,10,30,90 ng/ml的氟啶胺标准溶液,将标准溶液以及待检测样品提取液,分别加入到已经封闭好的酶标板中,每孔50μl,每个样品重复3个孔,再每孔加入50μl稀释至0.3μg/ml的抗氟啶胺单克隆抗体,37℃反应0.5h后,洗板拍干;(4)每孔加入100μl用含0.1%明胶的pbs以1:3000稀释的hrp标记的羊抗鼠igg二抗,37℃反应0.5h后,洗板拍干;(5)每孔加入100μl的tmb显色液,37℃显色15 min后,每孔加入50μl 2 m的h2so4终止液,450 nm测吸光值;(6)添加回收及样品前处理:选择黄瓜为检测样品。
48.待测样品洗净、切碎,在捣碎机中搅碎、混匀。分别称取三份样品匀浆,每份5g,向样品中分别添加20ppb、100ppb、250ppb的氟啶胺标准品(根据抗体线性范围及ic
50
设定添加浓度),剧烈振荡2min。加入10ml丙酮, 1 gnacl,5 g无水naso4,超声波振荡15min, 4000rpm离心10min,收集上清液,取上清液1ml,氮气吹干,用5mlpbs复溶(即稀释了五倍以减少样品基质的影响)。
49.采用间接竞争elisa进行添加回收试验,其回收率分别为94%,91%,103%。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。