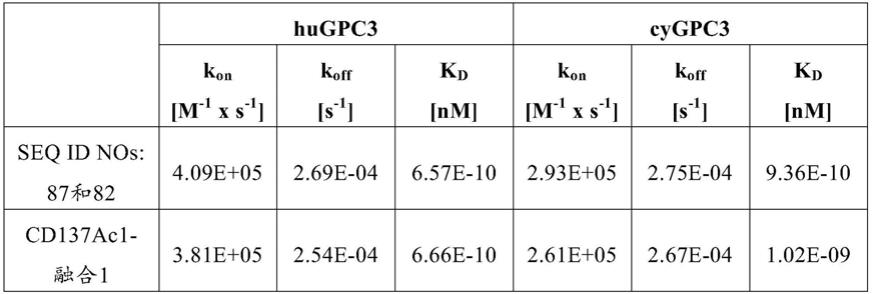
对cd137和gpc3特异性的新型融合蛋白
i.
背景技术:
1.磷脂酰肌醇聚糖
‑
3(gpc3,也称为dgsx、gtr2
‑
2、mxr7、oci
‑
5、sdys、sgb、sgbs和sgbs1)是一种属于糖基
‑
磷脂酰肌醇
‑
锚式硫酸肝素蛋白聚糖的磷脂酰肌醇聚糖家族的癌胚抗原。gpc3在发育过程中在各种组织中表达,通过如成纤维细胞生长因子(fgf)、非经典wnt或胰岛素样生长因子信号通路在形态发生和生长中发挥重要作用(cheng等,carcinogenesis,2008;song等,j biol chem,2005;song等,j biol chem,1997)。然而,在大多数正常成人组织中,gpc3表达下调或沉默。另外,根据细胞类型,gpc3可以正向和负向调节细胞生长。gpc3的功能丧失突变是simpson
‑
golabi
‑
behmel或simpson畸形综合征(sgbs)的原因,这是一种罕见的x染色体连锁过度生长障碍,sgbs患者具有增加的胚胎肿瘤(包括wilms’肿瘤)的风险(pilia等,nat genet,1996)。
2.gpc3在各种类型的癌症包括肝癌、胃癌、黑色素瘤、高级别尿路上皮癌、睾丸癌和一些子宫癌和阴道癌中表达(aydin等,diagn pathol,2015;ushiku等,cancer sci,2009;gailey和bellizzi,am j clin pathol,2013;yamanaka等,oncology,2007;nakatsura等,clin cancer res,2004;zynger等,am j surg pathol,2006;montalbano等,int j oncol,2016;midorikawa等,int j cancer,2003)。特别地,gpc3在肝细胞癌(hcc)中高度表达(capurro等,gastroenterology,2003;nakatsura等,biochem biophys res commun,2003;sung等,cancer sci,2003;zhu等,gut,2001),肝细胞癌是肝癌的主要形式,其占所有肝癌的90%,并每年导致至少500,000人死亡(jelic等,ann oncol,2010)。已经对gpc3作为hcc和其它癌症类型的诊断生物标志物和治疗靶点进行了广泛研究。已经得到了一些靶向gpc3的抗体,包括人源化小鼠抗体yp7和gc33以及人抗体hn3和mdx
‑
1414,然而这些抗体并未显示出抑制hcc细胞增殖或诱导细胞凋亡的能力(feng和ho,febs lett,2014)。特别地,gc33目前正在针对hcc的临床试验中进行评估。gc33功能的机制包括抗体依赖性细胞毒性(adcc),但是gc33不直接抑制gpc3
‑
阳性肿瘤细胞的增殖(takai等,cancer biol ther,2009;nakano等,biochem biophys res commun,2009;ishiguro等,cancer res,2008)。然而,虽然已证明gc33在体内表现出肿瘤生长抑制,但它并没有提供令人满意的临床疗效。同时,敲低和sirna实验结果表明gpc3并非hcc细胞的致死基因,这使得无法确定抗
‑
gpc3抗体能否有效地使肿瘤消退。
3.分化簇137或cd137(也称为4
‑
1bb或tnfrs9)是一种共刺激性免疫受体及肿瘤坏死因子受体(tnfr)超家族的成员。其主要在活化的cd4 与cd8 t细胞、活化的b细胞和天然杀伤(nk)细胞上表达,但也可在静息的单核细胞和树突状细胞(li和liu,clin pharmacol,2013)或内皮细胞(snell等,immunol rev,2011)上发现。cd137在调节免疫应答中扮演重要作用,因此是癌症免疫疗法的靶标。cd137配体(cd137l)是已知的cd137的唯一天然配体,并在一些诸如活化的b细胞、单核细胞和脾脏树突状细胞的抗原呈递细胞上组成型表达,也可在t淋巴细胞上诱导cd137配体。
4.cd137l是一种以膜结合形式和可溶性变体存在的三聚体蛋白。但是,可溶性cd137l活化例如表达cd137的淋巴细胞上的cd137的能力是受限的,需要高浓度才能引发效
应(wyzgol等,j immunol,2009)。活化cd137的天然方法为通过cd137
‑
阳性细胞与cd137l阳性细胞的接合。认为然后通过在相对细胞上的cd137l的聚集来诱导cd137的活化,导致经由traf1、2、和3的信号传导(yao等,nat rev drug discov,2013;snell等,immunol rev,2011)和进一步在cd137
‑
阳性t细胞中伴发下游效应。在通过它们相应的同源靶标的识别来活化t细胞的情况下,由共刺激cd137而引发的效应为进一步增强的活化、增强的存活和增殖、促炎性细胞因子的产生以及改善的杀伤能力。
5.已经在许多体内模型中证实了cd137共刺激对消除癌细胞的益处。cd137l在肿瘤上的过(forced)表达导致了例如肿瘤排斥(melero等,eur jimmunol,1998)。类似地,抗
‑
cd137 scfv在肿瘤上的过表达导致cd4
t细胞和nk
‑
细胞依赖性肿瘤消除(yang等,cancer res,2007;zhang等,mol cancer ther,2006;ye等,nat med,2002)。还证实了,系统地施用抗
‑
cd137抗体导致肿瘤生长迟缓(martinet等,gene ther,2002)。
6.研究还表明,cd137是人肿瘤中天然存在的肿瘤反应性t细胞的极佳标记物(ye等,clin cancer res,2014),并且抗
‑
cd137抗体可用于改进cd8
黑色素瘤浸润的淋巴细胞的扩增和活性,以用于过继性t细胞疗法(chacon等,plos one,2013)。
7.cd137共刺激的潜在治疗益处的临床前论证促进了靶向cd137的治疗性抗体包括bms
‑
663513(在美国专利no.7,288,638中描述)和pf
‑
05082566(fisher等,cancer immunol immunother,2012)的开发。
8.除其它之外,本发明提供了经由一种或多种融合蛋白同时接合cd137和gpc3的新手段,该种融合蛋白具有针对cd137的结合特异性和针对gpc3的结合特异性的性质。
9.ii.定义
10.以下所列定义了在本说明书中使用的术语、短语和缩写。本文列出和定义的所有术语旨在涵盖所有语法形式。
11.如本文所使用,除另有规定外,“cd137”意是指人cd137(hucd137)。人cd137意指由uniprot q07011定义的全长蛋白、其片段或其变体。cd137也称为4
‑
1bb或肿瘤坏死因子受体超家族成员9(tnfrsf9),是淋巴细胞活化诱导的(ila)。在一些特定的实施方案中,采用非人物种的cd137,如猕猴(cynomolgus)cd137和小鼠cd137。
12.如本文所使用,除另有规定外,“磷脂酰肌醇聚糖
‑
3”或“gpc3”意是指人gpc3(hugpc3)。人gpc3意指由uniprot p51654定义的全长蛋白、其片段或其变体。人gpc3由gpc3基因编码。gpc3也称为dgsx、gtr2
‑
2、mxr7、oci
‑
5、sdys、sgb、sgbs或sgbs1。在一些特定的实施方案中,采用非人物种的gpc3,如猕猴gpc3和小鼠gpc3。
13.如本文所使用,“结合亲和力”描述了本发明的生物分子(如多肽或蛋白,比如脂质运载蛋白突变蛋白、抗体、融合蛋白或任何其它肽或蛋白)结合选定靶标并形成复合物的能力。可以通过本领域技术人员已知的多种方法测量结合亲和力,包括但不限于,荧光滴定、基于酶联免疫吸附试验(elisa)的测定(包括直接和竞争elisa)、比如等温滴定量热法(itc)的量热法和表面等离子体共振(spr)。这些方法在本领域中是熟知的,并且其一些实例也在下文进一步描述。由此,将结合亲和力表示为采用这些方法测量的解离常数(k
d
)、半数最大有效浓度(ec
50
)或半数最大抑制浓度(ic
50
)的值。较低的k
d
、ec
50
或ic
50
值反映更好(更高)的结合能力(亲和力)。由此,可以测量并比较两个生物分子对选定靶标的结合亲和力。当比较两个生物分子对选定靶标的结合亲和力时,术语“大体相同”、“基本上相同”或
“
基本上类似”意指在所述结合亲和力测量的实验变异(variability)范围内,一种生物分子具有的表示为与另一分子相同或相似的k
d
、ec
50
或ic
50
值的结合亲和力。所述结合亲和力测量的实验变异取决于所采用的具体方法并是本领域技术人员已知的。
14.如本文所使用,术语“基本上”还可以指表现出目标特征或特性的全部或接近全部的范围或程度的定性条件。生物领域的普通技术人员将理解,生物学及化学现象很少(若有的话)走向完结和/或进行至完成或达到或避免绝对结果。因此,本文所使用的术语“基本上”用于捕捉许多生物学及化学现象中固有的潜在缺乏完整性的情况。
15.如本文所使用,术语“检测(detect/detection/detecting)”或“可检测的”理解为在定量和定性水平上以及它们的组合。从而其包括在本发明的生物分子上实施的定量、半定量和定性测量。
16.如本文所使用,“可检测的亲和力”一般意指生物分子与其靶标之间的结合能力为至多约10
‑5m或更低,其表示为k
d
、ec
50
或ic
50
值。一般不再能通过常规方法例如elisa和spr测量高于10
‑5m的结合亲和力(表示为k
d
、ec
50
或ic
50
值),且因此其是次要的。
17.注意到,本发明的生物分子与其靶标之间的复合物的形成受多个不同因素的影响,如相应靶标的浓度、竞争者的存在、所采用的缓冲系统的ph和离子强度、用于测定结合亲和力的实验方法(例如荧光滴定、竞争(competive)elisa(也称为竞争(competition)elisa)和表面等离子体共振),和甚至用于评估实验数据的数学算法。因此,本领域技术人员也清楚表示为k
d
、ec
50
或ic
50
值的结合亲和力可以在某个实验范围内变化,这取决于方法和实验设置。这意味着,可能会有所测得的k
d
、ec
50
或ic
50
值的轻微的偏差或会有公差范围,例如,取决于该值是通过elisa(包括直接或竞争elisa)、通过spr还是另一方法测定的。
18.如本文所使用,“特异的(specific for)”、“特异性结合”、“特异地结合”或“结合特异性”涉及生物分子区分所需靶标(例如cd137和gpc3)与一种或多种参照靶标(例如中性粒细胞明胶酶相关脂质运载蛋白的细胞受体)的能力。应理解,此类特异性不是绝对性质,而是一种相对性质,并且可以例如通过spr、蛋白质印迹、elisa、荧光激活细胞分选(facs)、放射免疫检定法(ria)、电化学发光(ecl)、免疫放射测定(irma)、免疫组化(ihc)和肽扫描来测定。
19.当在本文的结合cd137和gpc3的本发明的融合蛋白的上下文中使用时,术语“特异的(specific for)”、“特异性结合”、“特异地结合”或“结合特异性”意指如本文所述的融合蛋白结合cd137和gpc3、与cd137和gpc3反应或针对cd137和gpc3,但基本上不结合另一种蛋白。术语“另一种蛋白”包括不是cd137或gpc3或者与cd137或gpc3密切相关或同源的蛋白的任何蛋白。然而,来自除人以外的物种的cd137或gpc3和cd137或gpc3的片段和/或变体未被术语“另一种蛋白”排除。术语“基本上不结合”意指本发明的融合蛋白以比cd137和/或gpc3更低的结合亲和力结合另一种蛋白,即显示出小于30%、优选地20%、更优选地10%、特别优选地小于9%、8%、7%、6%或5%的交叉反应性。如上文定义的所述融合蛋白是否特异性反应可以很容易地进行测试,特别是通过比较本发明的融合蛋白与cd137和/或gpc3的反应和所述融合蛋白与其它(另一种)蛋白的反应。
20.如本文所使用,术语“脂质运载蛋白”是指重量为约18
‑
20kda的单体蛋白,其具有圆柱形β折叠片超二级结构区,所述结构区包含通过在一端的多个(优选为4个)环逐对连接的多个β
‑
链(优选为8个β
‑
链,标记为a至h)以由此包含配体结合口袋和限定配体结合口袋
的入口。优选地,本发明中所用的包含配体结合口袋的环是连接β
‑
链a和b、c和d、e和f以及g和h的开口端的环,并被标记为ab、cd、ef和gh环。得到公认的是,在脂质运载蛋白家族成员中,正是所述环在本应刚性的脂质运载蛋白骨架中的这种多样性产生多种不同的结合模式,每一种模式能够容纳不同大小、形状和化学特征的靶标(如skerra,biochim biophys acta,2000;flower等,biochim biophys acta,2000;flower,biochem j,1996中的综述)。应当理解,蛋白的脂质运载蛋白家族已经天然进化为结合范围广泛的配体,具有非常低水平的整体序列保守性(通常具有小于20%的序列同一性),但保留高度保守的整体折叠模式。不同脂质运载蛋白中位置之间的对应关系也为本领域技术人员所熟知(参见如美国专利no.7,250,297)。落入本文所使用的“脂质运载蛋白”的定义中的蛋白质包括、但不限于包括泪液脂质运载蛋白(tlc,lcn1)、脂质运载蛋白
‑
2(lcn2)或中性粒细胞明胶酶相关脂质运载蛋白(ngal)的人脂质运载蛋白,载脂蛋白d(apod),载脂蛋白m,α1‑
酸性糖蛋白1,α1‑
酸性糖蛋白2,α1‑
微球蛋白,补体成份8γ,视黄醇结合蛋白(rbp),附睾视黄酸结合蛋白,glycodelin,气味结合蛋白iia,气味结合蛋白iib,脂质运载蛋白
‑
15(lcn15)和前列腺素d合酶。
21.如本文所使用,除另有规定外,“泪液脂质运载蛋白”是指人泪液脂质运载蛋白(htlc),并进一步是指成熟人泪液脂质运载蛋白。当将术语“成熟”用于表征蛋白时意指蛋白基本上不含信号肽。本发明的“成熟htlc”是指人泪液脂质运载蛋白的成熟形式,其不具有信号肽。将成熟htlc描述为具有swiss
‑
prot数据库登录号p31025的序列的残基19
‑
176,其氨基酸示于seq id no:1。
22.如本文所使用,“脂质运载蛋白
‑
2”或“中性粒细胞明胶酶相关脂质运载蛋白”是指人脂质运载蛋白
‑
2(htlc2)或人中性粒细胞明胶酶相关脂质运载蛋白(hngal),并进一步是指成熟人脂质运载蛋白
‑
2或成熟人中性粒细胞明胶酶相关脂质运载蛋白。当将术语“成熟”用于表征蛋白时意指蛋白基本上不含信号肽。本发明的“成熟hngal”是指人中性粒细胞明胶酶相关脂质运载蛋白的成熟形式,其不具有信号肽。将成熟hngal描述为具有swiss
‑
prot数据库登录号p80188的序列的残基21
‑
198,其氨基酸示于seq id no:2。
23.如本文所使用,“天然序列”是指具有存在于自然界中的序列或具有野生型序列的蛋白或多肽,而不考虑该种蛋白或多肽的制备方式。此类天然序列蛋白或多肽可以从自然界中分离或者可以通过诸如重组或合成方法的其它手段产生。
[0024]“天然序列脂质运载蛋白”是指与源自自然界的相应多肽具有相同氨基酸序列的脂质运载蛋白。因此,天然序列脂质运载蛋白可以具有来自任何生物体、特别是哺乳动物的相应天然存在的(野生型)脂质运载蛋白的氨基酸序列。当在脂质运载蛋白的上下文中使用时,术语“天然序列”具体涵盖脂质运载蛋白的天然存在的截短的或分泌的形式、天然存在的变体形式(比如脂质运载蛋白的可变剪接形式和天然存在的等位基因变体)。在本文中术语“天然序列脂质运载蛋白”与“野生型脂质运载蛋白”可互换使用。
[0025]
如本文所使用,“突变蛋白”、“突变的”实体(蛋白质或核酸)或“突变体”是指与天然存在(野生型)的蛋白或核酸相比,一个或多个氨基酸或核苷酸的交换、缺失或插入。所述术语还包括如本文所述的突变蛋白的片段。本发明明确涵盖如本文所述的这样的脂质运载蛋白突变蛋白,该种突变蛋白具有圆柱形β折叠片超二级结构区,所述结构区包含通过在一端的4个环逐对连接的8个β
‑
链以由此包含配体结合口袋和限定配体结合口袋的入口,其中
与天然序列脂质运载蛋白相比,所述4个环中的至少三个中的每一个的至少一个氨基酸已被突变。优选地,本发明的脂质运载蛋白突变蛋白具有如本文所述的结合cd137的功能。
[0026]
如本文所使用,与本发明的脂质运载蛋白突变蛋白有关的术语“片段”是指n
‑
末端和/或c
‑
末端截短的(即缺少n
‑
末端和/或c
‑
末端氨基酸中的至少一个)源自全长成熟htlc或hngal或脂质运载蛋白突变蛋白的蛋白质或多肽。这种片段可包括其所源自的成熟htlc或hngal或脂质运载蛋白突变蛋白一级序列的至少10个或更多,比如20或30个或者更多个连续氨基酸,并且通常在成熟htlc或hngal的免疫测定中可检测到。这种片段可缺少n
‑
末端和/或c
‑
末端氨基酸中的多达2个、多达3个、多达4个、多达5个、多达10个、多达15个、多达20个、多达25个或多达30个(包括之间的所有数字)。作为示例性实例,这种片段可缺少成熟htlc的1个、2个、3个或4个n
‑
末端氨基酸(his
‑
his
‑
leu
‑
leu)和/或1个或2个c
‑
末端氨基酸(ser
‑
asp)。应理解,所述片段优选为其所源自的成熟htlc或hngal或脂质运载蛋白突变蛋白的功能片段,这意味着该片段优选地保留了其所源自的成熟htlc/hngal或脂质运载蛋白突变蛋白的优选对cd137的结合特异性。作为示例性实例,这种功能片段可至少包含在对应于成熟htlc的线性多肽序列的位置5
‑
153、5
‑
150、9
‑
148、12
‑
140、20
‑
135或26
‑
133处的氨基酸。作为另一个示例性实例,这种功能片段可至少包含在对应于成熟hngal的线性多肽序列的位置13
‑
157、15
‑
150、18
‑
141、20
‑
134、25
‑
134或28
‑
134处的氨基酸。
[0027]
关于本发明的融合蛋白的相应靶标cd137或gpc3的术语“片段”是指n
‑
末端和/或c
‑
末端截短的cd137或gpc3或者cd137或gpc3的蛋白结构域。本文所述的cd137的片段或gpc3的片段保留了全长cd137或gpc3被本发明的融合蛋白识别和/或结合的能力。作为示例性实例,所述片段可以是cd137或gpc3的胞外结构域。作为示例性实例,这种胞外结构域可包含cd137的胞外亚结构域的氨基酸,比如结构域1(uniprot q07011的残基24
‑
45)、结构域2(残基46
‑
86)、结构域3(87
‑
118)和结构域4(残基119
‑
159)的单独或组合的氨基酸序列。
[0028]
如本文所使用,术语“变体”涉及包含突变的蛋白质或多肽的衍生物,所述突变例如通过氨基酸序列或核苷酸序列的置换、缺失、插入和/或化学修饰进行。在一些实施方案中,这种突变和/或化学修饰不会减少蛋白或肽的功能。这种置换可以是保守的,即氨基酸残基被替代为化学相似的氨基酸残基。保守置换的实例为以下组的成员之间的替代:1)丙氨酸、丝氨酸、苏氨酸和缬氨酸;2)天冬氨酸、谷氨酸、谷氨酰胺、天冬酰胺和组氨酸;
[0029]
3)精氨酸、赖氨酸、谷氨酰胺、天冬酰胺和组氨酸;4)异亮氨酸、亮氨酸、甲硫氨酸、缬氨酸、丙氨酸,苯丙氨酸,苏氨酸和脯氨酸;和5)异亮氨酸、亮氨酸、甲硫氨酸、苯丙氨酸、酪氨酸和色氨酸。这种变体包括蛋白或多肽,其中一个或多个氨基酸被它们各自的d
‑
立体异构体或除天然存在的20种氨基酸外的氨基酸(比如,例如,鸟氨酸、羟脯氨酸、瓜氨酸、高丝氨酸、羟赖氨酸、戊氨酸)置换。这种变体还包括,例如,在n
‑
和/或c
‑
末端添加或缺失一个或多个氨基酸残基的蛋白或多肽。一般而言,变体与天然序列蛋白或多肽具有至少约50%、60%、70%、75%、80%、85%、90%、92%、95%或至少约98%的氨基酸序列同一性。变体优选保留了生物活性,如结合其所源自的蛋白或多肽的相同靶标。
[0030]
如本文关于本发明的融合蛋白的相应蛋白配体cd137或gpc3所使用的术语“变体”涉及分别与cd137或gpc3(野生型cd137或gpc3,比如如本文所述的以uniprot q07011保存的cd137或以uniprot p51654保存的gpc3)天然序列相比具有一个或多个(比如1、2、3、4、5、6、7、8、9、10、12、14、16、18、20、22、24、26、28、30、40、50、60、70、80或更多个)氨基酸置换、缺
失和/或插入的cd137或gpc3或其片段。cd137变体或gpc3变体与野生型cd137或gpc3分别具有优选地至少50%、60%、70%、80%、85%、90%或95%的氨基酸同一性。本文所述的cd137变体或gpc3变体保留了结合本发明公开的对cd137和gpc3具有特异性的融合蛋白的能力。
[0031]
如本文关于脂质运载蛋白突变蛋白所使用的术语“变体”涉及本发明的脂质运载蛋白突变蛋白或其片段,其中其序列具有包括置换、缺失和插入的突变和/或化学修饰。本文所述的脂质运载蛋白突变蛋白的变体保留了该变体所源自的脂质运载蛋白突变蛋白的生物活性,如结合cd137的生物活性。一般而言,脂质运载蛋白突变蛋白的变体与其所源自的脂质运载蛋白突变蛋白具有至少约50%、60%、70%、75%、80%、85%、90%、92%、95%、98%的氨基酸序列同一性。
[0032]
如本文所使用,术语“诱变”是指向多核苷酸或氨基酸序列中引入突变。优选地,在实验条件下引入突变,以使得在蛋白或多肽序列的给定位置处的天然存在的氨基酸可被改变,例如被至少一个氨基酸置换。术语“诱变”还包括通过缺失或插入一个或多个氨基酸而(另外的)改变序列区段的长度。因此,以下情况在本发明的范围内:例如,一个在选定序列位置处的氨基酸被三个氨基酸的延伸段(stretch)替代,从而相比于天然蛋白或多肽氨基酸序列的相应区段的长度,导致两个氨基酸残基的添加。这样的插入或缺失可以彼此独立地引入在本发明中可以进行诱变的任何序列区段中。在本发明的一个示例性实施方案中,可以将插入引入对应于天然序列脂质运载蛋白的ab环的氨基酸序列区段中(参见以全文引用并入本文的国际专利公开文本no.wo 2005/019256)。
[0033]
如本文所使用,术语“随机诱变”意指无预定的突变(氨基酸的改变)存在于某个序列位置处,而是至少两个氨基酸可以在诱变期间以某概率掺入在预限定的序列位置处。
[0034]
如本文所使用,术语“序列同一性”或“同一性”是衡量序列的相似性或关系的序列特性。如本发明所使用的术语“序列同一性”或“同一性”意指在本发明的蛋白或多肽序列与所讨论的序列(同源性)比对之后,相对于这两个序列中较长一个的残基数量的配对相同残基的百分比。通过将相同氨基酸残基的数量除以残基总数再使结果乘以100来量度序列同一性。
[0035]
如本文所使用,术语“序列同源性”或“同源性”是其一般含义,并且同源氨基酸包括相同氨基酸以及认为是在本发明的蛋白或多肽(如本发明的任意融合蛋白或脂质运载蛋白突变蛋白)线性氨基酸序列中的等同位置处的保守置换的氨基酸。
[0036]
技术人员可识别可用的计算机程序,例如blast(altschul等,nucleic acids res,1997)、blast2(altschul等,j mol biol,1990)和smith
‑
waterman(smith和waterman,j mol biol,1981)以便采用标准参数测定序列同源性或序列同一性。在本文中可以采用例如程序blastp,2.2.5版(2002年11月16日)(altschul等,nucleic acids res,1997)测定序列同源性或序列同一性百分比。在本实施方案中,同源性百分比基于包括前肽序列的完整蛋白或多肽序列比对(矩阵:blosum 62;间隙罚分:11.1;截止值设置为10
‑3),优选地在配对比较中使用野生型蛋白骨架作为参照。其计算为作为blastp程序输出的结果表示的“阳性”(同源氨基酸)数除以程序选定的用于比对的氨基酸总数的百分比。
[0037]
具体而言,为了确定脂质运载蛋白突变蛋白氨基酸序列的氨基酸残基是否与对应于野生型脂质运载蛋白氨基酸序列中的某一位置的野生型脂质运载蛋白不同,技术人员可利用本领域熟知的手段和方法,如手动地或通过使用诸如blast 2.0(其代表基本局部比对
搜索工具)或clustalw或任意适用于产生序列比对的其它合适程序的计算机程序进行比对。因此,脂质运载蛋白的野生型序列可作为“受试序列”或“参照序列”,而本文所述的与野生型脂质运载蛋白不同的脂质运载蛋白突变蛋白的氨基酸序列作为“查询序列”。本文中术语“野生型序列”、“参照序列”和“受试序列”可互换使用。优选地,脂质运载蛋白的野生型序列是示于seq id no:1的htlc序列或示于seq id no:2的hngal序列。
[0038]“间隙”是添加或缺失氨基酸所导致的比对中的空间。因此,两份完全相同的序列具有100%的同一性,但较不高度保守且具有缺失、添加或替换的序列可能具有较低程度的序列同一性。
[0039]
如本文所使用,术语“位置”意指本文描述的氨基酸序列中的氨基酸的位置或本文描述的核酸序列中的核苷酸的位置。要理解的是,如本文中在一种或多种脂质运载蛋白突变蛋白氨基酸序列位置的上下文中使用的术语“对应”或“相应”,相应位置不仅由前面的核苷酸或氨基酸的数量决定。因此,由于在(突变体或野生型)脂质运载蛋白的其它位置处的氨基酸缺失或添加,根据本发明的给定氨基酸的绝对位置可能与相应位置不同。类似地,由于在突变蛋白或野生型脂质运载蛋白5
’‑
非翻译区(utr)(包括启动子和/或任何其它调节序列或基因(包括外显子和内含子))的其它位置处的核苷酸缺失或添加,根据本发明的给定核苷酸的绝对位置可能与相应位置不同。
[0040]
根据本发明的“相应位置”可以是在根据本发明的配对或多序列比对中与其所对应的序列位置相匹配的序列位置。对于根据本发明的“相应位置”,优选地理解,核苷酸或氨基酸的绝对位置可以不同于相邻的核苷酸或氨基酸,但是所述相同的一个或多个“相应位置”仍可包含可已被交换、缺失或添加的所述相邻核苷酸或氨基酸。
[0041]
此外,对于基于根据本发明的参照序列的脂质运载蛋白突变蛋白中的相应位置,优选地理解,脂质运载蛋白突变蛋白的核苷酸或氨基酸的位置在结构上可对应于参照脂质运载蛋白(野生型脂质运载蛋白)或另一脂质运载蛋白突变蛋白中的其它位置处的位置,尽管这些位置在绝对位置数字方面可能不同,如技术人员鉴于脂质运载蛋白之间高度保守的整体折叠形式所理解地。
[0042]
如本文可互换使用的,术语“缀合(conjugate/conjugation)”、“融合(fuse/fusion)”或“连接”是指通过包括但不限于基因融合、化学缀合、通过连接子或交联试剂偶联和非共价联合的手段,经由全部形式的共价或非共价连结(linkage)将两个或更多个亚基连接在一起。
[0043]
如本文所使用的“融合多肽”或“融合蛋白”是指包含两个或更多个亚基的多肽或蛋白。在一些实施方案中,本文所述的融合蛋白包含两个或更多个亚基,这些亚基中至少一个能够特异性结合cd137,和另一个亚基能够特异性结合gpc3。在该融合蛋白中,这些亚基可通过共价或非共价键连接。优选地,所述融合蛋白是两个或更多个亚基之间的翻译融合物。该翻译融合物可以通过使一个亚基的编码序列在与另一个亚基的编码序列的阅读框内基因工程化产生。两个亚基均可以被编码连接子的核苷酸序列散布(interspersed)。然而,本发明的融合蛋白的亚基也可通过化学缀合连接。典型地,形成融合蛋白的亚基彼此之间连接,一个亚基的c
‑
末端与另一个亚基的n
‑
末端,或一个亚基的c
‑
末端与另一个亚基的c
‑
末端,或一个亚基的n
‑
末端与另一个亚基的n
‑
末端,或一个亚基的n
‑
末端与另一个亚基的c
‑
末端连接。融合蛋白的亚基可以以任何顺序连接,并可包括任何组成亚基中的一个以上。
如果一个或多个亚基是由多于一条多肽链组成的蛋白(复合物)的一部分,那么术语“融合蛋白”还可指包含融合的序列以及该蛋白(复合物)的全部其它多肽链的蛋白。作为一个示例性实例,在全长免疫球蛋白经由该免疫球蛋白的重链或轻链与脂质运载蛋白突变蛋白融合的情况下,术语“融合蛋白”可以指包含脂质运载蛋白突变蛋白和该免疫球蛋白的重链或轻链的单一多肽链。术语“融合蛋白”也可以指完整的免疫球蛋白(轻链和重链)和融合至其重链和/或轻链中的一个或两个上的脂质运载蛋白突变蛋白。
[0044]
如本文所使用,术语本文公开的融合蛋白的“亚基”是指单一蛋白或独立的多肽链,其自身可形成稳定的折叠结构并定义一种提供对靶标的结合基序的独特功能。在一些实施方案中,本发明优选的亚基是脂质运载蛋白突变蛋白。在一些其它实施方案中,本发明优选的亚基是全长免疫球蛋白或其抗原结合结构域。
[0045]
可由本发明的融合蛋白包含的“连接子”将两个或更多个如本文所述融合蛋白的亚基连接在一起。所述连结(linkage)可以是共价或非共价的。一种优选的共价连结(linkage)是通过肽键,比如氨基酸之间的肽键。一种优选的连接子是肽连接子。因此,在优选的实施方案中,所述连接子包含一个或多个氨基酸,比如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20或更多个氨基酸。本文描述了优选的肽连接子,包括甘氨酸
‑
丝氨酸(gs)连接子、糖基化的gs连接子和脯氨酸
‑
丙氨酸
‑
丝氨酸聚合物(pas)连接子。在一些优选的实施方案中,gs连接子是如seq id no:13所述的(g4s)3,将其用于将融合蛋白的亚基连接在一起。其它优选的连接子包括化学连接子。
[0046]
如本文所使用,术语“白蛋白”包括所有的哺乳动物白蛋白,比如人血清白蛋白或牛血清白蛋白或大鼠血清白蛋白。
[0047]
如本文所使用,术语“有机分子”或“小有机分子”表示这样的有机分子,其包含至少两个碳原子,但是优选地包含不超过7或12个可旋转碳键,具有100至2,000道尔顿、优选地100至1,000道尔顿范围的分子量,且任选地包含一个或两个金属原子。
[0048]
将“样品”定义为从任何受试者采集的生物样品。生物样品包括但不限于血液、血清、尿液、粪便、精液或组织,包括肿瘤组织。
[0049]“受试者”是脊椎动物,优选是哺乳动物,更优选是人。如本文所使用的术语“哺乳动物”是指归类为哺乳动物的任何动物,包括但不限于人、家畜和农用动物以及动物园、运动或宠物动物,比如绵羊、狗、马、猫、牛、大鼠、猪、诸如猕猴(cynomolgous monkey)的猿,仅举几个示例性实例。优选地,本文所使用的“哺乳动物”是人。
[0050]“有效量”是足够产生有益或者所希望的结果的量。可以在一次或多次个别施用或给药中施用有效量。
[0051]
如本文所使用,“抗体”包括整个抗体或其任何抗原结合片段(即“抗原结合部分”)或单链。整个抗体是指包含通过二硫键互相连接的至少两个重链(hc)和两个轻链(lc)的糖蛋白。每个重链由重链可变结构域(v
h
或hcvr)和重链恒定区(c
h
)组成。重链恒定区由三个结构域c
h1
、c
h2
和c
h3
组成。每个轻链由轻链可变结构域(v
l
或lcvr)和轻链恒定区(c
l
)组成。轻链恒定区由一个结构域c
l
组成。v
h
与v
l
区可进一步细分成高可变区,称作互补决定区(cdr),其间散布更保守的区域,称作框架区(fr)。各v
h
和v
l
由三个cdr和四个fr组成,从氨基末端至羧基末端按下列顺序排列:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。重链和轻链的可变区含有与抗原(例如,gpc3)相互作用的结合结构域。抗体的恒定区可任意地介导免疫球蛋白与宿主
组织或因子的结合,包括免疫系统的各种细胞(如,效应细胞)及典型补体系统的第一组分(c1q)。
[0052]
如本文所使用,抗体的“抗原结合片段”是指抗体的保留了特异性结合抗原(如gpc3)的能力的一个或多个片段。研究表明抗体的抗原结合功能可以通过全长抗体的片段进行。涵盖在术语抗体的“抗原结合片段”中的结合片段的实例包括(i)由v
h
、v
l
、c
l
、及c
h1
结构域组成的fab片段;(ii)包含由在铰链区的二硫桥连接的两个fab片段的f(ab’)2片段;(iii)由v
h
、v
l
、c
l
、及c
h1
结构域和c
h1
和c
h2
结构域之间的区域组成的fab’片段;(iv)由v
h
和c
h1
结构域组成的fd片段;(v)由抗体单臂的v
h
和v
l
结构域组成的单链fv片段;(vi)由v
h
结构域组成的dab片段(ward等,nature,1989);和(vii)分离的互补决定区(cdr)或两个或更多个分离的cdr的组合,其可任选地通过合成连接子连接;(viii)包含在同一多肽链中采用短连接子连接的v
h
和v
l
的“双抗体”(参见如专利文件ep404,097;wo 93/11161;和holliger等,proc natl acad sci u s a,1993);(ix)仅含有v
h
或v
l
的“结构域抗体片段”,其中在一些情况下,两个或更多个v
h
区为共价连接的。
[0053]
抗体可以是多克隆的或单克隆的;异种的、同种异体的或同系的;或它们的修饰形式(如,人源化的、嵌合的或多特异性的)。抗体也可能是完全人类的。
[0054]
如本文所使用,“框架”或“fr”是指可变结构域残基而非高可变区(cdr)残基。
[0055]“片段可结晶区”或“fc区”是指免疫球蛋白重链的c
‑
末端区域,包括天然序列fc区和变体fc区。尽管免疫球蛋白重链的fc区的边界可能改变,但人igg重链fc区通常被定义为从cys226或从pro230位置的氨基酸残基(根据kabat的eu索引编号)到其羧基末端的区段(johnson和wu,nucleic acids res,2000)。可以,例如,在抗体的生产或纯化过程中或通过重组工程化编码抗体重链的核酸,移除fc区的c
‑
末端赖氨酸(根据kabat的eu索引编号,残基447)。因此,完整抗体的组合物可包含移除了所有k447残基的抗体群、无k447残基移除的抗体群及具有有和无k447残基的抗体混合物的抗体群。在本发明抗体中使用的合适的天然序列fc区包括人igg1、igg2(igg2a、igg2b)、igg3和igg4。
[0056]“fc”受体或“fcr”是指结合抗体fc区的受体。
[0057]
如本文所使用,“分离的抗体”是指实质上脱离其自然环境的抗体。举例而言,分离的抗体实质上不含来自其所源自的细胞或组织源的细胞材料和其它蛋白。“分离的抗体”进一步是指实质上不含其它具有不同抗原特异性的抗体的抗体。在本文中,特异性结合gpc3的分离的抗体实质上不含特异性结合gpc3以外的抗原的抗体。然而,特异性结合gpc3的分离的抗体可具有与其它抗原的交叉反应性,所述其它抗原比如来自其它物种的gpc3分子。
[0058]
如本文所使用,“单克隆抗体”是指单一分子组合物的抗体分子制备物。单克隆抗体组合物对特定表位展示出单一的结合特异性和亲和力。
[0059]
如本文所使用,“人源化抗体”是指由源自除人之外的哺乳动物的抗体cdr以及人抗体或源自人抗体的fr区和恒定区组成的抗体。在一些实施方案中,人源化的抗体包括具有可变区氨基酸序列的可变结构域,如采用如ehrenmann等,(2010)所述的immunogenetics information system(imgt)domaingapalign工具评估,从整体上分析,所述可变区氨基酸序列更接近于人而非其它物种。在一些实施方案中,由于降低的抗原性,人源化抗体可作为治疗剂中的有效成分。如本文所使用的术语“治疗剂”或“治疗活性剂”是指治疗有用的试剂。治疗剂可以是任何用于预防、改善或治疗疾病、生理状态、症状或用于疾病、生理状态、
症状的评估或诊断的试剂。
[0060]
如本文所使用,“人抗体”包括这样的抗体,该种抗体具有其中框架区和cdr区均源自人种系免疫球蛋白序列的可变区。此外,若抗体包含恒定区,则该恒定区也源自人种系免疫球蛋白序列。本发明的人抗体可包括并非由人种系免疫球蛋白序列编码的氨基酸残基(如通过体外随机或定点诱变或通过体内体细胞突变而引入的突变)。然而,如本文所使用,术语“人抗体”不旨在包括这种抗体,该种抗体中源自另一哺乳动物物种种系(比如小鼠)的cdr序列被移植至人的框架序列。
iii.附图说明
[0061]
图1:提供了本技术中描述的代表性融合蛋白的设计概述,所述融合蛋白是对靶标cd137和gpc3双特异性的。基于对gpc3特异性的抗体(如一种抗体,其重链由seq id no:81提供,或包含seq id no:78的重链可变结构域,或包含gytftdye(hcdr1,seq id no:72)、ldpktgdt(hcdr2,seq id no:73)和trfysyty(hcdr3;seq id no:74)的cdr序列,以及其轻链由seq id no:82提供,或包含seq id no:79的轻链可变结构域,或包含qslvhsnrnty(lcdr1,seq id no:75)、kvs(lcdr2,seq id no:76)和sqnthvppt(lcdr3;seq id no:77)的cdr序列)和对cd137特异性的一种或多种脂质运载蛋白突变蛋白(如seq id no:40的脂质运载蛋白突变蛋白或与seq id no:49具有97%序列同一性并命名为cd137ac1的脂质运载蛋白突变蛋白)制备代表性融合蛋白。如图1a
‑
1i所示,将一种或多种脂质运载蛋白突变蛋白遗传地融合至gpc3特异性抗体的重链或轻链的c
‑
和/或n
‑
末端,得到融合蛋白,如seq id nos:87和82、seq id nos:88和82、seq id nos:81和89、seq id nos:81和90以及cd137ac1
‑
融合1、cd137ac1
‑
融合2、cd137ac1
‑
融合3、cd137ac1
‑
融合4、cd137ac1
‑
融合5、cd137ac1
‑
融合6和cd137ac1
‑
融合7(与seq id nos:91和82、seq id nos:92和82、seq id nos:81和93、seq id nos:81和94、seq id nos:95和82或seq id nos:96和82具有97%序列同一性的融合蛋白)。另外,所得的融合蛋白可以是针对cd137二价的(如图1a
‑
1d所示),或针对cd137四价的(如图1e
‑
1h所示)或针对cd137具有甚至更高的价(如图1i所示)。通过将一个或多个gpc
‑
3特异性脂质运载蛋白突变蛋白或cd137特异性脂质运载蛋白突变蛋白经由肽连接子融合至如本文所述提供的抗体的fc区的c
‑
末端来产生另外的单特异性融合蛋白(如图1j
‑
1k所示)。如seq id no:97和seq id no:98提供了所得到的单特异性融合蛋白。
[0062]
图2:示出了elisa实验的结果,其中如实施例3中所述测定了代表性融合蛋白与人gpc3(图2a)、猕猴gpc3(图2b)和人cd137(图2c)的结合。将gpc3或c
‑
末端his
‑
标记的cd137涂覆在微量滴定板上,并用100nm的最高浓度开始滴定测试的试剂。分别通过抗
‑
人igg fc
‑
辣根过氧化物酶(hrp)或抗
‑
ngal
‑
hrp检测研究中的结合的试剂。使用1:1结合模型拟合数据,其中ec
50
值和最大信号作为自由参数,斜率固定为1。所得到的ec
50
值在表4中提供。
[0063]
图3:示出了示例性elisa实验的结果,其中如实施例4中所述测定了代表性融合蛋白同时结合两种靶标gpc3和cd137的能力。将重组hugpc3(图3a)或hucd137
‑
his(图3b)涂覆在微量滴定板上,然后是融合蛋白的滴定。随后,分别加入恒定浓度的生物素化的hucd137
‑
his(图3a)或生物素化的hugpc3(图3b),其通过extravidin
‑
peroxidase检测。使用1:1结合模型拟合数据,其中ec
50
值和最大信号作为自由参数,斜率固定为一(unity)。所得到的ec
50
值在表3中提供。
[0064]
图4:示出了融合蛋白的靶标结合的评估结果,其如实施例6所述采用表达人cd137的cho细胞(图4a)以及表达人gpc3的sk
‑
hep1细胞(图4b)通过流式细胞术进行。当采用模拟(mock)转染的细胞时,未观察到结合。将荧光强度的几何平均值用于计算ec
50
值,所述ec
50
值在表6中提供。
[0065]
图5:示出了采用流式细胞术评估的融合蛋白与gpc3
‑
阳性肿瘤细胞的结合。如实施例7所述,采用不同的融合蛋白或对照温育具有不同gpc3表达水平(高度至中度表达:hepg2(图5a)>hep3b(图5b)>mkn
‑
45(图5c))的肿瘤细胞系和gpc3
‑
阴性细胞系nci
‑
n87(图5d),并将相应的结合亲和力(ec
50
)汇总于表7。
[0066]
图6:示出了采用cd137生物测定评估的代表性融合蛋白以gpc3靶标依赖性方式共刺激t细胞活化的潜力。在各种浓度的融合蛋白或对照存在下,将nfκb
‑
luc2/cd137 jurkat细胞与表达gpc3的肿瘤细胞系(高度至中度表达:hepg2>hep3b>mkn
‑
45,gpc3阴性:nci
‑
n87,分别对应图6a、6b、6c和6d)共培养。4小时后,加入荧光素酶测定试剂并测量发光信号。进行四参数逻辑曲线分析以计算ec
50
值(参见表7)。融合蛋白在gpc3充足(图6a和6b)的情况下共刺激t细胞活化,而在gpc3不足或不存在gpc3的情况下不共刺激t细胞活化(图6c与6d)。相对地,在不存在表达gpc3的细胞的情况下和在不存在任何肿瘤细胞的情况下,无论gpc3表达水平如何,参照抗
‑
cd137 mab(seq id nos:26和27)均展示出类似的活化。
[0067]
图7:证明了在gpc3存在下代表性融合蛋白共刺激t细胞活化的能力。平行测试了包含在融合蛋白中的gpc3抗体(seq id nos:81和82)、gpc3特异性脂质运载蛋白突变蛋白(fc融合)(seq id no:97)、先前已知的cd137/gpc3双特异性融合蛋白(seq id no:83)和同型(isotype)对照(seq id nos:24和25)。将用人gpc3转染(图7a)或模拟转染(人gpc3阴性,图7b)的sk
‑
hep1细胞或表达gpc3(图7c)的hep
‑
g2肿瘤细胞系接种到抗
‑
人抗
‑
cd3涂覆的板中。加入pan t细胞以及不同浓度的测试分子并温育3天。如实施例9所述,通过基于电化学发光的测定来测定上清液中分泌的il
‑
2的水平。融合蛋白seq id nos:87和82仅在gpc3存在下诱导il
‑
2分泌的强剂量依赖性增加,该种增加比先前已知的cd137/gpc3双特异性融合蛋白seq id no:83更强。
[0068]
图8:示出了代表性融合蛋白以gpc3靶标依赖性方式共刺激t细胞活化的能力。将表达不同gpc3水平(高度至中度表达:hepg2>hep3b>mkn
‑
45,分别对应图8a、8b和8c;gpc3阴性:nci
‑
n87,图8d)的不同肿瘤细胞系接种至涂覆了抗
‑
人cd3的板中。加入pan t细胞和不同浓度的融合蛋白和单一构建块并温育3天。如实施例10所述,通过基于电化学发光的测定来测定分泌的il
‑
2的水平。融合蛋白能够以gpc3依赖性方式增加il
‑
2分泌。相对地,由平行测试的参照cd137抗体(seq id nos:26和27)诱导的il
‑
2分泌不是gpc3依赖性的。
[0069]
图9:示出了在基于阻抗的t细胞杀伤测定中证明的代表性融合蛋白活化cd137共刺激信号传导通路并诱导t细胞介导的表达gpc3的肿瘤细胞的细胞溶解的能力。将表达gpc3的hepg2细胞或gpc3阴性nci
‑
n87细胞接种并粘附在电子微量滴定板上,然后添加抗
‑
cd3抗体、测试分子和非粘附性cd8 t细胞。如实施例11中所述,作为无单位“细胞指数(ci)”参数,每15分钟测量一次阻抗,持续3天。与先前已知的cd137/gpc3双特异性融合蛋白seq id no:83相比,融合蛋白seq id nos:87和82能够以更高水平以gpc3依赖的方式活化cd137通路并诱导剂量依赖性t细胞介导的表达gpc3的肿瘤细胞的裂解。
[0070]
图10:示出了在人源化小鼠肿瘤模型中采用0.5、5和20mg/kg的示例性融合蛋白、
等摩尔浓度(0.39和3.9mg/kg)的包含在该融合蛋白中的gpc3抗体、等摩尔浓度(3.9mg/kg)参照cd137抗体或溶媒对照(pbs)治疗后,随时间变化的肿瘤体积,如实施例12中所述。向nog小鼠皮下移植hepg2肿瘤,该肿瘤被允许长至80
‑
100mm3的大小。然后将小鼠随机分配至治疗(对照)组并静脉接受5
×
106个新鲜人pbmc,并在第1、8和15天以所示的剂量腹腔注射测试分子。每3至4天记录肿瘤生长。将数据显示为具有四分位距误差线的中位数。虚线表示与前几天相比,每组减少的动物数。在较高剂量水平(5和20mg/kg)下,融合蛋白在整个研究过程中完全抑制了肿瘤的生长,而在较低浓度(分别为0.5或0.39mg/kg)下具有剂量依赖性,但对肿瘤生长的影响较小。
[0071]
图11:提供了与两种先前已知的cd137/gpc3双特异性融合蛋白(seq id no:83和seq id no:84)相比,小鼠中示例性融合蛋白和该融合蛋白中包含的gpc3抗体的药代动力学分析结果,如实施例13所述。给雄性cd
‑
1小鼠(每个时间点2只小鼠)以2mg/kg或10mg/kg的剂量静脉内注射融合蛋白。使用通过靶标gpc3和抗
‑
人fc或抗
‑
ngal检测完整分子的夹心elisa检测了药物水平。与先前已知的cd137/gpc3双特异性融合蛋白(seq id no:83和seq id no:84)相比,本发明的融合蛋白(seq id nos:87和82)显示出强烈增强的药代动力学行为和延长的半衰期。
[0072]
iv.发明详述
[0073]
如本文所述,本发明涵盖这样的认知,即双价cd137结合剂(比如抗体)自身可能不足以使cd137在t细胞或nk细胞上聚集并导致有效的活化。此外,最新围绕tnfr家族成员的工作表明了抗
‑
tnfr抗体的机制,通过该机制所述抗体通过其fc区与fc
‑
γ受体相互作用(从而接合活化的表达fc
‑
γ受体的免疫细胞)并促进随后的抗肿瘤活性(bulliard等,immunol cell biol,2014;bulliard等,j exp med,2013)。因此,这表明,取决于不是选择性地定位于肿瘤而是分布在全身的fc
‑
γ受体阳性细胞的丰度,抗
‑
cd137抗体可能会触发cd137聚集。因此,抗
‑
cd137单一疗法的疗效和靶标特异性可能是令人担忧的。事实上,一些处于临床研究中的抗
‑
cd137疗法(比如urelumab和utomilumab)在低剂量时显示出令人失望的疗效结果和/或在高剂量或有效剂量时显示出毒性(bulliard等,immunol cell biol,2014;bulliard等,j exp med,2013)。因此,对既有效又安全的cd137靶向疗法的需求尚未得到满足。理想的cd137靶向剂应导致cd137聚集,并以肿瘤定位的方式在肿瘤浸润淋巴细胞上实现cd137聚集。如本文所述,为了获得这种cd137靶向剂,可以设计双特异性剂以在一端靶向cd137而在另一端靶向差异表达的肿瘤靶标。
[0074]
本发明涵盖这样的认知,即单特异性gpc3
‑
靶向剂可能不足以有效到治愈诸如hcc的肿瘤,并且能够将免疫细胞募集到肿瘤部位和/或直接抑制癌细胞增殖和/或存活的抗
‑
gpc3剂的抗肿瘤活性可能是相关的。因此,对这样的靶向gpc3的疗法的需求尚未得到满足,该种疗法具有相加的抗肿瘤作用并具有提供比单独的单特异性gpc3靶向剂更强的抗肿瘤活性的能力。
[0075]
除了别的之外,本发明提供通过具有cd137结合特异性和gpc3结合特异性的融合蛋白同时接合cd137和gpc3的新方法。为了接合cd137和gpc3,在如wo2016/184882中描述了抗
‑
gpc3抗体
‑
cd137特异性脂质运载蛋白突变蛋白的融合蛋白。然而,仍然需要这样的融合蛋白,其诱导gpc3依赖性t细胞杀伤/免疫应答从而以高的效率和选择性抑制表达gpc3的肿瘤生长。本发明的不同方面提供了融合蛋白,其通过将cd137
‑
阳性t细胞与肿瘤微环境中表
达的gpc3桥接来促进cd137聚集,由此将cd137诱导的t细胞活化和扩增与肿瘤细胞的抗
‑
gpc3介导的细胞毒性杀伤相结合。本发明还提供了这样的融合蛋白,其在一个分子中提供组合疗法的潜力并同时允许在肿瘤微环境中局部诱导抗原特异性t细胞,潜在地降低外周毒性。在这些方面,与单体的cd137或gpc3疗法相比,本发明的融合蛋白可提供增强的il
‑
2产生、免疫应答、t细胞介导的细胞溶解和/或抗肿瘤作用。
[0076]
另外,由于已经将猕猴广泛用于开发包括新生物制剂在内的新疗法的药代动力学或药物安全研究中,并且此类研究可能进一步是监管批准的必要先决条件,因此具有含gpc3结合部分的融合蛋白是有利的,该gpc3结合部分与人和猕猴gpc3交叉反应。先前未曾描述过此类含具有所述交叉反应性特征的gpc3结合部分的融合蛋白。
[0077]
此外,如本文所提供的,由于双特异性或多特异性分子可能在一些性质(包括靶向亲和力和特异性、稳定性、血液中的药代动力学和作用机制)方面与其构建块不同(spiess等,mol immunol,2015;sedykh等,drug des devel ther,2018),因此在一些实施方案中提供了构建块的仔细选择以及制造和其它实践的优化,以产生高质量的临床候选物。例如,双特异性或多特异性分子可能会部分或全部丧失靶标结合亲和力和构建块的特异性,从而导致不希望的脱靶结合。脱靶结合可进一步影响此类用于治疗用途的双特异性或多特异性分子的药代动力学、组织分布、功效和毒性。特别是,较差的药代动力学特征(profile)会导致难以达到治疗功效所需的剂量分布和患者不依从性(alavijeh和palmer,idrugs,2004),并且良好的药代动力学允许降低剂量,使皮下制剂得以开发和cog得以降低,并将给药间隔延长至比如每周一次、每2周一次、每3周一次或每4周一次(ryman和meibohm,cpt pharmacometrics syst pharmacol,2017)。药代动力学性质也受等电点(pi)的影响。pi的增加可导致血液清除率增加和组织滞留增加,半衰期更短,而较低的pi可减少组织摄取并导致半衰期更长。尽管关于蛋白质清除率和pi之间的相关性的观察结果可能相互矛盾,但治疗性抗体通常具有略高于生理ph7.4的pi值,因为大多数细胞表面带负电荷。对此,本发明的不同方面提供了这样的对cd137和gpc3双特异性的融合蛋白,其具有高亲和力和特异性、增强的稳定性、合适的pi以及良好的药代动力学性质。
[0078]
先前未曾描述过此类具有与本发明提供的用途相关的这些特征的融合蛋白。与本文提供的融合蛋白相对的是,在先已知的靶向cd137和gpc3的融合蛋白受累于以下的一种或多种:pk差,脱靶结合的程度无法接受,如免疫系统的非特异性(如,gpc3非依赖性)活化的程度无法接受,和/或介导t细胞活化、增殖和/或浸润的能力降低或退化。
[0079]
a.本发明的对cd137和gpc3特异性的示例性融合蛋白。
[0080]
在一些实施方案中,提供的融合蛋白含有至少两个任何顺序的亚基:(1)包含对gpc3特异性的全长免疫球蛋白或其抗原结合结构域的第一亚基,和(2)包含对cd137特异性的脂质运载蛋白突变蛋白的第二亚基。
[0081]
在一些实施方案中,提供的融合蛋白包含至少两个亚基,其中第一亚基包含全长免疫球蛋白或其抗原结合结构域并且是对gpc3特异性的,和其中第二亚基包含脂质运载蛋白突变蛋白并且是对cd137特异性的,其中所述第二亚基任选地经由连接子以n
‑
末端连接至所述第一亚基的每条重链(hc)的c
‑
末端。
[0082]
在一些实施方案中,提供的融合蛋白包含至少两个亚基,其中第一亚基包含全长免疫球蛋白或其抗原结合结构域并且是对gpc3特异性的,和其中第二亚基包含脂质运载蛋
白突变蛋白并且是对cd137特异性的,其中所述第二亚基任选地经由连接子以c
‑
末端连接至所述第一亚基的每条hc的n
‑
末端。
[0083]
在一些实施方案中,提供的融合蛋白包含至少两个亚基,其中第一亚基包含全长免疫球蛋白或其抗原结合结构域并且是对gpc3特异性的,和其中第二亚基包含脂质运载蛋白突变蛋白并且是对cd137特异性的,其中所述第二亚基任选地经由连接子以n
‑
末端连接至所述第一亚基的每条轻链(lc)的c
‑
末端。
[0084]
在一些实施方案中,提供的融合蛋白包含至少两个亚基,其中第一亚基包含全长免疫球蛋白或其抗原结合结构域并且是对gpc3特异性的,和其中第二亚基包含脂质运载蛋白突变蛋白并且是对cd137特异性的,其中所述第二亚基任选地经由连接子以c
‑
末端连接至所述第一亚基的每条lc的n
‑
末端。
[0085]
在一些实施方案中,提供的融合蛋白包含至少两个亚基,其中第一亚基包含全长免疫球蛋白或其抗原结合结构域并且是对gpc3特异性的,和其中第二亚基包含脂质运载蛋白突变蛋白并且是对cd137特异性的,其中所述第二亚基任选地经由连接子以n
‑
末端连接至所述第一亚基的每个重链恒定区(ch)的c
‑
末端。
[0086]
在一些实施方案中,提供的融合蛋白包含至少两个亚基,其中第一亚基包含全长免疫球蛋白或其抗原结合结构域并且是对gpc3特异性的,和其中第二亚基包含脂质运载蛋白突变蛋白并且是对cd137特异性的,其中所述第二亚基任选地经由连接子以n
‑
末端连接至所述第一亚基的每个轻链恒定区(cl)的c
‑
末端。
[0087]
在一些实施方案中,提供的融合蛋白还包含至少一个另外的亚基,例如,第三亚基。例如,融合蛋白可含有对cd137特异性的第三亚基。在一些实施方案中,第三亚基可以是或包含对cd137特异性的脂质运载蛋白突变蛋白。例如,可以将两个脂质运载蛋白突变蛋白融合至第一免疫球蛋白亚基,一个位于免疫球蛋白的c
‑
末端和一个位于免疫球蛋白的n
‑
末端。在一些实施方案中,可将脂质运载蛋白突变蛋白融合至免疫球蛋白的重链或轻链。
[0088]
在一些实施方案中,提供的融合蛋白可包含一个或多个另外的亚基(如第四、第五或第六亚基)。
[0089]
在一些实施方案中,至少一个亚基可在其n
‑
末端和/或其c
‑
末端融合至另一个亚基。
[0090]
在一些实施方案中,至少一个亚基可以经由连接子与另一个亚基连接。在一些另外的实施方案中,连接子为肽连接子,例如,非结构性的甘氨酸
‑
丝氨酸(gs)连接子,糖基化的gs连接子或脯氨酸
‑
丙氨酸
‑
丝氨酸聚合物(pas)连接子。在一些实施方案中,gs连接子为如seq id no:13所示的(gly4ser)3连接子((g4s)3)。其它示例性连接子示于seq id nos:14
‑
23。在一些实施方案中,肽连接子可具有1至50个氨基酸,比如1、2、3、4、5、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45或50个氨基酸。例如,当第一亚基包含全长免疫球蛋白时,第二亚基可经由所述第二亚基的n
‑
末端与所述免疫球蛋白的重链恒定区(ch)的c
‑
末端之间的肽连接子连接。在一些其它实施方案中,第三亚基可经由第三亚基的n
‑
末端与所述免疫球蛋白的轻链恒定区(cl)的c
‑
末端之间的肽连接子连接。
[0091]
在一些实施方案中,可基本上如图1所示将一个亚基连接至另一个亚基。一般而言,一个亚基可在其n
‑
末端和/或其c
‑
末端融合至另一个亚基。例如,在一些实施方案中,脂质运载蛋白突变蛋白亚基可优选地经由肽键在其n
‑
末端和/或其c
‑
末端融合至免疫球蛋白
亚基。进一步举例而言,脂质运载蛋白突变蛋白亚基可在其n
‑
末端连接至免疫球蛋白亚基的重链结构域(hc)的c
‑
末端(图1a),脂质运载蛋白突变蛋白亚基可在其c
‑
末端连接至免疫球蛋白亚基的hc的n
‑
末端(图1c),脂质运载蛋白突变蛋白亚基可在其n
‑
末端连接至免疫球蛋白亚基的轻链(lc)的c
‑
末端(图1b),和/或脂质运载蛋白突变蛋白亚基可在其c
‑
末端连接至免疫球蛋白亚基的lc的n
‑
末端(图1d)。
[0092]
在一些实施方案中,脂质运载蛋白突变蛋白亚基可在其n
‑
末端和/或其c
‑
末端融合至免疫球蛋白片段。例如,在一些实施方案中,脂质运载蛋白突变蛋白亚基可优选经由肽连接子在其n
‑
末端连接至免疫球蛋白亚基的重链恒定区(ch)的c
‑
末端,或脂质运载蛋白突变蛋白亚基可优选经由肽连接子在其n
‑
末端连接至免疫球蛋白亚基的轻链恒定区(cl)的c
‑
末端。
[0093]
在一些实施方案中,当一个亚基包含全长免疫球蛋白时,第二亚基可在所述第二亚基的n
‑
末端与所述免疫球蛋白的重链恒定区(ch)的c
‑
末端之间连接。
[0094]
在一些实施方案中,第三亚基可在所述第三亚基的n
‑
末端与所述免疫球蛋白的轻链恒定区(cl)的c
‑
末端之间连接。
[0095]
在一些实施方案中,对于本发明的融合蛋白,其中至少一个亚基可为或包含全长免疫球蛋白,当融合蛋白同时接合cd137和gpc3时,可同时保留全长免疫球蛋白fc区对fc受体阳性细胞的fc功能。
[0096]
在一些实施方案中,其中所提供的融合蛋白的至少一个亚基可为或包含全长免疫球蛋白,可通过蛋白工程化降低或完全抑制全长免疫球蛋白fc区对fc受体阳性细胞的fc功能,而融合蛋白同时接合cd137和gpc3。在一些实施方案中,可以通过例如将igg1骨架转换为igg4而实现上述情况,因为已知相比于igg1,igg4显示降低的fc
‑
γ受体相互作用。在一些实施方案中,为了进一步降低与fc
‑
γ受体的残留结合,可向igg4骨架中引入诸如f234a和l235a的突变。在一些实施方案中,还可将s228p突变引入igg4骨架,以使igg4半抗体的交换最少(silva等,j biol chem,2015)。在一些实施方案中,可引入f234a和l235a突变以降低adcc和adcp(glaesner等,diabetes metab res rev,2010)和/或引入m428l和n434s突变或m252y、s254t和t256e突变以延长血清半衰期(dall'acqua等,j biol chem,2006;zalevsky等,nat biotechnol,2010)。在一些实施方案中,融合蛋白的免疫球蛋白重链中可存在另外的n297a突变以便移除天然糖基化基序。
[0097]
在一些实施方案中,本发明的融合蛋白中包括的免疫球蛋白的fc部分可有助于维持该融合蛋白的血清水平。例如,当fc部分结合至内皮细胞和吞噬细胞上的fc受体时,该融合蛋白可变得内化并循环回到血流中,从而提高其在体内的半衰期。
[0098]
一方面,本发明的融合蛋白以高亲和力结合cd137。另一方面,所提供的融合蛋白以高亲和力结合gpc3。在一些优选的实施方案中,所提供的融合蛋白同时结合cd137与gpc3。在一些实施方案中,同时结合至cd137和gpc3允许所提供的融合蛋白表现出持久的抗肿瘤或抗感染应答。
[0099]
在一些实施方案中,本发明的融合蛋白可具有约6.5或更高,比如约6.8或更高、约7.1或更高、约7.4或更高、约7.5或更高、约7.7或更高、约8.0或更高、约8.5或更高或约9.0或甚至更高的等电点(pi)。在一些实施方案中,本发明的融合蛋白具有比先前已知的包含seq id no:83的氨基酸序列的结合cd137和gpc3的融合蛋白更高的pi。
[0100]
在一些实施方案中,本发明的融合蛋白可能够以至多约2nm或甚至更低,比如约1.5nm或更低、约1nm或更低、约0.8nm或更低或约0.7nm或更低的k
d
值结合gpc3。在一些实施方案中,本发明的融合蛋白可能够以与包含在此类融合蛋白中的对gpc3特异性的免疫球蛋白(比如具有由seq id nos:81和82提供的重链和轻链的抗体)的k
d
值相当或更低的k
d
值结合gpc3。可以在例如表面等离子体共振(spr)测定中,比如基本上如实施例2所述的spr测定中,测量所提供的融合蛋白的k
d
值。
[0101]
在一些实施方案中,本发明的融合蛋白可能够以至多约1nm或甚至更低,比如约0.5nm或更低、约0.3nm或更低、约0.2nm或更低、约0.15nm或更低或约0.1nm或更低的ec
50
值结合gpc3。在一些实施方案中,本发明的融合蛋白可能够以与包含在特定融合蛋白中的对gpc3特异性的免疫球蛋白(比如具有由seq id nos:81和82提供的重链和轻链的抗体)的ec
50
值相当或更低的ec
50
值结合gpc3。可以在例如酶联免疫吸附试验(elisa)测定中,比如基本上如实施例3所述的elisa测定中,测量所提供的融合蛋白的ec
50
值。
[0102]
在一些实施方案中,本发明的融合蛋白可能够以至多约5nm或甚至更低,比如约3nm或更低、约2nm或更低、约1nm或更低、约0.5nm或更低、约0.2nm或更低或约0.1nm或更低的ec
50
值结合cd137。可以在例如elisa测定中,比如基本上如实施例3所述的elisa测定中,测量所提供的融合蛋白的ec
50
值。
[0103]
在一些实施方案中,本发明的融合蛋白可与猕猴gpc3交叉反应。在一些实施方案中,所提供的融合蛋白可能够以至多约2nm或甚至更低,比如约1.5nm或更低、约1nm或更低、约0.8nm或更低或约0.7nm或更低的k
d
值结合猕猴gpc3。在一些实施方案中,本发明的融合蛋白可能够以与包含在此类融合蛋白中的对gpc3特异性的免疫球蛋白(比如具有由seq id nos:81和82提供的重链和轻链的抗体)的k
d
值相当或更低的k
d
值结合猕猴gpc3。可以在例如spr测定中,比如基本上如实施例2所述的spr测定中,测量所提供的融合蛋白的k
d
值。在一些实施方案中,提供的融合蛋白可能够以至多约1nm或甚至更低,比如约0.5nm或更低、比如约0.2nm或更低、约0.1nm或更低的ec
50
值结合猕猴gpc3。可以在例如elisa测定中,比如基本上如实施例3所述的elisa测定中,测量所提供的融合蛋白的ec
50
值。
[0104]
在一些实施方案中,本发明的融合蛋白可能够同时结合cd137和gpc3。在一些实施方案中,所提供的融合蛋白可能够以至多约10nm或甚至更低,比如5nm或更低、3nm或更低、2nm或更低、1nm或更低或0.5nm或更低的ec
50
值同时结合cd137和gpc3。在一些其它实施方案中,所提供的融合蛋白可能够以至多约10nm或甚至更低,比如8nm或更低、5nm或更低、3nm或更低或2nm或更低的ec
50
值同时结合cd137和gpc3。可以在例如elisa测定中,比如基本上如实施例4所述的elisa测定中,测定所述同时结合。
[0105]
在一些实施方案中,本发明的融合蛋白可能够以至多约50nm或甚至更低,比如约30nm或甚至更低、约25nm或甚至更低、约20nm或更低、约15nm或更低、约10nm或更低、约5nm或更低、约3nm或更低或约1nm或甚至更低的ec
50
值结合细胞上表达的cd137。可以在例如基本上如实施例6所述的流式细胞术分析中测量所提供的融合蛋白的ec
50
值。表达cd137的细胞可以是例如用人cd137转染的cho细胞。
[0106]
在一些实施方案中,本发明的融合蛋白可能够以至多约50nm或甚至更低,比如约30nm或更低、约25nm或甚至更低、约20nm或更低、约15nm或更低、约10nm或更低、约5nm或更低、约3nm或更低或约1nm或甚至更低的ec
50
值结合细胞上表达的gpc3。可以在例如基本上如
实施例6所述的流式细胞术分析中测量所提供的融合蛋白的ec
50
值。表达gpc3的细胞可以是例如用人gpc3转染的sk
‑
hep1细胞。
[0107]
在一些实施方案中,本发明的融合蛋白可能够结合肿瘤细胞上表达的gpc3。在一些实施方案中,提供的融合蛋白可能够以至多约50nm或甚至更低,比如约30nm或更低、约25nm或甚至更低、约20nm或更低、约15nm或更低、约10nm或更低、约5nm或更低、约3nm或更低或约1nm或甚至更低的ec
50
值结合肿瘤细胞上表达的gpc3。可以在例如基本上如实施例7所述的流式细胞术分析中测量结合表达gpc3的肿瘤细胞的融合蛋白的ec
50
值。表达gpc3的肿瘤细胞可以是例如hepg2、hep3b和mkn
‑
45细胞。
[0108]
在一些实施方案中,本发明的融合蛋白基本上不结合除cd137或gpc3以外的靶标。在一些实施方案中,与先前已知的包含seq id no:83的氨基酸序列的结合cd137和gpc3的融合蛋白相比,提供的融合蛋白与除cd137或gpc3以外的靶标具有降低的脱靶结合。可以通过如实施例5所述的elisa测定实施此类靶标结合的评估。
[0109]
在一些实施方案中,本发明的融合蛋白可能够共刺激t细胞应答。在一些实施方案中,与包含在融合蛋白中的gpc3抗体(具有由seq id nos:81和82提供的重链和轻链)、参照cd137抗体(具有由seqidnos:26和27提供的重链和轻链)或先前已知的包含seq id no:83的氨基酸序列的结合cd137和gpc3的融合蛋白相比,所提供的融合蛋白导致相当的或更强的t细胞活化。在一些实施方案中,与包含在融合蛋白中的gpc3抗体(具有由seq id nos:81和82提供的重链和轻链)、参照cd137抗体(具有由seq id nos:26和27提供的重链和轻链)或先前已知的包含seq id no:83的氨基酸序列的结合cd137和gpc3的融合蛋白相比,所提供的融合蛋白以相当或更好功效导致t细胞活化。可以在例如基本上如实施例8所述的cd137生物测定中,或在基本上如实施例9、实施例10和实施例11所述的功能t细胞活化测定中,测量刺激的t细胞应答或t细胞活化。
[0110]
在一些实施方案中,本发明的融合蛋白可能够诱导il
‑
2分泌增加。在一些优选的实施方案中,所提供的融合蛋白可能够诱导浓度依赖性il
‑
2分泌,和/或显示在更高浓度下诱导il
‑
2分泌增强的趋势。在一些实施方案中,与包含在融合蛋白中的gpc3抗体(具有由seqidnos:81和82提供的重链和轻链)或先前已知的包含seq id no:83的氨基酸序列的结合cd137和gpc3的融合蛋白相比,所提供的融合蛋白可以相当或更好功效导致il
‑
2分泌增加。可以在例如基本上如实施例9和实施例10所述的功能t细胞活化测定中测量il
‑
2分泌。
[0111]
在一些实施方案中,本发明的融合蛋白可能够诱导t细胞介导的细胞毒性。在一些实施方案中,提供的融合蛋白可导致剂量依赖性t细胞介导的细胞溶解。在一些实施方案中,与包含在所提供的融合蛋白中的gpc3抗体(具有由seqidnos:81和82提供的重链和轻链)相比,所提供的融合蛋白可以相当或更好功效诱导细胞毒性t细胞活化。在一些实施方案中,与具有由seq id nos:26和27提供的重链和轻链的cd137抗体、具有由seq id nos:26和27提供的重链和轻链的参照cd137抗体或先前已知的包含seq id no:83的氨基酸序列的结合cd137和gpc3的融合蛋白相比,所提供的融合蛋白可以相当或更好功效诱导细胞毒性t细胞活化。可以在例如基本上如实施例11所述的基于阻抗的t细胞杀伤测定中测量t细胞介导的细胞毒性。
[0112]
在一些实施方案中,本发明的融合蛋白可能够以gpc3依赖性方式共刺激t细胞应答。在一些实施方案中,所提供的融合蛋白可导致在gpc3
‑
阳性细胞(比如gpc3转染的细胞
或表达gpc3的肿瘤细胞)附近的t细胞局部诱导il
‑
2产生。当在本文中使用时,“在gpc3
‑
阳性细胞附近”是指t细胞与gpc3
‑
阳性细胞经由同时结合cd137与gpc3的所提供的融合蛋白而被彼此靠近。在一些实施方案中,提供的融合蛋白可导致局部t细胞介导的对表达gpc3的肿瘤细胞的杀伤。可以在例如基本上如实施例8所述的cd137生物测定中,或在基本上如实施例9、实施例10和实施例11所述的功能t细胞活化测定中,测定所提供的融合蛋白的gpc3依赖性t细胞活化。
[0113]
在一些实施方案中,在不存在gpc3的情况下,所提供的融合蛋白不能共刺激t细胞应答。在一些实施方案中,在不存在表达gpc3的细胞的情况下,所提供的融合蛋白不能共刺激t细胞应答。在一些实施方案中,所提供的融合蛋白可能够识别gpc3的存在并导致比具有由seq id nos:26和27提供的重链和轻链的cd137抗体更好的相应的t细胞活化。可以在例如基本上如实施例8所述的cd137生物测定中,或在基本上如实施例9、实施例10和实施例11所述的功能t细胞活化测定中,测定融合蛋白的gpc3依赖性作用。
[0114]
在一些实施方案中,提供的融合蛋白可导致抗肿瘤活性。在一些实施方案中,提供的融合蛋白可抑制肝细胞癌hepg2细胞的肿瘤生长。在一些实施方案中,与包含在融合蛋白中的gpc3抗体(具有由seq id nos:81和82提供的重链和轻链)相比,提供的融合蛋白可以相当的或更好的功效抑制肝细胞癌hepg2细胞的肿瘤生长。可以例如采用基本上如实施例12所述的hepg2异种移植模型测定此类抗肿瘤活性。
[0115]
在一些实施方案中,提供的融合蛋白可提高肿瘤浸润淋巴细胞的水平。在一些实施方案中,与包含在融合蛋白中的gpc3抗体(具有由seq id nos:81和82提供的重链和轻链)相比,提供的融合蛋白可导致cd3、cd4或cd8 t细胞的肿瘤内滤过增加。可以例如如实施例13中所述分析肿瘤浸润淋巴细胞。
[0116]
在一些实施方案中,所提供的融合蛋白具有良好的稳定性和药代动力学特征。在一些实施方案中,所提供的融合蛋白具有与包含在融合蛋白中的gpc3抗体(具有由seq id nos:81和82提供的重链和轻链)相当的药代动力学特征。在一些实施方案中,所提供的融合蛋白具有抗体样药代动力学。在一些实施方案中,所提供的融合蛋白具有约50小时或更长、75小时或更长、100小时或更长、125小时或更长、约150小时或更长、约175小时或更长、约200小时或更长、约250小时或更长或甚至更长的终末半衰期。在一些实施方案中,所提供的融合蛋白在小鼠中具有约50小时或更长、75小时或更长、100小时或更长、125小时或更长、约150小时或更长、约175小时或更长、约200小时或更长、约250小时或更长或甚至更长的终末半衰期。可如实施例13所述分析所提供的融合蛋白的药代动力学特征。
[0117]
在一些实施方案中,所提供的融合蛋白包含seq id nos:87
‑
96中任一个所示的氨基酸序列。
[0118]
在一些实施方案中,所提供的融合蛋白包含与seq id nos:87
‑
96中任一个所示的氨基酸序列具有至少70%、至少75%、至少80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少98%或甚至更高的序列同一性的氨基酸序列。
[0119]
在一些实施方案中,所提供的融合蛋白包含seq id nos:87和82、seq id nos:88和82、seq id nos:81和89、seq id nos:81和90、seq id nos:91和82、seq id nos:92和82、seq id nos:81和93、seq id nos:81和94、seq id nos:95和82或seq id nos:96和82所示的氨基酸序列。
[0120]
在一些实施方案中,所提供的融合蛋白包含与seq id nos:87和82、seq id nos:88和82、seq id nos:81和89、seq id nos:81和90、seq id nos:91和82、seq id nos:92和82、seq id nos:81和93、seq id nos:81和94、seq id nos:95和82或seq id nos:96和82所示的氨基酸序列具有至少70%、至少75%、至少80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少98%或甚至更高的序列同一性的氨基酸序列。
[0121]
b.包含在融合蛋白中的示例性免疫球蛋白
[0122]
在一些实施方案中,就所提供的融合蛋白而言,第一亚基可以为或包含对gpc3特异性的全长免疫球蛋白或其抗原结合结构域。在一些实施方案中,免疫球蛋白可以是例如igg1、igg2或igg4。在一些实施方案中,免疫球蛋白是或包含igg4。在一些实施方案中,免疫球蛋白是针对gpc3的单克隆抗体。
[0123]
本发明的结合gpc3的抗体的示例性实例可包含抗原结合区,其交叉阻断或结合与gpc3
‑
结合抗体相同的表位,所述gpc3
‑
结合抗体包含已知抗体的重链可变结构域(v
h
)和轻链可变结构域(v
l
),所述已知抗体比如考曲妥珠单抗(codrituzumab)(也称作gc33或ro5137382)、yp7(包括人源化的yp7)、hn3和hs20。在一些实施方案中,本发明的gpc3
‑
结合抗体可包含来自选自考曲妥珠单抗、yp7、hn3和hs20的抗体的抗原结合区,比如三个重链互补决定区(cdr)(hcdr1、hcdr2和hcdr3)和三个轻链cdr(lcdr1、lcdr2和lcdr3)中的任一个。
[0124]
在一些实施方案中,所提供的gpc3抗体或其抗原结合结构域可具有选自seq id nos:78、114、119、126和129的重链可变区(hcvr)和/或选自seq id nos:79、115和127的轻链可变区(lcvr)。
[0125]
在一些实施方案中,所提供的gpc3抗体或其抗原结合结构域的重链和轻链对分别为或包含如下的hcvr和lcvr:seq id nos:78和79、seq id no:129和79、seq id nos:114和115或seq id nos:126和127。
[0126]
在一些实施方案中,所提供的gpc3抗体或其抗原结合结构域的重链和轻链对分别为或包含hcvr和lcvr,所述hcvr和lcvr具有与seq id nos:78和79、seq id no:129和79、seq id nos:114和115或seq id nos:126和127所示的氨基酸序列具有至少70%、至少75%、至少80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少98%或甚至更高的序列同一性的序列。
[0127]
在一些实施方案中,所提供的gpc3抗体或其抗原结合结构域可具有为seq id nos:80和81中任一个的重链,和/或为seq id no:82的轻链。
[0128]
在一些实施方案中,所提供的gpc3抗体的重链和轻链对为或包含seq id nos:80和82或seq id no:81和82所示的氨基酸序列。
[0129]
在一些实施方案中,所提供的gpc3抗体的重链和轻链对为或包含重链和轻链,所述重链和轻链具有与seq id nos:80和82或seq id no:81和82所示的氨基酸序列具有至少70%、至少75%、至少80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少98%或甚至更高的序列同一性的序列。
[0130]
在一些实施方案中,所提供的gpc3抗体或其抗原结合结构域可具有与选自seq id nos:78、114、119、126和129的氨基酸序列具有至少70%、至少75%、至少80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少98%或甚至更高的序列同一性的hcvr,和/或与选自seq id nos:79、115和127的氨基酸序列具有至少70%、至少75%、至少80%、至少
85%、至少90%、至少92%、至少95%、至少97%、至少98%或甚至更高的序列同一性的lcvr。在其它实施方案中,所提供的gpc3抗体或其抗原结合结构域可具有与选自seq id nos:80和81的氨基酸序列具有至少70%、至少75%、至少80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少98%或甚至更高的序列同一性的重链,和/或与seq id no:82的氨基酸序列具有至少70%、至少75%、至少80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少98%或甚至更高的序列同一性的轻链。
[0131]
在一些实施方案中,所提供的gpc3抗体或其抗原结合结构域的重链可变区可具有三个cdr,所述三个cdr具有如下序列:gytftdye(hcdr1,seq id no:72)、ldpktgdt(hcdr2,seq id no:73)、trfysyty(hcdr3;seq id no:74)。在一些实施方案中,所提供的gpc3抗体或其抗原结合结构域的重链可变区可具有三个cdr,所述三个cdr具有如下序列:gftfnkna(hcdr1,seq id no:108)、irnktnnyat(hcdr2,seq id no:109)、vagnsfay(hcdr3;seq id no:110)。在一些实施方案中,所提供的gpc3抗体或其抗原结合结构域的重链可变区可具有三个cdr,所述三个cdr具有如下序列:yfdfdsye(hcdr1,seq id no:116)、iyhsgst(hcdr2,seq id no:117)、arvnmdrfdy(hcdr3;seq id no:118)。在一些实施方案中,所提供的gpc3抗体或其抗原结合结构域的重链可变区可具有三个cdr,所述三个cdr具有如下序列:gftfssya(hcdr1,seq id no:120)、iqkqglpt(hcdr2,seq id no:121)、aknrakfdy(hcdr3;seq id no:122)。
[0132]
在一些实施方案中,所提供的gpc3抗体或其抗原结合结构域的轻链可变区可具有三个cdr,所述三个cdr具有如下序列:qslvhsnrnty(lcdr1,seq id no:75)、kvs(lcdr2)、sqnthvppt(lcdr3;seq id no:77)。在一些实施方案中,所提供的gpc3抗体或其抗原结合结构域的轻链可变区可具有三个cdr,所述三个cdr具有如下序列:qsllyssnqkny(lcdr1,seq id no:111)、was(lcdr2)、qqyynyplt(lcdr3;seq id no:113)。在一些实施方案中,所提供的gpc3抗体或其抗原结合结构域的轻链可变区可具有三个cdr,所述三个cdr具有如下序列:qsissy(lcdr1,seq id no:123)、nas(lcdr2)、qqnrgfplt(lcdr3;seq id no:125)。
[0133]
在一些实施方案中,提供的gpc3抗体或其抗原结合结构域包含重链可变区和轻链可变区,所述重链可变区具有有如下序列的三个cdr:gytftdye(hcdr1,seq id no:72)、ldpktgdt(hcdr2,seq id no:73)、trfysyty(hcdr3;seq id no:74),所述轻链可变区具有有如下序列的三个cdr:qslvhsnrnty(lcdr1,seq id no:75)、kvs(lcdr2)、sqnthvppt(lcdr3;seq id no:77)。在一些实施方案中,提供的gpc3抗体或其抗原结合结构域包含重链可变区和轻链可变区,所述重链可变区具有有如下序列的三个cdr:gftfnkna(hcdr1,seq id no:108)、irnktnnyat(hcdr2,seq id no:109)、vagnsfay(hcdr3;seq id no:110),所述轻链可变区具有有如下序列的三个cdr:qsllyssnqkny(lcdr1,seq id no:111)、was(lcdr2)、qqyynyplt(lcdr3;seq id no:113)。在一些实施方案中,提供的gpc3抗体或其抗原结合结构域包含重链可变区和轻链可变区,所述重链可变区具有有如下序列的三个cdr:gftfssya(hcdr1,seq id no:120)、iqkqglpt(hcdr2,seq id no:121)、aknrakfdy(hcdr3;seq id no:122),所述轻链可变区具有有如下序列的三个cdr:qsissy(lcdr1,seq id no:123)、nas(lcdr2)、qqnrgfplt(lcdr3;seq id no:125)。
[0134]
除非另有说明,本文公开的全部cdr序列均根据lefranc,m.
‑
p.,the immunologist,7,132
‑
136(1999)中所述的imgt方法定义。cdr1由位置27至38组成,cdr2由
位置56至65组成,种系(germline)v
‑
基因的cdr3由位置105至116组成,重排的v
‑
j
‑
基因或v
‑
d
‑
j
‑
基因的cdr3由位置105至117(j
‑
phe或j
‑
trp 118之前的位置)组成,其中对于具有小于13个氨基酸的重排的cdr3
‑
imgt的环顶部具有间隙,或对于具有大于13个氨基酸的重排的cdr3
‑
imgt具有另外的位置112.1、111.1、112.2、111.2等。本段给出的位置根据lefranc,m.
‑
p.,the immunologist,7,132
‑
136(1999)中描述的imgt编号。
[0135]
包含在本发明的融合蛋白中的特异性地结合gpc3的抗体可包括fc部分,所述fc部分允许延长本发明的双特异性结合分子的体内半衰期。在一些实施方案中,这种fc部分优选地来自人来源,更优选地为igg1或igg4抗体的人fc部分,甚至更优选地为具有活化的或沉默的效应子功能的igg1或igg4的工程化人fc部分。在一些实施方案中,沉默的效应子功能可优于活化的效应子功能。在一些实施方案中,这种fc部分被工程化为使效应子功能沉默,其在根据kabat的eu索引(johnson和wu,nucleic acids res,2000)编号的位置234和/或235处具有突变。在一些实施方案中,可以在所提供的抗
‑
gpc3抗体的位置f234和l235处引入突变以使效应子功能沉默。在其它实施方案中,可以在所提供的抗
‑
gpc3抗体的位置d265和p329处引入突变以使效应子功能沉默。两组这些潜在突变的编号均根据kabat的eu索引(shields等,j biol chem,2001)。
[0136]
用于产生抗体及其片段的各种技术是本领域熟知的并描述在如altshuler等(2010)中。因此,例如,在用与添加剂和佐剂混合的抗原免疫后,可以从动物的血液中获得多克隆抗体,并且可以通过提供由连续细胞系培养物产生的抗体的任何技术来生产单克隆抗体。此类技术的实例描述在如harlow和lane(1999),(1988)中,并包括最初由和milstein,1975描述的杂交瘤技术、trioma技术、人b细胞杂交瘤技术(参见如li等,proc natl acad sci u s a,2006;kozbor和roder,immunol today,1983)和ebv
‑
杂交瘤技术以产生人单克隆抗体(cole等,cancer res,1984)。此外,重组抗体可以从单克隆抗体获得或可以通过各种展示方法(比如噬菌体、核糖体、mrna或细胞展示)从头制备。在一些实施方案中,用于表达重组(人源化)抗体或其片段的合适系统可选自例如细菌、酵母、昆虫、哺乳动物细胞系或转基因动物或植物(参见如美国专利no.6,080,560;holliger和hudson,nat biotechnol,2005)。另外,所描述的用于产生单链抗体的技术(尤其参见美国专利no.4,946,778)可适于产生对本发明的靶标特异性的单链抗体。可将biacore系统中应用的表面等离子体共振用于增加噬菌体抗体的效率。
[0137]
c.本发明的示例性脂质运载蛋白突变蛋白
[0138]
脂质运载蛋白是已天然进化成结合配体的蛋白质性结合分子。脂质运载蛋白存在于许多生物体中,包括脊椎动物、昆虫、植物和细菌。脂质运载蛋白家族的成员(pervaiz和brew,faseb j,1987)通常是小的分泌的蛋白并具有单个多肽链。它们的特征在于一系列不同的分子识别特性:它们结合多种主要是疏水性的小分子(例如类视黄醇、脂肪酸、胆固醇、前列腺素、胆绿素、信息素、甜味剂(tastant)和着嗅剂(odorant));和它们结合特异细胞表面受体及它们形成大分子复合物。尽管过去将它们主要分类为转运蛋白,但现在明确了脂质运载蛋白完成多种生理功能。这些功能包括在视黄醇转运、嗅觉、信息素信号传导和前列腺素合成中的作用。脂质运载蛋白还涉及于免疫应答的调节和细胞内环境稳态的介导(如,flower等,biochim biophys acta,2000;flower,biochem j,1996中的综述)。
[0139]
脂质运载蛋白之间的全序列保守性水平非常低,通常具有低于20%的序列同一
性。形成强烈对比的是,其整体折叠模式高度保守。脂质运载蛋白结构的中心部分由单个八链反平行的β
‑
片组成,所述β
‑
片自身闭合形成连续的氢键合的β桶。该β桶形成中央腔体。桶的一端被穿过其底部的n
‑
末端肽段以及连接β
‑
链的三个肽环立体封闭。β桶的另一端对溶剂开放并包含由四个柔性肽环(ab、cd、ef和gh)形成的靶标结合位点。正是所述环在本应刚性的脂质运载蛋白骨架中的这种多样性产生多种不同的结合模式,每一种模式能够容纳不同大小、形状和化学特征的靶标(如skerra,biochim biophys acta,2000;flower等,biochim biophys acta,2000;flower,biochem j,1996中的综述)。
[0140]
根据本发明的脂质运载蛋白突变蛋白可以是任何脂质运载蛋白的突变蛋白。其突变蛋白可以使用的合适的脂质运载蛋白(有时也称为“参照脂质运载蛋白”、“野生型脂质运载蛋白”、“参照蛋白骨架”或简单地称为“骨架”)的实例包括但不限于泪液脂质运载蛋白(脂质运载蛋白
‑
1、tlc或von ebner’s腺蛋白)、视黄醇结合蛋白、嗜中性粒细胞脂质运载蛋白型前列腺素d合酶、β
‑
乳球蛋白、胆汁结合蛋白(bbp)、载脂蛋白d(apod)、中性粒细胞明胶酶相关脂质运载蛋白(ngal)、α2
‑
微球蛋白相关的蛋白(a2m)、24p3/子宫钙蛋白(24p3)、von ebner’s腺蛋白1(vegp 1)、von ebner’s腺蛋白2(vegp 2)和主要过敏原can f 1(all
‑
1)。在相关的实施方案中,脂质运载蛋白突变蛋白源自由人泪液脂质运载蛋白(htic)、人中性粒细胞明胶酶相关脂质运载蛋白(hngal)、人载脂蛋白d(hapod)和欧洲粉蝶(pieris brassicae)的胆汁结合蛋白组成的脂质运载蛋白组。
[0141]
相比于与另一种脂质运载蛋白(还参见上文)的序列同一性,根据本发明的脂质运载蛋白突变蛋白的氨基酸序列与其所源自的参照(或野生型)脂质运载蛋白(例如htlc或hngal)可具有高序列同一性。在该一般情况下,根据本发明的脂质运载蛋白突变蛋白的氨基酸序列与相应参照(野生型)脂质运载蛋白的氨基酸序列至少基本上相似,条件是在比对时可能有由于氨基酸的添加或缺失导致的间隙(如本文所定义)。与相应参照(野生型)脂质运载蛋白的序列基本上相似的本发明的脂质运载蛋白突变蛋白的相应序列,在一些实施方案中,与相应脂质运载蛋白的序列具有至少60%、至少65%、至少70%、至少75%、至少80%、至少82%、至少85%、至少87%、至少90%的同一性,包括至少95%的同一性。在这一方面,本发明的脂质运载蛋白突变蛋白当然可包含如本文所述的置换,其使该脂质运载蛋白突变蛋白能够结合cd137。
[0142]
典型地,脂质运载蛋白突变蛋白相对于野生型或参照脂质运载蛋白(例如htlc或hngal)的氨基酸序列在包含配体结合口袋并限定配体结合口袋入口的开放端的四个环(参见上文)中含有一个或多个突变的氨基酸残基。如上文所述,这些区域在决定脂质运载蛋白突变蛋白对所需靶标的结合特异性中至关重要。在一些实施方案中,本发明的脂质运载蛋白突变蛋白还可在四个环之外的区域含有突变的氨基酸残基。在一些实施方案中,本发明的脂质运载蛋白突变蛋白可在连接脂质运载蛋白封闭端处的β
‑
链的三个肽环(命名为bc、de和fg)中的一个或多个中含有一个或多个突变的氨基酸残基。在一些实施方案中,源自泪液脂质运载蛋白、ngal脂质运载蛋白或它们的同源物的突变蛋白在n
‑
末端区域和/或β
‑
桶结构端部处排列的三个肽环bc、de和fg中的任意序列位置处可具有1、2、3、4或更多个突变的氨基酸残基,所述β
‑
桶结构端部位于天然脂质运载蛋白结合口袋的对面。在一些实施方案中,与泪液脂质运载蛋白的野生型序列相比,源自泪液脂质运载蛋白、ngal脂质运载蛋白或它们的同源物的突变蛋白在β
‑
桶结构端部处排列的肽环de中没有突变的氨基酸残基。
[0143]
在一些实施方案中,与相应的参照(野生型)脂质运载蛋白相比,根据本发明的脂质运载蛋白突变蛋白可包含一个或多个(比如2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20或甚至更多个)突变的氨基酸残基,条件是这种脂质运载蛋白突变蛋白应该能够结合cd137。在一些实施方案中,本发明的脂质运载蛋白突变蛋白包含至少两个(包括2、3、4、5或甚至更多个)突变的氨基酸残基,其中相应的参照(野生型)脂质运载蛋白的天然氨基酸残基被精氨酸残基置换。
[0144]
设想任意类型和数量的突变(包括置换、缺失和插入),只要所提供的脂质运载蛋白突变蛋白保留了其结合cd137的能力,和/或其与参照(野生型)脂质运载蛋白(例如成熟htlc或成熟hngal)的氨基酸序列具有至少60%,比如至少65%、至少70%、至少75%、至少80%、至少85%或更高的序列同一性。
[0145]
在一些实施方案中,置换是保守置换。在一些实施方案中,置换是非保守置换或来自下文列出的示例性置换中的一个或多个。
[0146]
具体而言,为了确定脂质运载蛋白突变蛋白氨基酸序列的氨基酸残基是否与对应于参照(野生型)脂质运载蛋白氨基酸序列中的某一位置的参照(野生型)脂质运载蛋白不同,技术人员可利用本领域熟知的手段和方法,如手动地或通过使用诸如blast 2.0(其代表基本局部比对搜索工具)或clustalw或任意适用于产生序列比对的其它合适程序的计算机程序进行比对。因此,参照(野生型)脂质运载蛋白的氨基酸序列可作为“受试序列”或“参照序列”,而脂质运载蛋白突变蛋白的氨基酸序列作为“查询序列”(还参见上文)。
[0147]
保守置换通常为以下置换,其根据待突变的氨基酸列出,每一个待突变的氨基酸后面为一个或多个可作为保守性的替代:ala
→
ser、thr或val;arg
→
lys、gln、asn或his;asn
→
gln、glu、asp或his;asp
→
glu、gln、asn或his;gln
→
asn、asp、glu或his;glu
→
asp、asn、gln或his;his
→
arg、lys、asn、gln、asp或glu;ile
→
thr、leu、met、phe、val、trp、tyr、ala或pro;leu
→
thr、ile、val、met、ala、phe、pro、tyr或trp;lys
→
arg、his、gln或asn;met
→
thr、leu、tyr、ile、phe、val、ala、pro或trp;phe
→
thr、met、leu、tyr、ile、pro、trp、val或ala;ser
→
thr、ala或val;thr
→
ser、ala、val、ile、met、val、phe、pro或leu;trp
→
tyr、phe、met、ile或leu;tyr
→
trp、phe、ile、leu或met;val
→
thr、ile、leu、met、phe、ala、ser或pro。其它置换也是可允许的并可凭经验或根据其它已知的保守或非
‑
保守置换确定。作为另一取向(orientation),以下组的每一组包含通常可用于定义彼此的保守置换的氨基酸:
[0148]
(a)丙氨酸(ala)、丝氨酸(ser)、苏氨酸(thr)、缬氨酸(val)
[0149]
(b)天冬氨酸(asp)、谷氨酸(glu)、谷氨酰胺(gln)、天冬酰胺(asn)、组氨酸(his)
[0150]
(c)精氨酸(arg)、赖氨酸(lys)、谷氨酰胺(gln)、天冬酰胺(asn)、组氨酸(his)
[0151]
(d)异亮氨酸(ile)、亮氨酸(leu)、甲硫氨酸(met)、缬氨酸(val)、丙氨酸(ala)、苯丙氨酸(phe)、苏氨酸(thr)、脯氨酸(pro)
[0152]
(e)异亮氨酸(ile)、亮氨酸(leu)、甲硫氨酸(met)、苯丙氨酸(phe)、酪氨酸(tyr)、色氨酸(trp)。
[0153]
如果这种保守性置换导致了生物活性的改变,则可引入更多实质性改变(如以下或如下文关于氨基酸分类进一步描述)并就所需特征筛选产物。这种更实质性改变的实例是:ala
→
leu或phe;arg
→
glu;asn
→
ile、val或trp;asp
→
met;cys
→
pro;gln
→
phe;glu
→
arg;his
→
gly;ile
→
lys、glu或gln;leu
→
lys或ser;lys
→
tyr;met
→
glu;phe
→
glu、gln或
asp;trp
→
cys;tyr
→
glu或asp;val
→
lys、arg、his。
[0154]
在一些实施方案中,脂质运载蛋白(突变蛋白)的物理和生物性质中的实质性修饰通过选择它们在维持以下的效果上显著不同的置换来完成:(a)置换区域中多肽骨架的结构,例如片(sheet)或螺旋构象;(b)靶点处分子的电荷或疏水性;或(c)侧链的体积(bulk)。
[0155]
基于一般侧链性质,将天然存在的残基分为以下的组:(1)疏水性:甲硫氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸;(2)中性亲水性:半胱氨酸、丝氨酸、苏氨酸、天冬酰胺、谷氨酰胺;(3)酸性:天冬氨酸、谷氨酸;(4)碱性:组氨酸、赖氨酸、精氨酸;(5)影响链取向的残基:甘氨酸、脯氨酸;和(6)芳香族:色氨酸、酪氨酸、苯丙氨酸。在一些实施方案中,置换可能需要将这些类别中一类的成员换成另一类。
[0156]
通常还可用丝氨酸置换不参与维持相应脂质运载蛋白正确构象的任何半胱氨酸残基,以改善分子的氧化稳定性并防止异常交联。相反,可将半胱氨酸键添加至脂质运载蛋白以提高其稳定性。
[0157]
d.本发明的示例性cd137特异性脂质运载蛋白突变蛋白
[0158]
如上所述,脂质运载蛋白是由其超二级结构定义的多肽,超二级结构即包含通过在一端的4个环逐对连接的8个β链以由此限定结合口袋的圆柱形β
‑
折叠片超二级结构区。本发明不局限于本文具体公开的脂质运载蛋白突变蛋白。在这一方面,本发明涉及具有圆柱形β
‑
折叠片超二级结构区的脂质运载蛋白突变蛋白,该结构区包含通过在一端的4个环逐对连接的8个β链以由此限定结合口袋,其中所述4个环中的至少3个的每一个的至少一个氨基酸已经突变,并且其中所述脂质运载蛋白以可检测的亲和力有效结合cd137。
[0159]
在一些实施方案中,本文公开的脂质运载蛋白突变蛋白可以是或包含成熟人泪液脂质运载蛋白(htlc)的突变蛋白。本文将成熟htlc的突变蛋白命名为“htlc突变蛋白”。在一些其它实施方案中,本文公开的脂质运载蛋白突变蛋白为成熟人中性粒细胞明胶酶相关脂质运载蛋白(hngal)的突变蛋白。本文将成熟hngal的突变蛋白命名为“hngal突变蛋白”。
[0160]
一方面,本发明包括任何数量的以可检测亲和力结合cd137的源自参照(野生型)脂质运载蛋白(优选源自成熟htlc或成熟hngal)的脂质运载蛋白突变蛋白。在相关的方面,本发明包含各种能够通过结合cd137来活化cd137下游信号传导通路的脂质运载蛋白突变蛋白。在此意义上,可将cd137看作参照(野生型)脂质运载蛋白(优选htlc或hngal)的非天然靶标,其中“非天然靶标”是指在生理条件下不结合参照(野生型)脂质运载蛋白的物质。通过在某些序列位置处用一个或多个突变工程化参照(野生型)脂质运载蛋白,本发明的发明人已经证明对非天然靶标即cd137的高亲和力和高特异性是可能的。在一些实施方案中,基于产生能够结合cd137的脂质运载蛋白突变蛋白的目标,在编码野生型脂质运载蛋白上某些序列位置处的1、2、3、4、5、6、7、8、9、10、11、12或甚至更多个核苷酸三联体处,可以通过用核苷酸三联体的亚集(subset)在这些位置处的置换来实施随机诱变。
[0161]
在一些实施方案中,本发明的脂质运载蛋白突变蛋白在对应于参照脂质运载蛋白(优选htlc或hngal)的线性多肽序列的一个或多个序列位置处可具有突变的(包括置换、缺失或插入)氨基酸残基。在一些实施方案中,相比于参照脂质运载蛋白(优选htlc或hngal)的氨基酸序列,本发明的脂质运载蛋白突变蛋白的突变的氨基酸残基的数目为1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20或更多(比如25、30、35、40、45或50),其中优选地为1、2、3、4、5、6、7、8、9、10或11,更优选地为9、10或11。然而,优选地本发明的脂质运载
蛋白突变蛋白仍然能够结合cd137。
[0162]
在一些实施方案中,与相应的参照(野生型)脂质运载蛋白相比,本发明的脂质运载蛋白突变蛋白可在其n
‑
末端缺少1、2、3、4或更多个氨基酸和/或在其c
‑
末端缺少1、2或更多个氨基酸;例如seq id nos:32
‑
38。在一些实施方案中,本发明涵盖如上定义的htlc突变蛋白,其中成熟htlc的前4个、1个、2个或3个n
‑
末端氨基酸残基(his
‑
his
‑
leu
‑
leu;位置1
‑
4)和/或成熟htlc的线性多肽序列的最后1个或2个c
‑
末端氨基酸残基(ser
‑
asp;位置157
‑
158)缺失(如seq id nos:32
‑
38)。在一些实施方案中,本发明涵盖如上定义的hngal突变蛋白,其中成熟hngal的线性多肽序列的氨基酸残基(lys
‑
asp
‑
pro;位置46
‑
48)缺失(seq id no:43)。此外,本发明的脂质运载蛋白突变蛋白可包括参照(野生型)脂质运载蛋白(优选htlc或hngal)在突变的氨基酸序列位置之外的野生型(天然)氨基酸序列。
[0163]
在一些实施方案中,将一个或多个突变的氨基酸残基引入本发明的脂质运载蛋白突变蛋白基本上不会妨碍或不会干扰该突变蛋白与指定靶标的结合活性和折叠。可以采用已建立的标准方法(sambrook和russell,2001,molecular cloning:a laboratory manual)在dna水平上完成这种突变(包括置换、缺失和插入)。在一些实施方案中,在对应于参照(野生型)脂质运载蛋白(优选htlc或hngal)的线性多肽序列的一个或多个序列位置处,通过用核苷酸三联体的亚集(subset)置换编码参照脂质运载蛋白相应序列位置的一个或多个核苷酸三联体的随机诱变来引入突变的氨基酸残基。
[0164]
在一些实施方案中,所提供的以可检测的亲和力结合cd137的脂质运载蛋白突变蛋白可包含至少一个用另一个氨基酸(例如丝氨酸残基)置换天然半胱氨酸残基的氨基酸置换。在一些实施方案中,以可检测的亲和力结合cd137的脂质运载蛋白突变蛋白可包含置换参照(野生型)脂质运载蛋白(优选htlc或hngal)的一个或多个氨基酸的一个或多个非天然半胱氨酸残基。在一些实施方案中,根据本发明的脂质运载蛋白突变蛋白包含至少两个用半胱氨酸残基置换天然氨基酸的氨基酸置换,从而形成一个或多个半胱氨酸桥。在一些实施方案中,所述半胱氨酸桥可以连接至少两个环区。根据(biochim biophys acta,2000)、flower(1996)和breustedt等,(2005)在本文中使用这些区的定义。
[0165]
一般而言,本发明的脂质运载蛋白突变蛋白与成熟htlc(seq id no:1)或成熟hngal(seq id no:2)的氨基酸序列可具有至少约70%,包括至少约80%,比如至少约85%的氨基酸序列同一性。
[0166]
在一些方面,本发明提供结合cd137的htlc突变蛋白。在这一方面,本发明提供一种或多种htlc突变蛋白,其能够以通过约300nm、200nm、150nm、100nm或更低的k
d
量度的亲和力结合cd137。在一些实施方案中,所提供的htlc突变蛋白能够以约250nm、150nm、100nm、50nm、20nm或甚至更低的ec
50
值结合cd137。在一些其它实施方案中,结合cd137的htlc突变蛋白可与猕猴cd137(cycd137)交叉反应。
[0167]
在一些实施方案中,本发明的htlc突变蛋白可干扰cd137l与cd137的结合。
[0168]
在一些实施方案中,所提供的htlc突变蛋白在对应于成熟htlc的线性多肽序列(seq id no:1)的位置5、26
‑
31、33
‑
34、42、46、52、56、58、60
‑
61、65、71、85、94、101、104
‑
106、108、111、114、121、133、148、150和153的一个或多个位置处可包含突变的氨基酸残基。
[0169]
在一些实施方案中,所提供的htlc突变蛋白在对应于成熟htlc的线性多肽序列(seq id no:1)的位置26
‑
34、55
‑
58、60
‑
61、65、104
‑
106和108的一个或多个位置处可包含
突变的氨基酸残基。
[0170]
在一些实施方案中,所提供的htlc突变蛋白在对应于成熟htlc的线性多肽序列(seq id no:1)的位置101、111、114和153的一个或多个位置处可进一步包含突变的氨基酸残基。
[0171]
在一些实施方案中,所提供的htlc突变蛋白在对应于成熟htlc的线性多肽序列(seq id no:1)的位置5、26
‑
31、33
‑
34、42、46、52、56、58、60
‑
61、65、71、85、94、101、104
‑
106、108、111、114、121、133、148、150和153的1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26或甚至更多个位置处可包含突变的氨基酸残基。在一些优选的实施方案中,所提供的htlc突变蛋白能够结合cd137,特别是人cd137。
[0172]
在一些实施方案中,所提供的htlc突变蛋白在对应于成熟htlc的线性多肽序列(seq id no:1)的位置26
‑
34、55
‑
58、60
‑
61、65、104
‑
106和108的1、2、3、4、5、6、7、8、9、10、11、12或甚至更多个位置处可包含突变的氨基酸残基。在一些优选的实施方案中,所提供的htlc突变蛋白能够结合cd137,特别是人cd137。
[0173]
在一些实施方案中,根据本发明的脂质运载蛋白突变蛋白可包含至少一个用如丝氨酸残基置换天然半胱氨酸残基的氨基酸置换。在一些实施方案中,根据本发明的htlc突变蛋白包含用另一个氨基酸(比如丝氨酸残基)置换天然半胱氨酸残基的氨基酸置换,所述天然半胱氨酸残基在对应于成熟htlc的线性多肽序列(seq id no:1)的位置61和/或153的位置处。在本上下文中应注意已经发现(在相应的天然核酸文库的水平上)移除由半胱氨酸残基61和153形成的野生型htlc的结构二硫键(参见breustedt等,j biol chem,2005)可以提供htlc突变蛋白,其不仅稳定折叠,还能以高亲和力结合给定非
‑
天然靶标。在一些实施方案中,结构二硫键的消除可提供进一步的优点,即允许将非天然二硫键生成或有意引入到本发明的突变蛋白中,由此增加该突变蛋白的稳定性。然而,结合cd137并具有在cys 61和cys 153之间形成的二硫桥的htlc突变蛋白也是本发明的一部分。
[0174]
在一些特定实施方案中,本发明的htlc突变蛋白在对应于成熟htlc的线性多肽序列(seq id no:1)的位置61和/或153的位置处可包含以下氨基酸置换中的一个或多个:cys 61
→
ala、phe、lys、arg、thr、asn、gly、gln、asp、asn、leu、tyr、met、ser、pro或trp和/或cys 153
→
ser或ala。
[0175]
在一些实施方案中,在对应于成熟htlc的线性多肽序列(seq id no:1)的位置61、101和153的位置处的两个或全部三个半胱氨酸密码子被另一个氨基酸的密码子替换。此外,在一些实施方案中,根据本发明的htlc突变蛋白在对应于成熟htlc的线性多肽序列(seq id no:1)的位置101的位置处包含天然半胱氨酸残基被丝氨酸残基或组氨酸残基置换的氨基酸置换。
[0176]
在一些实施方案中,根据本发明的突变蛋白包含在对应于成熟htlc的线性多肽序列(seq id no:1)的位置28或105的位置处的天然氨基酸被半胱氨酸残基置换的氨基酸置换。此外,在一些实施方案中,根据本发明的突变蛋白包含在对应于成熟htlc的线性多肽序列(seq id no:1)的位置111的位置处的天然精氨酸残基被脯氨酸残基置换的氨基酸置换。另外,在一些实施方案中,根据本发明的突变蛋白包含在对应于成熟htlc的线性多肽序列(seq id no:1)的位置114的位置处的天然赖氨酸残基被色氨酸残基或谷氨酸置换的氨基酸置换。
[0177]
在一些实施方案中,所提供的结合cd137的htlc突变蛋白在对应于成熟htlc的线性多肽序列(seq id no:1)的位置5、26
‑
31、33
‑
34、42、46、52、56、58、60
‑
61、65、71、85、94、101、104
‑
106、108、111、114、121、133、148、150和153的一个或多个位置处可包含以下突变的氨基酸残基中的一个或多个:ala 5
→
val或thr;arg 26
→
glu;glu 27
→
gly;phe 28
→
cys;pro 29
→
arg;glu 30
→
pro;met 31
→
trp;leu 33
→
ile;glu 34
→
phe;thr 42
→
ser;gly 46
→
asp;lys 52
→
glu;leu 56
→
ala;ser 58
→
asp;arg 60
→
pro;cys 61
→
ala;lys 65
→
arg或asn;thr 71
→
ala;val 85
→
asp;lys 94
→
arg或glu;cys 101
→
ser;glu 104
→
val;leu 105
→
cys;his 106
→
asp;lys 108
→
ser;arg 111
→
pro;lys 114
→
trp;lys 121
→
glu;ala 133
→
thr;arg 148
→
ser;ser 150
→
ile;和cys 153
→
ser。在一些实施方案中,本发明的htlc突变蛋白在成熟htlc(seq id no:1)的这些序列位置处包含两个或更多个,比如3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26或更多个或甚至全部突变的氨基酸残基。
[0178]
在一些实施方案中,与成熟htlc的线性多肽序列(seq id no:1)相比,所提供的结合cd137的htlc突变蛋白可包含以下突变的氨基酸残基的组之一:
[0179]
(a)arg 26
→
glu;glu 27
→
gly;phe 28
→
cys;pro 29
→
arg;glu 30
→
pro;met 31
→
trp;leu 33
→
ile;glu 34
→
phe;leu 56
→
ala;ser 58
→
asp;arg 60
→
pro;cys 61
→
ala;cys 101
→
ser;glu 104
→
val;leu 105
→
cys;his 106
→
asp;lys 108
→
ser;arg 111
→
pro;lys 114
→
trp;和cys 153
→
ser;
[0180]
(b)ala 5
→
thr;arg 26
→
glu;glu 27
→
gly;phe 28
→
cys;pro 29
→
arg;glu 30
→
pro;met 31
→
trp;leu 33
→
ile;glu 34
→
phe;leu 56
→
ala;ser 58
→
asp;arg 60
→
pro;cys 61
→
ala;lys 65
→
arg;val 85
→
asp;cys 101
→
ser;glu 104
→
val;leu 105
→
cys;his 106
→
asp;lys 108
→
ser;arg 111
→
pro;lys 114
→
trp;lys 121
→
glu;ala 133
→
thr;和cys 153
→
ser;
[0181]
(c)arg 26
→
glu;glu 27
→
gly;phe 28
→
cys;pro 29
→
arg;glu 30
→
pro;met 31
→
trp;leu 33
→
ile;glu 34
→
phe;leu 56
→
ala;ser 58
→
asp;arg 60
→
pro;cys 61
→
ala;lys 65
→
asn;lys 94
→
arg;cys 101
→
ser;glu 104
→
val;leu 105
→
cys;his 106
→
asp;lys 108
→
ser;arg 111
→
pro;lys 114
→
trp;lys 121
→
glu;ala 133
→
thr;和cys 153
→
ser;
[0182]
(d)ala 5
→
val;arg 26
→
glu;glu 27
→
gly;phe 28
→
cys;pro 29
→
arg;glu 30
→
pro;met 31
→
trp;leu 33
→
ile;glu 34
→
phe;leu 56
→
ala;ser 58
→
asp;arg 60
→
pro;cys 61
→
ala;lys 65
→
arg;lys 94
→
glu;cys 101
→
ser;glu 104
→
val;leu 105
→
cys;his 106
→
asp;lys 108
→
ser;arg 111
→
pro;lys 114
→
trp;lys 121
→
glu;ala 133
→
thr;和cys 153
→
ser;
[0183]
(e)arg 26
→
glu;glu 27
→
gly;phe 28
→
cys;pro 29
→
arg;glu 30
→
pro;met 31
→
trp;leu 33
→
ile;glu 34
→
phe;thr 42
→
ser;leu56
→
ala;ser 58
→
asp;arg 60
→
pro;cys 61
→
ala;cys 101
→
ser;glu 104
→
val;leu 105
→
cys;his 106
→
asp;lys 108
→
ser;arg 111
→
pro;lys 114
→
trp;ser 150
→
ile;和cys 153
→
ser;
[0184]
(f)arg 26
→
glu;glu 27
→
gly;phe 28
→
cys;pro 29
→
arg;glu 30
→
pro;met 31
→
trp;leu 33
→
ile;glu 34
→
phe;lys 52
→
glu;leu 56
→
ala;ser 58
→
asp;arg 60
→
pro;cys 61
→
ala;thr 71
→
ala;cys 101
→
ser;glu 104
→
val;leu 105
→
cys;his 106
→
asp;lys 108
→
ser;arg 111
→
pro;lys 114
→
trp;ala 133
→
thr;arg 148
→
ser;ser 150
→
ile;和cys 153
→
ser;和
[0185]
(g)ala 5
→
thr;arg 26
→
glu;glu 27
→
gly;phe 28
→
cys;pro 29
→
arg;glu 30
→
pro;met 31
→
trp;leu 33
→
ile;glu 34
→
phe;gly 46
→
asp;leu 56
→
ala;ser 58
→
asp;arg 60
→
pro;cys 61
→
ala;thr 71
→
ala;cys 101
→
ser;glu 104
→
val;leu 105
→
cys;his 106
→
asp;lys 108
→
ser;arg 111
→
pro;lys 114
→
trp;ser 150
→
ile;和cys 153
→
ser。
[0186]
在一些实施方案中,本发明的htlc突变蛋白的剩余区域,即与对应于成熟htlc的线性多肽序列(seq id no:1)的位置5、26
‑
31、33
‑
34、42、46、52、56、58、60
‑
61、65、71、85、94、101、104
‑
106、108、111、114、121、133、148、150和153的位置不同的区域,可包含成熟htlc的线性多肽序列在突变的氨基酸序列位置之外的野生型(天然)氨基酸序列。
[0187]
在一些实施方案中,本发明的htlc突变蛋白与成熟htlc的序列(seq id no:1)具有至少70%的序列同一性或至少70%的序列同源性。作为示例性实例,seq id no:32的突变蛋白与成熟htlc的氨基酸序列具有近84%的氨基酸序列同一性或序列同源性。
[0188]
在一些实施方案中,本发明的htlc突变蛋白包含如seq id nos:32
‑
38中任一个所示的氨基酸序列或其片段或变体。
[0189]
在一些实施方案中,本发明的htlc突变蛋白与选自seq id nos:32
‑
38的氨基酸序列具有至少75%、至少80%、至少85%、至少90%、至少95%、至少98%或更高的序列同一性。
[0190]
本发明还包含具有选自seq id nos:32
‑
38的氨基酸序列的htlc突变蛋白的结构同源物,所述结构同源物与所述的htlc突变蛋白具有大于约60%,优选地大于65%、大于70%、大于75%、大于80%、大于85%、大于90%、大于92%和最优选地大于95%的氨基酸序列同源性或序列同一性。
[0191]
在一些方面,本发明提供结合cd137的hngal突变蛋白。在这一方面,本发明提供一种或多种hngal突变蛋白,其能够以通过约800nm、700nm、200nm、140nm、100nm或更低,优选约70nm、50nm、30nm、10nm、5nm、2nm或甚至更低的k
d
量度的亲和力结合cd137。在一些实施方案中,所提供的hngal突变蛋白能够以约1000nm、500nm、100nm、80nm、50nm、25nm、18nm、15nm、10nm、5nm或更低的ec
50
值结合cd137。
[0192]
在一些实施方案中,所提供的结合cd137的hngal突变蛋白可与猕猴cd137交叉反应。在一些实施方案中,所提供的hngal突变蛋白能够以通过约50nm、20nm、10nm、5nm、2nm或甚至更低的k
d
量度的亲和力结合猕猴cd137。在一些实施方案中,所提供的hngal突变蛋白能够以约100nm、80nm、50nm、30nm或甚至更低的ec
50
值结合猕猴cd137。
[0193]
在一些实施方案中,本发明的hngal突变蛋白可干扰或竞争cd137l与cd137的结合。在一些其它实施方案中,本发明的hngal突变蛋白在cd137l存在下可能够结合cd137和/或能够结合cd137/cd137l复合物。
[0194]
在一些实施方案中,所提供的hngal突变蛋白在对应于成熟hngal的线性多肽序列(seq id no:2)的位置28、36、40
‑
41、49、52、65、68、70、72
‑
73、77、79、81、83、87、94、96、100、103、106、125、127、132和134的一个或多个位置处可包含突变的氨基酸残基。
[0195]
在一些实施方案中,所提供的hngal突变蛋白在对应于成熟hngal的线性多肽序列(seq id no:2)的位置28、36、40
‑
41、49、52、65、68、70、72
‑
73、77、79、81、83、87、94、96、100、103、106、125、127、132和134的1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21或甚至更多个位置处可包含突变的氨基酸残基。在一些优选的实施方案中,所提供的hngal突变蛋白能够结合cd137,特别是人cd137。
[0196]
在一些实施方案中,所提供的hngal突变蛋白在对应于成熟hngal的线性多肽序列(seq id no:2)的位置28、36、40
‑
41、49、52、65、68、70、72
‑
73、77、79、81、87、96、100、103、106、125、127、132和134的一个或多个位置处可包含突变的氨基酸残基。在一些优选的实施方案中,所提供的hngal突变蛋白能够结合cd137,特别是人cd137。
[0197]
在一些实施方案中,所提供的hngal突变蛋白在对应于成熟hngal的线性多肽序列(seq id no:2)的位置36、87和96的一个或多个位置处和在对应于成熟hngal的线性多肽序列(seq id no:2)的位置28、40
‑
41、49、52、65、68、70、72
‑
73、77、79、81、83、94、100、103、106、125、127、132和134的一个或多个位置处可包含突变的氨基酸残基。
[0198]
在一些其它实施方案中,所提供的hngal突变蛋白在对应于成熟hngal的线性多肽序列(seq id no:2)的位置20、25、28、33、36、40
‑
41、44、49、52、59、68、70
‑
73、77
‑
82、87、92、96、98、100、101、103、122、125、127、132和134的一个或多个位置处可包含突变的氨基酸残基。
[0199]
在其它实施方案中,所提供的hngal突变蛋白在对应于成熟hngal的线性多肽序列(seq id no:2)的位置36、40、41、49、52、68、70、72、73、77、79、81、96、100、103、125、127、132和134的一个或多个位置处和在对应于成熟hngal的线性多肽序列(seq id no:2)的位置20、25、33、44、59、71、78、80、82、87、92、98、101和122的一个或多个位置处可包含突变的氨基酸残基。
[0200]
在一些实施方案中,根据本发明的脂质运载蛋白突变蛋白可包含至少一个用如丝氨酸残基置换天然半胱氨酸残基的氨基酸置换。在一些实施方案中,根据本发明的hngal突变蛋白可包含用另一个氨基酸(比如丝氨酸残基)置换天然半胱氨酸残基的氨基酸置换,所述天然半胱氨酸残基在对应于成熟hngal的线性多肽序列(seq id no:2)的位置76和/或175的位置处。在本上下文中应注意已经发现(在相应的天然核酸文库的水平上)移除由半胱氨酸残基76和175形成的野生型hngal的结构二硫键(参见breustedt等,j biol chem,2005)可以提供hngal突变蛋白,其不仅稳定折叠,还能以高亲和力结合给定非
‑
天然靶标。在一些实施方案中,结构二硫键的消除可提供进一步的优点,即允许将非天然二硫键生成或有意引入到本发明的突变蛋白中,由此增加该突变蛋白的稳定性。然而,结合cd137并具有在cys 76和cys 175之间形成的二硫桥的hngal突变蛋白也是本发明的一部分。
[0201]
在一些实施方案中,所提供的结合cd137的hngal突变蛋白在对应于成熟hngal的线性多肽序列(seq id no:2)的位置28、36、40
‑
41、49、52、65、68、70、72
‑
73、77、79、81、83、87、94、96、100、103、106、125、127、132和134的一个或多个位置处可包含以下突变的氨基酸残基中的一个或多个:gln 28
→
his;leu 36
→
gln;ala 40
→
ile;ile 41
→
arg 或lys;gln 49
→
val、ile、his、ser或asn;tyr 52
→
met;asn 65
→
asp;ser 68
→
met、ala或gly;leu 70
→
ala、lys、ser或thr;arg 72
→
asp;lys 73
→
asp;asp 77
→
met、arg、thr或asn;trp 79
→
ala或asp;arg 81
→
met、trp或ser;phe 83
→
leu;cys 87
→
ser;leu 94
→
phe;asn 96
→
lys;tyr 100
→
phe;leu 103
→
his;tyr 106
→
ser;lys 125
→
phe;ser 127
→
phe;tyr 132
→
glu和lys 134
→
tyr。在一些实施方案中,本发明的hngal突变蛋白在成熟hngal(seq id no:2)的这些序列位置处包含两个或更多个,比如3、4、5、6、7、8、9、10、11、12、甚至更多个比如13、14、15、16、17、18、19、20、21、22、23、24个或全部突变的氨基酸残基。
[0202]
在一些实施方案中,所提供的结合cd137的hngal突变蛋白在对应于成熟hngal的线性多肽序列(seq id no:2)的位置20、25、28、33、36、40
‑
41、44、49、52、59、68、70
‑
73、77
‑
82、87、92、96、98、100、101、103、122、125、127、132和134的一个或多个位置处可包含以下突变的氨基酸残基中的一个或多个:gln 20
→
arg;asn 25
→
tyr或asp;gln 28
→
his;val 33
→
ile;leu 36
→
met;ala 40
→
asn;ile 41
→
leu;glu 44
→
val 或asp;gln 49
→
his;tyr 52
→
ser或gly;lys 59
→
asn;ser 68
→
asp;leu 70
→
met;phe 71
→
leu;arg 72
→
leu;lys 73
→
asp;asp 77
→
gln或his;tyr 78
→
his;trp 79
→
ile;ile 80
→
asn;arg 81
→
trp或gln;thr 82
→
pro;cys 87
→
ser;phe 92
→
leu或ser;asn 96
→
phe;lys 98
→
arg;tyr 100
→
asp;pro 101
→
leu;leu 103
→
his或pro;phe 122
→
tyr;lys 125
→
ser;ser 127
→
ile;tyr 132
→
trp;和lys 134
→
gly。在一些实施方案中,本发明的hngal突变蛋白在成熟hngal(seq id no:2)的这些序列位置处包含两个或更多个,比如3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33或34个突变的氨基酸残基。
[0203]
在一些实施方案中,所提供的结合cd137的hngal突变蛋白在对应于成熟hngal的线性多肽序列(seq id no:2)的位置36、40、41、49、52、68、70、72、73、77、79、81、96、100、103、125、127、132和134的一个或多个,比如2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19个位置处可包含以下突变的氨基酸残基中的一个或多个:leu 36
→
met;ala 40
→
asn;ile 41
→
leu;gln 49
→
his;tyr 52
→
ser或gly;ser 68
→
asp;leu 70
→
met;arg 72
→
leu;lys 73
→
asp;asp 77
→
gln 或his;trp 79
→
ile;arg 81
→
trp或gln;asn 96
→
phe;tyr 100
→
asp;leu 103
→
his或pro;lys 125
→
ser;ser 127
→
ile;tyr 132
→
trp;和lys 134
→
gly。在一些实施方案中,所提供的结合cd137的hngal突变蛋白在对应于成熟hngal的线性多肽序列(seq id no:2)的位置20、25、33、44、59、71、78、80、82、87、92、98、101和122的一个或多个,比如2、3、4、5、6、7、8、9、10、11、12、13、14个位置处可进一步包含以下突变的氨基酸残基中的一个或多个:gln 20
→
arg;asn 25
→
tyr或asp;val 33
→
ile;glu 44
→
val或asp;lys 59
→
asn;phe 71
→
leu;tyr 78
→
his;ile 80
→
asn;thr 82
→
pro;phe 92
→
leu或ser;lys 98
→
arg;pro 101
→
leu;和phe 122
→
tyr。
[0204]
在一些实施方案中,与成熟hngal的线性多肽序列(seq id no:2)相比,所提供的结合cd137的hngal突变蛋白可包含以下突变的氨基酸残基的组之一:
[0205]
(a)gln 28
→
his;leu 36
→
gln;ala 40
→
ile;ile 41
→
lys;gln 49
→
asn;tyr 52
→
met;ser 68
→
gly;leu 70
→
thr;arg 72
→
asp;lys 73
→
asp;asp 77
→
thr;trp 79
→
ala;arg 81
→
ser;cys 87
→
ser;asn 96
→
lys;tyr 100
→
phe;leu 103
→
his;tyr 106
→
ser;lys 125
→
phe;ser 127
→
phe;tyr 132
→
glu;和lys 134
→
tyr;
[0206]
(b)gln 28
→
his;leu 36
→
gln;ala 40
→
ile;ile 41
→
arg;gln 49
→
ile;tyr 52
→
met;asn 65
→
asp;ser 68
→
met;leu 70
→
lys;arg 72
→
asp;lys 73
→
asp;asp 77
→
met;trp 79
→
asp;arg 81
→
trp;cys 87
→
ser;asn 96
→
lys;tyr 100
→
phe;leu 103
→
his;tyr 106
→
ser;lys 125
→
phe;ser 127
→
phe;tyr 132
→
glu;和lys 134
→
tyr;
[0207]
(c)gln 28
→
his;leu 36
→
gln;ala 40
→
ile;ile 41
→
arg;gln 49
→
asn;tyr 52
→
met;asn 65
→
asp;ser 68
→
ala;leu 70
→
ala;arg 72
→
asp;lys 73
→
asp;asp 77
→
thr;trp 79
→
asp;arg 81
→
trp;cys 87
→
ser;asn 96
→
lys;tyr 100
→
phe;leu 103
→
his;tyr 106
→
ser;lys 125
→
phe;ser 127
→
phe;tyr 132
→
glu;和lys 134
→
tyr;
[0208]
(d)gln 28
→
his;leu 36
→
gln;ala 40
→
ile;ile 41
→
lys;gln 49
→
asn;tyr 52
→
met;asn 65
→
asp;ser 68
→
ala;leu 70
→
ala;arg 72
→
asp;lys 73
→
asp;asp 77
→
thr;trp 79
→
asp;arg 81
→
trp;cys 87
→
ser;asn 96
→
lys;tyr 100
→
phe;leu 103
→
his;tyr 106
→
ser;lys 125
→
phe;ser 127
→
phe;tyr 132
→
glu;和lys 134
→
tyr;
[0209]
(e)gln 28
→
his;leu 36
→
gln;ala 40
→
ile;ile 41
→
lys;gln 49
→
ser;tyr 52
→
met;asn 65
→
asp;ser 68
→
gly;leu 70
→
ser;arg 72
→
asp;lys 73
→
asp;asp 77
→
thr;trp 79
→
ala;arg 81
→
met;cys 87
→
ser;asn 96
→
lys;tyr 100
→
phe;leu 103
→
his;tyr 106
→
ser;lys 125
→
phe;ser 127
→
phe;tyr 132
→
glu;和lys 134
→
tyr;
[0210]
(f)gln 28
→
his;leu 36
→
gln;ala 40
→
ile;ile 41
→
lys;gln 49
→
val;tyr 52
→
met;asn 65
→
asp;ser 68
→
gly;leu 70
→
thr;arg 72
→
asp;lys 73
→
asp;asp 77
→
arg;trp 79
→
asp;arg 81
→
ser;cys 87
→
ser;leu 94
→
phe;asn 96
→
lys;tyr 100
→
phe;leu 103
→
his;tyr 106
→
ser;lys 125
→
phe;ser 127
→
phe;tyr 132
→
glu;和lys 134
→
tyr;
[0211]
(g)gln 28
→
his;leu 36
→
gln;ala 40
→
ile;ile 41
→
arg;gln 49
→
his;tyr 52
→
met;asn 65
→
asp;ser 68
→
gly;leu 70
→
thr;arg 72
→
asp;lys 73
→
asp;asp 77
→
thr;trp 79
→
ala;arg 81
→
ser;cys 87
→
ser;asn 96
→
lys;tyr 100
→
phe;leu 103
→
his;tyr 106
→
ser;lys 125
→
phe;ser 127
→
phe;tyr 132
→
glu;和lys 134
→
tyr;
[0212]
(h)gln 28
→
his;leu 36
→
gln;ala 40
→
ile;ile 41
→
lys;gln 49
→
asn;tyr 52
→
met;asn 65
→
asp;ser 68
→
gly;leu 70
→
thr;arg 72
→
asp;lys 73
→
asp;asp 77
→
thr;trp 79
→
ala;arg 81
→
ser;phe 83
→
leu;cys 87
→
ser;leu 94
→
phe;asn 96
→
lys;tyr 100
→
phe;leu 103
→
his;tyr 106
→
ser;lys 125
→
phe;ser 127
→
phe;tyr 132
→
glu;和lys 134
→
tyr;或
[0213]
(i)gln 28
→
his;leu 36
→
gln;ala 40
→
ile;ile 41
→
arg;gln 49
→
ser;tyr 52
→
met;asn 65
→
asp;ser 68
→
ala;leu 70
→
thr;arg 72
→
asp;lys 73
→
asp;asp 77
→
asn;trp 79
→
ala;arg 81
→
ser;cys 87
→
ser;asn 96
→
lys;tyr 100
→
phe;leu 103
→
his;tyr 106
→
ser;lys 125
→
phe;ser127
→
phe;tyr 132
→
glu;和lys 134
→
tyr。
[0214]
在一些其它实施方案中,在剩余区域,即与成熟hngal的线性多肽序列(seq id no:2)的位置28、36、40
‑
41、49、52、65、68、70、72
‑
73、77、79、81、83、87、94、96、100、103、106、125、127、132和134不同的区域,本发明的hngal突变蛋白可包含成熟hngal在突变的氨基酸序列位置之外的野生型(天然)氨基酸序列。
[0215]
在一些其它实施方案中,与成熟hngal的线性多肽序列(seq id no:2)相比,所提供的结合cd137的hngal突变蛋白可包含以下突变的氨基酸残基的组之一:
[0216]
(a)leu 36
→
met;ala 40
→
asn;ile 41
→
leu;gln 49
→
his;tyr 52
→
ser;ser 68
→
asp;leu 70
→
met;arg 72
→
leu;lys 73
→
asp;asp 77
→
gln;trp 79
→
ile;arg 81
→
trp;asn 96
→
phe;tyr 100
→
asp;leu 103
→
his;lys 125
→
ser;ser 127
→
ile;tyr 132
→
trp;和lys 134
→
gly;
[0217]
(b)leu 36
→
met;ala 40
→
asn;ile 41
→
leu;gln 49
→
his;tyr 52
→
ser;ser 68
→
asp;leu 70
→
met;arg 72
→
leu;lys 73
→
asp;asp 77
→
gln;trp 79
→
ile;arg 81
→
trp;phe 92
→
leu;asn 96
→
phe;lys 98
→
arg;tyr 100
→
asp;pro 101
→
leu;leu 103
→
his;lys 125
→
ser;ser 127
→
ile;tyr 132
→
trp;和lys 134
→
gly;
[0218]
(c)asn 25
→
tyr;leu 36
→
met;ala 40
→
asn;ile 41
→
leu;gln 49
→
his;tyr 52
→
gly;ser 68
→
asp;leu 70
→
met;phe 71
→
leu;arg 72
→
leu;lys 73
→
asp;asp 77
→
gln;trp 79
→
ile;arg 81
→
gln;phe 92
→
ser;asn 96
→
phe;tyr 100
→
asp;leu 103
→
his;lys 125
→
ser;ser 127
→
ile;tyr 132
→
trp;和lys 134
→
gly;
[0219]
(d)leu 36
→
met;ala 40
→
asn;ile 41
→
leu;gln 49
→
his;tyr 52
→
gly;ser 68
→
asp;leu 70
→
met;arg 72
→
leu;lys 73
→
asp;asp 77
→
gln;tyr 78
→
his;trp 79
→
ile;arg 81
→
trp;phe 92
→
leu;asn 96
→
phe;tyr 100
→
asp;leu 103
→
his;lys 125
→
ser;ser 127
→
ile;tyr 132
→
trp;和lys 134
→
gly;
[0220]
(e)asn 25
→
asp;leu 36
→
met;ala 40
→
asn;ile 41
→
leu;gln 49
→
his;tyr 52
→
gly;ser 68
→
asp;leu 70
→
met;arg 72
→
leu;lys 73
→
asp;asp 77
→
gln;trp 79
→
ile;arg 81
→
trp;phe 92
→
leu;asn 96
→
phe;tyr 100
→
asp;leu 103
→
his;lys 125
→
ser;ser 127
→
ile;tyr 132
→
trp;和lys 134
→
gly;
[0221]
(f)val 33
→
ile;leu 36
→
met;ala 40
→
asn;ile 41
→
leu;gln 49
→
his;tyr 52
→
gly;ser 68
→
asp;leu 70
→
met;arg 72
→
leu;lys 73
→
asp;asp 77
→
gln;trp 79
→
ile;arg 81
→
trp;phe 92
→
leu;asn 96
→
phe;tyr 100
→
asp;leu 103
→
his;lys 125
→
ser;ser 127
→
ile;tyr 132
→
trp;和lys 134
→
gly;
[0222]
(g)gln 20
→
arg;leu 36
→
met;ala 40
→
asn;ile 41
→
leu;glu 44
→
val;gln 49
→
his;tyr 52
→
gly;ser 68
→
asp;leu 70
→
met;arg 72
→
leu;lys 73
→
asp;asp 77
→
gln;trp 79
→
ile;arg 81
→
trp;phe 92
→
leu;asn 96
→
phe;tyr 100
→
asp;leu 103
→
his;phe 122
→
tyr;lys 125
→
ser;ser 127
→
ile;tyr 132
→
trp;和lys 134
→
gly;
[0223]
(h)leu 36
→
met;ala 40
→
asn;ile 41
→
leu;gln 49
→
his;tyr 52
→
ser;ser 68
→
asp;leu 70
→
met;arg 72
→
leu;lys 73
→
asp;asp 77
→
gln;trp 79
→
ile;ile 80
→
asn;arg 81
→
trp;thr 82
→
pro;asn 96
→
phe;tyr 100
→
asp;pro 101
→
leu;leu 103
→
pro;lys 125
→
ser;ser 127
→
ile;tyr 132
→
trp;和lys 134
→
gly;
[0224]
(i)leu 36
→
met;ala 40
→
asn;ile 41
→
leu;gln 49
→
his;tyr 52
→
gly;lys 59
→
asn;ser 68
→
asp;leu 70
→
met;arg 72
→
leu;lys 73
→
asp;asp 77
→
gln;trp 79
→
ile;arg 81
→
trp;phe 92
→
leu;asn 96
→
phe;tyr 100
→
asp;leu 103
→
his;lys 125
→
ser;ser 127
→
ile;tyr 132
→
trp;和lys 134
→
gly;和
[0225]
(j)leu 36
→
met;ala 40
→
asn;ile 41
→
leu;glu 44
→
asp;gln 49
→
his;tyr 52
→
ser;ser 68
→
asp;leu 70
→
met;phe 71
→
leu;arg 72
→
leu;lys 73
→
asp;asp 77
→
his;trp 79
→
ile;arg 81
→
trp;phe 92
→
leu;asn 96
→
phe;tyr 100
→
asp;leu 103
→
his;lys 125
→
ser;ser 127
→
ile;tyr 132
→
trp;和lys 134
→
gly。
[0226]
在一些实施方案中,与成熟hngal的线性多肽序列(seq id no:2)相比,所提供的
结合cd137的hngal突变蛋白可包含以下突变的氨基酸残基的组:gln 28
→
his;leu 36
→
gln;ala 40
→
ile;ile 41
→
arg;gln 49
→
ile;tyr 52
→
met;asn 65
→
asp;ser 68
→
met;leu 70
→
lys;arg 72
→
asp;lys 73
→
asp;asp 77
→
met;trp 79
→
asp;arg 81
→
trp;cys 87
→
ser;asn 96
→
lys;tyr 100
→
phe;leu 103
→
his;tyr 106
→
ser;lys 125
→
phe;ser 127
→
phe;tyr 132
→
glu;和lys 134
→
tyr和/或所提供的突变蛋白与seq id no:40的氨基酸序列可具有至少75%、至少80%、至少85%、至少90%、至少95%、至少98%或更高的序列同一性。
[0227]
在一些实施方案中,在本发明的hngal突变蛋白的剩余区域,即与成熟hngal的线性多肽序列(seq id no:2)的位置20、25、28、33、36、40
‑
41、44、49、52、59、68、70
‑
73、77
‑
82、87、92、96、98、100、101、103、122、125、127、132和134不同的区域,可包含成熟hngal在突变的氨基酸序列位置之外的野生型(天然)氨基酸序列。
[0228]
在一些实施方案中,本发明的hngal突变蛋白与成熟hngal的序列(seq id no:2)具有至少70%的序列同一性或至少70%的序列同源性。作为示例性实例,seq id no:40的突变蛋白与成熟hngal的氨基酸序列具有近87%的氨基酸序列同一性或序列同源性。
[0229]
在一些实施方案中,本发明的hngal突变蛋白包含如seq id nos:39
‑
57中任一个所示的氨基酸序列或其片段或变体。
[0230]
在一些实施方案中,本发明的hngal突变蛋白与选自seq id nos:39
‑
57的氨基酸序列具有至少75%、至少80%、至少85%、至少90%、至少95%、至少98%或更高的序列同一性。
[0231]
本发明还包含具有选自seq id nos:39
‑
57的氨基酸序列的hngal突变蛋白的结构同源物,所述结构同源物与所述hngal突变蛋白具有大于约60%,优选地大于65%、大于70%、大于75%、大于80%、大于85%、大于90%、大于92%和最优选地大于95%的氨基酸序列同源性或序列同一性。
[0232]
在一些实施方案中,本发明提供一种以约5nm或更低的k
d
量度的亲和力结合cd137的脂质运载蛋白突变蛋白,其中所述脂质运载蛋白突变蛋白与seq id no:40的氨基酸序列具有至少75%、至少80%、至少85%、至少90%、至少95%、至少98%或更高的序列同一性。
[0233]
在一些实施方案中,本发明提供一种以约5nm或更低的k
d
量度的亲和力结合cd137的脂质运载蛋白突变蛋白,其中所述脂质运载蛋白突变蛋白与seq id no:49的氨基酸序列具有至少75%、至少80%、至少85%、至少90%、至少95%、至少98%或更高的序列同一性。
[0234]
在一些实施方案中,本发明的脂质运载蛋白突变蛋白可在其n
‑
或c
‑
末端,优选地c
‑
末端包含异源氨基酸序列,比如strep ii标签(seq id no:12)或某些限制性酶的切割位点序列,而不影响该脂质运载蛋白突变蛋白的生物活性(结合其靶标,如cd137)。
[0235]
在一些实施方案中,可以引入脂质运载蛋白突变蛋白的其它修饰来调节突变蛋白的某些特征或者向突变蛋白中引入新的特征,所述调节突变蛋白的某些特征比如提高折叠稳定性、血清稳定性、蛋白抗性或水溶解性,或者降低聚集趋势。在一些实施方案中,修饰可导致所提供的突变蛋白的两个或更多(如2、3、4、5、6、7、8、9或10)个特征被调节。
[0236]
例如,还可以使脂质运载蛋白突变蛋白的一个或多个氨基酸序列位置突变以引入新的反应基团,例如用于与其它化合物如聚乙二醇(peg)、羟乙基淀粉(hes)、生物素、肽或蛋白质缀合,或用于形成非天然存在的二硫连结(linkage)。在一些情况下,缀合的化合物
(例如peg和hes)能够增加相应脂质运载蛋白突变蛋白的血清半衰期。
[0237]
在一些实施方案中,脂质运载蛋白突变蛋白的反应基团可天然存在于其氨基酸序列中,比如天然存在于所述氨基酸序列中的半胱氨酸残基。在一些其它实施方案中,可通过诱变引入此类反应基团。在通过诱变引入此类反应基团的情况下,一种可能性为在适当位置的氨基酸突变为半胱氨酸残基。将半胱氨酸残基引入htlc突变蛋白的氨基酸序列中的此类突变的示例性可能性包括htlc的野生型序列(seq id no:1)的置换thr 40
→
cys、glu 73
→
cys、arg 90
→
cys、asp 95
→
cys和glu 131
→
cys。将半胱氨酸残基引入hngal突变蛋白的氨基酸序列中的此类突变的示例性可能性包括,在对应于hngal的野生型序列(seq id no:2)的序列位置14、21、60、84、88、116、141、145、143、146或158的一个或多个序列位置处引入半胱氨酸残基。所产生的硫醇部分可以用于peg化或hes化该突变蛋白,例如,以便增加相应脂质运载蛋白突变蛋白的血清半衰期。
[0238]
在一些实施方案中,为了给将上述化合物中的一个缀合至脂质运载蛋白突变蛋白提供合适的氨基酸侧链以作为新的反应基团,可以将人工氨基酸引入脂质运载蛋白突变蛋白的氨基酸序列。一般而言,这些人工氨基酸设计为更具反应性,从而促进与所需化合物缀合。这种可通过诱变(例如采用人工trna)引入的人工氨基酸为对乙酰基
‑
苯丙氨酸。
[0239]
在一些实施方案中,本发明的脂质运载蛋白突变蛋白在其n
‑
末端或其c
‑
末端融合至蛋白、蛋白结构域或肽,例如,抗体、信号序列和/或亲和标签。在一些其它实施方案中,本发明的脂质运载蛋白突变蛋白在其n
‑
末端或其c
‑
末端缀合至配偶体,所述配偶体为蛋白、蛋白结构域或肽,例如抗体、信号序列和/或亲和标签。
[0240]
合适的融合配偶体的实例是诸如strep
‑
标签或strep
‑
标签ii(schmidt等,j mol biol,1996)、c
‑
myc
‑
标签、flag
‑
标签、his
‑
标签或ha
‑
标签的亲和标签或者诸如谷胱甘肽
‑
s
‑
转移酶的蛋白质,其允许容易检测和/或纯化重组蛋白。具有显色或荧光性质的蛋白(比如绿色荧光蛋白(gfp)或黄色荧光蛋白(yfp))也是本发明的脂质运载蛋白突变蛋白的合适融合配偶体。一般而言,可以用任何合适的化学物质或酶标记本发明的脂质运载蛋白突变蛋白,所述化学物质或酶在化学、物理、光学或酶反应中直接或间接产生可检测化合物或信号。例如,可将荧光或放射标记缀合至脂质运载蛋白突变蛋白以产生作为可检测信号的荧光或x
‑
射线。碱性磷酸酶、辣根过氧化物酶和β
‑
半乳糖苷酶是催化显色反应产物形成的酶标记(同时是光学标记)的实例。一般而言,通常用于抗体(除了那些专门与免疫球蛋白的fc部分中的糖部分一起使用的)的所有标记也可用于与本发明的脂质运载蛋白突变蛋白缀合。
[0241]
在一些实施方案中,本发明的脂质运载蛋白突变蛋白可与延长该突变蛋白血清半衰期的部分融合或缀合(这方面还参见国际专利公开文本no.wo 2006/056464,其中参考具有ctla
‑
4结合亲和力的人中性粒细胞明胶酶相关脂质运载蛋白(hngal)的突变蛋白描述了这种融合或缀合策略)。所述延长血清半衰期的部分可以是peg分子、hes分子、诸如棕榈酸(vajo和duckworth,pharmacol rev,2000)的脂肪酸分子、免疫球蛋白的fc部分、免疫球蛋白的c
h
3结构域、免疫球蛋白的c
h
4结构域、白蛋白结合肽、白蛋白结合蛋白或转铁蛋白,仅举几个例子。
[0242]
在一些实施方案中,若将peg用作缀合配偶体,则该peg分子可以是取代的、未取代的、线性的或支链的。其也可以是活化的聚乙烯衍生物。合适的化合物的实例是如国际专利
公开文本no.wo 1999/64016、美国专利no.6,177,074或美国专利no.6,403,564中关于干扰素所述的peg分子,或如对于其它蛋白例如peg修饰的天冬酰胺酶、peg
‑
腺苷脱氨酶(peg
‑
ada)或peg
‑
超氧化物歧化酶所述的peg分子(fuertges和abuchowski,journal of controlled release,1990)。此类聚合物(比如聚乙二醇)的分子量可以从约300至约70,000道尔顿,包括,例如,具有约10,000、约20,000、约30,000或约40,000道尔顿的分子量的聚乙二醇。此外,如例如美国专利no.6,500,930或6,620,413所述,基于延长血清半衰期的目的,可将诸如hes的碳水化合物低聚物和聚合物与本发明的突变蛋白缀合。
[0243]
在一些实施方案中,若将免疫球蛋白的fc部分用于延长本发明的脂质运载蛋白突变蛋白的血清半衰期的目的,则可采用可从syntonix pharmaceuticals,inc.(ma,usa)商购获得的synfusion
tm
技术。这种fc
‑
融合技术的应用允许产生更长效的生物药物,并可以例如由两个拷贝的连接至抗体fc区的所述突变蛋白组成以改善药物动力学、溶解度和生产效率。
[0244]
可用于延长脂质运载蛋白突变蛋白的血清半衰期的白蛋白结合肽的实例是例如如美国专利公开文本no.20030069395或dennis等(2002)所述,具有cys
‑
xaa1‑
xaa2‑
xaa3‑
xaa4‑
cys共有序列的那些,其中xaa1是asp、asn、ser、thr或trp;xaa2是asn、gln、his、ile、leu或lys;xaa3是ala、asp、phe、trp或tyr;和xaa4是asp、gly、leu、phe、ser或thr。融合或缀合至脂质运载蛋白突变蛋白以延长血清半衰期的白蛋白结合肽可以是细菌白蛋白结合蛋白、抗体、包括结构域抗体的抗体片段(参见例如美国专利6,696,245)或具有白蛋白结合活性的脂质运载蛋白突变蛋白。细菌白蛋白结合蛋白的实例包括链球菌蛋白g((konig和skerra,j immunol methods,1998)。
[0245]
在一些实施方案中,若白蛋白结合蛋白为抗体片段,其可以是结构域抗体。将结构域抗体(dab)工程化以允许精确控制生物物理性质和体内半衰期,从而产生最佳安全性和有效性产品特征(profile)。结构域抗体例如可从domantis ltd.(cambridge,uk和ma,usa)商购获得。
[0246]
在一些实施方案中,白蛋白本身(osborn等,j pharmacol exp ther,2002)或白蛋白的生物活性片段可用作本发明脂质运载蛋白突变蛋白的配偶体以延长血清半衰期。术语“白蛋白”包括所有的哺乳动物白蛋白,比如人血清白蛋白或牛血清白蛋白或大鼠白蛋白。可以按照美国专利no.5,728,553或欧洲专利公开文本no.ep0330451和no.ep0361991中的描述重组产生所述白蛋白或其片段。相应地,可将重组的人白蛋白(如,来自novozymes delta ltd.,nottingham,uk的)缀合或融合至本发明的脂质运载蛋白突变蛋白。
[0247]
在一些实施方案中,若将转铁蛋白用作延长本发明的脂质运载蛋白突变蛋白血清半衰期的配偶体,可将该突变蛋白遗传地融合至非
‑
糖基化转铁蛋白的n或c末端或者两者。非
‑
糖基化转铁蛋白具有14
‑
17天的半衰期,且转铁蛋白融合蛋白将类似地具有延长的半衰期。所述转铁蛋白载体还提供高生物利用度、生物分布和循环稳定性。这一技术可从biorexis(biorexis pharmaceutical corporation,pa,usa)商购获得。用于用作蛋白质稳定剂/半衰期延长配偶体的重组人转铁蛋白(deltaferrin
tm
)也可从novozymes delta ltd.(nottingham,uk)商购获得。
[0248]
另一个延长本发明的脂质运载蛋白突变蛋白半衰期的选择是将长的、非结构性
的、柔性富含甘氨酸的序列(例如具有约20至80个连续甘氨酸残基的聚甘氨酸)与突变蛋白的n
‑
或c
‑
末端融合。国际专利公开文本no.wo2007/038619中公开了这种方法,例如也称为“rpeg”(重组peg)。
[0249]
e.对cd137和gpc3特异性的融合蛋白的示例性用途和应用
[0250]
在一些实施方案中,本发明的融合蛋白可通过双重靶向(dual
‑
targeting)cd137和gpc3产生协同作用。在一些实施方案中,本发明的融合蛋白可通过双重靶向cd137和gpc3产生局部抗肿瘤作用。因此,本发明的融合蛋白在医学中存在许多可能的应用
[0251]
在一些实施方案中,本发明涵盖一种或多种本文公开的融合蛋白或一种或多种包含此类融合蛋白的组合物用于同时结合cd137和gpc3的用途。
[0252]
本发明还涉及一种或多种所述融合蛋白用于与cd137和/或gpc3形成复合物的用途。
[0253]
因此,在本发明的一方面,所提供的融合蛋白可用于检测cd137和gpc3。此类用途可包括如下步骤:使一种或多种所述融合蛋白与怀疑含有cd137和/或gpc3的样品在合适条件下接触,由此允许在融合蛋白与cd137和/或gpc3之间形成复合物,并通过合适的信号检测该复合物。可检测的信号可以由如上文所述的标记引起,或通过由于结合(即复合物形成)本身而导致的物理特性的变化而引起。一个实例是表面等离子体共振,其数值在结合配偶体的结合期间发生改变,所述配偶体中的一者固定在表面上,例如金箔上。
[0254]
本发明的融合蛋白还可用于分离cd137和/或gpc3。这种用途可包括以下步骤:使一种或多种所述融合蛋白与猜测含有cd137和/或gpc3的样品在合适条件下接触,由此允许在所述融合蛋白与cd137和/或gpc3之间形成复合物,并从所述样品中分离所述复合物。
[0255]
在一些实施方案中,本发明提供包含一种或多种根据本发明的融合蛋白的诊断和/或分析试剂盒。
[0256]
除了其在诊断中的用途,再一方面,本发明考虑包含一种或多种本发明的融合蛋白和药学上可接受的赋形剂的药物组合物。
[0257]
此外,在一些实施方案中,本发明提供同时结合cd137和/或gpc3的融合蛋白,用作诸如抗肿瘤剂和/或抗感染剂和免疫调节剂。在一些实施方案中,设想将本发明的融合蛋白用在预防、改善或治疗诸如各种癌症(包括gpc3阳性癌症,比如肝细胞癌(hcc)、黑色素瘤、merkel细胞瘤、wilm’s肿瘤和肝胚细胞瘤)的人疾病的方法中。因此,还提供了预防、改善或治疗有此需要的受试者中诸如各种癌症(包括gpc3阳性癌症,比如肝细胞癌(hcc)、黑色素瘤、merkel细胞瘤)的人疾病的方法,所述方法包括向所述受试者施用治疗有效量的一种或多种本发明的融合蛋白。
[0258]
可采用本发明的融合蛋白治疗的癌症的其它实例包括:肝癌、骨癌、胰腺癌、皮肤癌、头颈癌、乳腺癌、肺癌、皮肤或眼内恶性黑素瘤、肾癌、子宫癌、卵巢癌、结肠直肠癌、结肠癌、直肠癌、肛门区癌症、胃癌、睾丸癌、子宫癌、输卵管癌(carcinoma)、子宫内膜癌(carcinoma)、宫颈癌(carcinoma)、阴道癌(carcinoma)、外阴癌(carcinoma)、非霍奇金淋巴瘤、食道癌、小肠癌、内分泌系统癌、甲状腺癌、甲状旁腺癌、肾上腺癌、软组织肉瘤、尿道癌、阴茎癌、儿童实体瘤、淋巴细胞性淋巴瘤、膀胱癌、肾或输尿管癌、肾盂癌(carcinoma)、中枢神经系统(cns)肿瘤、原发性cns淋巴瘤、肿瘤血管生成、脊髓轴肿瘤、脑干胶质瘤、垂体瘤、卡波西(kaposi)肉瘤、表皮样癌、鳞状细胞癌,由环境诱导的包括那些由石棉诱导的癌
症,血液恶性肿瘤,包括例如多发性骨髓瘤、b细胞淋巴瘤、霍奇金淋巴瘤/原发性纵隔b细胞淋巴瘤、非霍奇金淋巴瘤、急性骨髓性淋巴瘤、慢性髓细胞性白血病、慢性淋巴样白血病、滤泡性淋巴瘤、弥漫性大b细胞淋巴瘤、伯基特(burkitt)淋巴瘤、免疫母细胞性大细胞淋巴瘤、前体b淋巴母细胞性淋巴瘤、外膜(mantle)细胞淋巴瘤、急性淋巴母细胞性白血病、蕈样霉菌病(mycosis fungoides)、间变性大细胞淋巴瘤、t细胞淋巴瘤、前体t淋巴母细胞性淋巴瘤和所述癌症的任意组合。在一些实施方案中,本发明还用于治疗转移性癌症。
[0259]
在一些实施方案中,本发明的融合蛋白可同时靶向其中表达gpc3的肿瘤细胞(比如hcc、黑色素瘤、merkel细胞瘤、wilm’s肿瘤和肝胚细胞瘤),并活化此类肿瘤细胞附近的宿主免疫系统的淋巴细胞。在一些实施方案中,本发明的融合蛋白可增加靶向的抗肿瘤t细胞活性、增强抗肿瘤免疫、诱导t细胞介导的细胞溶解和/或对肿瘤生长具有直接抑制作用,由此产生抗肿瘤结果。在一些实施方案中,本发明的融合蛋白可活化肿瘤微环境中的免疫应答。在一些实施方案中,本发明的融合蛋白可例如通过局部抑制致癌基因活性并诱导通过nk细胞和/或t细胞的细胞介导的细胞毒性,来降低效应淋巴细胞对健康细胞的副作用,即脱靶毒性。
[0260]
在一些实施方案中,本发明涵盖本发明的融合蛋白或包含所提供的融合蛋白的组合物用于在gpc3阳性肿瘤细胞(比如hcc、黑色素瘤、merkel细胞瘤、wilm’s肿瘤和肝胚细胞瘤)附近诱导局部淋巴细胞应答的用途。因此,在一些实施方案中,本发明提供在gpc3阳性肿瘤细胞(比如hcc、黑色素瘤、merkel细胞瘤、wilm’s肿瘤和肝胚细胞瘤)附近诱导局部淋巴细胞应答的方法,所述方法包括应用一种或多种本发明的融合蛋白或一种或多种包含此类融合蛋白的组合物。“局部(的)”意指在同时经由cd137结合t细胞并接合gpc3阳性肿瘤细胞后,t细胞在gpc3阳性细胞附近产生细胞因子,特别是il
‑
2和/或ifnγ。此类细胞因子反映了t细胞的活化,其随后能够通过活化其它杀伤细胞(比如t细胞或nk细胞)来直接或间接杀死gpc3阳性细胞。
[0261]
在一些实施方案中,本发明涵盖本发明的融合蛋白或包含此类融合蛋白的组合物用于共刺激t细胞和/或活化cd137下游信号传导通路的用途。优选地,当接合其中表达gpc3的肿瘤细胞时,所提供的融合蛋白共刺激t细胞和/或活化cd137下游信号传导通路。因此,本发明提供,优选地当接合其中表达gpc3的肿瘤细胞(比如hcc、黑色素瘤、merkel细胞瘤、wilm’s肿瘤和肝胚细胞瘤)时,诱导t淋巴细胞增殖和/或活化cd137下游信号传导通路的方法,所述方法包括应用一种或多种本发明的融合蛋白和/或一种或多种包含此类融合蛋白的组合物。
[0262]
在一些实施方案中,本发明涵盖本发明的融合蛋白或包含此类融合蛋白的组合物用于在t细胞上诱导cd137聚集和活化以及将此类t细胞导向其中表达gpc3的肿瘤细胞(比如hcc、黑色素瘤、merkel细胞瘤、wilm’s肿瘤和肝胚细胞瘤)的用途。
[0263]
对本领域技术人员而言,经审查以下的实施例及其附图(其并非意图是限制性的),本发明的另外的目的、优点和特征将变得显而易见。因此,应当理解的是,虽然本发明通过示例性实施方案以及任选的特征进行特定的公开,但本领域技术人员可以采取本文所公开于其中的公开内容的修饰及变化,且认为这样的修饰及变化在本发明的范围内。
[0264]
f.示例性的所提供对cd137和gpc3特异性的融合蛋白的产生
[0265]
在一些实施方案中,本发明提供包含编码所提供的融合蛋白的核苷酸序列的核酸
分子(dna和rna)。在一些实施方案中,本发明涵盖含有所提供的核酸分子的宿主细胞。由于遗传密码的简并性允许某些密码子被指定同一氨基酸的其它密码子取代,因此本发明不限于编码如本文所述融合蛋白的特定核酸分子,而是涵盖包含编码功能融合蛋白的核苷酸序列的所有核酸分子。在这方面,本发明还涉及编码所提供的融合蛋白的核苷酸序列。
[0266]
核酸分子,比如dna,如果它包含含有关于转录和/或翻译调节的信息的序列元件,并且这样的序列“可操作地连接”至编码所述蛋白的核苷酸序列,则被称为“能够表达核酸分子”或“能够允许表达核苷酸序列”。可操作的连接是这样的连接:在所述连接中,调节序列元件和待表达的序列以能够进行基因表达的方式连接。基因表达所必需的调节区域的确切性质可能因物种而异,但是通常这些区域包括启动子,所述启动子在原核生物中含有启动子本身(即引导转录起始的dna元件)以及当转录成rna时将发出翻译起始信号的dna元件。这样的启动子区域通常包括涉及转录和翻译起始的5’非编码序列,比如原核生物中的
‑
35/
‑
10盒和shine
‑
dalgarno元件或真核生物中的tata盒、caat序列和5'
‑
加帽元件。这些区域还可以包括增强子或阻遏子元件以及用于将天然蛋白靶向到宿主细胞的特定区室的翻译信号和前导序列。
[0267]
此外,所述3’非编码序列可能含有涉及转录终止、聚腺苷酸化等的调节元件。然而,如果这些终止序列在特定宿主细胞中不是令人满意的功能性的,则它们可能被该细胞中功能性的信号替代。
[0268]
因此,本发明的核酸分子可以“可操作地连接”至一个或多个调节序列(比如启动子序列)以允许该核酸分子表达。在一些实施方案中,本发明的核酸分子包括启动子序列和转录终止序列。合适的原核启动子例如为tet启动子、lacuv5启动子或t7启动子。可用于在真核细胞中表达的启动子的实例是sv40启动子或cmv启动子。
[0269]
在一些实施方案中,编码本技术中所公开的脂质运载蛋白突变蛋白的核酸分子可以与编码本发明的免疫球蛋白的另一个核酸分子“可操作地连接”,以允许本文公开的融合蛋白的表达。
[0270]
在一些实施方案中,所提供的方法可包括使至少一个编码成熟htlc的核酸分子在核苷酸三联体处经受诱变,以获得包含在所提供的融合蛋白中的脂质运载蛋白突变蛋白,所述核苷酸三联体编码对应于htlc的线性多肽序列(seq id no:1)的位置5、26
‑
31、33
‑
34、42、46、52、56、58、60
‑
61、65、71、85、94、101、104
‑
106、108、111、114、121、133、148、150和153的一个或多个位置。在一些实施方案中,所提供的方法可包括使至少一个编码成熟hngal的核酸分子在核苷酸三联体处经受诱变,以获得包含在所提供的融合蛋白中的脂质运载蛋白突变蛋白,所述核苷酸三联体编码对应于hngal的线性多肽序列(seq id no:2)的位置28、36、40
‑
41、49、52、65、68、70、72
‑
73、77、79、81、83、87、94、96、100、103、106、125、127、132和134的一个或多个位置。在一些实施方案中,所提供的方法可包括使至少一个编码成熟hngal的核酸分子在核苷酸三联体处经受诱变,以获得包含在所提供的融合蛋白中的脂质运载蛋白突变蛋白,所述核苷酸三联体编码对应于hngal的线性多肽序列(seq id no:2)的位置20、25、28、33、36、40
‑
41、44、49、52、59、68、70
‑
73、77
‑
82、87、92、96、98、100、101、103、122、125、127、132和134的一个或多个位置。
[0271]
此外,对于包含在融合蛋白中的本发明的htlc突变蛋白或hngal突变蛋白,在一些实施方案中,可以分别移除cys 61和cys 153或cys 76和cys 175之间天然存在的二硫键。
因此,此类突变蛋白可在具有减少的氧化还原环境(redox milieu)的细胞区室中,例如在革兰氏阴性细菌的细胞质中产生。
[0272]
进一步对于包含在融合蛋白中的本发明所提供的htlc突变蛋白或hngal突变蛋白,本发明还包括编码此类突变蛋白的核酸分子,在一些实施方案中,其在实验性诱变的指定序列位置之外可包含一个或多个另外的突变。这样的突变通常是可容忍的或甚至被证明是有利的,例如,如果它们有助于提高脂质运载蛋白突变蛋白和/或融合蛋白的折叠效率、血清稳定性、热稳定性或配体结合亲和力的话。
[0273]
在一些实施方案中,所提供的核酸分子还可以是载体或任何其它种类的克隆载体(vehicle)的一部分,所述克隆载体例如质粒、噬菌粒、噬菌体、杆状病毒、粘粒或人造染色体。
[0274]
在一些实施方案中,所提供的核酸分子可包含在噬菌粒中。如本上下文所使用的,噬菌粒载体表示编码温和噬菌体(比如m13或f1)的基因间区域的载体,或其融合至目标cdna的功能部分。例如,在一些实施方案中,经由此类提供的噬菌粒载体和适当的辅助噬菌体(如m13k07、vcs
‑
m13或r408)超感染细菌宿主细胞后,产生完整的噬菌体颗粒,由此使所编码的异源cdna能够与其相应的噬菌体表面上展示的多肽物理偶联(lowman,annu rev biophys biomol struct,1997;rodi和makowski,curr opin biotechnol,1999)。
[0275]
根据不同的实施方案,除了上述调节序列以及编码如本文所述的融合蛋白的核酸序列之外,克隆载体可以包含来源于与用于表达的宿主细胞相容的物种的复制和控制序列,以及在转化或转染的细胞上赋予可选表型的选择标记物。大量的合适的克隆载体是本领域已知的,并且是可商购获得的。
[0276]
在一些实施方案中,本发明还涉及采用基因工程的方法从编码融合蛋白或其中任何亚基的核酸开始产生本发明的融合蛋白的方法。在一些实施方案中,所提供的方法可以在体内进行,其中所提供的融合蛋白可以例如在细菌或真核宿主生物体中产生,然后从该宿主生物体或其培养物中分离。也可以例如使用体外翻译系统在体外产生本发明的融合蛋白。
[0277]
当在体内产生融合蛋白时,可采用本领域熟知的重组dna技术将编码此类蛋白的核酸引入到合适的细菌或真核宿主生物体中。在一些实施方案中,可以将编码如本文所述的融合蛋白的dna分子,特别是含有此类融合蛋白的编码序列的克隆载体转化至能够表达该基因的宿主细胞中。可以采用标准方法进行转化。因此,本发明还涉及含有本文公开的核酸分子的宿主细胞。
[0278]
在一些实施方案中,所转化的宿主细胞可在适用于编码本发明的融合蛋白的核苷酸序列表达的条件下培养。在一些实施方案中,宿主细胞可以是原核的诸如大肠杆菌(e.coli)或枯草芽孢杆菌(bacillus subtilis),或真核的诸如酿酒酵母(saccharomyces cerevisiae)、巴斯德毕赤酵母(pichia pastoris)、sf9或high5昆虫细胞、永生化哺乳动物细胞系(如hela细胞或cho细胞)或原代哺乳动物细胞。
[0279]
在一些实施方案(其中本发明的(包括包含在本文所公开的融合蛋白中的)脂质运载蛋白突变蛋白包括分子内二硫键)中,可以优选使用适当的信号序列将新生蛋白引导至具有氧化还原环境的细胞区室。这样的氧化环境可以由革兰氏阴性细菌(比如大肠杆菌)的周质提供,在革兰氏阳性细菌的细胞外环境中,或在真核细胞的内质网的内腔中,并通常有
利于结构二硫键的形成。
[0280]
在一些实施方案中,还可以在宿主细胞(优选大肠杆菌)的胞质溶胶中产生本发明的融合蛋白。在这种情况下,所提供的融合蛋白能够以可溶性的和折叠的状态直接获得,或者以包涵体的形式被回收,然后在体外复性。另一个选择是使用特定宿主菌株,所述菌株具有氧化细胞内环境,这由此可允许在胞质溶胶中形成二硫键(venturi等,j mol biol,2002)。
[0281]
在一些实施方案中,如本文所述的本发明的融合蛋白可不一定是通过使用遗传工程全部或部分地生成或产生的。而是,此类蛋白还可通过许多常规和熟知的技术中的任意技术获得,比如普通有机合成策略、固相相关合成技术、可商购获得的自动合成仪或通过体外转录和翻译。例如有可能的是,使用分子建模识别有前途的融合蛋白或包含在此类融合蛋白中的脂质运载蛋白突变蛋白,在体外合成它们,并且研究它们对目标靶标的结合活性。用于蛋白质的固相和/或溶液相合成的方法是本领域熟知的(参见如bruckdorfer等,curr pharm biotechnol,2004)。
[0282]
在一些实施方案中,本发明的融合蛋白可以通过使用本领域技术人员已知的已充分建立的方法的体外转录/翻译产生。
[0283]
在一些进一步的实施方案中,本文所述的融合蛋白还可通过单独的常规重组技术或与常规合成技术结合来制备。
[0284]
此外,在一些实施方案中,根据本发明的融合蛋白可通过将单独的亚基(如免疫球蛋白)与包含在融合蛋白中的突变蛋白缀合在一起来获得。可以例如采用常规方法通过所有形式的共价或非共价连接来实现此类缀合。
[0285]
本领域技术人员将理解可用于制备本发明所预期的、但其蛋白质或核酸序列未在本文中明确公开的融合蛋白的方法。作为概述,氨基酸序列的这种修饰包括如单个氨基酸位置的定向诱变,以通过引入某些限制性酶的切割位点来简化蛋白基因或其部分的亚克隆。此外,还能够引入这些突变以进一步提高融合蛋白对其靶标(例如cd137和gpc3)的亲和力。此外,若需要,可以引入突变以调节所述蛋白的一个或多个特征,比如,以改善折叠稳定性、血清稳定性、蛋白抗性或水溶解性或降低聚集倾向。
[0286]
本发明的特征还在于以下项目。
[0287]
项目1、一种能够结合cd137和gpc3的融合蛋白,其中所述融合蛋白包含至少两个任意顺序的亚基,其中第一亚基包含全长免疫球蛋白或其抗原结合结构域且是对gpc3特异性的,和其中第二亚基包含脂质运载蛋白突变蛋白且是对cd137特异性的。
[0288]
项目2、一种融合蛋白,其中所述融合蛋白包含至少两个亚基,其中第一亚基包含全长免疫球蛋白或其抗原结合结构域且是对gpc3特异性的,和其中第二亚基包含脂质运载蛋白突变蛋白且是对cd137特异性的,其中所述第二亚基任选地经由连接子以n
‑
末端连接至所述第一亚基的每条重链的c
‑
末端。
[0289]
项目3、一种融合蛋白,其中所述融合蛋白包含至少两个亚基,其中第一亚基包含全长免疫球蛋白或其抗原结合结构域且是对gpc3特异性的,和其中第二亚基包含脂质运载蛋白突变蛋白且是对cd137特异性的,其中所述第二亚基任选地经由连接子以c
‑
末端连接至所述第一亚基的每条重链的n
‑
末端。
[0290]
项目4、一种融合蛋白,其中所述融合蛋白包含至少两个亚基,其中第一亚基包含
全长免疫球蛋白或其抗原结合结构域且是对gpc3特异性的,和其中第二亚基包含脂质运载蛋白突变蛋白且是对cd137特异性的,其中所述第二亚基任选地经由连接子以n
‑
末端连接至所述第一亚基的每条轻链的c
‑
末端。
[0291]
项目5、一种融合蛋白,其中所述融合蛋白包含至少两个亚基,其中第一亚基包含全长免疫球蛋白或其抗原结合结构域且是对gpc3特异性的,和其中第二亚基包含脂质运载蛋白突变蛋白且是对cd137特异性的,其中所述第二亚基任选地经由连接子以c
‑
末端连接至所述第一亚基的每条轻链的n
‑
末端。
[0292]
项目6、根据项目1
‑
5中任一项所述的融合蛋白,其中所述融合蛋白能够以至多约1nm的k
d
值结合gpc3或能够以与包含于所述第一亚基中的免疫球蛋白或其抗原结合结构域单独的k
d
值相当或更低的k
d
值结合gpc3。
[0293]
项目7、根据项目6所述的融合蛋白,其中通过表面等离子体共振(spr)分析测定k
d
值。
[0294]
项目8、根据项目1
‑
7中任一项所述的融合蛋白,其中所述融合蛋白能够以至多约0.5nm的ec
50
值结合gpc3或能够以与包含于所述第一亚基中的免疫球蛋白或其抗原结合结构域单独的ec
50
值相当或更低的ec
50
值结合gpc3。
[0295]
项目9、根据项目1
‑
8中任一项所述的融合蛋白,其中所述融合蛋白能够以至多约3nm的ec
50
值结合cd137或能够以与包含于所述第二亚基中的对cd137特异性的脂质运载蛋白突变蛋白单独的ec
50
值相当或更低的ec
50
值结合cd137。
[0296]
项目10、根据项目8
‑
9中任一项所述的融合蛋白,其中通过酶联免疫吸附试验(elisa)分析测定ec
50
值。
[0297]
项目11、根据项目1
‑
10中任一项所述的融合蛋白,其中所述融合蛋白与猕猴gpc3交叉反应。
[0298]
项目12、根据项目1
‑
11中任一项所述的融合蛋白,其中当在elisa分析中测量所述融合蛋白时,所述融合蛋白能够以至多约10nm的ec
50
值同时结合cd137和gpc3。
[0299]
项目13、根据项目1
‑
12中任一项所述的融合蛋白,其中当在流式细胞分析中测量所述融合蛋白时,所述融合蛋白能够以至多约30nm的ec
50
值结合细胞上表达的cd137。
[0300]
项目14、根据项目1
‑
13中任一项所述的融合蛋白,其中当在流式细胞分析中测量所述融合蛋白时,所述融合蛋白能够以至多约30nm的ec
50
值结合细胞上表达的gpc3。
[0301]
项目15、根据项目1
‑
14中任一项所述的融合蛋白,其中所述融合蛋白能够结合表达gpc3的肿瘤细胞。
[0302]
项目16、根据项目1
‑
15中任一项所述的融合蛋白,其中所述融合蛋白能够刺激t细胞应答。
[0303]
项目17、根据项目1
‑
16中任一项所述的融合蛋白,其中所述融合蛋白能够诱导il
‑
2的分泌增加。
[0304]
项目18、根据项目1
‑
17中任一项所述的融合蛋白,其中与seq id no:83相比,所述融合蛋白能够诱导il
‑
2分泌增加至更高水平;和/或与seq id no:83相比,所述融合蛋白能够以更好的效率诱导il
‑
2的分泌增加。
[0305]
项目19、根据项目1
‑
18中任一项所述的融合蛋白,其中所述融合蛋白能够诱导淋巴细胞介导的细胞毒性。
[0306]
项目20、根据项目1
‑
19中任一项所述的融合蛋白,其中与seq id no:83相比,所述融合蛋白能够诱导由t细胞介导的表达gpc3的肿瘤细胞的杀伤增强;和/或与seq id no:83相比,所述融合蛋白能够以更好的效率诱导细胞毒性t细胞活化。
[0307]
项目21、根据项目1
‑
20中任一项所述的融合蛋白,其中所述融合蛋白能够以gpc3依赖性方式共刺激t细胞应答。
[0308]
项目22、根据项目1
‑
21中任一项所述的融合蛋白,其中所述融合蛋白能够在肿瘤微环境中共刺激t细胞应答。
[0309]
项目23、根据项目1
‑
22中任一项所述的融合蛋白,其中在gpc3不存在下,所述融合蛋白不共刺激t细胞应答。
[0310]
项目24、根据项目1
‑
23中任一项所述的融合蛋白,其中所述融合蛋白具有抗体样药代动力学特征。
[0311]
项目25、根据项目1
‑
24中任一项所述的融合蛋白,其中所述融合蛋白在小鼠中具有至少50小时、至少75小时、至少100小时、至少125小时、至少150小时、至少175小时、至少200小时、至少250小时或甚至更长的半衰期,和/或其中所述融合蛋白在小鼠中具有比seq id no:83的半衰期更长的半衰期。
[0312]
项目26、根据项目1
‑
25中任一项所述的融合蛋白,其中所述融合蛋白具有至少6.5、至少6.8、至少7.1、至少7.4、至少7.5、至少7.7或甚至更高的等电点,和/或其中所述融合蛋白具有比seq id no:83的等电点更高的等电点。
[0313]
项目27、根据项目1
‑
26中任一项所述的融合蛋白,其中所述脂质运载蛋白突变蛋白在对应于成熟人泪液脂质运载蛋白的线性多肽序列(seq id no:1)的位置5、26
‑
31、33
‑
34、42、46、52、56、58、60
‑
61、65、71、85、94、101、104
‑
106、108、111、114、121、133、148、150和153的位置处包含一个或多个突变的氨基酸残基。
[0314]
项目28、根据项目1
‑
27中任一项所述的融合蛋白,其中所述脂质运载蛋白突变蛋白的氨基酸序列在对应于成熟htlc的线性多肽序列(seq id no:1)的位置5、26
‑
31、33
‑
34、42、46、52、56、58、60
‑
61、65、71、85、94、101、104
‑
106、108、111、114、121、133、148、150和153的一个或多个位置处包含以下突变的氨基酸残基中的一个或多个:ala 5
→
val或thr;arg 26
→
glu;glu 27
→
gly;phe 28
→
cys;pro 29
→
arg;glu 30
→
pro;met 31
→
trp;leu 33
→
ile;glu 34
→
phe;thr 42
→
ser;gly 46
→
asp;lys 52
→
glu;leu 56
→
ala;ser 58
→
asp;arg 60
→
pro;cys 61
→
ala;ly s65
→
arg或asn;thr 71
→
ala;val 85
→
asp;lys 94
→
arg或glu;cys 101
→
ser;glu 104
→
val;leu 105
→
cys;his 106
→
asp;lys 108
→
ser;arg 111
→
pro;lys 114
→
trp;lys 121
→
glu;ala 133
→
thr;arg 148
→
ser;ser 150
→
ile和cys 153
→
ser。
[0315]
项目29、根据项目1
‑
28中任一项所述的融合蛋白,其中与成熟人泪液脂质运载蛋白的线性多肽序列(seq id no:1)相比,所述脂质运载蛋白突变蛋白的氨基酸序列包含以下突变的氨基酸残基的组之一:
[0316]
(a)arg 26
→
glu;glu 27
→
gly;phe 28
→
cys;pro 29
→
arg;glu 30
→
pro;met 31
→
trp;leu 33
→
ile;glu 34
→
phe;leu 56
→
ala;ser 58
→
asp;arg 60
→
pro;cys 61
→
ala;cys 101
→
ser;glu 104
→
val;leu 105
→
cys;his 106
→
asp;lys 108
→
ser;arg 111
→
pro;lys 114
→
trp;和cys 153
→
ser;
[0317]
(b)ala 5
→
thr;arg 26
→
glu;glu 27
→
gly;phe 28
→
cys;pro 29
→
arg;glu 30
→
pro;met 31
→
trp;leu 33
→
ile;glu 34
→
phe;leu 56
→
ala;ser 58
→
asp;arg 60
→
pro;cys 61
→
ala;lys 65
→
arg;val 85
→
asp;cys 101
→
ser;glu 104
→
val;leu 105
→
cys;his 106
→
asp;lys 108
→
ser;arg 111
→
pro;lys 114
→
trp;lys 121
→
glu;ala 133
→
thr;和cys 153
→
ser;
[0318]
(c)arg 26
→
glu;glu 27
→
gly;phe 28
→
cys;pro 29
→
arg;glu 30
→
pro;met 31
→
trp;leu 33
→
ile;glu 34
→
phe;leu 56
→
ala;ser 58
→
asp;arg 60
→
pro;cys 61
→
ala;lys 65
→
asn;lys 94
→
arg;cys 101
→
ser;glu 104
→
val;leu 105
→
cys;his 106
→
asp;lys 108
→
ser;arg 111
→
pro;lys 114
→
trp;lys 121
→
glu;ala 133
→
thr;和cys 153
→
ser;
[0319]
(d)ala 5
→
val;arg 26
→
glu;glu 27
→
gly;phe 28
→
cys;pro 29
→
arg;glu 30
→
pro;met 31
→
trp;leu 33
→
ile;glu 34
→
phe;leu 56
→
ala;ser 58
→
asp;arg 60
→
pro;cys 61
→
ala;lys 65
→
arg;lys 94
→
glu;cys 101
→
ser;glu 104
→
val;leu 105
→
cys;his 106
→
asp;lys 108
→
ser;arg 111
→
pro;lys 114
→
trp;lys 121
→
glu;ala 133
→
thr;和cys 153
→
ser;
[0320]
(e)arg 26
→
glu;glu 27
→
gly;phe 28
→
cys;pro 29
→
arg;glu 30
→
pro;met 31
→
trp;leu 33
→
ile;glu 34
→
phe;thr 42
→
ser;leu 56
→
ala;ser 58
→
asp;arg 60
→
pro;cys 61
→
ala;cys 101
→
ser;glu 104
→
val;leu 105
→
cys;his 106
→
asp;lys 108
→
ser;arg 111
→
pro;lys 114
→
trp;ser 150
→
ile;和cys 153
→
ser;
[0321]
(f)arg 26
→
glu;glu 27
→
gly;phe 28
→
cys;pro 29
→
arg;glu 30
→
pro;met 31
→
trp;leu 33
→
ile;glu 34
→
phe;lys 52
→
glu;leu 56
→
ala;ser 58
→
asp;arg 60
→
pro;cys 61
→
ala;thr 71
→
ala;cys 101
→
ser;glu 104
→
val;leu 105
→
cys;his 106
→
asp;lys 108
→
ser;arg 111
→
pro;lys 114
→
trp;ala 133
→
thr;arg 148
→
ser;ser 150
→
ile;和cys 153
→
ser;和
[0322]
(g)ala 5
→
thr;arg 26
→
glu;glu 27
→
gly;phe 28
→
cys;pro 29
→
arg;glu 30
→
pro;met 31
→
trp;leu 33
→
ile;glu 34
→
phe;gly 46
→
asp;leu 56
→
ala;ser 58
→
asp;arg 60
→
pro;cys 61
→
ala;thr 71
→
ala;cys 101
→
ser;glu 104
→
val;leu 105
→
cys;his 106
→
asp;lys 108
→
ser;arg 111
→
pro;lys 114
→
trp;ser 150
→
ile;和cys 153
→
ser。
[0323]
项目30、根据项目1
‑
29中任一项所述的融合蛋白,其中所述脂质运载蛋白突变蛋白的氨基酸序列包含选自seq id nos:32
‑
38或其片段或变体的氨基酸序列。
[0324]
项目31、根据项目1
‑
30中任一项所述的融合蛋白,其中所述脂质运载蛋白突变蛋白的氨基酸序列与选自seq id nos:32
‑
38的氨基酸序列具有至少85%的序列同一性。
[0325]
项目32、根据项目1
‑
26中任一项所述的融合蛋白,其中所述脂质运载蛋白突变蛋白在对应于成熟人中性粒细胞明胶酶相关脂质运载蛋白(hngal)的线性多肽序列(seq id no:2)的位置28、36、40
‑
41、49、52、65、68、70、72
‑
73、77、79、81、83、87、94、96、100、103、106、125、127、132和134的位置处包含一个或多个突变的氨基酸残基。
[0326]
项目33、根据项目1
‑
26和32中任一项所述的融合蛋白,其中所述脂质运载蛋白突变蛋白的氨基酸序列在对应于成熟人中性粒细胞明胶酶相关脂质运载蛋白(hngal)的线性
多肽序列(seq id no:2)的位置28、36、40
‑
41、49、52、65、68、70、72
‑
73、77、79、81、83、87、94、96、100、103、106、125、127、132和134的位置处包含以下突变的氨基酸残基中的一个或多个:gln 28
→
his;leu 36
→
gln;ala 40
→
ile;ile 41
→
arg或lys;gln 49
→
val、ile、his、ser或asn;tyr 52
→
met;asn 65
→
asp;ser 68
→
met、ala或gly;leu 70
→
ala、lys、ser或thr;arg 72
→
asp;lys 73
→
asp;asp 77
→
met、arg、thr或asn;trp 79
→
ala或asp;arg 81
→
met、trp或ser;phe 83
→
leu;cys 87
→
ser;leu 94
→
phe;asn 96
→
lys;tyr 100
→
phe;leu 103
→
his;tyr 106
→
ser;lys 125
→
phe;ser 127
→
phe;tyr 132
→
glu 和lys 134
→
tyr。
[0327]
项目34、根据项目1
‑
26和33中任一项所述的融合蛋白,其中所述脂质运载蛋白突变蛋白在对应于成熟人中性粒细胞明胶酶相关脂质运载蛋白(hngal)的线性多肽序列(seq id no:2)的位置20、25、28、33、36、40
‑
41、44、49、52、59、68、70
‑
73、77
‑
82、87、92、96、98、100、101、103、122、125、127、132和134的位置处包含一个或多个突变的氨基酸残基。
[0328]
项目35、根据项目1
‑
26和34中任一项所述的融合蛋白,其中所述脂质运载蛋白突变蛋白的氨基酸序列在对应于成熟hngal的线性多肽序列(seq id no:2)的位置20、25、28、33、36、40
‑
41、44、49、52、59、68、70
‑
73、77
‑
82、87、92、96、98、100、101、103、122、125、127、132和134的位置处包含以下突变的氨基酸残基中的一个或多个:gln 20
→
arg;asn 25
→
tyr 或asp;gln 28
→
his;val 33
→
ile;leu 36
→
met;ala 40
→
asn;ile 41
→
leu;glu 44
→
val或asp;gln 49
→
his;tyr 52
→
ser或gly;lys 59
→
asn;ser 68
→
asp;leu 70
→
met;phe 71
→
leu;arg 72
→
leu;lys 73
→
asp;asp 77
→
gln或his;tyr 78
→
his;trp 79
→
ile;ile 80
→
asn;arg 81
→
trp或gln;thr 82
→
pro;cys 87
→
ser;phe 92
→
leu或ser;asn 96
→
phe;lys 98
→
arg;tyr 100
→
asp;pro 101
→
leu;leu 103
→
his或pro;phe 122
→
tyr;lys 125
→
ser;ser 127
→
ile;tyr 132
→
trp;和lys 134
→
gly。
[0329]
项目36、根据项目1
‑
26和32
‑
35中任一项所述的融合蛋白,其中与成熟hngal的线性多肽序列(seq id no:2)相比,所述脂质运载蛋白突变蛋白的氨基酸序列包含以下突变的氨基酸残基的组之一:
[0330]
(a)gln 28
→
his;leu 36
→
gln;ala 40
→
ile;ile 41
→
lys;gln 49
→
asn;tyr 52
→
met;ser 68
→
gly;leu 70
→
thr;arg 72
→
asp;lys 73
→
asp;asp 77
→
thr;trp 79
→
ala;arg 81
→
ser;cys 87
→
ser;asn 96
→
lys;tyr 100
→
phe;leu 103
→
his;tyr 106
→
ser;lys 125
→
phe;ser 127
→
phe;tyr 132
→
glu;和lys 134
→
tyr;
[0331]
(b)gln 28
→
his;leu 36
→
gln;ala 40
→
ile;ile 41
→
arg;gln 49
→
ile;tyr 52
→
met;asn 65
→
asp;ser 68
→
met;leu 70
→
lys;arg 72
→
asp;lys 73
→
asp;asp 77
→
met;trp 79
→
asp;arg 81
→
trp;cys 87
→
ser;asn 96
→
lys;tyr 100
→
phe;leu 103
→
his;tyr 106
→
ser;lys 125
→
phe;ser 127
→
phe;tyr 132
→
glu;和lys 134
→
tyr;
[0332]
(c)gln 28
→
his;leu 36
→
gln;ala 40
→
ile;ile 41
→
arg;gln 49
→
asn;tyr 52
→
met;asn 65
→
asp;ser 68
→
ala;leu 70
→
ala;arg 72
→
asp;lys 73
→
asp;asp 77
→
thr;trp 79
→
asp;arg 81
→
trp;cys 87
→
ser;asn 96
→
lys;tyr 100
→
phe;leu 103
→
his;tyr 106
→
ser;lys 125
→
phe;ser 127
→
phe;tyr 132
→
glu;和lys 134
→
tyr;
[0333]
(d)gln 28
→
his;leu 36
→
gln;ala 40
→
ile;ile 41
→
lys;gln 49
→
asn;tyr 52
→
met;asn 65
→
asp;ser 68
→
ala;leu 70
→
ala;arg 72
→
asp;lys 73
→
asp;asp 77
→
thr;trp 79
→
asp;arg 81
→
trp;cys 87
→
ser;asn 96
→
lys;tyr 100
→
phe;leu 103
→
his;tyr 106
→
ser;lys 125
→
phe;ser 127
→
phe;tyr 132
→
glu;和lys 134
→
tyr;
[0334]
(e)gln 28
→
his;leu 36
→
gln;ala 40
→
ile;ile 41
→
lys;gln 49
→
ser;tyr 52
→
met;asn 65
→
asp;ser 68
→
gly;leu 70
→
ser;arg 72
→
asp;lys 73
→
asp;asp 77
→
thr;trp 79
→
ala;arg 81
→
met;cys 87
→
ser;asn 96
→
lys;tyr 100
→
phe;leu 103
→
his;tyr 106
→
ser;lys 125
→
phe;ser 127
→
phe;tyr 132
→
glu;和lys 134
→
tyr;
[0335]
(f)gln 28
→
his;leu 36
→
gln;ala 40
→
ile;ile 41
→
lys;gln 49
→
val;tyr 52
→
met;asn 65
→
asp;ser 68
→
gly;leu 70
→
thr;arg 72
→
asp;lys 73
→
asp;asp 77
→
arg;trp 79
→
asp;arg 81
→
ser;cys 87
→
ser;leu 94
→
phe;asn 96
→
lys;tyr 100
→
phe;leu 103
→
his;tyr 106
→
ser;lys 125
→
phe;ser 127
→
phe;tyr 132
→
glu;和lys 134
→
tyr;
[0336]
(g)gln 28
→
his;leu 36
→
gln;ala 40
→
ile;ile 41
→
arg;gln 49
→
his;tyr 52
→
met;asn 65
→
asp;ser 68
→
gly;leu 70
→
thr;arg 72
→
asp;lys 73
→
asp;asp 77
→
thr;trp 79
→
ala;arg 81
→
ser;cys 87
→
ser;asn 96
→
lys;tyr 100
→
phe;leu 103
→
his;tyr 106
→
ser;lys 125
→
phe;ser 127
→
phe;tyr 132
→
glu;和lys 134
→
tyr;
[0337]
(h)gln 28
→
his;leu 36
→
gln;ala 40
→
ile;ile 41
→
lys;gln 49
→
asn;tyr 52
→
met;asn 65
→
asp;ser 68
→
gly;leu 70
→
thr;arg 72
→
asp;lys 73
→
asp;asp 77
→
thr;trp 79
→
ala;arg 81
→
ser;phe 83
→
leu;cys 87
→
ser;leu 94
→
phe;asn 96
→
lys;tyr 100
→
phe;leu 103
→
his;tyr 106
→
ser;lys 125
→
phe;ser 127
→
phe;tyr 132
→
glu;和lys 134
→
tyr;
[0338]
(i)gln 28
→
his;leu 36
→
gln;ala 40
→
ile;ile 41
→
arg;gln 49
→
ser;tyr 52
→
met;asn 65
→
asp;ser 68
→
ala;leu 70
→
thr;arg 72
→
asp;lys 73
→
asp;asp 77
→
asn;trp 79
→
ala;arg 81
→
ser;cys 87
→
ser;asn 96
→
lys;tyr 100
→
phe;leu 103
→
his;tyr 106
→
ser;lys 125
→
phe;ser 127
→
phe;tyr 132
→
glu;和lys 134
→
tyr;
[0339]
(j)leu 36
→
met;ala 40
→
asn;ile 41
→
leu;gln 49
→
his;tyr 52
→
ser;ser 68
→
asp;leu 70
→
met;arg 72
→
leu;lys 73
→
asp;asp 77
→
gln;trp 79
→
ile;arg 81
→
trp;asn 96
→
phe;tyr 100
→
asp;leu 103
→
his;lys 125
→
ser;ser 127
→
ile;tyr 132
→
trp;和lys 134
→
gly;
[0340]
(k)leu 36
→
met;ala 40
→
asn;ile 41
→
leu;gln 49
→
his;tyr 52
→
ser;ser 68
→
asp;leu 70
→
met;arg 72
→
leu;lys 73
→
asp;asp 77
→
gln;trp 79
→
ile;arg 81
→
trp;phe 92
→
leu;asn 96
→
phe;lys 98
→
arg;tyr 100
→
asp;pro 101
→
leu;leu 103
→
his;lys 125
→
ser;ser 127
→
ile;tyr 132
→
trp;和lys 134
→
gly;
[0341]
(l)asn 25
→
tyr;leu 36
→
met;ala 40
→
asn;ile 41
→
leu;gln 49
→
his;tyr 52
→
gly;ser 68
→
asp;leu 70
→
met;phe 71
→
leu;arg 72
→
leu;lys 73
→
asp;asp 77
→
gln;trp 79
→
ile;arg 81
→
gln;phe 92
→
ser;asn 96
→
phe;tyr 100
→
asp;leu 103
→
his;lys 125
→
ser;ser 127
→
ile;tyr 132
→
trp;和lys 134
→
gly;
[0342]
(m)leu 36
→
met;ala 40
→
asn;ile 41
→
leu;gln 49
→
his;tyr 52
→
gly;ser 68
→
asp;leu 70
→
met;arg 72
→
leu;lys 73
→
asp;asp 77
→
gln;tyr 78
→
his;trp 79
→
ile;arg 81
→
trp;phe 92
→
leu;asn 96
→
phe;tyr 100
→
asp;leu 103
→
his;lys 125
→
ser;ser 127
→
ile;tyr 132
→
trp;和lys 134
→
gly;
[0343]
(n)asn 25
→
asp;leu 36
→
met;ala 40
→
asn;ile 41
→
leu;gln 49
→
his;tyr 52
→
gly;ser 68
→
asp;leu 70
→
met;arg 72
→
leu;lys 73
→
asp;asp 77
→
gln;trp 79
→
ile;arg 81
→
trp;phe 92
→
leu;asn 96
→
phe;tyr 100
→
asp;leu 103
→
his;lys 125
→
ser;ser 127
→
ile;tyr 132
→
trp;和lys 134
→
gly;
[0344]
(o)val 33
→
ile;leu 36
→
met;ala 40
→
asn;ile 41
→
leu;gln 49
→
his;tyr 52
→
gly;ser 68
→
asp;leu 70
→
met;arg 72
→
leu;lys 73
→
asp;asp 77
→
gln;trp 79
→
ile;arg 81
→
trp;phe 92
→
leu;asn 96
→
phe;tyr 100
→
asp;leu 103
→
his;lys 125
→
ser;ser 127
→
ile;tyr 132
→
trp;和lys 134
→
gly;
[0345]
(p)gln 20
→
arg;leu 36
→
met;ala 40
→
asn;ile 41
→
leu;glu 44
→
val;gln 49
→
his;tyr 52
→
gly;ser 68
→
asp;leu 70
→
met;arg 72
→
leu;lys 73
→
asp;asp 77
→
gln;trp 79
→
ile;arg 81
→
trp;phe 92
→
leu;asn 96
→
phe;tyr 100
→
asp;leu 103
→
his;phe 122
→
tyr;lys 125
→
ser;ser 127
→
ile;tyr 132
→
trp;和lys 134
→
gly;
[0346]
(q)leu 36
→
met;ala 40
→
asn;ile 41
→
leu;gln 49
→
his;tyr 52
→
ser;ser 68
→
asp;leu 70
→
met;arg 72
→
leu;lys 73
→
asp;asp 77
→
gln;trp 79
→
ile;ile 80
→
asn;arg 81
→
trp;thr 82
→
pro;asn 96
→
phe;tyr 100
→
asp;pro 101
→
leu;leu 103
→
pro;lys 125
→
ser;ser 127
→
ile;tyr 132
→
trp;和lys 134
→
gly;
[0347]
(r)leu 36
→
met;ala 40
→
asn;ile 41
→
leu;gln 49
→
his;tyr 52
→
gly;lys 59
→
asn;ser 68
→
asp;leu 70
→
met;arg 72
→
leu;lys 73
→
asp;asp 77
→
gln;trp 79
→
ile;arg 81
→
trp;phe 92
→
leu;asn 96
→
phe;tyr 100
→
asp;leu 103
→
his;lys 125
→
ser;ser 127
→
ile;tyr 132
→
trp;和lys 134
→
gly;和
[0348]
(s)leu 36
→
met;ala 40
→
asn;ile 41
→
leu;glu 44
→
asp;gln 49
→
his;tyr 52
→
ser;ser 68
→
asp;leu 70
→
met;phe 71
→
leu;arg 72
→
leu;lys 73
→
asp;asp 77
→
his;trp 79
→
ile;arg 81
→
trp;phe 92
→
leu;asn 96
→
phe;tyr 100
→
asp;leu 103
→
his;lys 125
→
ser;ser 127
→
ile;tyr 132
→
trp;和lys 134
→
gly。
[0349]
项目37、根据项目1
‑
26和32
‑
36中任一项所述的融合蛋白,其中所述脂质运载蛋白突变蛋白的氨基酸序列包含选自seq id nos:39
‑
57或其片段或变体的氨基酸序列。
[0350]
项目38、根据项目1
‑
26和32
‑
36中任一项所述的融合蛋白,其中所述脂质运载蛋白突变蛋白的氨基酸序列与选自seq id nos:39
‑
57的氨基酸序列具有至少85%的序列同一性。
[0351]
项目39、根据项目1
‑
26和32
‑
38中任一项所述的融合蛋白,其中与成熟hngal的线性多肽序列(seq id no:2)相比,所述脂质运载蛋白突变蛋白的氨基酸序列包含以下突变的氨基酸残基组:gln 28
→
his;leu 36
→
gln;ala 40
→
ile;ile 41
→
arg;gln 49
→
ile;tyr 52
→
met;asn 65
→
asp;ser 68
→
met;leu 70
→
lys;arg 72
→
asp;lys 73
→
asp;asp 77
→
met;trp 79
→
asp;arg 81
→
trp;cys 87
→
ser;asn 96
→
lys;tyr 100
→
phe;leu 103
→
his;tyr 106
→
ser;lys 125
→
phe;ser 127
→
phe;tyr 132
→
glu;和lys 134
→
tyr,和/或其中所述脂质运载蛋白突变蛋白与seq id no:40的氨基酸序列具有至少85%的序列同一性。
[0352]
项目40、根据项目1
‑
39中任一项所述的融合蛋白,其中通过连接子将一个亚基与
另一个亚基连接。
[0353]
项目41、根据项目1
‑
40中任一项所述的融合蛋白,其中通过连接子将所述第二亚基的n
‑
末端与所述第一亚基的每个重链恒定区(ch)的n
‑
或c
‑
末端或与所述第一亚基的每个轻链恒定区(cl)的n
‑
或c
‑
末端连接。
[0354]
项目42、根据项目1
‑
41中任一项所述的融合蛋白,其中通过连接子将所述第三亚基的n
‑
末端与所述第一亚基的每个重链恒定区(ch)的n
‑
或c
‑
末端、与所述第一亚基的每个轻链恒定区(cl)的n
‑
或c
‑
末端或与每个第二亚基的c
‑
末端连接。
[0355]
项目43、根据项目40
‑
42中任一项所述的融合蛋白,其中所述连接子是非结构性的(gly
‑
gly
‑
gly
‑
gly
‑
ser)3连接子(seq id no:13)。
[0356]
项目44、根据项目40
‑
43中任一项所述的融合蛋白,其中所述连接子是非结构性的甘氨酸
‑
丝氨酸连接子、多脯氨酸连接子、脯氨酸
‑
丙氨酸
‑
丝氨酸聚合物或选自seq id nos:13
‑
23的连接子。
[0357]
项目45、根据项目1
‑
44中任一项所述的融合蛋白,其中所述第一亚基是抗体。
[0358]
项目46、根据项目1
‑
45中任一项所述的融合蛋白,其中所述抗体的重链可变区选自seq id nos:78、114、119、126和129或为与seq id nos:78、114、119、126和129所示的氨基酸序列具有至少70%、至少75%、至少80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少98%或更高的序列同一性的序列,和其中所述抗体的轻链可变区选自seq id nos:79、115和127或为与seq id nos:79、115和127所示的氨基酸序列具有至少70%、至少75%、至少80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少98%或更高的序列同一性的序列。
[0359]
项目47、根据项目1
‑
46中任一项所述的融合蛋白,其中所述抗体包含重链或轻链,所述重链为seq id nos:80或81中任一或与seq id nos:80或81所示的氨基酸序列具有至少70%、至少75%、至少80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少98%或更高的序列同一性的序列,所述轻链为seq id no:82或与seq id nos:82所示的氨基酸序列具有至少70%、至少75%、至少80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少98%或更高的序列同一性的序列。
[0360]
项目48、根据项目1
‑
47中任一项所述的融合蛋白,其中所述抗体包含分别如下的重链可变区和轻链可变区:seq id nos:78和79、seq id nos:129和79、seq id nos:114和115或seq id nos:126和127,或包含具有与seq id nos:78和79、seq id nos:129和79、seq id nos:114和115或seq id nos:126和127所示的氨基酸序列具有至少70%、至少75%、至少80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少98%或更高序列同一性的序列的重链可变区和轻链可变区。
[0361]
项目49、根据项目1
‑
48中任一项所述的融合蛋白,其中所述抗体包含分别如下的重链和轻链:seq id nos:80和82或seq id nos:81和82,或包含具有与seq id nos:80和82或seq id nos:81和82所示的氨基酸序列具有至少70%、至少75%、至少80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少98%或更高序列同一性的序列的重链和轻链。
[0362]
项目50、根据项目36所述的融合蛋白,其中所述抗体的重链包含以下cdr序列的组之一:
[0363]
(a)gytftdye(hcdr1、seq id no:72)、ldpktgdt(hcdr2、seq id no:73)、trfysyty
(hcdr3;seq id no:74);
[0364]
(b)gftfnkna(hcdr1、seq id no:108)、irnktnnyat(hcdr2、seq id no:109)、vagnsfay(hcdr3、seq id no:110);
[0365]
(c)yfdfdsye(hcdr1、seq id no:116)、iyhsgst(hcdr2、seq id no:117)、arvnmdrfdy(hcdr3、seq id no:108);或
[0366]
(d)gftfssya(hcdr1、seq id no:120)、iqkqglpt(hcdr2、seq id no:121)、aknrakfdy(hcdr3、seq id no:122)。
[0367]
项目51、根据项目1
‑
50中任一项所述的融合蛋白,其中所述抗体的轻链包含以下cdr序列的组之一:
[0368]
(a)qslvhsnrnty(lcdr1、seq id no:75)、kvs(lcdr2)、sqnthvppt(lcdr3;seq id no:77);
[0369]
(b)qsllyssnqkny(lcdr1、seq id no:111)、was(lcdr2)、qqyynyplt(lcdr3、seq id no:113);或
[0370]
(c)qsissy(lcdr1、seq id no:123)、nas(lcdr2)、qqnrgfplt(lcdr3、seq id no:125)。
[0371]
项目52、根据项目1
‑
51中任一项所述的融合蛋白,其中所述抗体的重链包含以下cdr序列的组:gytftdye(hcdr1、seq id no:72)、ldpktgdt(hcdr2、seq id no:73)、trfysyty(hcdr3;seq id no:74);和所述抗体的轻链包含以下cdr序列的组:qslvhsnrnty(lcdr1、seq id no:75)、kvs(lcdr2)、sqnthvppt(lcdr3;seq id no:77)。
[0372]
项目53、根据项目1
‑
51中任一项所述的融合蛋白,其中所述抗体包含以下cdr序列的组:
[0373]
(a)gftfnkna(hcdr1、seq id nos:108)、irnktnnyat(hcdr2、seq id nos:109)、vagnsfay(hcdr3、seq id nos:110)、qsllyssnqkny(lcdr1、seq id no:111)、was(lcdr2)、qqyynyplt(lcdr3、seq id nos:113);或
[0374]
(b)gftfssya(hcdr1、seq id nos:120)、iqkqglpt(hcdr2、seq id nos:121)、aknrakfdy(hcdr3、seq id nos:122)、qsissy(lcdr1、seq id no:123)、nas(lcdr2)、qqnrgfplt(lcdr3、seq id no:125)。
[0375]
项目54、根据项目1
‑
53中任一项所述的融合蛋白,其中所述抗体具有igg4骨架。
[0376]
项目55、根据项目54所述的融合蛋白,其中所述igg4骨架具有以下突变中的一个或多个:s228p、n297a、f234a、l235a、m428l、n434s、m252y、s254t和t256e。
[0377]
项目56、根据项目1
‑
55中任一项所述的融合蛋白,其中所述融合蛋白包含seq id nos:87
‑
96中任一个所示的氨基酸序列,或其中所述融合蛋白包含与seq id nos:87
‑
96中任一个所示的氨基酸序列具有至少70%、至少75%、至少80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少98%或更高序列同一性的氨基酸序列。
[0378]
项目57、根据项目1
‑
56中任一项所述的融合蛋白,其中所述融合蛋白包含seq id nos:87和82所示的氨基酸,seq id nos:88和82所示的氨基酸,seq id nos:81和89所示的氨基酸,seq id nos:81和90所示的氨基酸,seq id nos:91和82所示的氨基酸,seq id nos:92和82所示的氨基酸,seq id nos:81和93所示的氨基酸,seq id nos:81和94所示的氨基酸,seq id nos:95和82所示的氨基酸,或seq id nos:96和82所示的氨基酸。
[0379]
项目58、根据项目1
‑
57中任一项所述的融合蛋白,其中所述融合蛋白包含与seq id nos:87和82、seq id nos:88和82、seq id nos:81和89、seq id nos:81和90、seq id nos:91和82、seq id nos:92和82、seq id nos:81和93、seq id nos:81和94、seq id nos:95和82或seq id nos:96和82所示的氨基酸序列具有至少70%、至少75%、至少80%、至少85%、至少90%、至少92%、至少95%、至少97%、至少98%或更高序列同一性的氨基酸序列。
[0380]
项目59、一种核酸分子,其包含编码项目1
‑
58中任一项所述的融合蛋白的核苷酸序列。
[0381]
项目60、根据项目59所述的核酸分子,其中所述核酸分子可操作地与允许所述核酸分子表达的调节序列连接。
[0382]
项目61、根据项目59或60所述的核酸分子,其中所述核酸分子包含在载体或噬菌粒载体中。
[0383]
项目62、一种宿主细胞,其含有项目59
‑
61中任一项所述的核酸分子。
[0384]
项目63、一种产生根据项目1
‑
58中任一项所述的融合蛋白的方法,其中从编码所述融合蛋白的核酸开始产生所述融合蛋白。
[0385]
项目64、根据项目63所述的方法,其中所述融合蛋白在细菌或真核宿主生物体中产生且自该宿主生物体或其培养物中分离。
[0386]
项目65、一种将项目1
‑
58中任一项所述的融合蛋白或包含这种融合蛋白的组合物用于同时活化cd137的下游信号传导通路和接合gpc3
‑
阳性肿瘤细胞的用途。
[0387]
项目66、一种同时活化cd137的下游信号传导通路和接合gpc3
‑
阳性肿瘤细胞的方法,所述方法包括向包含肿瘤的组织应用一种或多种项目1
‑
58中任一项所述的融合蛋白或者一种或多种包含这种融合蛋白的组合物。
[0388]
项目67、一种同时共刺激t细胞和接合gpc3
‑
阳性肿瘤细胞的方法,所述方法包括向包含肿瘤的组织应用一种或多种项目1
‑
58中任一项所述的融合蛋白或者一种或多种包含这种融合蛋白的组合物。
[0389]
项目68、一种同时诱导淋巴细胞活性和接合gpc3
‑
阳性肿瘤细胞的方法,所述方法包括向包含肿瘤的组织应用一种或多种项目1
‑
58中任一项所述的融合蛋白或者一种或多种包含这种融合蛋白的组合物。
[0390]
项目69、一种在t细胞上诱导cd137聚集和活化并将所述t细胞导向gpc3
‑
阳性肿瘤细胞的方法,所述方法包括向包含肿瘤的组织应用一种或多种项目1
‑
58中任一项所述的融合蛋白或者一种或多种包含这种融合蛋白的组合物。
[0391]
项目70、一种在gpc3
‑
阳性肿瘤细胞附近诱导局部淋巴细胞应答的方法,所述方法包括向包含肿瘤的组织应用一种或多种项目1
‑
58中任一项所述的融合蛋白或者一种或多种包含这种融合蛋白的组合物。
[0392]
项目71、一种在gpc3
‑
阳性肿瘤细胞附近诱导t细胞的il
‑
2分泌增加的方法,所述方法包括向包含肿瘤的组织应用一种或多种项目1
‑
58中任一项所述的融合蛋白或者一种或多种包含这种融合蛋白的组合物。
[0393]
项目72、一种诱导淋巴细胞介导的gpc3
‑
阳性肿瘤细胞的细胞溶解增加的方法,所述方法包括向包含肿瘤的组织应用一种或多种项目1
‑
58中任一项所述的融合蛋白或者一
种或多种包含这种融合蛋白的组合物。
[0394]
项目73、一种药物组合物,其包含一种或多种项目1
‑
58中任一项所述的融合蛋白。
[0395]
项目74、一种预防、改善或治疗gpc3
‑
阳性癌症的方法,所述方法包括向包含肿瘤的组织应用一种或多种项目1
‑
58中任一项所述的融合蛋白或者一种或多种包含这种融合蛋白的组合物。
[0396]
项目75、一种预防、改善或治疗肝细胞癌的方法,所述方法包括向包含肿瘤的组织应用一种或多种项目1
‑
58中任一项所述的融合蛋白或者一种或多种包含这种融合蛋白的组合物。
[0397]
项目76、根据项目1
‑
58中任一项所述的融合蛋白,其应用于治疗中。
[0398]
项目77、根据项目76所述应用的融合蛋白,其中所述应用为在癌症治疗中。
[0399]
项目78、根据项目1
‑
58中任一项所述的融合蛋白在制备药物中的用途。
[0400]
项目79、根据项目78所述的用途,其中所述药物用于癌症治疗。
v.实施例
[0401]
实施例1:代表性融合蛋白的表达和分析
[0402]
在该实施例中,将gpc3特异性抗体与seq id no:40的cd137特异性脂质运载蛋白突变蛋白或与seq id no:49具有97%的序列同一性并命名为cd137ac1的cd137特异性脂质运载蛋白经由连接子(比如seq id no:13的非结构性(g4s)3连接子)融合在一起以同时接合gpc3和cd137,产生代表性的抗体
‑
脂质运载蛋白突变蛋白融合蛋白,所述gpc3特异性抗体具有由seq id no:81提供的重链,或包含seq id no:78的重链可变结构域,或包含gytftdye(hcdr1,seq id no:72)、ldpktgdt(hcdr2,seq id no:73)和trfysyty(hcdr3;seq id no:74)的cdr,和具有由seq id no:82提供的轻链,或包含seq id no:79的重链可变结构域,或包含qslvhsnrnty(lcdr1,seq id no:75)、kvs(lcdr2,seq id no:76)和sqnthvppt(lcdr3;seq id no:77)的cdr。所产生的不同形式如图1所示。例如,通过将seq id no:40的脂质运载蛋白突变蛋白或与seq id no:49具有97%序列同一性的脂质运载蛋白突变蛋白中的一个或多个与抗体的四个末端中的一个或多个融合产生比如seq id nos:87和82、seq id nos:88和82、seq id nos:81和89、seq id nos:81和90以及cd137ac1
‑
融合1、cd137ac1
‑
融合2、cd137ac1
‑
融合3、cd137ac1
‑
融合4、cd137ac1
‑
融合5、cd137ac1
‑
融合6和cd137ac1
‑
融合7(与seq id nos:91和82、seq id nos:92和82、seq id nos:81和93、seq id nos:81和94、seq id nos:95和82或seq id nos:96和82具有97%序列同一性的融合蛋白)的此类融合蛋白,所述抗体包含由seq id no:81提供的重链,或包含seq id no:78的重链可变结构域,或包含gytftdye(hcdr1,seq id no:72)、ldpktgdt(hcdr2,seq id no:73)和trfysyty(hcdr3;seq id no:74)的cdr,和包含由seq id no:82提供的轻链,或包含seq id no:79的重链可变结构域,或包含qslvhsnrnty(lcdr1,seq id no:75)、kvs(lcdr2,seq id no:76)和sqnthvppt(lcdr3;seq id no:77)的cdr。产生的融合蛋白可以是针对cd137二价的(如,如图1a
‑
1d所示)或针对cd137四价的(如,如图1e
‑
1h所示),或针对cd137具有甚至更高的价(如,如图1i所示)。
[0403]
在本实施例中所述的gpc3特异性抗体以及全部抗体脂质运载蛋白突变蛋白融合蛋白具有工程化的igg4骨架,所述igg4骨架包含s228p突变以在体外和体内使igg4半抗体
交换最小(silva等,j biol chem,2015)。在本文所述全部抗体和融合蛋白中还可存在igg4骨架中的另外突变,包括突变f234a、l235a、m428l、n434s、m252y、s254t和t256e中的任一个或多个。还可引入f234a和l235a突变以降低adcc和adcp(glaesner等,diabetes metab res rev,2010)。还可引入m428l和n434s突变,或m252y、s254t和t256e突变以延长血清半衰期(dall'acqua等,j biol chem,2006;zalevsky等,nat biotechnol,2010)。所有抗体表达均不含羧基末端赖氨酸,以避免异质性。
[0404]
此外,如图1j
‑
1k所示,通过将seq id no:40的cd137特异性脂质运载蛋白突变蛋白或seq id no:64的gpc3特异性脂质运载蛋白中的一个或多个经由连接子(如seq id no:13的非结构性(g4s)3连接子)与seq id no:28提供的抗体的fc区的c
‑
末端融合得到单特异性脂质运载蛋白突变蛋白fc融合蛋白。seq id nos:98中提供了得到的构建体。
[0405]
本发明还包含不对称的抗体
‑
脂质运载蛋白突变蛋白融合形式,其中例如,该抗体的一条轻链可以与脂质运载蛋白突变蛋白融合而另一条轻链未融合。
[0406]
通过基因合成并克隆至哺乳动物表达载体产生所述融合蛋白的构建体。然后将融合蛋白的构建体在expi293ftm细胞(life technologies)中瞬时表达。通过应用蛋白a亲和色谱柱(applied biosystems)的hplc(agilent technologies)测量细胞培养基中融合蛋白的浓度。融合蛋白的效价汇总于表1。
[0407]
采用蛋白a色谱,然后通过磷酸盐缓冲盐水(pbs)中的尺寸排阻色谱(sec)纯化融合蛋白。sec纯化后,将包含单体蛋白的级分合并采用分析级sec和单体含量百分比再次分析。
[0408]
sec纯化后,将示例性融合蛋白的单体蛋白含量以及等电点(pi)汇总于表1。与先前已知的cd137/gpc3双特异性融合蛋白seq id no:83相比,提供的融合蛋白(seq id nos:87和82)的pi增加。
[0409]
表1:瞬时表达效价
[0410] 单体蛋白含量[%]测定的piseq id nos:87和8299.97.5cd137ac1
‑
融合298.3
‑‑
seq id nos:81和8299.0
‑‑
seq id no:83100.06.2
[0411]
实施例2:通过表面等离子体共振(spr)测定融合蛋白对gpc3的结合
[0412]
通过采用biacore t200仪器(ge healthcare)的表面等离子体共振(spr)测定示例性融合蛋白与重组人gpc3(hugpc3)和猕猴gpc3(cygpc3)(r&d systems)的结合动力学和亲和力。
[0413]
采用标准胺化学将抗
‑
人igg fc抗体(ge healthcare)固定在cm5传感器芯片上:使用1
‑
乙基
‑3‑
(3
‑
二甲基氨基丙基)
‑
碳化二亚胺(edc)和n
‑
羟基琥珀酰亚胺(nhs)活化芯片上的羧基。随后,以5μl/min的流速施加10mm醋酸钠(ph 5.0)中浓度为25μg/ml的抗
‑
人igg fc抗体溶液(ge healthcare),直至达到6000
‑
10000共振单位(ru)的固定水平。通过使1m乙醇胺溶液通过表面来封闭剩余未反应的nhs
‑
酯。参考通道以类似的方式处理。然后,以10μl/min的流速在芯片表面用抗
‑
人igg fc抗体捕获以0.2μg/ml存在于hbs
‑
ep 缓冲液中的测试融合蛋白(seq id nos:87和82以及cd137ac1
‑
融合1)或包含在融合蛋白中的gpc3抗
体(seq id nos:81和82)达180s。每次捕获步骤后,洗涤针(needle)。
[0414]
对于亲和力测定,在hbs
‑
ep 缓冲液(ge healthcare)中制备hugpc3或cygpc3的稀释液(100nm、25nm、6.25nm和1.56nm),并将其施加于制备的芯片表面。采用接触时间为180s、解离时间为900s和流速为30μl/min来实施结合测定。每次注射后,用40mm naoh 20%异丙醇清洗针。所有的测量均在25℃下进行。通过注入3m mgcl2达120s来实现芯片表面的再生。在蛋白质测量之前,为了调节目的实施三次启动循环。用biacore t200评估软件(v 2.0)评估数据。使用双重参照并使用1:1的结合模型来拟合原始数据。
[0415]
将针对示例性性融合蛋白的k
on
、k
off
和得到的平衡解离常数(k
d
)测定的值汇总于表2。所测试的融合蛋白(seq id nos:87和82以及cd137ac1
‑
融合1)以亚纳摩尔的亲和力结合hugpc3以及cygpc3,该亲和力与包含在融合蛋白中的gpc3抗体和先前已知的cd137/gpc3双特异性融合蛋白(seq id no:83)相当。
[0416]
表2:通过spr测定的融合蛋白的动力学常数和亲和力
[0417][0418][0419]
实施例3:在酶联免疫吸附试验(elisa)中融合蛋白对gpc3或cd137的结合
[0420]
采用酶联免疫吸附试验(elisa)来测定示例性融合蛋白与gpc3和cd137的结合效力。
[0421]
将pbs中1μg/ml浓度的重组hugpc3(r&d systems)在微量滴定板上于4℃下涂覆过夜。用pbs
‑
0.05%t(补充有0.05%(v/v)吐温20的pbs)洗涤5次后,将板用在pbs
‑
0.1%t中的2%bsa(w/v)(pbs
‑
0.1%t
‑
2%bsa)在室温下封闭1小时。用100μl pbs
‑
0.05%t(补充有0.05%(v/v)吐温20的pbs)洗涤5次后,将不同浓度的示例性融合蛋白(seq id nos:87和92以及cd137ac1
‑
融合1至7)或包含在融合蛋白中的gpc3抗体(seq id nos:81和82)添加至孔并在室温下温育1h,随后是另一洗涤步骤。通过用在pbs
‑
0.1%t
‑
2%bsa中1:5000稀释的抗人igg fc
‑
hrp(jackson laboratory)温育来检测研究中的结合的分子。在另外的洗涤步骤之后,向每个孔中加入荧光hrp底物(quantablu,thermo),并使用荧光酶标仪检测荧光强度。
[0422]
还采用相同的elisa设置测量了融合蛋白与猕猴gpc3和hucd137的结合效力,其中是将重组cygpc3(r&d systems)或hucd137
‑
his(具有c
‑
末端聚组氨酸标签的重组人cd137,
r&d systems)涂覆在微量滴定板上。类似地滴定测试试剂和经由抗
‑
ngal
‑
hrp检测结合的试剂。
[0423]
图2a
‑
2d中描绘了示例性的结果,及由1:1结合s形拟合所产生的拟合曲线,其中ec
50
值和最大信号为自由参数,斜率固定为一(unity)。所得到的ec
50
值在表3中提供。
[0424]
对于所提供的融合蛋白(seq id nos:87和92以及cd137ac1
‑
融合1至7)对人gpc3所观察到的ec
50
值与先前已知的cd137/gpc3双特异性融合蛋白(seq id no:83)和/或包含在融合蛋白中的gpc3抗体(seq id nos:81和82)非常相似或相当。一些测试的融合蛋白(seq id nos:87和82、cd137ac1
‑
融合3以及cd137ac1
‑
融合4)保留了针对人cd137的强结合亲和力。此外,一些测试的融合蛋白(seq id nos:87和82)还显示出以与人gpc3相当的水平与猕猴gpc3的交叉反应性,即以在与相应的对人gpc3的ec
50
相同范围内的ec
50
值结合猕猴gpc3。
[0425]
表3:gpc3或cd137结合的elisa数据
[0426][0427]
实施例4:在elisa中融合蛋白与gpc3和cd137的同时结合
[0428]
为了证明示例性融合蛋同时结合gpc3和cd137,使用双重结合的elisa形式。
[0429]
将pbs中的重组hucd137
‑
his(r&d systems)(1μg/ml)在4℃下在微量滴定板上涂覆过夜。在每个温育步骤后,用100μl pbs
‑
0.05%t洗涤板5次。在室温下将板用pbs
‑
0.1%t
‑
2%bsa封闭1小时,然后再次洗涤。将不同浓度的测试融合蛋白加入到孔中并在室温下温育1小时,随后进行洗涤步骤。随后,将生物素化的hugpc3以在pbs
‑
0.1%t
‑
2%bsa中1μg/ml的恒定浓度加入达1小时。洗涤后,向孔中加入在pbs
‑
0.1%t
‑
2%bsa中extravidin
‑
hrp(sigma
‑
aldrich)的1:5000的稀释液并温育1h。在另外的洗涤步骤之后,向每个孔中加入荧光hrp底物(quantablu,thermo),并使用荧光酶标仪检测荧光强度。
[0430]
同样采用反向设置来测试融合蛋白的双重结合,其中将1μg/ml重组hugpc3(r&d systems)涂覆在微量滴定板上并通过添加5μg/ml生物素化的hucd137
‑
his来检测结合的融合蛋白。
[0431]
图3示出了示例性双重结合数据,及由1:1结合s形拟合(sigmoidal binding fit)
所产生的拟合曲线,其中ec
50
值和最大信号为自由参数,斜率固定为一(unity)。ec
50
值汇总于表4。融合蛋白(seq id nos:87和82以及cd137ac1
‑
融合1至7)示出了明确的结合信号,表明这些融合蛋白能够同时接合gpc3和cd137。大多数此类融合蛋白均能以与先前已知的cd137/gpc3双特异性融合蛋白seq id no:83相当的水平同时接合gpc3和cd137。
[0432]
表4:gpc3和cd37的同时靶标结合的elisa数据
[0433][0434]
实施例5:通过elisa分析的融合蛋白的脱靶结合
[0435]
采用基于elisa的分析来评估融合蛋白对包括gpc3、gpc5及其它tnf受体蛋白(frese等,mabs,2013)的32种不同靶标的脱靶结合。将pbs中浓度为5μg/ml的靶标在4℃下在微量滴定板上涂覆过夜。用pbs
‑
0.05%t洗涤后,在室温下将板用pbs
‑
0.1%t
‑
2%bsa封闭1小时。在用100μl pbs
‑
0.05%t洗涤5次后,将100nm或10nm的测试融合蛋白加入到孔中并在室温下温育1小时,随后是另一洗涤步骤。通过用在pbs
‑
0.1%t
‑
2%bsa中1:5000稀释的山羊抗人igg fc
‑
hrp(jackson laboratory)温育来检测研究中的结合的抗体。在另外的洗涤步骤之后,向每个孔中加入荧光hrp底物(quantablu,thermo)并温育1h。使用荧光酶标仪检测荧光强度并将其相对于对照抗体(seq id nos:106和107)的信号标准化。将每个测试分子与32个靶标结合的标准化信号相加,以产生给定浓度(即100nm或10nm)的抗体的累积结合率。将每个测试分子在100nm和10nm时的累积结合率进一步相加,以产生累积结合率的总和。例如,当在100nm或10nm下测定时,对照抗体(seq id nos:106和107)(将结合32个靶标中的每一个所产生的荧光强度针对该对照抗体标准化)的累积结合率为32,则累积结合率的总和为64。结果示于表5。较高的累积结合率与较强的脱靶结合相关。
[0436]
提供的融合蛋白(seq id nos:87和82)以及包含在该融合蛋白中的gpc3抗体和cd137特异性脂质运载蛋白突变蛋白(fc融合)(分别为seq id nos:81和82以及seq id no:98)未显示出或显示出可忽略不计的脱靶结合(累积结合率的总和<150),而先前已知的cd137/gpc3双特异性融合蛋白(seq id no:83)显示出不希望的脱靶结合(累积结合率的总和>250)。
[0437]
表5:融合蛋白的脱靶结合
[0438][0439]
实施例6:结合表达cd137或gpc3的细胞的融合蛋白的流式细胞术分析
[0440]
通过流式细胞术评估示例性融合蛋白对表达人cd137的细胞和表达人gpc3的细胞的靶标特异性结合。
[0441]
采用flp
‑
in系统(life technologies)根据制造商的说明用人cd137或模拟对照稳定转染cho细胞。采用lipofectamine2000(invitrogen)根据制造商的说明用人gpc3或模拟对照稳定转染sk
‑
hep1细胞。在补充有10%胎牛血清(sigma
‑
aldrich)和500μg/ml潮霉素b(roth)的ham's f12培养基(gibco)中维持转染的cho细胞。在补充有20%胎牛血清(sigma
‑
aldrich)和500μg/ml g418(gibco)的rpmi 1640 glutamax培养基(gibco)中培养转染的sk
‑
hep1细胞。根据制造商的说明(37℃,5%co2气氛),在细胞培养瓶中培养细胞。
[0442]
对于流式细胞术分析,用示例性融合蛋白(seq id nos:87和82)、包含在该融合蛋白中的gpc3抗体或cd137特异性脂质运载蛋白突变蛋白(fc融合)(分别为seq id nos:81和82以及seq id no:98)、参照cd137抗体seq id nos:26和27或同型对照(seq id nos:24和25)温育相应的细胞系,并采用荧光标记的抗
‑
人igg抗体在如下所述的facs分析中检测:
[0443]
将每孔5
×
104个细胞在含有5%胎牛血清的冰冷pbs(pbs
‑
fcs)中温育1h。向细胞中加入测试分子的稀释系列,并在冰上温育1h。将细胞用pbs洗涤两次,然后用山羊抗
‑
higg alexa647标记的抗体或山羊抗
‑
higg alexa488
‑
标记的抗体在冰上温育30min。随后将细胞洗涤并用ique流式细胞仪(intellicyte screener)分析。采用graphpad软件绘制并拟合平均几何荧光信号。将荧光强度的几何平均值用于采用将底部固定至背景的四参数逻辑回归计算ec
50
值。
[0444]
图4描绘了测试分子结合人gpc3与cd137的能力。融合蛋白(seq id nos:87和82)与表达人gpc3和人cd137的细胞的结合亲和力(ec
50
)在低纳摩尔范围内,分别与gpc3抗体(seq id nos:81和82)和cd137特异性脂质运载蛋白突变蛋白(seq id no:98)或抗体(seq id nos:26和27)相当(汇总于表6中)。然而,先前已知的cd137/gpc3双特异性融合蛋白(seq id no:83)显示出与表达gpc3的细胞的有限的剂量依赖性结合,因为其结合曲线在高达100nm的浓度下未达到平台期(图4b)。无测试分子结合至模拟转染的细胞(数据未示出)。
[0445]
表6:融合蛋白与表达gpc3或cd137的细胞的结合亲和力
[0446][0447][0448]
实施例7:融合蛋白与gpc3阳性肿瘤细胞的结合亲和力
[0449]
通过流式细胞术评估融合蛋白与表达不同水平的gpc3的肿瘤细胞(hepg2、hep3b、mkn
‑
45和nci
‑
n87)的结合。
[0450]
在补充有10%胎牛血清(sigma
‑
aldrich)的dulbecco's modified eagle's培养基(dmso,pan biotech)中培养hepg2细胞系。在补充有10%胎牛血清(sigma
‑
aldrich)和2mm l
‑
谷氨酰胺(gibco)的minimum essential培养基(具有earle's盐)(gibco)中培养hep3b细胞系。分别在补充有20%或10%胎牛血清(sigma
‑
aldrich)的rpmi
‑
1640培养基 glutamax(gibco)中培养mkn
‑
45和nci
‑
n87细胞系。根据制造商的说明(37℃,5%co2气氛),在细胞培养瓶中培养所有的肿瘤细胞系。
[0451]
对于流式细胞术分析,用示例性融合蛋白(seq id nos:87和82)、包含在该融合蛋白中的gpc3抗体或cd137特异性脂质运载蛋白突变蛋白(fc融合)(分别为seq id nos:81和82以及seq id no:98)、参照cd137抗体seq id nos:26和27或同型对照(seq id nos:24和25)温育具有不同gpc3表达水平的肿瘤细胞系(高度至中度表达:hepg2>hep3b>mkn
‑
45)和gpc3阴性细胞系nci
‑
n87,并采用荧光标记的抗
‑
人igg抗体如实施例6中所述进行检测。
[0452]
图5描绘了融合蛋白(seq id nos:87和82)结合gpc3阳性肿瘤细胞的能力,并将相应的结合亲和力(ec
50
)汇总于表7。融合蛋白与表达gpc3的肿瘤细胞的结合亲和力在低纳摩尔范围内,与包含在融合蛋白中的gpc3抗体(seq id nos:81和82)相当。结果还表明融合蛋白不与gpc3阴性的肿瘤细胞结合。
[0453]
表7:融合蛋白与gpc3阳性肿瘤细胞的结合亲和力
[0454][0455][0456]
实施例8:采用cd137生物测定的gpc3依赖性t细胞共刺激
[0457]
采用商购可得的双重稳定转染的表达cd137和luc2基因(萤火虫荧光素酶的人源
化版本)的jurkat细胞系评估所选择的融合蛋白以gpc3依赖性方式诱导cd137信号传导通路活化的潜力,其中nfκb应答元件驱动luc2表达。在该生物测定中,cd137接合引起了cd137细胞内信号传导,从而导致nfκb
‑
介导的发光。
[0458]
如实施例7所述培养表达高水平gpc3的肝细胞癌细胞系hepg2和hep3b,和表达中度水平gpc3的胃癌细胞系mkn
‑
45,以及gpc3阴性的nci
‑
n87。测定的前一天,将相应的肿瘤细胞以每孔6.25x103个细胞铺板,并在37℃下在湿润的5%co2气氛中贴壁过夜。
[0459]
第二天,将3.75x104个nf
‑
kb
‑
luc2/cd137 jurkat细胞加入各孔,随后加入不同浓度(通常范围为0.00488nm至10nm)的示例性融合蛋白(seq id nos:87和82)、包含在该融合蛋白中的gpc3抗体或cd137特异性脂质运载蛋白突变蛋白(fc融合)(分别为seq id nos:81和82以及seq id no:98)、参照cd137抗体seq id nos:26和27或同型对照(seq id nos:24和25)。将板用透气密封膜覆盖,并在37℃下于湿润的5%co2气氛中温育。4h后,将30μl bio
‑
glo
tm
试剂加入各孔,并采用光度计(pherastar)定量生物发光信号。采用graphpad进行四参数逻辑曲线分析,以计算ec
50
值(共享如下),ec
50
值汇总于表8。为了证明融合蛋白与cd137接合的gpc3依赖性,采用最高浓度的测试分子在不存在肿瘤细胞的情况下平行进行相同的实验。测定一式三份地进行。
[0460]
图6描绘了代表性实验的结果。图6a和6b中所示的数据证明,在具有高gpc3表达水平的肿瘤细胞系存在下,示例性融合蛋白(seq id nos:87和82)诱导了强的cd137介导的t细胞共刺激。图6c
‑
6e表明通过融合蛋白的cd137活化是gpc3依赖性的,因为在具有中度或低gpc3表达的肿瘤细胞存在或表达gpc3的肿瘤细胞不存在的情况下,没有检测到nf
‑
kb
‑
luc2/cd137 jurkat细胞的活化。相对地,无论gpc3的表达水平如何和靶细胞不存在时,参照抗
‑
cd137mab(seq id nos:26和27)显示出cd137介导的t细胞共刺激。
[0461]
表8:采用cd137生物测定评估t细胞活化
[0462][0463]
实施例9:由融合蛋白诱导的gpc3依赖性t细胞活化的评估
[0464]
采用t细胞活化测定分析通过融合蛋白的gpc3靶标依赖性t细胞共刺激。将融合蛋白以不同的浓度施加至抗
‑
cd3刺激的t细胞,用人gpc3转染的或模拟转染的sk
‑
hep1细胞或gpc3阳性肿瘤细胞系hepg2共培养。在上清液中测量il
‑
2分泌水平。
[0465]
根据biochrom的方案,通过经由聚蔗糖密度梯度(biocoll 1.077g/ml,biochrom)的离心自血沉棕黄色层中分离健康志愿者供体的pbmc。采用pan t细胞纯化试剂盒(miltenyi biotec gmbh)根据制造商的说明通过磁性细胞分选自pbmc中进一步纯化t淋巴细胞。将纯化的pan t细胞重悬浮于由90%fcs和10%dmso组成的缓冲液中,立即冷冻并储存在液氮中直至进一步使用。对于测定,将t细胞解冻并置于补充有10%胎牛血清(sigma
‑
aldrich)和1%青霉素
‑
链霉素(gibco)的培养基(rpmi
‑
1640培养基 glutamax,gibco)中在
37℃下于湿润的5%co2气氛中过夜。sk
‑
hep1和hepg2细胞分别如实施例6和实施例7中所述培养。
[0466]
对于每个实验条件,采用一式三份实施以下程序:将平底组织培养板用0.25μg/ml抗
‑
cd3抗体在37℃下预涂覆2h,然后用pbs洗涤2次。用30μg/ml丝裂霉素c(sigma aldrich)处理人gpc3转染的或模拟转染的sk
‑
hep1细胞和gpc3阳性肿瘤细胞hepg2达30min,从而阻断增殖。将经丝裂霉素处理的细胞用pbs洗涤2次并以每孔1.0x104个细胞铺在培养基中以允许在37℃下在湿润的5%co2气氛中贴壁过夜。采用accutase(paa laboratories)使先前已在标准条件下生长的表达靶标的细胞脱落,然后重悬浮于培养基中。
[0467]
在接下来的几天,用pbs洗涤板2次后,每孔加入2.5x104个t细胞。融合蛋白(seq id nos:87和82)、包含在融合蛋白中的gpc3抗体(seq id nos:81和82)、先前已知的cd137/gpc3双特异性融合蛋白(seq id no:83)、gpc3特异性脂质运载蛋白突变蛋白(fc融合)(seq id nos:97)、参照cd137抗体(seq id nos:26和27)或同型对照(seq id nos:24和25)的稀释系列(通常范围为0.003nm至10nm)添加至相应的孔。将板用透气密封膜覆盖,并在37℃下在湿润的5%co2气氛中温育3天。随后,采用人il
‑
2duoset试剂盒(r&d systems)如下程序中所述评估上清液中的il
‑
2水平。
[0468]
在室温下用pbs中的1μg/ml“人il
‑
2捕获抗体”涂覆384孔板达2h。随后,用80μl pbs
‑
0.05%t洗涤孔5次。在含有1%酪蛋白(w/w)的pbs
‑
0.05%t中阻断1h后,将测定上清液和在培养基中稀释的浓度系列的il
‑
2标准品转移至相应的孔中并在4℃下温育过夜。第二天,加入在含有0.5%酪蛋白的pbs
‑
0.05%t中的100ng/ml山羊抗
‑
hil
‑2‑
bio检测抗体(r&d systems)和1μg/ml sulfotag
‑
标记的链霉亲和素(mesoscale discovery)的混合物并在室温下温育1h。洗涤后,向每个孔中加入25μl读数缓冲液(mesoscale discovery),并通过mesoscale discovery读数器检测得到的电化学发光(ecl)信号。使用mesoscale discovery软件进行分析和定量。
[0469]
还以相似的方式采用t细胞活化测定来评估另外的先前已知的cd137/gpc3双特异性融合蛋白seq id nos:99和27、seq id no:83以及seq id no:84共刺激t细胞应答的能力。在该实验中,将组织培养板用200μl的0.25μg/ml的抗
‑
cd3抗体在37℃下预涂覆达1h,然后用pbs洗涤2次。以每孔1.25x104个hepg2肿瘤细胞铺板,允许在37℃下在湿润的5%co2气氛中贴壁过夜,并在37℃下用10μg/ml丝裂霉素c处理2小时。将板用pbs洗涤2次并向每个孔中加入5x104个t细胞和浓度为1μg/ml的测试分子。将板用透气密封膜覆盖,并在37℃下在湿润的5%co2气氛中温育3天。随后,评估上清液中的il
‑
2浓度。
[0470]
图7示出了示例性数据。在融合蛋白(seq id nos:87和82)存在下,与同型对照相比,pan t细胞与人gpc3转染的sk
‑
hep1细胞(图7b)或表达gpc
‑
3的hepg2肿瘤细胞(图7c)的共培养导致了强的剂量依赖性il
‑
2分泌,并且比其中在高剂量水平下观察到无il
‑
2增加或il
‑
2分泌略微增加的gpc3抗体(seq id nos:81和82)、gpc3特异性脂质运载蛋白突变蛋白(seq id no:129)或先前已知的cd137/gpc3双特异性融合蛋白(seq id no:83)更强。当采用模拟转染的sk
‑
hep1细胞(gpc3阴性)共培养时,无测试分子展现出il
‑
2分泌的剂量依赖性增加。结果表明通过提供的融合蛋白的t细胞活化是gpc3依赖性的。
[0471]
实施例10:在表达不同水平gpc3的肿瘤细胞的存在下t细胞活化的评估
[0472]
利用另一t细胞测定以评估示例性融合蛋白以gpc3靶标依赖性方式共刺激t细胞
活化的能力。在具有不同gpc3表达水平的肿瘤细胞系存在下,将融合蛋白以不同浓度施加至抗
‑
cd3刺激的t细胞。测试的肿瘤细胞系包括hepg2、hep3b、mkn
‑
45和nci
‑
n87(高度至中度表达:hepg2>hep3b>mkn
‑
45,gpc3阴性:nci
‑
n87)。测量上清液中的il
‑
2分泌水平。
[0473]
如实施例9所述,自血沉棕黄色层中分离健康志愿者供体的pbmc并自pbmc纯化淋巴细胞。
[0474]
对于测定,将t细胞解冻并置于补充有10%胎牛血清(sigma
‑
aldrich)和1%青霉素
‑
链霉素(gibco)的培养基(rpmi
‑
1640培养基 glutamax,gibco)中在37℃下于湿润的5%co2气氛围中达16h。
[0475]
对于每个实验条件,采用一式三份实施以下程序:将平底组织培养板用0.25μg/ml抗
‑
cd3抗体在37℃下预涂覆2h并用pbs洗涤2次。将肿瘤细胞系hepg2、hep3b、mkn
‑
45或nic
‑
n87用30μg/ml丝裂霉素c(sigma aldrich)处理30min以阻断增殖。然后将用丝裂霉素处理的肿瘤细胞用pbs洗涤2次并以每孔8.3x103个细胞铺在培养基中从而允许在37℃下在湿润的5%co2气氛中贴壁过夜。采用accutase(paa laboratories)使先前已在标准条件下生长的靶细胞脱落,然后重悬浮于培养基中。
[0476]
第二天,用pbs洗涤板2次后,将每孔1.25x104个t细胞加入至肿瘤细胞中。将示例性融合蛋白(seq id nos:87和82)、包含在融合蛋白中的gpc3抗体或cd137特异性脂质运载蛋白突变蛋白(fc融合)(分别为seq id nos:81和82以及seq id nos:98)、参照cd137抗体(seq id nos:26和27)或同型对照(seq id nos:24和25)的稀释系列(通常范围为0.26nm至10nm)添加至相应的孔。将板用透气密封膜覆盖,并在37℃下在湿润的5%co2气氛中温育3天。
[0477]
共培养3天后,按照实施例9所述评估上清液中的il
‑
2水平。
[0478]
图8示出了示例性数据。在融合蛋白(seq id nos:87和82)存在下,与higg4同型对照相比,pan t细胞与表达高水平的gpc3的hepg2和hep3b细胞的共培养导致了il
‑
2分泌的明显增加。此外,mkn
‑
45(gpc3中度)或nic
‑
n87(gpc3阴性)与融合蛋白的共培养均未使il
‑
2分泌水平增加。数据表明,通过其活化t细胞或使il
‑
2分泌增加的能力量度的融合蛋白的功能活性是gpc3依赖性的。相比而言,由参照cd137抗体(seq id nos:26和27)诱导的t细胞活化或il
‑
2分泌不一定是gpc3依赖性的并难以预测。
[0479]
实施例11:由融合蛋白诱导的t细胞介导的表达gpc3的肿瘤细胞的细胞溶解的评估
[0480]
利用基于阻抗的t细胞杀伤测定评估融合蛋白活化cd137共刺激信号传导通路并诱导t细胞介导的表达gpc3的肿瘤细胞的细胞溶解的能力。基于此目的,将粘附性(adherent)肿瘤细胞接种在电子微量滴定板(e板)的孔中。细胞向金微电极的粘附阻碍了电极之间的电流流动。将阻抗测量为无单位“细胞指数”参数。细胞指数(ci)随着细胞的附着以及随后随时间推移的增殖而增加。将非粘附性cd8 t细胞、独立活化t细胞抗原的抗
‑
cd3抗体和不同浓度的测试分子添加到hepg2细胞中。其本身的添加不会导致阻抗改变。如果测试分子通过活化cd137信号传导通路来共刺激细胞毒性t细胞,则t细胞介导的靶细胞的细胞溶解将增加,并由此可将效应细胞对粘附性肿瘤细胞的破坏检测为降低的ci,从而能够产生实时杀伤曲线。
[0481]
自血沉棕黄色层中分离健康志愿者供体的pbmc。将cd8 t细胞自这些pbmc中分离
并储存在液氮中直至进一步使用。对于测定,将cd8 t细胞解冻并置于由补充有10%fbs和1%青霉素
‑
链霉素的rpmi
‑
1640培养基组成的测定培养基中在37℃下于湿润的5%co2气氛中达24h。
[0482]
对于每个实验条件,采用一式三份实施以下程序。将肿瘤细胞系hepg2(肝细胞癌细胞系,表达gpc3)或nci
‑
n87(胃癌细胞系,gpc3阴性)铺在e板的测试培养基中并在37℃下于湿润的5%co2气氛中温育24h以允许细胞贴壁并增殖。
[0483]
第二天,将抗
‑
cd3抗体添加至肿瘤细胞,随后加入示例性融合蛋白(seq id no:87和82)、包含在融合蛋白中的gpc3抗体或cd137特异性脂质运载蛋白突变蛋白(fc融合)(分别为seq id nos:81和82以及seq id nos:98)、参照cd137抗体(seq id nos:26和27)、先前已知的cd137/gpc3双特异性融合蛋白(seq id no:83)、gpc3特异性脂质运载蛋白突变蛋白(fc融合)(seq id no:97)或同型对照(seq id nos:24和25)的稀释系列。然后将静置的cd8 t细胞以5:1的比率添加至肿瘤细胞。将板用透气密封膜覆盖并温育3天,在此期间定期测量阻抗。
[0484]
采用rtca ht软件v1.0.1(acea biosciences)将ci值绘制为时间的函数。将标准化的ci计算为给定时间点(效应细胞添加后的20h、30h、40h、50h、60h、70h)的ci除以标准化时间点(效应细胞添加后的第一次测量)的ci。对于每个一式三份,采用如下公式将平均标准化ci值和相应的sd值用于计算特异性杀伤值:100
‑
(测试分子的标准化平均ci/靶细胞和效应细胞的标准化平均ci)x100。将特异性杀伤值导出到graphpad prism v7并以相应的sd值针对感兴趣的时间间隔绘制在xy图中。
[0485]
图9描绘了示例性实验的结果。数据表明融合蛋白seq id nos:87和82诱导剂量依赖性的t细胞介导的表达gpc3的hepg2细胞的裂解(图9a
‑
9c),但观察到靶标阴性的nci
‑
n87细胞无特异性裂解(图9d),证明了融合蛋白诱导的cd137通路的活化(其导致t细胞介导的杀伤)是gpc3依赖性的。与等摩尔量的先前已知的cd137/gpc3双特异性融合蛋白(seq id no:83)、gpc3抗体(seq id nos:81和82)或gpc3特异性脂质运载蛋白突变蛋白(fc融合)(seq id no:97)相比,所提供的融合蛋白seq id nos:87和82通过细胞毒性t细胞诱导了更高水平的gpc3阳性靶细胞杀伤(图9c)。此外,cd137特异性脂质运载蛋白突变蛋白(fc融合)(seq id no:98)、参照cd137抗体(seq id nos:26和27)和higg4同型对照(seq id nos:24和25)未诱导cd8 t细胞介导的杀伤(图9c)。
[0486]
进行另外的实验以证明cd137/gpc3双特异性融合蛋白(seq id nos:87和82)的强的t细胞介导的hepg2细胞的裂解取决于其双特异性设计而不仅仅是抗gpc3和抗cd137的组合。该实验基本上如上所述进行,但所有构建体均以10nm添加并将它们与gpc3抗体(seq id nos:81和82)和参照cd137抗体(seq id nos:26和27)的混合物(cocktail)以及gpc3抗体(seq id nos:81和82)和cd137特异性脂质运载蛋白突变蛋白(fc融合)(seq id no:98)的混合物(cocktail)进行比较。虽然再次检测到融合蛋白seq id nos:87和82的强的t细胞介导的裂解,但是由两种混合物介导的特异性裂解仅为中等强度,这证明了该种双特异性形式对实现t细胞介导的裂解的益处。
[0487]
实施例12:在植入人pbmc的异种移植小鼠模型中功能性体内活性的评估
[0488]
为了研究所提供的融合蛋白的体内活性,采用植入了人hepg2肿瘤细胞和人pbmc的免疫缺陷nog小鼠。
[0489]
向4
‑
6周龄的nog小鼠皮下(s.c.)注射在人工基膜/pbs(1:1)溶液中的5
×
106个hepg2细胞。允许肿瘤生长至80
‑
100mm3的大小,并将这一时间点定义为实验的第0天。在第0天根据肿瘤大小和动物体重,将小鼠随机分为治疗组(或对照组)。通过尾静脉注射向小鼠静脉内地(i.v.)给予5
×
106个新鲜人pbmc。在第1天的i.v.pbmc注射后,通过腹膜内(i.p.)注射使小鼠接受治疗或对照(pbs),并在第8天和第15天再次接受治疗或对照。所研究的分子包括示例性融合蛋白seq id nos:87和82(0.5、5或20mg/kg)、包含在融合蛋白中的gpc3抗体(seq id nos:81和82)(0.39或3.9mg/kg,与采用融合蛋白的0.5或5mg/kg治疗等摩尔浓度)和参照cd137抗体(seq id nos:26和27)(3.9mg/kg,与采用融合蛋白的5mg/kg治疗等摩尔浓度)。每3至4天记录肿瘤生长。将无药物暴露的动物排除在数据分析之外。
[0490]
研究结束时(第16天),将小鼠处死,并将肿瘤用福尔马林固定并用石蜡包埋(ffpe)。在biositehisto进行肿瘤的组织学和免疫组织化学分析。将ffpe异种移植肿瘤组织切片并用h&e染色或进行t细胞标记物cd3、cd4或cd8的染色。使用具有20x物镜的3d histech pannoramic midi仪器对染色的片进行成像和数字化。将caseviewer 2.2用于数字片的显微镜检查(microscoping),将image j用于基于肿瘤面积的分析。计算肿瘤浸润淋巴细胞(til)占肿瘤面积减去坏死面积的百分比。
[0491]
图10反映了本研究第2天、第6天、第9天、第13天和第16天测量的肿瘤体积的改变。通过融合蛋白seq id nos:87和82以及包含在融合蛋白中的gpc3抗体(seq id nos:81和82)实现了肿瘤生长抑制。在研究过程中,融合蛋白和gpc3抗体(分别在5或3.9mg/kg的浓度下)两者完全抑制了肿瘤的生长。融合蛋白和gpc3抗体的作用是剂量依赖性的,因为较低浓度的(0.5或0.39mg/kg)对肿瘤生长具有很小的作用。通过用参照cd137抗体(seq id nos:26和27)的治疗仅对肿瘤生长实现了有限的作用。
[0492]
表9汇总了通过肿瘤浸润淋巴细胞的组织学和免疫组织化学分析得到的数据。将瘤内cd3、cd4、或cd8 t细胞浸润以%til/(肿瘤面积
‑
坏死面积)示出。采用融合蛋白的治疗导致了高达10%的(肿瘤面积
‑
坏死面积)(全部治疗组)的t细胞浸润。与溶媒对照相比,采用gpc3抗体或参照cd137抗体治疗未诱导瘤内t细胞浸润。
[0493]
表9:肿瘤浸润淋巴细胞(til)占肿瘤面积减去坏死面积的百分比
[0494][0495]
实施例13:融合蛋白在小鼠中的药代动力学
[0496]
在小鼠中进行代表性融合蛋白(seq id nos:87和82)以及包含在融合蛋白中的gpc3抗体(seq id nos:81和82)的药代动力学分析,并将其与两种先前已知的cd137/gpc3双特异性融合蛋白(seq id no:83和seq id no:84)的药代动力学进行比较。以2mg/kg(seq id nos:87和82、seq id nos:81和82)或10mg/kg(seq id no:83、seq id no:84)的剂量向约5周龄的雄性cd
‑
1小鼠(每个时间点2只小鼠;charles river laboratories)向尾静脉中注射相应的构建体。对于基于抗体的构建体,在时间点5min、24h、168h和336h以及在5min、2h、4h、8h、24h、2d、3d、4d、7d、9d、11d、14d和21d获得来自小鼠的血浆样品。收集足够的全血(在异氟烷麻醉下采集)以获得至少30
‑
50μl的li
‑
heparin血浆/动物和时间。然后使用elisa分析血浆药物水平。
[0497]
对于seq id nos:87和82或seq id nos:81和82,采用以下方案:将人gpc3溶解在pbs中(1μg/ml)并在4℃下于微量滴定板上涂覆过夜。在每个温育步骤后,用80μl pbs
‑
0.05%t洗涤板5次。将板用pbs
‑
0.1%t
‑
2%bsa在室温下封闭1小时,然后洗涤。将血浆样品在pbs
‑
0.1%t
‑
2%bsa中稀释至20%血浆浓度,加入到孔中并在室温下温育1小时。随后是另一洗涤步骤。在用在pbs
‑
0.1%t
‑
2%bsa中稀释的1μg/ml的sulfo
‑
tag抗
‑
人抗体(mesoscale discovery)或抗
‑
ngal亲和纯化的多克隆抗血清温育1小时后检测研究中的结合的试剂。在另外的洗涤步骤后,向每个孔中加入25μl读数缓冲液,并通过mesoscale discovery读数器读取每个孔的电化学发光(ecl)信号。
[0498]
对于seq id no:83或seq id no:84,采用以下方案:将人cd137溶解在pbs中(1μg/ml)并在4℃下于微量滴定板上涂覆过夜。在每个温育步骤后,用80μl pbs
‑
0.05%t洗涤板。
将板用pbs
‑
0.1%t
‑
2%bsa在室温下封闭1小时,然后洗涤。将血浆样品在pbs
‑
0.1%t
‑
2%bsa中稀释至20%血浆浓度,加入到孔中并在室温下温育1小时。随后是另一洗涤步骤。在用在pbs
‑
0.1%t
‑
2%bsa中稀释的1μg/ml的人glypican
‑
bio和链霉亲和素sulfo
‑
标签温育1小时后检测研究中的结合的试剂。在另外的洗涤步骤后,向每个孔中加入25μl读数缓冲液,并通过mesoscale discovery读数器读取每个孔的ecl信号。
[0499]
为了数据分析和定量,还采用标准蛋白稀释液制备了校准曲线。将示例性实验中测试分子的血浆浓度随时间的变化绘制在图12中。使用phoenix winnonlin version 8.1对数据进行非
‑
室(non
‑
compartmental)分析,结果汇总在表10中。
[0500]
数据表明,所提供的融合蛋白seq id nos:87和82显示了典型的抗体药代动力学,而先前已知的cd137/gpc3双特异性融合蛋白seq id no:83和seq id no:84显示出明显受损的药代动力学特征。
[0501]
表10:小鼠中的药代动力学
[0502][0503]
实施例14:融合蛋白的热稳定性评估
[0504]
为了测定融合蛋白的作为整体稳定性的一般指标的熔融温度(t
m
),使用毛细管nanodsc仪(csc 6300,ta instruments)以1℃/min扫描(25℃
‑
100℃)pbs(gibco)中蛋白质浓度为1mg/ml的测试分子。使用积分nano分析软件从所示的自记温度图计算t
m
。
[0505]
将得到的示例性融合蛋白的最大熔融温度以及熔融起始温度列于下表11中。与一些先前已知的cd137/gpc3双特异性融合蛋白seq id no:83、seq id no:84以及seq id nos:26和102相比,融合蛋白seq id nos:72和82以及cd137ac1
‑
融合2具有改善的热稳定性。
[0506]
表11:通过nanodsc测定的t
m
和起始熔融温度
[0507] 熔融的起始[℃]t
m
[℃]seq id nos:87和8260.066.6/71.1cd137ac1
‑
融合260.066.6/70.9seq id nos:81和8260.066.6/71.1seq id no:8357.567.3/71.7seq id no:8459.067.6/70.7seq id nos:26和10246.056.9/70.8
[0508]
本文示例性所描述的实施方案可以适当地在本文中未具体公开的任何一种或多种要素、一种或多种限制不存在的情况下实施。因此,例如,术语“包含”、“包括”、“含有”等应被宽泛地解读且无限制。另外,本文所采用的术语和表达被用作描述的术语而非限制的
术语,并且无意图在使用这些术语和表达时,排除掉显示和描述的特征的任何等同物或其部分,而是认可各种修饰可以在本发明请求保护的范围内。因此,应当理解的是,虽然本发明的实施方案已通过优选的实施方案和任选的特征而被具体公开,本领域技术人员可以寻求其修饰和变化,并且这样的修饰和变化被认为是在本发明的范围内。本文所述的所有专利、专利申请、教科书和同行评审的出版物均通过引用全文并入本文。此外,当在通过引用并入本文的参考文献中的定义或使用的术语与本文所提供该术语的定义不一致或相反时,适用本文所提供的该术语的定义,而不适用该参考文献中该术语的定义。每个较窄种类和亚属分组落入类属的公开范围内,也形成本发明的一部分。这包括本发明的一般描述,且具有从该种类中去除任何主题的条件或负面限制,而不管该去除的材料是否在本文中具体陈述。此外,当特征是以马库什组的形式描述时,本领域技术人员将认识到,本发明还由此以该马库什组中任何单独成员或成员亚组的形式描述。进一步的实施方案将由以下的权利要求书变得显而易见。
[0509]
等同物:本领域的技术人员使用不超过常规实验就会认识到或者能够确定许多与此处描述的本发明的具体实施方案的等同物。以下的权利要求意欲涵盖这些等同物。在本说明书中提到的所有出版物、专利和专利申请在此引入本说明书中作为参考,就像每个单独的出版物、专利或专利申请具体地且分别指出引入本文作为参考一样。
[0510]
vi.非专利参考文献
[0511]
1.cheng,w.,tseng,c.j.,lin,t.t.,cheng,i.,pan,h.w.,hsu,h.c.&lee,y.m.2008.glypican
‑3‑
mediated oncogenesis involves the insulin
‑
like growth factor
‑
signaling pathway.carcinogenesis,29,1319
‑
26.
[0512]
2.song,h.h.,shi,w.,xiang,y.y.&filmus,j.2005.the loss of glypican
‑
3induces alterations in wnt signaling.j biol chem,280,2116
‑
25.
[0513]
3.song,h.h.,shi,w.&filmus,j.1997.oci
‑
5/rat glypican
‑
3binds to fibroblast growth factor
‑
2but not to insulin
‑
like growth factor
‑
2.j biol chem,272,7574
‑
7.
[0514]
4.pilia,g.,hughes
‑
benzie,r.m.,mackenzie,a.,baybayan,p.,chen,e.y.,huber,r.,neri,g.,cao,a.,forabosco,a.&schlessinger,d.1996.mutations in gpc3,a glypican gene,cause the simpson
‑
golabi
‑
behmel overgrowth syndrome.nat genet,12,241
‑
7.
[0515]
5.aydin,o.,yildiz,l.,baris,s.,dundar,c.&karagoz,f.2015.expression of glypican 3 in low and high grade urothelial carcinomas.diagn pathol,10,34.
[0516]
6.ushiku,t.,uozaki,h.,shinozaki,a.,ota,s.,matsuzaka,k.,nomura,s.,kaminishi,m.,aburatani,h.,kodama,t.&fukayama,m.2009.glypican 3
‑
expressing gastric carcinoma:distinct subgroup unifying hepatoid,clear
‑
cell,and alpha
‑
fetoprotein
‑
producing gastric carcinomas.cancer sci,100,626
‑
32.
[0517]
7.gailey,m.p.&bellizzi,a.m.2013.immunohistochemistry for the novel markers glypican 3,pax8,and p40(deltanp63)in squamous cell and urothelial carcinoma.am j clin pathol,140,872
‑
80.
[0518]
8.yamanaka,k.,ito,y.,okuyama,n.,noda,k.,matsumoto,h.,yoshida,h.,
miyauchi,a.,capurro,m.,filmus,j.&miyoshi,e.2007.immunohistochemical study of glypican 3in thyroid cancer.oncology,73,389
‑
94.
[0519]
9.nakatsura,t.,kageshita,t.,ito,s.,wakamatsu,k.,monji,m.,ikuta,y.,senju,s.,ono,t.&nishimura,y.2004.identification of glypican
‑
3 as a novel tumor marker for melanoma.clin cancer res,10,6612
‑
21.
[0520]
10.zynger,d.l.,dimov,n.d.,luan,c.,teh,b.t.&yang,x.j.2006.glypican 3:a novel marker in testicular germ cell tumors.am j surg pathol,30,1570
‑
5.
[0521]
11.montalbano,m.,rastellini,c.,wang,x.,corsello,t.,eltorky,m.a.,vento,r.&cicalese,l.2016.transformation of primary human hepatocytes in hepatocellular carcinoma.int j oncol,48,1205
‑
17.
[0522]
12.midorikawa,y.,ishikawa,s.,iwanari,h.,imamura,t.,sakamoto,h.,miyazono,k.,kodama,t.,makuuchi,m.&aburatani,h.2003.glypican
‑
3,overexpressed in hepatocellular carcinoma,modulates fgf2 and bmp
‑
7 signaling.int j cancer,103,455
‑
65.
[0523]
13.capurro,m.,wanless,i.r.,sherman,m.,deboer,g.,shi,w.,miyoshi,e.&filmus,j.2003.glypican
‑
3:a novel serum and histochemical marker for hepatocellular carcinoma.gastroenterology,125,89
‑
97.
[0524]
14.nakatsura,t.,yoshitake,y.,senju,s.,monji,m.,komori,h.,motomura,y.,hosaka,s.,beppu,t.,ishiko,t.,kamohara,h.,ashihara,h.,katagiri,t.,furukawa,y.,fujiyama,s.,ogawa,m.,nakamura,y.&nishimura,y.2003.glypican
‑
3,overexpressed specifically in human hepatocellular carcinoma,is a novel tumor marker.biochem biophys res commun,306,16
‑
25.
[0525]
15.sung,y.k.,hwang,s.y.,park,m.k.,farooq,m.,han,i.s.,bae,h.i.,kim,j.c.&kim,m.2003.glypican
‑
3 is overexpressed in human hepatocellular carcinoma.cancer sci,94,259
‑
62.
[0526]
16.zhu,z.w.,friess,h.,wang,l.,abou
‑
shady,m.,zimmermann,a.,lander,a.d.,korc,m.,kleeff,j.&buchler,m.w.2001.enhanced glypican
‑
3 expression differentiates the majority of hepatocellular carcinomas from benign hepatic disorders.gut,48,558
‑
64.
[0527]
17.jelic,s.,sotiropoulos,g.c.&group,e.g.w.2010.hepatocellular carcinoma:esmo clinical practice guidelines for diagnosis,treatment and follow
‑
up.ann oncol,21 suppl 5,v59
‑
64.
[0528]
18.feng,m.&ho,m.2014.glypican
‑
3 antibodies:a new therapeutic target for liver cancer.febs lett,588,377
‑
82.
[0529]
19.takai,h.,kato,a.,kinoshita,y.,ishiguro,t.,takai,y.,ohtani,y.,sugimoto,m.&suzuki,m.2009.histopathologicalanalyses of the antitumor activity of anti
‑
glypican
‑
3 antibody(gc33)in human liver cancer xenograft models:the contribution of macrophages.cancer biol ther,8,930
‑
8.
[0530]
20.nakano,k.,orita,t.,nezu,j.,yoshino,t.,ohizumi,i.,sugimoto,m.,
antibodies.j exp med,210,1685
‑
93.
[0556]
46.spiess,c.,zhai,q.&carter,p.j.2015.alternative molecular formats and therapeutic applications for bispecific antibodies.mol immunol,67,95
‑
106.
[0557]
47.sedykh,s.e.,prinz,v.v.,buneva,v.n.&nevinsky,g.a.2018.bispecific antibodies:design,therapy,perspectives.drug des devel ther,12,195
‑
208.
[0558]
48.alavijeh,m.s.&palmer,a.m.2004.the pivotal role of drug metabolism and pharmacokinetics in the discovery and development of new medicines.idrugs,7,755
‑
63.
[0559]
49.ryman,j.t.&meibohm,b.2017.pharmacokinetics of monoclonal antibodies.cpt pharmacometrics syst pharmacol,6,576
‑
588.
[0560]
50.silva,j.p.,vetterlein,o.,jose,j.,peters,s.&kirby,h.2015.the s228p mutation prevents in vivo and in vitro igg4 fab
‑
arm exchange as demonstrated using a combination of novel quantitative immunoassays and physiological matrix preparation.j biol chem,290,5462
‑
9.
[0561]
51.glaesner,w.,vick,a.m.,millican,r.,ellis,b.,tschang,s.h.,tian,y.,bokvist,k.,brenner,m.,koester,a.,porksen,n.,etgen,g.&bumol,t.2010.engineering and characterization of the long
‑
acting glucagon
‑
like peptide
‑
1 analogue ly2189265,an fc fusion protein.diabetes metab res rev,26,287
‑
96.
[0562]
52.dall'acqua,w.f.,kiener,p.a.&wu,h.2006.properties of human igg1s engineered for enhanced binding to the neonatal fc receptor(fcrn).j biol chem,281,23514
‑
24.
[0563]
53.zalevsky,j.,chamberlain,a.k.,horton,h.m.,karki,s.,leung,i.w.,sproule,t.j.,lazar,g.a.,roopenian,d.c.&desjarlais,j.r.2010.enhanced antibody half
‑
life improves in vivo activity.nat biotechnol,28,157
‑
9.
[0564]
54.shields,r.l.,namenuk,a.k.,hong,k.,meng,y.g.,rae,j.,briggs,j.,xie,d.,lai,j.,stadlen,a.,li,b.,fox,j.a.&presta,l.g.2001.high resolution mapping of the binding site on human igg1 for fc gamma ri,fc gamma rii,fc gamma riii,and fcrn and design of igg1 variants with improved binding to the fc gamma r.j biol chem,276,6591
‑
604.
[0565]
55.altshuler,e.p.,serebryanaya,d.v.&katrukha,a.g.2010.generation of recombinant antibodies and means for increasing their affinity.biochemistry(mosc),75,1584
‑
605.
[0566]
56.harlow,e.&lane,d.1999.using antibodies:a laboratory manual,cold spring harbor,n.y.,cold spring harbor laboratory press.
[0567]
57.harlow,e.&lane,d.1988.antibodies:a laboratory manual,cold spring harbor,ny,cold spring harbor laboratory.
[0568]
58.li,j.,sai,t.,berger,m.,chao,q.,davidson,d.,deshmukh,g.,drozdowski,b.,ebel,w.,harley,s.,henry,m.,jacob,s.,kline,b.,lazo,e.,rotella,f.,routhier,e.,rudolph,k.,sage,j.,simon,p.,yao,j.,zhou,y.,kavuru,m.,bonfield,t.,
thomassen,m.j.,sass,p.m.,nicolaides,n.c.&grasso,l.2006.human antibodies for immunotherapy development generated via a human b cell hybridoma technology.proc natl acad sci u s a,103,3557
‑
62.
[0569]
59.kozbor,d.&roder,j.c.1983.the production of monoclonal antibodies from human lymphocytes.immunol today,4,72
‑
9.
[0570]
60.cole,s.p.,campling,b.g.,louwman,i.h.,kozbor,d.&roder,j.c.1984.a strategy for the production of human monoclonal antibodies reactive with lung tumor cell lines.cancer res,44,2750
‑
3.
[0571]
61.holliger,p.&hudson,p.j.2005.engineered antibody fragments and the rise of single domains.nat biotechnol,23,1126
‑
36.
[0572]
62.pervaiz,s.&brew,k.1987.homology and structure
‑
function correlations between alpha 1
‑
acid glycoprotein and serum retinol
‑
binding protein and its relatives.faseb j,1,209
‑
14.
[0573]
63.sambrook,j.&russell,d.w.2001.molecular cloning:a laboratory manual,cold spring harbor,n.y.,cold spring harbor laboratory press.
[0574]
64.flower,d.r.2000.beyond the superfamily:the lipocalin receptors.biochim biophys acta,1482,327
‑
36.
[0575]
65.breustedt,d.a.,korndorfer,i.p.,redl,b.&skerra,a.2005.the 1.8
‑
a crystal structure of human tear lipocalin reveals an extended branched cavity with capacity for multiple ligands.j biol chem,280,484
‑
93.
[0576]
66.schmidt,t.g.,koepke,j.,frank,r.&skerra,a.1996.molecular interaction between the strep
‑
tag affinity peptide and its cognate target,streptavidin.j mol biol,255,753
‑
66.
[0577]
67.vajo,z.&duckworth,w.c.2000.genetically engineered insulin analogs:diabetes in the new millenium.pharmacol rev,52,1
‑
9.
[0578]
68.fuertges,f.&abuchowski,a.1990.the clinical efficacy of poly(ethylene glycol)
‑
modified proteins.journal of controlled release,11,139
‑
148.
[0579]
69.dennis,m.s.,zhang,m.,meng,y.g.,kadkhodayan,m.,kirchhofer,d.,combs,d.&damico,l.a.2002.albumin binding as a general strategy for improving the pharmacokinetics of proteins.j biol chem,277,35035
‑
43.
[0580]
70.konig,t.&skerra,a.1998.use of an albumin
‑
binding domain for the selective immobilisation of recombinant capture antibody fragments on elisa plates.j immunol methods,218,73
‑
83.
[0581]
71.osborn,b.l.,olsen,h.s.,nardelli,b.,murray,j.h.,zhou,j.x.,garcia,a.,moody,g.,zaritskaya,l.s.&sung,c.2002.pharmacokinetic and pharmacodynamic studies of a human serum albumin
‑
interferon
‑
alpha fusion protein in cynomolgus monkeys.j pharmacol exp ther,303,540
‑
8.
[0582]
72.lowman,h.b.1997.bacteriophage display and discovery of peptide leads for drug development.annu rev biophys biomol struct,26,401
‑
24.
[0583]
73.rodi,d.j.&makowski,l.1999.phage
‑
display technology
‑‑
finding a needle in a vast molecular haystack.curr opin biotechnol,10,87
‑
93.
[0584]
74.venturi,m.,seifert,c.&hunte,c.2002.high level production of functional antibody fab fragments in an oxidizing bacterial cytoplasm.j mol biol,315,1
‑
8.
[0585]
75.bruckdorfer,t.,marder,o.&albericio,f.2004.from production of peptides in milligram amounts for research to multi
‑
tons quantities for drugs of the future.curr pharm biotechnol,5,29
‑
43.
[0586]
76.frese,k.,eisenmann,m.,ostendorp,r.,brocks,b.&pabst,s.2013.an automated immunoassay for early specificity profiling of antibodies.mabs,5,279
‑
87.
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。