1.本发明属于生物技术领域,具体涉及一种肿瘤血管周细胞及其分离方法与应用。
背景技术:
2.肿瘤周细胞(tumor pericytes,tpcs)是一种位于肿瘤血管外周并嵌入到基底膜中的壁细胞,在肿瘤血管的新生、成熟和稳定、肿瘤侵袭和转移和肿瘤抗血管新生疗法治疗耐受等方面发挥着重要的作用(1-3)。肿瘤周细胞对肿瘤进展的调节作用已经成为近年来的研究热点。目前,横亘在肿瘤周细胞研究领域的最大障碍之一是缺乏肿瘤周细胞特异性分子标记物,这不仅影响了对肿瘤周细胞的辨识,也限制了肿瘤周细胞的分离和分选。首先,不同于肿瘤组织中的其他类型细胞,肿瘤周细胞仍然缺少特异性的分子标志物,大多数研究普遍采用ng2、cd146,pdgfrβ,cd13和αsma等标志物指示肿瘤周细胞(4-7)。基于此,目前从正常组织或肿瘤组织分离血管周细胞的方法主要是利用周细胞高表达的ng2,cd146,pdgfrβ,cd13和αsma等分子标志物的其中一种或多种对周细胞进行标记,然后利用磁珠分选或流式分选法分离血管周细胞(8-10)。经检索专利数据库发现,中国专利申请cn201611078356.2(申请公布号cn106589124a;发明名称:cd146单克隆抗体在胶质瘤血管周细胞检测及分离鉴定中的应用)和中国专利申请cn201810550545.8(申请公布号cn108715836a;发明名称:一种肿瘤组织中周细胞的分离和仿生培养)分别公开了采用cd146单个抗体或cd13,cd140b,cd146,ng2,αsma多个抗体标记细胞,利用流式细胞分选技术分离肿瘤血管周细胞的方法。然而,ng2、cd146,pdgfrβ,cd13和αsma等分子标记物不但表达于肿瘤周细胞,也同时表达于肿瘤相关成纤维细胞、平滑肌细胞和间充质干细胞等基质细胞(11-13)。因此,基于这些分子标记物的磁珠分选或流式分选法获得的周细胞可能同时包含了成纤维细胞和间充质干细胞等杂细胞,存在纯度不足的缺点。其次,由于肿瘤组织存在异质性,不同区域的肿瘤周细胞的分子标志物表达可能存在差异。因此,根据其中某一个或几个分子标志物的分选方法只能得到单一类型的肿瘤周细胞,不能全面反映肿瘤周细胞的异质性。此外,由于缺乏肿瘤周细胞的有效分离和培养方法,目前周细胞的体外研究通常使用人脑血管周细胞(human brain vascular pericytes,hbvps)与肿瘤细胞共孵育或hbvps转染fapα质粒等方法模拟肿瘤周细胞(14,15)。然而,因脑血管的生理功能和特征与肿瘤血管存在极大差异,使用肿瘤细胞教育hbvps无法反映真实肿瘤周细胞的生物学功能。综合上述现状,目前急需从全新的角度提供一种新型、简单、高效的肿瘤周细胞分离和培养的方法,以获得高纯度、高活性且能全面反映细胞异质性的肿瘤血管周细胞。
3.参考文献:
4.1.ferland-mccollough d,slater s,richard j,reni c,and mangialardi g.pericytes,an overlooked player in vascular pathobiology.pharmacol ther.2017;171:30-42.
5.2.paiva ae,lousado l,guerra dap,azevedo po,sena ifg,andreotti jp,et al.pericytes in the premetastatic niche.cancer res.2018;78(11):2779-86.
6.3.raza a,franklin mj,and dudek az.pericytes and vessel maturation during tumor angiogenesis and metastasis.am j hematol.2010;85(8):593-8.
7.4.proebstl d,voisin mb,woodfin a,whiteford j,d'acquisto f,jones ge,et al.pericytes support neutrophil subendothelial cell crawling and breaching of venular walls in vivo.j exp med.2012;209(6):1219-34.
8.5.cooke vg,lebleu vs,keskin d,khan z,o'connell jt,teng y,et al.pericyte depletion results in hypoxia-associated epithelial-to-mesenchymal transition and metastasis mediated by met signaling pathway.cancer cell.2012;21(1):66-81.
9.6.hong j,tobin np,rundqvist h,li t,lavergne m,garcia-ibanez y,et al.role of tumor pericytes in the recruitment of myeloid-derived suppressor cells.j natl cancer inst.2015;107(10).
10.7.murgai m,ju w,eason m,kline j,beury dw,kaczanowska s,et al.klf4-dependent perivascular cell plasticity mediates pre-metastatic niche formation and metastasis.nat med.2017;23(10):1176-90.
11.8.ee c,and f d.facs isolation of endothelial cells and pericytes from mouse brain microregions.nature protocols.2018;13(4):738-51.
12.9.k y,ea s,me o,a n,s r,h h,et al.loss of endothelium-derived wnt5a is associated with reduced pericyte recruitment and small vessel loss in pulmonary arterial hypertension.circulation.2019;139(14):1710-24.
13.10.yuan sm,guo y,zhou xj,shen wm,chen hn.pdgfr-β( )perivascular cells from infantile hemangioma display the features of mesenchymal stem cells and show stronger adipogenic potential in vitro and in vivo.int j clin exp pathol.2014;7(6):2861-70.
14.11.primac i,maquoi e,blacher s,heljasvaara r,van deun j,smeland hy,et al.stromal integrin alpha11 regulates pdgfr-beta signaling and promotes breast cancer progression.j clin invest.2019;130.
15.12.ak,ss ds,ov m,h t,b w,j z,et al.specification and diversification of pericytes and smooth muscle cells from mesenchymoangioblasts.cell reports.2017;19(9):1902-16.
16.13.le ds,tm m,s kh,and dt c.mesenchymal stem cells and pericytes:to what extent are they related?stem cells and development.2016;25(24):1843-52.
17.14.franco m,roswall p,cortez e,hanahan d,and pietras k.pericytes promote endothelial cell survival through induction of autocrine vegf-a signaling and bcl-w expression.blood.2011;118(10):2906-17.
18.15.chen m,lei x,shi c,huang m,li x,wu b,et al.pericyte-targeting prodrug overcomes tumor resistance to vascular disrupting agents.j clin invest.2017;127(10):3689-701.
技术实现要素:
19.本发明的首要目的旨在克服现有利用磁珠分选或流式分选肿瘤周细胞技术的缺点与不足,提供一种肿瘤血管周细胞的分离方法。该方法可以提供数量充足、来源可靠、质量稳定的肿瘤血管周细胞用于基础医学、生物学研究和药物开发研究。
20.本发明的另一目的在于提供一种肿瘤血管周细胞。本发明以人结直肠癌血管为例分离和鉴定肿瘤周细胞,采用本发明所述方法获得的其它类型实体恶性肿瘤血管周细胞也在本发明的保护范围内。
21.本发明的再一目的在于提供上述肿瘤血管周细胞的应用。
22.本发明主要通过以下技术方案实现上述目的:
23.一种肿瘤血管周细胞的分离方法,是从新鲜的实体肿瘤组织样本中剥离得到肿瘤血管,将肿瘤血管剪切成环状片段,然后将肿瘤血管环状片段置于预铺基质胶的周细胞培养基中,进行条件培养,最后从基质胶中回收肿瘤血管周细胞。
24.所述的实体肿瘤可以为肝癌、结直肠癌、乳腺癌、宫颈癌、前列腺癌、胶质瘤、黑色素瘤、胰腺癌、鼻咽癌、肺癌或胃癌;优选为结直肠癌。
25.所述的实体肿瘤组织样本优选为保存于含1%(v/v)青链双抗(青霉素和链霉素,penicillin-streptomycin,ps)的dmem培养基中的实体肿瘤组织。
26.所述的实体肿瘤组织为经知情同意和医学伦理批准,从确诊的实体恶性肿瘤患者手术过程中,获取的手术切除新鲜的包含癌灶与癌旁组织的、无大面积坏死的实体肿瘤组织。
27.所述的实体肿瘤组织在保存前,先用含1%(v/v)青链双抗的dmem培养基进行冲洗,去除残留粪便及血渍等污染物。
28.所述的实体肿瘤组织样本在使用前,优选先用4℃预冷的含1%(v/v)青链双抗的磷酸盐缓冲液冲洗,直至冲洗至无血色为止。
29.所述的从新鲜的实体肿瘤组织样本中剥离得到肿瘤血管,将肿瘤血管剪切成环状片段的过程优选在体视显微镜引导下进行。
30.所述的肿瘤血管在剥离前,优选先修剪去除附着在血管外径的脂肪组织。该过程优选在体视显微镜引导下进行。
31.所述的血管的管径优选为30~100μm。
32.所述的血管环状片段的长度优选为4~6mm。
33.所述的基质胶的配制方法优选为:用4℃预冷的dmem培养基以体积比2:1的比例稀释基质胶,然后在稀释的基质胶溶液中加入终浓度为0.5%~2%(w/v)的人血小板衍生生长因子bb(pdgf-bb);更优选为在稀释的基质胶溶液中加入终浓度为1%(w/v)的人血小板衍生生长因子bb。
34.所述的基质胶的用量优选为按24孔板每孔加入100μl基质胶计。
35.所述的基质胶在使用前优选先置于37℃培养箱孵育30~40分钟。
36.所述的周细胞培养基的配方优选为:含有2%(v/v)胎牛血清、1%(v/v)周细胞生长添加物pgs、100u/ml青霉素和100μg/ml链霉素的基础培养基。
37.所述的条件培养的条件优选为37℃、5%co2、95%湿度的培养箱中培养13~15天;优选为14天。
38.所述的回收的具体操作为:用磷酸盐缓冲液冲洗基质胶,离心,去除上清,所得沉淀中加入分散酶进行消化,停止消化,即可。
39.所述的离心的条件优选为转速1000~2000
×
g,时间10~20分钟;更优选为转速1500
×
g,时间15分钟。
40.所述的分散酶优选浓度为1u/ml的分散酶溶液。
41.所述的消化的条件优选为37℃培养箱中孵育2~3小时。
42.所述的停止消化使用的试剂优选为edta;更优选为浓度为10mm的edta溶液。
43.所述的分散酶溶液和所述的edta溶液的配比,优选按体积比1:4计。
44.所述的分离全过程在超净台内无菌条件下进行。
45.一种肿瘤血管周细胞,为通过上述肿瘤血管周细胞的分离方法制备得到。
46.所述的肿瘤血管周细胞具有如下的生物学特性:高表达fapα、ng2、pdgfrβ和cd146四个阳性分子标记物,不表达cd31、myh11两个阴性分子标记物;具有核占比大,细胞器少的亚细胞结构特征;具备向内皮细胞管腔趋化、粘附的生物学特性。
47.上述肿瘤血管周细胞在肿瘤相关生物学研究和/或制备抗肿瘤药物中的应用。
48.上述肿瘤血管周细胞在构建永生化肿瘤血管周细胞中的应用。
49.一种永生化肿瘤血管周细胞的构建方法,先通过上述肿瘤血管周细胞的分离方法制备肿瘤血管周细胞,然后以sv40t抗原慢病毒转染所述的肿瘤血管周细胞,即得到永生化肿瘤血管周细胞。
50.一种永生化肿瘤血管周细胞,通过上述永生化肿瘤血管周细胞的构建方法制备得到。
51.一种永生化肿瘤血管周细胞单克隆株的构建方法,用有限稀释法对阳性克隆的上述永生化肿瘤血管周细胞进行克隆化培养,即得到永生化肿瘤血管周细胞单克隆株。
52.一种永生化肿瘤血管周细胞单克隆株,通过上述永生化肿瘤血管周细胞单克隆株的构建方法制备得到。
53.本发明相对于现有技术具有如下的优点及效果:
54.1.本发明首次利用剥离肿瘤血管以及条件培养方法获得肿瘤血管周细胞。与以往利用cd13、αsma、cd146、ng2、pdgfrβ等单个或多个分子标记物的抗体进行磁珠分选或流式分选获得单一类型的肿瘤周细胞的方法相比较,本发明所采用的肿瘤血管周细胞分离方法更简易操作、成本更低;利用本发明方法分离得到的肿瘤血管周细胞的类型更全面,更能真实地反映了肿瘤血管周细胞的异质性。
55.2.本发明获得的肿瘤周细胞来源于人结直肠癌手术标本,能真实地反映肿瘤血管生物学特征。因此,本发明获得的人结直肠癌血管周细胞优于以往采用正常人脑血管周细胞或牛眼视网膜血管周细胞与肿瘤细胞在体外共培养获得的模拟肿瘤血管周细胞。
56.3.本发明首次采用透射电镜观测了获得的原代人结直肠癌血管周细胞及其永生化细胞单克隆株的亚细胞结构特征,为人结直肠癌血管周细胞的鉴定提供了可参考的新标准。
57.4.本发明首次采用sv40t慢病毒感染原代培养人结直肠癌血管周细胞,实现了永生化人结直肠癌血管周细胞模型构建零的突破。
58.5.本发明首次挑选了永生化人结直肠癌血管周细胞的单克隆株,为人结直肠癌血
管周细胞的生物学及医学研究提供充足、稳定、可靠的细胞原材料。
附图说明
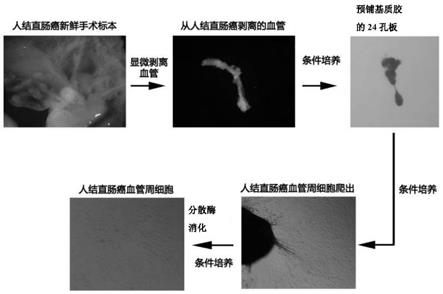
59.图1为人结直肠癌血管周细胞的分离流程图。
60.图2为人结直肠癌血管周细胞流式细胞术鉴定图。
61.图3为人结直肠癌血管周细胞免疫荧光鉴定图。
62.图4为人结直肠癌血管周细胞透射电镜鉴定图。
63.图5为人结直肠癌血管周细胞与脐静脉内皮细胞三维管腔粘附实验结果图,其中,pkh26标记huvec,为红色荧光,pkh67标记cpc,为绿色荧光。
64.图6为pgmlv-sv40t慢病毒质粒结构示意图。
65.图7为pcr检测sv40t基因的表达结果图,其中,泳道1为marker,泳道2为人结直肠癌血管周细胞,泳道3为永生化人结直肠癌血管周细胞,泳道4为永生化人结直肠癌血管周细胞单克隆株。
66.图8为cck8法测定不同传代数人结直肠癌血管周细胞的细胞增殖活性结果图。
67.图9为永生化人结直肠癌血管周细胞单克隆细胞株流式鉴定图。
68.图10为永生化人结直肠癌血管周细胞单克隆细胞株免疫荧光鉴定图。
69.图11为永生化人结直肠癌血管周细胞单克隆细胞株透射电镜鉴定图。
70.图12为永生化人结直肠癌血管周细胞单克隆细胞株与脐静脉内皮细胞三维管腔粘附实验结果图,其中,pkh26标记huvec,为红色荧光,pkh67标记cpc,为绿色荧光。
具体实施方式
71.下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
72.实施例1 人结直肠癌血管的剥离以及人结直肠癌血管周细胞的分离和培养
73.实验方法:参照图1所示的流程,取新鲜的人结直肠癌样本(通过广州华侨医院胃肠外科收集,所用收集的样本均告知患者研究目的和签署知情同意书,对根据临床影像学、血清癌胚蛋白检验、活检等技术手段术前确诊的恶性结直肠癌,获取手术切除新鲜的包含癌灶与癌旁组织的肿瘤标本,并用含1%(v/v)青链双抗的dmem培养基进行冲洗去除残留粪便及血渍等污染物,保存于含1%(v/v)青链双抗的dmem培养基中),在超净工作台用含1%(v/v)ps(青-链霉素,penicillin-streptomycin)的pbs(1
×
,ph=7.4)冲洗干净,至无血色为止,置于含预冷pbs的无菌解剖皿上,在体视显微镜下找到结直肠黏膜组织,并使用显微解剖弹簧剪去除黏膜下层血管的周围组织,剪取靠近黏膜侧管径<100μm的肿瘤血管,用显微解剖镊子并将肿瘤血管夹取,置于预冷的条件培养基中,待用。随后在超净工作台内,用预冷的dmem空白培养基以体积比2:1的比例稀释基质胶(matrigel,cat.no.354248),并在稀释的matrigel溶液内加入终浓度为1%(w/v)的人血小板衍生生长因子bb(pdgf-bb),制备涂抹液。将涂抹液按100μl/孔加入至24孔板底部,并将24孔板放置于37℃培养箱孵育30分钟。用弹簧剪将结直肠癌血管剪切成长度约5mm的血管环,然后用显微解剖镊子将人结直肠癌血管环加入至预铺matrigel的24孔板中,加入1ml周细胞完全培养液(周细胞培养基pericyte medium(pm,cat.no.1201),即包含2%(v/v)胎牛血清、1%(v/v)
周细胞生长添加物pgs、100u/ml青霉素、100μg/ml链霉素的基础培养基)。随后放置于在37℃、5%co2、95%湿度的培养箱中培养14天,可见细胞从微血管环向四周爬出并紧贴matrigel生长。将matrigel包裹的人结直肠癌血管细胞样本用pbs清洗一遍后,1500
×
g离心5分钟,去除上清,沉淀物加入200μl含1u/ml的分散酶溶液(cat.no.07923),并在37℃培养箱中孵育2小时以消化去除基质胶。随后加入800μl的浓度为10mm的edta停止消化。所得细胞用pbs清洗三遍后,转移至新的6孔板,继续常规培养。
74.实验结果:获得管径30~100μm的肿瘤血管;通过周细胞培养基条件培养,获得约3
×
106个人结直肠癌血管细胞,可供后续培养和鉴定使用。
75.实施例2 流式细胞术测定人结直肠癌血管周细胞分子标记物的表达
76.实验方法:将实施例1获得的人结直肠癌血管细胞用100μl的细胞染色缓冲液(staining buffer)重悬后转移至1.5ml ep管,再向管中加入1μl的anti-cd32-pe blocking(miltenyi cat.no.130-097-521)原型对照液于冰上封闭10分钟;然后加入anti-fapα-pe(r&d cat.no.fab3715p)、anti-ng2-pe(miltenyicat.no.130-097-458)、anti-pdgfrβ-pe(miltenyicat.no.130-105-323)和anti-cd146-pe(miltenyicat.no.130-097-939)四个周细胞阳性分子标记物和anti-cd31-pe(miltenyicat.no.130-110-807)、myh11(cat.no.pa5-82526)两个阴性分子标记物的流式抗体,于冰上避光孵育30~60分钟,pbs清洗两遍;再加1μg/ml的dapi进行细胞核染色,冰上避光孵育10分钟,pbs清洗两遍;最后用400μl stanning buffer重悬细胞,使用bd facs canto ii流式细胞仪上机检测。采用flowjo vx处理数据。
77.实验结果:流式细胞术实验结果如图2所示。结果显示,人结直肠癌血管周细胞原代培养细胞高表达fapα、ng2、pdgfrβ和cd146四个周细胞阳性分子标记物,但不表达cd31、myh11两个阴性分子标记物。
78.实施例3 免疫荧光法测定人结直肠癌血管周细胞分子标记物的表达
79.实验方法:将实施例1获得的人结直肠癌血管周细胞重悬后,以每皿1
×
105个细胞密度接种于激光共聚焦小皿上,24小时后弃去培养液并用pbs清洗,4%(w/v)多聚甲醛(溶剂为0.1m、ph=7.4的pbs)室温固定30分钟,0.1%triton-x100透膜3分钟,5%bsa室温封闭1小时,加入anti-fapα(r&dcat.no.af3715)、anti-ng2(r&d cat.no.mab2585)、anti-pdgfrβ(r&dcat.no.af385)和anti-cd146(r&dcd146(r&dcat.no.af932)四个周细胞阳性分子标记物和anti-cd31(r&dcat.no.bba7)、anti-myh11(cat.no.pa5-82526)两个阴性分子标记物的一抗于4℃孵育过夜。隔天使用pbs清洗3次,每次10分钟,然后避光孵育相应的荧光二抗,室温孵育60分钟。dapi标记细胞核3分钟后,在zeiss lsm800激光共聚焦显微镜下观察并拍照。
80.实验结果:激光共聚焦显微镜结果如图3所示。结果显示,人结直肠癌血管周细胞原代培养细胞高表达fapα、ng2、pdgfrβ和cd146四个周细胞阳性分子标记物,但不表达cd31、myh11两个阴性分子标记物。
81.实施例4 透射电镜检测人结直肠癌血管周细胞的亚细胞特征
82.实验方法:收集实施例1获得的对数生长期的人结直肠癌血管周细胞,用0.25%胰酶消化,800
×
g离心5分钟。离心后弃上清,将细胞移入ep管中,pbs清洗两次;加入3%戊二醛(美国alfaaesar公司)溶液中,4℃固定过夜;pbs漂洗两次,每次10分钟;继续加入1%四氧化锇(cat.no.18459),4℃固定30分钟;pbs漂洗两次,每次10分钟;依次用浓度为30%、50%、70%、90%、100%(2次)的乙醇溶液脱水,每次10分钟;吸出乙醇,把细胞团块移入底部滴加包埋剂的胶囊中,注满包埋剂,放烤箱60℃聚合2小时;利用leica em uc7型超薄切片机对细胞包埋块进行70~90nm超薄切片,2%醋酸双氧铀(cat.no.spi-02624)及1%柠檬酸铅(cat.no.hd17800)双染色后,利用日立h-7650型透射电镜对超薄切片进行观察。
83.实验结果:透射电镜观测如图4所示。结果显示,人结直肠癌血管周细胞原代培养细胞具有核占比大,细胞器少的亚细胞结构特征。
84.实施例5 三维管腔粘附实验测定人结直肠癌血管周细胞向内皮细胞管腔的趋向性
85.实验方法:采用人脐静脉内皮细胞huvec(cat.no.8000)与实施例1获得的人结直肠癌血管周细胞进行3d共培养实验,观察周细胞的生物学特性。首先在96孔板中每孔加入20μl的matrigel,于37℃培养箱放置30分钟使其凝固备用。消化收集huvec,使用pbs清洗3次后,将huvec混悬在低血清内皮细胞培养基endothelial cell medium(ecm(cat.no.1001) 2%胎牛血清 1%ecgs(内皮细胞生长因子,cat.no.1052) 青霉素100u/ml 链霉素100μg/ml)中,用pkh 26(1:1000,sigma aldrich,cat.no.pkh26gl)细胞膜染料标记,室温染色3分钟,使用无菌的5%bsa终止染色。pbs清洗后使用ecm重悬huvec,计数,然后将其加入预铺matrigel的96孔板中,每孔3
×
104个细胞,培养2小时后huvec开始形成管腔。随后,采用pkh67(sigma aldrich,cat.no.pkh67gl)按照上述方法标记获得的人结直肠癌血管周细胞,并将其加入含有huvec的96孔板中,每孔2
×
104个细胞,分别在0、2和4小时利用荧光显微镜拍照记录人结直肠癌血管周细胞的粘附情况。
86.实验结果:三维管腔粘附实验结果如图5所示。结果表明,人结直肠癌血管周细胞原代培养细胞具有向人脐静脉内皮细胞管腔附着的趋向性。
87.实施例6 构建sv40t慢病毒并感染原代人结直肠癌血管周细胞及其单克隆株
88.实验方法:将含有人sv40t基因转载至pgmlv载体,构建pgmlv-sv40t慢病毒质粒(本实施例使用的是构建好的pgmlv-sv40t慢病毒质粒,购于吉满生物,货号:gm-0220sv01,质粒结构见图6),混合转染试剂lipofectamine 2000和慢病毒包装质粒vsvg/pmdl/rev,混合比例为5:3:2,加入hek-293t工具细胞中,24小时后收取病毒上清液并离心去杂质。将原代人结直肠癌血管周细胞(第一代)传代到24孔板,按1
×
105每孔接种到24孔板6小时后,采用moi 50的病毒滴度(共5
×
106慢病毒颗粒)感染周细胞,于37℃、5%co2培养箱培养24小时后换成新鲜培养基,培养48小时后进行传代。于96孔培养板中,采用有限稀释法将已感染sv40t的人结直肠癌血管周细胞稀释至每2孔含1个细胞,培养7~10天后,选择单个细胞克隆生长的阳性孔再一次进行克隆,重复3次,获得单克隆株ihcpc-1。
89.实施例7 pcr法测定人结直肠癌血管周细胞sv40t的表达情况
90.实验方法:使用trizol法分别提取人结直肠癌血管周细胞、转染sv40t的人结直肠癌血管周细胞、及转染sv40t的人结直肠癌血管周细胞单克隆株ihcpc-1的rna,根据sv40t序列设计pcr引物,引物序列:正向链:5
’-
ccacaaaggaaaaagctgcactgcta-3’,反向链:5
’-
tcaacagcctgttggcatatggtttt-3’,pcr程序:95℃预变性5分钟;95℃30秒、60℃30秒、72℃30秒,共进行35个循环;72℃延伸10分钟,4℃保存。利用凝胶电泳检测sv40t序列的表达情况。
91.实验结果:结果如图7所示。pcr检测人结直肠癌血管周细胞(泳道1)、转染sv40t的人结直肠癌血管周细胞(泳道2)、及转染sv40t的人结直肠癌血管周细胞单克隆株(泳道3)的sv40t基因表达,在泳道2和泳道3均观察到约550bp的阳性条带,表明永生化人结直肠癌血管细胞及其单克隆株构建成功。
92.实施例8 人结直肠癌血管周细胞的增殖活性检测
93.实验方法:将传代至第1、10代人结直肠癌血管周细胞,和第1、10、25代永生化人结直肠癌血管周细胞以每孔1
×
103细胞密度接种于96孔板中,采用cell counting kit-8(cck8)法检测细胞铺板后1~7天的细胞数量。具体检测方法:细胞铺板后1~7天,去除待测细胞上清液,并加入90μl细胞培养基和10μl的cck8溶液(碧云天,c0038)。把细胞放置于细胞培养箱孵育60分钟后,利用酶标仪(tecan f500)于450nm波长下测定吸光度,并根据吸光度计算细胞增殖活性。
94.实验结果:结果如图8所示。未永生化的人结直肠癌血管周细胞传代至第10代后其细胞增殖活性较第1代显著衰减,而第1、10、25代永生化人结直肠癌血管周细胞的细胞增殖活性与第1代人结直肠癌血管周细胞的细胞增殖活性相接近。
95.实施例9 永生化人结直肠癌血管周细胞单克隆株的致瘤性实验
96.实验方法:收集处于对数生长期的永生化人结直肠癌血管周细胞单克隆株,用预冷的matrigel重悬细胞,然后以1
×
107个/ml的细胞密度按0.2ml/只的量接种于balb/c nu/nu裸鼠背部皮下。裸鼠共10只,雌雄各半。对裸鼠进行常规饲养,共计4周,观察永生化人结直肠癌血管周细胞单克隆株的成瘤情况。
97.实验结果:永生化人结直肠癌血管周细胞单克隆株在接种后4周内未见成瘤。可见,本发明构建的永生化人结直肠癌血管周细胞单克隆株不具备潜在的致瘤性特征。
98.实施例10 流式细胞术测定永生化细胞单克隆细胞株分子标记物的表达
99.实验方法参考实施例2。
100.实验结果:流式细胞术实验结果如图9所示。结果显示,与人结直肠癌血管周细胞原代培养细胞一样,永生化细胞单克隆细胞株高表达fapα、ng2、pdgfrβ和cd146四个周细胞阳性分子标记物,但不表达cd31、myh11两个阴性分子标记物。可见,本发明构建的永生化细胞株保持表达与原代周细胞一致的分子标记物。
101.实施例11 免疫荧光法测定永生化细胞单克隆细胞株分子标记物的表达
102.实验方法参考实施例3。
103.实验结果:激光共聚焦显微镜结果如图10所示。结果显示,与人结直肠癌血管周细胞原代培养细胞一样,永生化细胞单克隆细胞株高表达fapα、ng2、pdgfrβ和cd146四个周细胞阳性分子标记物,但不表达cd31、myh11两个阴性分子标记物。可见,本发明构建的永生化细胞株保持表达与原代周细胞一致的分子标记物。
104.实施例12 透射电镜检测人永生化细胞单克隆细胞株的亚细胞特征
105.实验方法参考实施例4。
106.实验结果:透射电镜观测如图11所示。结果显示,与人结直肠癌血管周细胞原代培养细胞一样,永生化细胞单克隆细胞株具有核占比大,细胞器少的亚细胞结构特征。
107.实施例13 三维管腔粘附实验测定永生化细胞单克隆细胞株向内皮细胞管腔的趋向性
108.实验方法参考实施例5。
109.实验结果:三维管腔粘附实验结果如图12所示。结果表明,与人结直肠癌血管周细胞原代培养细胞一样,永生化细胞单克隆细胞株具有向人脐静脉内皮细胞管腔附着的趋向性。可见,本发明构建的永生化细胞株保留与原代周细胞同样的向内皮细胞管腔趋化的生物学特性。
110.上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。