1.本发明属于生物医药技术领域,具体涉及携载氧全氟丙烷及吲哚菁绿的纳米载药系统的制备方法。
背景技术:
2.类风湿关节炎(ra)是一种自身免疫机制诱发的常见慢性、系统性炎症性疾病,主要表现为对称性、进展性、侵袭性的多关节滑膜炎症,如果不经过及时正确的治疗,受累关节滑膜炎症会持久反复发作,导致关节软骨及软骨下骨质破坏,最终引起关节畸形、功能丧失,具有极高的致残率,对个人健康造成极大影响,明显增加经济和社会负担。
3.目前ra的治疗仍以早期开始接受改善病情抗风湿药(dmards)疗法、以减少或预防关节损伤及维持关节的完整性和功能为主要目标,其中甲氨蝶呤(mtx)作为一线治疗的首选药物,其在减轻症状和体征、减少致残以及延缓影像学结构破坏等方面优于其他dmards,在ra早期抑制滑膜增生、炎性反应和持续控制病情中发挥着举足轻重的作用,是目前治疗ra的经典一线药物。尽管mtx单独应用或与其抗风湿药物联合应用对多数ra患者疗效良好,但由于全身用药缺乏病变滑膜组织靶向性,药物在其他组织分布而导致严重的系统性不良反应;此外,大约30%左右的ra患者对mtx治疗缺乏有效反应,导致慢性、持续性关节炎。因此探索构建一种靶向作用病变关节滑膜的载mtx新型多功能给药系统,精准靶向“切除”病变滑膜、提高治疗效果、降低mtx系统不良反应,同时能对滑膜病变进行动态监测及实时疗效评估十分必要。
4.近年来,吲哚菁绿(icg)增强的荧光光学成像(foi)用于成像治疗方面已取得一定的成效,如cn202010306885.3公开了一种携载amd070和icg的多模态靶向纳米泡,公开了包括外壳,所述外壳外侧连接有amd070,所述外壳内包裹有吲哚菁绿和生物惰性气体的纳米泡结构,进一步公开生物惰性气体为全氟丙烷,多模态靶向纳米泡可穿过肿瘤血管壁进入肿瘤组织间隙,能够在肿瘤组织中实现精确成像和治疗,超声造影增强显像的原因是微泡内含有气体,较其周围生物介质易于压缩,其在超声场中具有较强的回波反射性能,能显著增强超声信号,且其含有的气体越多,增强信号能力越大,这也是吲哚菁绿在成像治疗中得到了非常实际的应用,但是由于针对的是肿瘤的特殊病变,而该临床运用要求的条件也非常苛刻,如由于肿瘤新生血管壁的间隙在380
‑
780nm之间,因此只允许粒径小于700nm的颗粒穿过肿瘤血管壁进入肿瘤组织间隙,而且靶向纳米泡还需要进入肿瘤组织间隙才能发挥作用,因此靶向纳米泡的粒径要求在400
‑
600nm,可见,虽然吲哚菁绿在成像治疗临床上得到了非常实际的应用,但是,需要考虑靶向性、穿透性、有效性等方面,是需要综合考量的,条件也非常苛刻,极大的限制了靶向成像治疗方面的应用。
5.ra关节炎症一直以来也是困扰人类的疾病之一,利用吲哚菁绿的强大优势,可以推断将其运用在类风湿的成像靶向治疗方面讲具有深远影响,目前该运用评估已在动物模型上得以验证,初步的临床结果也提示该成像方法可用于ra患者关节炎症的评估与临床评估,与核磁共振及超声成像结果有很好的一致性。因此基于吲哚菁绿的foi有望成为动态监
测ra关节炎症治疗效果的有效手段,对于实时调整治疗方案,实现个体化精准治疗目标有着极大的应用前景,但是目前也只是在动物模型上得到验证,因此研究开发一种能改善运用过程中的苛刻条件,提高负载成分活性,药剂学特性稳定的载药系统,在推动吲哚菁绿在ra关节病变的靶向成像治疗中的运用具有重要意义。
技术实现要素:
6.本发明针对现有技术的不足,提出了一种携载氧全氟丙烷及吲哚菁绿的纳米载药系统的制备方法。
7.具体是通过以下技术方案来实现的:
8.携载氧全氟丙烷及吲哚菁绿的纳米载药系统的制备方法,其特征在于,包括如下步骤:
9.s1:将plga溶于二氯甲烷中得到plga二氯甲烷溶液,将mtx溶于ph 7
‑
9的pbs缓冲液中得到mtx溶液,将icg、浓度为3
‑
8%的聚乙烯醇分别溶于超纯水中分别得到其超纯水溶液;
10.s2:用医用氧气向全氟丙烷中充氧1
‑
10min得到载氧全氟丙烷,取载氧全氟丙烷与s1步骤中所述icg超纯水溶液及mtx溶液用超声声振仪处理后得到乳浊液,再将其加入到plga二氯甲烷溶液中,充氧1
‑
10min后声振得到一级乳化液;将聚乙烯醇水溶液加入到一级乳化液中,声振得到二级乳化液;
11.s3:将s2所述二级乳化液搅拌2
‑
8h后高速离心,沉淀物用超纯水反复洗涤及高速离心两次,洗涤至上清液澄清后重悬于超纯水中,放4℃保存备用,将二级乳化液搅拌后再进行离心最大限度的使得二氯甲烷充分挥发
12.进一步,所述的plga与二氯甲烷的重量与体积配比按mg:ml计为80
‑
120:1
‑
8。
13.进一步,所述的icg与超纯水的重量与体积配比按mg:ml计为1
‑
5:0.5
‑
1.5。
14.进一步,所述的mtx与pbs的重量与体积配比按mg:ml计为10
‑
20:1
‑
5。
15.进一步,所述s2步骤中的超声声振仪处理,是将载氧全氟丙烷、icg超纯水溶液及mtx溶液按比例混合后采用超声声振仪进行间歇振动80
‑
100s,其中所述间歇振动,是振3
‑
8s,停3
‑
8s,以此反复。
16.进一步,所述s2步骤声振得到一级乳化液,是将乳浊液加入到plga二氯甲烷溶液充氧后,采用超声声振仪进行间歇振动2
‑
8min,其中所述间歇振动,是振3
‑
10s,停3
‑
10s,以此反复声振得到一级乳化液。
17.进一步,所述s2步骤声振得到二级乳化液,是将聚乙烯醇水溶液加入到一级乳化液中,采用超声声振仪进行间歇振动1
‑
5min,其中所述间歇振动,是振2
‑
10s,停2
‑
10s,以此反复声振得到二级乳化液。
18.进一步,所述s3中的高速离心,转速为10000
‑
15000rpm,时间为2
‑
10min。
19.进一步,s1至s3全过程在冰浴并且避光的环境下进行。
20.进一步,一种携载氧全氟丙烷及吲哚菁绿的纳米载药系统,在多模态荧光成像和超声成像病变检测下指导类风湿关节炎关节病变的诊疗一体化临床转化中的应用。
21.有益效果:
22.1)采用改良的双乳化法制备了载携氧全氟丙烷及吲哚菁绿和甲氨蝶呤的新型多
功能纳米粒,使用该方法制备的纳米粒负载活性成分明确、药剂学特性稳定、具有良好的类风湿关节炎受累关节靶向分布作用。
23.2)本发明得到的纳米粒包载的icg稳定性比游离型icg明显提高,提高了病变关节荧光光学成像和光动力作用。
24.3)本发明制备得到的载携氧全氟丙烷及吲哚菁绿和甲氨蝶呤的纳米粒呈现出良好的类风湿关节炎病变关节多模态荧光显像和超声成像、通过药理学作用及光动力作用而呈现改善病情抗风湿作用,有望实现荧光成像和超声成像导航下ra关节病变的诊疗一体化临床转化应用。
25.4)将icg与携氧的氟碳化合物(pfp)共同包载于纳米载药系统中,一方面增加了icg溶液稳定性、延长其血液循环时间,同时又为icg光声动力作用提供氧气同时发挥icg的荧光成像与光
‑
声动力学治疗双重作用,同时包载的携氧氟碳化合物具有超声造影剂作用。
26.5)受累关节的滑膜异常增生和局部缺氧在ra的发病机制中起重要作用,此外,ra成纤维样滑膜细胞(flss)的过度增殖会导致耗氧量增加和局部微环境缺氧,从而导致滑膜炎症、促炎细胞浸润、血管生成和软骨降解。以上过程相互促进,形成正反馈循环,共同推动ra的进展。因此,在治疗过程中有效改善局部缺氧微环境ra的治疗具有重要意义和临床价值。
27.6)载氧pfp在近红外激光刺激下引起液滴到气泡的转变,nps转化为微气泡,同时发挥光动力作用。当暴露于低强度聚焦声波时,微泡破裂并引起空化,同时释放氧气和icg并产生声动力学反应。
附图说明
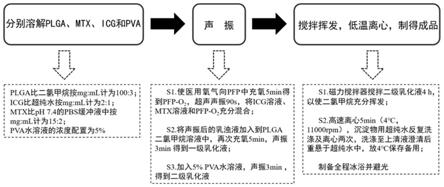
28.图1为载携氧全氟丙烷及吲哚菁绿和甲氨蝶呤多功能纳米粒制备方法示意图;
29.图2为载携氧全氟丙烷及吲哚菁绿和甲氨蝶呤多功能纳米粒的结构示意图与表征;
30.图3为载携氧全氟丙烷及吲哚菁绿和甲氨蝶呤多功能纳米粒包封率及载药量检测;
31.图4为载携氧全氟丙烷及吲哚菁绿和甲氨蝶呤多功能纳米粒光学特性检测;
32.图5为载携氧全氟丙烷及吲哚菁绿和甲氨蝶呤多功能纳米粒体外超声成像图;
33.图6为载携氧全氟丙烷及吲哚菁绿和甲氨蝶呤多功能纳米粒体外光声成像图;
34.图7为正常大鼠与cia大鼠载携氧全氟丙烷及吲哚菁绿和甲氨蝶呤多功能纳米粒的体内靶向分布荧光成像实验;
35.图8为正常大鼠与cia大鼠载携氧全氟丙烷及吲哚菁绿和甲氨蝶呤多功能纳米粒的体内超声成像实验;
36.图9为正常大鼠与cia大鼠载携氧全氟丙烷及吲哚菁绿和甲氨蝶呤多功能纳米粒的体内光声成像实验;
具体实施方式
37.下面对本发明的具体实施方式作进一步详细的说明,但本发明并不局限于这些实施方式,任何在本实施例基本精神上的改进或代替,仍属于本发明权利要求所要求保护的
范围。
38.本技术携载氧全氟丙烷及吲哚菁绿的载药纳米粒(oim@nps)的总体步骤参见图1所示的制备流程示意图
39.实施例1
40.s1:将80mgplga溶于1ml二氯甲烷,1mgicg溶于0.5ml超纯水,10mgmtx溶于100μl的ph 7的pbs缓冲液中,将聚乙烯醇加入超纯水使终浓度为3%备用;
41.s2:用医用氧气对装有1ml全氟丙烷的密闭装置中缓慢充氧1min,制备pfp
‑
o2,取出200μl的pfp
‑
o2与s1制备得到的icg溶液及mtx溶液用超声声振仪充分混合80s(振3s,停3s);将声振后的乳浊液加入到plga二氯甲烷溶液中,再次充氧1min,声振2min(振3s,停3s),得到一级乳化液;将5%pva水溶液加入到一级乳化液中,声振1min(振2s,停2s),得到二级乳化液;
42.s3:使用磁力搅拌器对s2所得产物搅拌,2h,以使二氯甲烷充分挥发,高速离心2min(4℃,10000rpm),沉淀物用超纯水反复洗涤及离心两次,洗涤至上清液澄清后重悬于超纯水中,4℃保存备用。制备全程冰浴并避光。
43.实施例2
44.s1:将120mgplga溶于8ml二氯甲烷,5mgicg溶于1.5ml超纯水,50mgmtx溶于500μl的ph 9的pbs缓冲液中,将聚乙烯醇加入超纯水使终浓度为8%备用;
45.s2:用医用氧气对装有1ml全氟丙烷的密闭装置中缓慢充氧10min,制备pfp
‑
o2,取出200μl的pfp
‑
o2与s1制备得到的icg溶液及mtx溶液用超声声振仪充分混合100s(振8s,停8s);将声振后的乳浊液加入到plga二氯甲烷溶液中,再次充氧10min,声振8min(振10s,停10s),得到一级乳化液;将5%pva水溶液加入到一级乳化液中,声振5min(振10s,停10s),得到二级乳化液;
46.s3:使用磁力搅拌器对s2所得产物搅拌8h,以使二氯甲烷充分挥发,高速离心10min(4℃,15000rpm),沉淀物用超纯水反复洗涤及离心两次,洗涤至上清液澄清后重悬于超纯水中,4℃保存备用。制备全程冰浴并避光。
47.实施例3
48.s1:将50mgplga溶于1.5ml二氯甲烷,2mgicg溶于1ml超纯水,3mgmtx溶于400μl的ph 7.4的pbs缓冲液中,将聚乙烯醇加入超纯水使终浓度为5%备用;
49.s2:用医用氧气对装有1ml全氟丙烷的密闭装置中缓慢充氧5min,制备pfp
‑
o2,取出200μl的pfp
‑
o2与s1制备得到的icg溶液及mtx溶液用超声声振仪充分混合90s(振5s,停5s);将声振后的乳浊液加入到plga二氯甲烷溶液中,再次充氧5min,声振3min(振5s,停5s),得到一级乳化液;将5%pva水溶液加入到一级乳化液中,声振3min(振5s,停5s),得到二级乳化液;
50.s3:使用磁力搅拌器对s2所得产物搅拌4h,以使二氯甲烷充分挥发。高速离心5min(4℃,11000rpm),沉淀物用超纯水反复洗涤及离心两次,洗涤至上清液澄清后重悬于超纯水中,4℃保存备用。制备全程冰浴并避光。
51.以实施例3为例,将本实施例所制得的载携氧全氟丙烷及吲哚菁绿的载药纳米粒(oim@nps)进行检测分析,结果如下:
52.①
载携氧全氟丙烷及吲哚菁绿和甲氨蝶呤多功能纳米粒(oim@nps)的药剂学特性
表征
53.具体操作为:1)将oim@nps用超纯水稀释一定倍数后,使用倒置荧光显微镜观察其形态及大小;2)将oim@nps用超纯水稀释一定倍数后,采用透射电镜观察其细微形态;3)利用malvern粒径仪检测其粒径大小、分布及电位。
54.结果如图2所示:1)oim@nps在常温下为绿色乳状液体,如图2.a所示;2)在倒置荧光显微镜下,oim@nps呈球形,分散性良好、均匀一致,并呈现出红色荧光,说明icg成功包载在纳米粒中,如图2.d和2.e所示;3)在透射电镜下观察到oim@nps表面光滑呈球形,为单个分散纳米粒,呈明显的壳核结构,如图2.b和2.c所示;4)oim@nps的粒径为231.70
±
16.54nm,电位为
‑
6.00
±
1.84mv,如图2.f和2.g所示。
55.②
载携氧全氟丙烷及吲哚菁绿和甲氨蝶呤多功能纳米粒(oim@nps)包封率及载药量检测
56.具体操作为:1)称取icg溶于超纯水中,精确稀释至不同浓度,用uv
‑
vis分光光度计检测各浓度的吸光度值,绘制icg水溶液的标准曲线;2)称取mtx溶于ph 7.4的pbs缓冲液中,精确稀释至不同浓度,用高效液相色谱仪检测各浓度的曲线下峰面积,绘制mtx溶液的标准曲线;3)在纳米粒制备过程中,收集所有离心过程的上清液,采用间接测定法测定icg及mtx的含量,即分别用uv
‑
vis分光光度计和高效液相色谱仪检测上清液中吸光度值和曲线下峰面积,然后通过所制备的标准曲线计算出其包封率及载药量。
57.按下式计算包封率及载药量:
58.包封率(%)=(所用icg总量
‑
上清液中icg量)/所有icg总量
×
100%;载药量=(所用icg总量
‑
上清液中icg量)/nps的总量
×
100%。
59.mtx的包封率及载药量同理。
60.结果如图3所示,结果表明:icg的包封率和载药量分别为65.291
±
1.442%和2.374
±
0.053%;mtx的包封率和载药量分别为42.179
±
5.275%和2.301
±
0.288%。
61.③
载携氧全氟丙烷及吲哚菁绿和甲氨蝶呤多功能纳米粒(oim@nps)的光学特性检测
62.具体操作为:1)将制备好的oim@nps及游离icg均用超纯水稀释至一定浓度,分别检测二者在600
‑
900nm范围内的吸收光谱图;2)将制备好的oim@nps及游离icg均用超纯水稀释至一定浓度,在4℃情况下保存,每3d测定一次二者在780nm的吸光度,连续测定15天。
63.结果如图4所示,结果表明:游离icg的降解速度比oim@nps快。经过15天的观察,oim@nps吸收强度降低约18%,而游离icg降低约60%。说明oim@nps有效提高了icg的稳定性。
64.④
载携氧全氟丙烷及吲哚菁绿和甲氨蝶呤多功能纳米粒(oim@nps)的体外超声成像
65.将载icg及mtx纳米粒制备成体外成像凝胶模型,具体操作为:在400ml超纯水中加入8g琼脂糖凝胶粉,加热搅拌使其完全溶解以及气泡完全排出,趁热缓慢倒入200μl枪头盒中,并在其中插入枪头,待凝胶冷却凝固后得到凝胶模型;实验分为三组:pbs组、游离icg组、oim@nps组,将实验样品分别加入凝胶孔洞中,使用超声诊断成像仪进行b
‑
mode和ceus成像。然后,经1.5w/cm2的808nm激光辐照1分钟后,再次进行成像。获取成像图片,并用dyf软件分析其平均声强。
66.结果如图5所示,结果表明:经近红外激光辐照后,oim@nps组有明显的增强。说明近红外照射激发了oim@nps内的icg,使得pfp内核相变产生气体,超声成像增强。
67.⑤
载携氧全氟丙烷及吲哚菁绿和甲氨蝶呤多功能纳米粒(oim@nps)的体外光声成像图
68.将载icg及mtx纳米粒制备成体外成像凝胶模型,具体操作为:在400ml超纯水中加入8g琼脂糖凝胶粉,加热搅拌使其完全溶解以及气泡完全排出,趁热缓慢倒入200μl枪头盒中,并在其中插入枪头,待凝胶冷却凝固后得到凝胶模型;实验分为三组:pbs组、游离icg组、oim@nps组,将实验样品分别加入凝胶孔洞中,使用vevo lazr光声成像系统采集光声成像图。然后,经1.5w/cm2的808nm激光辐照1分钟后,再次进行成像,并进行结果分析。
69.结果如图6所示,结果表明:pbs和oim@nps组的光声成像没有显着差异,它们在ni范围内没有吸收峰,故没有光声成像的能力。照射后oim@nps组的光声强度显著增加。同时,oim@nps的光声强度高于游离icg。这说明,作为光声成像的介导,oim@nps在光声成像中表现出比游离icg更稳定的成像效果。
70.⑥
载携氧全氟丙烷及吲哚菁绿和甲氨蝶呤多功能纳米粒(oim@nps)在正常大鼠和cia模型大鼠体内关节靶向分布荧光成像实验
71.具体操作为:取正常大鼠及cia模型大鼠各三只,尾静脉注射oim@nps(以mtx载药量计,3mg/kg),于注射后2h、6h和24h在小动物活体荧光成像系统中观察纳米粒在老鼠体内关节分布情况并采集图像,最后进行荧光强度分析。
72.结果如图7所示:从小动物活体荧光成像结果中,oim@nps在注射后2h、6h和24h,cia大鼠关节部位的荧光信号均强于正常大鼠,且在2h时达最高值,荧光强度定量分析结果进一步证实oim@nps注射后cia大鼠关节部位荧光强度明显高于正常大鼠,表明oim@nps对类风湿关节炎病变关节部位具有显著的靶向分布性。
73.⑦
载携氧全氟丙烷及吲哚菁绿和甲氨蝶呤多功能纳米粒(oim@nps)在正常大鼠和cia模型大鼠体内超声成像实验
74.具体操作:正常sd大鼠随机分为3组:生理盐水组(即ns组)、icg组、oim@nps组;cia大鼠随机分为3组:生理盐水组(即ns组)、icg组、oim@nps组。每组大鼠注射oim@nps 2h后,接受激光(1.5w/cm2 5min)
‑
低强度聚焦超声(3w/cm2 1min)激发。分别在激发前(即0h),激发后2h、6h和24h用超声诊断成像仪在b
‑
mode以及ceus模式下观察关节并采集图像,最后将采集的图像用dfy超声定量分析软件做数据处理。
75.结果如图8所示:图8.a、8.c和8.e分别对应正常大鼠的生理盐水(ns)组、游离icg组和oim@nps组,图8.b、8.d和8.f分别对应cia大鼠的ns组、游离icg组和oim@nps组;在注射相应的药物(ns、icg、oim@nps)后激光
‑
低强度聚焦超声激发前(即0h),b
‑
mode以及ceus模式下关节区域的超声信号在6组之间无明显差异。经激光
‑
低强度聚焦超声激发后,在ceus模式下可明显观察到oim@nps组关节部位增强的回声信号,尤其在cia大鼠中,而ns组和icg组均没有增强回声信号。在b
‑
mode模式下也可明显观察到oim
‑
nps组成像增强,cia大鼠成像强度大于正常大鼠。oim
‑
nps组超声成像强度具体结果为:ceus模式下,cia大鼠中ei为11.22
±
1.39(0h)、60.05
±
2.73(2h)、32.14
±
3.68(6h)、3.03
±
2.93(24h),正常大鼠中ceus模式下ei为6.37
±
2.73(0h)、20.63
±
1.05(2h)、9.10
±
3.97(6h)、2.12
±
0.53(24h)。b
‑
mode模式下,cia大鼠中ei为74.30
±
0.53(0h)、93.10
±
2.63(2h)、80.67
±
1.89(6h)、
54.89
±
1.89(24h),正常大鼠中ei为57.02
±
1.39(0h)、72.78
±
1.82(2h)、62.48
±
0.53(6h)、51.56
±
0.53(24h)。
76.⑧
载携氧全氟丙烷及吲哚菁绿和甲氨蝶呤多功能纳米粒(oim@nps)在正常大鼠和cia模型大鼠体内光声成像实验
77.具体操作:正常sd大鼠随机分为3组:生理盐水组(即ns组)、icg组、oim@nps组;cia大鼠随机分为3组:生理盐水组(即ns组)、icg组、oim@nps组。每组大鼠注射oim@nps 2h后,接受激光(1.5w/cm2 5min)
‑
低强度聚焦超声(3w/cm2 1min)激发。分别在激发前(即0h),激发后2h、6h和24h用vevo lazr光声成像系统采集光声成像图,并用光声仪自带软件进行数据分析。
78.结果如图9所示:图9.a、9.c和9.e分别对应正常大鼠的生理盐水(ns)组、游离icg组和oim@nps组,图9.b、9.d和9.f分别对应cia大鼠的ns组、游离icg组和oim@nps组;在光声成像中,ns组和icg组在激光
‑
低强度聚焦超声激发前后均没有明显成像作用,而oim@nps组进行激光
‑
低强度聚焦超声激发前后都有较好成像效果,cia大鼠中pa强度为0.13
±
0.00(0h)、0.31
±
0.03(2h)、0.23
±
0.02(6h)、0.11
±
0.01(24h),正常大鼠中pa强度为0.14
±
0.01(0h)、0.24
±
0.02(2h)、0.19
±
0.02(6h)、0.10
±
0.02(24h)。
79.上述成像实验结果表明oim@nps在体内具有较长循环时间,能更好的在关节部位聚集分布。另一方面,在注射oim
‑
nps后经激光
‑
低强度聚焦超声激发后2h能有较好的pa成像效果,体现出对后期体内治疗的导航作用。
80.综上所述,本发明制备得到了活性成分明确、载药量高、药剂学特性良好的载携氧全氟丙烷及吲哚菁绿和甲氨蝶呤多功能纳米粒,该产品在体外超声成像和光声成像中表现出比游离icg更稳定和优良的成像效果,有望实现荧光成像和超声成像导航下类风湿关节病变的精准治疗。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。