1.本发明涉及中药领域,具体涉及一种四妙勇安汤制备工艺及其质控方法。
背景技术:
2.随着《药品注册管理办法》和《古代经典名方中药复方制剂简化注册审批管理规定》的发布,传统的中药新药研发模式正逐渐回归理性,而在《古代经典名方中药复方制剂简化注册审批管理规定》中提到,中药经典名方可以不再做临床研究而直接申报生产,恰好给医药行业指出了一条创新中药研究开发的途径。
3.在众多的中药经典名方中,四妙勇安汤方由金银花、玄参,当归,甘草4味药物组成,是治疗热毒性脱疽的著名古方。方中重用金银花、玄参为君清热解毒,两药合用,既清气分邪热,又解血分热毒,况玄参尚有养阴散结之效;臣以当归之温润,活血祛瘀,流通血脉,补养阴血以濡四末。甘草生用,一则助金银花泻火解毒,二则合当归、玄参养阴生津,三则调和诸药,为佐使。药虽四味,量大力专四药合用,共奏清热解毒,活血止痛之功。
4.由于处方药材合煎时的高温以及溶液中复杂的化学环境,可能在溶液中发生固有物质间的络合、水解、氧化、还原等反应,从而生成溶液中原来没有的某些新物质,这些新物质对全方会产生增效、减毒或改性等药效作用。为了保持成分和药效的一致性,国家药监局发布的《古代经典名方中药复方制剂物质基准的申报材料要求(征求意见稿)》中规定,经典名方物质基准是指以古代医籍中记载的古代经典名方制备方法为依据制备而得的中药药用物质的标准,除成型工艺外,其余制备方法应当与古代医籍记载基本一致。
5.正如现有中国文献cn102920838a中记载的四妙勇安汤干膏粉以及用该干膏粉制备口服制剂的制备方法中,由于其产物采用原方剂水煎液进行浓缩和干燥制备得到,因此该方式能够最大限度的保留与传统汤剂临床应用的一致性。但实际上,即使前期采用原方剂水煎液,在后续成型工艺中,浓缩和干燥步骤中的工艺参数的变化也会极大地影响浓缩和干燥物质的成分组成,进而使制备得到的中药中间体或成品与临床汤剂中所含的物质基础并不一致,因此,存在成型工艺处理获得的中药物质基础或复方制剂无法与标准汤剂具有临床疗效一致性的问题。
技术实现要素:
6.因此,本发明要解决的技术问题在于克服现有技术中采用的应用于四妙勇安汤的后续成型工艺会导致所得产物中所含的物质基础与标准汤剂不同,进而使两者的临床疗效可能不一致的缺陷;从而提供一种工艺质控方法,其能够以标准汤剂的物质基准为参考标准,更加简便且准确的判断出相应工艺制备得到的产物与标准汤剂之间的物质基础的一致性,通过该物质基础的一致性可以筛选出与标准汤剂的物质基础最为接近的工艺参数作为优选工艺。
7.一种四妙勇安汤制备工艺的质控方法,包括:
8.获得标准汤剂和供试品;采用四妙勇安汤的水煎液作为标准汤剂,采用四妙勇安
汤的物质基准实物或复方制剂作为供试品;至少获得供试品的特征图谱或指纹图谱的关键质量属性相似系数s
cqa
,通过该s
cqa
值筛选出数量最多的值更接近数值1的特征图谱或指纹图谱所对应的工艺参数即可;
9.特征图谱或指纹图谱的s
cqa
的获取规则为:将标准汤剂和供试品进行特征图谱或指纹图谱检测,设标准汤剂中的其中一个特征峰作为s峰,根据特征图谱或指纹图谱显示的各个特征峰相对于s峰的相对峰面积的比值计算s
cqa
值,其中,s
cqa
值=供试品中各特征峰对应s峰的相对峰面积/标准汤剂中各特征峰对应s峰的相对峰面积。
10.具体的,特征图谱或指纹图谱的s
cqa
值的数量与特征图谱或指纹图谱中特征峰的数量相同,一个特征峰对应一个s
cqa
值。其中,特征图谱或指纹图谱的s
cqa
中,特征峰1的s
cqa
值=供试品中特征峰1对应s峰的相对峰面积/标准汤剂中特征峰1对应s峰的相对峰面积。
11.本发明中数量最多的更接近数值1的s
cqa
值是指:在0.70~1.30范围内数量最多的s
cqa
值,或者,当在0.70~1.30范围内的数量相同时,在0.90~1.10范围内数量最多的s
cqa
值。物质基准实物是指生产过程中获得的中间物,如:提取液、浓缩液、浸膏、干燥粉剂等中间制剂,该复方制剂是指含有辅料的颗粒剂、粉剂等成品制剂。
12.所述特征图谱或指纹图谱的检测方法为高效液相色图谱法,该高效液相色谱法的色谱条件如下:
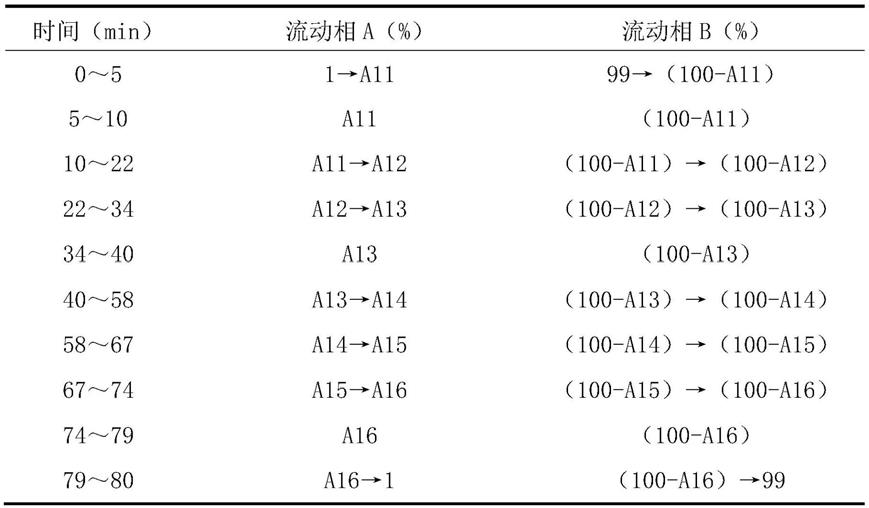
13.色谱柱:以十八烷基硅烷键合硅胶为填充剂的色谱柱;检测波长:230nm~254nm;以乙腈为流动相a,以0.08%~0.12%体积浓度的磷酸溶液为流动相b,按以下梯度洗脱程序进行梯度洗脱:
[0014][0015]
梯度洗脱程序中,a11为6%
×
(100%
±
5%)、a12为9%
×
(100%
±
5%),a13为15%
×
(100%
±
5%),a14为27%
×
(100%
±
5%),a15为42%
×
(100%
±
5%),a16为70%
×
(100%
±
5%),且a11<a12<a13<a14<a15<a16。
[0016]
在特征图谱或指纹图谱的检测方法中,所述色谱柱的柱长为150mm,内径为2.1mm,粒度为1.6~1.9μm,柱温为25℃~30℃;进样量为2μl~5μl;流速为0.25ml/min~0.35ml/min。
[0017]
采用标准汤剂进行处理后获得标准溶液,采用供试品进行处理后获得供试品溶液,采用标准溶液和供试品溶液进行特征图谱或指纹图谱检测;
[0018]
所述标准溶液的获取过程为:取随行标准汤剂适量,摇匀,滤过,取续滤液,即得;
[0019]
所述供试品溶液的获取过程为:取供试品0.3g~0.5g,加入体积浓度为30%~55%醇溶液15ml~25ml,称定重量,超声处理,放冷后再称定重量,用30%~55%醇溶液补足减失的重量,摇匀,滤过,取续滤液,即得。
[0020]
所述特征图谱或指纹图谱检测时,还包括对照品溶液的检测,所述对照品溶液采用对照品制备获得;
[0021]
所述对照品为四妙勇安汤中已知的活性成分,已知的活性成分至少包括挥发性有效成分中的一种;优选的,所述对照品至少包括藁本内酯;更为优选的,所述对照品为绿原酸、新绿原酸、隐绿原酸、阿魏酸、安格洛苷c、肉桂酸、哈巴俄苷、藁本内酯;
[0022]
所述标准溶液中的特征峰包括对照品溶液所对应的峰;
[0023]
优选的,更接近数值1的值是指在0.70~1.30范围内的值。
[0024]
所述对照品溶液制备过程为取新绿原酸、绿原酸、隐绿原酸、阿魏酸、安格洛苷c、肉桂酸、哈巴俄苷、藁本内酯对照品适量,精密称定,加45%甲醇制成每1ml分别含新绿原酸22μg、绿原酸166μg、隐绿原酸41μg、阿魏酸9μg、安格洛苷c22μg、肉桂酸4μg、哈巴俄苷12μg、藁本内酯15μg的溶液,即得。
[0025]
所述标准汤剂的特征图谱或指纹图谱中具有不低于30个的特征峰,该特征峰中包括四妙勇安汤中已知的活性成分所对应的峰;
[0026]
获取特征图谱或指纹图谱中所有特征峰相对于s峰的相对保留时间,设标准汤剂的特征图谱或指纹图谱中所有特征峰的相对保留时间为规定值,则供试品的特征图谱或指纹图谱中各个特征峰的相对保留时间在规定值的
±
10%之内;且至少有80%以上数量的特征峰的s
cqa
值在0.70~1.30范围内。
[0027]
所述标准汤剂的特征图谱或指纹图谱中具有30个特征峰,所述s
cqa
值至少有24个在0.70~1.30范围内;
[0028]
规定值中,峰1为0.126、峰2为0.160、峰3为0.194、峰4为0.251、峰5为0.269、峰6为0.292、峰7为0.297、峰8为0.315、峰9为0.323、峰10为0.334、峰11为0.348、峰12为0.407、峰13为0.485、峰14为0.514、峰15为0.577、峰16为0.596、峰17为0.623、峰18为0.676、峰19为0.702、峰20为0.718、峰21为0.739、峰22为0.760、峰23为0.769、峰24为0.781、峰25为0.879、峰26为0.941、峰27为0.979、峰28为1.000、峰29为1.016、峰30为1.073。
[0029]
所述标准汤剂的指纹图谱直接采用与物质基准实物或复方制剂相同批次的原料制备后检测获得;或者,采用至少15批次的中药原料制备得到的标准汤剂进行检测,进而获得至少15批次标准汤剂的特征图谱或指纹图谱,最后通过对至少15批次的标准汤剂的指纹图谱的相对峰面积进行均值计算而获得。
[0030]
所述供试品的关键质量属性相似系数s
cqa
还包括出膏率的s
cqa
、有效指标成分含量的s
cqa
或有效指标成分转移率的s
cqa
中的至少一种;
[0031]
其中,
[0032]
出膏率的s
cqa
值=物质基准实物的出膏率/标准汤剂的出膏率;
[0033]
有效指标成分含量的s
cqa
值=物质基准实物的有效指标成分含量/标准汤剂的有
效指标成分含量;
[0034]
有效指标成分转移率的s
cqa
值=物质基准实物的有效指标成分转移率/标准汤剂的有效指标成分转移率;
[0035]
质量控制时,选择s
cqa
值越接近与1的工艺参数作为此步工艺的最优工艺参数即可。
[0036]
一种四妙勇安汤的物质基准实物或复方制剂的制备工艺,包括:提取液直接采用冷冻干燥的方式制备;或者,先将挥发性成分收集后,再进行浓缩或/和干燥步骤,最后将收集的挥发性成分添加到浓缩或/和干燥后获得的物质中即可。
[0037]
本发明技术方案,具有如下优点:
[0038]
1.本发明提供的了一种新的质量控制的指标s
cqa
值,尤其是指纹图谱或特征图谱的s
cqa
,通过该s
cqa
值可以有效质控出不同生产工艺步骤制备得到所含的物质基础是否与标准汤剂一致,因而可以筛选出与标准汤剂的物质基础一致的物质基准实物或复方制剂的最佳制备工艺;同时,通过s
cqa
值比较每步工艺所得中间体与标准汤剂的相似性,当其值越接近数值1,表明所得中间体的关键质量属性指标与标准汤剂越一致,在工艺过程中造成的物质变化越小;因此,通过该质控方法可以有效促使经方制剂四妙勇安汤的物质基准实物或复方制剂与传统的标准汤剂之间物质基础的差异减少,进一步避免经方制剂四妙勇安汤的临床疗效与传统汤剂存在较大差异,保证临床疗效的一致性;
[0039]
同时,通过该s
cqa
值的设置,可以更加简便、高效的选择出与传统的标准汤剂的物质基础最为接近的物质基准实物或复方制剂所对应的工艺作为优选工艺,提供更加简便有效且更加准确的用于工艺筛选的工艺的质控方法,有效缩短分析时间,节约成本。
[0040]
2.本发明提供的质量控制方法中的s
cqa
值,其不仅仅能够用于筛选出与传统的标准汤剂更为一致的物质基础最为接近的物质基准实物或复方制剂所对应的工艺,并且还能够有效监控物质基准实物或复方制剂的质量优劣,保证批与批之间成品质量的稳定性,从而最大程度保证所制备四妙勇安汤物质基准实物及复方制剂及复方制剂的安全性与有效性。
[0041]
3.本发明提供了四妙勇安汤的物质基准实物或复方制剂的制备工艺,具体限制了无浓缩阶段和干燥阶段采用冷冻干燥的工艺条件,该工艺条件下,能够完全满足本发明的质控要求,使制备得到的四妙勇安汤的物质基准实物或复方制剂与传统汤剂之间的物质基础保持一致,进而保证疗效。
附图说明
[0042]
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0043]
图1是本发明中标准汤剂的指纹图谱。
具体实施方式
[0044]
实施例1
[0045]
一种四妙勇安汤制备工艺的质控方法,本实施例进行了浓缩步骤对四妙勇安汤中物质基础的影响的考察,具体考察过程如下:
[0046]
标准汤剂的获取:按四妙勇安汤处方药量称取金银花、玄参、当归、甘草(3:3:2:1),一煎加14倍水,煎煮前浸泡30min,加盖煎煮,武火(500w)沸腾后,改文火(300w)煎煮30min,保持微沸,趁热过滤,药渣加水12倍进行二次煎煮,武火沸腾后,改文火煎煮20min,合并两次煎煮药液,定容至7000ml,即得标准汤剂。
[0047]
浓缩液的获取:取标准汤剂3000ml进行减压浓缩,浓缩温度为60℃,浓缩至相对密度1.05,作为浓缩液。
[0048]
本实施例中的四妙勇安汤的标准汤剂的指纹图谱可以直接采用与四妙勇安汤物质基准实物或四妙勇安汤制剂相同批次的原料制备后检测获得,也可以采用多批次的中药原料制备得到的多批次标准汤剂进行检测,进而获得的多批次标准汤剂的特征图谱或指纹图谱,最后通过对多批次标准汤剂的指纹图谱进行均值计算而获得。本实施例中采用与四妙勇安汤物质基准实物或四妙勇安汤制剂相同批次的原料制备后检测获得。
[0049]
本实施例中取该浓缩液作为供试品,与对照品溶液和标准汤剂同时进行高效液相指纹图谱检测,检测过程如下:
[0050]
采用以十八烷基硅烷键合硅胶为填充剂的色谱柱,色谱柱柱长为150mm,内径为2.1mm,粒度为1.8μm,以乙腈为流动相a,以0.10%体积浓度磷酸溶液为流动相b;进样量为3μl;柱温为28℃;流速为每分钟0.3ml;检测波长:237nm。按下表1中的规定进行梯度洗脱:
[0051]
表1
[0052][0053][0054]
供试品溶液的制备方法:精密量取浓缩液0.5g,置25ml量瓶中,加体积浓度为45%的甲醇溶液至刻度,称定重量,超声处理,放冷后再称定重量,加体积浓度为45%的甲醇溶液补足减失的重量,摇匀,滤过,取续滤液,即得。
[0055]
采用四妙勇安汤中已知的活性成分作为指标性成分,即在对照品溶液中包括四妙勇安汤中已知的活性成分。该已知的活性成分至少包括挥发性有效成分中的一种,例如藁本内酯;或者,该已知的活性成分至少包括绿原酸、新绿原酸、隐绿原酸、阿魏酸、安格洛苷
c、哈巴俄苷、肉桂酸、藁本内酯。采用上述已知的活性成制备混合标准品,具体如下:
[0056]
取新绿原酸、绿原酸、隐绿原酸、阿魏酸、安格洛苷c、肉桂酸、哈巴俄苷、藁本内酯对照品适量,精密称定,加45%甲醇制成每1ml分别含新绿原酸22μg、绿原酸166μg、隐绿原酸41μg、阿魏酸9μg、安格洛苷c 22μg、肉桂酸4μg、哈巴俄苷12μg、藁本内酯15μg的溶液,即得。
[0057]
标准煎液的制备:取标准汤剂适量,摇匀,滤过,取续滤液,即得标准溶液。
[0058]
采用上述对照品溶液、供试品溶液以及标准溶液进行上机检测,通过上述检测和计算后获得的结果如表2
‑
3、图1所示。其中,图1为标准溶液获得的指纹图谱。表2为浓缩液的特征峰s
cqa
,表3为标准汤剂和浓缩液的指标成分的含量。
[0059]
表2浓缩液的特征峰s
cqa
[0060]
峰编号12345678s
cqa
0.9720.9781.0011.0450.9931.1150.9950.992峰编号910111213141516s
cqa
1.0000.9680.9910.9931.0551.0141.0311.025峰编号1718192021222324s
cqa
0.9801.0121.1141.2701.0001.3660.9711.003峰编号252627282930
ꢀꢀ
s
cqa
1.0071.0861.0171.0001.185丢失
ꢀꢀ
[0061]
表3标准汤剂和浓缩液的指标成分的含量
[0062][0063]
本实施例的质控要求为:
[0064]
控制供试品的特征图谱或指纹图谱中具有如图1所示的30个特征峰,且该30个特征峰相对于s峰所对应的特征峰的相对保留时间应当在以下范围内:
[0065]
峰1为0.126
±
0.013、峰2为0.160
±
0.016、峰3为0.194
±
0.019、峰4为0.251
±
0.025、峰5为0.269
±
0.027、峰6为0.292
±
0.029、峰7为0.297
±
0.030、峰8为0.315
±
0.031、峰9为0.323
±
0.032、峰10为0.334
±
0.033、峰11为0.348
±
0.035、峰12为0.407
±
0.041、峰13为0.485
±
0.048、峰14为0.514
±
0.051、峰15为0.577
±
0.058、峰16为0.596
±
0.060、峰17为0.623
±
0.062、峰18为0.676
±
0.068、峰19为0.702
±
0.070、峰20为0.718
±
0.072、峰21为0.739
±
0.074、峰22为0.760
±
0.076、峰23为0.769
±
0.077、峰24为0.781
±
0.078、峰25为0.879
±
0.088、峰26为0.941
±
0.094、峰27为0.979
±
0.098、峰28为1.000、峰29为1.016
±
0.102、峰30为1.073
±
0.107。
[0066]
通过上述表2和表3的检测结果结合质控要求可知:浓缩液s
cqa
值在0.70~1.30范围内的色谱峰有28个,0.90~1.10范围内的色谱峰有24个,一个色谱峰丢失。
[0067]
采用上述质控方法可以确定:上述浓缩的步骤获得的物质基准实物不能满足质控要求。因此,可以将提取液直接使用,不进行直接浓缩,如需浓缩,则需在浓缩前采用适宜的方法将挥发性成分提取后再进行浓缩,以减少会发性成分的损失。
[0068]
实施例2
[0069]
一种四妙勇安汤制备工艺的质控方法,本实施例进行了干燥步骤对四妙勇安汤中物质基础的影响的考察,具体考察过程如下:
[0070]
干燥粉的获取:取标准汤剂分别进行喷雾干燥及真空冷冻干燥得四妙勇安汤的干燥粉;
[0071]
供试品溶液的制备方法:精密量取干燥粉0.5g,置25ml量瓶中,加体积浓度为45%的甲醇溶液至刻度,称定重量,超声处理,放冷后再称定重量,加体积浓度为45%的甲醇溶液补足减失的重量,摇匀,滤过,取续滤液,即得。
[0072]
采用上述供试品溶液进行上机检测,检测方法和检测参数与实施例1相同,通过上述检测和计算后获得的结果如表4
‑
5所示。其中,表4为两种不同干燥方式获得的干燥粉的特征峰s
cqa
,表5为两种不同干燥方式获得的干燥粉的指标成分的含量(换算成相同量的标准汤剂下制备得到的干燥粉下指标成分的含量)以及指标成分的s
cqa
;所述指标成分含量的s
cqa
=干燥粉中指标性成分的含量/标准汤剂中指标性成分的含量。
[0073]
表4
[0074][0075]
表5
[0076][0077][0078]
通过上述检测结果可知:根据指标成分含量结果的s
cqa
值发现,喷雾干燥方式下藁本内酯成分的s
cqa
值为0.07,而冷冻干燥方式下该成分的s
cqa
值为1.05,说明标准溶液采用喷雾干燥会造成指标成分藁本内酯大量损失,其他成分差异较小,所以四妙勇安汤标准溶液直接干燥时采用冷冻干燥方式为佳。
[0079]
通过上述不同冻干样液体积的特征图谱与四妙勇安汤标准汤剂特征图谱的s
cqa
值比较发现:喷雾干燥的方式中s
cqa
值在0.70~1.30范围内的色谱峰有5个,冷冻干燥的方式中s
cqa
值在0.70~1.30范围内的色谱峰有30个,且喷雾干燥的方式导致挥发性成分藁本内酯含量极低,喷雾干燥的方式不满足质控需求。因此,通过本发明的质控方法可以确定,满足质控要求的为提取液直接用于冷冻干燥。该制备方法可以使物质基准实物中保留更多挥发性成分。本发明还可以采用上述质控方法,有效对干燥工艺参数进行考察,获取最佳的工
艺参数条件。
[0080]
通过上述实施例1和实施例2的检测可知,本发明不仅仅可以通过s
cqa
数据对四妙勇安汤物质基准实物或复方制剂进行质量检测,还能通过s
cqa
数据筛选出四妙勇安汤物质基准实物或复方制剂的工艺条件,排除检测结果不好的四妙勇安汤物质基准实物或复方制剂的制备工艺,实现四妙勇安汤的制备工艺的质量控制。例如:通过实施例1中浓缩步骤会影响成分组成,则可以根据该检测结果,采用提取液直接冷冻干燥的方式,保证与标准汤剂的物质基础一致;或者,也可以先计算出标准汤剂中挥发油的得率,生产时可先行提取挥发油,然后按相同品种标准汤剂中挥发油含量成比例重新加入的方式。
[0081]
实施例3
[0082]
本实施例提供了对不同制备工艺条件下制备得到的四妙勇安汤物质基准实物进行检测,包括实例1~实例7,并根据检测结果有效实现四妙勇安汤制备工艺的控制,进而筛选出最佳的制备工艺条件。
[0083]
其中,检测的方法与实施例1中记载的方法相同,均是采用高效液相指纹图谱检测方法进行检测,检测条件与实施例1也完全相同,区别仅仅在于供试品不同,本实施例中采用如下实例1~实例7的工艺制备获得的供试品。
[0084]
实例1
[0085]
1.1四妙勇安汤物质基准实物的制备
[0086]
按四妙勇安汤处方药量称取金银花、玄参、当归、甘草(3:3:2:1),一煎加14倍水,煎煮前浸泡60min,加盖煎煮,沸腾后,改小火,保持微沸,煎煮30min,趁热过滤,药渣加水12倍进行二次煎煮,武火沸腾后,改文火煎煮20min,合并两次煎煮药液,定容至7000ml,将煎煮液于冷冻干燥机中干燥,得到四妙勇安汤物质基准实物。
[0087]
1.2四妙勇安汤物质基准实物的检测结果
[0088]
物质基准实物的出膏率为48.25%,安格洛苷c转移率为97.56%;绿原酸转移率102.13%;新绿原酸转移率105.19%;隐绿原酸转移率102.13%;哈巴俄苷转移率102.78%;肉桂酸转移率106.98%;阿魏酸转移率92.9%,藁本内酯转移率106.53%。
[0089]
四妙勇安汤物质基准实物与四妙勇安汤的标准汤剂相比,高效液相指纹图谱相似度系数为0.965,四妙勇安汤物质基准实物的指纹图谱的s
cqa
值如下表6所示。
[0090]
实例2
[0091]
2.1四妙勇安汤物质基准实物的制备
[0092]
按四妙勇安汤处方药量称取金银花、玄参、当归、甘草(3:3:2:1),一煎加12倍水,煎煮前浸泡60min,加盖煎煮,沸腾后,沸腾后,改小火,保持微沸,煎煮40min,趁热过滤,药渣加水10倍进行二次煎煮,武火沸腾后,改文火煎煮30min,合并两次煎煮药液,定容至6000ml,将煎煮液于冷冻干燥机中干燥,得到四妙勇安汤物质基准实物。
[0093]
2.2四妙勇安汤物质基准实物的检测结果
[0094]
物质基准实物的出膏率为47.36%,安格洛苷c转移率为98.24%;绿原酸转移率101.13%;新绿原酸转移率101.61%;隐绿原酸转移率104.52%;哈巴俄苷转移率101.94%;肉桂酸转移率113.72%;阿魏酸转移率87.89%,藁本内酯转移率105.85%。
[0095]
四妙勇安汤物质基准实物与四妙勇安汤的标准汤剂相比,高效液相指纹图谱相似度系数为0.987,四妙勇安汤物质基准实物的指纹图谱的s
cqa
值如下表6所示。
[0096]
实例3
[0097]
3.1四妙勇安汤物质基准实物的制备
[0098]
按四妙勇安汤处方药量称取金银花、玄参、当归、甘草(3:3:2:1),一煎加10倍水,煎煮前浸泡0min,加盖煎煮,沸腾后,改小火,保持微沸,煎煮50min,趁热过滤,药渣加水8倍进行二次煎煮,武火沸腾后,改文火煎煮40min,合并两次煎煮药液,定容至5000ml,将煎煮液于冷冻干燥机中干燥,得到四妙勇安汤物质基准实物。
[0099]
3.2四妙勇安汤物质基准实物的检测结果
[0100]
物质基准实物的出膏率为46.58%,安格洛苷c转移率为91.69%;绿原酸转移率102.83%;新绿原酸转移率103.19%;隐绿原酸转移率107.74%;哈巴俄苷转移率106.53%;肉桂酸转移率108.6%;阿魏酸转移率90.13%,藁本内酯转移率106.31%。
[0101]
四妙勇安汤物质基准实物与四妙勇安汤的标准汤剂相比,高效液相指纹图谱相似度系数为0.989,四妙勇安汤物质基准实物的指纹图谱的s
cqa
值如下表6所示。
[0102]
实例4
[0103]
4.1四妙勇安汤物质基准实物的制备
[0104]
按四妙勇安汤处方药量称取金银花、玄参、当归、甘草(3:3:2:1),一煎加14倍水,煎煮前浸泡0min,加盖煎煮,沸腾后,改小火,保持微沸,30min,趁热过滤,药渣加水12倍进行二次煎煮,武火沸腾后,改文火煎煮20min,合并两次煎煮药液,定容至700ml,将煎煮液于冷冻干燥机中干燥,得到四妙勇安汤物质基准实物。
[0105]
4.2四妙勇安汤物质基准实物的检测结果
[0106]
物质基准实物的出膏率为43.33%,安格洛苷c转移率为99.19%;绿原酸转移率99.09%;新绿原酸转移率100.01%;隐绿原酸转移率103.24%;哈巴俄苷转移率101.32%;肉桂酸转移率118.03%;阿魏酸转移率100.37%,藁本内酯转移率100.96%。
[0107]
四妙勇安汤物质基准实物与四妙勇安汤的标准汤剂相比,高效液相指纹图谱相似度系数为0.996,四妙勇安汤物质基准实物的指纹图谱的s
cqa
值如下表6所示。
[0108]
实例5
[0109]
5.1四妙勇安汤物质基准实物的制备
[0110]
按四妙勇安汤处方药量称取金银花、玄参、当归、甘草(3:3:2:1),一煎加12倍水,煎煮前浸泡30min,加盖煎煮,沸腾后,改小火,保持微沸,煎煮40min,趁热过滤,药渣加水10倍进行二次煎煮,武火沸腾后,改文火煎煮30min,合并两次煎煮药液,定容至600ml,将煎煮液于冷冻干燥机中干燥,得到四妙勇安汤物质基准实物。
[0111]
5.2四妙勇安汤物质基准实物的检测结果
[0112]
物质基准实物的出膏率为43.66%,安格洛苷c转移率为104.30%;绿原酸转移率102.01%;新绿原酸转移率117.96%;隐绿原酸转移率106.66%;哈巴俄苷转移率104.73%;肉桂酸甘草酸转移率105.54%;阿魏酸转移率90.46%,藁本内酯转移率97.35%。
[0113]
四妙勇安汤物质基准实物与四妙勇安汤的标准汤剂相比,高效液相指纹图谱相似度系数为0.991,四妙勇安汤物质基准实物的指纹图谱的s
cqa
值如下表6所示。
[0114]
实例6
[0115]
6.1四妙勇安汤物质基准实物的制备
[0116]
按四妙勇安汤处方药量称取金银花、玄参、当归、甘草(3:3:2:1),一煎加10倍水,煎煮前浸泡60min,加盖煎煮,沸腾后,改小火,保持微沸,煎煮50min,趁热过滤,药渣加水8倍进行二次煎煮,武火沸腾后,改文火煎煮40min,合并两次煎煮药液,定容至500ml,将煎煮液于冷冻干燥机中干燥,得到四妙勇安汤物质基准实物。
[0117]
6.2四妙勇安汤物质基准实物的检测结果
[0118]
物质基准实物的出膏率为43.22%,安格洛苷c转移率为96.93%;绿原酸转移率102.58%;新绿原酸转移率102.91%;隐绿原酸转移率106.70%;哈巴俄苷转移率105.35%;肉桂酸转移率118.54%;阿魏酸转移率92.56%,藁本内酯转移率104.03%。
[0119]
四妙勇安汤物质基准实物与四妙勇安汤的标准汤剂相比,高效液相指纹图谱相似度系数为0.979,四妙勇安汤物质基准实物的指纹图谱的s
cqa
值如下表6所示。
[0120]
实例7
[0121]
7.1四妙勇安汤物质基准实物的制备
[0122]
按四妙勇安汤处方药量称取金银花、玄参、当归、甘草(3:3:2:1),一煎加10倍水,煎煮前浸泡60min,加盖煎煮,沸腾后,改小火,保持微沸,煎煮50min,趁热过滤,药渣加水8倍进行二次煎煮,武火沸腾后,改文火煎煮40min,合并两次煎煮药液,定容至500ml,将煎煮液于喷雾干燥机(170℃)中直接干燥,得到四妙勇安汤物质基准实物。
[0123]
6.2四妙勇安汤物质基准实物的检测结果
[0124]
物质基准实物的出膏率为43.28%,安格洛苷c转移率为98.65%;绿原酸转移率100.36%;新绿原酸转移率101.64%;隐绿原酸转移率104.50%;哈巴俄苷转移率103.25%;肉桂酸转移率112.56%;阿魏酸转移率94.28%,藁本内酯转移率7.65%。
[0125]
四妙勇安汤物质基准实物与四妙勇安汤的标准汤剂相比,高效液相指纹图谱相似度系数为0.979,四妙勇安汤物质基准实物的指纹图谱的s
cqa
值如下表6所示。
[0126]
表6
[0127][0128]
通过上述检测结果可以有效评价制备工艺与标准汤剂关键质量属性的一致性。通过上述检测结果可知:本实例1
‑
2中的四妙勇安汤物质基准实物的s
cqa
值中,均是30个峰在0.7~1.3的范围值之内,本实例3
‑
4中的四妙勇安汤物质基准实物的s
cqa
值中,均是29个峰在0.7~1.3的范围值之内,本实例5
‑
6中的四妙勇安汤物质基准实物的s
cqa
值中,均是28个峰在0.7~1.3的范围值之内,上述实例1
‑
6的工艺满足质控要求;而实例7中只有5个峰在0.7~1.3的范围值之内,并不满足质控要求。同时,根据上述实施例1
‑
6和7对比可以有效证明:在不同提取工艺条件下,进行冷冻干燥方式获得的特征图谱的s
cqa
差异不大,均能满足质控要求,而采用喷雾干燥的工艺步骤,其特征图谱的s
cqa
并不满足质控要求,进一步证明采用冷冻干燥方式为最佳的干燥工艺方式。
[0129]
实施例4
[0130]
本实施例与实施例3中实例1的区别在于,采用检测的色谱条件不同,具体设置如下:
[0131]
采用实例1中两批次四妙勇安汤的物质基准实物分别进行以下特征图谱或指纹图谱检测,检测方法如下:
[0132]
检测一、
[0133]
采用以十八烷基硅烷键合硅胶为填充剂的色谱柱,色谱柱柱长为150mm,内径为2.1mm,粒度为1.6μm,以乙腈为流动相a,以0.08%体积浓度磷酸溶液为流动相b;进样量为4μl;柱温为35℃;流速为每分钟0.28ml;检测波长:254nm。按下表7中的规定进行梯度洗脱:
[0134]
表7
[0135][0136]
检测二、
[0137]
采用以十八烷基硅烷键合硅胶为填充剂的色谱柱,色谱柱柱长为150mm,内径为2.1mm,粒度为1.9μm,以乙腈为流动相a,以0.12%体积浓度磷酸溶液为流动相b;进样量为2μl;柱温为25℃;流速为每分钟0.32ml;检测波长:230nm。按下表8中的规定进行梯度洗脱:
[0138]
表8
[0139][0140]
分别采用本实施例中上述检测一、检测二的检测方法对实施例3中实例1的四妙勇安汤物质基准实物进行检测,计算相应检测方法的s
cqa
值,出膏率,转移率值,并进行差异性比较如下:
[0141]
表9
[0142]
[0143][0144]
表10
[0145][0146]
通过检测结果与实例1的检测结果对比可知,两批次四妙勇安汤物质基准实物分别检测得到的s
cqa
值与表6中实例1的结果差异在5%以内,两批次四妙勇安汤物质基准实物的出膏率和有效指标成分转移率与实例1的结果差异也在5%以内。
[0147]
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。