medical science.2016,78(3):355
‑
63.doi:10.1292/jvms.15
‑
0446(中国猪流行性腹泻病毒流行病学及疫苗研究进展,兽医学杂志,2016,78(3):355
‑
63);
9.4.langel sn,paim fc,lager km,vlasova an,saif lj.lactogenic immunity and vaccines for porcine epidemic diarrhea virus(pedv):historical and current concepts.virus research.2016,226:93
‑
107.doi:10.1016/j.virusres.2016.05.016(猪流行性腹泻病毒(pedv)的泌乳免疫和疫苗:历史和当前概念,病毒学研究,2016,226:93
‑
107);
10.5.施标董世娟朱,等.中国猪流行性腹泻病毒分子流行病学研究进展.中国农业科学.2013,46(20):4362
‑
69;
11.6.song x,hu s.adjuvant activities of saponins from traditional chinese medicinal herbs.vaccine.2009,27(36):4883
‑
90.doi:10.1016/j.vaccine.2009.06.033(传统中药来源的皂苷类药物的佐剂活性研究,疫苗杂志,2009,27(36):4883
‑
90);
12.7.zhai l,wang y,yu j,hu s.enhanced immune responses of chickens to oral vaccination against infectious bursal disease by ginseng stem
‑
leaf saponins.poult sci.2014,93(10):2473
‑
81.doi:10.3382/ps.2014
‑
04056(人参茎叶皂甙增强鸡对传染性法氏囊病口服疫苗的免疫应答,家禽科学杂志,2014,93(10):2473
‑
81);
13.8.zhai l,li y,wang w,wang y,hu s.vaccine.2011,29(31):5007
‑
14.doi:10.1016/j.vaccine.2011.04.097(口服人参茎叶皂甙对鸡新城疫疫苗免疫应答的影响,疫苗杂志,2011,29(31):5007
‑
14);
14.9.yu j,shi fs,hu s.improved immune responses to a bivalent vaccine of newcastle disease and avian influenza in chickens by ginseng stem
‑
leaf saponins.vet immunol immunopathol.2015,167(3
‑
4):147
‑
55.doi:10.1016/j.vetimm.2015.07.017(人参茎叶皂甙提高鸡对新城疫和禽流感双价疫苗的免疫应答,兽医免疫病理学,2015,167(3
‑
4):147
‑
55);
15.10.fricker g,kromp t,wendel a,blume a,zirkel j,rebmann h,setzer c,quinkert ro,martin f,muller
‑
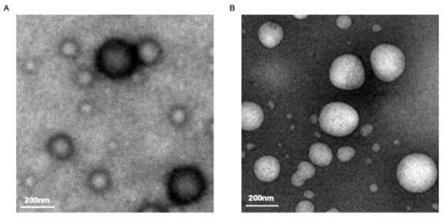
goymann c.phospholipids and lipid
‑
based formulations in oral drug delivery.pharm res.2010,27(8):1469
‑
86.doi:10.1007/s11095
‑
010
‑
0130
‑
x(口服给药中的磷脂和脂质基制剂,药学研究,2010,27(8):1469
‑
86);
16.11.versypt anf,pack dw,braatz rd.mathematical modeling of drug delivery from autocatalytically degradable plga microspheres
‑
areview.journal of controlled release.2013,165(1):29
‑
37.doi:10.1016/j.jconrel.2012.10.015(自催化降解plga微球给药的数学模型——综述,控制释放杂志,2013,165(1):29
‑
37);
17.12.lin cy,lin sj,yang yc,wang dy,cheng hf,yeh mk.biodegradable polymeric microsphere
‑
based vaccines and their applications in infectious diseases.human vaccines&immunotherapeutics.2015,11(3):650
‑
6.doi:10.1080/21645515.2015.1009345(生物可降解聚合物微球疫苗及其在传染病中的应用,人类疫苗与免疫治疗学,2015,11(3):650
‑
6);
18.13.shakweh m,besnard m,nicolas v,fattal e.poly(lactide
‑
co
‑
glycolide)
particles of different physicochemical properties and their uptake by peyer's patches in mice.european journal of pharmaceutics and biopharmaceutics.2005,61(1
‑
2):1
‑
13.doi:10.1016/j.ejpb.2005.04.006(不同理化性质的聚丙交酯
‑
乙交酯颗粒及其在小鼠体内被派尔贴片吸收,欧洲药剂学和生物药剂学杂志,2005,61(1
‑
2):1
‑
13);
19.14.sanchez a,tobio m,gonzalez l,fabra a,alonso mj.biodegradable micro
‑
and nanoparticles as long
‑
term delivery vehicles for interferon
‑
alpha.european journal of pharmaceutical sciences.2003,18(3
‑
4):221
‑
9.doi:10.1016/s0928
‑
0987(03)00019
‑
8(可生物降解的微粒和纳米粒作为干扰素α的长期载体,2003,18(3
‑
4):221
‑
9)。
20.cn104288111a公开了一种人参皂苷rg3聚乳酸羟基乙酸纳米微球及其制备方法,s1:将人参皂苷rg3溶解在二甲基亚砜中,得到第一预定浓度的第一溶液,将聚乳酸
‑
羟基乙酸共聚物溶解在二氯甲烷中,得到第二预定浓度的第二溶液;s2:将预定比例的所述第一溶液加入到所述第二溶液中,超声,形成悬浊液;s3:将所述悬浊液加入到含有聚乙烯醇的水溶液中,超声乳化,得到乳液;s4:将所述乳液干燥处理,待所述乳液的微球固化后,离心分离并洗涤、冻干,得到药效好的人参皂苷rg3聚乳酸羟基乙酸纳米微球。
技术实现要素:
21.本发明要解决的技术问题是提供一种人参茎叶皂苷纳米粒及其制备方法和用途。
22.为解决上述技术问题,本发明提供一种人参茎叶皂苷纳米粒的制备方法,包括以下步骤:
23.1)、将人参茎叶皂苷溶于水中,得浓度为10~100mg/ml的人参茎叶皂苷溶液,作为内水相;
24.将聚乳酸羟基乙酸溶于有机溶剂中,得浓度为10~200mg/ml的聚乳酸羟基乙酸溶液,作为油相;
25.将聚乙烯醇溶于水中,得浓度为1~2g/100ml的聚乙烯醇溶液,作为外水相;
26.2)、将内水相加入(滴加)至油相中,经超声处理,得到油包水型初乳(为稳定的油包水型初乳);内水相和油相的体积比为1:10~3:10;
27.3)、将油包水型初乳加入(滴加)至外水相中,经超声处理,得到水包油包水型复乳(稳定的水包油包水型复乳);油包水型初乳和外水相的体积比为1:10~1:2;
28.4)、水包油包水型复乳经减压蒸发去除有机溶剂,然后经离心后,收集上清,得人参茎叶皂苷纳米粒悬液;
29.人参茎叶皂苷纳米粒悬液冷冻干燥,得人参茎叶皂苷纳米粒(人参茎叶皂苷聚乳酸羟基乙酸纳米粒的冻干粉)。
30.作为本发明的人参茎叶皂苷纳米粒的制备方法的改进:所述溶剂为二氯甲烷。
31.作为本发明的人参茎叶皂苷纳米粒的制备方法的进一步改进:
32.所述步骤2)的超声处理为:超声2s间歇3s,总时2min;11~13ml体系,功率190w;
33.所述步骤3)的超声处理为:超声2s间歇3s,总时5min;33~123ml体系,功率190w。
34.作为本发明的人参茎叶皂苷纳米粒的制备方法的进一步改进:所述步骤4)中的离心:3000
±
500rpm离心30
±
5min。
35.在本发明的步骤4)中减压蒸发、冷冻干燥均为常规工艺;例如:
36.减压蒸发:100rpm的转速、55℃的水浴温度条件下减压蒸发30
±
5min;
37.冷冻干燥:人参茎叶皂苷纳米粒悬液先于
‑
80℃预冻24h,然后继续于
‑
80℃冷冻干燥48h,得到人参茎叶皂苷纳米粒(人参茎叶皂苷聚乳酸羟基乙酸纳米粒的冻干粉)。
38.本发明还同时提供了利用上述方法制备而得的人参茎叶皂苷纳米粒的用途:促进猪流行性腹泻疫苗诱导的抗体(包括血清igg、igg1、igg2a和肠黏膜中iga以及中和抗体)和细胞因子的生成。
39.在本发明中:采用超声溶解的方式,使得人参茎叶皂苷溶于水中形成内水相;采用超声溶解的方式,使得聚乳酸羟基乙酸溶于有机溶剂中形成油相。
40.采用本发明方法制备而得的人参茎叶皂苷纳米粒(人参茎叶皂苷聚乳酸羟基乙酸纳米粒的冻干粉)中,各皂苷单体的包封率为:rg1高达51.2%,re高达44.32%,rb2高达36.63%,rd高达69.34%,rf高达53.27%,rc高达58.56%,rb1高达52.37%。利用粒径电位测定仪对人参茎叶皂苷纳米粒的粒径、多分散系数(pdi)及表面电势进行了分析,并通过透射电镜对其表面形态进行了研究,发现人参茎叶皂苷聚乳酸羟基乙酸纳米粒呈现均一的纳米分散体系。
41.本发明实际使用时,动物口服该人参茎叶皂苷纳米粒后,接种猪流行性腹泻疫苗以促进疫苗诱导的抗体和细胞因子的生成。口服用量一般为:30~120μg/只,连续口服7天后按照常规方式注射疫苗。
42.与现有技术相比,本发明具有如下技术优势:
43.1、提供一种人参茎叶皂苷聚乳酸羟基乙酸纳米粒的制备方法,填补了国内外研究的空白。
44.2、人参茎叶皂苷聚乳酸羟基乙酸纳米粒具有免疫增强活性。通过本发明的实验证明:人参茎叶皂苷制备成人参茎叶皂苷聚乳酸羟基乙酸纳米粒后不仅能够增强猪流行性腹泻疫苗诱导的全身体液免疫和细胞免疫反应,而且能够明显促进特异性的肠黏膜免疫应答。
45.综上所述:本发明首次利用复乳法制备人参茎叶皂苷聚乳酸羟基乙酸纳米粒,所得的纳米粒悬液中各皂苷单体的包封率较高,药物性质稳定,同时对猪流行性腹泻疫苗具有免疫增强作用,对防治猪流行性腹泻病有重要意义。
附图说明
46.下面结合附图对本发明的具体实施方式作进一步详细说明。
47.图1为人参茎叶皂苷聚乳酸羟基乙酸纳米粒(gsls
‑
nps)和空白聚乳酸羟基乙酸纳米粒(nps)的透射电镜图;其中,a为gsls
‑
nps的透射电镜图,b为nps的透射电镜图;
48.图2为口服人参茎叶皂苷聚乳酸羟基乙酸纳米粒(gsls
‑
nps)对小鼠注射猪流行性腹泻(pedv)疫苗后血清igg抗体及其亚类水平的影响(上标字母不同表示组间有显著性差异,p<0.05);其中,a为血清igg抗体水平,b为血清igg1抗体水平;c为血清igg2a抗体水平;
49.图3为口服人参茎叶皂苷聚乳酸羟基乙酸纳米粒(gsls
‑
nps)对小鼠注射猪流行性腹泻(pedv)疫苗后肠道iga抗体水平的影响(上标字母不同表示组间有显著性差异,p<0.05);其中,a为粪便iga抗体水平,b为十二指肠iga抗体水平,c为空肠iga抗体水平,d为回
肠iga抗体水平;
50.图4为口服人参茎叶皂苷聚乳酸羟基乙酸纳米粒(gsls
‑
nps)对小鼠注射猪流行性腹泻(pedv)疫苗后中和抗体水平的影响(上标字母不同表示组间有显著性差异,p<0.05);
51.图5为口服人参茎叶皂苷聚乳酸羟基乙酸纳米粒(gsls
‑
nps)对小鼠注射猪流行性腹泻(pedv)疫苗后淋巴细胞分泌细胞因子水平的影响(上标字母不同表示组间有显著性差异,p<0.05);其中,a为ifn
‑
γ表达水平,b为il
‑
10表达水平,c为il
‑
6表达水平。
具体实施方式
52.下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
53.以下案例中所用试剂如下:
54.人参茎叶皂苷(gsls),购自吉林省宏久生物科技股份有限公司,总皂苷含量大于80%,含re(29.34%)、rg1(12.94%)、rd(12.23%)、rb2(12.22%)、rc(7.36%)、rb1(2.39%)和rf(0.69%);
55.聚乳酸羟基乙酸(50:50,分子量:1.7万),购自济南岱罡生物工程有限公司;
56.聚乙烯醇(分子量:72000),购自生工生物工程(上海)股份有限公司;
57.二氯甲烷,购自上海凌峰化学试剂有限公司。
58.实施例1、一种人参茎叶皂苷聚乳酸羟基乙酸纳米粒的制备:
59.1)、称取10mg的人参茎叶皂苷,充分溶解于蒸馏水(约1ml)中,形成内水相,浓度为10mg/ml;
60.称取0.2g的聚乳酸羟基乙酸,加入至二氯甲烷(约10ml)中并溶解,形成油相,浓度为20mg/ml;
61.称取2.2g的聚乙烯醇,溶于蒸馏水(约110ml)中,形成外水相,浓度为2g/100ml;
62.为了确保溶解,可采用超声溶解的方式,使得人参茎叶皂苷溶于水中,使得聚乳酸羟基乙酸溶于二氯甲烷中。
63.2)、按照内水相:油相=1:10的体积比,将1ml的内水相滴加到10ml的油相中,并以功率190w,超声2s间歇3s,总时2min的条件进行超声,得到稳定的油包水型初乳。
64.3)、按照油包水型初乳:外水相=1:10的体积比;将11ml的油包水型初乳滴加入110ml外水相后,以功率190w,超声2s间歇3s,总时5min的条件进行超声,得到稳定的水包油包水型复乳。
65.4)、将水包油包水型复乳于旋转蒸发仪上减压蒸发去除有机溶剂(二氯甲烷),转速100rpm,水浴55℃,30min;然后装入离心管中,以转速3000rpm离心30min后,收集上清,即得人参茎叶皂苷的聚乳酸羟基乙酸纳米粒悬液。
66.将纳米粒悬液放入
‑
80℃冰箱中预冻24h,再放入冷冻干燥机中
‑
80℃干燥48h,即可得到即得人参茎叶皂苷的聚乳酸羟基乙酸纳米粒冻干粉(gsls
‑
nps)。
67.空白对比例:将实施例1步骤2)中的1ml内水相改成1ml蒸馏水,其余等同于实施例1;得空白聚乳酸羟基乙酸纳米粒(nps)。
68.实验1、皂苷单体的包封率
69.采用hplc法检测人参茎叶皂苷聚乳酸羟基乙酸纳米粒中各皂苷单体的包封率。包
封率=w1/w2
×
100%;载药量=w1/w3
×
100%;
70.式中:w1为包封的药物质量,w2为体系中的药物总质量,w3为冻干后纳米粒的质量。
71.具体结果如下:
72.包封率:rg1为51.2%,re为44.32%,rb2为36.63%,rd为69.34%,rf为53.27%,rc为58.56%,rb1为52.37%。
73.载药量:rg1为0.15%,re为0.29%,rb2为0.099%,rd为0.19%,rf为0.0081%,rc为0.095%,rb1为0.028%。
74.实验2、人参茎叶皂苷聚乳酸羟基乙酸纳米粒的表征
75.将实施例1所得的人参茎叶皂苷的聚乳酸羟基乙酸纳米粒(gsls
‑
nps)以及空白对比例所得的空白聚乳酸羟基乙酸纳米粒(nps),进行粒径电位检测及透射电镜观察:粒使用粒径电位测定仪(anton paar litesizer 500)分析粒径和电势,使用透射电子显微镜(jem
‑
1200ex)分析表面形态;
76.粒径和电势结果见表1。
77.表1
78.纳米粒粒径(nm)pdizeta电势(mv)nps271.48
±
6.270.128
±
0.058
‑
3.91
±
0.12gsls
‑
nps227.71
±
5.250.104
±
0.017
‑
3.37
±
0.08
79.由表1可见,gsls
‑
nps的粒径较nps的粒径小,其原因可能是包裹了人参茎叶皂苷后,纳米粒内部的分子间作用力增强,使得粒径变小;纳米粒的zeta电势均为负值;pdi指的是纳米粒粒径分布的均匀度,pdi越小说明纳米粒大小越均匀,分散性也就越好,从表1中看出所制备的gsls
‑
nps的pdi较nps的pdi小,且都小于0.2,说明其分散性较好。
80.纳米粒表面形态见图1。由图1可见,gsls
‑
nps和nps分布均匀,粒子均呈规则的球形,大小均一,表面光滑。粒径、电势及电镜结果表明人参茎叶皂苷聚乳酸羟基乙酸纳米粒具有优良的物理化学性质。
81.实验3、口服人参茎叶皂苷聚乳酸羟基乙酸纳米粒显著提高猪流行性腹泻疫苗在小鼠体内诱导的抗体水平
82.1、试剂
83.高糖dmem细胞培养液,购自赛默飞世尔生化制品(北京)有限公司;
84.0.25%胰酶,购自杭州吉诺生物医药技术有限公司;
85.猪流行性腹泻病毒(pedv)抗体检测试剂盒,购自杭州洪晟生物技术股份有限公司;
86.hrp标记山羊抗小鼠igg抗体,购自杭州宝科生物科技有限公司;
87.hrp标记山羊抗小鼠iga抗体,购自santa cruz生物科技有限公司;
88.hrp标记山羊抗小鼠igg1和igg2a抗体,购自艾博抗(上海)贸易有限公司。
89.2、采用实施例1制备而得的人参茎叶皂苷的聚乳酸羟基乙酸纳米粒(gsls
‑
nps)、空白对比例制备而得的空白聚乳酸羟基乙酸纳米粒(nps)。
90.3、疫苗
91.zj/zx2018
‑
c10毒株(genbank:mk250953)pedv疫苗(病毒滴度为1
×
10
5.8
tcid50/
ml),由本实验室保存。
92.4、动物分组和疫苗给药
93.将25只6~8周龄雌性balb/c小鼠随机分成5组,每组5只,
94.第1组(gsls
‑
nps/pedv)小鼠灌胃60μg人参茎叶皂苷聚乳酸羟基乙酸纳米粒gsls
‑
nps(含0.088μg rg1、0.173μg re、0.059μg rb2、0.113μg rd、0.005μg rf、0.057μg rc、0.017μg rb1)的生理盐水液(约0.5ml);
95.第2组(g
‑
solution/pedv)小鼠灌胃60μg人参皂苷单体(含0.088μg rg1、0.173μg re、0.059μg rb2、0.113μg rd、0.005μg rf、0.057μg rc、0.017μg rb1)的生理盐水液(约0.5ml);
96.第3组(nps/pedv)小鼠灌胃60μg空白聚乳酸羟基乙酸纳米粒nps的生理盐水液(约0.5ml);
97.第4组(pedv)小鼠灌胃0.5ml生理盐水;
98.上述第1组~第4组每次灌胃总体积为0.5ml/只,连续灌胃7天(每天一次),于最后一次灌胃后24h后海穴注射0.1ml pedv疫苗,间隔20天后,后海穴注射0.1ml pedv疫苗进行二免;
99.第5组(saline)小鼠连续7天灌胃生理盐水(每天一次),于最后一次灌胃后24h后海穴注射0.1ml生理盐水,间隔20天后,后海穴注射0.1ml生理盐水。
100.5、采样
101.于第二次疫苗接种后第14天,采集眼眶静脉窦血液,5000rpm离心5min,分离血清;采集粪便,以4ml/g加缓冲液(含0.01m pbs和0.05m edta)悬浮,加钢珠在组织匀浆机上震荡2min,7000rpm离心5min,收集上清液;取十二指肠、空肠和回肠各3cm,分别以4ml/g加缓冲液(含0.01m pbs和0.05m edta)悬浮,加钢珠在组织匀浆机上震荡2min,7000rpm离心5min,收集上清液。所有样品于
‑
20℃保存。
102.6、iga、igg及其亚类抗体检测
103.用猪流行性腹泻病毒抗体检测试剂盒中的抗原包被板、样品稀释液、洗涤液、tmb底物和终止液,具体步骤如下:
104.(1)将样品和试剂盒从冰箱取出恢复至室温;
105.(2)在抗原包被板中加入100μl样品,其中血清1:100稀释,粪便和肠组织上清1:2稀释;
106.(3)37℃孵育90min;
107.(4)用洗涤液洗涤5次;
108.(5)每孔加入100μl酶标抗体(1:1000稀释),37℃孵育60min;
109.(6)重复步骤4;
110.(7)每孔加入100μltmb底物,37℃孵育15min;
111.(8)每孔加入50μl终止液终止反应,在450nm下读取吸光值。
112.7、中和抗体检测
113.(1)将vero细胞浓度调整到1
×
106个细胞/ml,均匀铺至96孔细胞培养板中,每孔100μl细胞,培养过夜;
114.(2)样品经56℃灭活处理后,用dmem培养液进行倍比稀释,;
115.(3)将病毒稀释到200tcid50/100μl;
116.(4)将稀释样品与稀释病毒液等体积混合,置于37℃,5%co2培养箱中孵育2h;
117.(5)吸去96孔板中vero细胞上清,用pbs洗涤后,取100μl样品
‑
病毒混合液加入每孔细胞中,置于37℃,5%co2培养箱中孵育2h;
118.(6)吸去样品
‑
病毒混合液,用pbs洗涤后,每孔加入200μl,置于37℃,5%co2培养箱中孵育5
‑
10天,以能保护50%细胞不被感染的最高血清稀释度的倒数作为中和终点,用reed和muench两氏法计算结果,结果以log2值表示。
119.8、统计分析
120.试验结果表示为平均值
±
标准差(mean
±
s.d.),采用graphpad prism(5.0)软件中单因素方差分析(turkey’s multiple comparisons)进行统计,p<0.05即判定为差异性显著。
121.9、结果
122.由图2可知,与单独pedv疫苗组(pedv)和空白聚乳酸羟基乙酸纳米粒组(nps/pedv)相比,人参茎叶皂苷聚乳酸羟基乙酸纳米粒组(gsls
‑
nps/pedv)的小鼠血清中pedv特异性igg及其亚类igg1和igg2a抗体水平明显升高(p<0.05);而且与人参皂苷单体水溶液组(g
‑
solution/pedv)相比,gsls
‑
nps/pedv组的小鼠血清中pedv特异性igg1亚类水平明显升高(p<0.05),但总igg抗体水平和igg2a水平没有明显差异。结果说明口服人参茎叶皂苷聚乳酸羟基乙酸纳米粒能够提高pedv疫苗诱导的血清igg抗体水平,对igg1和igg2a亚类抗体的产生具有显著的促进作用,并且与人参皂苷单体水溶液相比具有一定优势。
123.由图3可知,单独pedv疫苗(pedv)接种可以提高小鼠粪便和十二指肠中的iga抗体水平(p<0.05),但对空肠和回肠中的iga水平无明显作用;与单独pedv疫苗组(pedv)相比,人参茎叶皂苷聚乳酸羟基乙酸纳米粒组(gsls
‑
nps/pedv)小鼠的粪便、十二指肠、空肠和回肠中pedv特异性iga抗体水平均明显升高(p<0.05);并且gsls
‑
nps/pedv组的粪便、十二指肠和空肠中pedv特异性iga抗体水平明显高于g
‑
solution/pedv和nps/pedv组(p<0.05),但这三组的回肠iga抗体水平没有明显差异。空肠和回肠是pedv主要的入侵部位,增强这两个部位中的特异性黏膜免疫反应对于抵御病毒入侵具有积极意义。由结果可见,口服人参茎叶皂苷聚乳酸羟基乙酸纳米粒能够促进pedv疫苗诱导的肠黏膜免疫反应,并且与人参皂苷单体水溶液相比具有明显优势。
124.由图4可知,与单独pedv疫苗组(pedv),人参皂苷单体水溶液组(g
‑
solution/pedv)和空白聚乳酸羟基乙酸纳米粒组(nps/pedv)相比,口服人参茎叶皂苷聚乳酸羟基乙酸纳米粒(gsls
‑
nps/pedv)能够明显提高小鼠血清和粪便中的中和抗体水平(p<0.05);而口服人参皂苷单体水溶液(g
‑
solution/pedv)和空白聚乳酸羟基乙酸纳米粒(nps/pedv)对小鼠血清和粪便中的中和抗体水平没有明显作用。中和抗体是机体抵御病毒入侵的一个重要武器。由此可见,口服人参茎叶皂苷聚乳酸羟基乙酸纳米粒能够显著增强机体抗pedv感染的能力。
125.实验4、口服人参茎叶皂苷聚乳酸羟基乙酸纳米粒显著提高猪流行性腹泻疫苗在小鼠体内诱导的细胞因子表达水平
126.一、材料和方法
127.1、试剂
128.rpmi 1640细胞培养液,购自赛默飞世尔生化制品(北京)有限公司;
129.小鼠ifn
‑
γ、il
‑
10和il
‑
6细胞因子检测试剂盒,均购自深圳欣博盛生物科技有限公司。
130.2、采用实施例1制备而得的人参茎叶皂苷的聚乳酸羟基乙酸纳米粒(gsls
‑
nps)、空白对比例制备而得的空白聚乳酸羟基乙酸纳米粒(nps)。
131.2、疫苗和灭活抗原
132.zj/zx2018
‑
c10毒株(genbank accession number:mk250953)pedv疫苗(滴度为1
×
10
5.8
tcid50/ml)由本实验室保存。该病毒用0.05%β
‑
丙内脂在4℃灭活12h,并在37℃继续放置2h。灭活后的病毒接种到vero细胞上,观察10天,连续传3代,未观察到病变即灭活完全,灭活抗原用于刺激淋巴细胞。
133.3、动物分组和疫苗给药
134.同实验3。
135.4、采样
136.于第二次疫苗接种后第14天,处死小鼠,采集脾脏和肠系膜淋巴结并分离单个核细胞,调整细胞浓度为5
×
106个/ml,并接种到24孔板中,每孔2ml,置于37℃,5%co2培养箱孵育2h;加入100μl的pedv抗原刺激48h;收集上清保存于
‑
20℃。
137.5、细胞因子检测
138.用欣博盛细胞因子检测试剂盒检测,具体步骤如下:
139.(1)将试剂盒从冰箱取出,恢复至室温;
140.(2)标准品按照试剂盒要求倍比稀释,抗原包被板中每孔加100μl样品或标准品,置于37℃恒温箱中孵育90min;;
141.(3)洗板5次;
142.(4)每孔加100μl生物素化抗体,置于37℃恒温箱中孵育60min;
143.(5)重复步骤3;
144.(6)每孔加100μl酶结合物工作液,置于37℃恒温箱中避光孵育30min;
145.(7)重复步骤3;
146.(8)每孔加100μl tmb底物,置于37℃恒温箱中避光孵育15min;
147.(9)每孔加50μl终止液终止反应,在450nm下读取吸光值。
148.6、统计分析
149.试验结果表示为平均值
±
标准差(mean
±
s.d.),采用graphpad prism(5.0)软件中单因素方差分析(turkey’s multiple comparisons)进行统计,p<0.05即判定为差异性显著。
150.7、结果
151.由图5可知,与生理盐水组(saline)相比,单独pedv疫苗(pedv)接种只能够促进脾淋巴细胞分泌il
‑
6(p<0.05),而对ifn
‑
γ和il
‑
10的表达以及肠系膜淋巴结中这三种细胞因子的表达均没有明显作用;而口服人参茎叶皂苷聚乳酸羟基乙酸纳米粒(gsls
‑
nps/pedv)能够显著提高pedv疫苗诱导的小鼠脾脏和肠系膜淋巴结中ifn
‑
γ、il
‑
10和il
‑
6的表达水平(p<0.05),并且明显高于人参皂苷单体水溶液组(g
‑
solution/pedv)和空白聚乳酸羟基乙酸纳米粒组(nps/pedv);口服人参皂苷单体水溶液(g
‑
solution/pedv)只能够促进
疫苗诱导的脾脏和肠系膜淋巴结中il
‑
10的表达(p<0.05),但对ifn
‑
γ和il
‑
6的增强作用并不明显。ifn
‑
γ和il
‑
10分别属于th1和th2型细胞因子,其中th1型细胞因子主要介导细胞免疫,th2型细胞因子主要介导体液免疫。il
‑
6属于th17型细胞因子,也是一种多效性细胞因子,能够促进b细胞和t细胞的增殖以及细胞毒性杀伤性t细胞的活化,并且参与炎症反应。由结果可见,人参茎叶皂苷聚乳酸羟基乙酸纳米粒是一种th1/th2/th17平衡型的免疫增强剂,并且与人参皂苷单体水溶液相比具有明显优势。
152.对比例1、相对于实施例1作如下改动:
153.将步骤1)中内水相的制备,改成“称取30mg的人参茎叶皂苷,充分溶解于蒸馏水(约3ml)中;
154.将步骤2)中“按照内水相:油相=1:10的体积比,将1ml的内水相滴加到10ml的油相中”改成“按照内水相:油相=3:10的体积比,将3ml的内水相滴加到10ml的油相中”;
155.其余等同于实施例1。
156.对比例2、相对于实施例1作如下改动:
157.将步骤1)中外水相的制备,改成“称取0.44g的聚乙烯醇,溶于蒸馏水(约22ml)中形成外水相”158.将步骤3)中“按照油包水型初乳:外水相=1:10的体积比;将11ml的油包水型初乳滴加入110ml外水相后”改成“按照油包水型初乳:外水相=1:2的体积比;将11ml的油包水型初乳滴加入22ml外水相后”;
159.其余等同于实施例1。
160.将对比例1和对比例2所得的人参茎叶皂苷聚乳酸羟基乙酸纳米粒,按照上述实验1和实验2所述方法进行检测,与实施例1所得结果的对比如下表2所示:
161.表2
[0162][0163]
最后,还需要注意的是,以上列举的仅是本发明的若干个具体实施例。显然,本发明不限于以上实施例,还可以有许多变形。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。