使用突变型大肠杆菌的可拉酸生产
[技术领域]
[0001]
本发明涉及使用突变型大肠杆菌生产可拉酸的方法。
[
背景技术:
]
[0002]
可拉酸是一种胞外多糖,其带有负电荷,分子量为3.4kda,且已知由属于肠杆菌(enterobacteriaceae)科的各种细菌产生,从而形成生物膜并生长。据估计,可拉酸在生物膜三维结构的形成中起重要作用,并赋予生物膜中细菌对噬菌体感染的耐受性,对环境因素如渗透压、脱水、低温和氧化应激的耐受性,以及对抗生素的抗性。可拉酸的结构是具有重复的六糖的结构,包括例如两个岩藻糖、两种半乳糖、一个葡萄糖和一个葡萄糖醛酸。此外,可拉酸具有作为残留物的乙酸和丙酮酸。岩藻糖是单体糖中的一种,是一种不能轻易获得的稀有糖,但由于数种生理活性功能而被广泛用于食品、医疗和化妆品领域。作为食品材料,可拉酸由于高水分结合力而被用作凝固剂、成膜剂、凝胶形成剂或乳化稳定剂,并且由于具有低热量而被用作减肥糖。在医药方面,可拉酸被用作抗炎剂、抗癌剂和佐剂,并且由于美白、保湿、促进真皮细胞再生和抗衰老作用而被广泛用作化妆品材料。然而,尽管有这些用途,但获得可拉酸的方法仍是困难的且收率低,因此可拉酸非常昂贵。但是,旨在最大化生产的可拉酸以岩藻糖为单体,该岩藻糖约占总质量的1/3,且如果可拉酸大量生产,可用于岩藻糖的生产。另外,根据最近的研究结果,可拉酸本身的各种生理活性已经被揭示,其利用价值不断提高。
[0003]
然而,没有关于优化培养基以利用微生物来进行可拉酸的大量生产的研究。实际上,在着眼于对生产不同类型的细胞外多糖的研究时,考虑到细胞外多糖的产量会根据培养基成分的变化而发生很大的变化的事实,可见对培养基优化的研究是必不可少的。
[0004]
[相关技术文献]
[0005]
[非专利文献]
[0006]
front.microbiol.6:496(2015),细菌胞外多糖:生物合成途径和工程策略。
[
技术实现要素:
]
[0007]
[技术问题]
[0008]
发明人基于先前的研究开发了生产可拉酸的最佳菌株,其中通过去除参与构成细胞膜的脂多糖形成的基因中的waaf基因来形成不完全脂多糖,结果,当相应的细胞被暴露于外部应力时,通过对抗应力的防御机制产生可拉酸,并通过培养基优化完成了大量生产可拉酸的方法。
[0009]
因此,本发明旨在提供使用去除了waaf基因的突变型大肠杆菌jm109菌株通过培养基优化来大量生产可拉酸的方法。
[0010]
[技术方案]
[0011]
本发明涉及生产可拉酸的方法,所述方法包括:
[0012]
通过从大肠杆菌jm109菌株中去除waaf基因来制备突变型大肠杆菌jm109菌株;和
na2hpo4、3.00g/l kh2po4、0.50g/l nacl、0.24g/l mgso4和0.011g/lcacl2)培养waaf基因缺失的大肠杆菌jm109菌株的结果。
[0031]
[发明方式]
[0032]
在下文中,将参考以下实施例详细描述本发明。提供以下实施例仅用于举例说明本发明,本发明的内容不限于以下实施例。
[0033]
[实施例1]基因去除
[0034]
本发明使用的菌株是大肠杆菌jm109δwaaf,waaf基因从普通大肠杆菌jm109菌株中去除。用于基因去除的策略是λ-red重组技术,图1示意性示出了该策略。详细过程如下:
[0035]
1)使用pkd4粒通过pcr扩增包含翻转酶识别靶标(frt)之间的卡那霉素抗性基因以及与waaf的侧翼区域具有同源性的上游和下游基因的序列片段。
[0036]
用于扩增序列片段的引物组如下:
[0037]
正向引物:5
’‑
atggtgccgtccattattatcgcggatgccggaagttaacgaagctattc ttgtgtaggctgg agctgcttc-3’(seq id no:1)和反向引物:5
’‑
gataaccctccgcagcgtcacc tttacgcactttgtgatagccggtaatc atgggaattagccatggtcc-3’(seq id no:2)。引物下划线的序列区表示waaf的同源重组区。
[0038]
2)将pkd46质粒插入大肠杆菌jm109中。
[0039]
3)将1)中扩增的线性dna模板插入到插入了pkd46质粒的大肠杆菌jm109中,然后表达pkd46质粒。
[0040]
4)通过表达翻转酶重组蛋白的pcp20质粒的插入和表达,完成了从常规大肠杆菌jm109中仅去除了waaf基因的菌株。
[0041]
[实施例2]发酵条件
[0042]
作为用于培养基优化的基础培养基,选择了可以容易地表现出每种成分的影响且对分析的影响很小的培养基:m9基本培养基,对基本培养基的组成进行了部分改变,培养基成分的浓度范围因使用而异。具体地,优化前,m9基本培养基的组成如下:10.00g/l-30.00g/l葡萄糖、1.00g/l-2.00g/l胰蛋白胨、3.00g/l-10.00g/l磷酸钠(na2hpo4)、1.50g/l-4.50g/l磷酸钾(kh2po4)、0.12g/l-0.36g/l硫酸镁(mgso4)、0.005g/l-0.017g/l氯化钙(cacl2)和0.50g/l氯化钠(nacl)。调查结果发现在低温时会产生大量可拉酸,因此在25℃进行发酵。此外,作为详细条件,在含有50ml培养基的250ml厄伦美厄锥形瓶中通过200rpm振荡培养进行培养,接着在24小时后测量细菌生长程度和可拉酸产量.
[0043]
[实施例3]可拉酸的定量
[0044]
对可拉酸的定量以对单体之一葡萄糖醛酸进行具体定量的方式进行。回收培养基后,接着将培养基在90℃至95℃反应10分钟使蛋白质失活。然后将所得溶液在4℃和10000
×
g离心30分钟,从而将细菌细胞以团块的形式分离,可拉酸存在于上清液中。仅回收上清液后,加入体积相当于上清液3倍体积的乙醇,以使可拉酸沉淀。沉淀再次通过在4℃和10000
×
g离心30分钟回收,溶解在蒸馏水中并用于对葡萄糖醛酸进行定量。对葡萄糖醛酸进行定量按如下进行:
[0045]
1)将12.5mm四硼酸钠-硫酸溶液5ml加入1ml样品中,100℃反应5分钟。
[0046]
2)充分冷却后,加入在0.5%(w/v)氢氧化钠水溶液中溶解了1.5g/l羟基二苯的100μl溶液,并充分混合。
[0047]
3)通过将测得的526nm溶液吸光度代入标准图中,计算出相应样品的葡萄糖醛酸浓度。
[0048]
4)用葡萄糖醛酸标准溶液绘制标准图。
[0049]
[实施例4]最佳碳源的选择
[0050]
通过仅改变碳源的类型和浓度而保留m0基本培养基的其他成分不变,来测量细菌生长的程度和可拉酸的产量。使用共计6种来源如葡萄糖、蔗糖、甘油、木糖、糖蜜和麦芽提取物作为碳源。具体地,在含有6.78g/l na2hpo4、3.00g/lkh2po4、0.50g/l nacl、1.00g/l nh4cl、0.24g/l mgso4和0.011g/l cacl2的发酵培养基中,
[0051]
添加浓度为5g/l、10g/l、15g/l或20g/l的碳源并测量可拉酸的产量。
[0052]
如图2所示,当使用葡萄糖作为碳源时,由于可拉酸以最高水平产生,细菌生长的结果也不错,故选择葡萄糖作为最佳碳源。然而,由于难以确认随浓度变化的差异,因此通过浓度进行增进实验。参考图3,当葡萄糖浓度为20g/l时,可拉酸的产量和细菌生长最高,因此后续实验以20g/l的葡萄糖作为碳源进行。
[0053]
[实施例5]最佳氮源的选择
[0054]
由前面的实验可知,选择20g/l的葡萄糖作为碳源,在保留其他因子不变的同时,用各种类型和浓度的氮源来测量细菌的生长和可拉酸的产量。使用了总共7种氮源,该7种氮源包括作为有机氮源的蛋白胨、胰蛋白胨、酵母提取物、尿素和玉米浓缩物,以及作为无机氮源的硫酸铵和氯化铵。具体地,通过将0.5g/l、1g/l或1.5g/l的氮源加入到包含20.00g/l葡萄糖、6.78g/l na2hpo4、3.00g/l kh2po4、0.50g/l nacl、0.24g/l mgso4和0.011g/l cacl2的发酵培养基中。
[0055]
如图4所示,当提供胰蛋白胨时,显示出可拉酸的产量最大。在细菌生长方面,胰蛋白胨在酵母提取物之后显示出最好的结果。因此选择胰蛋白胨作为氮源,后续实验采用1.5g/l的胰蛋白胨进行。
[0056]
结果,根据实施例4和5,分别使用葡萄糖和胰蛋白胨作为碳源和氮源,m9基本培养基的最终组成包括葡萄糖、磷酸钠、磷酸钾、氯化钠、胰蛋白胨、硫酸镁和氯化钙。
[0057]
[实施例6]对用于可拉酸合成的培养基进行优化的统计方法
[0058]
《6-1》部分因子设计(ffd)
[0059]
ffd作为认真地对培养基成分的浓度进行优化的第一步,是一种检验各组分对可拉酸产量的影响程度的实验。
[0060]
为了筛选培养基中影响可拉酸生产的最重要成分,使用minitab 18.1(美国宾夕法尼亚州州立学院minitab)进行ffd。ffd形成了18个实验混合物,该18个实验混合物由六个自变量三个水平(-1、0和1)组成(表1和2)。在ffd中,使用葡萄糖(x1)、胰蛋白胨(x2)、na2hpo4(x3)、kh2po4(x4)、mgso4(x5)和cacl2(x6)的量(g/l)作为自变量,并且使用大肠杆菌jm109δwaaf产生的可拉酸的量(y1;mg/l)和细胞密度(od600;y2)作为因变量。因变量的代码值由以下等式获得:
[0061][0062]
在此,xi为培养基成分的水平(代码值),xi为培养基成分在水平xi的实际值,x0为
培养基成分在基线时的实际值,δxi为阶跃变化值。所有实验以一式三份进行。
[0063]
基于ffd的实验结果,进行回归分析,以确定对可拉酸生产有显著影响的组分。这仅仅意味着当xi具有较高的绝对系数估计值时,xi对可拉酸的生产有重要影响。当xi为负系数估计值时,表示xi对可拉酸的生产有负影响,且当xi为正系数估计值时,表示有正影响。
[0064]
实验浓度基于m9基本培养基和之前的实验确定,且总结在表1中。利用确定的浓度设计ffd,并且根据设计进行实验后,测定细菌生长的程度和可拉酸的产量,总结于表2中。为了获得准确的结果,进行回归分析,回归分析结果如表3所示。作为回归分析的结果,证实了x2和x3,即胰蛋白胨和na2hpo4对可拉酸的产量有极大影响,并且发现在确定的浓度范围内,随着浓度的增加,可拉酸的产量增加。因此,进行了对这两种成分浓度进行优化的实验作为后续实验。
[0065]
[表1]ffd浓度范围设置
[0066][0067]ax1=(x
1-20)/10;x2=(x
2-1.5)/0.5;x3=(x
3-6.78)/3;x4=(x
4-3)/1.5;x5=(x
5-0.24)/0/12;x6=(x
6-0.011)/0.006
[0068]
[表2]ffd的实验设计及其结果
[0069][0070]a数据按一式三份实验的平均值
±
标准偏差来表示
[0071]
[表3]ffd结果的回归分析
[0072][0073]a未显示p值高于0.3的结果
[0074]
*r2=0
·
9839
[0075]
[实施例7]最速上升法
[0076]
为了确定通过ffd选择的两种成分的最佳浓度,首先,进行了用于检测近似最佳浓度的最速上升法。在确定的浓度范围内,两种组分的浓度越高,可拉酸的产量就越高。因此,通过在同时增加两种组分的浓度的情况下测量细菌生长的程度和可拉酸的产量来确定两种组分的近似最佳浓度范围。参见表4,如所预期,随着两种组分浓度增加,可拉酸的产量增加并在第8次实验中达到最大值。因此,确认最佳条件是:胰蛋白胨约为2.90g/l,na2hpo4约为10.98g/l。
[0077]
[表4]最速上升法实验设计及其结果
[0078][0079]
[实施例8]使用中心复合设计(ccd)的表面响应法
[0080]
基于通过最速上升法获得的结果,在胰蛋白胨和na2hpo4近似浓度的最佳条件之前和之后进行ccd。
[0081]
具体地,为了确定培养基中两种成分(即胰蛋白胨和na2hpo4)的最佳浓度以进行可拉酸的最大化生产,使用五个代码值(-1.414、-1、0、1和1.414)进行ccd。使用以下等式计算两个因子(胰蛋白胨和na2hpo4)的代码值:
[0082]
(1)
[0083]
选择三维模型以基于回归分析来模拟胰蛋白胨和na2hpo4的最佳浓度。三维模型的等式如下:
[0084]
(2)
[0085]
在此,xi和xj是自变量的代码值,y是预期响应(可拉酸产量)。影响响应(y)的各种回归系数,例如b0、b1、b2、b3、b4、b5和b6,表示截距(b0)、线性系数(b1、b2)、2因子交互系数(b3)、二级系数(b4,b5)和三级系数(b6,b7)。通过回归分析获得用于可拉酸生产的3d模型的每个系数。基于固定模型,使用design-expert 7.0(美国明尼苏达州明尼阿波利斯市stat-ease)绘制响应面图,以找到用于生产可拉酸的胰蛋白胨和na2hpo4的最佳浓度。
[0086]
结果如表5所示,回归分析结果如表6所示。基于这些,在3d表面图(图5)中表示随胰蛋白胨和na2hpo4浓度而变化的可拉酸的产量。之后,进行了确认实验以找到导致可拉酸的最大产量的点。
[0087]
[表5]ccd的实验设计及其结果
[0088][0089]ax2=(x
2-2.9)/0.2;x3=(x
3-10.98)/0.6
[0090]b数据按一式三份实验的平均值
±
标准偏差来表示
[0091]
[表6]ccd结果的回归分析
[0092][0093]
*r2=0.8682
[0094]
[例9]最佳培养基的确定
[0095]
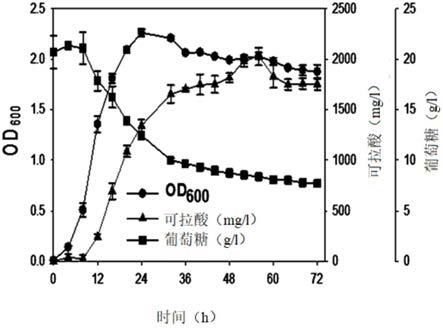
作为在含有20.00g/l葡萄糖、2.63g/l胰蛋白胨、10.62g/l na2hpo4、3.00g/l kh2po4、0.50g/l nacl、0.24g/l mgso4和0.011g/l cacl2的发酵培养基中于25℃和200rpm下培养的结果,确认按照最佳条件,最大的可拉酸产量为2052.8mg/l(图6)。确认该产量是m9培养基优化前的产量约10倍的值。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
