1.本发明涉及用于治疗人类免疫缺陷病毒(hiv)感染的化合物、组合物和方法。更具体地,本发明提供了新的hiv抑制剂、含有此类化合物的药物组合物以及使用这些化合物治疗hiv感染的方法。本发明还涉及制备下文所述化合物的方法。
背景技术:
2.获得性免疫缺陷综合征(aids)是hiv感染的结果。hiv仍然是一个主要的全球公共卫生问题。2015年,估计有3670万人感染hiv(包括180万儿童),全球hiv流行率为0.8%。该数字的绝大多数生活在低收入和中等收入国家。同年,110万人死于aids相关疾病。
3.目前hiv感染个体的治疗由已获批的抗逆转录病毒剂的组合组成。目前有近四十多种药物被批准用于hiv感染,作为单一药剂、固定剂量组合或单一片剂方案;后两种含有2-4种批准的药剂。这些药剂属于许多不同的类别,在病毒复制周期中靶向病毒酶或病毒蛋白的功能。因此,药剂被分类为核苷酸逆转录酶抑制剂(nrti)、非核苷酸逆转录酶抑制剂(nnrti)、蛋白酶抑制剂(pi)、整合酶链转移抑制剂(insti)或进入抑制剂(一种,马拉韦罗(maraviroc),靶向宿主ccr5蛋白,而另一种,恩夫韦地(enfuvirtide),是靶向病毒gp160蛋白的gp41区域的肽)。此外,药代动力学增强剂(可比司他(cobicistat)或利托那韦(ritonavir))可与需要加强的抗逆转录病毒剂(arv)联合使用。
4.尽管有各种药剂和药物组合,但仍然存在新的抗逆转录病毒药剂的医疗需求。高病毒异质性、药物相关毒性、耐受性问题和依从性差都可导致治疗失败,并可导致选择具有突变的病毒,从而对一种或多种抗逆转录病毒剂或甚至来自整个类别的多种药物产生耐药性(beyrer,c.,pozniak a.hiv drug resistance
–
an emerging threat to epidemic control.n.engl.j.med.2017,377,1605-1607;gupta,r.k.,gregson j.,等人,hiv-1drug resistance before initiation or re-initiation of first-line antiretroviral therapy in low-income and middle-income countries:a systematic review and meta-regression analysis.lancet infect.dis.2017,18,346-355;zazzi,m.,hu,h.,prosperi,m.the global burden of hiv-1drug resistance in the past 20years.peerj.2018,doi10.7717/peerj.4848)。因此,需要新的药物,其更易于服用,对耐药性的发展具有高的遗传障碍,并且相对于目前的药剂具有改善的安全性。在这种广泛的选择中,可用作优选的抗逆转录病毒疗法(art)的一部分的新作用机制(moa)仍可发挥主要作用,因为它们应有效对抗对当前药剂具有耐药性的病毒。使药物更容易长期服用或甚至终生服用的改进可包括以下全部或部分:减少的副作用、减少的药物-药物相互作用、增加的给药间隔或符合个体患者偏好的替代施用途径。提高安全性的目标明确地包括对任何会导致停止给药的毒性的高治疗指数,并且还可以包括减少的副作用或减少的药物-药物相互作用。在联合方案中使用较少的总药物的可能性也可能导致改善的依从性和安全性。增加的抗病毒靶标的效力,特别是如果在人血浆和血清白蛋白的存在下维持,也将导致剂量
减少,并且可以直接和积极地影响给药的持续时间和治疗指数,而非副作用和毒性。总之,如果发现具有新作用机制的抗hiv药物,其也具有上述促进长期依从性和安全性的其它益处,则将实现对hiv感染患者的最大益处。
5.某些潜在的治疗性化合物现已在本领域中描述并列于blair,wade s.等人,antimicrobial agents and chemotherapy(2009),53(12),5080-5087,blair,wade s.等人,plos pathogens(2010),6(12),e1001220,thenin-houssier,suzie;valente,susana t.current hiv research,2016,14,270-282,以及以下编号的pct专利申请:wo 2012065062、wo 2013006738、wo 2013006792、wo 2014110296、wo 2014110297、wo 2014110298、wo 2014134566、wo 2015130964、wo2015130966、wo 2016033243、wo2018035359和wo2018203235。
6.本领域现在需要的是新的并且可用于治疗hiv的其它化合物。另外,这些化合物应提供药物用途的优势,例如,在其作用机制、结合、抑制功效、靶标选择性、溶解度、安全性、生物利用度和/或降低的给药频率中的一种或多种。还需要使用这些化合物的新制剂和治疗方法。
技术实现要素:
7.简而言之,在一个方面,本发明公开了以下描述的化合物
[0008][0009]
及其药学上可接受的盐(下文称为“本发明的化合物和盐”)。
[0010]
在另一方面,本发明公开了包含本发明的化合物或盐的药物组合物。
[0011]
在另一方面,本发明公开了治疗人类hiv感染的方法,其包括施用本发明的化合物或盐。
[0012]
在另一方面,本发明公开了本发明的化合物或盐,其用于治疗。
[0013]
在另一方面,本发明公开了本发明的化合物或盐,其用于治疗人类hiv感染。
[0014]
在另一方面,本发明公开了本发明的化合物或盐在制备用于治疗人类hiv感染的药物中的用途。
附图说明
[0015]
图1为下述研究中大鼠的平均血浆浓度-时间曲线的总结。
具体实施方式
[0016]
优选地,本发明的化合物和盐具有如下所示的立体化学:
丙二醇(tris,氨丁三醇)、精氨酸、苯乙胺(n-苄基苯乙胺)、苄星(n,n'-二苄基乙二胺)、双-(2-羟乙基)胺、铋、钙、氯普鲁卡因、胆碱、克立咪唑(1-对氯苄基-2-吡咯烷-1'-基甲基苯并咪唑)、环己胺、二苄基乙二胺、二乙胺、二乙基三胺、二甲胺、二甲基乙醇胺、多巴胺、乙醇胺、乙二胺、l-组氨酸、铁、异喹啉、勒皮啶、锂、赖氨酸、镁、葡甲胺(n-甲基葡糖胺)、哌嗪、哌啶、钾、普鲁卡因、奎宁、喹啉、钠、锶、叔丁胺和锌。
[0023]
在一个实施方案中,酸加成盐选自盐酸盐、氢溴酸盐、氢碘酸盐、硫酸盐、硫酸氢盐、硝酸盐、磷酸盐、磷酸氢盐、乙酸盐、苯甲酸盐、琥珀酸盐、糖酸盐、富马酸盐、马来酸盐、乳酸盐、柠檬酸盐、酒石酸盐、葡糖酸盐、樟脑磺酸盐、甲磺酸盐、乙磺酸盐、苯磺酸盐、对甲苯磺酸盐和双羟萘酸盐。在一个实施方案中,碱加成盐包括金属盐(诸如钠、钾、铝、钙、镁和锌)和铵盐(诸如异丙胺、二乙胺、二乙醇胺盐)。其它盐(诸如三氟乙酸盐和草酸盐)可用于制备本发明的化合物和盐,并且包括在本发明的范围内。
[0024]
本发明化合物的盐的所有可能的化学计量和非化学计量形式都包括在本发明的范围内。酸加成盐和碱加成盐可以由熟练的化学家通过用适当的酸或碱在合适的溶剂中处理本发明的化合物,然后结晶和过滤来制备。
[0025]
本发明的药物组合物还包含药学上可接受的载体、赋形剂和/或稀释剂。在一个实施方案中,本发明的药物组合物还包含药学上可接受的赋形剂。
[0026]
在本发明的方法中,优选的施用途径为口服和通过注射以皮下或肌内递送。因此,优选的药物组合物包括适于口服施用的组合物(例如片剂)和适于注射(例如皮下或肌内注射)的组合物。
[0027]
在另一方面,本发明公开了预防人类hiv感染或降低感染风险的方法,其包括施用本发明的化合物或盐。暴露前预防(或prep)是处于hiv感染风险的人每天服用药物以降低其hiv感染的机会。已证明prep可有效降低感染风险。如本文所用,“hiv”或“人类免疫缺陷病毒”是指hiv-1和/或hiv-2。
[0028]
本发明的化合物和盐被认为具有hiv衣壳作为其生物靶标,因此其作用机制是以一种或多种方式修饰hiv衣壳的功能。例如,本发明的化合物和盐可用作衣壳抑制剂。
[0029]
本发明的化合物和盐可单独使用或与其它治疗剂组合使用。因此,根据本发明的联合治疗包括施用至少一种本发明的化合物或盐,以及施用至少一种可用于治疗hiv感染的其它药剂。本发明的化合物和盐以及任何其它药学活性剂可以一起或分开施用,并且当分开施用时,施用可以同时或以任何顺序依次进行。例如,本发明的化合物或盐和其它药剂可以在单一药物组合物中一起配制和施用或可以分开配制和施用。
[0030]
将选择本发明的化合物和盐以及其它药物活性剂的量和施用的相对时机,以实现所需的联合治疗效果。本发明化合物及其盐、溶剂化物或其它药学上可接受的衍生物与其它治疗剂可通过以下组合来组合施用:(1)包含多种化合物的单一药物组合物;或(2)各自包含所述化合物之一的单独的药物组合物。或者,该组合可以按顺序分开施用,其中首先施用一种治疗剂,然后施用另一种,反之亦然,如果合适,可以按不同的时间表施用不同的药剂。这种顺序施用可以在时间上接近或在时间上远离。将选择本发明化合物或其盐和其它药学活性剂的量和施用的相对时机以实现所需的联合治疗效果。
[0031]
因此,本发明的化合物和盐可以与一种或多种用于预防或治疗hiv的药剂组合使用。此类药剂包括,例如,核苷hiv逆转录酶抑制剂、非核苷hiv逆转录酶抑制剂、hiv蛋白酶
抑制剂、hiv融合抑制剂、hiv附着抑制剂、ccr5抑制剂、cxcr4抑制剂、hiv出芽或成熟抑制剂和hiv整合酶抑制剂。合适的其它药剂包括,例如,阿巴卡韦(abacavir)、阿扎那韦(atazanavir)、比克替拉韦(bictegravir)、卡波特韦(cabotegravir)、地瑞那韦(darunavir)、地拉夫定(delavirdine)、去羟肌苷(didanosine)、双脱氧肌苷(dideoxyinosine)、度鲁特韦(dolutegravir)、多拉韦林(doravirine)、依法韦仑(efavirenz)、埃替格韦(elvitegravir)、恩曲他滨(emtricitabine)、etavirine、fosamprenavir、fostemsavir、gsk3640254、茚地那韦(indinavir)、slatravir、拉米夫定(lamivudine)、洛匹那韦(lopinavir)、马拉韦罗、奈非那韦(nelfinavir)、奈韦拉平(nevirapine)、雷格拉韦(raltegravir)、rilpiverine、利托那韦(ritonavir)、沙奎那韦(saquinavir)、slatravir、司他夫定(stavudine)、替拉那韦(tipranavir)、替诺福韦(tenofovir)、替诺福韦艾拉酚胺(tenofovir alafenamide)、富马酸替诺福韦二吡呋酯(tenofovir disoproxil fumarate)、扎西他滨(zalcitabine)、齐多夫定(zidovudine)、抗体n6ls、gsk3739937/vh3739937和s-648414。其它合适的其它药剂包括度鲁特韦、拉米夫定、fostemsavir、卡波特韦、马拉韦罗、rilpiverine、阿扎那韦(reyataz)、替诺福韦、afenamide、efda、多拉韦林和preziata。其它合适的其它药剂包括度鲁特韦、拉米夫定、fostemsavir和卡波特韦。优选的药剂包括,例如,比克替拉韦、卡波特韦、度鲁特韦、fostemsavir、islatravir和拉米夫定。特别优选的药剂包括,例如,比克替拉韦、卡波特韦、度鲁特韦、fostemsavir和拉米夫定。
[0032]
实施例
[0033]
双环[3.1.0]己-3-醇的制备
[0034][0035]
在n2气氛下,在0-5℃,在3小时内向环戊-3-烯醇(130g,1545mmol)在dcm(1200ml)中的搅拌溶液中滴加二乙基锌的己烷(1.0m,3091ml,3091mmol)。在0℃在1小时内向该溶液中滴加二碘甲烷(249ml,3091mmol)的dcm溶液(300ml)。使反应混合物升温至27℃,此时观察到白色沉淀的形成。将混合物搅拌16小时。通过tlc(sio2,20%etoac/石油醚,rf=0.3,uv-无活性,pma-活性)监测反应进程。通过小心加入饱和nh4cl水溶液(1.5l)淬灭反应混合物。将混合物通过硅藻土垫过滤。将水层用dcm(2
×
1l)萃取。将合并的有机层用无水na2so4干燥,过滤,然后减压浓缩,得到粗品双环[3.1.0]己-3-醇,其为红色液体,180g。1h nmr(400mhz,cdcl3)δ=4.41-4.35(m,1h),2.18-2.05(m,2h),1.73(d,j=13.9hz,2h),1.35-1.25(m,2h),1.21-1.14(m,1h),0.57-0.43(m,2h).gcms:m/z=98.1).
[0036]
双环[3.1.0]己-3-酮的制备
[0037][0038]
在n2气氛下,在0℃,向双环[3.1.0]己-3-醇(210g,2054mmol)在dcm(5000ml)中的搅拌溶液中分批加入戴斯马丁氧化剂(dess-martin periodinane)(954g,225mmol)。使混合物升温至27℃,然后搅拌16小时。通过tlc(sio2,20%丙酮/己烷,rf=0.3,uv非活性,pma活性)监测反应进程。将反应混合物通过硅藻土垫过滤,并将滤液用naoh水溶液(1n,8
×
1l)洗涤。将合并的水相用dcm(5x 1l)萃取。将合并的有机层用无水na2so4干燥,过滤,然后减压
浓缩(浴温:20℃),得到粗品双环[3.1.0]己-3-酮,其为棕色液体。将该液体通过在70℃向下蒸馏进一步纯化,得到双环[3.1.0]己-3-酮,其为浅黄色粘性液体,125g(62%)。1h nmr(400mhz,cdcl3)δ=2.61-2.54(m,2h),2.17-2.12(m,2h),1.54-1.46(m,2h),0.92-0.86(m,1h),-0.01
‑‑
0.08(m,1h);gcms:m/z=96.1.
[0039]
2-(2,2-二氟乙酰基)双环[3.1.0]己-3-酮的制备
[0040][0041]
在n2气氛下,在-78℃,向双环[3.1.0]己-3-酮(125g,1274mmol)在thf(1500ml)中的搅拌溶液中加入lda(2.0m,在thf中,0.701l,1402mmol)。将溶液在-78℃搅拌1小时。在30分钟内向该溶液中缓慢加入二氟乙酸乙酯(174g,1402mmol)的thf溶液(300ml),保持温度为-78℃。使反应混合物升温至27℃,然后搅拌1小时。通过tlc(sio2,20%丙酮/己烷,rf=0.3,uv-活性)监测反应进程。通过添加hcl水溶液(1n,2000ml)淬灭反应混合物。将混合物搅拌30分钟。然后用etoac(3
×
1000ml)萃取。将合并的有机层用盐水(1000ml)洗涤,经无水na2so4干燥并过滤。将滤液减压浓缩,得到2-(2,2-二氟乙酰基)双环[3.1.0]己-3-酮,其为浅黄色粘稠液体,180g(71%)。1h nmr(400mhz,cdcl3)δ=6.18(t,j=54.8hz,1h),2.70-2.62(m,1h),2.35(d,j=19.4hz,1h),2.14(br s,1h),1.26-1.21(m,1h),1.04-1.03(m,1h),0.22-0.21(m,1h),lcms:m/z=173.17).
[0042]
2-(3-(二氟甲基)-3b,4,4a,5-四氢-1h-环丙并[3,4]环戊并[1,2-c]吡唑-1-基)乙酸乙酯的制备
[0043][0044]
在n2气氛下,在27℃,向2-(2,2-二氟乙酰基)双环[3.1.0]己-3-酮(180g,910mmol)在乙醇(2l)中的搅拌溶液中加入2-肼基乙酸乙酯盐酸盐(422g,2729mmol),然后加入硫酸(20ml,375mmol)。将混合物搅拌30分钟,然后加热至100℃并搅拌16小时。通过tlc(sio2,20%丙酮/己烷,rf=0.3,uv-活性)监测反应进程。将反应混合物减压浓缩。将残余物溶于etoac(2000ml),并用水(2
×
1l)、盐水(1.0l)洗涤,用无水na2so4干燥,过滤,然后减压浓缩。将所得残余物经硅胶柱色谱(石油醚(pet.):丙酮100:0
→
98:2),得到2-(3-(二氟甲基)-3b,4,4a,5-四氢-1h-环丙并[3,4]环戊并[1,2-c]吡唑-1-基)乙酸乙酯,其为灰白色固体,110g(46%)。1h nmr(400mhz,dmso-d6)δ=6.86(t,j=54.8hz,1h),4.93(s,2h),4.14(q,j=7.2hz,2h),2.88-2.79(m,1h),2.76-2.68(m,1h),2.14-2.04(m,2h),1.19(t,j=7.2hz,3h),1.10-1.03(m,1h),0.14(q,j=4.3hz,1h).
[0045]
2-(3-(二氟甲基)-5-氧代-3b,4,4a,5-四氢-1h-环丙并[3,4]环戊并[1,2-c]吡唑-1-基)乙酸乙酯的制备
[0046][0047]
在0℃,向2-(3-(二氟甲基)-3b,4,4a,5-四氢-1h-环丙并[3,4]环戊并[1,2-c]吡唑-1-基)乙酸乙酯(110g,422mmol)和硅藻土(395g)在环己烷(3.5l)中的搅拌溶液中分批加入重铬酸吡啶盐(794g,2110mmol)。在氮气气氛下,在10分钟内向该混合物中滴加叔丁基氢过氧化物(355ml,2130mmol)。将反应混合物温热至27℃,然后在该温度搅拌48小时。通过tlc(sio2,30%丙酮/石油醚,rf=0.4,uv-活性)监测反应进程。将反应混合物过滤,并将滤饼用etoac(1000ml)萃取。将滤液用饱和na2s2o3水溶液(2x500ml);饱和feso4水溶液(300ml)洗涤;然后用盐水(500ml)洗涤。将有机层用无水na2so4干燥,过滤并减压浓缩,得到粗品标题化合物(150g)。
[0048]
2-(3-(二氟甲基)-4,4a-二氢螺[环丙并[3,4]环戊并[1,2-c]吡唑-5,2'-[1,3]二硫戊环]-1(3bh)-基)乙酸乙酯的制备
[0049][0050]
在氮气气氛下,在27℃,向2-(3-(二氟甲基)-5-氧代-3b,4,4a,5-四氢-1h-环丙并[3,4]环戊并[1,2-c]吡唑-1-基)乙酸乙酯(75g,269mmol)在dcm(1500ml)中的搅拌溶液中加入乙烷-1,2-二硫醇(43.0ml,511mmol),然后加入三氟化硼乙酸(72.6ml,511mmol)。将该溶液搅拌16小时。通过tlc(sio2,20%丙酮/石油醚,rf=0.35,uv活性)监测反应进程。完成后,将反应混合物冷却至0℃,并通过加入饱和nahco3水溶液(500ml)淬灭。将混合物用dcm(2
×
1000ml)萃取。将合并的有机物用盐水(1000ml)洗涤,用无水na2so4干燥,过滤并减压浓缩,得到棕色液体。将该物质经硅胶柱色谱(石油醚:etoac 95:5
→
90:10),得到2-(3-(二氟甲基)-4,4a-二氢螺[环丙并[3,4]环戊并[1,2-c]吡唑-5,2'-[1,3]二硫戊环]-1(3bh)-基)乙酸乙酯,其为灰白色固体,80g(74%)。1h-nmr(400mhz,cdcl3)δ=6.61(t,j=55.2hz,1h),5.00-4.85(m,2h),4.29-4.19(m,2h),3.55-3.46(m,4h),2.63-2.53(m,1h),2.49-2.38(m,1h),1.30-1.24(m,4h),0.65-0.60(m,1h).lcms m h=346.9.
[0051]
2-(3-(二氟甲基)-5,5-二氟-3b,4,4a,5-四氢-1h-环丙并[3,4]环戊并[1,2-c]吡唑-1-基)乙酸乙酯的制备
[0052][0053]
在n2气氛下,在-70℃,向1,3-二溴-5,5-二甲基咪唑烷-2,4-二酮(26.3g,92mmol)
在dcm(20ml)中的搅拌溶液中加入hf-吡啶(2.460g,24.83mmol)。将溶液保持30分钟。向该溶液中加入2-(3-(二氟甲基)-4,4a-二氢螺[环丙并[3,4]环戊并[1,2-c]吡唑-5,2'-1,3]二硫戊环]-1(3bh)-基)乙酸乙酯(10g,25mmol)的dcm溶液(20ml)。使反应混合物温热至-40℃,然后在该温度搅拌1小时。通过tlc(sio2,30%etoac/石油醚,rf=0.3,uv无活性)监测反应进程。通过加入饱和nahco3水溶液(200ml)淬灭反应混合物。将混合物温热至室温,然后用etoac(2
×
100ml)萃取。将合并的有机物用盐水(50ml)洗涤;经无水na2so4干燥;过滤;减压浓缩,得到棕色固体。将该物质经硅胶柱色谱(石油醚:etoac 100:0
→
75-25),得到2-(3-(二氟甲基)-5,5-二氟-3b,4,4a,5-四氢-1h-环丙并[3,4]环戊并[1,2-c]吡唑-1-基)乙酸乙酯,其为浅黄色固体,8.5g(91%)。1h nmr(400mhz,cdcl3)δ=6.62(t,j=55.2hz,1h),4.82(s,2h),4.30-4.18(m,2h),2.51-2.37(m,2h),1.42-1.35(m,1h),1.31-1.23(m,3h),1.14-1.08(m,1h).lcms m h=293.07.
[0054]
2-(3-(二氟甲基)-5,5-二氟-3b,4,4a,5-四氢-1h-环丙并[3,4]环戊并[1,2-c]吡唑-1-基)乙酸的制备
[0055][0056]
在n2气氛下,在0℃,向2-(3-(二氟甲基)-5,5-二氟-3b,4,4a,5-四氢-1h-环丙[3,4]环戊并[1,2-c]吡唑-1-基)乙酸乙酯(15g,50mmol)在thf(17ml)和meoh(66ml)中的搅拌溶液中加入lioh(1.788g,74.7mmol)的水溶液(66ml)。使反应混合物升温至27℃,然后在该温度搅拌3小时。通过tlc(sio2,5%meoh/dcm,rf=0.2,uv活性)监测反应进程。完成后,将反应混合物减压浓缩;用水(50ml)稀释;并用etoac(2
×
250ml)洗涤以除去杂质。将水层用hcl水溶液(1m)调节至ph 2-3,然后用etoac(3
×
1000ml)萃取。将合并的有机物用无水na2so4干燥;过滤;并减压浓缩,得到2-(3-(二氟甲基)-5,5-二氟-3b,4,4a,5-四氢-1h-环丙并[3,4]环戊并[1,2-c]吡唑-1-基)乙酸,其为灰白色固体,14g(98%)。lcms m h=265.15.
[0057]
分离得到2-((3bs,4ar)-3-(二氟甲基)-5,5-二氟-3b,4,4a,5-四氢-1h-环丙并[3,4]环戊并[1,2-c]吡唑-1-基)乙酸和2-((3br,4as)-3-(二氟甲基)-5,5-二氟-3b,4,4a,5-四氢-1h-环丙并[3,4]环戊并[1,2-c]吡唑-1-基)乙酸
[0058][0059]
将2-(3-(二氟甲基)-5,5-二氟-3b,4,4a,5-四氢-1h-环丙并[3,4]环戊并[1,2-c]吡唑-1-基)乙酸(5.5g)溶解于异丙醇(20ml)中。将该溶液按如下分批进行sfc手性分离:仪器=thar 80;柱=chiralpak ic 30x250mm,5微米;溶剂a=超临界co2;溶剂b=含有0.5%异丙胺(v/v)的异丙醇;洗脱液组成=70%a:30%b;流速=65g/min;背压=100巴;温度=30℃;进样量=2.5ml;检测=220nm。收集2-((3bs,4ar)-3-(二氟甲基)-5,5-二氟-3b,4,4a,5-四氢-1h-环丙并[3,4]环戊并[1,2-c]吡唑-1-基)乙酸在7.5分钟至14分钟的洗脱峰;
收集2-((3br,4as)-3-(二氟甲基)-5,5-二氟-3b,4,4a,5-四氢-1h-环丙并[3,4]环戊并[1,2-c]吡唑-1-基)乙酸在2.7分钟至5.8分钟的洗脱峰。对于每种对映异构体,将所得溶液进行减压浓缩并将所得固体溶解于etoac中,然后依次用柠檬酸水溶液(1m)、水和盐水洗涤两次。将有机溶液经na2so4干燥;过滤;然后真空浓缩,得到分离的对映异构体,回收率为80-90%。
[0060]
3-溴-6-氯-2-氟苯甲腈的制备
[0061][0062]
在室温,向3-溴-6-氯-2-氟苯甲醛(210.0g,0.89mol,1.0当量)在水(2.1l)中的搅拌溶液中加入羟胺-o-磺酸(175.15g,1.55mol,1.75当量)。将反应混合物加热至50℃并搅拌18小时。将混合物冷却至室温并搅拌1-1.5小时。将固体通过过滤分离,然后用水洗涤。将湿固体在50℃真空干燥12-15小时,得到3-溴-6-氯-2-氟苯甲醛,190.0g(91%)。
[0063]
7-溴-4-氯-1-甲基-1h-吲唑-3-胺的制备
[0064][0065]
在25-35℃,向3-溴-6-氯-2-氟苯甲腈(360.0g,1.55mol,1.0当量)的乙醇溶液(1.08l)中加入甲基肼硫酸盐(1.11kg,7.73mol,5.0当量),然后加入三乙胺(1.3l,9.3mol,6.0当量)。将反应混合物加热至110℃并保持15小时(通过tlc监测反应)。反应完成后,将混合物冷却至室温。加入水(3.0l)并将混合物在室温搅拌1小时。将固体通过过滤分离并用水洗涤。将湿固体在50℃真空干燥12-15小时。将粗品固体经柱色谱(10%ea/己烷至40%ea/己烷),得到产物,其为浅黄色固体。收率:185.0g(46.0%)。
[0066]
n-(7-溴-4-氯-1-甲基-1h-吲唑-3-基)甲磺酰胺的制备
[0067][0068]
向7-溴-4-氯-1-甲基-1h-吲唑-3-胺(1.40g,5.37mmol)的dcm溶液(30ml)中加入hunig碱(3.75ml,21.5mmol),然后将反应在冰浴中冷却,并加入甲磺酰氯(1.26ml,16.1mmol)。将反应混合物在该温度搅拌1小时(形成沉淀)。然后将混合物用二氯甲烷(100ml)稀释并用水、1m hcl和盐水洗涤,干燥(na2so4),过滤并真空浓缩。将残余物溶于etoh(30ml)和10ml 20%naoh水溶液中。将所得混合物用热风枪加热直至其变成均质溶液并在室温搅拌30分钟。将混合物用水(80ml)稀释并用1n hcl(60ml)酸化。将沉淀过滤,用水洗涤,真空干燥,得到标题产物(1.5g),其为灰白色固体。1h nmr(500mhz,cdcl3)δ7.48(d,j=7.9hz,1h),7.24(br s,1h),6.95(d,j=7.9hz,1h),4.38(s,3h),3.42(s,3h).lc/ms(m h)
=337.80.
[0069]
n-(7-溴-4-氯-1-甲基-1h-吲唑-3-基)-n-(4-甲氧基苄基)甲磺酰胺的制备
[0070][0071]
向n-(7-溴-4-氯-1-甲基-1h-吲唑-3-基)甲磺酰胺(1.3g,3.84mmol)和1-(氯甲基)-4-甲氧基苯(0.625ml,4.61mmol)在dmf(30ml)中的混合物中加入碳酸铯(1.626g,4.99mmol)并将该混合物在80℃加热2小时。将混合物倒入水(100ml)中并用etoac(50ml,2x)萃取。将合并的有机层用盐水洗涤,用mgso4干燥,过滤并真空浓缩。将残余物通过bioateg(0~35%etoac-己烷)纯化,得到标题产物(1.5g),其为白色泡沫。1h nmr(500mhz,cdcl3)δ7.44(d,j=7.9hz,1h),7.31(d,j=8.5hz,2h),6.99(d,j=7.9hz,1h),6.84(d,j=8.5hz,2h),4.99(br s,1h),4.76(br s,1h),4.40(s,3h),3.80(s,3h),3.01(s,3h).
[0072]
n-(7-氨基-4-氯-1-甲基-1h-吲唑-3-基)-n-(4-甲氧基苄基)甲磺酰胺的制备
[0073][0074]
按照参考文献:andersen,jacob et al,synlett 2005(14),2209-2213。向n-(7-溴-4-氯-1-甲基-1h-吲唑-3-基)-n-(4-甲氧基苄基)甲磺酰胺(600.0mg,1.308mmol)、碘化亚铜(i)(49.8mg,0.262mmol)、抗坏血酸钠(518mg,2.62mmol)和(1r,2r)-n1,n2-二甲基环己烷-1,2-二胺(46.5mg,0.327mmol)在nmp(10ml)中的混合物中加入叠氮化钠(255mg,3.92mmol)的水溶液(2.0ml)。然后将混合物密封并在微波系统中在120℃加热2.5小时。然后将混合物通过硅藻土垫过滤并用etoac洗涤该垫。将滤液倒入水(100ml)中并用etoac(50ml,2x)萃取。将合并的有机层用盐水洗涤,经mgso4干燥,过滤并真空蒸发。将残余物通过bioatge(5-100%etoac/己烷)纯化,得到标题产物(400mg),其为灰白色固体。1h nmr(400mhz,cdcl3)δ7.33-7.29(m,2h),6.89(d,j=7.8hz,1h),6.85-6.79(m,2h),6.48(d,j=7.8hz,1h),5.11(br.s,1h),4.81(br.s,1h),4.30(s,3h),3.80(br s,2h),3.79(s,3h),2.99(s,3h).lc/ms(m h)
=395.00.
[0075]
2-氨基-6-(苄氧基)烟酸的制备
[0076][0077]
将2-氨基-6-氯烟酸(5g,29mmol)和叔丁醇钾(9.75g,87mmol)的苯甲醇溶液(97ml)加热至120℃持续3小时。冷却至环境温度后,将非常暗的反应混合物加入到水中并用乙醚(
×
3)洗涤。然后将水层用0.5m柠檬酸酸化。过滤棕褐色沉淀,得到产物(4.4g,
62%),其无需进一步纯化即用于下一反应中。1h nmr(500mhz,dmso-d6)δ12.40(br s,1h),7.94(d,j=8.55hz,1h),7.06-7.52(m,5h),6.04(d,j=8.24hz,1h),5.33(s,2h).lc/ms:m/z=245.15[m 1]
.
[0078]
n-[(6p)-7-{2-[(1s)-1-氨基-2-(3,5-二氟苯基)乙基]-7-羟基-4-氧代-3h,4h-吡啶并[2,3-d]嘧啶-3-基}-4-氯-1-甲基-1h-吲唑-3-基]-n-[(4-甲氧基苯基)甲基]甲磺酰胺的制备
[0079]
方案:
[0080][0081]
步骤1:
[0082]
在-25℃,向(s)-2-((叔丁氧基羰基)氨基)-3-(3,5-二氟苯基)丙酸(5.49g,18.23mmol)和2-氨基-6-(苄氧基)烟酸(4.45g,18.23mmol)的乙腈悬浮液(92ml)(黄色溶液)中加入吡啶(9.83ml,122mmol),然后加入2,4,6-三丙基-1,3,5,2,4,6-三氧杂三磷杂环己烷2,4,6-三氧化物(“t3p”,45.2ml,76mmol)。将反应混合物(在加入t3p后变为澄清溶液)在-25℃至10℃搅拌4.5小时,然后加入n-(7-氨基-4-氯-1-甲基-1h-吲唑-3-基)-n-(4-甲氧基苄基)甲磺酰胺(6g,15.19mmol)并将混合物搅拌18小时,同时温热至室温。将反应混合物用乙酸乙酯稀释,依次用1n naoh、水、0.5m柠檬酸和水洗涤,然后经na2so4干燥并真空浓缩。将所得残余物在二氧化硅(330g redisep gold柱)上纯化,在15cv内使用含0-60%乙酸乙酯的己烷溶液,然后保持在60%etoac进行10cv。将所需的级分合并并浓缩得到浅黄色固体(8.1g,9.14mmol,60.1%收率),n-[(1s)-1-[(3p,3p)-7-(苄氧基)-3-(4-氯-3-{n-[(4-甲氧基苯基)甲基]甲磺酰氨基}-1-甲基-1h-吲唑-7-基)-4-氧代-3h,4h-吡啶并[2,3-d]嘧啶-2-基]-2-(3,5-二氟苯基)乙基]氨基甲酸叔丁酯(主要)和n-[(1s)-1-[(3m,3m)-7-(苄氧基)-3-(4-氯-3-{n-[(4-甲氧基苯基)甲基]甲磺酰氨基}-1-甲基-1h-吲唑-7-基)-4-氧代-3h,4h-吡啶并[2,3-d]嘧啶-2-基]-2-(3,5-二氟苯基)乙基]氨基甲酸叔丁酯(次要)。lc/ms:m/z=886.25[m 1]
.
[0083]
步骤2:
[0084]
将tfa(21.1ml,274mmol)加入(s)-(1-(7-(苄氧基)-3-(4-氯-3-(n-(4-甲氧基苄基)甲磺酰氨基)-1-甲基-1h-吲唑-7-基)-4-氧代-3,4-二氢吡啶并[2,3-d]嘧啶-2-基)-2-(3,5-二氟苯基)乙基)氨基甲酸叔丁酯(步骤1的产物,8.1g,9.14mmol)的二氯甲烷溶液(45.7ml)中。将混合物在室温搅拌2小时。将所得浅黄色溶液浓缩。将残余物溶于乙酸乙酯中,然后用1n naoh洗涤三次,然后经na2so4干燥,然后真空浓缩,得到油状残余物。将残余物在硅胶(330g redisep gold柱)上通过溶剂a:溶剂b 65:35
→
0:100(2cv),然后0:100(9cv);溶剂a=己烷;溶剂b=9:9:2己烷:乙酸乙酯:meoh的梯度方法纯化。收集第一个洗脱
异构体(主要)并真空浓缩,得到n-[(6p)-7-{2-[(1s)-1-氨基-2-(3,5-二氟苯基)乙基]-7-羟基-4-氧代-3h,4h-吡啶并[2,3-d]嘧啶-3-基}-4-氯-1-甲基-1h-吲唑-3-基]-n-[(4-甲氧基苯基)甲基]甲磺酰胺(4.1g,5.89mmol,64.5%收率)。1h nmr(500mhz,dmso-d6)δ7.86-7.98(m,1h)7.15-7.37(m,4h)6.97-7.06(m,1h)6.70-6.89(m,4h)6.40-6.48(m,1h)4.70-4.88(m,2h)3.41-3.81(m,7h)3.20-3.28(m,1h)3.08-3.12(m,3h)2.71-2.79(m,1h)1.69-2.00(m,2h).lc/ms:m/z=696.20[m 1]
.
[0085]
n-((s)-1-((3p)-3-(4-氯-3-(n-(4-甲氧基苄基)甲磺酰氨基)-1-甲基-1h-吲唑-7-基)-7-羟基-4-氧代-3,4-二氢吡啶并[2,3-d]嘧啶-2-基)-2-(3,5-二氟苯基)乙基)-2-((3bs,4ar)-3-(二氟甲基)-5,5-二氟-3b,4,4a,5-四氢-1h-环丙并[3,4]环戊并[1,2-c]吡唑-1-基)乙酰胺的制备
[0086][0087]
向n-[(6p)-7-{2-[(1s)-1-氨基-2-(3,5-二氟苯基)乙基]-7-羟基-4-氧代-3h,4h-吡啶并[2,3-d]嘧啶-3-基}-4-氯-1-甲基-1h-吲唑-3-基]-n-[(4-甲氧基苯基)甲基]甲磺酰胺(0.926g,1.330mmol)在dmf(13ml)中的搅拌溶液中加入2-((3bs,4ar)-3-(二氟甲基)-5,5-二氟-3b,4,4a,5-四氢-1h-环丙并[3,4]环戊并[1,2-c]吡唑-1-基)乙酸(0.351g,1.330mmol)、2-(3h-[1,2,3]三唑并[4,5-b]吡啶-3-基)-1,1,3,3-四甲基异磺酸鎓六氟磷酸盐(v)(“hatu”,0.531g,1.397mmol)和dipea(0.581ml,3.33mmol)。将反应混合物搅拌2小时,然后将反应混合物用水稀释并用乙酸乙酯萃取。将合并的etoac萃取物用盐水洗涤,经na2so4干燥,并真空浓缩。将粗产物通过硅胶快速色谱进行纯化,使用10-100%乙酸乙酯的己烷溶液,得到n-((s)-1-((3p)-3-(4-氯-3-(n-(4-甲氧基苄基)甲磺酰氨基)-1-甲基-1h-吲唑-7-基)-7-羟基-4-氧代-3,4-二氢吡啶并[2,3-d]嘧啶-2-基)-2-(3,5-二氟苯基)乙基)-2-((3bs,4ar)-3-(二氟甲基)-5,5-二氟-3b,4,4a,5-四氢-1h-环丙并[3,4]环戊并[1,2-c]吡唑-1-基)乙酰胺(1.1g,88%),其为灰白色泡沫状固体。lc/ms:m/z=942.25[m 1]
.
[0088]
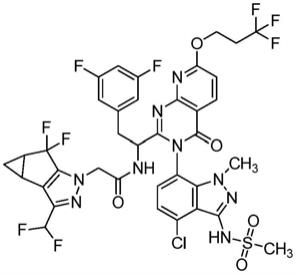
实施例1的制备:n-((s)-1-((3p)-3-(4-氯-1-甲基-3-(甲磺酰氨基)-1h-吲唑-7-基)-4-氧代-7-(3,3,3-三氟丙氧基)-3,4-二氢吡啶并[2,3-d]嘧啶-2-基)-2-(3,5-二氟苯基)乙基)-2-((3bs,4ar)-3-(二氟甲基)-5,5-二氟-3b,4,4a,5-四氢-1h-环丙并[3,4]环戊并[1,2-c]吡唑-1-基)乙酰胺
[0089][0090]
在室温,将(e)-二氮烯-1,2-二甲酸二异丙酯(“diad”,0.125ml,0.637mmol)的thf溶液(0.2ml)滴加至n-(1-((3p)-3-(4-氯-3-(n-(4-甲氧基苄基)甲磺酰氨基)-1-甲基-1h-吲唑-7-基)-7-羟基-4-氧代-3,4-二氢吡啶并[2,3-d]嘧啶-2-基)-2-(3,5-二氟苯基)乙基)-2-((3bs,4ar)-3-(二氟甲基)-5,5-二氟-3b,4,4a,5-四氢-1h-环丙并[3,4]环戊并[1,2-c]吡唑-1-基)乙酰胺(0.2g,0.212mmol)、3,3,3-三氟丙-1-醇(0.073g,0.637mmol)和三苯基膦(0.178g,0.679mmol)在四氢呋喃(2.1ml)中的混合物中。将反应混合物在室温搅拌18小时,然后真空浓缩。将残余物在硅胶(24g redisep gold柱)上纯化,在15cv内使用0-60%乙酸乙酯的己烷溶液的梯度,然后保持在60%乙酸乙酯/己烷进行5cv。将含有纯产物的级分合并,然后浓缩,得到黄色固体。将该固体溶于dcm(1ml)中:tfa(0.5ml);将溶液冷却至0℃;并向溶液中加入三氟甲磺酸(0.057ml,0.637mmol)。将混合物搅拌1小时,然后真空浓缩。将残余物溶于乙酸乙酯中;用1n naoh洗涤;用0.5m柠檬酸洗涤;经na2so4干燥;过滤;然后真空浓缩。将残余物经硅胶色谱(24g redisep gold柱),在20cv内使用0-60%乙酸乙酯的己烷溶液,然后在60%乙酸乙酯进行10cv。将含有纯产物的级分合并,然后真空浓缩,得到n-(1-((6r)-3-(4-氯-1-甲基-3-(甲磺酰氨基)-1h-吲唑-7-基)-4-氧代-7-(3,3,3-三氟丙氧基)-3,4-二氢吡啶并[2,3-d]嘧啶-2-基)-2-(3,5-二氟苯基)乙基)-2-((3bs,4ar)-3-(二氟甲基)-5,5-二氟-3b,4,4a,5-四氢-1h-环丙并[3,4]环戊并[1,2-c]吡唑-1-基)乙酰胺(0.078g,0.081mmol,38.0%收率),其为棕色固体。1h nmr(500mhz,methanol-d4)δppm 8.46-8.53(m,1h)7.28-7.34(m,1h)7.19-7.24(m,1h)7.03-7.09(m,1h)6.53-6.81(m,4h)4.80(dd,j=5.96,2.98hz,3h)4.49-4.62(m,2h)3.58-3.62(m,3h)3.40-3.49(m,1h)3.22-3.24(m,3h)3.06-3.14(m,1h)2.80-2.89(m,2h)2.37-2.44(m,2h)1.32-1.37(m,1h)0.96-1.01(m,1h).lcms分析方法:柱=acquity uplc beh c18,2.1x100mm,1.7μm颗粒;进样量=5.00μl;流速=0.80ml/min;溶剂a=95:5水:mecn w/0.1%v/v甲酸;溶剂b=5:95水:mecn w/0.1%v/v甲酸;洗脱曲线=起始%b:0,结束%b:100,梯度时间:3.5min,然后在100%b保持1分钟;检测波长1=220nm,波长2=254nm。lcms保留时间=3.097分钟;m/z=918.05[m 1]
。
[0091]
n-(7-氨基-4-氯-1-甲基-1h-吲唑-3-基)-n-(4-甲氧基苄基)甲磺酰胺的替代制备
[0092][0093]
合成方案:
[0094][0095]
步骤1:2,6-二氯-3-硝基苯甲醛的制备
[0096][0097]
在低于15℃向圆底烧瓶中的硫酸(h2so4)(5.63l,4.5v)溶液(0-5℃)中分批加入2,6-二氯苯甲醛(1.25kg,7.10mol,1.0当量)。将反应物料在0-5℃搅拌30分钟。在低于10℃,将新鲜制备的硝化混合物的溶液[由浓h2so4(0.425l,0.34v)和70%hno3(0.85kg,13.49mol,1.30当量)在0℃制备]加入到上述反应混合物中[注意:反应轻微放热(3-6℃);因此优选在较低温度添加]。将反应混合物在5-10℃搅拌2-3小时。在反应完成后(通过tlc监测),在低于25℃用冰冷水(18.75l,15v)淬灭。然后将反应物料温热至室温并搅拌2小时。将固体通过过滤分离,然后用水(2.5l,2.0v)洗涤。通过保持真空过滤60-90分钟从固体中除去大量残余水。将粗品湿固体先在空气气氛下干燥;然后在热风烘箱中在50-55℃干燥10-12小时(直至水分含量不超过5.0%),得到干燥的标题产物2,6-二氯-3-硝基苯甲醛(1.44kg,92%收率),其为黄色固体。1h nmr(400mhz,cdcl3):δ10.44(s,1h),7.88(d,j=8.4hz,1h),7.56(d,j=8.8hz,1h).
[0098]
步骤2:2,6-二氯-3-硝基苯甲腈的制备
[0099][0100]
(步骤-2a)在室温向圆底烧瓶中的dmso(5.9l,5.0v)溶液中加入2,6-二氯-3-硝基苯甲醛(1.17kg,5.31mol,1.0当量)。在室温搅拌30分钟后,加入盐酸羟胺(0.63kg,9.04mol,1.70当量),并将反应物料在室温搅拌3小时。在反应完成后(通过tlc监测),通过以足以维持温度低于30℃的速率加入冰冷水(18.0l,15.0v)淬灭反应物料(观察:加入水后形成固体)。将反应物料在室温搅拌60-90分钟。将固体通过过滤分离;用水(2.5l,2.0v)洗涤;然后用丙酮和己烷的混合物(6.0l,1:1比例)洗涤。通过保持真空过滤60-90分钟从固体中除去大量残余水。将湿固体先风干,然后最后在热风烘箱中在50-55℃干燥10-12小时(直到水分含量不超过1.0%),得到干燥的目标产物2,6-二氯-3-硝基苯甲醛肟(1.22kg,92%收率),其为灰白色固体。粗产物(其含有10-20%的2,6-二氯-3-硝基苯甲腈)无需进一步纯化直接用于下一步。
[0101]
(步骤-2b)在0-5℃,向粗品肟(上述制备,1.13kg,4.80mol,1.0当量)在dcm(9.04l,8.0v)中的搅拌溶液中加入三乙胺(“tea”,1.02kg,10.09mol,2.1当量)。搅拌5分钟后,在15℃缓慢加入甲磺酰氯(0.60kg,5.29mol,1.1当量)(观察:在添加过程中注意到放热)。然后将反应物料在室温搅拌30-45分钟。反应完成后(通过tlc监测反应进程;流动相:20%乙酸乙酯的己烷溶液),将反应物料用水(6.78l,6.0v)稀释;将有机层分离;并将水层用dcm(3.4l,3.0v)萃取。将合并的有机层用盐水(5.65l,5.0v)洗涤;经na2so4干燥;并真空浓缩。将所得粗品固体在室温与己烷(4.50l,4.0v)一起研磨。将湿物质在热风烘箱中在50-55℃干燥5-6小时,得到干燥产物2,6-二氯-3-硝基苯甲腈(0.95kg,91%收率),其为黄色固体。1h nmr(400mhz,cdcl3):δ8.07(d,j=8.8hz,1h),7.63(d,j=8.8hz,1h).
[0102]
步骤3:4-氯-7-硝基-1h-吲唑-3-胺的制备
[0103][0104]
在15-20℃向2,6-二氯-3-硝基苯甲腈(750.0g,3.45mol,1.0当量)在乙醇(7.5l,10.0v)中的搅拌溶液中缓慢加入水合肼(519.0g,10.36mol,3.0当量),同时保持反应物料低于25℃(观察:添加时会轻微放热,添加后将开始形成固体)。将反应混合物温度缓慢升至室温,然后将混合物搅拌3小时(观察:在此过程中固体的量将增加)。反应完成后(通过tlc监测),将混合物用水(7.5l,10.0v)稀释并在室温进一步搅拌1小时。将固体通过过滤分离,然后用水(2.25l,3.0v)洗涤。将湿固体用1:1比例的丙酮(1.875l,2.5v)和己烷(1.875l,2.5v)的混合物洗涤。通过保持真空过滤60-90分钟从固体中除去大量残余水。最后将湿固体在热风烘箱中在50℃干燥7-8小时(直到水分含量达到低于1.5%),得到干燥产物4-氯-7-硝基-1h-吲唑-3-胺(549.0g,75%收率),其为砖红色固体。1h nmr(400mhz,cdcl3):δ10.36(bs,1h),8.20(d,j=8.4hz,1h),7.07(d,j=8.40hz,1h),4.73(bs,2h).
[0105]
步骤4:4-氯-1-甲基-7-硝基-1h-吲唑-3-胺的制备
[0106][0107]
在5-10℃向4-氯-7-硝基-1h-吲唑-3-胺(500g,0.42mol,1.0当量)在dmf(5.0l,10.0v)中的搅拌溶液中缓慢加入碳酸铯(cs2co3)(1.91kg,5.88mol,2.5当量),同时保持反应物料低于10℃。搅拌5-10分钟后,加入硫酸二甲酯(326.3g,2.59mol,1.1当量),同时保持反应物料低于10℃(注意:为了获得更有利的区域选择性,优选缓慢添加)。然后,将反应温度缓慢升至室温,并在相同温度再继续搅拌2小时。反应完成后(通过tlc监测),通过加入冰冷的水(15.0l,30.0v)淬灭反应物料,然后将所得混合物在室温搅拌6-8小时。将固体通过过滤分离,然后用水(1.5l,3.0v)洗涤。将湿固体用ipa(1.5l,3.0v)洗涤,然后用己烷(1.0l,2.0v)洗涤。通过保持真空过滤60-90分钟从固体中除去大量残余水。将湿固体在热风烘箱中在50℃干燥7-8小时(直至水分含量低于1.0%)。分离的物质4-氯-1-甲基-7-硝基-1h-吲唑-3-胺(319.0g,60%收率)无需进一步纯化即可用于下一步。1h nmr(400mhz,cdcl3):δ7.97(d,j=8.32hz,1h),6.97(d,j=8.24hz,1h),4.63(bs,2h),3.96(s,3h).
[0108]
步骤5:n-(4-氯-1-甲基-7-硝基-1h-吲唑-3-基)甲磺酰胺的制备
[0109][0110]
(步骤5a)在0-5℃向4-氯-1-甲基-7-硝基-1h-吲唑-3-胺(625.0g,2.76mol,1.0当量)的dcm(6.25l,10.0v)溶液中加入三乙胺(tea)(837.0g,8.27mol,3.0当量);然后加入4-二甲氨基吡啶(dmap)(20.60g,0.165mol,0.06当量)。将反应物料搅拌5-10分钟,然后缓慢加入甲磺酰氯(mscl)(790.0g,6.89mol,2.5当量),同时保持反应物料低于10℃。将反应混合物温热至室温,然后搅拌1.5-2.0小时。反应完成后(通过tlc监测),将混合物用水(6.25l,10.0v)稀释,然后在室温搅拌15分钟。将有机层分离,并将水层用dcm(6.25l,10.0v)萃取。将合并的有机层用盐水(1.25l,2.0v)洗涤,经na2so4干燥并浓缩,得到粗品固体。将固体在室温与己烷(1.25l,2.0v)一起研磨,得到中间体n-(4-氯-1-甲基-7-硝基-1h-吲唑-3-基)-n-(甲磺酰基)甲磺酰胺,将其直接用于下一步。
[0111]
(ii)在室温,向n-(4-氯-1-甲基-7-硝基-1h-吲唑-3-基)-n-(甲磺酰基)甲磺酰胺(如上制备)在乙醇(10.5l,20.0v)中的搅拌溶液中缓慢加入5%naoh水溶液(4.38l,7.0v)[注:优选通过滴液漏斗缓慢添加]。将反应物料在相同温度搅拌3小时。反应完成后(通过tlc监测)[tlc分析的样品制备:将~1.0ml样品用2.0n hcl水溶液酸化至达到ph:2-3,用乙酸乙酯萃取,将有机层进行tlc分析],将反应物料冷却至0-5℃并通过加入2.0n hcl水溶液(3.13l,5.0v)将ph调节至2-3,同时保持反应温度低于10℃[注意:在加入hcl时发生沉淀并随着搅拌而增加]。将反应混合物温热至室温,然后搅拌1.5-2.0小时。将所得固体通过过滤分离,然后用水(1.25l,2.0v)洗涤;然后用己烷(1.25l,2.0v)洗涤。通过保持真空过滤60-90分钟从固体中除去大量残余水。将湿物质在热风烘箱中在50℃干燥6-7小时(直到水分含量低于1.0%),得到干燥产物n-(4-氯-1-甲基-7-硝基-1h-吲唑-3-基)甲磺酰胺(640.0g,
76%),其为黄色固体。1h nmr(400mhz,cdcl3):δ8.05(d,j=8.32hz,1h),7.32(bs,1h),7.17(d,j=8.28hz,1h),4.15(s,3h),3.45(s,3h).
[0112]
步骤6:制备n-(4-氯-1-甲基-7-硝基-1h-吲唑-3-基)-n-(4-甲氧基苄基)甲磺酰胺
[0113][0114]
在室温,向n-(4-氯-1-甲基-7-硝基-1h-吲唑-3-基)甲磺酰胺(635.0g,2.08mol,1.0当量)和1-(氯甲基)-4-甲氧基苯(359.0g,2.30mol,1.1当量)在dmf(6.35l,10.0v)中的混合物中加入碳酸钾(374.7g,2.70mol,1.3当量)。将反应混合物加热至80-90℃并在该温度保持3小时。反应完成后(通过tlc监测),将混合物倒入冰冷的水(19.05l,30.0v)中[注意:优选在剧烈搅拌下缓慢淬灭以避免产物沉淀时结块]。将所得固体通过过滤分离并用水(1.90l,3.0v)洗涤;然后用己烷(1.27l,2.0v)洗涤固体。通过保持真空过滤60-90分钟从固体中除去大量残余水。将分离的固体溶解于乙酸乙酯(12.7l,20.0v)中并加入木炭(63.5g)。将混合物加热至60-70℃,然后在该温度搅拌30-45分钟。将混合物趁热(40-50℃)通过硅藻土垫过滤,然后用乙酸乙酯(3.17l,5.0v)萃取硅藻土垫。将合并的滤液在低于50℃减压浓缩至干。在室温将乙酸乙酯(0.635l,1.0v)加入固体。将所得固体悬浮液搅拌30分钟。将固体通过过滤分离,然后用己烷(1.27l,2.0v)洗涤。通过保持真空过滤45-60分钟从固体中除去残余的水,得到产物n-(4-氯-1-甲基-7-硝基-1h-吲唑-3-基)-n-(4-甲氧基苄基)甲磺酰胺(705.0g,80%收率),其为黄色固体。1h nmr(400mhz,cdcl3):δ7.99(d,j=8.24hz,1h),7.27(d,j=8.68hz,2h),7.19(d,j=8.24hz,1h),6.80(d,j=8.44hz,2h),4.95-4.76(m,2h),4.17(s,3h),3.76(s,3h),3.01(s,3h).
[0115]
步骤7:n-(7-氨基-4-氯-1-甲基-1h-吲唑-3-基)-n-(4-甲氧基苄基)甲磺酰胺的制备
[0116][0117]
在室温,向锌粉(540.0g,8.23mol,10.0当量)在thf(3.50l,10.0v)和水(7.0l,20.0v)的混合物中的搅拌悬浮液中加入氯化铵(nh4cl)(449.0g,8.23mol,10.0当量)。向混合物中加入n-(4-氯-1-甲基-7-硝基-1h-吲唑-3-基)-n-(4-甲氧基苄基)甲磺酰胺(350g,0.823mol,1.0当量)的thf(7.0l,20.0v)溶液。将反应混合物在室温搅拌3-4小时。反应完成后(通过过程中tlc/hplc监测),将混合物用乙酸乙酯(3.5l,10.0v)和水(1.12l,2.5v)稀释。将混合物搅拌15分钟。将反应物料通过硅藻土垫过滤,用乙酸乙酯(1.75l,5.0v)洗涤。收集两相滤液,并分离各相。将水层用乙酸乙酯(3.50l,10.0v)萃取。将合并的有机层用盐水(3.50l,10v)洗涤,经na2so4干燥,然后真空浓缩,得到粗品固体。向粗产物中加入mtbe(3.25l,10v),并将悬浮液在室温搅拌30分钟。将固体通过过滤分离。通过保持真空过滤30-45分钟从固体中除去大量残余水。将湿产物在热风烘箱(50℃)中干燥2小时,得到标题产物
n-(7-氨基-4-氯-1-甲基-1h-吲唑-3-基)-n-(4-甲氧基苄基)甲磺酰胺(276.0g,85%收率),其为灰白色固体。1h nmr(400mhz,cdcl3):δ7.29-7.26(m,2h),6.86-6.79(m,2h),6.42(d,j=7.80hz,1h),4.99-4.70(m,2h),4.25(s,3h),3.77(s,5h),2.98(s,3h).
[0118]
2-氨基-6-(3,3,3-三氟丙氧基)烟酸的制备
[0119][0120]
合成方案:
[0121][0122]
步骤1:2-氨基-6-(苄氧基)烟酸的制备
[0123][0124]
在n2气氛下,在26℃,向2-氨基-6-氯烟酸(200g,1159mmol)在苯甲醇(1400ml,13464mmol)中的搅拌溶液中加入叔丁醇钾(390g,3477mmol)。将反应混合物加热至120℃并
在该温度搅拌16小时。通过tlc(sio2,10%meoh/dcm,rf=0.5)监测反应进程。完成后,将反应混合物用水(3l)稀释并用乙醚(2x1000ml)萃取。将有机层分离并将水层用柠檬酸水溶液(0.5m)酸化至ph 4。将沉淀的固体通过过滤收集,然后减压干燥,得到2-氨基-6-(苄氧基)烟酸,其为灰白色固体(220g,收率=72%)。1h nmr(400mhz,dmso-d6)δ=12.56-12.32(m,1h),7.97-7.91(m,1h),7.52-7.41(m,2h),7.38-7.11(m,5h),6.03(d,j=8.5hz,1h),5.39-5.31(m,2h).lcms purity=93%;m/z=245.29(m h).
[0125]
步骤2:2-氨基-6-(苄氧基)烟酸甲酯的制备
[0126][0127]
在n2气氛下,在26℃,向2-氨基-6-(苄氧基)烟酸(220g,901mmol)在dmf(2.5l)中的搅拌溶液中缓慢加入碳酸钾(373g,2702mmol)和碘甲烷(0.282l,4504mmol)。将反应混合物在27℃搅拌16小时。通过tlc(sio2,40%etoac/石油醚,rf=0.6)监测反应进程。完成后,将反应混合物用水(5l)稀释。将沉淀的固体通过过滤分离,然后真空干燥,得到2-氨基-6-(苄氧基)烟酸甲酯,其为灰白色固体(220g,收率=92%)。1h nmr(400mhz,cdcl3)δ=8.00(d,j=8.4hz,1h),7.42
–
7.40(m,2h),7.39
–
7.35(m,2h),7.34
–
7.31(m,1h),6.01(d,j=8.4hz,1h),5.33(s,2h),3.84(s,3h).lcms purity=97%,m/z=259.30(m h).
[0128]
步骤3:2-氨基-6-羟基烟酸甲酯的制备
[0129][0130]
在n2气氛下,在26℃,向2-氨基-6-(苄氧基)烟酸甲酯(50g,190mmol)在dcm(500ml)中的搅拌溶液中缓慢加入tfa(800ml)和三氟甲磺酸(25ml,282mmol)。将反应混合物在26℃搅拌16小时。通过tlc(sio2,etoac,rf=0.2)监测反应进程。完成后,在真空下除去挥发物,得到粗产物。将该物质与乙醚(3
×
1000ml)一起研磨,然后将沉淀的固体通过过滤分离。向固体中加入水(2l),然后将混合物搅拌5小时。将固体通过过滤收集并用水洗涤。将固体真空干燥,得到2-氨基-6-羟基烟酸甲酯,其为灰白色固体(25g,收率=78%)。1h nmr(300mhz,dmso-d6)δ=10.92
–
10.76(m,1h),7.65(d,j=9.5hz,1h),7.43
–
6.87(m,2h),5.51(d,j=9.5hz,1h),3.69(s,3h).lcms纯度=99.32%;m/z=169.32(m h).通过
19
f-nmr证实产物中不存在tfa和三氟甲磺酸。产物无需额外纯化即可直接用于下一步。
[0131]
步骤4:2-氨基-6-(3,3,3-三氟丙氧基)烟酸甲酯的制备
[0132][0133]
在氮气气氛下,在27℃,向2-氨基-6-羟基烟酸甲酯(50g,297mmol)在thf(1000ml)中的搅拌溶液中加入三苯基膦(156g,595mmol)。将反应物料冷却至0℃并向反应物料中滴加偶氮二甲酸二异丙酯(“diad”,116ml,595mmol)。将溶液搅拌30分钟。在0℃向溶液中加入3,3,3-三氟丙-1-醇(52.4ml,595mmol)的thf溶液(200ml)。然后使反应物料缓慢升温至27℃,然后在该温度搅拌16小时。通过tlc(sio2,10%etoac/石油醚,rf=0.5)监测反应过程。完成后,将反应混合物用水(500ml)稀释并用etoac(2
×
500ml)萃取。将合并的有机物用水(500ml)洗涤,然后用盐水溶液(500ml)洗涤。将有机层经无水na2so4干燥,过滤,然后减压浓缩,得到粗产物,其为黄色半固体(100g)。将该物质通过硅胶色谱纯化,用含5-10%etoac的石油醚溶液洗脱。将含有所需产物的级分合并并减压浓缩,得到2-氨基-6-(3,3,3-三氟丙氧基)烟酸甲酯,其为黄色液体(50g,60%收率)。1h-nmr(400mhz,cdcl3)δ:8.01(d,j=8.8hz,1h),7.21
–
6.85(brs,1h),6.04(d,j=8.4hz,1h),4.50(t,j=6.6hz,2h),3.84(s,3h),2.63
–
2.55(m,2h).lcms分析方法:柱=acquity beh c18(50mm
×
2.1mm,1.7um);流动相a=0.05%甲酸水溶液;流动相b=0.05%甲酸的can溶液;梯度=时间(min.)/%b:0/3,0.4/3,2.5/98,3.4/98,3.5/3,4/3;柱温=35℃;流速=0.6ml/min。lcms结果:保留时间=2.03分钟;观察到的离子=265.15(m h);lcms纯度=93%。
[0134]
步骤5:2-氨基-6-(3,3,3-三氟丙氧基)烟酸的制备
[0135][0136]
在氮气气氛下,在0℃,向2-氨基-6-(3,3,3-三氟丙氧基)烟酸甲酯(50g,189mmol)在四氢呋喃(thf)(500ml)、甲醇(150ml)和水(80ml)中的搅拌溶液中加入氢氧化锂一水合物(22.66g,946mmol)。将反应混合物在50℃搅拌16小时。通过tlc(sio2,50%etoac/石油醚,rf=0.3)。完成后,将反应混合物减压浓缩,得到含水残余物。然后通过加入1n hcl将残余物酸化至ph 4。将所得沉淀通过过滤收集,用水(500ml)洗涤,然后用正己烷(400ml)洗涤,然后干燥,得到2-氨基-6-(3,3,3-三氟丙氧基)烟酸,其为灰白色固体(45g,90%收率)。1h-nmr(400mhz,dmso-d6)δ:12.47(brs,1h),7.93(d,j=8.8hz,1h),7.35(brs,2h),5.98(d,j=8.8hz,1h),4.44(t,j=6.1hz,2h),2.84
–
2.73(m,2h).产物无需进一步纯化即可直接用于下一步。
[0137]
2-氨基-6-(3,3,3-三氟丙氧基)烟酸的替代制备
[0138][0139]
合成方案:
[0140][0141]
步骤1:2-氨基-6-氟烟酸的制备
[0142][0143]
在0℃将nh3在水中(“25%nh3在h2o中”,1l,4v)和异丙醇(6.5l,26v)的混合物鼓泡氨气1小时。向高压釜(25l)中的该混合物中加入2,6-二氟烟酸(250g,1571mmol)。然后将反应混合物在105℃搅拌20小时。通过tlc(sio2,80%etoac/石油醚,rf=0.3)监测反应进程。完成后,使反应混合物冷却至20℃,然后在低于20℃减压浓缩至体积为4-6v(1.5l)。将残余物溶于水(5l)中,通过加入2n hcl(700ml)酸化至ph 2-3,然后搅拌2小时。将所得沉淀通过过滤收集,用水(4000ml)洗涤,然后用正己烷(5000ml)洗涤,然后在真空烘箱中在50℃干燥,得到2-氨基-6-氟烟酸,其为灰白色固体(250g,92%收率)。将该产物与通过相同方法制备的其它批次的产物共混,得到2000g合并产物。通过将固体悬浮在甲苯(10l)中,然后通过蒸馏除去甲苯,从固体中除去残余溶剂。将所得固体在真空烘箱中在60℃干燥7天,得到2-氨基-6-氟烟酸,其为灰白色固体(1.6kg,77%收率)。1h-nmr(400mhz,dmso-d6)δ:12.94(brs,1h),8.17(t,j=8.8hz,1h),7.56(brs,2h),6.25(dd,j=8.2,2.8hz,1h).lcms方法:柱=acquity beh c18(50mm
×
2.1mm,1.7um);流动相a=0.05%甲酸水溶液;流动相b=0.05%甲酸的乙腈溶液;梯度=时间(min)/%b:0/3,0.4/3,2.5/98,3.4/98,3.5/3,4/3;柱温=35℃;流速=0.6ml/min。lcms结果:保留时间=1.24分钟;观察到的离子=157.04(m h);lcms纯度=96%。
[0144]
步骤2:2-氨基-6-氟烟酸甲酯的制备
[0145][0146]
向2-氨基-6-氟烟酸(150g,961mmol)和碳酸钾(398g,2882mmol)在dmf(1500ml)中的搅拌溶液中加入碘甲烷(300ml,4804mmol)。将反应混合物在27℃,在氮气气氛下搅拌16小时。通过tlc(sio2,30%etoac/石油醚,rf=0.7)监测反应进程。完成后,通过加入冰冷的水(5000ml)淬灭反应混合物。将所得沉淀通过过滤收集,用水(2000ml)洗涤,然后用正己烷(1000ml)洗涤,然后干燥,得到2-氨基-6-氟烟酸甲酯,其为棕色固体(120g,70%收率)。1h-nmr(400mhz,dmso-d6)δ:8.20(t,j=8.8hz,1h),7.54(brs,2h),6.29(dd,j=8.4,2.8hz,1h),3.82(m,3h).lcms方法:柱=acquity beh c18(50mm
×
2.1mm,1.7um);流动相a=0.05%甲酸水溶液;流动相b=0.05%甲酸的乙腈溶液;梯度=时间(min)/%b:0/3,0.4/3,2.5/98,3.4/98,3.5/3,4/3;柱温=35℃;流速=0.6ml/min。lcms结果:保留时间=1.55分钟;观察到的离子=171.07(m h);lcms纯度=96%。产物无需进一步纯化即可直接用于下一步。
[0147]
步骤3:2-氨基-6-(3,3,3-三氟丙氧基)烟酸甲酯和2-氨基-6-(3,3,3-三氟丙氧基)烟酸3,3,3-三氟丙酯的制备
[0148][0149]
在氮气气氛下,在0℃,向2-氨基-6-氟烟酸甲酯(25g,147mmol)和3,3,3-三氟丙-1-醇(15.54ml,176mmol)在thf(500ml)中的搅拌溶液中分批加入氢化钠(60%油分散液,8.82g,220mmol)。将反应混合物在0℃搅拌30分钟,然后使其缓慢升温至27℃并在该温度搅拌16小时。通过tlc(sio2,10%etoac/石油醚,rf=0.5)监测反应进程。完成后,将反应混合物冷却至0℃并用饱和nh4cl水溶液(300ml)淬灭。将混合物用etoac(2
×
500ml)萃取。将合并的有机物用盐水溶液(200ml)洗涤,经无水na2so4干燥,过滤,然后减压浓缩,得到2-氨基-6-(3,3,3-三氟丙氧基)烟酸甲酯,其为黄色液体(40g)。在反应中还观察到酯交换副产物2-氨基-6-(3,3,3-三氟丙氧基)烟酸3,3,3-三氟丙酯的形成。lcms方法:柱=acquity beh c18(50mm
×
2.1mm,1.7um);流动相a=0.05%甲酸水溶液;流动相b=0.05%甲酸的乙腈溶液;梯度=时间(min)/%b:0/97,0.4/97,2.5/2,3.4/2,3.5/97,4.0/97;柱温=35℃;流速=0.6ml/min。lcms结果:保留时间=2.04&2.22分钟;观察到的离子=265.18&347.29(m h);lcms纯度=2-氨基-6-(3,3,3-三氟丙氧基)烟酸甲酯,57%;2-氨基-6-(3,3,3-三氟丙氧基)烟酸3,3,3-三氟丙酯,15%。将该粗产物混合物与通过相同方法制备的另外两批粗产物(40g和50g)共混。将合并的物质(130g)通过硅胶色谱法纯化,用含10-20%etoac的石油醚洗脱。将含有所需产物的级分合并并减压浓缩,得到2-氨基-6-(3,3,3-三氟丙氧基)烟酸
甲酯与2-氨基-6-(3,3,3-三氟丙氧基)烟酸3,3,3-三氟丙酯的6:1混合物,其为浅黄色液体(100g,90%收率)。1h-nmr(400mhz,cdcl3)δ:8.02
–
7.97(m,1h),7.04
–
6.48(m,1h),6.08
–
6.03(m,1h),4.52
–
4.47(m,2h),3.83(s,3h),2.64
–
2.54(m,2h).lcms方法:柱=acquity beh c18(50mm
×
2.1mm,1.7um);流动相a=0.05%甲酸水溶液;流动相b=0.05%甲酸的乙腈溶液;梯度=时间(min)/%b:0/97,0.4/97,2.5/2,3.4/2,3.5/97,4.0/97;柱温=35℃;流速=0.6ml/min。lcms结果:保留时间=2.02&2.21分钟;观察到的离子=264.97&346.97(m h);lcms纯度=2-氨基-6-(3,3,3-三氟丙氧基)烟酸甲酯,66%;2-氨基-6-(3,3,3-三氟丙氧基)烟酸3,3,3-三氟丙酯,11%。
[0150]
步骤4:2-氨基-6-(3,3,3-三氟丙氧基)烟酸的制备
[0151][0152]
在氮气气氛下,在27℃,向2-氨基-6-(3,3,3-三氟丙氧基)烟酸甲酯和2-氨基-6-(3,3,3-三氟丙氧基)烟酸3,3,3-三氟丙酯(6:1,100g,310mmol)在四氢呋喃(thf)(800ml)、甲醇(300ml)和水(200ml)中的搅拌溶液中加入氢氧化锂一水合物(37.2g,1552mmol)。将反应混合物在50℃搅拌8小时。通过tlc(sio2,50%etoac/石油醚,rf=0.3)监测反应进程。完成后,将反应混合物减压浓缩,然后通过加入1n hcl将所得含水残余物酸化至ph 4。将所得沉淀通过过滤收集,用水(2000ml)洗涤,然后用正己烷(1000ml)洗涤,然后干燥,得到2-氨基-6-(3,3,3-三氟丙氧基)烟酸,其为灰白色固体(80g,97%收率)。1h-nmr(400mhz,dmso-d6)δ:12.47(brs,1h),7.93(d,j=8.4hz,1h),7.33(brs,2h),5.99(d,j=8.4hz,1h),4.45(t,j=6.2hz,2h),2.83
–
2.74(m,2h).lcms方法:柱=acquity beh c18(50mm
×
2.1mm,1.7um);流动相a=0.05%甲酸水溶液;流动相b=0.05%甲酸的乙腈溶液;梯度=时间(min.)/%b:0/3,0.4/3,2.5/98,3.4/98,3.5/3,4/3;柱温=35℃;流速=0.6ml/min。lcms结果:保留时间=1.73分钟;观察到的离子=251.17(m h);lcms纯度=94%。产物无需进一步纯化即可直接用于下一步。
[0153]
实施例1的替代制备:n-((s)-1-((3p)-3-(4-氯-1-甲基-3-(甲磺酰氨基)-1h-吲唑-7-基)-4-氧代-7-(3,3,3-三氟丙氧基)-3,4-二氢吡啶并[2,3-d]嘧啶-2-基)-2-(3,5-二氟苯基)乙基)-2-((3bs,4ar)-3-(二氟甲基)-5,5-二氟-3b,4,4a,5-四氢-1h-环丙并[3,4]环戊并[1,2-c]吡唑-1-基)乙酰胺
[0154][0155]
合成方案:
[0156][0157]
步骤1:(s)-(1-(3-(4-氯-3-(n-(4-甲氧基苄基)甲磺酰氨基)-1-甲基-1h-吲唑-7-基)-4-氧代-7-(3,3,3-三氟丙氧基)-3,4-二氢吡啶并[2,3-d]嘧啶-2-基)-2-(3,5-二氟苯基)乙基)氨基甲酸叔丁酯的制备
[0158][0159]
在氮气气氛下,在-25℃,向(s)-2-((叔丁氧基羰基)氨基)-3-(3,5-二氟苯基)丙酸(62.3g,207mmol)和2-氨基-6-(3,3,3-三氟丙氧基)烟酸(55g,207mmol)在乙腈(600ml)中的搅拌溶液中加入吡啶(41.8ml,517mmol)。在15分钟内所得混合物中滴加2,4,6-三丙
基-1,3,5,2,4,6-三氧杂三磷杂环己烷2,4,6-三氧化物(“t3p”,50%wt在etoac中,609ml,1033mmol)。将溶液在-25℃搅拌1小时,然后使其缓慢升温至13℃并搅拌5小时。在13℃向溶液中加入n-(7-氨基-4-氯-1-甲基-1h-吲唑-3-基)-n-(4-甲氧基苄基)甲磺酰胺(82g,207mmol)。然后使反应物料缓慢升温至27℃,然后在该温度搅拌16小时。通过tlc(sio2,40%etoac/石油醚,rf=0.4)监测反应进程。完成后,将反应混合物减压浓缩。将残余物溶于etoac(500ml)中,然后依次用柠檬酸水溶液(0.5m,2
×
500ml)、naoh水溶液(1n,3
×
500ml)洗涤。将有机层经na2so4干燥,过滤,然后减压浓缩,得到粗产物(180g),将其通过硅胶色谱来纯化,用40-50%etoac的石油醚溶液洗脱。将含有所需产物的级分合并并减压浓缩,得到(s)-(1-(3-(4-氯-3-(n-(4-甲氧基苄基)甲磺酰氨基)-1-甲基-1h-吲唑-7-基)-4-氧代-7-(3,3,3-三氟丙氧基)-3,4-二氢吡啶并[2,3-d]嘧啶-2-基)-2-(3,5-二氟苯基)乙基)氨基甲酸叔丁酯,其为灰白色固体(85g,39%收率)。该产物为同手性阻转异构体(非对映体)的混合物。lcms方法:柱=acquity beh c18(50mm
×
2.1mm,1.7um);流动相a=0.05%甲酸水溶液;流动相b=0.05%甲酸的乙腈溶液;梯度=时间(min)/%b:0/3,0.4/3,2.5/98,3.4/98,3.5/3,4/3;柱温=35℃;流速=0.6ml/min。lcms结果:保留时间=2.46分钟;观察到的离子=892.53(m h);lcms纯度=85%。
[0160]
步骤2:(s)-n-((6p)-7-((3p)-2-(1-氨基-2-(3,5-二氟苯基)乙基)-4-氧代-7-(3,3,3-三氟丙氧基)吡啶并[2,3-d]嘧啶-3(4h)-基)-4-氯-1-甲基-1h-吲唑-3-基)甲磺酰胺的制备
[0161][0162]
在0℃向(s)-(1-(3-(4-氯-3-(n-(4-甲氧基苄基)甲磺酰氨基)-1-甲基-1h-吲唑-7-基)-4-氧代-7-(3,3,3-三氟丙氧基)-3,4-二氢吡啶并[2,3-d]嘧啶-2-基)-2-(3,5-二氟苯基)乙基)氨基甲酸叔丁酯(85g,95mmol)在dcm(300ml)中的搅拌溶液中加入三氟乙酸(tfa,294ml,3810mmol),然后加入三氟甲磺酸(25.4ml,286mmol)。使溶液升温至27℃并在氮气气氛下搅拌1小时。通过tlc(sio2,80%etoac/石油醚,rf=0.3)监测反应进程。完成后,在温和的氮气流下除去挥发物。将残余物溶解于etoac(1000ml)中并依次用2nnaoh(2
×
500ml)和盐水(500ml)洗涤。将有机层经na2so4干燥,过滤,然后减压浓缩,得到粗产物,将其通过硅胶色谱来纯化,用50-99%etoac的石油醚溶液洗脱。将含有所需产物的级分合并并减压浓缩,得到(s)-n-(7-(2-(1-氨基-2-(3,5-二氟苯基)乙基)-4-氧代-7-(3,3,3-三氟丙氧基)吡啶并[2,3-d]嘧啶-3(4h)-基)-4-氯-1-甲基-1h-吲唑-3-基)甲磺酰胺,其为浅黄色固体(63g)。该物质为同手性阻转异构体(非对映异构体)的混合物,比例为64:26,如通过lcms测定。将该产物与通过遵循相同程序制备的另外三批产物共混。将合并的产物(195g)
溶解于甲醇:乙腈(80:20,1300ml)并将该溶液通过prep-sfc使用以下方法纯化:柱=(r,r)whelk-01(250
×
30
×
5μ);洗脱液=co2:meoh(65:35);流速=90g/min;背压=120巴;检测=214nm(uv);迭加时间(stack time)=14分钟;每次进样量=430mg。收集纯的主峰并减压浓缩,得到单一立体异构体(s)-n-((6p)-7-((3p)-2-(1-氨基-2-(3,5-二氟苯基)乙基)-4-氧代-7-(3,3,3-三氟丙氧基)吡啶并[2,3-d]嘧啶-3(4h)-基)-4-氯-1-甲基-1h-吲唑-3-基)甲磺酰胺,其为灰白色固体(113g,63%收率)。1hnmr(400mhz,dmso-d6)δ:8.42(d,j=8.8hz,1h),7.43(d,j=8.1hz,1h),7.37(d,j=8.1hz,1h),7.06(d,j=8.8hz,1h)7.03
–
6.97(m,1h),6.75
–
6.70(m,2h),4.73
–
4.69(m,2h),3.68(s,3h),3.58
–
3.52(m,1h),3.28
–
3.24(m,1h),3.22(s,3h),2.97
–
2.83(m,3h).lcms方法:柱=xbridge c18(75mm
×
4.6mm,3.5μm);流动相a=5mm碳酸氢铵水溶液;流动相b=乙腈;梯度=时间(min)/%b:0/5,0.5/5,1.0/15,4.0/98,7.0/98,7.5/5,8.0/5;柱温=35℃;流速=1.3ml/min。lcms结果:保留时间=4.03分钟;观察到的离子=672.07(m h);lcms纯度=98%;hplc纯度=98%;手性hplc纯度=98%。
[0163]
步骤3:n-((s)-1-((3p)-3-(4-氯-1-甲基-3-(甲磺酰氨基)-1h-吲唑-7-基)-4-氧代-7-(3,3,3-三氟丙氧基)-3,4-二氢吡啶并[2,3-d]嘧啶-2-基)-2-(3,5-二氟苯基)乙基)-2-((3bs,4ar)-3-(二氟甲基)-5,5-二氟-3b,4,4a,5-四氢-1h-环丙并[3,4]环戊并[1,2-c]吡唑-1-基)乙酰胺的制备
[0164][0165]
向(s)-n-((6p)-7-((3p)-2-(1-氨基-2-(3,5-二氟苯基)乙基)-4-氧代-7-(3,3,3-三氟丙氧基)吡啶并[2,3-d]嘧啶-3(4h)-基)-4-氯-1-甲基-1h-吲唑-3-基)甲磺酰胺(55g,82mmol)和2-((3bs,4ar)-3-(二氟甲基)-5,5-二氟-3b,4,4a,5-四氢-1h-环丙并[3,4]环戊并[1,2-c]吡唑-1-基)乙酸(22.70g,86mmol)在乙酸乙酯(818ml)中的搅拌溶液中加入2,6-二甲基吡啶(23.83ml,205mmol)。向混合物中滴加2,4,6-三丙基-1,3,5,2,4,6-三氧杂三磷杂环己烷2,4,6-三氧化物(“t3p”,50%wt.在乙酸乙酯中)(97ml,164mmol),此时内部温度从17℃升至24℃。将混合物在室温搅拌2小时。通过加入水(500ml)淬灭反应。将各相分配,并将有机相用水(500ml)洗涤,然后经na2so4干燥。将混合物过滤并将滤液浓缩至原始体积的1/4,得到粗产物,其为乙酸乙酯溶液。
[0166]
按照如下修改的相同程序制备第二批产物:使用(s)-n-((6p)-7-((3p)-2-(1-氨基-2-(3,5-二氟苯基)乙基)-4-氧代-7-(3,3,3-三氟丙氧基)吡啶并[2,3-d]嘧啶-3(4h)-基)-4-氯-1-甲基-1h-吲唑-3-基)甲磺酰胺(53.4g,79mmol)进行反应,并相应地调整所有
其它试剂的量。后处理以盐水(300ml)洗涤然后用mgso4干燥结束。
[0167]
将粗产物合并,然后吸附到硅藻土上。将所得粉末进行硅胶色谱(3kg redisep gold柱),用30-85%乙酸乙酯的己烷溶液洗脱。将含有所需产物的级分合并并减压浓缩,得到黄色泡沫。将该物质置于高真空下18小时。使用研钵和研杵将该物质转化为细粉,并将固体置于50℃的真空烘箱中48小时,得到n-((s)-1-((3p)-3-(4-氯-1-甲基-3-(甲磺酰氨基)-1h-吲唑-7-基)-4-氧代-7-(3,3,3-三氟丙氧基)-3,4-二氢吡啶并[2,3-d]嘧啶-2-基)-2-(3,5-二氟苯基)乙基)-2-((3bs,4ar)-3-(二氟甲基)-5,5-二氟-3b,4,4a,5-四氢-1h-环丙并[3,4]环戊并[1,2-c]吡唑-1-基)乙酰胺,其为黄色粉末(134.1g,90%收率)。1h nmr(500mhz,dmso-d6)δppm 9.84-9.91(1h,m)9.49(1h,d,j=8.34hz)8.47(1h,d,j=8.35hz)7.79(1h,d,j=7.75hz)7.49(1h,d,j=8.05hz)7.11(1h,d,j=8.64hz)6.80-7.09(2h,m)6.66(2h,dd,j=8.20,2.24hz)4.69-4.75(3h,m)4.57(1h,d,j=16.39hz)4.48(1h,ddd,j=11.03,8.35,2.68hz)3.51(3h,s)3.42(1h,dd,j=14.01,2.38hz)3.20(3h,s)3.05(1h,dd,j=14.01,11.03hz)2.89-2.99(2h,m)2.42-2.48(2h,m)1.32-1.40(1h,m)0.81-0.86(1h,m).lcms方法:柱=acquity uplc beh c18(2.1
×
100mm,1.7μm颗粒);溶剂a=水:mecn(95:5),含0.1%v/v甲酸;溶剂b=mecn:水(95:5),含0.1%v/v甲酸;梯度=时间(min)/%b:0/0,3.5/100,4.5/100;流速=0.8ml/min。lcms结果:保留时间=3.173分钟;观察到的质量=917.95(m h)。uplc纯度=99.8%。
[0168]
实施例1的命名:
[0169]
如上制备的实施例1的化合物是含有轴手性的同手性物质。轴手性可以使用i iupac gold book(doi:10.1351/goldbook.a00547)中详述的p/m命名法来描述。然而,目前仅有有限数量的能够产生包含p/m命名法的化学名称的软件工具可用,并且甚至更少的选项可用来将使用该命名法的化学名称转化为分子的结构表示。因此,为了清楚和方便,下面提供了实施例1的几个名称:
[0170]
通过chemdraw ultra 12(无p/m命名法)生成的实施例1的名称为:
[0171]
n-((s)-1-(3-(4-氯-1-甲基-3-(甲磺酰氨基)-1h-吲唑-7-基)-4-氧代-7-(3,3,3-三氟丙氧基)-3,4-二氢吡啶并[2,3-d]嘧啶-2-基)-2-(3,5-二氟苯基)乙基)-2-((3bs,4ar)-3-(二氟甲基)-5,5-二氟-3b,4,4a,5-四氢-1h-环丙并[3,4]环戊并[1,2-c]吡唑-1-基)乙酰胺
[0172]
由jchem for excel(包括p/m命名法)生成的实施例1的化学名称为:
[0173]
n-[(1s)-1-[(3p,3p)-3-(4-氯-3-甲磺酰氨基-1-甲基-1h-吲唑-7-基)-4-氧代-7-(3,3,3-三氟丙氧基)-3h,4h-吡啶并[2,3-d]嘧啶-2-基]-2-(3,5-二氟苯基)乙基]-2-[(2s,4r)-9-(二氟甲基)-5,5-二氟-7,8-二氮杂三环[4.3.0.02,4]壬-1(6),8-二烯-7-基]乙酰胺
[0174]
由chemdraw ultra 12(手动添加p/m命名法)生成的化学名称为:
[0175]
n-((s)-1-((3p)-3-(4-氯-1-甲基-3-(甲磺酰氨基)-1h-吲唑-7-基)-4-氧代-7-(3,3,3-三氟丙氧基)-3,4-二氢吡啶并[2,3-d]嘧啶-2-基)-2-(3,5-二氟苯基)乙基)-2-((3bs,4ar)-3-(二氟甲基)-5,5-二氟-3b,4,4a,5-四氢-1h-环丙并[3,4]环戊并[1,2-c]吡唑-1-基)乙酰胺
[0176]
对比试验:
[0177]
在许多试验中将实施例1的化合物与wo 2018203235(方案1)中描述的实施例60.2的化合物进行比较。出于这些比较的目的,我们选择使用每种化合物的同手性材料,因为这种纯度水平最能代表将在人类临床试验中使用的水平。具体而言,在实施例1和实施例60.2中,围绕指示的吲唑c-n键的受限旋转产生阻转异构体(非对映异构体),其可通过色谱法分离并且在室温不会相互转化。因此,使用色谱法,我们以纯形式分离出方案2中所示的立体异构体。
[0178]
方案1
[0179][0180]
方案2
[0181][0182]
通过lc-ms/ms定量化合物的一般程序:
[0183]
将所有体外样品进样到exion lc 4500triple quad
tm lc-ms/ms系统上。所用的分析柱为phenomenex c18(c18,4.6mm
×
50mm,5μm),其保持在室温。流动相a由0.1%(v/v)甲酸的milliq水溶液组成。流动相b由100%甲醇组成。流速为1ml/min。梯度如下:流动相b在0.7分钟内由5%线性增加至90%,在90%保持1.4分钟,并在5%保持0.7分钟。
[0184]
将所有体内样品进样到triple quad
tm 6500lc-ms/ms系统上,其中柱保持为60℃。流动相a由h2o、1mm nh4oac、0.025%甲酸组成。流动相b由甲醇、5mm nh4oac组成。流速为0.6ml/min。柱和洗脱梯度选自下述一般分析方法之一。
[0185]
一般分析方法a:
[0186]
柱=waters x-bridge beh c18(2.1x50mm,1.7μm颗粒);梯度:时间(min.)/%b=
0.0/10,0.2/10,0.8/90,1.3/90,1.31/10,2.0/10。
[0187]
一般分析方法b:
[0188]
柱=waters beh c18(2.1x50mm,2.5μm颗粒);梯度:时间(min.)/%b=0.0/10,0.2/10,0.8/90,1.3/90,1.31/10,2.0/10。
[0189]
一般分析方法c:
[0190]
柱=waters beh c18(2.1x50mm,1.7μm颗粒);梯度:时间(min.)/%b=0.0/2,0.40/2,0.7/65,1.3/90,1.9/90,1.91/2,2.5/2。
[0191]
测量效力和细胞毒性的程序:
[0192]
mt-2细胞、293t细胞和nl
4-3
病毒的前病毒dna克隆获自nih aids research and reference reagent program。mt-2细胞在补充有10%热灭活胎牛血清(fbs)、100mg/ml青霉素g和至多100单位/ml链霉素的rpmi 1640培养基中增殖。293t细胞在补充有10%热灭活fbs、100mg/ml青霉素g和100mg/ml链霉素的dmem培养基中增殖。重组nl
4-3
前病毒克隆(其中nef基因的一部分被renilla荧光素酶基因取代)用于制备在这些研究中使用的参比病毒。通过使用来自mirus bio llc(madison,wi)的transit-293transfection reagent将重组nl
4-3
前病毒克隆转染到293t细胞中来制备重组病毒。2-3天后收集上清液,并使用荧光素酶活性作为标记物通过测量荧光素酶活性来滴定mt-2细胞中存在的病毒量。荧光素酶使用promega(madison,wi)的enduren live cell substrate定量。化合物对重组病毒的抗病毒活性通过测量在化合物的连续稀释的情况下用重组病毒感染4-5天的mt-2细胞中的荧光素酶活性来定量。
[0193]
50%有效浓度(ec
50
)通过使用中值效应方程的指数形式计算,其中(fa)=1/[1 (ed
50
/药物浓度)m](johnson va,byington rt.infectivity assay.in techniques in hiv research.ed.aldovini a,walker bd.71-76.new york:stockton press.1990)。50%抑制浓度(ic
50
)通过使用中值效应方程的指数形式计算,其中抑制百分比=1/[1 (ec
50
/药物浓度)m],其中m为反映浓度-响应曲线的斜率的参数。
[0194]
使用与抗病毒测定中所述相同的方案测定化合物细胞毒性和相应的cc
50
值,不同之处在于使用未感染的细胞。在第4天,通过使用基于xtt(2,3-双[2-甲氧基-4-硝基-5-磺苯基]-2h-四唑正离子-5-甲酰苯胺内盐)的比色测定(sigma-aldrich,st louis,mo)在未感染的mt2细胞中评估细胞毒性。
[0195]
结果:
[0196]
实施例1和实施例60.2的效力在初始抗hiv病毒学测定的误差内(实施例1的ec
50
=25
±
8pm,实施例60.2的ec
50
=18
±
13pm)。请注意,当最初测试时,实施例1的ec
50
为0.034nm,然而,进一步测试产生25
±
8pm的修正平均值。对于实施例1和实施例60.2,测得的细胞毒性cc
50
分别为》0.5μm和》10μm。
[0197]
测量肝微粒体中代谢的程序:
[0198]
将来自人、大鼠、犬和猴的肝微粒体解冻并在100mm磷酸钾缓冲液(ph7.4)中稀释至1mg/ml的终浓度。在1:1乙腈:水(v/v)中以100x终浓度1μm制备测试化合物和对照并等分到微粒体混合物中。将混合物在37℃在振荡水浴中预温育10分钟。温育一式两份进行。温育中包括三个对照;华法林(warfarin)、非那西丁(phenacetin)和维拉帕米(verapamil)。预温育后,用终浓度为1mm的nadph引发反应。在0、5、15、30、45和60分钟时,取出25μl样品并用
300μl含有内标(替米沙坦(telmisartan))的乙腈淬灭。将样品在1200rpm涡旋5分钟,然后在4000rpm离心10分钟。将上清液的100μl等分试样用水稀释3倍,并上样到exion lc 4500triple quad lc-ms/ms系统上。结果报告为剩余母体的百分比,并且由在每个时间点之后剩余的测试化合物的峰面积比计算并与零时间温育进行比较。
[0199]
结果:
[0200]
实施例1在犬肝微粒体中的稳定性是实施例60.2的6倍,且实施例1在猴肝微粒体中的稳定性是实施例60.2的至少2倍。该数据表明,对于犬和猴体内的代谢,实施例1应该比实施例60.2明显更稳定。
[0201]
表1
[0202][0203]
测量人肝细胞中代谢的程序:
[0204]
将来自人、猴、犬、大鼠和小鼠的悬浮液中冷冻保存的肝细胞解冻并在预热的william's medium e(ph 7.4)中稀释。将肝细胞悬浮液的等分试样添加至在预热的william's medium e(ph 7.4)中制备的测试化合物工作溶液中,以达到0.5
×
106细胞/毫升和≤0.25%dmso中0.5μm的终浓度。将这些样品在37℃用5%二氧化碳温育并且以200rpm振荡。温育进行一份(singlet)。在时间点0、10、30、60、120和240分钟,取出50μl温育混合物的等分试样并加入到100μl含有内标的乙腈溶液中,将混合物涡旋,然后在4℃和3500rpm离心15分钟。实验完成后,通过lc-ms/ms分析样品。代谢稳定性结果报告为剩余母体测试化合物的百分比。该百分比通过将温育后(t
x
)测试化合物的峰面积比除以在刚温育前零时间(t0)测试化合物的峰面积比来计算。
[0205]
消除速率常数(k,min-1
)使用非线性回归拟合计算,公式如下:
[0206]ct
=c0×e(-k
×
t)
[0207]
其中:
[0208]
c0为初始浓度,以峰面积比(测试化合物峰面积/内标峰面积)表示;
[0209]ct
为t处的浓度,以面积比(测试化合物峰面积/内标峰面积)表示;
[0210]
e为自然对数的底
[0211]
t为时间(min);
[0212]
k为消除速率常数(min-1
)。
[0213]
半衰期(t
1/2
,min)使用以下公式计算:
[0214][0215]
其中:
[0216]
k为消除速率常数(min-1
)。
[0217]
体外固有清除率(cl
int
,ml/min/百万细胞)使用以下公开计算:
[0218]
cl
int
=0.693/t
1/2
/n
[0219]
其中:
[0220]
t
1/2
为半衰期;
[0221]
n为每ml的细胞数。
[0222]
结果:
[0223]
计算出实施例1在人肝细胞中的半衰期为》480分钟,而实施例60.2在人肝细胞中的半衰期为350分钟。实施例60.2在人肝细胞中的固有清除率为0.465ml/min/g肝脏,比实施例1中发现的0.312ml/min/g肝脏清除率快1.5倍。
[0224]
测量体内药代动力学参数(pk)的程序:
[0225]
在雄性cd1小鼠、wistar han大鼠、食蟹猴和比格犬中研究pk。两组动物(每组n=3)以静脉内(iv)剂量(1mg/kg)或通过经口管饲法(5mg/kg溶液和悬浮液)接受测试化合物。药物在90%peg 400、10%乙醇中配制用于iv施用,以及在90%peg 400、5%乙醇中配制用于po施用。在iv给药后0.167、0.25、0.5、0.75、1、2、3、5、7、24、48、72和96小时采集血样;口服给药后0.25、0.5、0.75、1、2、3、5、7、24、48、72和96小时采集血样。将血样收集到k3edta管中并以1500-2000xg离心以获得血浆。将血浆样品储存在-20℃直至通过lc-ms/ms进行分析。
[0226]
将所有体内样品上样到exion lc 4500triple quad
tm lc-ms/ms系统上,其中柱保持在60℃且流速为0.6ml/min。所有lc-ms/ms分析参数均以电子方式记录在原始数据文件中。大鼠iv、犬iv、猴iv和猴po pk样品通过一般分析方法a进行分析。小鼠iv、小鼠po和犬po pk样品通过一般分析方法b进行分析。大鼠po样品通过一般分析方法c进行分析。
[0227]
pk参数通过血浆浓度对时间数据的非区室分析(phoenix winnonlin v8.1)获得。峰浓度(c
max
)和c
max
的时间(t
max
)直接在实验观察中记录下来。使用线性对数梯形法则计算从时间零到最后取样时间的曲线下面积[auc
0-t
]和从时间零到无穷大的曲线下面积[auc
inf
]。iv施用后评估总血浆清除率(cl
tp
)、稳态分布体积(v
ss
)、表观消除半衰期(t-half)和平均停留时间(mrt)。使用具有可定量浓度的最少三个时间点进行auc和t-half的评估。绝对口服生物利用度(f)评估为口服和iv给药后的剂量标准化auc值之比。
[0228]
结果:
[0229]
在四种临床前物种中测量实施例1和实施例60.2的iv药代动力学(pk)参数:小鼠、大鼠、犬和猴。相对于实施例60.2,实施例1在所有四种物种中显示出改善的清除率。与上述肝微粒体测定的结果一致,犬和猴的清除率差异最显著,其中清除率分别提高4.9倍和2.6倍。同样,在犬和猴中的循环中实施例1半衰期分别比实施例60.2高3.4倍和2倍。
[0230]
表2
[0231][0232]
[0233]
表3
[0234][0235]
在预期的药物可进入人类临床试验之前,化合物的安全性通常应在两种临床前物种中评估:一种啮齿动物和一种非啮齿动物。这些物种通常为大鼠和犬或猴。体内安全性研究的一个目的是获得循环中药物的浓度,该浓度比如果给予人类有效剂量的药物所预期的浓度高许多倍。在安全性研究中获得的药物浓度与在服用有效剂量药物的人类中预期的药物浓度之间的倍数差异称为“安全范围(margin)”。在安全性研究中实现高安全范围很重要,因为随着安全范围增加,如果可能发生药物相关不良事件,则在临床前安全性评估期间会观察到的信心也会增加。
[0236]
在大鼠、犬或猴中改善的pk参数意味着在这些临床前物种的循环中需要较低剂量的化合物以获得高浓度的药物。因此,给予实施例1剂量的猴或犬将获得比给予相同大小剂量的实施例60.2更高的margin。由于剂量大小的实际限制,在非啮齿动物安全性评估研究中用实施例1可达到的margin(以及因此的置信度)高于用实施例60.2可达到的margin。
[0237]
用于提供人体剂量预测的临床前pk参数的异速增长(allometric scaling)程序:
[0238]
人类剂量预测使用phoenix winnonlin(v 8.0)软件和microsoft excel进行,使用modelrisk插件进行群体建模。基于小鼠、大鼠、猴和犬iv数据的平均异速增长(体重换算系数(body weight scaling factor)为0.75)和来自所有物种的vss的平均值(体重换算系数为1.0)获得每种化合物的cl
tp
的人类评估值。人类iv参数(vc、ka、k12、k21、kel)使用来自临床前物种(小鼠、大鼠、犬和食蟹猴(cyno))的平均停留时间(mean residence time,mrt)标度,使用人vss和cl
tp
评估值来确定。吸收(ka)通过去卷积(po)或由临床前物种中的半衰期(sc)确定(ka=ln(2)/t1/2)。po和sc的预测人类剂量是考虑到人类变异性而计算的,并计算为覆盖95%的人类群体。
[0239]
结果:
[0240]
临床前物种pk参数通常用于在人类临床试验之前预测人类pk参数。用于这种预测的方法被称为“异速增长”,并且通常在文献中讨论和实践。使用异速增长,实施例1在人体中维持药物有效血浆浓度所需的预测每日一次口服剂量比实施例60.2低7倍。具体而言,实施例1的预测的人qd po剂量小于10mg,而实施例60.2的预测的人qd po剂量大于30mg。
[0241]
虽然特异质性药物反应(即,超敏反应)本质上是不可预知的和严重的,因此代表了一个显著的临床问题,但是已经指出以10mg或更少的日剂量给予的药物很少与高发病率的特异质性药物反应相关(uetrecht,j.p.new concepts in immunology relevant to idiosyncratic drug reactions:the“danger hypothesis”and innate immune system.chem.res.toxicol.1999,12(5),387-395,doi:10.1021/tx980249i)。
[0242]
在皮下体内实验中测量药代动力学参数的程序:
[0243]
将药物在1%kolliphor p188/1%peg3350/3.5%甘露醇/94.5%水中配制,然后
以20mg/kg的剂量皮下注射施用于wistar han大鼠。在0.167、0.25、0.5、0.75、1、2、3、5、7、24、48、72、96小时采集血样,然后每3天采集一次,持续最多122天。将血样收集到k3edta管中并以1500-2000xg离心以获得血浆。将血浆样品储存在-20℃直至通过lc-ms/ms进行分析。
[0244]
结果:
[0245]
在大鼠sc pk实验中评估每种化合物用于皮下(sc)施用的适合性。如本实验所确定的,实施例1的化合物在血浆中的表观半衰期为13天,实施例60.2的为11.5天。实施例1的auc
0-无穷大
为4941天*ng/ml(外推的auc为2.89%)。实施例60.2的auc
0-无穷大
为609天*ng/ml(外推的auc为12.8%)。实施例1的生物利用度为93%,实施例60.2的生物利用度为25%。对于所有动物,实施例1的药物浓度维持在7ng/ml以上73天,实施例60.2维持24天(图1)。使用得自sc大鼠pk的表观半衰期和生物利用度结合得自异速增长的预测的人类清除率值来计算预测的人类每月一次皮下(q1m sc)剂量。实施例1维持药物在人体中的有效血浆浓度所需的预测q1m sc剂量比实施例60.2低15倍。
[0246]
测量冷藏保存的人肝细胞中细胞色素p450诱导的程序:
[0247]
遵循fda的指导(“in vitro metabolism-and transporter-mediated drug-drug interaction studies guidance for industry”),使用来自相同的三个单独供体(而不是合并的供体)的肝细胞测试实施例1和实施例60.2诱导cyp2b6表达的潜力,并使用“倍数变化法”评估酶mrna水平的变化。在该试验中,mrna水平的倍数变化小于2倍被认为是阴性结果,而变化≥2倍被认为是阳性结果。
[0248]
在cyp诱导测定中使用来自三个供体的可诱导冷藏保存的人原代肝细胞测试化合物,以确定引起cyp2b6诱导的潜力(如通过mrna转录增加所测量)。将测试化合物(0.12至30μm终浓度)与天然表达参与调节各种cyp酶的表达水平的所有核受体的原代人肝细胞一起温育48小时。将测试化合物和对照的新鲜溶液在测定培养基中稀释,并每24小时添加一次,连续两天,dmso的终浓度为0.1%。在温育结束时,评估细胞单层的完整性、细胞密度和活力以评估细胞毒性作用。然后将细胞溶解在细胞裂解缓冲液中,并从每个测定样品中纯化总rna。然后将样品用于逆转录聚合酶链式反应(rt-pcr)以定量编码人cyp2b6基因的特定mrna物种的量。
[0249]
将测试化合物和对照的诱导潜力与已知的cyp2b6诱导剂苯巴比妥(phenobarbital)(1000μm)进行比较。该测定的结果表示为诱导倍数。将诱导倍数计算为用测试化合物处理的细胞中的mrna水平与单独用dmso(溶剂对照)处理的细胞中的mrna水平(即基础mrna水平)之比,并且因此代表了测试化合物的诱导潜力。诱导倍数值用于计算对照活性值的百分比,然后将其拟合至4参数逻辑回归模型以确定ec
50
和e
max
值(如果观察到诱导)。还平行评估了细胞毒性以避免由于细胞毒性导致的假阳性cyp诱导结果。应避免在细胞毒性浓度评估和解释cyp诱导潜力。
[0250]
结果:
[0251]
在任何测试浓度(高达30μm),两种化合物均未观察到细胞毒性。对于实施例1,在所有三个供体中均发现了阴性结果(无诱导)。对于实施例60.2,在3个供体中的2个发现了阳性结果(诱导)(ec
50
值为1.5μm和1.8μm)。
[0252]
cyp酶表达的诱导被认为是药物-药物相互作用的根本原因,导致其代谢受诱导的
cyp同工型控制的受害药物(victim drug)的清除率增加。在cyp同工型中,cyp2b6在hiv治疗方面尤为重要,因为广泛用于治疗hiv的药物依法韦仑(efavirenz,efv)(包括在2019年世界卫生组织的基本药物列表中)主要由cyp2b6代谢(ward,b.a.,gorski,j.c.,jones,d.r.,hall,s.d.,flockhard,d.a.,desta,z.the cytochrome p450 2b6(cyp2b6)is the main catalyst of efavirenz primary and secondary metabolism:implication for hiv/aids therapy and utility of efavirenz as a substrate marker of cyp2b6catalytic activity,j.pharmacol.exp.ther.,2003,306,287-300,doi:10.1124/jpet.103.049601)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
