1.本发明涉及传染病防控领域,具体地,涉及一种检测非洲猪瘟病毒和猪瘟病毒的引物组合物及应用。
背景技术:
2.非洲猪瘟(african swine fever,asf)是由非洲猪瘟病毒(african swine fevervirus,asfv)感染家猪和野猪引起的一种急性、烈性、出血性的传染病。该病给我国养猪业带来了极大的冲击。迄今为止,国内外针对asf均没有有效的疫苗及治疗方案。猪瘟(classical swine fever,csf) 是由猪瘟病毒(classical swine fever virus,csfv)感染引起的一种猪的急性接触性传染病。急性csf临床上常表现为高热稽留、厌食、皮肤黏膜广泛充血出血等。
3.asf的临床症状与急性csf相似,通常需要通过分子生物学技术将二者进行区别。目前,用于asf和csf的传统检测方法多局限于实验室检测,存在操作费时费力、检测时间长、依赖精密仪器等缺点。因此,亟需建立一种操作简便、检测效率高、用于生产实践的现场检测方式。
技术实现要素:
4.为了解决非洲猪瘟病毒及猪瘟病毒在现场检测中操作繁琐、检测时间长的问题,本发明提供了一种检测非洲猪瘟病毒和猪瘟病毒的引物组合物及应用。
5.本发明的第一个目的是提供一种检测非洲猪瘟病毒的引物。
6.本发明的第二个目的是提供上述引物在制备检测非洲猪瘟的试剂盒中的应用。
7.本发明的第三个目的是提供一种检测猪瘟病毒的引物。
8.本发明的第四个目的是提供上述引物在制备检测猪瘟的试剂盒中的应用。
9.本发明的第五个目的是提供一种检测非洲猪瘟病毒和猪瘟病毒的引物组合物。
10.本发明的第六个目的是提供上述引物在制备检测非洲猪瘟和/或猪瘟的试剂盒中的应用。
11.本发明的第七个目的是提供一种同时检测非洲猪瘟病毒和猪瘟病毒的试剂盒。
12.为了实现上述目的,本发明是通过以下方案予以实现的:
13.一种检测非洲猪瘟病毒的引物,包含核苷酸序列如seq id no:1~2所示的引物。
14.上述引物在制备检测非洲猪瘟的试剂盒中的应用也在本发明的保护范围之内。
15.一种检测猪瘟病毒的引物,包含核苷酸序列如seq id no:3~4所示的引物。
16.上述引物在制备检测猪瘟的试剂盒中的应用也在本发明的保护范围之内。
17.一种检测非洲猪瘟病毒和猪瘟病毒的引物组合物,包含上述引物中的一种或两种。
18.上述引物组合物在制备检测非洲猪瘟和/或猪瘟的试剂盒中的应用也在本发明的保护范围之内。
19.一种同时检测非洲猪瘟病毒和猪瘟病毒的试剂盒,包含上述引物组合物。
20.优选地,所述引物组合物包含核苷酸序列如seq id no:1~4所示的引物。
21.重组酶介导的等温扩增技术(recombinase aided amplification,raa)是一种新型的体外核酸扩增技术,该技术利用重组酶与引物结合,按照碱基互补配对原则,对目的片段所对应的dna序列进行特异性的识别,具有反应速度快和操作便捷等优点,只需要在常温条件下便可实现目的片段的扩增,有效避免了苛刻的温度循环扩增条件,反应时间也明显缩短。
22.本发明以待测样本的基因组dna和/或cdna作为模板,进行重组酶介导的等温扩增,通过琼脂糖凝胶电泳看是否有出现目的条带,可直观判断待测样本是否存在非洲猪瘟病毒和/或猪瘟病毒。
23.优选地,所述试剂盒还包含重组酶介导的等温扩增试剂。
24.进一步地,所述重组酶介导的等温扩增试剂为等温扩增酶、等温扩增缓冲液和/或乙酸镁中的一种或几种。
25.更优选地,所述等温扩增酶为冻干酶粉。
26.更优选地,所述等温扩增缓冲液为基础缓冲液。
27.更优选地,所述乙酸镁为乙酸镁溶液。
28.更优选地,所述冻干酶粉、所述基础缓冲液和所述乙酸镁溶液来自江苏奇天基因生物科技有限公司的raa核酸扩增试剂盒,所述raa核酸扩增试剂盒的货号为b00r00。
29.优选地,所述重组酶介导的等温扩增的反应温度为39℃。
30.优选地,所述重组酶介导的等温扩增的反应时间为15~30min。
31.用琼脂糖凝胶电泳检测raa扩增产物前,通常需要使用酚或者氯仿等有机溶剂先对扩增产物进行纯化。
32.本发明将重组酶介导的等温扩增的产物与氯仿溶液充分混合,直至出现白色沉淀;离心,取上清;将上清与上样缓冲液充分混合,再进行琼脂糖凝胶电泳。
33.优选地,判定是否存在asfv和/或csfv的标准为:有且只有一条大小为 464bp的条带,则表示存在asfv;有且只有一条大小为207bp的条带,则表示存在csfv;同时有一条大小为464bp的条带及一条大小为207bp的条带,则表示既存在asfv又存在csfv;没有条带,则表示既不存在asfv也不存在 csfv;其余情况表示等温扩增的反应体系和/或程序有问题,无法判定是否存在 asfv和/或csfv,需要重做。
34.与现有技术相比,本发明具有以下有益效果:
35.本发明提供了检测非洲猪瘟病毒和猪瘟病毒的引物,并建立了非洲猪瘟病毒、猪瘟病毒双重raa琼脂糖凝胶电泳法的检测方法。通过使用本发明提供的引物对待测样本的基因组dna和/或cdna进行重组酶介导的等温扩增,再进行琼脂糖凝胶电泳检测,可快速、准确地检测出是否存在非洲猪瘟病毒和/或猪瘟病毒,具有操作简便、检测效率高等优点,对防控非洲猪瘟和猪瘟以及促进养猪业的发展具有重要的应用价值。
附图说明
36.图1为asfv、csfv双重raa琼脂糖凝胶电泳法的检测引物鉴定结果;m: dl2000 dnamarker;1:asf-f1(seq id no:1)/asf-r1(seq id no:2)和 csf-f1/csf-r1;2:asf-f1
(seq id no:1)/asf-r1(seq id no:2)和csf-f2 (seq id no:3)/csf-r2(seq id no:4);3:asf-f1(seq id no:1)/asf-r1 (seq id no:2)和csf-f3/csf-r3;4:asf-f2/asf-r2和csf-f1/csf-r1;5:asf-f2/asf-r2和csf-f2(seq id no:3)/csf-r2(seq id no:4);6: asf-f2/asf-r2和csf-f3/csf-r3。
37.图2为asfv、csfv双重raa琼脂糖凝胶电泳法的建立;m:dl2000 dnamarker;1:超纯水;2:asfv p72基因质粒;3:csfv ns5b基因质粒;4: asfv p72基因质粒 csfv ns5b基因质粒。
38.图3为asfv、csfv双重raa琼脂糖凝胶电泳法的特异性;m:dl2000 dnamarker;1:超纯水;2:asfv p72基因质粒;3:csfv ns5b基因质粒;4: asfv p72基因质粒 csfv ns5b基因质粒;5:ppv基因组dna;6:pcv2基因组dna;7:fmdv基因组cdna;8:svv基因组cdna;9:prv基因组 dna;10:prrsv基因组cdna;11:jev基因组cdna。
39.图4为asfv、csfv双重raa琼脂糖凝胶电泳法的敏感性;m:dl2000 dnamarker;1:超纯水;2:asfv p72基因质粒;3:csfv ns5b基因质粒;4:混合质粒10
10
copies/μl;5:混合质粒109copies/μl;6:混合质粒108copies/μl; 7:混合质粒107copies/μl;8:混合质粒106copies/μl;9:混合质粒105copies/μl; 10:混合质粒104copies/μl;11:混合质粒103copies/μl;12:混合质粒102copies/μl; 13:混合质粒101copies/μl。
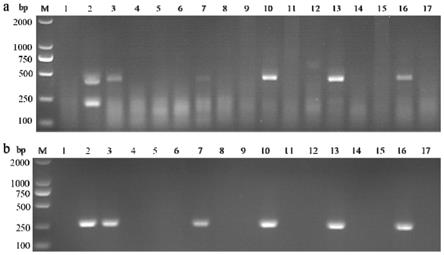
40.图5为asfv疑似病料的检测结果;a为asfv、csfv双重raa琼脂糖凝胶电泳法的检测结果;b为常规pcr的检测结果;m:dl2000 dnamarker;1:超纯水;2:asfv p72基因质粒 csfv ns5b基因质粒;3~17:asfv-dna-1~ 15。
41.图6为csfv疑似病料的检测结果;a为asfv、csfv双重raa琼脂糖凝胶电泳法的检测结果;b为常规pcr的检测结果;m:dl2000 dnamarker;1:超纯水;2:asfv p72基因质粒 csfv ns5b基因质粒;3~17:csfv-cdna-1~ 15。
具体实施方式
42.下面结合说明书附图及具体实施例对本发明作出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
43.本发明所用非洲猪瘟病毒(asfv)pig/hlj/2018株、猪蓝耳病毒(prrsv) nadc34-like株、日本乙型脑炎病毒(jev)sw/gd/2009株、猪细小病毒(ppv) gd株、猪瘟病毒(csfv)石门株、伪狂犬病毒(prv)ah株、猪圆环病毒2 型病毒(pcv2)ch/sh/2010株、塞内卡病毒(svv)gxhzh-1株和口蹄疫病毒(fmdv)o/sea/mya-98株核酸均由华南农业大学兽医学院微生物学与免疫学教研室保存。
44.实施例1 asfv p72基因质粒、csfv ns5b基因质粒的制备
45.1、asfv p72基因质粒的合成
46.参照asfv p72基因(genbank:mk333180.1)的序列,在基因序列的前端引入ecorⅰ酶切位点,在基因序列的后端引入bamhⅰ酶切位点,以pmd19-t 载体为骨架,交由生工生物工程(上海)股份有限公司合成,即得到asfv p72 基因质粒。
47.2、csfv ns5b基因质粒的制备
48.针对csfv ns5b基因(genbank:ay775178.2)设计上游扩增引物csfv-p-f:5
’‑
gcagagcaactgtgcaga-3’和下游扩增引物csfv-p-r: 5
’‑
atcgggtccccttcatag-3’。
49.以csfv基因组cdna为模板,用csfv-p-f/csfv-p-r进行pcr扩增。
50.反应体系为:mix酶,45μl;csfv-p-f(10μmol/l),2μl;csfv-p-r(10 μmol/l),2μl;dna,1μl。
51.反应条件为:98℃,预变性2min;98℃,变性10s;56℃,退火10s,72℃,延伸10s,共30个循环;72℃终延伸1min。
52.pcr反应结束后,进行琼脂糖凝胶电泳,将扩增的目的片段使用omega 公司胶回收试剂盒进行回收纯化,得到回收产物。
53.将回收产物连接至pmd19-t载体,转化至大肠杆菌dh5α,挑取单克隆菌落接种于amp抗性lb液体培养基中扩大培养。
54.使用引物c-ns5b-f:5
’‑
aacaagacaataggctcag-3’和c-ns5b-r: 5
’‑
tgtggttgtatttctccc-3’进行菌液鉴定。
55.将鉴定结果符合预期的菌液送至生工生物工程(上海)股份有限公司测序,保留测序结果正确的菌株。使用omega质粒抽提试剂盒提取测序结果正确的菌株的质粒,即得到csfv ns5b基因质粒。
56.实施例2 asfv、csfv双重raa琼脂糖凝胶电泳法检测引物的确定
57.1、实验方法
58.(1)检测引物的设计
59.对asfv的p72基因(genbank:mk333180.1、genbank:mk554698.1、 genbank:mn172368.1、genbank:mk940252.1、genbank:mk628478.1、genbank: mn393476.1、genbank:mh910495.1、genbank:kj195685.1、genbank:ay578707.1、 genbank:kj195685.1、genbank:mh681419.1、genbank:mk645909.1)进行比对分析,并将其作为设计asfv的raa引物的模板。共设计2对asfv上下游引物,分别记为asf-f1(seq id no:1)/asf-r1(seq id no:2)、 asf-f2/asf-r2,具体序列见表1。
60.对csfv的ns5b基因(genbank:ay775178.2、genbank:ay805221.1、 genbank:ay663656.1、genbank:ay382481.1、genbank:ay259122.1、genbank: af531433.1、genbank:eu497410.1、genbank:hq380231.1、genbank:ky860615.2、 genbank:mk121886.1、genbank:mn558863.1、genbank:lc374604.1)进行分析,并将其作为csfv raa引物设计的模板。共设计3对csfv上下游引物,分别记为csf-f1/csf-r1、csf-f2(seq id no:3)/csf-r2(seq id no:4)、 csf-f3/csf-r3,具体序列见表1。
61.表1 asfv、csfv双重raa反应引物序列
[0062][0063][0064]
交由公司进行引物合成。
[0065]
(4)双重raa反应体系的配制
[0066]
将步骤(1)中的2对asfv上下游引物和3对csfv上下游引物进行两两组合,共得到6种引物组,分别记为引物组1~6,具体分组信息如表2所示。
[0067]
表2 asfv、csfv引物组合信息
[0068][0069]
以相同拷贝数的实施例1所得的asfv p72基因质粒和csfv ns5b基因质粒作为模板。
[0070]
根据raa核酸扩增试剂盒(江苏奇天基因生物科技有限公司,货号b00r00) 的说明书配制raa反应体系的混合液为:基础缓冲液,25.0μl;纯化水,15.7μl; asf-f1(seq id no:1)/asf-f2(10μmol/l),1.2μl;asf-r1(seq id no:2) /asf-r2(10μmol/l),1.2μl;csf-f1/csf-f2(seq id no:3)/csf-f3(10μmol/l), 1.2μl;csf-r1/csf-r2(seq id no:4)/
csf-r3(10μmol/l),1.2μl;asfv p72 基因质粒 csfv ns5b基因质粒,2μl。
[0071]
(4)双重raa反应的步骤
[0072]
将上述混合液加入预装有冻干酶粉的反应管中,轻柔吹打混匀,使酶粉完全溶解;
[0073]
向反应管中加入2.5μl的乙酸镁溶液,用掌上离心机瞬时离心数秒;
[0074]
将反应管置于39℃恒温水浴锅中反应15~30min(反应开始5min时取出反应管轻弹管壁混匀)完成目的片段的扩增;
[0075]
扩增结束后,向每个反应管中添加与反应管中溶液等体积的氯仿溶液,反复吹打混匀,直至出现白色沉淀;
[0076]
将反应管置于高速离心机中,12000
×
g离心5min后,吸取上层清澈液体(吸取过程中应当避免吸取白色沉淀及底部氯仿溶液),置于0.2ml ep管中,加入上样缓冲液。
[0077]
(5)琼脂糖凝胶电泳
[0078]
用1.5%琼脂糖凝胶电泳进行检测鉴定,使用凝胶成像系统观察结果。
[0079]
2、实验结果
[0080]
如图1所示,引物组1~6均扩增出两条特异性条带。其中,引物组2即asf-f1 (seq id no:1)/asf-r1(seq id no:2)扩增出大小为464bp的核苷酸序列如seq id no:5所示的特异性条带1,且csf-f2(seq id no:3)/csf-r2(seqid no:4)扩增出大小为207bp的核苷酸序列如seq id no:6所示的特异性条带 2,且两个条带亮度相近、扩增产物的大小差距较大,便于对最终检测结果的判定,故将引物组2即asf-f1(seq id no:1)/asf-r1(seq id no:2)和csf-f2 (seq id no:3)/csf-r2(seq id no:4)确定为asfv、csfv双重raa琼脂糖凝胶电泳法的最佳检测引物。
[0081]
实施例3 asfv、csfv双重raa琼脂糖凝胶电泳法的建立
[0082]
1、实验方法
[0083]
以实施例1的asfv p72基因质粒和csfv ns5b基因质粒作为模板,并以超纯水作为阴性对照的模板。
[0084]
以实施例2的asf-f1(seq id no:1)/asf-r1(seq id no:2)和csf-f2 (seq id no:3)/csf-r2(seq id no:4)作为扩增引物。
[0085]
raa反应体系的混合液为:基础缓冲液,25.0μl;纯化水,15.7μl;asf-f1 (seq id no:1)(10μmol/l),1.2μl;asf-r1(seq id no:2)(10μmol/l), 1.2μl;csf-f2(seq id no:3)(10μmol/l),1.2μl;csf-r2(seq id no:4) (10μmol/l),1.2μl;超纯水/asfv p72基因质粒/csfv ns5b基因质粒/asfvp72基因质粒 csfv ns5b基因质粒,2μl。
[0086]
按照实施例2步骤(4)进行双重raa反应。
[0087]
用1.5%琼脂糖凝胶电泳进行检测鉴定,使用凝胶成像系统观察结果。
[0088]
2、实验结果
[0089]
如图2所示,阴性对照无条带,而以asfv p72基因质粒、csfv ns5b基因质粒、asfv p72基因质粒 csfv ns5b基因质粒作为模板的泳道均出现大小与预期相符的特异性条带且无杂带,表明asfv、csfv双重raa琼脂糖凝胶方法已建立成功,使用asf-f1(seq id no:1)/asf-r1(seq id no:2)和csf-f2 (seq id no:3)/csf-r2(seq id no:4)进行双重raa反应结合琼脂糖凝胶电泳可简单快速地鉴别待测样品中是否存在asfv和csfv。
[0090]
实施例4 asfv、csfv双重raa琼脂糖凝胶电泳法的特异性
[0091]
1、实验方法
[0092]
以ppv基因组dna、pcv2基因组dna、fmdv基因组cdna、svv基因组cdna、prv基因组dna、prrsv基因组cdna、jev基因组cdna、实施例1的asfv p72基因质粒和csfv ns5b基因质粒作为模板,并以超纯水作为阴性对照的模板。
[0093]
以实施例2的asf-f1(seq id no:1)/asf-r1(seq id no:2)和csf-f2 (seq id no:3)/csf-r2(seq id no:4)作为扩增引物。
[0094]
raa反应体系的混合液为:基础缓冲液,25.0μl;纯化水,15.7μl;asf-f1 (seq id no:1)(10μmol/l),1.2μl;asf-r1(seq id no:2)(10μmol/l), 1.2μl;csf-f2(seq id no:3)(10μmol/l),1.2μl;csf-r2(seq id no:4) (10μmol/l),1.2μl;超纯水/ppv基因组dna/pcv2基因组dna/fmdv基因组cdna/svv基因组cdna/prv基因组dna/prrsv基因组cdna/jev基因组 cdna/asfv p72基因质粒/csfv ns5b基因质粒/asfv p72基因质粒 csfvns5b基因质粒,2μl。
[0095]
按照实施例2步骤(4)进行双重raa反应。
[0096]
用1.5%琼脂糖凝胶电泳进行检测鉴定,使用凝胶成像系统观察结果。
[0097]
2、实验结果
[0098]
如图3所示,以ppv基因组dna、pcv2基因组dna、fmdv基因组cdna、 svv基因组cdna、prv基因组dna、prrsv基因组cdna、jev基因组cdna 作为模板的泳道均未出现扩增条带,仅以asfv p72基因质粒、csfv ns5b基因质粒、asfv p72基因质粒 csfv ns5b基因质粒作为模板的泳道出现与大小与预期相符的特异性条带,表明已建立的该方法asfv、csfv双重raa琼脂糖凝胶电泳法检测方法具有良好的特异性,不会因为样品中存在ppv、pcv2、 fmdv、svv、prv、prrsv、jev而出现假阳性结果。
[0099]
实施例5 asfv、csfv双重raa琼脂糖凝胶电泳法的敏感性
[0100]
1、实验方法
[0101]
将实施例1的asfv p72基因质粒和csfv ns5b基因质粒的混合质粒调节浓度至10
10
copies/μl,再进行10倍稀释(即10
10
copies/μl、109copies/μl、10
8 copies/μl、107copies/μl、106copies/μl、105copies/μl、104copies/μl、103copies/μl、 102copies/μl、101copies/μl),作为模板。
[0102]
以实施例2的asf-f1(seq id no:1)/asf-r1(seq id no:2)和csf-f2 (seq id no:3)/csf-r2(seq id no:4)作为扩增引物。
[0103]
raa反应体系的混合液为:基础缓冲液,25.0μl;纯化水,15.7μl;asf-f1 (seq id no:1)(10μmol/l),1.2μl;asf-r1(seq id no:2)(10μmol/l), 1.2μl;csf-f2(seq id no:3)(10μmol/l),1.2μl;csf-r2(seq id no:4) (10μmol/l),1.2μl;超纯水/asfv p72基因质粒/csfv ns5b基因质粒/混合质粒10
10
copies/μl/混合质粒109copies/μl/混合质粒108copies/μl/混合质粒10
7 copies/μl/混合质粒106copies/μl/混合质粒105copies/μl/混合质粒104copies/μl/ 混合质粒103copies/μl/混合质粒102copies/μl/混合质粒101copies/μl,2μl。
[0104]
按照实施例2步骤(4)进行双重raa反应。
[0105]
用1.5%琼脂糖凝胶电泳进行检测鉴定,使用凝胶成像系统观察结果。
[0106]
2、实验结果
[0107]
如图4所示,对asfv p72基因拷贝数最低检测限为106copies/μl,对csfvns5b基因拷贝数最低检测限为105copies/μl。
[0108]
实施例6 asfv、csfv双重raa琼脂糖凝胶电泳法的应用
[0109]
1、实验方法
[0110]
(1)样品处理
[0111]
取疑似感染asfv和csfv的病料各15份,加入pbs溶液,用组织震荡仪进行组织破碎。12000
×
g离心5min,转移上清液置于新的1.5ml离心管中。
[0112]
用omega公司viral dna提取试剂盒抽提疑似感染asfv的病料的dna,得到15份asfv病料的dna样本,记为asfv-dna-1~15。
[0113]
用omega公司viral rna提取试剂盒抽提疑似感染csfv的病料的rna,经过反转录,得到15份csfv病料的cdna样本,记为csfv-cdna-1~15。
[0114]
(2)常规pcr
[0115]
以实施例1的asfv p72基因质粒和csfv ns5b基因质粒、csfv-cdna-1~ 15、asfv-dna-1~15作为模板,并以超纯水作为阴性对照的模板。
[0116]
所用pcr引物的信息如表3所示。
[0117]
表3常规pcr引物
[0118]
引物名称引物序列(5’~3’)基因组位置(nt)oie-asfv-fcttaccgatgaaaatgatac772~791oie-asfv-ratggatactgagggaatagc1049~1030oie-csfv-fgacacaagcgcaggcaatag1583~1602oie-csfv-ragtgggttccaggactacat2031~2012
[0119]
pcr反应体系为:mix(green)酶,45μl;oie-asfv-f/oie-csfv-f(10 μmol/l),2μl;oie-asfv-r/oie-csfv-r(10μmol/l),2μl;超纯水/asfv p72 基因质粒/csfv ns5b基因质粒/asfv p72基因质粒 csfv ns5b基因质粒 dna/csfv-cdna-1~15/asfv-dna-1~15,1μl。
[0120]
pcr反应条件为:98℃,预变性2min;98℃,变性10s;56℃,退火10s, 72℃,延伸10s,共30个循环;72℃终延伸1min。
[0121]
用1.5%琼脂糖凝胶电泳进行检测鉴定,使用凝胶成像系统观察结果。
[0122]
(3)双重raa反应
[0123]
以实施例1的asfv p72基因质粒和csfv ns5b基因质粒、csfv-cdna-1~ 15、asfv-dna-1~15作为模板,并以超纯水作为阴性对照的模板。
[0124]
以实施例2的asf-f1(seq id no:1)/asf-r1(seq id no:2)和csf-f2 (seq id no:3)/csf-r2(seq id no:4)作为扩增引物。
[0125]
raa反应体系的混合液为:基础缓冲液,25.0μl;纯化水,15.7μl;asf-f1 (seq id no:1)(10μmol/l),1.2μl;asf-r1(seq id no:2)(10μmol/l), 1.2μl;csf-f2(seq id no:3)(10μmol/l),1.2μl;csf-r2(seq id no:4) (10μmol/l),1.2μl;超纯水/asfv p72基因质粒/csfv ns5b基因质粒/asfvp72基因质粒 csfv ns5b基因质粒dna/csfv-cdna-1~15/asfv-dna-1~15,2μl。
[0126]
按照实施例2步骤(4)进行双重raa反应。
[0127]
用1.5%琼脂糖凝胶电泳进行检测鉴定,使用凝胶成像系统观察结果。
[0128]
2、实验结果
[0129]
如图5a~图5b所示,双重raa凝胶电泳方法共检出asfv阳性病料5份,阴性病料10份,与常规pcr方法检测结果一致,二者符合率为100%。
[0130]
如图6a~图6b所示,双重raa凝胶电泳方法共检出csfv阳性病料9份,阴性病料6份,与常规pcr方法检测结果一致,二者符合率为100%。
[0131]
结果表明,本发明建立的asfv、csfv双重raa凝胶电泳方法的检测与国际通用的oie检测方法的准确性相当,具有临床实用性,可推广应用于非洲猪瘟和猪瘟的现场检测。
[0132]
实施例7一种同时检测asfv和csfv的试剂盒及使用方法
[0133]
1、试剂盒的组成成分
[0134]
试剂盒的主要成分包含raa反应基础缓冲液、纯化水、asf-f1(seq idno:1)(10μmol/l)、asf-r1(seq id no:2)(10μmol/l)、csf-f2(seq id no:3) (10μmol/l)、csf-r2(seq id no:4)(10μmol/l)、raa反应冻干酶粉、乙酸镁溶液。
[0135]
上述raa反应基础缓冲液、raa反应冻干酶粉、乙酸镁溶液可购自江苏奇天基因生物科技有限公司。
[0136]
2、使用方法
[0137]
(1)样品基因组提取:
[0138]
本试剂盒对样品基因组的提取方法没有指定要求,一般可用实验室常规方法 (酚-氯仿抽提法)或试剂盒进行提取,获得样品基因组dna或rna。若提取到的是基因组rna,则需进一步反转录为cdna。
[0139]
(2)raa反应
[0140]
配制raa反应体系的混合液为:基础缓冲液,25.0μl;纯化水,15.7μl; asf-f1(seq id no:1)/asf-f2(10μmol/l),1.2μl;asf-r1(seq id no:2) /asf-r2(10μmol/l),1.2μl;csf-f1/csf-f2(seq id no:3)/csf-f3(10μmol/l), 1.2μl;csf-r1/csf-r2(seq id no:4)/csf-r3(10μmol/l),1.2μl;基因组dna/cdna,2μl。
[0141]
将上述混合液加入预装有冻干酶粉的反应管中,轻柔吹打混匀,使酶粉完全溶解。
[0142]
向反应管中加入2.5μl的乙酸镁溶液,用掌上离心机瞬时离心数秒。
[0143]
将反应管置于39℃恒温水浴锅中反应15~30min(反应开始5min时取出反应管轻弹管壁混匀)完成目的片段的扩增。
[0144]
扩增结束后,向每个反应管中添加与反应管中溶液等体积的氯仿溶液,反复吹打混匀,直至出现白色沉淀。
[0145]
将反应管置于高速离心机中,12000
×
g离心5min后,吸取上层清澈液体(吸取过程中应当避免吸取白色沉淀及底部氯仿溶液),置于0.2ml ep管中,加入上样缓冲液。
[0146]
(3)琼脂糖凝胶电泳
[0147]
用1.5%琼脂糖凝胶电泳进行检测鉴定,使用凝胶成像系统观察结果。
[0148]
(4)结果判读
[0149]
有且只有一条464bp的条带,则表示存在asfv;有且只有一条207bp的条带,则表示存在csfv;有两条长短不一的条带,则表示既存在asfv又存在 csfv;没有条带,则表示既不存在asfv也不存在csfv;其余情况表示等温扩增的反应体系和/或程序有问题,无法判定是否存在asfv和/或csfv,需要重做。
[0150]
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,对于本领域的普通技术人员来说,在上述说明及思路的基础上还可以做出其它不同形式的变化或变动,这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
