1.本发明属于生物技术领域,尤其涉及一种以葡萄糖为底物生物合成葫芦二烯醇的工程菌、构建及其应用。
背景技术:
2.葫芦二烯醇是从罗汉果、西瓜、冬瓜和苦瓜等多种葫芦科植物中分离得到的葫芦烷型四环三萜类化合物的基本前体,其在生物体内能被进一步被酶修饰形成罗汉果甜苷和葫芦素等化合物。葫芦二烯醇从植物中发现,传统的生产葫芦二烯醇的是通过植物提取,但容易受到植物生长的周期性与不稳定性等因素,并不利于工业化生产,且含量极低,根据现有报道从植物中提取的含量约为万分之一。除此,目前还报道了:葫芦二烯醇的生物合成前体物质在酿酒酵母中的主要合成途径是通过mva途径合成,2分子的异戊二烯焦磷酸(ipp)分子和1分子的二甲烯丙基焦磷酸(dmapp)经浓缩形成15个碳分子的法呢基焦磷酸(fpp),2分子的fpp随后头对头耦合形成1分子的角鲨烯(squalene,sq),角鲨烯随后被酵母自身的角鲨烯环氧化酶(erg1)氧化生产2,3-环氧化角鲨烯,随后通过异源的葫芦二烯醇合酶(cbs)合成葫芦二烯醇。目前对于葫芦二烯醇生物合成的方法的优化往往是简单通过筛选不同来源的葫芦二烯醇合酶生产葫芦二烯醇,其虽然得到了相对较高的葫芦二烯醇产量,但是往往存在较多的中间产物角鲨烯,而过多的中间产物并不利于下游产业的分离纯化。
技术实现要素:
3.针对现有技术的不足,本发明的目的在于提供一种以葡萄糖为底物生物合成葫芦二烯醇的工程菌、构建及其应用,该工程菌株可以将葡萄糖转化为葫芦二烯醇,产量较高,且无中间产物角鲨烯的存在,有利于葫芦二烯醇的大规模生成。
4.提供一种以葡萄糖为底物微生物合成葫芦二烯醇的工程菌的方法,包括以下步骤:
5.1)获得西葫芦籽来源的角鲨烯环氧化酶(cpse2)替代酵母自身来源的erg1,其催化角鲨烯生成2,3环氧角鲨烯的能力优于酵母自身erg1;
6.2)利用酵母的自身同源重组系统在gal7位点过表达角鲨烯环氧化酶cpse2和角鲨烯合酶erg9;
7.3)敲除羊毛甾醇合erg7,并在该位点调控hmgs和截短hmgr的表达,获得产2,3-环氧角鲨烯的工程菌;
8.4)构建葫芦二烯醇合酶cds表达质粒,将质粒导入步骤3)的工程菌中,得到产葫芦二烯醇的酵母工程菌。
9.按上述方案,步骤(1)为:采集西葫芦籽的rna,经过反转录得到西葫芦籽来源的角鲨烯环氧化酶(cpse2)。
10.按上述方案,所述角鲨烯环氧化酶基因cpse2的核苷酸序列如seq id no.001中所
示,氨基酸序列如seq id no.002所示。该角鲨烯环氧化酶催化角鲨烯生成2,3环氧角鲨烯得活性比酿酒酵母自身来源的erg1高50%。按上述方案,步骤(3)中截短hmgr指羟甲基戊二酸单酰辅酶a还原酶蛋白截短了n端前400-551个氨基酸,优选截短羟甲基戊二酸单酰辅酶a还原酶蛋白n端前500-551个氨基酸,更优选的范围为截短羟甲基戊二酸单酰辅酶a还原酶蛋白n端前551个氨基酸。
11.按上述方案,步骤(4)具体为:通过使用高拷贝质粒prs313过表达葫芦二烯醇合酶cds生物合成模块,得到产葫芦二烯醇的酵母工程菌。
12.按上述方案,所述的酵母为酿酒酵母。
13.提供一种以葡萄糖为底物微生物合成葫芦二烯醇的工程菌株,酵母工程菌中整合了葫芦二烯醇合酶cds基因和环角鲨烯氧化酶cpse2基因。
14.按上述方案,所述的酵母工程菌上过表达角鲨烯环氧化酶cpse2和角鲨烯合酶erg9。
15.按上述方案,所述人工合成葫芦二烯醇合酶cds基因序列,其核苷酸序列如seq id no.003所示,其核苷酸序列如seq id no.004所示。
16.按上述方案,步骤(1)为:采集西葫芦籽的rna,经过反转录得到西葫芦籽来源的环角鲨烯氧化酶(cpse2)。
17.按上述方案,所述角鲨烯环氧化酶基因cpse2的核苷酸序列如seq id no.001中所示,氨基酸序列如seq id no.002所示。该角鲨烯环氧化酶催化角鲨烯生成2,3环氧角鲨烯活性比酿酒酵母自身来源的erg1高50%。
18.按上述方案,所述酵母工程菌中敲除羊毛甾醇合酶erg7位点,在该位点调控hmgs和截短hmgr的表达。
19.按上述方案,所述截短hmgr指羟甲基戊二酸单酰辅酶a还原酶蛋白n端截短了前400-551个氨基酸,优选截短羟甲基戊二酸单酰辅酶a还原酶蛋白n端前500-551个氨基酸,更优选的范围为截短羟甲基戊二酸单酰辅酶a还原酶蛋白n端前551个氨基酸。
20.本发明还有一个目的在于提供一种以葡萄糖为底物生物合成葫芦二烯醇的工程菌株在生物合成葫芦二烯醇中的应用。
21.按上述方案,所述的生物合成葫芦二烯醇的方法为:
22.将以葡萄糖为底物生物合成葫芦二烯醇的工程菌株培养,获得种子液;
23.将种子液接种到含有葡萄糖、氮源、金属元素和维生素的培养基中,分批流加补料发酵合成葫芦二烯醇;发酵过程中:分批补料葡萄糖控制葡萄糖浓度在10-15g/l。
24.按上述方案,所述的发酵温度为28-32℃;发酵时间优选为120h-144h。
25.按上述方案,发酵过程中ph控制范围为4.5-5.5;溶氧量不高于40%,优选不高于20%。
26.本发明优选的一个以葡萄糖为底物生物合成葫芦二烯醇的工程菌构建的实施方式为:
27.1)分别构建酿酒酵母角鲨烯生物合成增强模块ptef1-erg9-cyct和ptdh3-cpse2-ttp1模块,利用酵母的自身同源重组特点将这两个模块整合至酿酒酵母的基因组中。
28.2)在1)构建所得菌株基础上通过在erg7位点插入mva增强途径模块的2个表达模块ppgk1-trhmgr-tadh1和ppdc1-hmgs-tadh2模块,从而将酿酒酵母的代谢途径导向了mva
途径;
29.3)构建高等拷贝质粒表达葫芦二烯醇合酶cds,构建葫芦二烯醇生物合成模块,将其导入2)中所构建菌株,得到以葡萄糖为底物生物合成葫芦二烯醇的生产菌株。
30.本发明通过新的角鲨烯环氧化酶的挖掘并替换酵母自身的erg1,以及过表达角鲨烯环氧化酶cpse2和角鲨烯合酶erg9以增强前体物质的合成,以及可进一步地,敲除羊毛甾醇合酶erg7位点,弱化葫芦二烯醇的竞争途径;且在该位点调控hmgs和截短hmgr的表达,将酵母的代谢流导向mva途径,获得改造酵母工程菌,然后过表达葫芦二烯醇合酶cds,由此获得的酵母工程菌通过增强角鲨烯氧化模块表达、提高mva途径代谢通路和敲除羊毛甾醇竞争途径构建底盘酵母细胞工程菌,在该底盘菌的基础上表达异源蛋白葫芦二烯醇合酶,转化酿酒酵母宿主产生的2,3-单氧化角鲨烯,生成葫芦二烯醇,葫芦二烯醇产量达到1432mg/l,且无中间产物角鲨烯的存在。
31.与现有技术相比,本发明具有如下有益效果:
32.本发明通过表达高活性的异源角鲨烯环氧化酶cpse2,在酿酒酵母中催化角鲨烯生成2,3-氧化角鲨烯,以及进一步地,提高mva途径代谢通路和敲除羊毛甾醇竞争途径异源表达葫芦二烯醇合酶,最终得到从头产葫芦二烯醇的工程菌。该方法操作简单,不污染环境,产量高,且相较于现有技术,没有中间产物角鲨烯的存在,更有利于最终产物的分离提纯,为绿色生物制造葫芦二烯醇提供了一种新的解决思路方法。
附图说明:
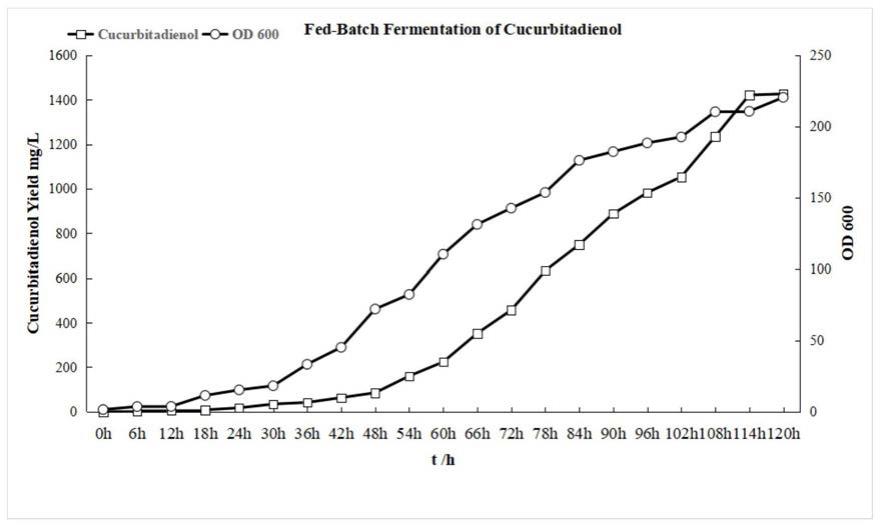
33.图1为酿酒酵母发酵生产葫芦二烯醇产量图。
具体实施方式
34.实施例1产葫芦二烯醇底盘菌的构建
35.(1)一种角鲨烯环氧化酶核苷酸的获得
36.trizol法提取西葫芦籽(cucurbita pepo)的rna,rna经过反转录盒转化成cdna模板,在用tdh3
‑‑
cpse2-f/ttp1-cpse2-r为引物组合扩增得到cpse2基因,经测序后,cpse2核苷酸片段如序列表seq id no.001中所示,其氨基酸序列见序列表seq id no.002所示,其与西葫芦籽数据库中的cpse基因同源性为99%。以酿酒酵母基因组为模板,tdh3-up/down为引物,pcr扩增后得到启动子ptdh3;同样的,以酿酒酵母基因组为模板,ttp1-up/down为引物,扩增得到ttp1终止子;将ptdh3启动子、cpse2基因和ttp1终止子使用gibson assembly的方法进行片段组装,构建得到ptdh3-cpse2-ttp1表达基因簇模块片段1,该片段编码西葫芦籽的角鲨烯氧化酶,其催化活性相较于酵母本身erg1编码的角鲨烯氧化酶的催化活性提高50%。
37.(2)增强角鲨烯基因表达模块的构建
38.以酿酒酵母基因组为模板,tef1-up/down为引物,pcr扩增后得到启动子ptef;同样的,以酿酒酵母基因组为模板,cyc1t-up/down为引物,pcr扩增后得到终止子cyc1t;以酿酒酵母基因组为模板,erg9-up/down为引物,扩增得到erg9基因组;使用overlap的构建方法,将前边的三片段进行组装,构建得到ptef1-erg9-cyct表达基因簇模块片段2。
39.以gal7-1-up/down为引物,酿酒酵母基因组为模板,扩增gal7基因上游500bp的同
源片段3;以gal7-2-up/down为引物,酿酒酵母基因组为模板,扩增gal7基因下游500bp的同源片段4;以ura3-up/down为引物,puc19-ura3基因组为模板,扩增得到ura3筛选标记标签5。
40.将上述得到的片段,利用酵母的多片段自组装技术,通过醋酸锂法制备感受态细胞。按照电转法将上述得到的5个片段以摩尔比1:1:1:1:1的方式加入感受态细胞中。转化后在sm-δura固体筛选培养基中30℃恒温培养箱培养48h,提取酵母基因组进行验证,正确的菌株命名为sc-c03。
41.a)其中醋酸锂制备酵母感受态的方法如下:
42.i)取1ml的酵母培养物(od 0.6-0.8),10 000r/min离心1min,除尽上清,
43.ii)无菌水洗涤细胞沉淀,10 000r/min离心1min,除尽上清,两遍;
44.iii)加入1ml酵母处理液(含dtt),25℃金属浴20min;
45.iv)10 000r/min离心1min,除尽上清;
46.v)加入1ml1m山梨醇(过滤除菌),充分混匀,两遍
47.vi)加入60ul 1m山梨醇,并加入2ul的目标质粒或dna片段,充分混匀后转移到电
48.转杯,冰置5min;
49.vii)2.7kv电击,电击时间为5.7ms左右均可;
50.viii)加入1ml 1m的山梨醇,转移到1.5ml的ep管中,30℃恒温振荡培养箱250
51.r/min培养48h,涂布对应筛选标签的平板,筛选阳性单克隆。
52.(3)羊毛甾醇合酶的敲除与甲羟戊酸途径的调控
53.3-羟基-3甲基戊二酸辅酶a还原酶hmgr是mva途径中的限速酶,加强hmgr表达有利于提高mva途径中甲羟戊二酸供应,hmgr含有n端跨膜区和c端催化活性区,分别发挥相应跨膜定位作用和催化活性作用,细胞中hmgr过表达会导致甲羟戊酸代谢途径反馈抑制,因此截短n端跨膜区可以降低反馈抑制和提高甲羟戊酸代谢流。通过以trhmgr-up/down为引物,酿酒酵母基因组为模板,扩增得到截短了551个氨基酸的trhmgr基因片段;以pgk1-up/down为引物,酿酒酵母基因组为模板,扩增得到ppgk1启动子;同样的以adh1-up/down为引物,酿酒酵母基因组为模板,扩增得到adh1终止子;将模块通过gibson assembly的方法进行组装构建得到ppgk1-trhmgr-tadh1基因表达片段。以pdc1-up/down为引物,酿酒酵母基因组为模板,扩增得到ppdc1启动子片段;以hmgs-up/down为引物,酿酒酵母基因组为模板,扩增得到hmgs基因片段;以tadh2-up/down为引物,酿酒酵母基因组为模板,扩增得到tadh2终止子片段,通过gibson assembly的方法进行片段组装,构建得到ppdc1-hmgs-tadh2表达片段。
54.以erg7-1-up/down为引物,酿酒酵母基因组为模板,扩增得到erg7上游500bp同源臂片段;以trp1-f/r为引物,puc19-trp1质粒为模板,扩增得到trp1筛选抗性片段基因;以erg7-2-up/down为引物,酿酒酵母基因组为模板,扩增得到erg7基因下游500bp的同源片段。将ppgk1-trhmgr-tadh1、ppdc1-hmgs-tadh2和erg7上下游同源片段、trp1筛选标签用酵母的多片段同源重组策略,整合至sc-c03菌株,孵育后的菌液涂布sm-δura,δtrp平板,筛选出的阳性单克隆提基因组验证,得到调控甲羟戊酸途径且弱化羊毛甾醇合酶的sc-c05菌株。
55.实施例2产葫芦二烯醇酿酒酵母工程菌的构建
56.1)葫芦二烯醇合酶基因片段获得
57.人工合成葫芦二烯醇合酶cds基因序列,其核苷酸序列见seq id no.003,其核苷酸序列见seq id no.004,将其构建至puc19质粒载体骨架,得到puc19-cds质粒;以酿酒酵母基因组为模板,tef-up/down为引物,扩增得到ptef启动子片段;同时以酿酒酵母基因组为模板,cyc1-up/down为引物,扩增得到tcyc终止子片段;以puc19-cds质粒为模板,cds-1-up/down为引物,扩增得到cds基因片段,将启动子ptef、cds结构基因片段、tcyc1终止子片段通过overlap的方法将三片段进行组装,得到ptef-cds-tcyc1表达模块,使用gibson assembly的方法将ptef-cds-tcyc1表达模块质粒整合puc19质粒上,构建得到puc19-ptef-cds-tcyc1表达模块质粒。
58.2)一种产葫芦二烯醇酿酒酵母工程菌的构建
59.以sacii-ptef-f/sacii-tcuc1-r为引物,puc19-ptef-cds-tcyc1表达模块质粒为模板扩增得到两端含sacii酶切位点的ptef-cds-tcyc1表达模块;随后对prs313载体和ptef-cds-tcyc1表达模块使用sacii酶进行酶切处理,酶连后的质粒转入dh5α感受态中,筛选测序得到正确的prs313-ptef-cds-tcyc1质粒。
60.将上述构建得到的prs313-ptef-cds-tcyc1质粒转入sc-c05菌株中,构建得到产葫芦二烯醇酿酒酵母工程菌sc-c10菌株。
61.实施例3.一株产葫芦二烯醇酿酒酵母工程菌的发酵
62.摇瓶发酵:挑取固体平板上活化的sc-c10单克隆,于ypd液体培养基中30℃250rpm过夜振荡培养制备种子液;将制备好的种子液接种至δleu高密度发酵培养基振荡培养5d进行发酵液测量。其中发酵培养基配方如下:
63.发酵培养基:25g/l的葡萄糖,15g/l(nh4)2so4,8g/l k2hpo4,3g/l mgso4*7h2o,5g/l赖氨酸,10ml微量元素(含15g/l edta,10.2g/l znso4*7h2o,0.5g/l mncl2*4h2o,0.86g/l cocl2*6h2o,0.5g/l cuso4,0.56g/l na2moo4*2h2o,3.84g/l cacl2,5.12g/l feso4*7h2o),12ml维生素(含0.05g/l生物素,0.2g/l对氨基苯甲酸,1g/l烟酸,1g/l泛酸钙,1g/l盐酸硫胺,1g/l盐酸吡哆醛1.25g/l肌醇)。1l补料培养基:400g/l葡萄糖,10ml的微量元素。发酵过程控制温度为30℃,溶氧优选控制在不超过20%,ph设置为5.5,溶氧和转速相偶联,当溶氧值高于40%时加入补料培养基至维持葡萄糖在15g/l,发酵5d后取发酵液进行检测,见图1。
64.葫芦二烯醇的产品检测方法
65.取发酵液于破碎管中,13000rpm离心2min,弃上清,重复2次;加入与沉淀等体积的玻璃珠(直径0.5mm)后,加入500ul的萃取液(甲醇:丙酮=1:1),振荡破碎5min,超声破碎30min,12000rpm离心5min,取上清液重复1次。上清液过滤至也想小瓶后,使用gc-ms进行样品的定性和定量分析。gc-ms测定条件:进样口温度300℃,进样体积1ul,不分流,溶剂延时12min,色谱柱:hp-5ms(30mm x 0.25mm);色谱条件:80℃,保持1min;20℃/min升温至300℃,保持15min;ms条件:sim:69、218、363和411.
66.结果显示sc-c10酿酒酵母工程菌摇瓶发酵产葫芦二烯醇产量达到62.3mg/l,检测发酵液中无角鲨烯的产生;高密度发酵中葫芦二烯醇产量达到1432mg/l,在初始发酵24h检测到30mg/l的角鲨烯的生成,在最终发酵120h时未检测到中间体角鲨烯的生成。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
