1.本发明涉及质谱检测技术领域,特别涉及一种基于磁性固相萃取的脂溶性维生素的液相色谱串联质谱检测方法。
背景技术:
2.维生素a是一种脂溶性维生素,对人体生长发育、维持正常身体机能、抵抗疾病等有重要作用,由视黄醇和长链脂肪酸结合而成的视黄酯是人体储存维生素a的主要形式。缺乏维生素a会导致夜盲症、生殖功能受损、免疫功能下降、骨代谢失常等生理机能损伤;而过量摄入维生素a会引起毒副作用。维生素d是一种脂溶性维生素,主要由维生素d2、维生素d3两种活性成分组成,维生素d在肝脏内被转化为25-羟基维生素d,临床上以25-羟基维生素d作为评价体内维生素d营养水平的指标。25-羟基维生素d是调节人体钙磷代谢的重要因子,协调骨钙的动员或沉积、尿钙的吸收或排泄,维持体内血钙水平的稳定,对骨骼发育、肌肉神经传导、信息传递等生命活动至关重要。儿童缺乏维生素d时表现为佝偻病,成人缺乏表现为骨软化、骨质疏松;维生素d过量则会引起钙的吸收增加,导致高钙血症。维生素e是一组以立体异构体存在的生育酚类物质,其中以α-生育酚活性最强,维生素 e是具有抗氧化功效的脂溶性维生素,它具有保护细胞膜完整性的重要功能,可预防动脉粥硬化,同时还能抑制平滑肌细胞增殖,增强一些酶的活性并抑制另一些酶的活性,从而达到调控目的基因的表达,长期缺乏维生素e会导致神经系统不正常,如肌肉共济失调、反射减退、失明及痴呆。综上,脂溶性维生素在人体生长、代谢、发育过程中发挥着重要的作用。合理的维生素水平对维持人体健康十分重要,准确测定人体中脂溶性维生素的含量,可以指导人们科学合理的补充维生素,预防疾病,提高生活质量,同时对脂溶性维生素缺乏或过量的临床判断、治疗管理和生理评估具有辅助诊断的意义。
3.在临床质谱体外诊断试剂中,检测血清中脂溶性维生素常用方法有蛋白沉淀(ppt)、液液萃取法(lle)、蛋白沉淀(ppt) 液液萃取法(lle)、固相萃取法(spe),固相支持液液萃取法(sle)等,其中蛋白沉淀 液液萃取法应用最为广泛,该方法具有成本低的特点,这种方法去除内源性干扰物的能力较差,容易堵塞色谱柱及污染质谱仪器,同时实验中使用了挥发性强的试剂,对实验人员存在健康隐患;例如专利:cn110779780a公开的一种高效液相色谱串联质谱检测血清中脂溶性维生素的样品前处理方法,其使用乙醇进行蛋白沉淀,并使用正己烷进行液液萃取、氮气吹干萃取液、样品复溶才可将样品进样分析,过程繁琐、需要大量人工操作,实验效率低下。达到。固相萃取法利用固相萃取填料与目标物的作用力,选择性吸附目标物,可以达到良好的净化效果,但固相萃取法使用的固相萃取柱/固相萃取96孔板均为高成本实验耗材,实验中固相萃取填料接触到有机试剂之后会产生溶胀现象,会影响溶液通过固相萃取填料的流速,从而产生孔间均一性差的问题;例如专利cn111198238a公开的血清中维生素d代谢物-25(oh)d3的萃取方法及检测方法,该方法首先对样品进行蛋白沉淀,然后再将沉淀的混合溶液上样至活性炭96孔板上,使用正己烷等强
挥发试剂进行洗脱,氮气吹干洗脱液后进行样品的复溶,该方法在使用了高成本耗材的情况下操作步骤依旧繁琐,效率低下。而固相支持液液萃取法实验机理为液液萃取机理,产品形式为96孔板,同样也属于高成本的实验耗材,实验中需要使用大量挥发性强的有机试剂,对实验环境及人员均不友好,例如专利cn110763788a公开的高效液相色谱-串联质谱结合固相支持液液萃取法定量检测五种脂溶性维生素的方法。以上三种方法,还均存在一个共同的问题,即不便于实现全自动化样品前处理,不利于提高临床质谱样品前处理环节的工作效率。
4.所以,现在需要提供一种操作简单、回收率高、成本低、更可靠、更高效的脂溶性维生素样品前处理方案,该方案需克服现有方法存在的不足,从而提高临床质谱脂溶性维生素样品处理效率,并保证检测结果可靠、稳定。
技术实现要素:
5.本发明所要解决的技术问题在于针对上述现有技术中的不足,提供一种基于磁性固相萃取的脂溶性维生素的液相色谱串联质谱检测方法。
6.为解决上述技术问题,本发明采用的技术方案是:一种基于磁性固相萃取的脂溶性维生素的液相色谱串联质谱检测方法,该方法包括以下步骤:
7.1)制备测试样品:
8.1-1)取待测的脂溶性维生素样品,向其中加入内标溶液,混匀;
9.1-2)取磁性固相萃取填料,进行活化处理;
10.1-3)将磁性固相萃取填料加入到步骤1-1)得到的溶液中,混匀得到混合液a;
11.1-4)通过外加磁场将混合液a中的磁性固相萃取填料转移至清洗液中,清洗;
12.1-5)通过外加磁场将步骤1-4)的产物中的磁性固相萃取填料转移至洗脱液中,洗脱;
13.1-6)通过外加磁场去除步骤1-5)的产物中的磁性固相萃取填料,将剩余的溶液稀释混匀,得到测试样品;
14.2)构建标准曲线:
15.配置不同浓度的脂溶性维生素标准液,供液相色谱串联质谱法检测,以构建待测的脂溶性维生素的标准曲线;
16.3)采用液相色谱串联质谱法对测试样品进行检测,结合构建的标准曲线得到测试样品中的脂溶性维生素的含量。
17.优选的是,所述步骤1-2)具体为:将磁性固相萃取填料加入到甲醇中进行活化,然后通过外加磁场将磁性固相萃取填料转移到水中进行填料平衡。
18.优选的是,其中,清洗液为甲醇的体积分数占2-70%的甲醇水溶液。
19.优选的是,所述步骤1-4)具体为:
20.1-4-1)先通过外加磁场将混合液a中的磁性固相萃取填料转移至甲醇的体积分数占2%-30%的甲醇水溶液中,混合30-120s;
21.1-4-2)然后再将磁性固相萃取填料转移至甲醇的体积分数占50%-70%的甲醇水溶液中,混合30-120s。
22.优选的是,所述洗脱液为甲醇和异丙醇的混合液,且甲醇与异丙醇的体积比为7:3
~9:1。
23.优选的是,所述步骤1)具体包括:
24.1-1)取50-150μl待测的脂溶性维生素样品,向其中加入5-15μl内标溶液,500-1500转/分钟下混匀1-4min;
25.1-2)将0.5-6mg的磁性固相萃取填料加入到100-300μl的甲醇中进行活化,然后通过外加磁场将磁性固相萃取填料转移到200-600μl的水中进行填料平衡;
26.1-3)将磁性固相萃取填料加入到步骤1-1)得到的溶液中,混匀1-5min, 得到混合液a;
27.1-4)通过外加磁场将混合液a中的磁性固相萃取填料转移至清洗液中进行清洗,具体包括:
28.1-4-1)先通过外加磁场将混合液a中的磁性固相萃取填料转移至 300-700μl的甲醇的体积分数占2%-30%的甲醇水溶液中,混合30-120s;
29.1-4-2)然后再将磁性固相萃取填料转移至300-700μl的甲醇的体积分数占50%-70%的甲醇水溶液中,混合30-120s;
30.1-5)通过外加磁场将步骤1-4)的产物中的磁性固相萃取填料转移至 50-200μl的甲醇和异丙醇的混合液中,混合30-120s;该混合液中的甲醇与异丙醇的体积比为7:3~9:1;
31.1-6)通过外加磁场将步骤1-5)的产物中的磁性固相萃取填料转移至步骤1-4-1)剩余的溶液中,丢弃;再向步骤1-5)的产物中剩余的溶液中加入 10-100μl的高纯水稀释,500-1500转/分钟下混匀1-5min,得到测试样品。
32.优选的是,所述步骤1)具体包括:
33.1-1)取100μl待测的脂溶性维生素样品,向其中加入10μl内标溶液, 1000转/分钟下混匀2min;
34.1-2)将2.5mg的磁性固相萃取填料加入到200μl的甲醇中进行活化,然后通过外加磁场将磁性固相萃取填料转移到400μl的水中进行填料平衡;
35.1-3)将磁性固相萃取填料加入到步骤1-1)得到的溶液中,混匀2min, 得到混合液a;
36.1-4)通过外加磁场将混合液a中的磁性固相萃取填料转移至清洗液中进行清洗,具体包括:
37.1-4-1)先通过外加磁场将混合液a中的磁性固相萃取填料转移至500μl 的甲醇的体积分数占20%的甲醇水溶液中,混合60s;
38.1-4-2)然后再将磁性固相萃取填料转移至500μl的甲醇的体积分数占 50%的甲醇水溶液中,混合60s;
39.1-5)通过外加磁场将步骤1-4)的产物中的磁性固相萃取填料转移至 100μl的甲醇和异丙醇的混合液中,混合60s;该混合液中的甲醇与异丙醇的体积比7:3;
40.1-6)通过外加磁场将步骤1-5)的产物中的磁性固相萃取填料转移至步骤1-4-1)剩余的溶液中,丢弃;再向步骤1-5)的产物中剩余的溶液中加入 30μl的高纯水稀释,1000转/分钟下混匀2min,得到测试样品。
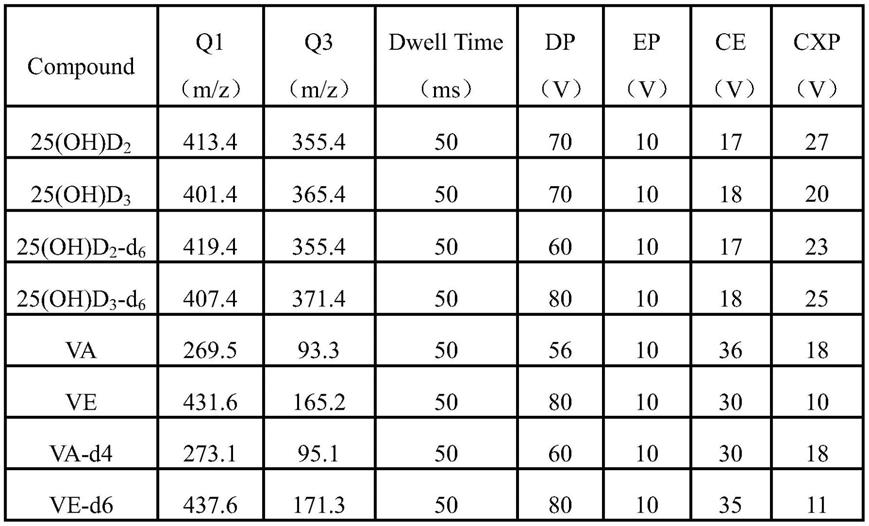
41.优选的是,所述步骤3)中,液相色谱检测条件为:
42.色谱柱:十八烷基填料色谱柱;
43.流动相:a相为甲酸水溶液,b相为甲酸甲醇溶液;
44.梯度洗脱程序:0-0.5min,70%b;0.5-1.5min,100%b;1.5-3.5min, 100%b;3.5-3.6min,70%b;3.6-5.0min,70%b;
45.流速:0.6ml/min;进样量:10μl;柱温:30℃。
46.优选的是,所述步骤3)中,质谱条件为:
47.离子源:电喷雾离子源;
48.检测方式:多反应监测;
49.气帘气20psi,喷雾器60psi,辅助加热气55psi,温度400℃,离子化电压5000v,碰撞气4psi。
50.优选的是,其中,脂溶性维生素包括维生素a、25-羟基维生素d2、25
‑ꢀ
羟基维生素d3、维生素e中的一种或多种。
51.本发明的有益效果是:
52.本发明提供的基于磁性固相萃取的脂溶性维生素的液相色谱串联质谱检测方法,使用了磁性固相萃取方法进行样本中脂溶性维生素的前处理,其基于基质分散型固相萃取,藉由外部磁场将磁性固相萃取填料进行转移,整个实验流程易于实现自动化;同时,还保留了固相萃取高选择性、高净化率等优点;
53.本发明通过磁性固相萃取填料分散吸附增加接触面积,能提高吸附速率及富集效果,缩短平衡时间;本发明能够避免spe流速差异、填料溶胀等误差,降低质谱检测变异性;
54.本发明的样品处理步骤能够去除内源性磷脂、蛋白质等物质的干扰,降低基质效应与仪器污染风险。
附图说明
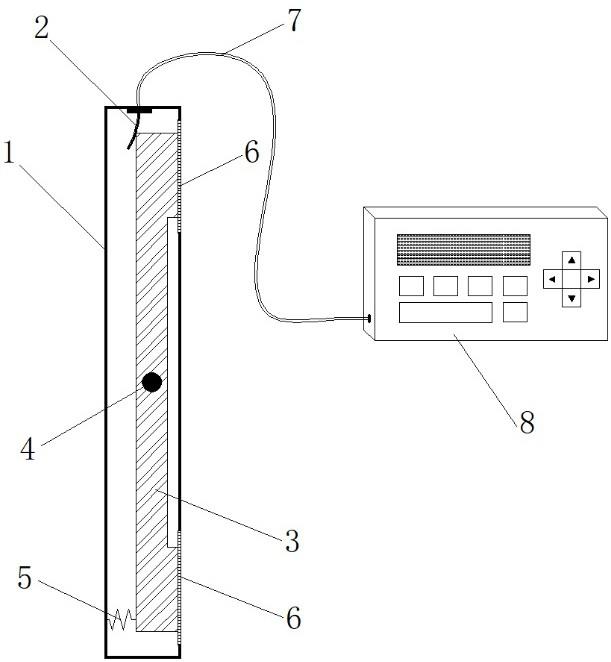
55.图1为本发明中的实施例中的磁性固相萃取填料的转移示意图;
56.图2(a)-2(d)为本发明的实施例中的目标物色谱图;
57.图3(a)-3(d)为本发明的实施例中的目标物的标准曲线图。
具体实施方式
58.下面结合实施例对本发明做进一步的详细说明,以令本领域技术人员参照说明书文字能够据以实施。
59.应当理解,本文所使用的诸如“具有”、“包含”以及“包括”术语并不排除一个或多个其它元件或其组合的存在或添加。
60.试剂来源说明
61.(1)维生素a(美国sigma alrdich,99.4%);
62.(2)25-羟基维生素d2(加拿大多伦多研究化学,97%);
63.(3)25-羟基维生素d3(加拿大多伦多研究化学trc,97%);
64.(4)维生素e(sigma alrdich,99.2%);
65.(5)维生素a-d4(荷兰buchem bv,98%);
66.(6)25-羟基维生素d
2-d6(medical isotopes,99%);
67.(7)25-羟基维生素d
3-d6(medical isotopes,98%);
68.(8)维生素e-d6(上海谱芬生物,95%);
69.(9)甲醇(康科德科技有限公司);
70.(10)正己烷(康科德科技有限公司);
71.(11)甲酸(fisher chemical公司);
72.(12)牛血清白蛋白(amresco公司);
73.(13)高纯水为符合国际gb/t 6682-2008的一级水。
74.实施例1
75.本实施例提供一种基于磁性固相萃取的脂溶性维生素的液相色谱串联质谱检测方法,该方法包括以下步骤:
76.1、制备测试样品:
77.1-1)取100μl待测的脂溶性维生素样品,向其中加入10μl内标溶液, 1000转/分钟下混匀2min;
78.1-2)将2.5mg的磁性固相萃取填料加入到200μl的甲醇中进行活化,然后通过外加磁场将磁性固相萃取填料转移到400μl的水中进行填料平衡;
79.1-3)将磁性固相萃取填料加入到步骤1-1)得到的溶液中,混匀2min, 得到混合液a;
80.1-4)通过外加磁场将混合液a中的磁性固相萃取填料转移至清洗液中进行清洗,具体包括:
81.1-4-1)先通过外加磁场将混合液b中的磁性固相萃取填料转移至500μl 的甲醇的体积分数占20%的甲醇水溶液中,混合60s;
82.1-4-2)然后再将磁性固相萃取填料转移至500μl的甲醇的体积分数占 50%的甲醇水溶液中,混合60s;其中,通过20%的甲醇水溶液和50%的甲醇水溶液进行2步淋洗,能充分去除磷脂、多肽等干扰分子,且基本不会造成目标分子的损失;
83.1-5)通过外加磁场将步骤1-4)的产物中的磁性固相萃取填料转移至 100μl的甲醇和异丙醇的混合液中,混合60s;该混合液中的甲醇与异丙醇的体积比7:3;
84.1-6)通过外加磁场将步骤1-5)的产物中的磁性固相萃取填料转移至步骤1-4-1)剩余的溶液中,丢弃;再向步骤1-5)的产物中剩余的溶液中加入 30μl的高纯水稀释,1000转/分钟下混匀2min,得到测试样品。
85.其中,可通过磁性固相萃取仪器施加外加磁场进行磁性固相萃取填料的转移,本实施例中采用磁性固相萃取仪器,磁性固相萃取填料为磁性微球或磁珠等亲水亲脂平衡型磁性固相萃取填料。
86.参照图1,为磁性固相萃取填料转移示意图,其中采用磁性固相萃取仪器为磁棒,磁棒外套有搅拌套,通过磁棒的磁性收集磁珠(磁性固相萃取填料)。
87.2、构建标准曲线:
88.配置不同浓度的脂溶性维生素标准液,供液相色谱串联质谱法检测,以构建待测的脂溶性维生素的标准曲线;
89.将标准品维生素a、25-羟基维生素d2、25-羟基维生素d3、维生素e、维生素a-d4、25-羟基维生素d
2-d6、25-羟基维生素d
3-d6、维生素e-d6通过稀释配置得到各维生素标准液。维
(25-羟基维生素d3)、ve(维生素e)的含量。参照图2(a)-(d) 为目标物色谱图,其中,(a)va的色谱图;(b)25(oh)d2的色谱图;(c) 25(oh)d3的色谱图;(d)ve的色谱图。参照图3(a)-(d)为目标物的标准曲线图,其中,(a)va的标准曲线图;(b)25(oh)d2的标准曲线图;(c) 25(oh)d3的标准曲线图;(d)ve的标准曲线图。
104.本实施例中对磁性固相萃取填料的添加量进行了详细优化,通过采用不同添加量的磁性固相萃取填料进行实验,并综合考量整体检测方法,确定了磁性固相萃取填料的添加量。不同添加量下,对比洗脱液峰面积数据如下表 2:
105.表2
[0106][0107][0108]
由实验数据可见,磁性固相萃取填料质量为0.5mg-1.5mg时,由于填料的官能团数量不够吸附目标物,会有部分物质会在淋洗阶段损失掉,因此洗脱液中目标物的峰面积偏小。1.5mg-3.0mg范围,目标物的峰面积变化不大。实验中,洗脱剂的体积一定时,磁性固相萃取填料量越少洗脱可进行得越充分。以人血清中含量偏低的25(oh)d2与25(oh)d3为实验考量点,磁性固相萃取填料用量为2.5mg时,可获得最好的实验效果。微球用量为3.0mg时, va与ve的峰面积最大,但是这两个组分的含量均为μg级别,为较高含量的组分,降低微球用量对va与ve的损失量影响不大。经过优化,确定使用磁性固相萃取填料的质量为2.5mg。
[0109]
本实施例中还对不同的洗脱液以及其比例进行了详细的优化对比实验,并综合考量整体检测方法,确定了洗脱液的配方。本实施例中,采用不同溶剂作为洗脱液进行目标物洗脱,对比洗脱液峰面积数据如下表3:
[0110]
表3
[0111]
洗脱液溶剂组成25(oh)d225(oh)d3vave乙腈20144652441962414025698甲醇30257905453026484989570乙腈/甲醇(1/1)25832809962308264406725甲醇/异丙醇(9/1)402191742323075075757981甲醇/异丙醇(7/3)632191905806773255930353甲醇/异丙醇(6/4)640151950297047656545505
[0112]
本实施例中尝试了乙腈、甲醇、异丙醇三种试剂及相应混合试剂的洗脱效果,实验发现乙腈作为洗脱剂时,对目标物的洗脱效果较差,同时乙腈与甲醇混合试剂的实验结果也类似。本发明的目标物均为亲脂性较强的维生素,洗脱剂使用醇类物质进行洗脱效果较
为理想,因此尝试了甲醇与异丙醇的组合试剂,实验中发现,当洗脱剂中含有异丙醇时,比纯甲醇的洗脱效果更为理想,同时异丙醇的含量越高,效果越明显。当异丙醇含量增加至40%时,目标物的峰面积增加得不明显,但是此时洗脱液中需要加入较大体积的水进行稀释才能消除进样时带来的溶剂效应,相当于样本被较大比例的稀释了,这对于低含量组分的检测是不利的。因此实验中使用甲醇:异丙醇为7:3的混合溶剂进行洗脱,即可获得良好的效果。
[0113]
尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用,它完全可以被适用于各种适合本发明的领域,对于熟悉本领域的人员而言,可容易地实现另外的修改,因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。