柱状黄杆菌vi型分泌系统效应分子及其免疫蛋白及应用
技术领域
1.本发明属于分子生物学领域,具体涉及柱状黄杆菌vi型分泌系统(type vi secretion system,t6ss)效应分子及其免疫蛋白及应用。
背景技术:
2.柱状黄杆菌(flavobacterium columnare)是拟杆菌门的一种鱼类病原菌,在全球范的自然环境和人工养殖环境中均有分布,能感染几乎所有淡水养殖鱼类,并常常带来巨大的经济损失。鱼类感染柱状黄杆菌后,通常会在在鱼类的鳃部、体表和鳍条根部定植,并呈柱状堆积。病鱼相应逐渐出现鳃部溃烂、背部溃疡和鳍条坏死等一系列症状。人们将该病称为柱形病或细菌性烂鳃病。
3.与变形菌门病原菌已得到深入广泛的研究不同,柱状黄杆菌因为遗传操作困难、遗传改造效率低,该菌的致病机制研究一直进展缓慢。近些年,由于基因组测序技术不断提高,柱状黄杆菌在世界各地分离的菌株也得到了全基因组测序,部分菌株的序列已经提交至ncbi数据库。因此,申请人根据已公布的62株柱状黄杆菌的全基因组序列,进行比对分析发现,该菌具备细菌的vi性分泌系统(type vi secretion system,t6ss)和ix型分泌系统(typeix secretion system,t9ss)编码基因。但是,目前仅报道柱状黄杆菌的t9ss与其毒力密切相关,而vi性分泌系统(type vi secretion system,t6ss)的功能研究则未见任何报道。由于t6ss主要通过向靶细胞分泌效应分子,发挥毒力作用,因此,开展柱状黄杆菌t6ss效应分子的功能研究,探讨其在柱状黄杆菌致病过程中所起的作用,对于深入了解该菌的致病机制、降低鱼类感染柱形病的风险,进而推动该病的科学防治具有积极意义。
4.本发明通过深入分析62株已报道的柱状黄杆菌全基因组序列,并结合构建t6ss结构蛋白突变株,从数十个柱状黄杆菌胞外蛋白中开展该菌t6ss效应分子的研究,最终获得4对柱状黄杆菌t6ss效应分子及免疫蛋白。
技术实现要素:
5.本发明的目的是提供柱状黄杆菌t6ss效应分子及其免疫蛋白在细菌竞争生长中的应用,所述的柱状黄杆菌效应分子的序列为seq id no.2所示,所述的免疫蛋白为seq id no.4所示。
6.本发明的最后一个目的在于提供了柱状黄杆菌t6ss效应分子或其免疫蛋白在制备柱状黄杆菌检测试剂中的应用。
7.为了实现上述目的,本发明采用了以下技术措施:
8.柱状黄杆菌菌t6ss效应分子及其免疫蛋白,所述的效应分子为seq id no.2所示,所述的免疫蛋白为seq id no.4所示。编码seq id no.2所示蛋白的基因之一为seq id no.1所示,编码免疫蛋白为seq id no.4所示蛋白的基因之一为seq id no.3所示。
9.本发明的保护范围包括:柱状黄杆菌t6ss效应分子及其免疫蛋白在细菌竞争生长中的应用;
10.柱状黄杆菌t6ss效应分子或其免疫蛋白在制备柱状黄杆菌检测试剂中的应用。
11.柱状黄杆菌t6ss效应分子及其免疫蛋白在制备柱状黄杆菌弱毒苗中的应用。
12.与现有技术相比,本发明具有以下优点:
13.1.首次在柱状黄杆菌这一鱼类病原中筛选到柱状黄杆菌t6ss效应分子fse及其免疫蛋白fsi,并发现其分别在基因组中具有4个拷贝,明确了效应分子及其免疫蛋白在基因组中的相对位置。
14.2.首次在柱状黄杆菌中成功缺失了4对柱状黄杆菌t6ss效应分子fse及其免疫蛋白fsi,以便从事柱状黄杆菌研究的人员能快速且深入研究其致病机制。
15.3.首次实现了对柱状黄杆菌t6ss效应分子fse及其免疫蛋白fsi的原核表达。
16.4.首次通过在大肠杆菌(escherichia coli)中进行诱导表达的方式,直接证明fse为柱状黄杆菌t6ss效应分子,能将大肠杆菌直接致死;并通过fse与fsi共表达的方式,首次证明fsi作为免疫蛋白,可以将fse的毒性中和。
17.5.首次将柱状黄杆菌t6ss效应分子fse及其免疫蛋白fsi的缺失突变株,与其它病原进行竞争生长培养试验,进一步证明柱状黄杆菌t6ss效应分子及其免疫蛋白对其它细菌具有毒性,为开发弱毒疫苗株奠定了基础。通过在候选疫苗株中敲除这些细菌竞争生长必需基因,从而实现候选疫苗株在自然界中的自然清除。
附图说明
18.图1为柱状黄杆菌t6ss效应分子fse及其免疫蛋白fsi对大肠杆菌的裂解情况。
19.图2为柱状黄杆菌t6ss效应分子fse及其免疫蛋白fsi缺失突变株与嗜水气单胞菌竞争生长结果。
20.图3为柱状黄杆菌t6ss效应分子fse及其免疫蛋白fsi的单克隆抗体检测细菌结果示意图;其中:(a)fse分子的单克隆抗体检测柱状黄杆菌野生型g4、fcg-107(δfse)和互补株fcg-168(fse
)中fse基因的表达情况;(b)fsi分子的单克隆抗体检测柱状黄杆菌野生型g4、fcg-84(δfsefsi)和互补株fcg-168(fsi
fse
)中fsi基因的表达情况。
21.图4为红色荧光标记的弱毒疫苗株fcg-60(δctl2)和绿色荧光标记的fcg-169(δctl2δfse fsi)菌株单独培养和共培养情况下的活菌数。
具体实施方式
22.下面结合附图及实施例子对本发明作进一步说明,但并不作为对本发明权利范围的限制。本发明所述技术方案,如未特别说明,均为本领域的常规技术。
23.本发明实施例所用的柱状黄杆菌强毒株野生型为g4株(difference in genes between ahigh virulence strain g
4 and a low virulence strain g
18 of flavobacterium columnare by using suppression subtractive hybridization.li n,zhang j,zhang lq,nie p.j fish dis.2010may;33(5):403-12.doi:10.1111/j.1365-2761.2009.01132.x.epub 2010jan 24.)。实施例中所涉及的基因缺失突变株是在g4株中,进行基因缺失突变获得的菌株。
24.实施例1:
25.柱状黄杆菌t6ss候选效应分子及其免疫蛋白的获得:
26.申请人通过构建不同的t6ss结构蛋白缺失突变株,以对其缺失后效应分子的变化进行筛选,最终筛选出效应分子fse(seq id no.2所示)及其免疫蛋白fsi(seq id no.4所示)。本发明的效应分子fse的编码基因有4个拷贝分布在柱状黄杆菌的基因组上,与该四个效应分子对应的,免疫蛋白fsi的编码基因也有四拷贝分布在柱状黄杆菌的基因组上。
27.以缺失柱状黄杆菌t6ss结构蛋白tssc为例,说明t6ss结构蛋白缺失突变株的构建方法。包括以下步骤:
28.(1)确定tssc基因的待缺失dna序列
29.通过生物信息学分析以确定tssc基因的功能结构域,并初步确定待缺失的dna片段长度。
30.(2)确定待缺失区域的上下游序列、构建基因敲除质粒
31.本例中,将tssc基因的开放阅读框编码的起始密码子上游的序列和起始密码子,以及终止密码子及其下游序列扩增并连接后,克隆至柱状黄杆菌自杀质粒pms75的bamhi和sphi酶切位点。最终形成用于tssc基因缺失的自杀质粒pnl-25。
32.(3)将基因敲除质粒转入柱状黄杆菌野生型菌株
33.将上一步获得的基因敲除质粒pnl-25转化到大肠杆菌(escherichia coli)菌株s17-1λpir中。将携带质粒pnl-25的大肠杆菌和野生型柱状黄杆菌分别培养至对数生长期,离心收集菌体。分别用不含抗生素的shieh液体培养基分别洗涤两次,并重悬至100μl并滴在无抗的shieh固体培养基上。将该平板在28℃静置培养20-24h。
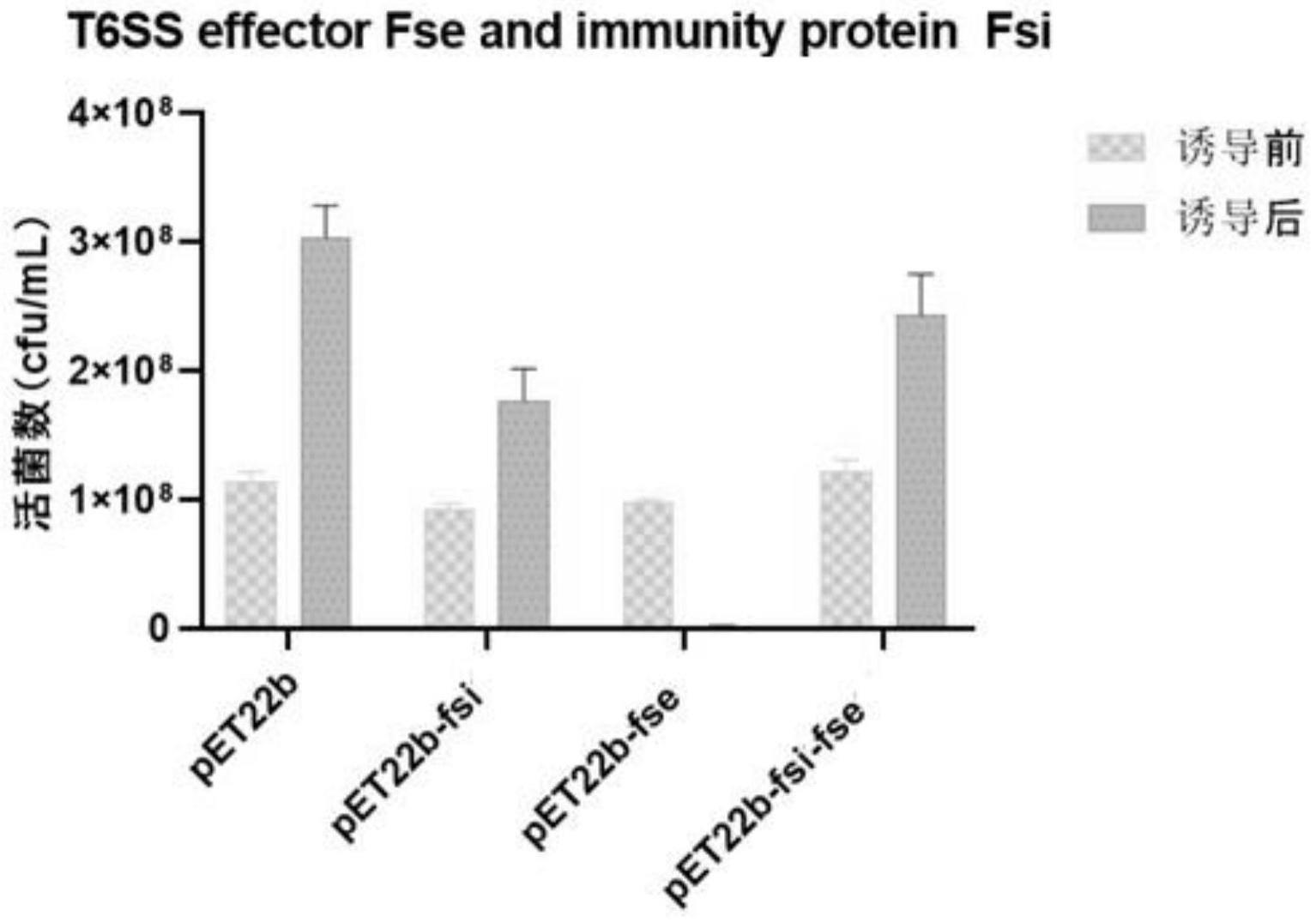
34.(4)筛选在柱状黄杆菌中发生两次同源重组的菌株
35.将已完成接合转移的细菌混合物涂布至含四环素的shieh平板,28℃静置培养至有菌落长出。该菌落即为完成第一次同源重组的菌株。
36.无菌挑取菌落并分别接种在无抗shieh液体培养基中过夜培养,再将菌液涂布于含10%蔗糖的shieh平板。在28℃静置培养24-48h,选择单菌落分别在含四环素和不含四环素的shieh平板上划线培养。选取将只能在无四环素的shieh平板上生长的该菌株即可获得经过两轮同源重组的细菌。
37.(8)缺失突变株筛选和确认
38.将经过两轮同源重组的细菌接种至液体shieh培养基中,振荡培养至对生生长期。在待缺失dna区域的序列的上游和下游分别选择一段序列作为正向引物和反向引物,菌液pcr方法检测经过两轮同源重组的细菌,将该菌株毒力基因已发生缺失突变的菌株命名为fcg-44,将其用于t6ss效应分子筛选试验。
39.柱状黄杆菌野生型和tssc突变株胞外蛋白质组分析:
40.分别将柱状黄杆菌野生型和tssc突变株培养至对数生长期,离心收集培养液上清。将两组培养物的上清液用0.2μm的滤膜过滤除菌后,进行质谱分析。从中筛选到野生型和突变株的胞外差异蛋白。进一步的,从这些差异蛋白中对效应分子进行筛选。
41.最终,筛选出本发明的效应分子fse(seq id no.2所示)及其免疫蛋白fsi(seq idno.4所示),编辑seq id no.2所示蛋白的基因为seq id no.1所示(也可以根据密码子形成其他的基因序列),编辑seq id no.4所示蛋白的基因为seq id no.3所示(也可以根据密码子形成其他的基因序列)。上述序列,在ncbi数据库中均被预测为uncharacteri zed protein,即功能未知的序列。
42.实施例2:
43.柱状黄杆菌t6ss效应分子fse及其免疫蛋白fsi对大肠杆菌的裂解能力:
44.(1)构建fse和fsi蛋白原核表达质粒和原核表达菌株
45.分别将fse和fsi蛋白的编码基因fse和fsi的完整开放阅读框克隆至原核表达载体pe t-22b的bamhi和hindiii位点,再将fse和fsi蛋白的编码基因fse和fsi的完整开放阅读框串联克隆至pet-22b的bamhi和hindiii位点。获得的三个重组质粒分别命名为pet22b-fse、pet22b-fsi和pet22b-fsi-fse。将这三个重组质粒分别转化大肠杆菌表达菌株de3中,获得重组大肠杆菌,分别将其命名为e131、e130和e132。同时将空质粒pet-22b也转化到de3菌株中,命名为e125。重组的菌株用于检测表达蛋白的裂解作用和中和作用。
46.(2)原核表达的fse蛋白对大肠杆菌的裂解
47.分别将上述步骤中获得的4株菌培养至对数生长期(od
600
=0.4~0.5),各取1ml至新的离心管中在16℃继续过夜振荡培养,原管中各加入iptg至终浓度为0.5mm,在16℃过夜振荡培养。次日,将培养物分别进行10倍梯度稀释后,涂布lb平板进行计数分析。计数结果见图1。
48.通过该实验可发现:e125(pet22b)、e130(pet22b-fsi)和e132在诱导表达后,活菌数都在继续增加,而e131(pet22b-fse)经过相同处理后,活菌数在下降。这表明e131中携带的fse基因为t6ss效应分子基因。fse基因的裂解效果在e132(pet22b-fsi-fse)中,通过fsi基因的共表达被中和。因此,fsi基因为t6ss效应分子基因共轭的免疫蛋白编码基因。
49.实施例3:
50.柱状黄杆菌t6ss效应分子fse及其免疫蛋白fsi缺失突变株与嗜水气单胞菌竞争生长:
51.柱状黄杆菌毒力fse和fsi基因在柱状黄杆菌基因组中各有4个拷贝,并且成对分布。根据实施例1中的方法,将这四个基因对在柱状黄杆菌基因组中进行缺失,构建四缺失突变株fcg-84(δfsiδfse)。另外,再将fse基因在柱状黄杆菌基因组中存在的4个拷贝进行共缺失,构建缺失突变株fcg-107(δfse)。通过检测柱状黄杆菌野生型、fcg-84和fcg-107与绿色荧光(gfp)标记的嗜水气单胞菌ah-1竞争生长的情况,进一步确定fse和fsi基因在柱状黄杆菌竞争生长中所发挥的功能。
52.fcg-84缺失突变株的构建过程,包括以下步骤:
53.(1)确定fse和fsi串联基因的待缺失dna序列
54.通过生物信息学分析以确定fse和fsi串联基因四个拷贝在基因组上的位置及其上下游序列,并初步确定fse和fsi串联基因待缺失的dna片段长度。
55.(2)确定待缺失区域的上下游序列、构建基因敲除质粒
56.本例中,将fse和fsi串联基因的起始密码子上游的序列和起始密码子,终止密码子及其下游序列扩增并连接后,克隆至柱状黄杆菌自杀质粒pms75的多克隆位点。最终形成用于fse和fsi串联基因缺失的自杀质粒pnl-66、pnl-69、pnl-85和pnl-86。
57.构建pnl-66所需引物序列为:
[0058]5’‑
gctag ggatcc tgagctatccttaagatcctta-3’[0059]5’‑
gctag gtcgac cataattataaatatttaaaaaattaag-3’[0060]
扩增产物为:2485bp;
[0061]5’‑
gctag gtcgac taaacaacaactaaacaactaaaaaata-3’[0062]5’‑
gctag ctgcag cagcggctttaacacatcc-3’[0063]
扩增产物为:2473bp;
[0064]
构建pnl-69所需引物序列为:
[0065]5’‑
gctag ctgcagtgacataattataaatatttaaaaaa-3’[0066]5’‑
gctag gcatgcagcaccgcagagtagctacg-3’[0067]
扩增产物为:2192bp;
[0068]5’‑
gctag ctgcagtaaacaacaactaaacaactaaaaaa-3’[0069]5’‑
gctag gtcgac tagggtcgtcaatataagc-3’[0070]
扩增产物为:2452bp。
[0071]
构建pnl-85所需引物序列为:
[0072]5’‑
gctag ggatccgaagttttagaatctaacgg-3’[0073]5’‑
gctag gtcgac cataattataaatatttaaaaaattaag-3’[0074]
扩增产物为:2464bp;
[0075]5’‑
gctag gtcgactaaacaacaactaaacaactaaacaa-3’[0076]5’‑
gctag gcatgcttgtttttccaagttatgg-3’[0077]
扩增产物为:2431bp.
[0078]
构建pnl-86所需引物序列为:
[0079]5’‑
gctag ggatcccaaaaatgaattcattattaaag-3’[0080]5’‑
gctag gtcgac cataattataaatatttaaaaaattaag-3’[0081]
扩增产物为:2434bp;
[0082]5’‑
gctag gtcgac taaacaacaactaaacaactaaaaaata-3’[0083]5’‑
gctag gcatgctagcggctttaacacatcc-3’[0084]
扩增产物为:2473bp。
[0085]
(3)将基因敲除质粒转入柱状黄杆菌野生型菌株
[0086]
将上一步获得的基因敲除质粒pnl-66转化到大肠杆菌菌株s17-1λpir中。将携带质粒pnl-66的大肠杆菌和野生型柱状黄杆菌分别培养至对数生长期,离心收集菌体。分别用不含抗生素的shieh液体培养基分别洗涤两次,并重悬至100μl并滴在无抗的shieh固体培养基上。将该平板在28℃静置培养20-24h。
[0087]
(4)筛选在柱状黄杆菌中发生两次同源重组的菌株
[0088]
将已完成接合转移的细菌混合物涂布至含四环素的shieh平板,28℃静置培养至有菌落长出。该菌落即为完成第一次同源重组的菌株。
[0089]
无菌挑取菌落并分别接种在无抗shieh液体培养基中过夜培养,再将菌液涂布于含10%蔗糖的shieh平板。在28℃静置培养24-48h,选择单菌落分别在含四环素和不含四环素的shieh平板上划线培养。选取将只能在无四环素的shieh平板上生长的该菌株即可获得经过两轮同源重组的细菌。
[0090]
(8)缺失突变株筛选和确认
[0091]
将经过两轮同源重组的细菌接种至液体shieh培养基中,振荡培养至对生生长期。在待缺失dna区域的序列的上游和下游分别选择一段序列作为正向引物和反向引物,菌液
pcr方法检测经过两轮同源重组的细菌,将该菌株fse1和fsi1串联基因已发生单缺失突变的菌株命名为fcg-61。
[0092]
检测引物序列为:
[0093]5’–
aactaggttcaggagcttac
–3’
[0094]5’–
tgtagcgtctatttgttgtg
–3’
[0095]
扩增产物为572bp为突变株,1624bp为野生型。
[0096]
(9)四缺失菌株的构建和筛选
[0097]
以fcg-61菌株为背景菌株,按照上述(3)-(8)的步骤,依次转入自杀质粒pnl-69、pnl-85和pnl-86,通过两轮同源重组、蔗糖平板负选择和特异性引物检测等过程,筛选获得fcg-84菌株。
[0098]
fse2和fsi2串联基因检测引物序列为:
[0099]5’–
gattataaaaatgattttaca
–3’
[0100]5’–
tattttttagttgtttagttgttgttta
–3’
[0101]
扩增产物为349bp为突变株,1342bp为野生型。
[0102]
fse3和fsi3串联基因检测引物序列为:
[0103]5’–
catacctctagaagcaaaatc5
’–
tgtcgtcaggatggttgag
[0104]
扩增产物为686bp为突变株,1736bp为野生型。
[0105]
fse4和fsi4串联基因检测引物序列为:
[0106]5’–
catcacttttaatgatggggtc5
’–
tgtcgtcaggatggttgag
[0107]
扩增产物为572bp为突变株,1624bp为野生型。
[0108]
将获得fse和fsi串联基因四缺失菌株与嗜水气单胞菌进行竞争生长实验,具体包括以下步骤:
[0109]
(1)培养细菌至对数生长期
[0110]
将柱状黄杆菌野生型和fcg-84、fcg-107缺失突变株,以及嗜水气单胞菌分别培养至对数生长期(od
600
=0.4-0.5)。
[0111]
(2)细菌的竞争生长
[0112]
分别取上述各组处于对数生长期的细菌2μl,点种于shieh平板;再各取2μl柱状黄杆菌野生型和fcg-84、fcg-107缺失突变株,分别与2μl嗜水气单胞菌混合,点种于shieh平板,28℃过夜培养。观察细菌竞争生长情况。结果如图2所示。
[0113]
柱状黄杆菌野生型g4株能较好抑制嗜水气单胞菌生长,fcg-84、fcg-107缺失突变株的竞争生长能力下降。这表明fse为柱状黄杆菌的效应分子。
[0114]
实施例4:
[0115]
柱状黄杆菌t6ss效应分子fse及其免疫蛋白fsi在柱状黄杆菌检测中的应用:
[0116]
本例以western blot方法为例来阐述t6ss效应分子及其免疫蛋白的单克隆抗体在柱状黄杆菌检测药物中的应用。具体方式如下:
[0117]
(1)柱状黄杆菌t6ss效应分子fse及其免疫蛋白fsi单克隆抗体的制备
[0118]
选择fse蛋白的第25-152aa和fsi蛋白的第1-128aa进行原核表达。将纯化后的蛋白各免疫10只小鼠制备抗体。将经过三免的小鼠取血清进行elisa检测,同时与柱状黄杆菌强毒株g4的野生型和δfse/fsi突变株进行wb检测。根据检测结果,选择条带单一的血清所
对应的小鼠进行融合筛选。用fse和fsi的重组蛋白进行elisa筛选,选择阳性细胞株与柱状黄杆菌强毒株g4的野生型和δfse/fsi突变株进行wb检测。
[0119]
最终,针对fse和fsi各获得3株内源性检测阳性的细胞株制备腹水,并经过纯化获得单克隆抗体。
[0120]
(2)柱状黄杆菌t6ss效应分子fse及其免疫蛋白fsi的检测
[0121]
将柱状黄杆菌野生型g4株和效应分子fse及其免疫蛋白fsi的四缺失突变株fcg-84及相应互补株fcg-85、fse四缺失突变株fcg-107和相应互补株fcg-168分别培养至对数生长期。
[0122]
样品制备:取上述菌株培养物各1ml,离心收集菌体,用5
×
loading buffer重悬后,沸水浴15min。
[0123]
电泳及转膜:将上述样品用sds-page胶电泳分离,采用湿转法将蛋白转移至pvdf膜。
[0124]
封闭:用终浓度为5%脱脂奶粉tbst溶液室温封闭1h。
[0125]
一抗孵育:根据抗体效价,以1:5000~1:1000的比例将抗体稀释于含1%脱脂奶粉的tbst中,室温孵育1-4h或者4℃过夜孵育。tbst溶液洗膜4次,每次5min。
[0126]
二抗孵育:以1:5000的比例将hrp标记的羊抗兔抗体稀释于含1%脱脂奶粉的tbst中,室温孵育30min-1h。tbst溶液洗膜4次,每次5min。
[0127]
显色:加入化学发光底物进行显色,待目的带出现终止反应。
[0128]
结果如图3所示,fse抗体在野生型g4和互补菌株fcg-168有显色条带,突变株fcg-107株无检出;fsi抗体在野生型菌株和互补株fcg-85有显色条带,而在突变株fcg-84中未检出。说明利用本发明抗原制备的抗体特异性良好。
[0129]
实施例5:
[0130]
柱状黄杆菌t6ss效应分子fse及其免疫蛋白fsi在制备可自然清除弱毒苗中的应用:
[0131]
本应用以红色荧光标记的柱状黄杆菌弱毒疫苗株fcg-60(δctl2)和绿色荧光标记的fcg-169(δctl2δfsiδfse)菌株为例进行说明。
[0132]
1.所述的fcg-60的构建过程如下:
[0133]
(1)确定cytolysin基因的待缺失dna序列
[0134]
通过生物信息学分析以确定cytolysin基因的位置及其上下游序列,并初步确定cytolysi n基因待缺失的dna片段长度。
[0135]
(2)确定待缺失区域的上下游序列、构建基因敲除质粒
[0136]
本例中,将cytolysin基因的起始密码子上游的序列和起始密码子,终止密码子及其下游序列扩增并连接后,克隆至柱状黄杆菌自杀质粒pms75的多克隆位点。最终形成用于cy tolysin基因缺失的自杀质粒pnl-65。
[0137]5’–
gctag ggatcc ggtttcgtttattcatgaacag5
’–
gctag gtcgacc atacacatctatttgtaattatc
[0138]
扩增产物为:2069bp。
[0139]5’–
gctag gtcgact aataagtatttaatttagagaggctg5
’–
gctag ctgcag cagtaaatcagctttaatgcc
[0140]
扩增产物为:2011bp。
[0141]
(3)将基因敲除质粒转入柱状黄杆菌野生型菌株
[0142]
将上一步获得的基因敲除质粒pnl-65转化到大肠杆菌菌株s17-1λpir中。将携带质粒pnl-65的大肠杆菌和野生型柱状黄杆菌分别培养至对数生长期,离心收集菌体。分别用不含抗生素的shieh液体培养基分别洗涤两次,并重悬至100μl并滴在无抗的shieh固体培养基上。将该平板在28℃静置培养20-24h。
[0143]
(4)筛选在柱状黄杆菌中发生两次同源重组的菌株
[0144]
将已完成接合转移的细菌混合物涂布至含四环素的shieh平板,28℃静置培养至有菌落长出。该菌落即为完成第一次同源重组的菌株。
[0145]
无菌挑取菌落并分别接种在无抗shieh液体培养基中过夜培养,再将菌液涂布于含10%蔗糖的shieh平板。在28℃静置培养24-48h,选择单菌落分别在含四环素和不含四环素的shieh平板上划线培养。选取将只能在无四环素的shieh平板上生长的该菌株即可获得经过两轮同源重组的细菌。
[0146]
(8)缺失突变株筛选和确认
[0147]
将经过两轮同源重组的细菌接种至液体shieh培养基中,振荡培养至对生生长期。在待缺失dna区域的序列的上游和下游分别选择一段序列作为正向引物和反向引物,菌液pcr方法检测经过两轮同源重组的细菌,将该菌株ctl2基因已发生缺失突变的菌株命名为fcg-60。检测引物序列为:
[0148]5’‑
caaattagagaaagggctaaat-3’[0149]5’‑
ggctgtctgaagaggttataa-3’[0150]
扩增产物为2147bp表明回复野生型;476bp表明ctl2基因已被成功缺失突变。
[0151]
2.fcg-169(δctl2δfsiδfse)菌株的构建:
[0152]
所需的自杀质粒仍为pnl-65,但背景菌株由野生株g4更换为fcg84(δfsiδfse)。其余过程,包括检测引物均与fcg-60相同。
[0153]
3.上述过程制备的柱状黄杆菌基因缺失突变株fcg-60,fcg-169分别进行毒力测试。包括以下步骤:
[0154]
(1)培养细菌至对数生长期
[0155]
将柱状黄杆菌野生株、fcg-60(δctl2)和fcg-169(δctl2δfsiδfse)分别培养至对数生长期(od
600
=0.4-0.5)。以不接种细菌的等体积shieh培养基作为对照。
[0156]
(2)浸泡感染斑马鱼
[0157]
分别将上述各组细菌在250ml温度为28℃的养殖水体中稀释至约0.6
×
105cfu/ml,shi eh培养基也用相同来源的养殖水体,按照相同倍数稀释备用。向各组水体中分别放入10尾健康成年斑马鱼,在28℃浸泡感染1h后,转移至2l的养殖水体中。连续7天观察并记录感染及死亡情况。结果显示,突变株fcg-60和fcg-169感染鱼体的能力均明显下降,受试鱼存活率较野生株提高(表1)。存活率的计算公式:存活率=(受试斑马鱼总数-7天累计死亡的斑马鱼数量)
×
100/受试斑马鱼总数。
[0158]
表1材料鱼经野生株和突变株感染后的存活率
[0159]
菌株名称g4fcg-60fcg-169存活率20%60%60%
[0160]
4.柱状黄杆菌fcg-60(δctl2)和fcg-169(δctl2δfsiδfse)缺失突变株在免疫材料鱼中的应用:
[0161]
(1)用fcg-60和fcg-169基因突变株免疫斑马鱼
[0162]
取500ml温度为28℃的养殖水体,将处于对数生长期的fcg-60和fcg-169分别稀释至约2.5
×
104cfu/ml。同时,将等体积的shieh培养基在相应的水体中作为对照组。向各组水体中分别放入20尾健康成年斑马鱼,28℃浸泡1h后,转移至4l的养殖水体中养殖4周。
[0163]
(2)用强毒株的野生型分别感染各组斑马鱼
[0164]
将柱状黄杆菌强毒株的野生型培养至对数生长期(od
600
=0.4-0.5)。将细菌稀释至约0.8
×
105cfu/ml后,将上述经过免疫并饲养4周的斑马鱼和对照组的斑马鱼浸泡感染1h,然后转移至4l的养殖水体中养殖一周,观察并记录死亡情况。结果显示,突变株免疫斑马鱼后,鱼体被野生强毒株感染后存活的数量较对照提高约15-20%(表2)。
[0165]
表2经突变株免疫的材料鱼人工感染后的存活率
[0166][0167][0168]
5.两株细菌的竞争生长实验,主要步骤如下:
[0169]
将两株细菌分别接种至新鲜的shieh液体培养基,在28度摇床中振荡培养至对数生长期(od
600
=0.4-0.5)。从两种培养物中各取1ml,进行梯度稀释后,涂布shieh平板,用于活菌计数。将剩余培养物按照两者1:1的比例混合,静置于28度共培养96h。随后,将共培养物进行梯度稀释,分别涂布shieh平板。待单菌落长出后,在荧光显微镜下统计红色和绿色荧光菌落的数量。分别与共培养之前的相应菌株的活菌数相比,fcg-169(δctl2δfsiδfse)菌株的活菌数下降,而fcg-60(δctl2)菌株的活菌数上升。表明fsi和fse蛋白的缺失导致了细菌的竞争生长能力下降(图4)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。