1.本发明涉及农业生物技术领域,具体涉及里氏木霉纤维素酶转录抑制因子70351的应用及提高纤维素酶表达量和酶活的方法。
背景技术:
2.丝状真菌里氏木霉具有强大的分泌纤维素酶的能力,其混合发酵液中,纤维二糖水解酶的表达占胞外总分泌蛋白的50%以上。然而,纤维素酶的高成本仍然是纤维素生物炼制的主要瓶颈之一,因此需要继续开发新的方法,以提高纤维素酶的表达,降低应用成本。
3.在里氏木霉中,纤维素酶的表达受多个调控途径的影响。其中,调控主要发生在转录水平,包括主要激活因子xyr1、ace2、ace3、vib1和hap2/3/5,抑制因子cre1、ace1、rce1和rce2等多个转录因子的协同调控。目前,已经有几篇关于对转录抑制因子敲除提高纤维素酶表达的研究。例如,转录因子cre1是里氏木霉的碳代谢阻遏转录抑制因子,科研学者通过同源重组的方法敲除了里氏木霉eu7-22的转录抑制因子cre1,在诱导或者抑制性碳源培养条件下,内切纤维素酶活性分别提高了1.15倍和7.50倍;在里氏木霉alko2221菌株,转录抑制因子ace1的缺失明显提高了纤维素酶的表达,而在里氏木霉c30oexyr1菌株中删除ace1并没有带来任何改善;在里氏木霉tu6-rp菌株敲除rce1,纤维酶的表达略有提高(50%左右);在野生型菌株qm6a敲除rce2,内切纤维素酶活性提高了约30%。里氏木霉有500多个转录因子,然而,近几十年只发现了几个抑制纤维素酶表达的转录因子。因此,继续挖掘里氏木霉的新型转录因子并对其进行基因工程改造提高纤维素酶的表达,显的尤为重要。
技术实现要素:
4.本发明的目的是提供里氏木霉转录抑制因子70351的应用。
5.本发明的再一目的是提供一种提高里氏木霉纤维素酶的表达量和酶活的方法。
6.根据本发明的转录抑制因子70351编码氨基酸序列如seq id no:1所示的蛋白质。
7.根据本发明的转录抑制因子70351的核苷酸序列如seq id no:2所示。
8.根据本发明的提高里氏木霉纤维素酶的表达量和酶活的方法,包括敲除里氏木霉转录抑制因子70351的步骤。
9.根据本发明的提高里氏木霉纤维素酶的表达量和酶活的方法,其中,构建所述里氏木霉转录因子70351的敲除质粒,并将其导入里氏木霉。
10.根据本发明的提高里氏木霉纤维素酶的表达量和酶活的方法,其中,所述里氏木霉转录因子70351的敲除质粒包括里氏木霉转录因子70351的donor质粒和里氏木霉转录因子70351的 sgrna质粒载体。
11.根据本发明的具体实施方式,转录抑制因子70351的donor质粒包括70351上游同源臂、pcre/loxp-hph(潮霉素表达盒)和70351下游同源臂;p70351sgrna质粒包括pdc1p-70351sgrna-pdc1t、tel序列、pdc1p-cas9-pdc1t和大肠杆菌基本元件(氨苄编码基因和大
肠杆菌复制起始点)。
12.根据本发明的具体实施方式,将70351上游同源臂、pcre/loxp-hph(潮霉素表达盒)、下游同源臂通过无缝拼接方式串联拼接,得到质粒p70351 donor。
13.根据本发明的具体实施方式,将pdc1p-70351sgrna-pdc1t、tel序列、pdc1p-cas9-pdc1t和大肠杆菌基本元件通过无缝拼接方式串联拼接,得到质粒p70351sgrna。
14.根据本发明的具体实施方式,敲除该转录抑制因子70351的里氏木霉的方法包括以下步骤:(1)敲除70351的donor dna和p70351sgrna分别用pac1和i-ceu1酶切(2)用步骤(1)得到的质粒载体转化宿主细胞,得到敲除70351的里氏木霉菌株。
15.根据本发明的具体实施方式,上述敲除质粒载体可以提高里氏木霉的纤维素酶酶活表达。
16.本发明提供的这种纤维素酶表达相关的转录抑制因子70351对于纤维素酶活性表达具有调节作用,通过构建该基因的敲除质粒,并用其转化宿主菌,在宿主菌中敲除转录抑制因子70351的表达可提高宿主菌的蛋白表达量和纤维素酶酶活。本发明丰富了里氏木霉纤维素酶的转录调控网络,为提高纤维素酶产量,降低纤维素酶成本,实现纤维素有效利用提高了新途径。
附图说明
17.图1 提高纤维素酶表达的转录抑制因子的p70351donor质粒图谱。
18.图2为提高纤维素酶表达的转录抑制因子的p70351sgrna质粒图谱。
19.图3显示转录抑制因子70351在里氏木霉基因组敲除的pcr鉴定结果。
20.图4显示敲除转录抑制因子70351的里氏木霉菌株蛋白表达的比较。
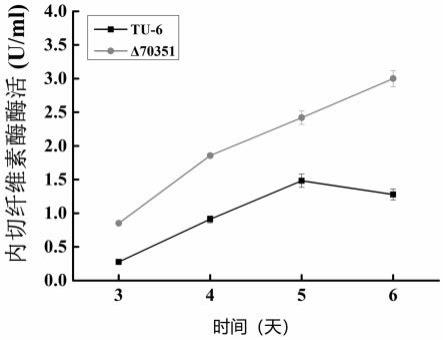
21.图5显示敲除转录抑制因子70351的里氏木霉菌株纤维素酶的表达比较。
具体实施方式
22.下列实施例中未注明具体条件的实验方法,通常按照常规条件进行。本发明所使用的里氏木霉tu-6菌株是尿嘧啶缺陷型突变体,编号atcc (mya-256)。
23.实施例1 转录抑制因子的p70351 donor和p70351sgrna质粒的构建(1)构建转录抑制因子p70351 donor质粒p70351 donor质粒包含70351上游同源臂、pcre/loxp-hph(潮霉素表达盒和大肠杆菌基本复制元件)和70351下游同源臂。
24.以本实实验室保存的pcre/loxp-hph质粒为模板,引物loxp-hphf1/loxp-hphr1扩增pcre/loxp-hph部分;以里氏木霉tu-6基因组为模板,引物70351upf1/70351upr1扩增1.5 kb长度的70351上游同源臂、引物70351downf1/70351downr1扩增1.5 kb长度的70351下游同源臂。
25.pcr反应体系包括:2 ng模板、1
ꢀµ
l正向引物、1
ꢀµ
l反向引物、25
ꢀµ
l的2xpcr mix,双蒸水补足至50
ꢀµ
l。
26.pcr反应程序为:95℃,5min;94℃、30s,55℃、30s,72℃、3min,34个循环;72℃,10 min。
27.pcr产物进行电泳、回收上述3个片段后,采用同源重组的方法构建干扰质粒载体。转化大肠杆菌trans1-t1感受态细胞,平板上长出的大肠菌落做菌落pcr,将pcr鉴定为阳性的大肠菌落送测序,将测序正确的质粒命名为p70351 donor, 如图1。引物如下:loxp-hphf1(seq id no:3),oxp-hphr1(seq id no:4);70351upf1(seq id no:5),70351upr1(seq id no:6);70351downf1(seq id no:7),70351downr1(seq id no:8)。
28.(2)设计sgrna序列设计优化针对转录抑制因子70351的sgrna,确保grna不发生脱靶。最终确定grna序列如seq id no:9所示。
29.(3)构建转录抑制因子的p70351sgrna质粒p70351sgrna质粒包括pdc1p-70351sgrna-pdc1t、tel序列、pdc1p-cas9-pdc1t和大肠杆菌基本元件(氨苄编码基因和大肠杆菌复制起始点)。以pcre/loxp-hph质粒为模板,扩增大肠杆菌基本元件;以里氏木霉tu-6基因组为模板,扩增pdc1的启动子和终止子,合成70351sgrna序列部分(seq id no:9),通过体外overlap获得pdc1p-70351sgrna-pdc1t片段;合成的tel序列进行扩增;以含cas9的质粒扩增cas9片段,与pdc1的启动子和pdc1终止子,通过体外overlap获得pdc1p-cas9-pdc1t片段。电泳、回收的4个片段用同源重组的方法连接。转化大肠杆菌trans1-t1感受态细胞,对平板上长出的大肠菌落做菌落pcr,将pcr鉴定为阳性的大肠菌落送测序,将测序正确的质粒命名为p70351 sgrna质粒, 如图2。
30.实施例2.转录抑制因子70351的敲除(1)敲除70351的donor dna和70351sgrna转化里氏木霉将里氏木霉tu-6接种于土豆培养基(pda)平板上,28
ꢀº
c静置培养7 d待其产孢,将孢子刮下并接种于100 ml含有尿嘧啶的pdb培养基中,28
º
c、160 rpm振摇培养过夜。目筛过滤收集萌发的菌丝,加入10 mg/ml的纤维素酶在30
º
c消化2-3小时。收集原生质体后,构建敲除70351的donor dna和p70351sgrna分别用pac1和i-ceu1酶切,转化里氏木霉宿主细胞。
31.(2) pcr验证转录抑制因子70351在里氏木霉基因组的敲除挑取单个转化子,接种于含mm-葡萄糖培养基的24孔板,于28℃培养5-7天。提取基因组dna,验证转录抑制因子70351在里氏木霉基因组的敲除。引物验证70351敲除的下游部分,验证引物的f端设计在里氏木霉基因组的70351基因上游250 bp处,r端设计在p70351 donor质粒的大肠杆菌复制起始点处,验证引物序列如下:引物f (seq id no:10),引物r (seq id no:11)。
32.如果扩增出约2000 bp大小的片段,则证明该基因被敲除。将pcr产物在1%琼脂糖胶上电泳,结果如图3所示,出现和预期一致的条带。
33.实施例3.敲除转录抑制因子70351对的蛋白表达的影响(1)敲除转录抑制因子70351的转化子的摇瓶诱导将敲除转录抑制因子70351的转化子和出发菌株分别接种2
×
107孢子于50 ml mm-glucose培养基中,28℃,160 rpm培养2 天。以10%的接种量转接至50 ml mm 2% avicel培养基中以诱导纤维素酶的表达。从第3天开始,每隔24 h取样,连续取样至6天。
34.(2)敲除转录抑制因子70351的转化子的蛋白浓度、纤维素酶的测定蛋白定量用考马斯亮蓝法,加入250
ꢀµ
l 1
ꢀ×ꢀ
dye reagent染液和10
ꢀµ
l蛋白标品
后,室温下反应10分钟后,测定595 nm的吸光值, 结果见图4。在发酵第5天,里氏木霉tu-6的蛋白浓度是0.027 mg/ml, δ70351菌株(转化子)的蛋白浓度是0.062 mg/ml,提高了1.3倍。
35.纤维素酶的测定采用羧甲基纤维素钠(1.5 % cmc-na)作为底物进行测定。用柠檬酸-磷酸氢二钠缓冲液(0.05 m、ph 5.0)配制。取适当稀释的酶液100
ꢀµ
l,加入到900
ꢀµ
l cmc-na底物中,振荡混合均匀,50 ℃水浴保温30 min,反应终止时,向各试管中加入1.5 ml dns试剂,在沸水中煮5 min,迅速冷却,测定540 nm的吸光度。1 ml液体酶,在50 ℃、ph 5.0的条件下,每小时水解羧甲基纤维素钠,产生1 μmol还原糖(以葡萄糖计)所需要的酶量定义为一个酶活力单位(u),结果见图5。在发酵第5天,里氏木霉tu-6的内切纤维素酶酶活为1.42 u/ml, δ70351菌株的内切纤维素酶酶活为2.42 u/ml,提高了0.7倍。
36.应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
