1.本发明属于生物化学技术领域,涉及一种低分子量牛樟芝胞外多糖及其制备和应用。
背景技术:
2.牛樟芝是一种来自中国台湾的药用真菌,由于其具有预防和治疗肝病、食物中毒、高血压等疾病而几乎没有生物毒性,被当地人称为“神奇灵药”和“森林中的红宝石”。研究指出,牛樟芝多糖对酒精性肝损伤有较好的保护效果,并且具有较好的抗氧化性。但是目前从牛樟芝子实体以及菌丝体中得到的多糖大多为大分子量多糖,大分子量多糖的生物利用率较低,不利于多糖活性功能的发挥。
3.癌症是多种病因诱导的占位性疾病,是指机体在各种致癌因素的作用下,局部上皮组织细胞出现异常增殖、生长不受控制、浸润性和转移性等生理特征而形成的恶性肿瘤。截至2020年,全球有1930万例癌症患者,其中肺癌、乳腺癌、结肠直肠癌占绝大多数。近年来关于癌症预防及治疗药物的研究以及新型抗癌药物的开发引起了全球范围的关注。癌症的发生与环境的恶化以及自身抵抗力下降有关,临床上使用的治疗手段及药物很多,主要包括手术治疗、放疗和化疗,但大多数都有一定副作用,例如腹泻、恶心、呕吐、脱发、免疫力下降等。通过摄入具有抗癌活性的天然产物,协助提高身体对疾病的抗性,能够更好地抵抗癌症。
4.本发明正是基于此而提出的。
技术实现要素:
5.本发明的目的就是为了提供一种低分子量牛樟芝胞外多糖及其制备和应用,该多糖具有良好的抗肿瘤功能,安全性良好,且能够促进肠道合成短链脂肪酸等。
6.本发明的目的可以通过以下技术方案来实现:
7.本发明的技术方案之一提供了一种低分子量牛樟芝胞外多糖的制备方法,包括以下步骤:
8.(1)将牛樟芝菌株s-29的发酵液离心,获得发酵液上清;
9.(2)将发酵液上清进行超滤处理,得到截留液,即为牛樟芝胞外多糖液;
10.(3)将牛樟芝胞外多糖液预冷后,加入三氯乙酸,搅拌均匀后静置,离心去除蛋白,得到除蛋白后的牛樟芝胞外多糖混合液;
11.(4)往除蛋白后的牛樟芝胞外多糖混合液中加入乙醇,静置过夜,离心,收集沉淀,清洗,复溶,干燥,即得到目标产物。
12.进一步的,步骤(1)中,制备牛樟芝菌株s-29的发酵液的具体过程为:取牛樟芝菌株s-29先在pda斜面培养基上培养,再接入种子培养基中培养,所得种子液再即如发酵培养基中培养,即得到发酵液。其中,牛樟芝菌株s-29(antrodia camphorata s-29,其保藏编号为cgmcc 9590)。
13.进一步的,步骤(1)中,离心的工艺条件具体为:在4500r/min条件下离心15min。
14.进一步的,步骤(2)中,超滤处理过程具体为:采用截留分子量为10kda的超滤膜,超滤温度为40℃,超滤压力为0.4mpa。
15.进一步的,步骤(3)中,预冷温度为10℃;所加入的三氯乙酸终浓度为4%,m/v(即溶质质量相对于溶液体积的百分比)。
16.进一步的,步骤(3)中,静置的时间为2h,离心的速度为9000rpm,离心时间为15min。
17.进一步的,步骤(4)中,所加入乙醇为95%乙醇,其加入量满足:乙醇终浓度为80%,静置过夜的温度为4℃;
18.离心条件具体为:9000r/min离心15min。
19.本发明的技术方案之二提供了一种低分子量牛樟芝胞外多糖,其采用如上所述的制备方法制备得到,其特征在于,该牛樟芝胞外多糖的分子量为2.6*104da。具体的,其包括半乳糖、葡萄糖、甘露糖及岩藻糖,各组分摩尔比为1:0.21:0.18:0.11。
20.本发明的技术方案之三提供了一种低分子量牛樟芝胞外多糖的应用,该低分子量牛樟芝胞外多糖用于制备抗肿瘤药剂。
21.进一步的,所述的抗肿瘤药剂为抗肺癌药剂、抗乳腺癌药剂或抗结直肠癌药剂。
22.本发明提供的低分子量牛樟芝胞外多糖具有良好的抗人肺癌肿瘤细胞活性,在制备抗肿瘤功能性食品或药物方面有良好的应用潜力。将上述方法制备得到的低分子量牛樟芝胞外多糖作为原料,以食品或者药品的常规生产工艺制备用于抗肿瘤功能的功能性食品或药品。本发明提供的低分子量牛樟芝胞外多糖,制备工艺简单,制备得到的多糖纯度高,分子量小,生物利用度高,且能够显著提高短链脂肪酸组成,改善肠道环境。
23.本发明提到的牛樟芝多糖分子量为2.6
×
104da,主要由半乳糖、葡萄糖、甘露糖及岩藻糖组成,摩尔比为1:0.21:0.18:0.11,该多糖样品对肺癌细胞a549、乳腺癌细胞mcf-7、结直肠癌细胞caco-2的增殖具有良好的抑制效果,认为牛樟芝胞外多糖可以作为治疗癌症的天然药物成分,为开发抗癌新药提供新的思路,积极推动天然抑癌活性成分的开发利用。
附图说明
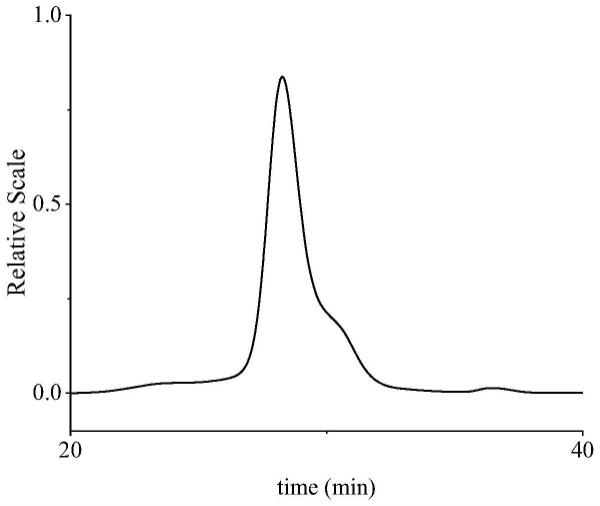
24.图1是牛樟芝多糖hpsec图;
25.图2是牛樟芝多糖的单糖组成;其中,(a)是单糖混标的hpaec图,(b)是牛樟芝多糖的hpaec图;
26.图3是牛樟芝多糖的红外光谱图;
27.图4是牛樟芝多糖对肺癌细胞a549的抑制率图;
28.图5是牛樟芝多糖对乳腺癌细胞mcf-7的抑制率图;
29.图6是牛樟芝多糖对结直肠癌细胞caco-2的抑制率图;
30.图7是牛樟芝多糖体外酵解总糖及还原糖含量变化图;
31.图8是牛樟芝多糖体外酵解过程中ph的变化图;
32.图9是牛樟芝多糖体外酵解过程中scfas的变化图。
具体实施方式
33.下面结合附图和具体实施例对本发明进行详细说明。本实施例以本发明技术方案为前提进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
34.以下实施例中,牛樟芝菌株s-29的发酵液的获取过程具体如下:
35.斜面培养基:pda培养基。
36.种子培养基(g/l):葡萄糖20g,玉米浆4g,大豆蛋白胨5g。
37.发酵培养基(g/l):葡萄糖60g,玉米浆2g,大豆蛋白胨3g,mgso4·
7h2o0.5g,kh2po
4 0.5g。
38.所用培养基均在115℃灭菌20min。
39.牛樟芝菌株s-29先在pda斜面培养基中以28℃培养13天,然后接入种子培养基中培养,种子液28℃、150r/min培养4天之后接入发酵培养基(此处种子液的接种量为15%,v/v)。
40.发酵培养条件为:培养温度28℃,摇床转速150r/min,ph 5.0,培养至12天。
41.其余所使用的材料、试剂等,如无特殊说明均可从商业途径得到。cck-8细胞增殖活性检测试剂盒购自碧云天生物技术公司。
42.实施例1:牛樟芝低分子量胞外多糖的制备
43.(1)将牛樟芝菌株s-29(antrodia camphorata s-29,其保藏编号为cgmcc9590)发酵液在4500r/min条件下离心15min,获得发酵液上清;
44.(2)将发酵液上清通过截留分子量为10kda的超滤膜,超滤温度为40℃,超滤压力为0.4mpa,超滤后的截留液即为牛樟芝胞外多糖液;
45.(3)将上述步骤制备得到的牛樟芝胞外多糖液预冷至10℃,向其中缓慢加入三氯乙酸至终浓度(此处指“三氯乙酸”的终浓度)为4%,m/v,搅拌均匀后静置2h,9000r/min离心15min,去除蛋白;
46.(4)缓慢向除蛋白后的牛樟芝胞外多糖液中加入95%乙醇,使得乙醇终浓度为80%,4℃静置过夜;9000r/min离心15min,收集沉淀,用乙醇清洗沉淀3次,挥发去除乙醇,加水复溶后冷冻干燥得到牛樟芝低分子量胞外多糖,该多糖的纯度为88.43%,蛋白质含量为2.36%。
47.实施例2:牛樟芝多糖的分子量及单糖组成测定
48.采用高效尺寸排阻色谱(hpsec-ri)测定上述实施例1制备的牛樟芝胞外多糖的分子量。以0.1m nano3水溶液为流动相,系统温度保持在40℃,流速为0.5ml/min,牛樟芝胞外多糖样品用0.1m nano3水溶液配制成1mg/ml溶液,进样200μl。由图1可知,牛樟芝胞外多糖的保留时间分别为29.04分钟,呈现单一对称峰,这表示该多糖样品是均质多糖,其分子量为2.6*104da。结果表明,牛樟芝胞外多糖是一种低分子量、组分单一的均质多糖。
49.采用thermoic-5000高效阴离子交换色谱串联脉冲安培检测器(hpaec-pad)测定牛樟芝胞外多糖的单糖组成。首先称取10mg牛樟芝多糖(即牛樟芝胞外多糖),加入0.5ml 12m硫酸,室温反应30分钟,缓慢加水将硫酸稀释至2m,混匀,在105℃油浴中水解2小时快速冷却并稀释100倍后,通过0.22μm微孔膜过滤,取样分析。在相同条件下对10种单糖样品进行定性和定量分析:岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、果糖、半乳糖
醛酸、葡萄糖醛酸。由图2可知,牛樟芝多糖(即牛樟芝胞外多糖)主要由半乳糖、葡萄糖、甘露糖和岩藻糖组成,摩尔比为1:0.21:0.18:0.11。
50.实施例3:牛樟芝多糖的红外光谱测定
51.采用kbr压片法,将上述实施例1制备的牛樟芝多糖和干燥kbr按1:10(m/m,即质量比)的比例混合均匀,然后用液压机压制成均匀透明的薄片。以空白kbr薄片用作参考,红外光谱仪用于扫描。分辨率4cm-1
,扫描范围:4000~400cm-1
。
52.如图3所示,3405nm附近的吸收峰较宽,是由羟基0-h的伸缩振动引起,在2920nm和1383nm处的吸收峰代表c-h伸缩振动和变角振动,这三处均为多糖化合物的典型结构;1653nm处的峰代表多糖官能团中o-h的伸缩振动;1420nm处的吸收峰代表c-o伸缩振动;1000-1200cm-1附近的一系列峰与c-o-c和c-0-h的伸缩振动有关,表明牛樟芝多糖含吡喃糖环;873nm处的吸收峰说明多糖由β-糖苷键连接。
53.实施例4:牛樟芝多糖抑制癌细胞增殖
54.分别选取对数生长期的细胞a549、mcf-7以及caco-2,用0.25%胰酶消化酶解成单细胞悬液,调整细胞为2
×
105个/ml,铺在96孔细胞培养板上,每孔200μl,放在37℃培养箱中24h,使细胞完全贴壁后,吸取培养基,加入含有不同浓度的上述实施例1制备得到的牛樟芝胞外多糖(100、200、400、600、800μg/ml)的培养基,以含100μg/ml 5-fu的培养液为阳性对照,空白对照组为不添加牛樟芝胞外多糖的培养基。每孔设置6个平行复孔。相同培养条件培养培养24h、48h后,按照cck-8试剂盒的操作说明测定牛樟芝多糖对癌症细胞的抑制率。
55.如图4所示,牛樟芝胞外多糖对肺癌细胞a549生长具有良好的抑制作用。当多糖浓度达到400μg/ml时抑制剂达到60%以上,显著高于阳性对照组5-fu。
56.如图5所示,牛樟芝胞外多糖对乳腺癌细胞mcf-7生长具有良好的抑制作用。在100-800μg/ml浓度范围内,对癌细胞抑制率成浓度依赖性。当多糖浓度为800μg/ml时抑制剂达到60%以上,抑制率与阳性对照组5-fu相当。
57.如图6所示,牛樟芝胞外多糖对结直肠细胞caco-2生长具有良好的抑制作用。在100-800μg/ml浓度范围内,对癌细胞抑制率成浓度依赖性。当多糖浓度为800μg/ml时抑制剂达到57.3%,略低于阳性对照组5-fu抑制效果。
58.实施例5:牛樟芝胞外多糖改善肠道环境
59.采用体外酵解实验,考察牛樟芝胞外多糖对肠道短链脂肪酸合成能力的影响。肠道菌群培养基:2g蛋白胨,2g酵母提取物,0.5g半胱氨酸,0.1gnacl,2g nahco3,0.04g k2hpo4,0.04g kh2po4,0.01g mgso4 7h2o,0.01g cacl2 6h2o,0.01g血红素,0.5g牛胆盐,2ml吐温80,10μl vk1,1ml 1%刃天青,去离子水定容至1l。
60.随机选取三名志愿者的粪便样本5g装入无菌离心管,加入50ml 10%生理盐水混合,磁力搅拌器上搅拌均匀,离心(500g,4℃,5min)取上清得粪便菌悬液,放入厌氧瓶待用;空白组取90ml肠道菌群培养基加10ml粪便菌悬液;实验组取90ml肠道菌群培养基(含有10mg/ml牛樟芝低分子量胞外多糖)加10ml粪便菌悬液;各组用牛皮纸封口后至于37℃厌氧培养箱中启动发酵,并于0、6、12、24h分别取样15ml,离心(9000g,4℃,10min)后收集上清液。
61.总糖含量采用苯酚-硫酸法进行测定。还原糖含量测定采用3,5-二硝基水杨酸比
色法。采用气相色谱法对体外酵解样品中乙酸、丙酸、丁酸及总短链脂肪酸含量进行测定。色谱仪配备了毛细管柱和氢火焰电离检测器(fid)。操作条件如下:载气(氮气)的流速为19ml/min。初始柱温在100℃下保持1分钟,然后以4
°
c/min的速率升高至180℃。注射器和检测器的温度保持在250℃。空气、氮气和氢气分别以260,30和30ml/min的流速用作补充气体。
62.如图7所示,牛樟芝低分子量胞外多糖在人粪便酵解液中部分降解,碳水化合物消耗率为36.42%,也就是说牛樟芝低分子量胞外多糖可以被肠道微生物部分,且大部分能够已活性形式被人体吸收。如图8所示,牛樟芝低分子量胞外多糖在人粪便酵解液中能够显著降低肠道ph,适宜的肠道ph环境更有利于肠道健康。
63.如图9所示,牛樟芝低分子量胞外多糖在人粪便酵解液中能够显著促进短链脂肪酸(scfas)合成。牛樟芝低分子量胞外多糖组短链脂肪酸总含量在酵解24h后达到165.28
±
10.98μg/ml,比酵解0h提高了58.24%,显著高于空白对照组。
64.综上所述,本发明涉及的牛樟芝小分子胞外多糖分子量为2.65*104da,生物利用度高,对肺癌细胞a549、乳腺癌细胞mcf-7、结直肠细胞caco-2的增殖活性具有显著的抑制效果。此外,该多糖能够改善肠道ph,显著促进肠道中短链脂肪酸的合成,促进肠道健康。
65.上述的对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
