1.本发明涉及生物技术领域,尤其是涉及一种胞苷单磷酸激酶突变体及其基因和应用。
背景技术:
2.胞苷单磷酸激酶(cytidine monophosphate kinase,cmk)是核苷单磷酸激酶家族的重要成员。cmk在核苷酸合成代谢中起关键作用,催化磷酸基团从三磷酸腺苷(adenosine triphosphate,atp)转移到胞苷单磷酸(cytidine monophosphate,cmp),生成胞苷二磷酸(cytidine diphosphate,cdp)。cdp随后被磷酸化以生成胞苷三磷酸(cytidine triphosphate,ctp)。
[0003]3’‑
唾液酸乳糖(3
’‑
sialyllactose,3
’‑
sl)是母乳中含量丰富的酸性寡糖成分之一,其含有益生元,具有抗病毒、抗病原菌粘附、促进认知、促进大脑发育和免疫调节等重要生理功能。
[0004]
经研究表明,胞苷单磷酸激酶(cmk)在酶促合成3
’‑
sl过程中起着重要作用,ctp再生是酶促合成3
’‑
sl的重要途径。cmk和多聚磷酸激酶(polyphosphate kinase,ppk)以多聚磷酸为底物,催化cmp转化为ctp。但在ctp再生过程中,发现cmk酶的热稳定性较差,影响ctp再生效果,从而影响3
’‑
唾液酸乳糖的合成。
技术实现要素:
[0005]
本发明的目的在于克服上述现有技术的不足之处而提供一种胞苷单磷酸激酶突变体及其基因和应用。
[0006]
为实现上述目的,本发明采取的技术方案为:
[0007]
第一目的,本发明提供了一种胞苷单磷酸激酶突变体,所述胞苷单磷酸激酶突变体与seq id no:1具有至少90%的核苷酸序列一致性,且包含以下至少一个或多个位置的突变,所述的突变位点包括seq id no:1的第3、4、5、74、77、79、85、170或173位中的至少一个突变位点,所述的突变为在所述的突变位点上发生取代、插入或删除一个或多个氨基酸残基。
[0008]
酶的热稳定性是评价酶生物催化剂的一个重要指标,热稳定性高有利于提高反应速率和减少酶活力的损失。由于cmk酶在ctp再生过程中热稳定性较差,影响了3
’‑
唾液酸乳糖的合成,因此,本发明对胞苷单磷酸激酶(cmk)进行分子改造,得到了热稳定性较高的胞苷单磷酸激酶突变体,进而提高3
’‑
唾液酸乳糖合成的反应速率,缩短其生产周期,降低了生产成本。
[0009]
为了提供胞苷单磷酸激酶的热稳定性,对胞苷单磷酸激酶进行分析改造,在pdb数据库中选择cmk(pdb数据库登录号:1kdo)作为cmk突变位点的模板,本发明人经过大量的实验,对胞苷单磷酸激酶多个位点改造,最终获得11个突变位点,即在seq id no:1基础上的对第3、4、5、74、76、77、79、85、170、173或223位至少一个位点进行突变。其中在seq id no:1
基础上对第3、4、5、74、77、79、85、170或173位至少一个位点进行定点突变后,可以提高了胞苷单磷酸激酶的热稳定性,有助于提高3
’‑
唾液酸乳糖的产量及得到更高转化率的底物sa。
[0010]
作为本发明所述胞苷单磷酸激酶突变体的优选实施方式,所述的突变为取代突变,至少包括以下一个或多个氨基酸残基的取代:
[0011]
第3位丙氨酸被脯氨酸取代;或
[0012]
第4位异亮氨酸被甘氨酸取代;或
[0013]
第8位丙氨酸被天冬酰胺取代;或
[0014]
第74位苏氨酸被甘氨酸取代;或
[0015]
第77位天冬酰胺被组氨酸取代;或
[0016]
第79位谷氨酰胺被天冬酰胺取代;或
[0017]
第85位谷氨酸被天冬酰胺取代;或
[0018]
第170位天冬酰胺被甘氨酸取代;或
[0019]
第173位精氨酸被丝氨酸取代。
[0020]
本发明通过对单点突变的胞苷单磷酸激酶突变体进行热稳定性筛选可知,与野生型相比,第77位、79、173位上的突变可以显著提高胞苷单磷酸激酶突变体的残余酶活,分别提高了9.52%、5.91%、12.53%,热稳定性较佳。
[0021]
作为本发明所述胞苷单磷酸激酶突变体的优选实施方式,所述的突变选自如下任一组合:
[0022]
1)包含第77位天冬酰胺被组氨酸取代和第79位谷氨酰胺被天冬酰胺取代,或;
[0023]
2)包含第77位天冬酰胺被组氨酸取代和第173位精氨酸被丝氨酸取代,或;
[0024]
3)包含第79位谷氨酰胺被天冬酰胺取代和第173位精氨酸被丝氨酸取代,或;
[0025]
4)包含第77位天冬酰胺被组氨酸取代、第79位谷氨酰胺被天冬酰胺取代和第173位精氨酸被丝氨酸取代。
[0026]
本发明对获得的核苷酸序列进行了密码子优化,最后突变获得热稳定性较高的胞苷单磷酸激酶突变体,本发明的胞苷单磷酸激酶突变体在酶催化实验中合成3
’‑
唾液酸乳糖产量较高,并且底物sa的转化率也较高。
[0027]
经过热稳定性实验筛选,将胞苷单磷酸激酶在第77位、第79位和第173位进行组合突变,当胞苷单磷酸激酶第77位残基asn
→
his(天冬酰胺被组氨酸取代)和第173位残基arg
→
ser(精氨酸被丝氨酸取代)时,获得胞苷单磷酸激酶突变体残余酶活提高了24.43%,热稳定性效果最佳。
[0028]
将上述进行组合突变的胞苷单磷酸激酶突变体引入3
’‑
唾液酸乳糖合成过程中,可以显著提高3
’‑
唾液酸乳糖的含量和底物的转化率,有利于工业化生产3
’‑
唾液酸乳糖。
[0029]
第二目的,本发明提供了一种检测上述胞苷单磷酸激酶突变体的引物,所述引物的核苷酸序列如seq id no:2~seq id no:23所示。
[0030]
更优选地,检测胞苷单磷酸激酶中第3位丙氨酸被脯氨酸取代的引物如seq id no:2~3所示;检测第4位异亮氨酸被甘氨酸取代的引物如seq id no:4~5所示;检测第8位丙氨酸被天冬酰胺取代的引物如seq id no:6~7所示;检测第74位苏氨酸被甘氨酸取代的引物如seq id no:8~9所示;检测第76位甘氨酸被组氨酸取代的引物如seq id no:10~11所示;检测第77位天冬酰胺被组氨酸取代的引物如seq id no:12~13所示;检测第79位谷
氨酰胺被天冬酰胺取代的引物如seq id no:14~15所示;检测第85位谷氨酸被天冬酰胺取代的引物如seq id no:16~17所示;检测第170位天冬酰胺被甘氨酸取代的引物如seq id no:18~19所示;检测第173位精氨酸被丝氨酸取代的引物如seq id no:20~21所示;检测第223位赖氨酸被精氨酸取代的引物如seq id no:22~23所示。
[0031]
第三目的,本发明提供了一种基因,基因编码上述的胞苷单磷酸激酶突变体。
[0032]
第四目的,本发明提供了一种质粒,所述质粒包括上述的胞苷单磷酸激酶突变体。
[0033]
第五目的,本发明提供了一种宿主细胞,宿主细胞包括上述的基因或者质粒。
[0034]
宿主细胞优选为大肠杆菌,在一优选实施例中,宿主细胞可以为大肠杆菌、链霉菌、酵母菌等宿主微生物。
[0035]
第六目的,本发明提供了上述胞苷单磷酸激酶突变体在制备3
’‑
唾液酸乳糖中的应用。
[0036]
第七目的,本发明提供了上述胞苷单磷酸激酶突变体在提高胞苷单磷酸激酶热稳定性能中的应用。
[0037]
第八目的,本发明提供了一种促进3
’‑
唾液酸乳糖催化活性的方法,在生物酶法催化体系中,使用上述的胞苷单磷酸激酶突变体。
[0038]
在一优选实施例中,所述的生物酶法催化体系为体外酶法或全细胞催化。
[0039]
与现有技术相比,本发明具有以下有益效果:
[0040]
本发明提供了一种胞苷单磷酸激酶突变体及其基因和应用,采用定点突变提高了胞苷单磷酸激酶的热稳定性,将热稳定性佳的胞苷单磷酸激酶突变体构建到菌株中,在3
’‑
唾液酸乳糖的酶催化合成中,提高了酶催化反应的速率和减少了酶活力的损失,使得可以获得更高产量的3
’‑
唾液酸乳糖,并进一步提升了底物的转化率,缩短了生产周期,降低了生产成本。
附图说明
[0041]
图1为野生型与胞苷单磷酸激酶单点突变体热稳定性图;
[0042]
图2为野生型与胞苷单磷酸激酶复合突变体热稳定性图;
[0043]
图3为n77h/r173s组合突变体的基因位点突变序列比对图;
[0044]
图4为cmp的标准曲线;
[0045]
图5为3
’‑
sl的标准曲线;
[0046]
图6为sa的标准曲线;
[0047]
图7为3
’‑
唾液酸乳糖含量变化图。
具体实施方式
[0048]
为更好的说明本发明的目的、技术方案和优点,下面将结合附图和具体实施例对本发明作进一步说明。
[0049]
在以下实施例中,所使用的实验方法如无特殊说明,均为常规方法,所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0050]
本发明基于b-factor的理性设计方法,对胞苷单磷酸激酶进行点突变改造,获得突变后的胞苷单磷酸激酶突变体。本发明的胞苷单磷酸激酶突变体可以是重组多肽、合成
多肽。其可以是化学合成的产物,或使用重组技术从原核或真核宿主(例如,细菌、酵母、高等植物、昆虫和哺乳动物细胞)中产生。本发明的胞苷单磷酸激酶突变体的核苷酸序列与seq id no:1具有至少90%的核苷酸序列一致性,且包含以下至少一个或多个位置的突变,所述的突变位点包括seq id no:1的第3、4、5、74、77、79、85、170或173位中的至少一个突变位点,突变为在所述的突变位点上发生取代、插入或删除一个或多个氨基酸残基。
[0051]
实施例1、构建胞苷单磷酸激酶单点突变体质粒
[0052]
1)在pdb数据库中选择cmk(pdb数据库登录号:1kdo)的核苷酸序列作为cmk突变位点的模板(核苷酸序列如seq id no:1所示),本发明人经过大量的实验,对胞苷单磷酸激酶多个位点改造,最终选择11个突变位点,即在seq id no:1基础上可进行单点突变,第3位丙氨酸被脯氨酸取代;或第4位异亮氨酸被甘氨酸取代;或第8位丙氨酸被天冬酰胺取代;或第74位苏氨酸被甘氨酸取代;或第76位甘氨酸被组氨酸取代;或第77位天冬酰胺被组氨酸取代;或第79位谷氨酰胺被天冬酰胺取代;或第85位谷氨酸被天冬酰胺取代;或第170位天冬酰胺被甘氨酸取代;或第173位精氨酸被丝氨酸取代;或第223位赖氨酸被精氨酸取代。本发明采用定点试剂盒进行突变,其中突变位点的引物表如表1所示。
[0053]
表1
[0054][0055][0056]
2)通过pcr技术,将cmk基因插入表达质粒pet22b( )的hindiii和bamhi限制性位点之间,获得质粒pet22b( )-cmk。以pet22b( )-cmk为突变模板,分别利用上述表1的引物进行定点突变。
12h,使用质粒提取试剂盒进行质粒提取,经(1%,w/v)琼脂糖凝胶电泳检测后测序。将测序正确的质粒分别命名为pet22b( )-3p(胞苷单磷酸激酶突变体a3p),pet22b( )-4g(胞苷单磷酸激酶突变体i4g),pet22b( )-5n(胞苷单磷酸激酶突变体a5n),pet22b( )-74g(胞苷单磷酸激酶突变体t74g),pet22b( )-76h(胞苷单磷酸激酶突变体g76h),pet22b( )-77h(胞苷单磷酸激酶突变体n77h),pet22b( )-79n(胞苷单磷酸激酶突变体q79n),pet22b( )-85n(胞苷单磷酸激酶突变体e85n),pet22b( )-170g(胞苷单磷酸激酶突变体n170g),pet22b( )-173s(胞苷单磷酸激酶突变体r173s)和pet22b( )-223r(胞苷单磷酸激酶突变体k223r);将测序正确的菌种保存-80℃。
[0080]
4、胞苷单磷酸激酶复合突变体的构建
[0081]
将上述筛选的热稳定性好的胞苷单磷酸激酶突变体n77h、q79n与r173s进行组合突变,即在seq id no:1基础上可进行组合突变,例如1)包含第77位天冬酰胺被组氨酸取代和第79位谷氨酰胺被天冬酰胺取代(n77h/q79n组合突变体),或;2)包含第77位天冬酰胺被组氨酸取代和第173位精氨酸被丝氨酸取代(n77h/r173s组合突变体),或;3)包含第79位谷氨酰胺被天冬酰胺取代和第173位精氨酸被丝氨酸取代(q79n/r173s组合突变体),或;4)包含第77位天冬酰胺被组氨酸取代、第79位谷氨酰胺被天冬酰胺取代和第173位精氨酸被丝氨酸取代(n77h/q79n/r173s组合突变体)。以n77h/q79n组合突变体为例,以pet22b( )-77h质粒为模板,q79n-f和q79n-r为引物,利用pcr技术进行克隆,再化转进e.coli bl21 star(de3)
△
lacz
△
nanetka中,提质粒进行测序,测序正确的质粒命名为pet22b( )-n77h/q79n、pet22b( )-n77h/r173s、pet22b( )-q79n/r173s和pet22b( )-n77h/q79n/r173s构建方法同上,将测序正确的菌种保存-80℃。
[0082]
实施例3、突变株发酵及酶活检测
[0083]
1、菌体制备
[0084]
1)种子液准备:从-80℃冰箱中取出甘油管保藏的实施例2含有胞苷单磷酸激酶单点/复合突变体的菌种,在含50ug/ml amp抗性的lb平板上划线,37℃过夜培养;从固体平板上挑取单菌落,并接种到含有50ug/ml的amp抗性5ml lb培养基中,37℃恒温振荡培养过夜;
[0085]
2)发酵培养:将上述过夜培养物按1%接种量转接于装有含50ug/ml的amp抗性100ml lb培养基的三角瓶中,37℃、230rpm继续培养至od
600
=0.6~0.8,加入终浓度为0.2mm iptg再转入18℃,250rpm恒温振荡培养16h。
[0086]
3)菌体收集:将发酵液在4℃、10000rpm离心10min,倒掉上清,收集菌体,-20℃保存。
[0087]
2、热稳定性检测
[0088]
1)将含未突变质粒的野生型(wt)菌和含胞苷单磷酸激酶单点/复合突变体的菌种分别定量冰浴超声破碎,破碎条件:超3s,停6s,超声50次。
[0089]
2)取定量的粗酶液加入5ml的底物体系中,30℃水浴30min,立即用沸水煮2min,12000rpm,5min离心,取上清,过滤进样。平行实验3组,取平均值。底物体系:50mm tris-hcl(ph8.0)、50mm(nh4)2so4、10mm mgcl2、10mm atp、5mm cmp。
[0090]
3)酶活测定
[0091]
同时将剩余粗酶液放于35℃孵育4h,重复第二步操作。将未经保温孵育wt及各突变体的酶活定义为100%,其热稳定性即残余酶活定义为孵育4h后测的酶活/未经保温所测
的酶活*100%。
[0092]
4)酶活的定义:
[0093]
在30℃下,每分钟能转化1μmol底物cmp的酶量。
[0094]
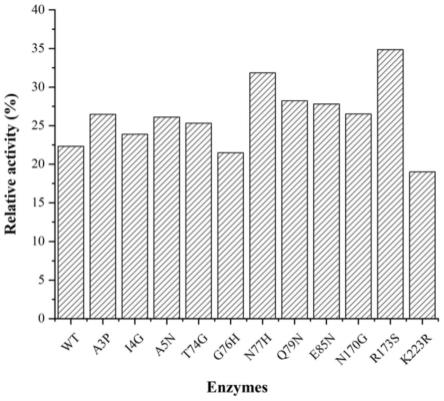
经过热稳定性实验筛选可知,与野生型相比,胞苷单磷酸激酶突变体n77h、胞苷单磷酸激酶突变体q79n与胞苷单磷酸激酶突变体r173s分别提高了9.52%、5.91%、12.53%(参考图1)。与野生型相比,n77h/r173s组合突变体的残余酶活提高了24.43%,因此n77h/r173s组合突变体的热稳定效果最佳(参考图2)。
[0095]
实施例4、3
’‑
唾液酸乳糖(3
’‑
sl)酶催化方法
[0096]
1)3
’‑
sl酶催化质粒构建
[0097]
使用质粒pet-22b( )-n77h/r173s作为模板,引物sl-f(atatacatatgaccgcaatt)和sl-r(cagactcgagggccagggcc)扩增n77h/r173s基因片段,使用限制性内切酶ndei和xhoi消化扩增片段和petduet-ppk。从琼脂糖凝胶中回收片段并与线性化载体用t4连接酶连接。将连接产物化转到实验室保存的感受态细胞e.coli dh5α中,37℃修复后,涂至amp的平板上进行筛选。阳性转化子经pcr验证和测序证实(图3)后,得到质粒petduet-ppk-cmk-n77h/r173s(pdpcns)。将质粒pdpcns转入e.coli bl21 star(de3)
△
lacz
△
nanetka/pcoladuet-css-st中,得到菌株e.coli bl21 star(de3)
△
lacz
△
nanetka/pcoladuet-css-st/petduet-ppk-cmk-n77h/r173s,命名为菌株b。取菌株e.coli bl21 star(de3)
△
lacz
△
nanetka/pcoladuet-css-st/petduet-ppk-cmk,命名为菌株a,其中pcoladuet-css-st/petduet-ppk-cmk来源于li z,chen x,ni z,et al,processes,efficient production of 3
′‑
sialyllactose by single whole-cell in one-pot biosynthesis.2021,9(6).。同样操作分别得到菌株c:e.coli bl21 star(de3)
△
lacz
△
nanetka/pcoladuet-css-st/petduet-ppk-cmk-n77h/q79n/r173s、菌株d:e.coli bl21 star(de3)
△
lacz
△
nanetka/pcoladuet-css-st/petduet-ppk-cmk-q79n/r173s、菌株e:e.coli bl21 star(de3)
△
lacz
△
nanetka/pcoladuet-css-st/petduet-ppk-cmk-n77h/q79n。
[0098]
2)热稳定菌株的制备
[0099]
①
种子液准备:从-80℃冰箱中取出甘油管保藏的上步骤的菌株a、b、c、d、e,在含50ug/ml amp和50ug/ml kan抗性的lb平板上划线,37℃过夜培养;从固体平板上挑取单菌落,并接种到含有50ug/ml的amp和50ug/ml kan抗性50ml lb培养基中,37℃恒温振荡培养过夜。
[0100]
②
发酵培养:将上述过夜培养物按1%接种量转接于装有含50ug/ml的amp和50ug/ml kan抗性100ml lb培养基的三角瓶中,37℃、230rpm继续培养至od600=0.6~0.8,加入终浓度为0.2mm iptg再转入20℃,250rpm恒温振荡培养18h。
[0101]
③
菌体的收集:将发酵液在4℃、8000rpm离心10min,倒掉上清,收集菌体。-20℃保存。
[0102]
3)酶催化合成3
’‑
sl
[0103]
①
将菌株a~e的菌体分别定量冰浴超声破碎,破碎条件:超3s,停6s,超声50次。
[0104]
②
将上述粗酶液加入3
’‑
sl的酶催化25ml的反应体系中,反应体系:80mm sa、90mm乳糖、30mm mgcl2、30mm六偏磷酸、30mm cmp、40g/l的菌体。反应温度为35℃,ph为7.00,且用磁力搅拌器搅拌。2h后补10mm六偏磷酸钠。每隔2h取样,立即用沸水煮2min,12000rpm,
5min离心,取上清,稀释合适倍数,过滤进样。平行实验3组,取平均值。hplc检测sa和3
’‑
sl的含量。
[0105]
其中检测cmp的条件包括:zorbax c18色谱柱;柱温为30℃;检测波长为271nm;流动相为11%(甲醇)和含89%的0.6%磷酸(三乙胺调节ph6.6);流速为0.6ml/min。
[0106]
检测sa、sl的条件包括:tskgel amide-80色谱柱;柱温为60℃;检测波长为210nm;流动相为70%(乙腈)和30%甲酸铵(10mm,ph4.0);流速为1.0ml/min。其中cmp、3
’‑
sl、sa的标准曲线分别如图4-6所示。
[0107]
参考图7,当sa底物为80mm时,反应10h后,添加菌株b的酶催化实验中产生76.54mm的3
’‑
sl,底物sa转化率95.7%;对照组即添加菌株a的酶催化实验中产生60.68mm的3
’‑
sl,底物sa转化率75.9%。
[0108]
综上所述,将含有热稳定性较好的n77h/r173s组合突变体的基因构建到重组菌株b中,在3
’‑
sl的酶催化合成过程中,与对照组相比,添加重组菌株b菌体的酶催化体系可以得到更高产量的3
’‑
sl和底物sa的更高转化率。
[0109]
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。