1.本发明属于基因工程技术领域,具体涉及细胞周期调控蛋白抑制剂在肿瘤治疗中的应用。
背景技术:
2.细胞以分裂的方式进行增殖,每次分裂后所产生的新细胞必须经过生长增大,才能再分裂,细胞增殖必须经过生长到分裂的这种过程称为细胞周期。维持正常的细胞周期动力学是一切生命现象的基础,细胞周期各生化事件的进行受到系列蛋白的严格调控。细胞周期调控蛋白参与对细胞周期各时期的过程进行调控,如polo样激酶家族(plk1),是一类广泛存在于真核细胞中的丝氨酸/苏氨酸激酶,可通过其激酶活性与多种底物相互作用,调节细胞有丝分裂、胞质分裂、dna损伤应答、发育等过程,plk1一直被认为是一种致癌基因,抑制其活性可以诱导肿瘤细胞的凋亡;c-jun氨基末端激酶(jnk),又称为应激活化蛋白激酶,在细胞周期、生殖、凋亡和细胞应激等多种生理和病理过程中起重要作用,有研究报道激活jnk通路可以促进肿瘤细胞的增殖,促进肿瘤形成;ras蛋白是一种膜结合型的gtp/gdp结合蛋白,kras基因是ras家族中最主要的突变型,与22%的人类肿瘤相关,是肺癌、结直肠癌和胰腺癌中的高频突变基因,kras蛋白由突变的kras基因编码,其会持续刺激细胞生长,打乱生长规律,从而导致肿瘤的发生。上述三种细胞周期调控蛋白都可以在一定条件下促进肿瘤的形成,因此抑制这一类细胞周期调控蛋白的表达水平,可以有效抑制肿瘤的生长。
3.目前,针对于细胞周期调控蛋白的抑制剂,主要有抗体类、crispr类、非编码小rna类、反义寡核苷酸类、小干扰rna类、小分子类抑制剂。但是,这些抑制剂都有一定缺点:抗体分子通常较大,免疫原性较高,体内组织渗透性差,含有二硫键、糖基化等修饰,结构复杂,生产成本高;由于人类中普遍存在基因突变和密码子简并性,设计的crispr靶向靶基因序列的向导rna(sgrna)存在脱靶或无效的风险,且crispr技术的靶点是基因组,并不直接作用于翻译目标蛋白的mrna及目标蛋白本身,所以起效慢;由于人类中普遍存在基因突变和密码子简并性,因此使用非编码小rna类、小干扰rna类和反义寡核苷酸类抑制剂,这些核苷酸序列存在脱靶或无效的风险;而有效的小分子类抑制剂需要从成千上万的小分子中大规模筛选出活性小分子,耗时冗长,耗费极高,且活性小分子经过药监局试验动物模型有效性及毒性评估后,还需经过一期临床试验进行人体毒性评估,然则人与试验动物体内的生物酶存在很大差异,对试验动物没有毒性的小分子抑制剂,在人体内某些生物酶的作用下则会转化为对人体具有巨大毒性的小分子,从而使得筛选出的九成以上的活性小分子在一期临床试验惨遭淘汰。
4.因此,提供能高效、快速、低成本降低细胞周期调控蛋白抑制剂在肿瘤治疗中显得尤为重要。
技术实现要素:
5.本发明旨在至少解决上述现有技术中存在的技术问题之一。为此,本发明提出细胞周期调控蛋白抑制剂在制备肿瘤治疗药物中的应用,这种抑制剂能够快速、高效地降低细胞周期调控蛋白的水平,进而抑制肿瘤的形成及生长。
6.本发明还提出一种用于肿瘤治疗的药物组合物。
7.根据本发明的一个方面,提出了细胞周期调控蛋白抑制剂在制备肿瘤治疗药物中的应用,所述细胞周期调控蛋白抑制剂包括编码靶向抑制细胞周期调控蛋白的融合蛋白的mrna,所述融合蛋白包括设计锚蛋白重复序列蛋白和降解结构域。
8.根据本发明的一种优选的实施方式,至少具有以下有益效果:
9.设计锚蛋白重复序列蛋白(darpin)作为一种新型的结合蛋白,与抗体药物相比具有稳定性高、免疫原性低、能在表达菌株中高水平表达、生产成本低等诸多优点;该抑制剂以mrna为主要成分,mrna进入细胞后翻译成融合蛋白的速度很快,融合蛋白直接作用于细胞周期调控蛋白的速度也很快,即该抑制剂的起效速度快于crispr类抑制剂和小干扰rna类抑制剂;且mrna进入细胞质就能发挥作用,不需要进入细胞核,因此该抑制剂的转染效率也较高;另外,该抑制剂对基因突变和密码子简并性的兼容性更高,不会脱靶;相较于小分子类抑制剂(针对不同目标蛋白的分子结构差异巨大,体内代谢和降解途径的不可预知性很大),以mrna为主要组分的抑制剂,mrna的体内代谢及降解途径都十分明确,以该抑制剂为主要成分的肿瘤治疗药物通过药监局指定的动物有效性及毒性试验后,通过ⅰ期临床试验的可能性更高,从而进一步降低药物研发成本。
10.其中,所述细胞周期调控蛋白抑制剂为降解所述细胞周期调控蛋白的物质。
11.在本发明的一些实施方式中,所述设计锚蛋白重复序列蛋白包括靶向所述细胞周期调控蛋白的设计锚蛋白重复序列蛋白。
12.所述降解结构域通过招募蛋白酶体降解途径中参与降解的物质,进而降解所述设计锚蛋白重复序列蛋白靶向结合的细胞周期调控蛋白。
13.在本发明的一些实施方式中,所述细胞周期调控蛋白包括plk1、jnk或kras中的至少一种。
14.在本发明的一些实施方式中,所述设计锚蛋白重复序列蛋白包括靶向所述plk1、所述jnk或所述kras的设计锚蛋白重复序列蛋白中的至少一种。
15.在本发明的一些实施方式中,所述肿瘤包括结直肠癌、肺癌、胰腺癌、乳腺癌、宫颈癌或肝癌中的至少一种。
16.在本发明的一些优选的实施方式中,所述设计锚蛋白重复序列蛋白为靶向plk1的设计锚蛋白重复序列蛋白,其氨基酸序列如seq id no:1所示。
17.seq id no:1:
18.meqkliseedlggldykddddkasgsdlgkklleaaragqddevriliangadvnavdntgltplhlaavsghleivevllkhgadvdaadvygftplhlaamtghleivevllkygadvnafdmtgstplhlaadeghleivevllky。
19.在本发明的一些优选的实施方式中,所述设计锚蛋白重复序列蛋白为靶向jnk的设计锚蛋白重复序列蛋白,其氨基酸序列如seq id no:2所示。
20.seq id no:2:
21.meqkliseedlggldykddddkasgsdlgkklleaareghrdrveefikrgadvntadetgftplhlaaweghlgivevllkngadvnanderghtplhlaaytghleivevllkngagvnatdvigtaplhlaamwghleivevllkhgadvnaqdkfgktpfdlaidngnediaevlqkaa。
22.在本发明的一些优选的实施方式中,所述设计锚蛋白重复序列蛋白为靶向kras的设计锚蛋白重复序列蛋白,其氨基酸序列如seq id no:3所示。
23.seq id no:3:
24.meqkliseedlggldykddddkasgsdlgkklleaaragqddevrilmangadvnahdtfgftplhlaalyghleivevllkngadvnaddsygrtplhlaamrghleivevllkygadvnaadeegrtplhlaakrghleivevllkngadvnaqdkfgktafdisidngnedlaeilqkln。
25.在本发明的一些实施方式中,所述降解结构域包括招募泛素化复合物的结构域。
26.在本发明的一些优选的实施方式中,所述降解结构域包括e3泛素连接酶中招募所述泛素化复合物的结构域,或所述e3泛素连接酶中招募所述泛素化复合物的结构域中的1个或2个氨基酸改变后得到的结构域中的至少一种。
27.在本发明的一些更优选的实施方式中,所述降解结构域包括e3泛素连接酶的接头蛋白(spop),其氨基酸序列如seq id no:4所示。
28.seq id no:4:
29.vnisgqntmnmvkvpecrladelgglwensrftdcclcvagqefqahkailaarspvfsamfehemeeskknrveindvepevfkemmcfiytgkapnldkmaddllaaadkyalerlkvmcedalcsnlsvenaaeililadlhsadqlktqavdfinyhasdvletsgwksmvvshphlvaeayrslasaqcpflgpprkrlkqsgs。
30.具体地,在所述mrna编码的所述靶向抑制细胞周期调控蛋白的融合蛋白中,所述设计锚蛋白重复序列蛋白能够特异性地与所述细胞周期调控蛋白结合,所述降解结构域能够招募泛素化复合物,所述泛素化复合物给所述细胞周期调控蛋白标上泛素,所述泛素标记的细胞周期调控蛋白会被蛋白酶体降解,从而实现对所述细胞周期调控蛋白靶向抑制的作用。
31.在本发明的一些实施方式中,所述细胞周期调控蛋白抑制剂还包括载体。
32.在本发明的一些实施方式中,所述载体包括病毒载体或非病毒载体中的任一种。
33.在本发明的一些优选的实施方式中,所述载体选择所述非病毒载体。
34.在本发明的一些优选的实施方式中,所述非病毒载体包括聚合物材料、多肽或脂质纳米体中的至少一种。
35.在本发明的一些实施方式中,所述聚合物材料包括脂肪酸链修饰的聚合物材料。
36.在本发明的一些实施方式中,所述聚合物材料包括聚乙烯亚胺、聚氨基酯或壳聚糖中的至少一种。
37.在本发明的一些实施方式中,所述细胞周期调控蛋白抑制剂的制备方法,包括以下步骤:
38.s1:设计融合蛋白的氨基酸序列;
39.s2:推导编码所述融合蛋白的氨基酸序列对应的cdna序列,并插入质粒中;
40.s3:扩增并提取载有编码所述融合蛋白的cdna序列的质粒,将所述质粒转录形成mrna并纯化;
41.s4:将步骤s3中的mrna与载体混合即制成细胞周期调控蛋白抑制剂。
42.在本发明的一些实施方式中,步骤s1所述设计融合蛋白的氨基酸序列的方法,包括以下步骤:通过结构生物学和蛋白质组学,挖掘与细胞周期调控蛋白具有亲和力的设计锚蛋白重复序列蛋白,并获取相应的氨基酸序列;选择所述降解结构域,并获取相应的氨基酸序列;拼接所述与细胞周期调控蛋白具有亲和力的设计锚蛋白重复序列蛋白的氨基酸序列和所述降解结构域的氨基酸序列,经过热力学稳定性进行序列优化后,获得所述融合蛋白的氨基酸序列。
43.在本发明的一些实施方式中,步骤s2中还需在所述cdna序列的5’端加上t7启动子和kozak序列,经过密码子优化后将所述cdna序列插入所述质粒中。
44.在本发明的一些实施方式中,步骤s3中将所述质粒转入感受态细胞中,通过筛选、扩增并提取所述质粒。
45.在本发明的一些实施方式中,所述感受态细胞包括生产质粒的工程菌。
46.在本发明的一些实施方式中,步骤s4所述载体包括病毒载体或非病毒载体中的任一种。
47.在本发明的一些优选的实施方式中,所述载体选择非病毒载体。
48.在本发明的一些优选的实施方式中,所述非病毒载体包括聚合物材料、多肽或脂质纳米体中的至少一种。
49.在本发明的一些更优选的实施方式中,所述载体选择脂质纳米体。
50.在本发明的一些实施方式中,所述聚合物材料包括脂肪酸链修饰的聚合物材料。
51.在本发明的一些实施方式中,所述聚合物材料包括聚乙烯亚胺、聚氨基酯或壳聚糖中的至少一种。
52.在本发明的一些实施方式中,所述肿瘤治疗药物为固态形式或液态形式。
53.在本发明的一些实施方式中,所述固态形式包括颗粒剂、片剂、冻干粉、栓剂或胶囊中的任一种。
54.在本发明的一些实施方式中,所述液态形式包括口服液、溶液剂或糖浆剂中的任一种。
55.根据本发明的第二个方面,提出了一种用于肿瘤治疗的药物组合物,其中所述药物组合物包括:细胞周期调控蛋白抑制剂,药学上可接受的载体及其他抗肿瘤物质;所述细胞周期调控蛋白抑制剂包括编码靶向抑制细胞周期调控蛋白的融合蛋白的mrna,所述融合蛋白包括设计锚蛋白重复序列蛋白和降解结构域。
56.在本发明的一些实施方式中,所述药学上可接受的载体包括赋形剂、稀释剂、黏合剂或吸收促进剂中的至少一种。
57.在本发明的一些实施方式中,所述其他抗肿瘤物质包括细胞增殖抑制剂、抗肿瘤抗生素、激素或免疫抑制剂中的至少一种。
附图说明
58.下面结合附图和实施例对本发明做进一步的说明,其中:
59.图1为本发明实施例1中通过western blotting对plk1蛋白含量检测的结果图;其中,
“‑”
代表没有加入,“ ”代表加入;
60.图2为本发明实施例2中通过western blotting对jnk蛋白含量检测的结果图;其
中,
“‑”
代表没有加入,“ ”代表加入;
61.图3为本发明实施例3中通过western blotting对kras蛋白含量检测的结果图;其中,
“‑”
代表没有加入,“ ”代表加入;
62.图4为本发明试验例中不同注射条件下裸鼠的肿瘤大小的照片图;其中,
“‑”
代表没有加入,“ ”代表加入,虚线圈起来的部分为肿瘤。
具体实施方式
63.下面详细描述本发明的实施例,描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。
64.本发明的描述中,除非另有明确的限定,培养、离心等词语应做广义理解,所属技术领域技术人员可以结合技术方案的具体内容合理确定上述词语在本发明中的具体含义。
65.本发明的描述中,参考术语“一个实施例”、“一些实施例”等的描述意指结合该实施例描述的具体特征、材料或者特点包含于本发明的至少一个实施例中。在本说明书中,对上述术语的示意性表述不一定指的是相同的实施例。而且,描述的具体特征、材料或者特点可以在任何的一个或多个实施例中以合适的方式结合。
66.实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,均可从商业途径得到的试剂和材料。
67.实施例1
68.本实施例制备了plk1蛋白抑制剂,该抑制剂包括编码靶向抑制plk1蛋白的融合蛋白的mrna和阳离子脂质体。具体过程为:
69.(1)通过结构生物学和蛋白质组学,选取合适的设计锚蛋白重复序列蛋白和降解结构域;
70.设计锚蛋白重复序列蛋白:选取靶向plk1的设计锚蛋白重复序列蛋白,其氨基酸序列如seq id no:1所示;
71.seq id no:1:
72.meqkliseedlggldykddddkasgsdlgkklleaaragqddevriliangadvnavdntgltplhlaavsghleivevllkhgadvdaadvygftplhlaamtghleivevllkygadvnafdmtgstplhlaadeghleivevllky;
73.降解结构域:选取e3泛素连接酶的spop,其氨基酸序列如seq id no:4所示;
74.seq id no:4:
75.vnisgqntmnmvkvpecrladelgglwensrftdcclcvagqefqahkailaarspvfsamfehemeeskknrveindvepevfkemmcfiytgkapnldkmaddllaaadkyalerlkvmcedalcsnlsvenaaeililadlhsadqlktqavdfinyhasdvletsgwksmvvshphlvaeayrslasaqcpflgpprkrlkqsgs;
76.将seq id no:1和seq id no:4拼接,并经热力学稳定性优化;
77.(2)推导(1)中拼接得到的氨基酸序列对应的cdna序列,并在cdna的5’端加上t7启动子和kozak序列,经密码子优化后得到优化cdna序列,将优化cdna序列插入质粒中;
78.(3)将(2)中的质粒转入感受态细胞dh5α中,经过含氨苄青霉素的lb平板培养基挑选单克隆菌种测序,获得含有(2)中优化cdna序列的单克隆菌种,经过含氨苄青霉素的lb液体培养基扩增并提取质粒;将获得的质粒用t7启动子体外转录试剂盒转录出大量mrna并纯
化,mrna的序列如seq id no:5所示;
79.seq id no:5:
80.auggaacagaagcugaucucagaggaagaccuggggggccuggacuacaaagaugaugaugacaaggcaagcggcagcgaucugggcaaaaagcugcuggaggccgcacgcgccggacaggaugaugaggugcggauccucaucgcuaacggcgccgauguuaaugccguggauaauacaggccugaccccucugcaccuggccgccgugucuggccaccuggagauuguggaggugcugcugaaacacggcgccgacgucgacgccgccgacgucuauggguucacuccccugcaccucgcugccaugaccggacaccuggagaucguggaggugcuucugaaguacggcgccgaugugaacgccuucgacaugaccggcucaacuccacugcaccuggcagccgacgagggacaucuggagaucguggaaguccugcugaaauacggaagcggcagcggcucaggcuccgugaacaucagcggacagaauacaaugaacauggugaaggugcccgagugcaggcuggccgacgagcugggcggccugugggagaacagcagguucaccgacugcugccuguguguggcuggucaggaguuccaggcccacaaggccauccuggccgccaggucccccguguucagcgccauguucgagcacgagauggaggaguccaagaagaaccgcguggagauuaaugaugucgaacccgagguguucaaggaaaugaugugcuucaucuauaccggcaaggcucccaaucuggacaaaauggccgaugaucugcuggccgccgccgacaaguacgcccuggaaagacugaaggucaugugcgaggaugcccuguguuccaaucugagcguggaaaacgccgccgaaauucugauccuggcugaccugcacucagccgaucagcugaagacucaggccguggauuucauuaacuaccacgcaagugaugugcuggagacuagcggcuggaagucaaugguggugagccacccccaccugguggcagaggcuuauagaucucuggccucugcccagugccccuuucugggccccccccgcaagcgccugaagcagagcgggucuug;
81.(4)将(2,3-二油酰基-丙基)-三甲基氯化铵、1,2-二油酰-sn-甘油-3-磷酸、胆固醇和二硬脂酰基磷脂酰乙醇胺-聚乙二醇-2000按摩尔比为1:1:1:0.1混合制成阳离子脂质体,将阳离子脂质体与上述mrna混合即制成plk1蛋白抑制剂;
82.培养人宫颈癌细胞hela(来源于北京协和医院),使用的培养基是dmem培养基、10%胎牛血清和1%青霉素-链霉素溶液,均购自美国gibco公司,培养条件为37℃,5%co2;
83.然后将hela细胞分为3组,第1组不加上述mrna和阳离子脂质体,第2组向每毫升hela细胞培养基中添加64μg阳离子脂质体,第3组向每毫升hela细胞培养基中添加2μg mrna和64μg阳离子脂质体(即加入了上述plk1蛋白抑制剂),静置15min后,用超滤管加超纯水,多次离心,培养细胞6h后提取细胞总蛋白,进行蛋白质印迹(western blotting)检测,以检测plk1蛋白的含量,结果如图1所示。
84.图1显示,以actin蛋白作为内参蛋白,
“‑”
代表没有加入,“ ”代表加入;第1组(不加mrna和阳离子脂质体)和第2组(只加阳离子脂质体)中plk1蛋白的含量均不会降低,而第3组(加入了plk1蛋白抑制剂)中plk1蛋白的含量显著降低,表明上述plk1蛋白抑制剂中编码融合蛋白的mrna具有显著抑制plk1蛋白水平的作用,且阳离子脂质体对plk1蛋白没有影响,只起到递送mrna的作用。
85.实施例2
86.本实施例制备了jnk蛋白抑制剂,该抑制剂包括编码靶向抑制jnk蛋白的融合蛋白的mrna和阳离子脂质体。具体过程为:
87.(1)通过结构生物学和蛋白质组学,选取合适的设计锚蛋白重复序列蛋白和降解结构域;
88.设计锚蛋白重复序列蛋白:选取靶向jnk的设计锚蛋白重复序列蛋白,其氨基酸序列如seq id no:2所示;
89.seq id no:2:
90.meqkliseedlggldykddddkasgsdlgkklleaareghrdrveefikrgadvntadetgftplhlaaweghlgivevllkngadvnanderghtplhlaaytghleivevllkngagvnatdvigtaplhlaamwghleivevllkhgadvnaqdkfgktpfdlaidngnediaevlqkaa;
91.降解结构域:选取e3泛素连接酶的spop,其氨基酸序列如seq id no:4所示;
92.seq id no:4:
93.vnisgqntmnmvkvpecrladelgglwensrftdcclcvagqefqahkailaarspvfsamfehemeeskknrveindvepevfkemmcfiytgkapnldkmaddllaaadkyalerlkvmcedalcsnlsvenaaeililadlhsadqlktqavdfinyhasdvletsgwksmvvshphlvaeayrslasaqcpflgpprkrlkqsgs;
94.将seq id no:2和seq id no:4拼接,并经热力学稳定性优化;
95.(2)推导(1)中拼接得到的氨基酸序列对应的cdna序列,并在cdna的5’端加上t7启动子和kozak序列,经密码子优化后得到优化cdna序列,将优化cdna序列插入质粒中;
96.(3)将(2)中的质粒转入感受态细胞dh5α中,经过含氨苄青霉素的lb平板培养基挑选单克隆菌种测序,获得含有(2)中优化cdna序列的单克隆菌种,经过含氨苄青霉素的lb液体培养基扩增并提取质粒;将获得的质粒用t7启动子体外转录试剂盒转录出大量mrna并纯化,mrna的序列如seq id no:6所示;
97.seq id no:6:
98.auggagcagaagcugaucuccgaggaggaccugggcggccuggacuauaaggacgacgacgacaaggccucuggcagugaccuggggaagaagcugcuggaggccgcccgcgagggacauagggaucgcguggaagaauuuaucaagagaggcgccgacgugaacacagcugaugaaaccgguuuuacaccucugcaccuggccgccugggaaggccaccugggcauuguggaagugcugcucaaaaacggcgccgacgugaacgccaaugacgagagaggccauaccccucugcaccuggcagccuacacagggcaccuggagaucguggaggugcugcugaagaacggcgccggagugaaugccacugaugugaucggcaccgccccucugcaucuggccgccauguggggccaccuggaaaucguggaggugcugcugaagcauggagcugacgugaacgcacaggacaaguuuggcaaaaccccauuugaucuggccauugacaauggcaacgaagacauugcugaggugcugcagaaagccgccggaagcggcagcggcucaggcuccgugaacaucagcggacagaauacaaugaacauggugaaggugcccgagugcaggcuggccgacgagcugggcggccugugggagaacagcagguucaccgacugcugccuguguguggcuggucaggaguuccaggcccacaaggccauccuggccgccaggucccccguguucagcgccauguucgagcacgagauggaggaguccaagaagaaccgcguggagauuaaugaugucgaacccgagguguucaaggaaaugaugugcuucaucuauaccggcaaggcucccaaucuggacaaaauggccgaugaucugcuggccgccgccgacaaguacgcccuggaaagacugaaggucaugugcgaggaugcccuguguuccaaucugagcguggaaaacgccgccgaaauucugauccuggcugaccugcacucagccgaucagcugaagacucaggccguggauuucauuaacuaccacgcaagugaugugcuggagacuagcggcuggaagucaaugguggugagccacccccaccugguggcagaggcuuauagaucucuggccucugcccagugccccuuucugggccccccccgcaagcgccugaagcagagcgggucuug;
99.(4)将(2,3-二油酰基-丙基)-三甲基氯化铵、1,2-二油酰-sn-甘油-3-磷酸、胆固醇和二硬脂酰基磷脂酰乙醇胺-聚乙二醇-2000按摩尔比为1:1:1:0.1混合制成阳离子脂质体,将阳离子脂质体与上述mrna混合即制成jnk蛋白抑制剂;
100.培养人宫颈癌细胞hela(来源于北京协和医院),使用的培养基是dmem培养基、10%胎牛血清和1%青霉素-链霉素溶液,均购自美国gibco公司,培养条件为37℃,5%co2;
101.然后将hela细胞分为3组,第1组不加上述mrna和阳离子脂质体,第2组向每毫升
hela细胞培养基中添加64μg阳离子脂质体,第3组向每毫升hela细胞培养基中添加2μg mrna和64μg阳离子脂质体(即加入了上述jnk蛋白抑制剂),静置15min后,用超滤管加超纯水,多次离心,培养细胞6h后提取细胞总蛋白,进行蛋白质印迹(western blotting)检测,以检测jnk蛋白的含量,结果如图2所示。
102.图2显示,以actin蛋白作为内参蛋白,
“‑”
代表没有加入,“ ”代表加入;第1组(不加mrna和阳离子脂质体)和第2组(只加阳离子脂质体)中jnk蛋白的含量均不会降低,而第3组(加入了jnk蛋白抑制剂)中jnk蛋白的含量显著降低,表明上述jnk蛋白抑制剂中编码融合蛋白的mrna具有显著抑制jnk蛋白水平的作用,且阳离子脂质体对jnk蛋白没有影响,只起到递送mrna的作用。
103.实施例3
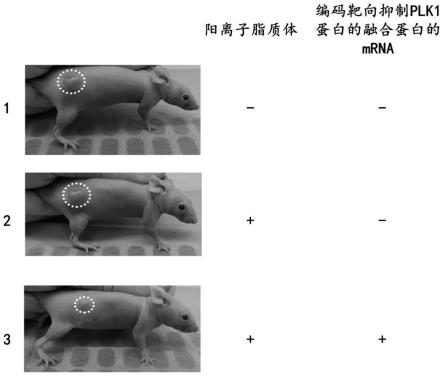
104.本实施例制备了kras蛋白抑制剂,该抑制剂包括编码靶向抑制kras蛋白的融合蛋白的mrna和阳离子脂质体。具体过程为:
105.(1)通过结构生物学和蛋白质组学,选取合适的设计锚蛋白重复序列蛋白和降解结构域;
106.设计锚蛋白重复序列蛋白:选取靶向kras的设计锚蛋白重复序列蛋白,其氨基酸序列如seq id no:3所示;
107.seq id no:3:
108.meqkliseedlggldykddddkasgsdlgkklleaaragqddevrilmangadvnahdtfgftplhlaalyghleivevllkngadvnaddsygrtplhlaamrghleivevllkygadvnaadeegrtplhlaakrghleivevllkngadvnaqdkfgktafdisidngnedlaeilqkln;
109.降解结构域:选取e3泛素连接酶的spop,其氨基酸序列如seq id no:4所示;
110.seq id no:4:
111.vnisgqntmnmvkvpecrladelgglwensrftdcclcvagqefqahkailaarspvfsamfehemeeskknrveindvepevfkemmcfiytgkapnldkmaddllaaadkyalerlkvmcedalcsnlsvenaaeililadlhsadqlktqavdfinyhasdvletsgwksmvvshphlvaeayrslasaqcpflgpprkrlkqsgs;
112.将seq id no:3和seq id no:4拼接,并经热力学稳定性优化;
113.(2)推导(1)中拼接得到的氨基酸序列对应的cdna序列,并在cdna的5’端加上t7启动子和kozak序列,经密码子优化后得到优化cdna序列,将优化cdna序列插入质粒中;
114.(3)将(2)中的质粒转入感受态细胞dh5α中,经过含氨苄青霉素的lb平板培养基挑选单克隆菌种测序,获得含有(2)中优化cdna序列的单克隆菌种,经过含氨苄青霉素的lb液体培养基扩增并提取质粒;将获得的质粒用t7启动子体外转录试剂盒转录出大量mrna并纯化,mrna的序列如seq id no:7所示;
115.seq id no:7:
116.auggaacagaaacugaucucugaggaggaucugggcggccuggacuauaaggaugacgacgacaaagccuccggcuccgaucugggaaagaaacugcuggaggccgcccgggccggccaggacgacgaggugagaauccugauggccaacggcgccgacguuaacgcccacgacaccuuuggcuucacuccucugcaccucgccgcccuguauggccaucuggagaucguggaggugcugcugaagaacggagccgacgugaaugcugacgauagcuacggaaggaccccacugcaucuggccgccaugagaggccaccuggagauuguggaggugcugcugaaguacggagcggacgugaacgccgcugaugaggaaggcaggaccccccugcaccuggcugccaaaagaggacaccuggagauuguggaggugcugcugaaaaacg
gcgccgaugugaacgcccaggacaaguuuggaaagacugccuucgacaucucaaucgacaacggcaacgaggaucuggccgagauucugcagaaacugaacggaagcggcagcggcucaggcuccgugaacaucagcggacagaauacaaugaacauggugaaggugcccgagugcaggcuggccgacgagcugggcggccugugggagaacagcagguucaccgacugcugccuguguguggcuggucaggaguuccaggcccacaaggccauccuggccgccaggucccccguguucagcgccauguucgagcacgagauggaggaguccaagaagaaccgcguggagauuaaugaugucgaacccgagguguucaaggaaaugaugugcuucaucuauaccggcaaggcucccaaucuggacaaaauggccgaugaucugcuggccgccgccgacaaguacgcccuggaaagacugaaggucaugugcgaggaugcccuguguuccaaucugagcguggaaaacgccgccgaaauucugauccuggcugaccugcacucagccgaucagcugaagacucaggccguggauuucauuaacuaccacgcaagugaugugcuggagacuagcggcuggaagucaaugguggugagccacccccaccugguggcagaggcuuauagaucucuggccucugcccagugccccuuucugggccccccccgcaagcgccugaagcagagcgggucuug;
117.(4)将(2,3-二油酰基-丙基)-三甲基氯化铵、1,2-二油酰-sn-甘油-3-磷酸、胆固醇和二硬脂酰基磷脂酰乙醇胺-聚乙二醇-2000按摩尔比为1:1:1:0.1混合制成阳离子脂质体,将阳离子脂质体与上述mrna混合即制成kras蛋白抑制剂;
118.培养人宫颈癌细胞hela(来源于北京协和医院),使用的培养基是dmem培养基、10%胎牛血清和1%青霉素-链霉素溶液,均购自美国gibco公司,培养条件为37℃,5%co2;
119.然后将hela细胞分为3组,第1组不加上述mrna和阳离子脂质体,第2组向每毫升hela细胞培养基中添加64μg阳离子脂质体,第3组向每毫升hela细胞培养基中添加2μg mrna和64μg阳离子脂质体(即加入了上述kras蛋白抑制剂),静置15min后,用超滤管加超纯水,多次离心,培养细胞6h后提取细胞总蛋白,进行蛋白质印迹(western blotting)检测,以检测kras蛋白的含量,结果如图3所示。
120.图3显示,以actin蛋白作为内参蛋白,
“‑”
代表没有加入,“ ”代表加入;第1组(不加mrna和阳离子脂质体)和第2组(只加阳离子脂质体)中kras蛋白的含量均不会降低,而第3组(加入了kras蛋白抑制剂)中kras蛋白的含量显著降低,表明上述kras蛋白抑制剂中编码融合蛋白的mrna具有显著抑制kras蛋白水平的作用,且阳离子脂质体对kras蛋白没有影响,只起到递送mrna的作用。
121.试验例
122.本试验例对实施例1制备的plk1蛋白抑制剂的有效性进行了测试。其中:
123.将培养好的hela细胞(培养方法同上)以每只小鼠一百万个细胞的数量接种于balb/c裸鼠的皮下,当裸鼠的肿瘤长至30mm3左右时,将裸鼠分为3组:每隔2d给第1组裸鼠通过尾静脉注射100μl生理盐水,每隔2d给第2组裸鼠通过尾静脉注射100μl(640μg)阳离子脂质体,每隔2d给第3组裸鼠通过尾静脉注射100μl编码靶向抑制plk1蛋白的融合蛋白的mrna和阳离子脂质体(即注射了plk1蛋白抑制剂,包括20μg mrna和640μg阳离子脂质体);2周后,观察裸鼠的肿瘤生长情况并拍照,结果如图4所述。
124.图4显示,
“‑”
代表没有加入,“ ”代表加入,虚线圈起来的部分为肿瘤;第1组(注射生理盐水)和第2组(注射阳离子脂质体)裸鼠的肿瘤大小分别为232mm3和249mm3,而第3组(注射plk1蛋白抑制剂)裸鼠的肿瘤大小为67mm3,显著小于第一组和第二组的肿瘤,表明plk1蛋白抑制剂中的编码融合蛋白的mrna能有效抑制肿瘤的生长,因此以plk1蛋白抑制剂为主要成分的药物或药物组合物在治疗肿瘤方面是有效的。
125.上面对本发明实施例作了详细说明,但是本发明不限于上述实施例,在所属技术
领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下作出各种变化。此外,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。