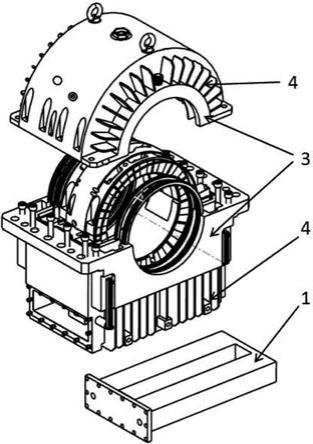
1.本发明属于生物医学技术领域,具体涉及飞龙掌血素和/或甘草香豆素在制备提高对疼痛抵抗力的药物中的应用。
背景技术:
2.飞龙掌血素(toddaculin)是一种香豆素类化合物,该化合物来源于芸香科、飞龙掌血属植物(toddalia asiatica)。目前,飞龙掌血素可通过提取和人工合成方法获得。甘草香豆素(glycycoumarin)是一种甘草中主要的生物活性香豆素,属于飞龙掌血素的类似物。
3.现有技术已知,飞龙掌血素可诱导白血病细胞分化和凋亡。同时,飞龙掌血素抑制过多的破骨细胞活性,增强成骨细胞分化和矿化。甘草香豆素通过激活自噬,抑制内质网应激介导的jnk和gsk-3介导的线粒体途径,来抑制肝细胞脂性凋亡。甘草香豆素能直接靶向t-lak细胞源蛋白激酶发挥抗肝癌活性。然而,飞龙掌血素和甘草香豆素在离子通道抑制以及对疼痛感知方面尚未有相关报道。
技术实现要素:
4.有鉴于此,本发明的目的在于提供飞龙掌血素和/或甘草香豆素在制备提高对疼痛抵抗力的药物中的应用。
5.本发明提供了一种影响人和动物对疼痛感知的化合物,包括飞龙掌血素和甘草香豆素。
6.优选的,所述飞龙掌血素和甘草香豆素的质量比为1~10:1~10。
7.本发明提供了飞龙掌血素、甘草香豆素或所述化合物在制备提高人和/ 或动物对疼痛抵抗力的药物中的应用。
8.本发明提供了一种镇痛剂,活性成分包括飞龙掌血素、甘草香豆素或所述化合物。
9.本发明提供了一种离子通道抑制剂,活性成分包括飞龙掌血素、甘草香豆素或所述化合物。
10.本发明提供了飞龙掌血素、甘草香豆素或所述化合物在制备预防和/或治疗cav3.2离子通道相关疾病的药物中的应用。
11.优选的,所述cav3.22离子通道相关疾病包括以下一种或几种:慢性疼痛、家族性醛固酮增多症、早发型高血压和瘙痒。
12.本发明提供了一种抑制cav3.2离子通道激活的试剂在制备提高人和/或动物对疼痛抵抗力的药物中的应用。
13.优选的,所述抑制cav3.2离子通道激活的试剂包括飞龙掌血素和/或甘草香豆素。
14.本发明提供了飞龙掌血素、甘草香豆素或所述化合物在制备提高人和/或动物对疼痛抵抗力的药物中的应用。飞龙掌血素和/或甘草香豆素能够显著抑制不同物种中
cav3.2电压门控型离子通道的激活。电生理实验表明, toddaculin和glycycoumarin作用于cav3.2受体。cav3.2作为人或动物外周疼痛感知密切相关的感受器,而toddaculin和glycycoumarin能有效抑制 cav3.2,在一定时间内会钝化人或动物对疼痛的感应。通过在模式动物小鼠的实验表明,toddaculin和glycycoumarin处理可以增强小鼠对福尔马林、醋酸、热、硫化氢和紫杉醇诱导的急性疼痛的耐受能力,小鼠疼痛行为数量显著降低。综上所述,toddaculin和glycycoumarin增强了小鼠等物种对疼痛的抵抗力,可以作为资源开发成一种潜在的镇痛剂,应用于人类和其他动物缓解疼痛。同时,toddaculin和glycycoumarin靶向作用于受体cav3.2,可以应用于相关离子通道病的研究及其作为潜在治疗药物。
附图说明
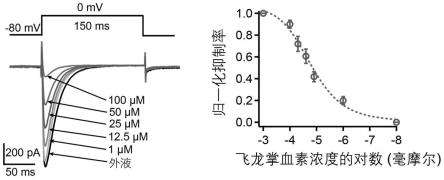
15.图1为toddaculin对cav3.2离子通道抑制作用结果;
16.图2为toddaculin和cav3.2相互作用的位点筛选和基于双突变循环的 toddaculin和cav3.2之间结合性结果;
17.图3为toddaculin和glycycoumarin抑制cav3.2的电流和浓度效应曲线;
18.图4为toddaculin对小鼠缓解疼痛的效果;其中a和b是硫化氢钠诱导模型结果;c是紫杉醇诱导的异常疼痛模型;d是福尔马林诱导疼痛模型; e是醋酸诱导的疼痛模型;
19.图5为toddaculin和glycycoumarin对小鼠缓解疼痛的效果比较。
具体实施方式
20.本发明提供了一种影响人和动物对疼痛感知的化合物,包括飞龙掌血素和甘草香豆素。
21.在本发明中,所述飞龙掌血素的结构式如式i所示;获得途径为购自昆明路非生物科技有限公司。
[0022][0023]
在本发明中,所述甘草香豆素的结构式如式ii所示;获得途径为购自云南西力生物技术股份有限公司。
[0024][0025]
在本发明中,所述飞龙掌血素和甘草香豆素的质量比优选为1~10:1~10,更优选为1~5:1~5,最优选为1:1。
[0026]
本发明提供了飞龙掌血素、甘草香豆素或所述化合物在制备提高人和/ 或动物对疼痛抵抗力的药物中的应用。
[0027]
在本发明中,飞龙掌血素或甘草香豆素均能靶向作用于受体cav3.2,且能够显著抑制cav3.2的激活,所述cav3.2是一类疼痛相关的电压门控钙离子通道,在外周神经细胞中大量表达,特别是在背根神经节,正是由于cav3.2 的特殊分布,cav3.2被发现与疼痛的多种生理和病理功能密切相关从而使得人和动物在疼痛情况下,通过所述化合物辅助进行镇痛。在本发明实施例中,在电生理实验结果表明,飞龙掌血素或甘草香豆素是缓解cav3.2诱导疼痛的关键化学物质,同时通过小鼠疼痛模型实验验证toddaculin对小鼠的缓解疼痛效果。合成小鼠和人等物种cav3.2质粒,利用膜片钳技术验证toddaculin 抑制哺乳动物cav3.2的激活,证实toddaculin在不同物种上应用的普适性。因此飞龙掌血素能够影响人和动物对疼痛的感知,并可用于提高动物对疼痛的抵抗力。甘草香豆素在提高人和/或动物对疼痛抵抗力方面优于飞龙掌血素。在小鼠疼痛模型中,飞龙掌血素的有效剂量优选不低于10mg/kg体重小鼠。甘草香豆素的有效剂量优选不低于1mg/kg体重小鼠。
[0028]
本发明提供了一种镇痛剂,活性成分包括飞龙掌血素、甘草香豆素或所述化合物。
[0029]
在本发明中,所述镇痛剂优选还包括药学上可接受的辅料。本发明对所述辅料的种类没有特殊限制,采用本领域所熟知的辅料即可,例如葡萄糖、蔗糖、淀粉等。本发明对所述镇痛剂的剂型没有特殊限定,利用本领域的常规剂型既可。本发明优选将所述镇痛剂通过口服或者注射等方式应用于人类和动物缓解疼痛、短期内克服急性和慢性疼痛等。本发明对所述镇痛剂的制备方法没有特殊限制,采用本领域所熟知的镇痛剂即可。所述镇痛剂的用法用量优选为1~10mg/kg体重小鼠。
[0030]
本发明提供了一种离子通道抑制剂,活性成分包括飞龙掌血素、甘草香豆素或所述化合物。
[0031]
在本发明中,飞龙掌血素或甘草香豆素均能靶向作用于受体cav3.2,显著抑制cav3.2的激活,因此飞龙掌血素和/或甘草香豆素可作为活性成分发挥抑制离子通道激活的作用。在本发明实施例中,在hek293t细胞系上过表达小鼠cav3.2受体(mcav3.2),通过膜片钳技术实验结果表明,飞龙掌血素的作用靶点是cav3.2受体,能够抑制cav3.2受体的激活。利用rosetta 分子建模软件对mcav3.2(小鼠cav3.2通道)的分子结构进行模拟。通过对 mcav3.2序列进行嵌合体和点突变,发现突变位点l1508a能够影响飞龙掌血素结合,因此所述飞龙掌血素可抑制cav3.2通道的激活,从而影响cav3.2 通道发挥相应生物学功能。
[0032]
在本发明中,所述离子通道抑制剂优选还包括药学上可接受的辅料,例如葡萄糖、蔗糖、淀粉等。本发明对所述离子通道抑制剂的制备方法没有特殊限制,采用本领域所熟知的离子通道抑制剂即可。
[0033]
本发明提供了飞龙掌血素、甘草香豆素或所述化合物在制备预防和/或治疗cav3.2离子通道相关疾病的药物中的应用。
[0034]
在本发明中,所述cav3.2离子通道的激活可导致多种疾病,例如慢性疼痛、家族性醛固酮增多症、早发型高血压或者瘙痒等。鉴于飞龙掌血素和 /或甘草香豆素可有效抑制cav3.2离子通道的激活,从而为防治cav3.2离子通道相关疾病提供了新的技术手段。
[0035]
本发明提供了一种抑制cav3.2离子通道激活的试剂在制备提高人和/或动物对疼痛抵抗力的药物中的应用。
mg-atp,用csoh调至ph为7.3。
[0045]
结果如图1所示,toddaculin抑制cav3.2通道的激活,且呈现浓度依赖关系。
[0046]
实施例2
[0047]
m cav3.2的结构模拟及点突变实验
[0048]
i.m cav3.2结构模拟
[0049]
m cav3.2的建模使用rosetta分子建模软件版本2020.37构建。采用人 cav3.1(pdb:6kzo)的低温冷冻电镜结构作为同源模建的起始结构。使用rosetta将其结构舒展,选择了toddaculin对接的最低能量分数。对于每个对接试验,共生成10000个模型,并使用toddaculin与小鼠cav3.2的通道之间的结合能进一步评分。选取出其中结合能量最低的复合物结构模型作为最终 toddaculin与cav3.2相互作用的结构模型。
[0050]
ii.mcav3.2点突变
[0051]
利用点突变实验探究mcav3.2影响toddaculin的靶向结合位点。本发明中使用的所有突变mcav3.2通道全部使用同源重组方法构建,使用赛百盛公司fasta快速定点突变试剂盒获得。具体实验操作步骤如下:
[0052]
1、向质粒引入单碱基定点突变,只需设计一对引物(示例:194q/k-f1: gcgggtaccaagggcaacatcttcgccacgtccgcg,seq id no:1); 194q/k-f2:gatgttgcccttggtacccgcggcgatgacggccac,seqid no:2)将质粒进行反向pcr扩增,引物设计原则为:正反向扩增引物 5
′
端包含20bp反向互补区域(gc含量40%-60%为佳),各引物非互补区域长度至少为15bp(待突变位点至引物3
′
端区域tm值高于60℃为佳)。将1μl 模板dna序列、8.5μl去离子水、2μl 2
×
max缓冲液、0.5μl dntp混合物、 1μl 5’pcr引物、1μl 3’pcr引物以及0.5μl dna聚合酶离心管进行反应。在pcr仪中按以下程序扩增:95℃预变性30s;95℃变性15s,60℃退火15s, 72℃延伸9min,30个循环;72℃延伸5min。
[0053]
2、重组反应:将上一步骤pcr产物40-50μl添加dpni 2μl,37℃孵育 2h。然后取2μldpni消化产物,2μl ceⅱ缓冲液,1μlexnaseⅱ和5μl去离子水,共计10μl重组体系37℃恒温反应30min后,冰水浴冷却5min。将连接产物转化至100μldh5α感受态细胞中,涂板过夜培养后挑单克隆菌落,摇菌扩增培养后测序验证。
[0054]
利用电生理单细胞膜片钳系统检测toddaculin处理对所有点突变 mcav3.2通道的电流改变,即toddaculin在野生型和各点突变通道上的抑制速率。
[0055]
利用电生理单细胞膜片钳系统检测toddaculin处理对所有点突变 mcav3.2通道的电流改变,即toddaculin在野生型和各点突变通道上的抑制速率。
[0056]
图2结果表明,l1508位置的氨基酸突变显著减弱toddaculin对mcav3.2 通道的抑制。
[0057]
实施例3
[0058]
toddaculin类似物glycycoumarin的cav3.2通道抑制活性
[0059]
基于cav3.2和toddaculin的直接相互作用,针对cav3.2的l1508位点进行计算机对接分析。
[0060]
结果表明,toddaculin的类似物glycycoumarin和cav3.2通道对接能量较低,提示glycycoumarin对cav3.2通道有较好的亲和力(见图3左上图)。
[0061]
为了验证对接结果,进行了全细胞电生理记录,具体参见实施例1方法,区别仅在
a.genetic deletion of cav3.2 t-type calcium channels abolishesh2s-dependent somatic and visceral pain signaling in c57bl/6mice.jpharmacol sci.2019jul;140(3):310-312.doi:10.1016/j.jphs.2019.07.010.epub 2019jul 30.)。
[0068]
4.紫杉醇诱导的神经病理性疼痛:将紫杉醇溶于17%cremophor el、 17%乙醇和66%生理盐水的混合液中。在第一次给药之前和第2、4、6和8 天使用vonfrey试验评估机械性异常性疼痛。在给药前及第2、4和6天将每只小鼠置于具有金属丝网地板的透明塑料盒(20
×
17
×
13cm)中进行实验,并通过改良的上下法确定缩爪阈值(参考文献:son db,choi w,kim m,goej,jeong d,park ck,kimyh,lee h,suh jw.decursinalleviates mechanicalallodynia in a paclitaxel-induced neuropathic pain mouse model.cells.2021 mar 4;10(3):547.)。给药方法为分别给予小鼠腹腔注射100μl生理盐水、 1mg/kg、10mg/kg、20mg/kg toddaculin,或者5mg/kg吗啡。
[0069]
5.热诱导的鼠尾疼痛:小鼠的尾浸入试验是在将鼠尾浸入温度为53
±ꢀ
0.5℃的水浴中后进行的。预实验中热反应(甩尾)时间少于15秒的个体舍弃,30秒无反应的个体舍弃。将各分组动物腹腔分别注射100μl生理盐水(阴性对照组)、溶于100μl生理盐水的toddaculin(试验组)、溶于100μl生理盐水的glycycoumarin(20mg/kg,实验组)和5mg/kg吗啡(阳性对照组)。甩尾实验在给药后30分钟进行(参考文献:yang s,xiao y,kang d,liu j,li y, undheim ea,klint jk,rong m,lai r,king gf.discovery of a selectivenav1.7 inhibitor from centipede venom with analgesic efficacy exceedingmorphine in rodent pain models.proc natl acad sci u s a.2013oct22;110(43):17534-9.doi:10.1073/pnas.1306285110.)。小鼠鼠尾从浸入水中到鼠尾摆动脱离水浴的时间记为疼痛潜伏期。
[0070]
图4为各疼痛模型给药后缓解疼痛结果。在给药toddaculin后,能有效缓解疼痛,并且缓解程度呈剂量依赖性。
[0071]
图5中上方两图分别为福尔马林诱导的疼痛实验中20mg/kg toddaculin 或glycycoumarin给药组阶段i和阶段ii的添足时间统计结果。图5中下方两图分别为热诱导的鼠尾疼痛模型中20mg/kg toddaculin或glycycoumarin 给药组疼痛潜伏期和醋酸诱导的疼痛模型中醋酸扭体统计结果。由图5结果可知,与生理盐水相比,toddaculin或glycycoumarin给药处理均能极显著缓解各种因素诱导的疼痛,并且glycycoumarin缓解疼痛的药效优于toddaculin。
[0072]
上述小鼠相关行为学实验表明,通过给小鼠腹腔注射toddaculin和 glycycoumarin可以帮助小鼠缓解疼痛。toddaculin和glycycoumarin增强了小鼠对疼痛的抵抗力,可以作为资源开发成一种潜在的镇痛剂,应用于人类和其它动物缓解疼痛。其次,toddaculin和glycycoumarin靶向作用于受体 cav3.2,可以应用于相关离子通道病的研究及其作为潜在治疗药物。
[0073]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。