1.本发明属于生物医药技术领域,具体涉及含共轭羧酸的神经酰胺类化合物及其制备方法和应用。
背景技术:
2.神经酰胺是构成皮肤角质层的细胞间脂质的主要成分之一,用来防止因蒸发而引起的水分过多流失并维持角质层的结构。角质层可作为屏障以保护底层组织免于受到来自外在环境的有害物质或微生物的侵害。当已分化的角质细胞从角质层脱落时,角质的细胞间脂质会形成薄片状结构,从而有助于维持皮肤的基本功能。细胞间脂质是由神经酰胺、胆固醇、游离脂肪酸等成分组成,且这些成分之中,已知神经酰胺在角质层的水分保留与屏障功能上扮演着重要角色。已知角质层中的神经酰胺含量的减少会提高水分蒸发并使各种皮肤疾病恶化。此外,已知藉由外部补充神经酰胺可使由皮肤老化或外在刺激造成角质层中的神经酰胺含量减少的皮肤恢复至正常状态。因此,已针对含有神经酰胺的各种天然动物和植物产品进行了研究。这些存在于动植物和微生物中的神经酰胺数量极少,因此存在提取困难和生产成本高的问题。此外,源自天然的神经酰胺对于化妆品中常用的溶剂等物质具有非常低的溶解度,故而要使产品含有能充分发挥效能的量具有一定难度。
3.由于市场上对于功能性神经酰胺的广泛需求,必须研究并开发出能仿效天然神经酰胺且具有增强功效的神经酰胺衍生物,该类神经酰胺能解决天然神经酰胺的缺点并能商业化生产。
技术实现要素:
4.本发明的目的是提供一类结构新颖的神经酰胺类化合物,其含有共轭羧酸,共轭羧酸是指羧基与碳碳双键共轭的羧酸,碳碳双键指直链的-ch=ch-,不包括成环的情况如环己烯,也不包括芳环和杂环的碳碳键。
5.本发明的另一目的是提供神经酰胺类化合物的合成方法。
6.本发明的另一目的是提供神经酰胺类化合物的用途。
7.为达到上述目的之一,本发明采用以下技术方案;
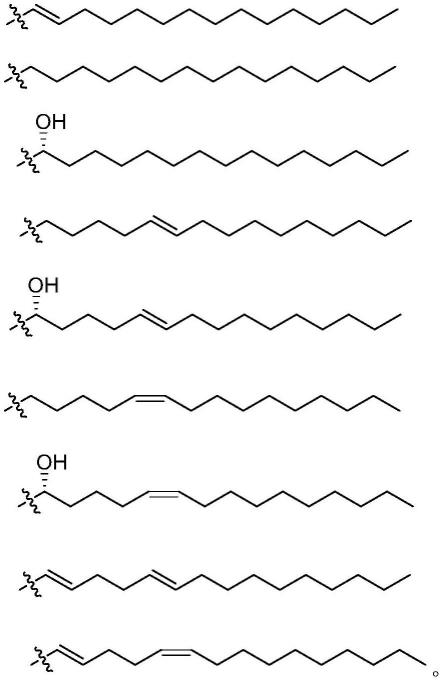
8.本发明的第一方面,一种神经酰胺类化合物,其具有通式i的结构或通式i的对映异构体、非对映异构体:
[0009][0010]
其中,r1选自阿魏酸、芥子酸、脱落酸、异维a酸、维a酸、夫西地酸、王浆酸、山梨酸、咖啡酸或反式肉桂酸缩合后的残基,
[0011]
r2选自以下结构之一:
[0012]-c
15h29
、-c
15h31
、-c
15h27
、-chohc
14h27
、-chohc
14h29
。
[0013]
缩合后的残基是指相应的羧酸rcooh的羧基与鞘氨醇碱的氨基缩合形成肽键之后,残余的羧酸片段r,如王浆酸缩合后的残基为阿魏酸缩合后的残基为
[0014]
其中,阿魏酸作为一种酚类植物成分具有强大的抗氧化活性,对人体健康有着极大的促进作用;阿魏酸可以显著升高辐射细胞中谷胱甘肽和烟酰胺腺嘌呤二核苷酸磷酸含量,对受辐射内皮细胞产生保护作用。
[0015]
异维a酸适用于重度痤疮,尤其适用于结节囊肿型痤疮,亦可用于毛发红糠疹等疾病。
[0016]
维a酸主要影响骨的生长和促进上皮细胞增生、分化、角质溶解等代谢作用;用于治疗寻常痤疮、银屑病、鱼鳞病、扁平苔癣、毛发红糠疹、毛囊角化病、鳞状细胞癌及黑色素瘤等疾病。
[0017]
山梨酸是一种食品添加剂,是国际上应用最广的防腐剂,具有较高的抗菌性能,可以抑制霉菌的生长繁殖。
[0018]
王浆酸,即10羟基﹣2﹣癸烯酸,是蜂王浆中的一种成分,属于一种不饱和脂肪酸,王浆酸具有增强机体抵抗力、抗菌消炎和强烈抑制淋巴癌、乳腺癌等多种细胞的功能,还具有强壮机体、防止脱发、治疗急性幅射损伤和化学物质损伤的作用。
[0019]
进一步地,所述r2选自以下结构之一:
[0020][0021]
进一步地,所述r2选自以下结构之一:
[0022][0023]
分别对应鞘氨醇、二氢鞘氨醇、植物鞘氨醇。
[0024]
进一步地,所述r1选自阿魏酸、反式肉桂酸、王浆酸、维a酸、山梨酸、咖啡酸或芥子酸缩合后的残基。
[0025]
进一步地,所述r1选自阿魏酸、王浆酸、维a酸、山梨酸、咖啡酸或芥子酸缩合后的残基。
[0026]
进一步地,所述r1选自阿魏酸缩合后的残基。
[0027]
进一步地,所述r1选自反式肉桂酸缩合后的残基。
[0028]
进一步地,所述r1选自王浆酸缩合后的残基。
[0029]
进一步地,所述r1选自维a酸缩合后的残基。
[0030]
进一步地,所述r1选自山梨酸缩合后的残基。
[0031]
进一步地,所述r1选自咖啡酸缩合后的残基。
[0032]
进一步地,所述r1选自芥子酸缩合后的残基。
[0033]
神经酰胺类化合物选自以下化合物之一:
[0034][0035][0036]
本发明的第二方面,一种制备神经酰胺类化合物的方法,包括以下步骤:
[0037][0038]
化合物s1和n-羟基琥珀酰亚胺、缩合剂反应得到化合物s2;
[0039]
化合物s2和鞘氨醇碱反应得到化合物i。
[0040]
进一步地,所述化合物s1、n-羟基琥珀酰亚胺、缩合剂、鞘氨醇碱的摩尔比为1:(1~2):(1~2):(0.8~1)。
[0041]
进一步地,所述缩合剂为dcc。
[0042]
进一步地,所述反应的溶剂为thf。
[0043]
一种制备神经酰胺类化合物的方法,包括以下步骤:
[0044][0045]
化合物s1和鞘氨醇碱、缩合剂反应得到化合物i。
[0046]
进一步地,所述缩合剂包括edci和hobt。
[0047]
进一步地,所述化合物s1、edci、hobt、鞘氨醇碱的摩尔比为1:(1~2):(1~2):(0.8~1)。
[0048]
进一步地,所述反应的溶剂为dcm。
[0049]
本发明的第三方面,神经酰胺类化合物作为抗氧化剂的应用,尤其是在化妆品、保健品、药品中的应用。
[0050]
本发明具有以下有益效果:
[0051]
本发明将功效性羧酸与鞘氨醇碱反应,得到一类结构新颖的神经酰胺类化合物,功效性羧酸具有生理活性的分子片段引入到神经酰胺中,将会提升该类分子的原有功效,也会改善神经酰胺化合物理化性质,比如,提升神经酰胺化合物的抗氧化性。
[0052]
说明书附图
[0053]
图1为实施例10神经酰胺化合物的抗氧化性的测试结果。
具体实施方式
[0054]
下面结合具体实施例对本发明做进一步的说明。
[0055]
所有反应在氮气气氛下进行。除非另有说明,化学品均购自商业化产品并且不经进一步纯化。实验中使用的二氯甲烷、四氢呋喃均为无水溶剂。薄层色谱分析(tlc)使用60f254硅胶板。硅胶柱层析使用青岛海洋硅胶(粒径0.040-0.063mm)。tlc显色采用uv光(254nm)或碘。nmr图谱使用bruker dpx 400核磁共振仪表征,1h nmr为400mhz,溶剂为氘代甲醇,氘代dmso或氘代四氢呋喃,以四甲基硅烷(tms)为内标。化学位移的单位是ppm,耦合
常数的单位是hz。在1h nmr中,δ表示化学位移,s表示单峰,d表示双峰,t表示三重峰,q表示四重峰,m表示多重峰。
[0056]
dcc指n,n'-二环己基碳二亚胺,thf指四氢呋喃,dcm指二氯甲烷,edci指1-(3-二甲胺基丙基)-3-乙基碳二亚胺,hobt指1-羟基苯并三唑。
[0057]
神经酰胺类化合物的通用合成方法
[0058]
方法a
[0059][0060]
步骤1:将化合物s1(50mmol),n-羟基琥珀酰亚胺(60~75mmol,优选60mmol),dcc(60~75mmol,优选60mmol)置于250ml加入圆底烧瓶中,加入100ml四氢呋喃,随后在室温条件下搅拌4~24小时,通过tlc检测,直至化合物s1完全消失。后处理:过滤反应体系,收集滤液直接用于下一步反应。
[0061]
步骤2:将鞘氨醇碱(40~50mmol,优选45mmol)加入到上一步的滤液中,随后在室温条件下搅拌24~72小时,通过tlc检测,直至鞘氨醇碱完全消失。后处理:加入饱和碳酸氢钠水溶液淬灭。分离有机层,干燥,过滤并真空浓缩。由此获得的残余物通过硅胶柱纯化,得到产物(50~70%收率)。
[0062]
方法b
[0063][0064]
将化合物s1(50mmol),edci(60~75mmol,优选60mmol),hobt(60~75mmol,优选60mmol)置于250ml加入圆底烧瓶中,加入100ml二氯甲烷,随后在室温条件下搅拌1小时,随后将鞘氨醇碱(40~50mmol,优选45mmol)加入到反应体系中,在室温条件下搅拌24~72小时,直至鞘氨醇碱完全消失。后处理:加入水淬灭。分离有机层,干燥,过滤并真空浓缩。由此获得的残余物通过硅胶柱纯化,得到产物(50~65%收率)。
[0065]
实施例1
[0066]
阿魏酸与植物鞘氨醇通过方法a缩合的产物。
[0067][0068]1h nmr(400mhz,methanol-d4)δ7.45(d,j=15.6hz,1h),7.12(d,j=2.0hz,1h),7.03(dd,j=8.3,1.9hz,1h),6.79(d,j=8.1hz,1h),6.53(d,j=15.7hz,1h),4.23(q,j=
5.3hz,1h),3.88(s,3h),3.80(qd,j=11.2,5.0hz,2h),3.64(t,j=5.8hz,1h),3.56(ddd,j=8.9,5.9,2.5hz,1h),1.68(dtd,j=12.9,7.2,6.2,3.5hz,1h),1.53(d,j=8.4hz,1h),1.43(ddd,j=12.4,8.1,3.7hz,1h),1.36
–
1.16(m,23h),0.89(t,j=6.7hz,3h)。
[0069]
实施例2
[0070]
阿魏酸与鞘氨醇通过方法a缩合的产物。
[0071][0072]1h nmr(400mhz,methanol-d4)δ7.43(d,j=15.7hz,1h),7.12(d,j=2.0hz,1h),7.03(dd,j=8.2,2.0hz,1h),6.79(d,j=8.1hz,1h),6.50(d,j=15.7hz,1h),5.75
–
5.62(m,1h),5.55
–
5.44(m,1h),4.35(t,j=7.0hz,1h),4.12(t,j=7.4hz,1h),4.01
–
3.94(m,1h),3.88(s,3h),3.78
–
3.68(m,1h),2.54
–
2.45(m,1h),2.30
–
2.16(m,1h),2.02(p,j=7.2hz,2h),1.37
–
1.10(m,20h),0.89(t,j=6.9hz,3h)。
[0073]
实施例3
[0074]
阿魏酸与二氢鞘氨醇通过方法a缩合的产物。
[0075][0076]1h nmr(400mhz,methanol-d4)δ7.48(d,j=15.7hz,1h),7.16(d,j=2.0hz,1h),7.06(dd,j=8.2,1.9hz,1h),6.82(d,j=8.2hz,1h),6.55(d,j=15.7hz,1h),4.01
–
3.93(m,1h),3.91(s,3h),3.79(d,j=5.0hz,2h),3.77
–
3.71(m,1h),1.92
–
1.85(m,2h),1.38
–
1.23(m,26h),0.96
–
0.87(m,3h)。
[0077]
实施例4
[0078]
反式肉桂酸与植物鞘氨醇通过方法a缩合的产物。
[0079][0080]1h nmr(400mhz,methanol-d4)δ7.60
–
7.50(m,3h),7.42
–
7.31(m,3h),6.71(d,j=15.8hz,1h),4.25(td,j=5.7,4.2hz,1h),3.83(dd,j=11.3,4.3hz,1h),3.77(dd,j=11.3,5.8hz,1h),3.64(t,j=5.8hz,1h),3.56(ddd,j=9.1,5.9,2.5hz,1h),1.75
–
1.61(m,1h),1.53(d,j=9.1hz,1h),1.48
–
1.16(m,24h),0.90(t,j=6.8hz,3h)。
[0081]
实施例5
[0082]
王浆酸与植物鞘氨醇通过方法a缩合的产物。
[0083][0084]1h nmr(600mhz,methanol-d4)δ6.81(dt,j=15.3,7.0hz,1h),6.02(dt,j=15.3,1.5hz,1h),4.19(td,j=5.8,4.3hz,1h),3.81(dd,j=11.3,4.4hz,1h),3.76(dd,j=11.2,5.8hz,1h),3.62(t,j=5.8hz,1h),3.58
–
3.53(m,3h),2.23(qd,j=7.2,1.6hz,2h),1.57
–
1.49(m,5h),1.39
–
1.29(m,32h),0.92(t,j=7.0hz,3h)。
[0085]
实施例6
[0086]
维a酸与植物鞘氨醇通过方法b缩合的产物
[0087][0088]1h nmr(400mhz,methanol-d4)δ7.01(dd,j=15.0,11.4hz,1h),6.32(dd,j=23.7,15.6hz,2h),6.21
–
6.09(m,2h),5.93(s,1h),4.17(td,j=5.7,4.4hz,1h),3.86
–
3.72(m,2h),3.64(t,j=5.8hz,1h),3.61
–
3.53(m,1h),2.33(d,j=1.1hz,3h),2.06(t,j=6.5hz,2h),2.01(d,j=1.1hz,3h),1.73(d,j=1.0hz,3h),1.66(ddp,j=8.8,5.6,2.9hz,3h),1.54
–
1.47(m,3h),1.30(d,j=4.9hz,25h),1.05(s,6h),0.92(t,j=6.8hz,3h)。
[0089]
实施例7
[0090]
芥子酸与植物鞘氨醇通过方法b缩合的产物
[0091][0092]1h nmr(400mhz,methanol-d4)δ7.47(d,j=15.6hz,1h),6.88(s,2h),6.58(d,j=15.6hz,1h),4.26(td,j=5.6,4.3hz,1h),3.89(s,6h),3.85
–
3.78(m,2h),3.67(t,j=5.8hz,1h),3.59(ddd,j=9.0,5.9,2.6hz,1h),1.77
–
1.61(m,2h),1.61
–
1.43(m,2h),1.29(dd,j=11.8,5.4hz,22h),0.92(t,j=6.8hz,3h)。
[0093]
实施例8
[0094]
咖啡酸与植物鞘氨醇通过方法b缩合的产物。
[0095][0096]1h nmr(400mhz,methanol-d4)δ7.53(d,j=15.9hz,1h),7.02(d,j=2.1hz,1h),6.92(dd,j=8.2,2.1hz,1h),6.76(d,j=8.2hz,1h),6.24(d,j=15.9hz,1h),4.20(q,j=
5.3hz,1h),3.78(qd,j=11.2,5.0hz,2h),3.62(t,j=6.0hz,1h),3.50(ddd,j=8.9,6.0,2.4hz,1h),1.64(dtd,j=12.9,7.2,6.2,3.5hz,1h),1.51(d,j=8.4hz,1h),1.43(ddd,j=12.4,8.1,3.7hz,1h),1.36
–
1.16(m,23h),0.89(t,j=6.7hz,3h)。
[0097]
实施例9
[0098]
山梨酸与植物鞘氨醇通过方法b缩合的产物。
[0099][0100]1h nmr(400mhz,methanol-d4)δ7.70(td,j=6.8,3.8hz,1h),7.32
–
7.23(m,1h),7.14(dd,j=15.1,10.6hz,1h),6.25(ddd,j=15.1,10.6,1.7hz,1h),6.13(dq,j=15.2,6.5hz,1h),6.00(d,j=15.1hz,1h),4.20(td,j=5.7,4.3hz,1h),3.79(qd,j=11.2,5.1hz,2h),3.62(t,j=5.8hz,1h),3.55(ddd,j=8.9,5.9,2.5hz,1h),1.86(dd,j=6.6,1.4hz,3h),1.74
–
1.61(m,1h),1.54(d,j=9.0hz,1h),1.39
–
1.30(m,24h),0.95
–
0.86(m,3h)。
[0101]
实施例10
[0102]
用抗氧化-abts法测试实施例1、2、3、5制备的神经酰胺化合物的抗氧化性
[0103]
实验原理:采用abts(2,2
′‑
azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)diammonium salt)评价样品抗氧化能力最初由miller等(1993)提出,现采用的一般是后来re等(1999)改进后的方法。该方法利用abts可被过硫酸钾、过氧化氢、二氧化锰等一系列化合物氧化,生成蓝绿色的abts 阳离子自由基,在734nm处有最大吸收峰。在抗氧化剂的作用下,abts 还原成无色的abts。通过测定734nm处的吸光值,即可判定反应物的抗氧化能力。
[0104]
abts自由基清除检测抗氧化性能:3ml abts水溶液(12mmol/l)与3ml过硫酸钾溶液(2.45mmol/l),均匀混合,于室温下避光稳定12~16h。以dmso作为稀释介质,选取合适的稀释比例,调整过硫酸钾溶液于734nm波长处的吸光度为0.700
±
0.025。加入不同浓度样品摇匀,避光放置10min,于734nm处测吸光值。
[0105]
结果如图1所示,对照1为神经酰胺3b,对照2为神经酰胺3。
[0106]
可见,本发明的化合物相比现有的神经酰胺化合物具有更好的抗氧化效果,对自由基的清除率普遍高出15~75%。
[0107]
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何属于本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应该以权利要求的保护范围为准。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
