1.本发明属于生物技术领域,尤其涉及一种基于基因组学途径快速鉴定调控油菜含油量基因的方法及其应用。
背景技术:
2.油菜是我国重要的油料作物、主要的食用植物油来源。增加油菜含油量对提高菜籽油的产量十分重要。有研究表明含油量每提高1%相当于油菜产量提高2.3%
‑
2.5%,而高含油量的种质资源是培育新品种的关键所在。因此,加强油菜含油量代谢的遗传基础解析对于创造新的高含油量种质资源具有非常重要的意义。
3.但是,由于含油量受环境影响较大,遗传调控复杂,加之甘蓝型油菜的基因组比较复杂,因此发掘调控油菜含油量的基因难度很大。在油菜中,传统的qtl定位方法挖掘新基因主要包括qtl初定位、精细定位、候选基因挖掘和验证三个阶段。qtl初定位和精细定位两个阶段需构建不同群体,通过多年多点的种植来收集表型和分子标记数据,由于油菜的生长发育周期较长(6
‑
7个月),这两个阶段需耗时至少4
‑
5年或更久。当定位到一定区间后,需要对区间内的候选基因做转基因互补验证,而区间内的候选基因往往多达数十个或更多。加之,油菜至今没有全基因组的突变体库,只能利用拟南芥突变体和超量表达进行互补验证。因此,通过传统的qtl定位方法来挖掘调控油菜含油量基因耗时长、工作量大。
技术实现要素:
4.针对现有技术存在的问题,本发明提供了一种基于基因组学途径快速鉴定调控油菜含油量基因的方法及其应用,目的在于解决现有技术中的一部分问题或至少缓解现有技术中的一部分问题。
5.本发明是这样实现的,一种基于基因组学途径快速鉴定调控油菜含油量基因的方法,包括以下步骤:
6.s1:将高含油量油菜材料与低含油量油菜材料不同发育时期的角果进行转录组测序;
7.s2:对转录组测序结果进行分析,筛选表达差异基因;
8.s3:将差异基因在qoc
‑
a5 qtl位点进行扫描,鉴定出调控油菜种子含油量的基因;
9.s4:对鉴定出的基因的功能进行验证。
10.进一步地,所述高含油量油菜材料包括高含油量近交系1l99;所述低含油量油菜材料包括低含油量近交系1l363。
11.进一步地,步骤s4中利用crispr技术构建基因突变体,检测突变体材料含油量的变化。
12.进一步地,鉴定出的调控油菜种子含油量的基因包括bnech.a5。
13.本技术还提供了一种调控油菜种子含油量的方法,敲除或降低油菜材料中
bnech.a5基因的表达,提高油菜种子含油量。
14.进一步地,利用crispr/cas9介导的基因敲除技术敲除或降低油菜材料中bnech.a5基因的表达。
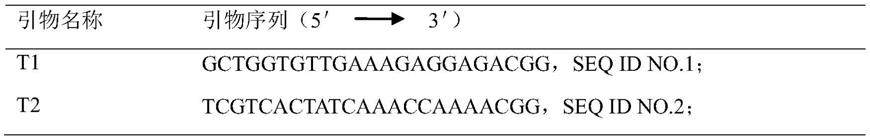
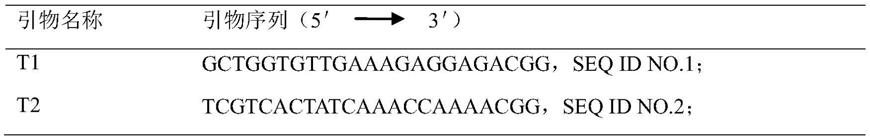
15.进一步地,crispr/cas9技术中涉及2个靶标序列,分别为:t1:gctggtgttgaaagaggagacgg;t2:tcgtcactatcaaaccaaaacgg。
16.进一步地,所述2个靶标序列的基因编辑引物分别为:t1
‑
f:gtcagctggtgttgaaagaggaga;t1
‑
r:aaactctcctctttcaacaccagc;t2
‑
f:gtcatcgtcactatcaaaccaaaa;t2
‑
r:aaacttttggtttgatagtgacga。
17.进一步地,构建靶标基因编辑载体,并转化至受体材料中,获得油菜种子含油量提高的突变体材料。
18.本技术还提供了bnech.a5基因在调控油菜种子含油量中的应用。
19.综上所述,本发明的优点及积极效果为:
20.本发明不需要花费多年的时间来构建群体,考查表型数据,直接通过对高低含油量近交系不同发育时期角果进行转录组测序,结合已知的qtl位点进行扫描,排除非目的基因,鉴定到参与调控油菜种子含油量的基因,降低了对候选基因验证的工作量,更具有针对性;提供了能提高油菜种子含油量的crispr/cas9系统的靶标序列t1、t2,这两个靶点可以精确地定点编辑bnech.a5基因的两个拷贝;通过crispr/cas9介导的基因敲除技术可以不同程度的提高油菜种子含油量;只需1.5
‑
2年即可确定新基因的功能并获得新的高含油量新材料,最终获得调控甘蓝型油菜种子含油量新基因,极大的缩短了获得新基因的时间,加快了新种质资源的培育。
21.且本技术中通过验证bnech.a5的基因功能发现,敲除甘蓝型油菜bnech.a5基因后,能显著提高甘蓝型油菜种子的含油量,增幅达到24.3%,达到极显著水平。
22.本发明为调控甘蓝型油菜种子含油量新基因的发掘与验证提供了新的途径,提供了新的种质资源,具有良好的应用前景。
附图说明
23.图1是不同材料中,bnech.a5基因在不同时期的表达量变化趋势;
24.图2是突变体材料的pcr电泳图;
25.图3是bnech.a5突变体含油量检测结果。
具体实施方式
26.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例对本发明进行进一步详细说明,各实施例及试验例中所用的设备和试剂如无特殊说明,均可从商业途径得到。此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
27.根据本技术包含的信息,对于本领域技术人员来说可以轻而易举地对本发明的精确描述进行各种改变,而不会偏离所附权利要求的精神和范围。应该理解,本发明的范围不局限于所限定的过程、性质或组分,因为这些实施方案以及其他的描述仅仅是为了示意性说明本发明的特定方面。实际上,本领域或相关领域的技术人员明显能够对本发明实施方式作出的各种改变都涵盖在所附权利要求的范围内。
28.为了更好地理解本发明而不是限制本发明的范围,在本技术中所用的表示用量、百分比的所有数字、以及其他数值,在所有情况下都应理解为以词语“大约”所修饰。因此,除非特别说明,否则在说明书和所附权利要求书中所列出的数字参数都是近似值,其可能会根据试图获得的理想性质的不同而加以改变。各个数字参数至少应被看作是根据所报告的有效数字和通过常规的四舍五入方法而获得的。本发明中,“约”指给定值或范围的10%以内,优选为5%以内。
29.本发明下述各实施例中未特别限定温度时,则均为常温条件。常温是指四季中自然室温条件,不进行额外的冷却或加热处理,一般常温控制在10~30℃,最好是15~25℃。
30.本发明披露了一种基于基因组学途径快速鉴定调控油菜含油量基因的方法及其应用。申请人通过田间多年多点试验筛选到高含油量近交系1l99(liu et al.,2016)和低含油量近交系1l363(liu s,fan c,li j,cai g,yang q,wu j,yi x,zhang c,zhou y.a genome
‑
wide association study reveals novel elite allelic variations in seed oil content of brassicanapus.theor appl genet,2016,129(6):1203
‑
1215),并基于这两个材料进行了本技术中的实验。下面将结合本发明实施例,对本发明的技术方案进行清楚、完整地描述。
31.实施例1基于基因组学途径快速鉴定调控油菜含油量基因
32.1、高含油量近交系1l99和低含油量近交系1l363的rna样品制备
33.将甘蓝型油菜高含油量近交系1l99和低含油量近交系1l363于播种季节种植于华中农业大学试验田。分别取开花后11天、16天、23天、30天、37天和44天的不同发育时期角果,每个时期的样品取3个生物学重复。根据rna提取试剂盒(transzol plant,bioteke,china)的说明书提取样品rna,rna经过rnase
‑
free dnase
‑
i(thermo scientific,usa)处理以去除gdna污染,并使用核酸/蛋白质分析仪730(beckman)进行定量。
34.2、建库、测序及分析
35.利用truseq nano dna ht sample preparation kit(illumina,美国)对样品进行文库的构建,具体流程见试剂盒说明书。随后采用illuminahiseq
tm
2500测序仪(作物遗传改良国家重点实验室,华中农业大学)对所有文库进行2
×
150bp的双末端测序。用ngs qc tool kit对raw reads进行质量控制,将上述质量控制后的clean reads用hisat2比对到甘蓝型油菜darmor
‑
bzh(http://www.genoscope.cns.fr/brassicanapus/data/)参考基因组上(brassica napus v4.1,chalhoub et al 2014),参数采用默认设置。使用bowtie2将clean reads比对到基因组序列上,然后使用rsem计算各个样品的基因表达水平。
36.3、鉴定参与调控甘蓝型油菜含油量基因
37.通过表达量的差异分析获得一系列差异基因,本技术中把这些差异基因在之前发现的qoc
‑
a5(liu s,fan c,li j,cai g,yang q,wu j,yi x,zhang c,zhou y.a genome
‑
wide association study reveals novel elite allelic variations in seed oil content of brassicanapus.theor appl genet,2016,129(6):1203
‑
1215)qtl位点进行扫描,共发现有14个差异基因在该qtl区间内。通过对14个基因在高含油量近交系1l99和低含油量近交系1l363的表达量分析,发现bnech.a5基因于不同油菜种子发育时期的表达量在高含油量近交系中表达量较低,而在低含油量近交系中表达量较高,且在开花后30天
‑
44天间的种子含油量积累的关键时期表达量呈现剧烈变化(图1)。因此,bnech.a5基因有可能参
与负调控油菜种子含油量代谢。
38.实施例2通过crispr/cas9介导的基因敲除技术验证bnech.a5的基因功能
39.1、筛选靶点序列并设计引物
40.从参考基因组darmor
‑
bzh中获得甘蓝型油菜bnech.a5基因的核苷酸序列(如seq id no.17)。设计、筛选出t1、t2共两个靶点(表1),并针对靶点序列设计引物(表2)。
41.表1靶点序列
[0042][0043]
表2靶点引物序列
[0044][0045][0046]
2、构建两靶点基因编辑载体pbnech载体
[0047]
(1)靶点接头制备:将表2接头引物用ddh2o溶解成10μm母液。将左右引物各取1μl加入到8μl ddh2o混合稀释到1μm,涡旋震动混匀。然后放入水浴锅90℃,处理30”,自然冷却至室温。
[0048]
(2)sgrna表达盒连接反应
[0049]
1)酶切atu3d、atu3b两个质粒,酶切体系见表3。
[0050]
表3质粒酶切体系
[0051][0052]
2)酶切过的atu3d、atu3b两个质粒质粒与各所对应接头连接反应,室温(20
‑
28℃)连接约10
‑
15min,质粒与各所对应接头见表4,连接反应体系见表5。
[0053]
表4质粒与各所对应接头
[0054]
接头bas1酶切质粒t1atu3dt2atu3b
[0055]
表5表达盒连接反应体系
[0056]
成分加入量终浓度(量)10
×
t4 dna ligase buffer1μl1
×
pylsgrna
‑
u#质粒(bas1)0.5μl10~20ng靶点接头0.5μl0.05μmt4 dna ligase(neb)(400u/ul)0.1μl~40uddh2o7.9μl total10μl [0057]
(3)扩增sgrna表达盒片段。做2轮巢式pcr,第一轮pcr做2个反应,分别用u
‑
f/接头反向引物,和用接头正向引物/gr
‑
r;第二轮为overlapping pcr,用位置特异引物扩增出表达盒产物。所用引物序列见表6,第一轮pcr反应体系见表7,反应程序见表8。第一轮反应结束后,将反应1和反应2的产物各取1μl加入到8μl ddh2o混合稀释,涡旋震动混匀。第二轮pcr,sgrna表达盒特定位置引物对的使用方法:pps
‑
ggl/pgs
‑
gg2(pt1),pps
‑
gg2/pgs
‑
ggr(pt2r),扩增相应的u#
‑
t1
‑
grna、u#
‑
t2
‑
grna。先将各引物用ddh2o溶解成10μm母液。将pps
‑
ggl和pgs
‑
gg2引物各取1.5μl加入到7μl ddh2o混合稀释到1.5μm,涡旋震动混匀,命名为pt1、pt2r依次配置;反应体系见表9,程序见表10。
[0058]
表6巢式pcr引物序列
[0059][0060]
表7第一轮pcr反应体系
[0061]
成分加入量sgrna连接产物0.5μl10um u
‑
f/gr
‑
r0.3μl10um t
‑
r/t
‑
f0.3μl2mm dntp1.5μl25mm mgso40.6μl10*buffer1.5μlkod plus0.3μlddh2o10μltotal15μl
[0062]
表8第一轮pcr反应程序
[0063][0064][0065]
表9第二轮反应体系
[0066]
成分加入量u#
‑
t
‑
grna2ul引物组合pt3ul2mm dntp2μl10*kod buffer15μlkod polymerase0.3μlddh2o7.7μltotal30μl
[0067]
表10第二轮反应程序
[0068][0069]
(4)巢式pcr产物纯化。将第二轮反应的五个产物混合,用北京全式金生物技术公司的easypure quick gel extraction kit对pcr产物进行纯化;用分光光度计测其浓度,为25ng/μl,试验需用75ng,相当于3μl。
[0070]
(5)双元载体与sgrna表达盒的酶切连接反应。
[0071]
反应体系见表11,反应程序见表12。
[0072]
表11双元载体与sgrna表达盒的酶切连接反应体系
[0073][0074][0075]
表12双元载体与sgrna表达盒的酶切连接反应程序
[0076][0077]
(6)连接产物转大肠杆菌测序确定。操作步骤如下:
[0078]
a.取50μl冰浴上融化的trans1
‑
t1 phage resistant chemically competent cell感受态细胞,加入10μl的连接产物,轻轻混匀,在冰浴中放置30分钟。
[0079]
b.42℃水浴热激30秒,然后快速将管转移到冰浴中2分钟,该过程不要摇动离心管。
[0080]
c.向每个离心管中加入500μl无菌液体lb培养基(不含抗生素),混匀后置于37℃摇床,200rpm培养1小时,使细菌复苏。
[0081]
d.吸取50μl已转化的感受态细胞加到含lb(25g/l)琼脂培养基上,将细胞均匀涂开。将平板置于37℃至液体被吸收,倒置平板,37℃过夜培养。
[0082]
e.挑取单克隆,pcr阳性鉴定,体系,程序及引物如下:
[0083]
pb
‑
l:gcgcgcggtctcgctcgactagtatgg,seq id no.13;
[0084]
pb
‑
r:gcgcgcggtctctaccgacgcgtatcc,seq id no.14;
[0085][0086]
f.选取阳性克隆测序,确定pbnech质粒无突变,可以用于后续试验。
[0087]
(8)将构建好的载体转入农杆菌gv3101电转感受态细胞。具体步骤如下:取一管50μlgv3101电转感受态细胞置于冰上,溶化后加入0.1μg构建好的载体质粒并用移液器轻轻吸打混匀;将含有载体质粒的感受态用移液器吸入冰上预冷的电转杯中,使用gene pulser电转仪(购自bio
‑
rad公司)在1800v电压下电击6ms;向电转杯中加入500μl液体lb混匀后将菌液转到2ml离心管中,28℃摇床中150rpm培养2hrs;取100μl菌液铺固体lb平皿(含庆大霉素25μg/ml和卡那霉素50μg/ml),吹干后28℃培养箱中培养2
‑
3天;挑取菌斑进行pcr检测,体系和反应程序同(7)
‑
e,阳性克隆进行摇菌分装于
‑
80℃保存或直接用于植物转化,得到pbnech载体农杆菌菌株。
[0088]
3、pbnech载体下胚轴遗传转化
[0089]
(1)灭菌
[0090]
a.用75%酒精浸泡甲9707成熟晒干种子1min。
[0091]
b.将洗好的种子转入无菌容器(培养盒)中,把酒精倒入废液缸,并加入适量的消毒液(84消毒液浓度无菌水:84液=1:1),灭菌时间为10
‑
15min。
[0092]
c.消毒后,将消毒液倒入废液缸,用无菌水(50ml左右)冲洗种子4
‑
5遍。
[0093]
(2)播种
[0094]
a.用无菌镊子将灭菌好的种子播到m0,每皿10
‑
12粒。
[0095]
b.将培养皿放到无菌培养盒中,置暗光24℃下培养6天。
[0096]
(3)摇菌
[0097]
播种4
‑
5天后用lb液体培养基(kanamycin 50mg/l gentamicin 25mg/l)培养pbnech载体农杆菌菌株。在28℃,180
‑
220rpm摇床中培养约15个小时左右。测培养后菌液的od值,一般为0.4左右较好(用无菌三角瓶或离心管,一般配两个浓度的菌液10/15μl菌液 4ml的lb)。
[0098]
(4)外植体的制备及侵染
[0099]
a.准备菌液,吸取2ml培养好的菌株于无菌的2ml的离心管中,在离心机以每分钟6000转离心3min,倒掉上清;用与菌液相同体积的dm(加as)重新悬浮一次,再在同样的条件下离心,弃上清后,再用相同体积dm(加as)悬浮。将悬浮后的菌液用18ml的dm稀释(在灭菌
培养皿中进行)。
[0100]
b.剪切外植体,用无菌镊子和解剖刀切取播种6天后幼苗下胚轴,每个长度为0.8
‑
1.0cm。在m1液体培养基中切取效果更佳,切取外植体时尽量一刀垂直切下。
[0101]
c.将切好的外植体放到已经配制好浓度菌液的培养皿中,浸染15min(时间不能过长,避免外植体失水严重死亡或后期农杆菌抑制不住),隔段时间摇晃一次,还差3min时吸去菌液。浸染时以每皿(20ml菌液)150
‑
200个外植体较合适。
[0102]
(5)将侵染后的外植体用灭菌后的滤纸吸干,再用镊子转到m1培养基中,每皿50
‑
60个外植体暗光下24℃培养2天后转入m2中,24℃白光16h/暗光8h培养。
[0103]
(6)20天后转到m3中,每20天继代一次,直至出现绿芽。
[0104]
转入m4生根,生根时间需2
‑
4周。长根后将小苗移栽到温室穴盘中,前期需要覆盖塑料膜防止过度失水,一周以后可以将膜揭开。最后根据气候移至大田生长。
[0105]
4、获得突变体植株
[0106]
①
用ctab方法提取植株叶片dna,用载体上特有的序列引物扩增进行阳性检测,产物用1%琼脂糖凝胶电泳检测。反应体系在pcr扩增仪上进行,pcr扩增反应体系如下:
[0107][0108]
引物序列如下(5
’‑3’
):
[0109]
pb
‑
l:gcgcgcggtctcgctcgactagtatgg,seq id no.15;
[0110]
pb
‑
r:gcgcgcggtctctaccgacgcgtatcc,seq id no.16。
[0111]
检测结果如图2,ck1为阳性对照,ck2为阴性对照。
[0112]
②
编辑检测。挑选阳性单株ta克隆测序和野生型对比是否发生突变。
[0113]
pcr产物的制备:
[0114]
1)于灭菌pcr管中配制如下反应体系,分别扩增,扩增引物见表14:
[0115]
[0116][0117]
pcr程序设置为98℃变性3min;98℃15sec,59℃15sec,72℃2min,32个循环;72℃10min;25℃10min。
[0118]
表14扩增引物
[0119][0120]
2)吸取4ul pcr产物进行水平胶检测产物的质量。如果扩增产物有多条带建议凝胶回收目的片段。
[0121]
3)之后参照peasy
‑
blunt simple cloning kit试剂盒说明书将目的基因片段连入peasy
‑
blunt载体中,构建测序中间载体,交由测序公司测序。
[0122]
克隆反应
[0123]
1)在微型离心管中依次加入peasy
‑
blunt simple cloning vector 1ul,pcr产物4μl(根据pcr产物量可适当增减,最多不超过4μl),轻轻混合,室温(27℃
‑
37℃)反应5分钟,反应结束后将离心管置于冰上。
[0124]
2)加连接产物于50ul trans1
‑
t1感受态细胞中(在感受态细胞刚刚解冻时加入连接产物),轻轻混匀,冰浴20
‑
30分钟后,42℃水浴热击30秒,立即置于冰上2分钟。加入250μl平衡至室温的lb培养基,200rpm,37℃培养1小时。吸摇好的菌液50μl(依据连接片段长度大小而定)均匀的涂在含50μg/m l kan抗性的lb平板上,在37℃培养箱中过夜培养(为了得到较多克隆,4000rpm离心1min,弃掉部分上清,保留100
‑
150μl,轻弹悬浮菌体,取全部菌液涂板)。
[0125]
菌液pcr鉴定阳性克隆:
[0126]
1)挑选白色单克隆至10ul无菌水中,涡旋混合。
[0127]
取2ul混合液于20ul pcr体系,用m13f/m13r通用引物扩增,pcr程序设置为94℃变性6min;94℃30sec,59℃30sec,72℃30 sec,35个循环;72℃10min;25℃10min。1%琼脂糖凝胶电泳鉴定阳性克隆。
[0128]
2)挑取阳性克隆菌液进行测序。用m13f/m13r通用引物测序。测序结束后用sequencher把测序结果与野生型对应的序列分析进行比对分析。
[0129]
③
获得突变植株
[0130]
对bnech.a5基因在t0代株阳性植株中编辑检测后得到突变单株,bnech.a5突变体在t2靶点与野生型相比缺失了22个碱基,如下:
[0131]
t2 gaagggttggaatcgaaccgggg
[0132]
甲9707:tcttctagaagggttggaatcgaaccggggagtcg
[0133]
bnech.a5:tcttctaga
‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑
gtcg
[0134]
实施例3油菜bnech.a5突变可用于提高种子含油量
[0135]
在实施例2获得突变体植株后自交加代,得到纯合突变体植株。
[0136]
按如下步骤测定突变体种子含油量。
[0137]
样品的制备:
[0138]
1)把突变体和野生型种子于37℃恒温培养箱干燥处理48h,以保证种子水分含量一致性。各单株取出大小均匀一致的50mg种子称重并记录重量备用;
[0139]
2)将称量好的油菜种子用研钵压破,置于干净的10ml玻璃试管中,可离心将种子甩至管底;
[0140]
3)在上述玻璃管中加入1.5ml 2.5%硫酸的色谱纯甲醇溶液(0.01%bht),200μl标样(十七烷酸甘油三酯,2mg/ml),400μl色谱纯甲苯,旋紧螺旋盖震荡混匀;
[0141]
4)将准备好的样品放入到95℃水浴锅内水浴1h(注意检查玻璃试管是否漏气),取出静置冷却至室温;
[0142]
5)加入1.8ml 0.9%nac1溶液,1ml色谱纯正己烷,小心混匀,1000rpm,离心5min;
[0143]
6)小心吸取600μl上清液于新的进样瓶,样品制备完成待用。
[0144]
7)gc分析在安捷伦gc6890气相色谱仪上进行,升温程序为180℃2min,再按照10℃/min升至220℃,保持7min。毛细管柱为hp 19091n
‑
133,每次样品进样量为1μl。在安捷伦公司生产的自动进样气相色谱仪上直接运行程序。
[0145]
气相色谱仪参数设置:安捷伦hp7890a,检测器为氢火焰离子化检测器,自动进样1μl,分流比设置为1:45,检测器温度为250℃,进样室温度为280℃,载气为n2,流速30ml/min,尾吹为40ml/min,h2速度为30ml/min,空气流速为300ml/min,炉温设置为持续升温,180℃保持2min,然后10℃/min升至220℃保持7min。脂肪酸成分由各脂肪酸气化后的出峰时间和标准脂肪酸出峰时间对比确定,用峰面积百分比表示脂肪酸含量。
[0146]
结果如图3所示,结果表明,在bnech.a5基因突变体中,含油量最高达到39.4%,相同条件下的野生型材料甲9707含油量为31.7%,增幅达到24.3%,达到极显著差异(p值为1.69181e
‑
30)。
[0147]
试验结果证明,对甘蓝型油菜bnech.a5基因突变后,能显著提高甘蓝型油菜种子的含油量。
[0148]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。