一种用于检测avapritinib中间体中对映异构体的方法
技术领域
1.本发明涉及avapritinib技术领域,特别涉及一种用于检测avapritinib中间体中对映异构体的方法。
背景技术:
2.avapritinib(ava)是一种口服、强效、高选择性酪氨酸激酶抑制剂(tyrosine kinase inhibitors,tki),由blueprint medicines公司研发,于2020年1月9日获美国食品和药物管理局(fda)批准上市。
3.在对kit/pdgfrα突变gist患者的最新研究中,ava已经显示出包括pdgfrαd842v突变患者在内的初步疗效,并有可能成为该突变亚群一线治疗药物。ava常规给药方案为每日空腹口服1次,每次300mg,直至患者疾病进展或出现不能耐受的不良反应,其结构式见图1。
[0004][0005]
其结构式见图1。
[0006]
ava为一种typeⅰ型tki,主要通过识别激酶的活性构象,竞争性地结合在atp结合位点上,抑制激酶的自身磷酸化从而阻断细胞增殖信号,最后阻止肿瘤细胞生长。
[0007]
ava作为一种tki,已被证实对kit和pdgfrα突变具有广泛抑制作用,临床前研究显示,ava可强效、精准地抑制pdgfrαd842v(ic50:0.24nmol
·
l
‑
1)和kit d816v(ic50:0.27nmol
·
l
‑
1)突变。有研究表明ava在gist人源肿瘤异种移植模型中具有显著抗肿瘤活性,在kit外显子11/17双突变gist中,ava比现有标准治疗方法更具活性。ava除具有直接的抗肿瘤活性,还可以逆转abcb1和abcg2介导肿瘤细胞的耐药性。研究发现ava在安全剂量范围(0.1~1.0μmol
·
l
‑
1)内可促使过度表达abcb1的nci
‑
adr
‑
res卵巢癌细胞、kb
‑
v1表皮癌细胞和mdr19
‑
hek293细胞对紫杉醇恢复敏感性,并且该效应与ava药物浓度成正比,还可促使过度表abcg2的s1
‑
m1
‑
80直肠癌细胞、人h460
‑
mx20肺癌细胞和r482
‑
hek293细胞对米托蒽醌恢复敏感性,此外还发现ava除了促使过度表达abcb1的多重耐药肿瘤细胞对秋水仙碱和多柔比星恢复敏感性,还可以促使过度表达abcg2的多重耐药肿瘤细胞对拓扑替康和sn
‑
38恢复敏感性。
[0008]
经文献检索,所报道的avapritinib合成主要路线之一是以(s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺作为关键中间体,和4
‑
氯
‑6‑
(1
‑
甲基
‑
1h
‑
吡唑
‑4‑
基)吡咯并[2,1
‑
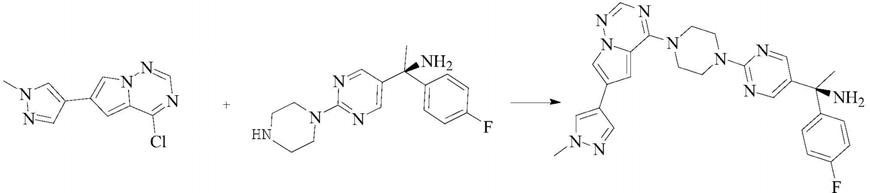
f][1,2,4]三嗪反应制备得到。
[0009][0010]
avapritinib对映异构体来源于关键中间体(s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺中的对映异构体,其对映异构体的大小可决定avapritinib对映异构体的大小。为确保临床用药的安全有效,根据手性药物指导原则,有必要对avapritinib关键中间体(s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺中的((r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺进行有效的质量控制。
[0011]
现有技术中并无有效的((s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺手性有效控制检测方法,因此,为不断提高avapritinib的安全性和有效性,迫切需要建立一种操作简便、灵敏度高、重现性好的avapritinib中关键中间体(s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺的对映异构体的定量检测方法。
技术实现要素:
[0012]
鉴于此,本发明提出一种用于检测avapritinib中间体中对映异构体的方法,对(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺进行有效分离并进行定量,检测效果良好。
[0013]
本发明的技术方案是这样实现的:
[0014]
一种用于检测avapritinib中间体中对映异构体的方法,所述avapritinib中间体为(s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺,所述对映异构体为(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺,其特征在于,所述方法包括以下步骤:
[0015]
s1、配制((s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺供试品溶液:
[0016]
取(s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺样品和正己烷
‑
无水乙醇溶液混合配制成供试品溶液,待用;
[0017]
s2、配制(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺对照品贮备液:
[0018]
取(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺和正己烷
‑
无水乙醇溶液混合配制成(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺对照品贮备液,待用;
[0019]
s3、配制(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺对照品溶液:
[0020]
取(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺对照品贮备液和正己烷
‑
无水乙醇溶液混合配制成(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺对照品溶液,待用;
[0021]
s4、配制混合溶液:
[0022]
取(s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺样品和步骤s2所配制的(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺对照品贮备液加入容量瓶中,用正己烷
‑
无水乙醇溶液稀释,混合均匀,分别制成混合溶液,待用;
[0023]
s5、分别吸取等量的对照品溶液、供试品溶液和混合溶液,注入高效色谱仪中进行测定,所述高效液相色谱法的测定条件包括:色谱柱为chiralcel*od
‑
h色谱柱,柱温为30
℃,检测波长为220nm,流动相的流速为0.8~1.2ml/min;
[0024]
所述流动相由正己烷、乙醇和异丙醇按体积比为99:0.5:0.5混合制得。
[0025]
进一步的,步骤s1,所述供试品溶液中(s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺和正己烷
‑
无水乙醇溶液的质量体积比g/l为0.1~5:1。
[0026]
进一步的,步骤s2,所述对照品贮备液中(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺和正己烷
‑
无水乙醇溶液的质量体积比g/l为5~15:1。
[0027]
进一步的,步骤s3,所述对照品溶液中(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺对照品贮备液和正己烷
‑
无水乙醇溶液的质量体积比g/l为0.005~0.05:1混合制得。
[0028]
进一步的,步骤s4,所述混合溶液中(s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺和流动相的质量体积比g/l为0.1~5:1。
[0029]
进一步的,步骤s4,所述混合溶液中(s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺和步骤s2所配制的(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺对照品贮备液、正己烷
‑
无水乙醇溶液的质量体积比g/l为5~15:0.1~5:10。
[0030]
进一步的,步骤s5,所述柱温为30℃,流动相的流速为0.8~1.0ml/min。
[0031]
进一步的,所述流动相体积比为99~102:0.1~1:0.5的正己烷、乙醇和异丙醇。
[0032]
进一步的,步骤s5,所述色谱柱的长250mm,内径4.6mm,纤维素表面共价键合硅胶填充剂,填充料粒径为5μm。
[0033]
进一步的,所述正己烷
‑
无水乙醇溶液为体积比为0.3~1.5:1的正己烷和无水乙醇混合制得。
[0034]
与现有技术相比,本发明的有益效果是:
[0035]
(1)本发明提供了avapritinib中间体手性分子的控制方法,(s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺和(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺进行分离检测的方法,本发明采用不同于现有技术的色谱条件,从hplc图谱中以看出它们之间有一定距离,能有效地对avapritinib关键中间体中对映异构体进行分离检测,且峰型对称,无拖尾现象。
[0036]
(2)采用杂质对照品对照的检测方法,其分离度、专属性、定量限与检测限、线性、精密度、重复性、准确度、溶液稳定性、耐用性等方面均经详细验证,且各项验证结果均符合相关法规和指导原则的要求,实际检测效果良好。
[0037]
(3)本发明实用性强,检测过程中,(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺的检测限可达0.0129μg/ml,即可以检出(s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺中高于0.01%的(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺,实用性强。检测过程简单、快捷。
[0038]
(4)本发明所述的高效液相色谱法,其测定条件中所包含的范围内均为有效值,即:在各参数范围内取任意值后,也能准确的检测出关键中间体中的对映异构体,且能对对映异构体进行有效分离。在实际检测过程中,便于检测人员对参数的调整和避免人为误差对检测结果产生的影响,适宜推广使用。
附图说明
[0039]
图1为本发明实施例1的供试品溶液的hplc图谱;
[0040]
图2为本发明实施例1的对照品溶液的hplc图谱;
具体实施方式
[0041]
为了更好理解本发明技术内容,下面提供具体实施例,对本发明做进一步的说明。
[0042]
本发明实施例所用的实验方法如无特殊说明,均为常规方法。
[0043]
本发明实施例所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0044]
为了对avapritinib关键中间体进行质量控制,以及不断提高avapritinib药品的安全性和有效性,本发明提出了一种用于检测avapritinib中关键中间体对映异构体的方法,其中,avapritinib中关键中间体为(s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺,对映异构体为(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺,即主要是对(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺进行分离检测。
[0045]
在实际检测过程中,采用高效液相色谱法,其测定条件中在本发明各参数范围内进行调整后,均能准确的检测出(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺,且能对(s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺和((r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺进行有效的分离检测。
[0046]
以下14个典型实施例均选取相同批号(20210421批)的(s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺样品进行检测。
[0047]
实施例1
[0048]
选取批号为20210421批的(s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺的含量进行检测,包括如下步骤:
[0049]
s1、制备(s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺供试品溶液:
[0050]
称取10mg(s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺样品加入10ml正己烷
‑
无水乙醇溶液,由体积比为1:1的正己烷和无水乙醇混合制得,混合均匀后,配制成每1ml含(s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺1.0mg的溶液,作为供试品溶液,待用。
[0051]
s2、制备(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺对照品贮备液:
[0052]
称取(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺,精密称定100mg,正己烷
‑
无水乙醇溶液溶解并定量稀释制成每1ml中约含10mg(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺的溶液,作为
‑
(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺对照品贮备液。
[0053]
s3、制备(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺对照品溶液:
[0054]
量取(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺对照品贮备,正己烷
‑
无水乙醇溶液溶解并定量稀释制成每1ml中约含10μg(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺的溶液,作为(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺对照品溶液。
[0055]
s4、混合溶液的制备:
[0056]
称取(s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺10mg,加入10ml容量
瓶中,精密量取步骤s2的(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺对照品贮备液0.1ml加至容量瓶中并用正己烷
‑
无水乙醇溶液稀释至刻度,混合,摇匀,作为混合溶液,待用。
[0057]
s5、取对照溶液20μl注入高效液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高为满量程的20%~25%,再精密量取供试品溶液、对照品溶液、混合溶液各20μl,分别注入相色谱仪,记录色谱图。本实施例中的(s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺供试品、(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺对照品及混合溶液高效液相色谱图。其中高效液相色谱法的测定条件包括:
[0058]
色谱柱:chiralcel*od
‑
h(型号:长250mm,内径4.6mm,纤维素表面共价键合硅胶填充剂,填充料粒径5μm);
[0059]
检测器:uv检测器;
[0060]
检测波长:220nm;
[0061]
柱温:30℃;
[0062]
流速:1.0ml/min;
[0063]
流动相:按体积比计算,正己烷:乙醇:异丙醇=99:0.5:0.5。经检测可知,(s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺样品中的(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺含量为0.044%。从图谱中可以看出,(s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺和(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺的分离度大于1.5。
[0064]
实施例2
[0065]
选取批号和实施例1相同批的(s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺样品,对其(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺的峰纯度进行检测,本实施例与实施例1的区别仅在于:色谱条件中使用检测器不同,其它检测条件和实施例1一致。在本实施例中,高效液相色谱法的测定条件包括:
[0066]
色谱柱:chiralcel*od
‑
h(型号:长250mm,内径4.6mm,纤维素表面共价键合硅胶填充剂,填充料粒径5μm);
[0067]
检测器:dad检测器;
[0068]
检测波长:220nm;
[0069]
柱温:30℃;
[0070]
流速:1.0ml/min;
[0071]
流动相:按体积比计算,正己烷:乙醇:异丙醇=99:0.5:0.5。经检测可知,(s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺峰纯度为0.999991,(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺的峰纯度为0.999992。
[0072]
实施例3
[0073]
选取(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺对照品溶液进行检测限与定量限检测,信噪比为10:1为定量限,信噪比为3:1为检测限,本实施例与实施例1检测条件一致。在本实施例中,高效液相色谱法的测定条件包括:
[0074]
色谱柱:chiralcel*od
‑
h(型号:长250mm,内径4.6mm,纤维素表面共价键合硅胶填充剂,填充料粒径5μm);
[0075]
检测器:uv检测器;
[0076]
检测波长:220nm;
[0077]
柱温:30℃;
[0078]
流速:1.0ml/min;
[0079]
流动相:按体积比计算,正己烷:异丙醇:三乙胺=80:20:0.05。
[0080]
经检测可知,(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺检测限为0.0129μg/ml,定量限为0.0516μg/ml。
[0081]
实施例4
[0082]
选取(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺对照品贮备液进行线性关系检测,配制对照品溶液定量限浓度、以及140%、120%、100%、80%、60%限度浓度,本实施例与实施例1检测条件一致。在本实施例中,高效液相色谱法的测定条件包括:
[0083]
色谱柱:chiralcel*od
‑
h(型号:长250mm,内径4.6mm,纤维素表面共价键合硅胶填充剂,填充料粒径5μm);
[0084]
检测器:uv检测器;
[0085]
检测波长:220nm;
[0086]
柱温:30℃;
[0087]
流速:1.0ml/min;
[0088]
流动相:按体积比计算,正己烷:乙醇:异丙醇=99:0.5:0.5。
[0089]
经检测可知,(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺,线性回归方程y=70425x
‑
14.336,线性相关系数为0.99986。
[0090]
实施例5
[0091]
配制(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺对照品溶液定量限浓度以及100%浓度,连续进样6次,本实施例与实施例1检测条件一致。在本实施例中,高效液相色谱法的测定条件包括:
[0092]
色谱柱:chiralcel*od
‑
h(型号:长250mm,内径4.6mm,纤维素表面共价键合硅胶填充剂,填充料粒径5μm);
[0093]
检测器:uv检测器;
[0094]
检测波长:220nm;
[0095]
柱温:30℃;
[0096]
流速:1.0ml/min;
[0097]
流动相:按体积比计算,正己烷:乙醇:异丙醇=99:0.5:0.5。
[0098]
经检测可知,(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺其定量限浓精密度及100%浓度分别为1.62%、0.44%。
[0099]
实施例6
[0100]
配制(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺对照品溶液及供试品溶液放置0、4、8、12、16、24小时,考察稳定性,本实施例与实施例1检测条件一致。在本实施例中,高效液相色谱法的测定条件包括:
[0101]
色谱柱:chiralcel*od
‑
h(型号:长250mm,内径4.6mm,纤维素表面共价键合硅胶填充剂,填充料粒径5μm);
[0102]
检测器:uv检测器;
[0103]
检测波长:220nm;
[0104]
柱温:30℃;
[0105]
流速:1.0ml/min;
[0106]
流动相:按体积比计算,正己烷:乙醇:异丙醇=99:0.5:0.5。
[0107]
经检测可知,(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺对照品的峰面积rsd为0.62%,供试品溶液中(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺的峰面积rsd为0.82%,(s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺主峰的峰面积rsd为0.54%。
[0108]
实施例7
[0109]
选取批号和实施例1相同批的(s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺样品6份,进行重复性考察,本实施例与实施例1检测条件一致。在本实施例中,高效液相色谱法的测定条件包括:
[0110]
色谱柱:chiralcel*od
‑
h(型号:长250mm,内径4.6mm,纤维素表面共价键合硅胶填充剂,填充料粒径5μm);
[0111]
检测器:uv检测器;
[0112]
检测波长:220nm;
[0113]
柱温:30℃;
[0114]
流速:1.0ml/min;
[0115]
流动相:按体积比计算,正己烷:乙醇:异丙醇=99:0.5:0.5。
[0116]
经检测可知,(s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺样品中((r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺含量rsd为1.3%。
[0117]
实施例8
[0118]
选取批号和实施例1相同批的(s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺样品6份,配制成混合溶液6份,本实施例与实施例1检测条件一致。在本实施例中,高效液相色谱法的测定条件包括:
[0119]
色谱柱:chiralcel*od
‑
h(型号:长250mm,内径4.6mm,纤维素表面共价键合硅胶填充剂,填充料粒径5μm);
[0120]
检测器:uv检测器;
[0121]
检测波长:220nm;
[0122]
柱温:30℃;
[0123]
流速:1.0ml/min;
[0124]
流动相:按体积比计算,正己烷:乙醇:异丙醇=99:0.5:0.5。
[0125]
经检测可知,(s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺样品中((r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺回收率98.2%,rsd为1.7%。
[0126]
实施例9
[0127]
选取批号和实施例1相同批的(s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺样品,对其(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺的含量进行检测,本实施例与实施例1的区别仅在于:色谱条件中流速的参数不同,其它检测条件和实施例1一
致。在本实施例中,高效液相色谱法的测定条件包括:
[0128]
色谱柱:chiralcel*od
‑
h(型号:长250mm,内径4.6mm,纤维素表面共价键合硅胶填充剂,填充料粒径5μm);
[0129]
检测器:uv检测器;
[0130]
检测波长:220nm;
[0131]
柱温:30℃;
[0132]
流速:0.8ml/min;
[0133]
流动相:按体积比计算,正己烷:乙醇:异丙醇=99:0.5:0.5。
[0134]
经检测可知,(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺含量为0.042%。
[0135]
实施例10
[0136]
选取批号和实施例1相同批的(s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺样品,对其(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺的含量进行检测,本实施例与实施例1的区别仅在于:色谱条件中流速的参数不同,其它检测条件和实施例1一致。在本实施例中,高效液相色谱法的测定条件包括:
[0137]
色谱柱:chiralcel*od
‑
h(型号:长250mm,内径4.6mm,纤维素表面共价键合硅胶填充剂,填充料粒径5μm);
[0138]
检测器:uv检测器;
[0139]
检测波长:220nm;
[0140]
柱温:30℃;
[0141]
流速:1.2ml/min;
[0142]
流动相:按体积比计算,正己烷:乙醇:异丙醇=99:0.5:0.5。
[0143]
经检测可知,(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺含量为0.045%。
[0144]
实施例11
[0145]
选取批号和实施例1相同批的(s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺样品,对其(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺的含量进行检测,本实施例与实施例1的区别仅在于:色谱条件中柱温的参数不同,其它检测条件和实施例1一致。在本实施例中,高效液相色谱法的测定条件包括:
[0146]
色谱柱:chiralcel*od
‑
h(型号:长250mm,内径4.6mm,纤维素表面共价键合硅胶填充剂,填充料粒径5μm);
[0147]
检测器:uv检测器;
[0148]
检测波长:220nm;
[0149]
柱温:25℃;
[0150]
流速:1.0ml/min;
[0151]
流动相:按体积比计算,正己烷:乙醇:异丙醇=99:0.5:0.5。
[0152]
经检测可知,(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺含量为0.043%。
[0153]
实施例12
[0154]
选取批号和实施例1相同批的(s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺样品,对其(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺的含量进行检测,本实施例与实施例1的区别仅在于:色谱条件中柱温的参数不同,其它检测条件和实施例1一致。在本实施例中,高效液相色谱法的测定条件包括:
[0155]
色谱柱:chiralcel*od
‑
h(型号:长250mm,内径4.6mm,纤维素表面共价键合硅胶填充剂,填充料粒径5μm);
[0156]
检测器:uv检测器;
[0157]
检测波长:220nm;
[0158]
柱温:35℃;
[0159]
流速:1.0ml/min;
[0160]
流动相:按体积比计算,正己烷:乙醇:异丙醇=99:0.5:0.5。
[0161]
经检测可知,(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺含量为0.046%。
[0162]
实施例13
[0163]
选取批号和实施例1相同批的(s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺样品,对其(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺的含量进行检测,本实施例与实施例1的区别仅在于:色谱条件中流动相比例的参数不同,其它检测条件和实施例1一致。在本实施例中,高效液相色谱法的测定条件包括:
[0164]
色谱柱:chiralcel*od
‑
h(型号:长250mm,内径4.6mm,纤维素表面共价键合硅胶填充剂,填充料粒径5μm);
[0165]
检测器:uv检测器;
[0166]
检测波长:220nm;
[0167]
柱温:30℃;
[0168]
流速:1.0ml/min;
[0169]
流动相:按体积比计算,正己烷:乙醇:异丙醇=98:1.0:1.0。
[0170]
经检测可知,(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺含量为0.043%。
[0171]
实施例14
[0172]
选取批号和实施例1相同批的(s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺样品,对其(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺的含量进行检测,本实施例与实施例1的区别仅在于:色谱条件中流动相比例的参数不同,其它检测条件和实施例1一致。在本实施例中,高效液相色谱法的测定条件包括:
[0173]
色谱柱:chiralcel*od
‑
h(型号:长250mm,内径4.6mm,纤维素表面共价键合硅胶填充剂,填充料粒径5μm);
[0174]
检测器:uv检测器;
[0175]
检测波长:220nm;
[0176]
柱温:30℃;
[0177]
流速:1.0ml/min;
[0178]
流动相:按体积比计算,正己烷:乙醇:异丙醇=99:0.4:0.6。
[0179]
经检测可知,(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺含量为0.045%。
[0180]
由实施例1至实施例14的检测结果可知,在avapritinib关键中间体(s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺的检测过程中,在本发明色谱条件的各参数范围内,对流动相比例、流速、柱温等进行调整后,均能对关键中间体(s)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺中的对映异构体(r)
‑1‑
(4
‑
氟苯基)
‑1‑
[2
‑
(哌嗪
‑1‑
基)嘧啶
‑5‑
基]乙胺进行有效分离,且其检测结果均有效、准确。
[0181]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。