针对黄热病毒ns1蛋白的抗体及其应用
技术领域
1.本发明属于生物医药技术领域,具体涉及一种针对黄热病毒ns1蛋白的抗体及其应用。
背景技术:
2.黄热病毒(yfv)是以伊蚊为媒介在虫媒传染病毒,与寨卡病毒(zikv)、西尼罗河病毒(wnv)和登革热病毒(denv)等同属黄病毒科黄病毒属。黄热病毒的传播媒介是蚊子,因此,在蚊子流行地区和发展中国家中黄热病的暴发率很高。当前主要流行于非洲和南美洲的热带、亚热带地区。黄热病毒可引起严重危害人类健康的黄热病,表现为黄疸,出血、甚至多系统的器官衰竭。因黄热病症状与同科病毒引起的疾病症状类似,且同一地区还可能同时流行黄热病毒和其它黄病毒,因此在临床上凭借临床症状难以鉴别。此外,由于黄病毒科的病毒在抗原性上具有相似的特征,抗体可能会具有交叉反应性。而且,登革病毒还会引起ade(抗体依赖的增强作用),这些情况使得临床诊断更为复杂。以上问题也对开发黄热病的血清学诊断方法提出了巨大挑战。
3.诊断黄热病毒感染的实验室方法主要包括病毒分离、核酸检测、抗原检测和血清学检测等。目前最可靠的诊断方法主要是提取病毒rna后进行qrt
‑
pcr,该方法费时、成本高昂且需要在特定的实验室由专业人员进行操作,使用的仪器也较复杂,无法广泛便捷的应用。因此,迫切需要开发一种操作简单、可在感染早期即可检测产品和方法,且可在偏远地区使用。
4.黄热病毒的非结构蛋白1(nonstructural protein 1,ns1)是比较保守的糖蛋白,有膜型和分泌型两种形式,在感染机体中表达量高且时间长,是检测黄热病毒感染的良好靶点。
技术实现要素:
5.针对现有技术存在的不足,本发明的目的之一在于提供一种针对黄热病毒ns1非结构蛋白的抗体及其在制备产品中的应用。
6.本发明目的之二在于基于本发明公开的抗体开发一种高度灵敏的黄热病毒的检测试剂盒和检测方法。此试剂盒或方法在普通实验室即可进行操作,而且可进一步开发为多样的试剂盒,如胶体金,elisa等,便于使用。
7.为实现上述目的,本发明具体技术方案如下:
8.第一方面,本发明提供了一种针对黄热病毒ns1非结构蛋白的抗体,所述抗体包括 yd40和/或yb36抗体;
9.其中,yd40抗体包含如seq id no:1所示的氨基酸序列的重链可变区,如seq id no:2所示的氨基酸序列的轻链可变区;
10.yb36抗体包含如seq id no:3所示的氨基酸序列的重链可变区,如seq id no:4 所示的氨基酸序列的轻链可变区。
11.在一些实施方案中,yd40或yb36抗体还包含:如seq id no:5所示的氨基酸序列的重链恒定区和如seq id no:6所示的氨基酸序列的轻链恒定区。
12.在一些实施方案中,以上抗体轻链为kappa轻链。
13.在一些实施方案中,所述yb36或yd40抗体还包括n端信号肽,所述信号肽氨基酸序列为seq id no:7;所述信号肽的核苷酸酸序列如seq id no:8所示。
14.第二方面,本发明提供了一种核酸分子,所述核酸分子包含编码以上所述抗体的核苷酸序列。
15.在一些实施方案中,所述核苷酸序列如seq id no:9
‑
14所示;
16.其中,针对yd40抗体,重链可变区的核苷酸序列如seq id no:9所示,轻链可变区的核苷酸序列如seq id no:10所示;
17.针对yb36抗体,重链可变区的核苷酸序列如seq id no:11所示,轻链可变区的核苷酸序列如seq id no:12所示。
18.针对yd40或yb36抗体,重链恒定区的核苷酸序列如seq id no:13所示和轻链恒定区的核苷酸序列如seq id no:14所示。
19.第三方面,本发明提供了包含以上所述核酸分子的表达载体。
20.第四方面,本发明提供了一种黄热病毒检测试剂盒,所述试剂盒包括以上任一所述抗体。
21.在一些实施方案中,所述试剂盒包括以上所述yd40和yb36抗体,所述yd40用作检测抗体具有显色标记;所述yb36被固定并且被用作捕获抗体。
22.在一些实施方案中,还包括用于固定捕获抗体的固相载体、样品处理液、阳性对照物、阴性对照物、显色液和终止液。
23.在一些实施方案中,所述固相载体包括:硝酸纤维素膜、胶乳颗粒、磁性颗粒、胶体金、玻璃、纤维玻璃、聚合物或纤维光学传感器中的任意一种或至少两种的组合。
24.在一些实施方案中,所述显色标记物可以是酶、胶体金属颗粒、着色胶乳颗粒、荧光胶乳颗粒、发光物质、荧光物质等。酶可以是酶联免疫测定法(eia)中使用的各种酶,例如碱性磷酸酶、过氧化物酶、β
‑
d
‑
半乳糖苷酶等;胶体金属颗粒例如可以使用胶体金颗粒、胶体硒颗粒等。优选地,辣根过氧化物酶。
25.在一些实施方案中,所述显色液和终止液可以商业购买或自行配置。所述显色液如酶底物,tmb等。
26.在一些实施方案中,所述阳性对照物为黄热病毒ns1蛋白;所述阴性对照物为不含黄热病毒ns1蛋白的空白对照。
27.第五方面,本发明提供了一种非疾病的诊断和治疗目的、检测样品中黄热病毒或其 ns1蛋白的方法,所述方法包括如下步骤:
28.将待测样品与所述的抗体混合,孵育,检测得到黄热病毒或者其相应抗原的存在情况。
29.在一些实施方式中,所述方法包括夹心法和竞争法。
30.在一优选实施方式中,所述夹心法包括如下步骤:
31.(1)将yb36作为捕获抗体与固相载体结合;
32.(2)将步骤(1)中所得的固相载体与待测样品混合,孵育,并以对照样品进行对照;
33.(3)所述孵育完成后,洗涤所述的固相载体,加入显色标记的检测抗体yd40并再次孵育,所述检测抗体与黄热病毒或者其相应抗原结合;
34.(4)再次洗涤所述的固相载体,然后加入显色液,使用酶标仪测定相应的吸光值;
35.(5)将所测得的吸光值与对照样品的吸光值相比较,确定所述待测样品中黄热病毒的存在情况及其相对量。
36.优选地,所述待测样品为生物样品,进一步的,所述样品包括细胞上清、血浆、血清和全血。
37.第六方面,本发明提供了所述的抗体在制备治疗和/或预防黄热病毒的药物中的应用。
38.优选地,所述药物包括以上任一种抗体。
39.第七方面,本发明提供了所述的抗体在制备检测和/或诊断黄热病毒的产品中的应用。
40.在一些实施方案中,所述产品可以在包括(但不限于)酶联免疫测定法、放射免疫测定法、荧光免疫测定法等方法中使用。
41.使用本发明公开的yb36和/或yd40抗体的任何检测方法及其制备的产品均在本发明的保护范围内。
42.优选地,所述产品包括(但不限于)检测试剂、检测试纸和检测试剂盒。
43.在一些实施方案中,所述检测试纸包括基底、样品区、结合区和反应区,其中沿着待测样品流动方向,所述样品区、结合区和反应区依次设置在所述基底上;所述结合区负载有显色标记的yd40抗体;所述反应区设置有检测区,所述检测区负载yb36抗体,其被固定在所述检测区并被用做捕获抗体。所述反应区还设置有质控区。
44.在一些实施方案中,所述检测试纸在所述反应区远离所述样品区的一侧还包括吸收区。
45.在一些实施方案中,所述显色标记是胶体金标记或荧光标记。
46.在一些实施方案中,所述检测试纸可以按照现有技术如中国专利申请cn102747040a 中实施例中所描述的方法制备。
47.基于上述技术方案,本发明具有以下有益效果:
48.1、本发明的单克隆抗体yb36和yd40可特异性识别yfv
‑
ns1蛋白,亲和力高,具有敏感性和特异性好等优点;并将其用于制备诊断黄热病毒产品。
49.2、本发明提供了一种高灵敏,可靠的双抗体夹心elisa方法,可用于检测动物或人血清在内的不同类型样品中的yfv
‑
ns1蛋白抗原,用于黄病毒感染的早期的诊断,达到早发现、早隔离,避免传播的目的。
50.3、本发明基于双抗制备的产品包括yfv
‑
ns1病毒检测试剂盒和检测试纸;由于其使用的单克隆抗体具有高亲和力和特异性,所得检测结果较为准确;并便于携带和保存,操作简单,方法稳定、可在短时间内完成测试。相比于核酸检测,具有检测时间更短,成本更低的特性,特别适合大量样本以及偏远地区的筛查。
附图说明
51.图1:yfv
‑
ns1蛋白纯化分子筛(a)与sds
‑
page结果(b)。
52.图2:抗体纯化后,抗体sds
‑
page结果。
53.图3:抗体与黄热病毒和同科病毒ns1蛋白结合结果。
54.图4:表面等离子共振技术检测抗体与yfv
‑
ns1蛋白的亲和力。
55.图5:octet red 96仪器检测yd40和yb36非竞争性结合yfv
‑
ns1蛋白。
56.图6:捕获抗体yb36与标记抗体yd40的双抗体夹心elisa试验的结果曲线图;(a) 探索包被抗体yb36使用量;(b)检测抗体yd40使用量;(c)探索可检测到抗原yfv
‑
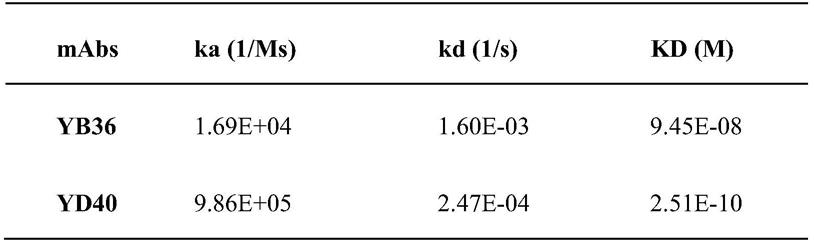
ns1 的下限。
57.图7:本发明建立夹心elisa法(b)与目前现有的核酸检测法(a)比较结果。
58.图8:本发明建立夹心elisa法检测临床样本验证结果。
具体实施方式
59.以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
60.下述实施例所使用的实验方法如无特殊说明,均为常规方法。
61.下述实施例中所有的材料、试剂等,如无特殊说明,均可从商业途径获得。
62.实施例1黄热病毒非结构蛋白1(yfv
‑
ns1)的表达与纯化
63.yfv
‑
ns1的胞外区基因片段通过nde i和xho i克隆至pfastbac i载体中,转化至大肠杆菌dh10,获得重组质粒bacmid
‑
ns1。然后,转染sf9细胞,获得含有ns1基因的杆状病毒。杆状病毒感染hi5细胞后,可分泌表达ns1蛋白至培养上清。通过亲和层析和分子筛层析的方法进行纯化,通过sds
‑
page鉴定蛋白纯度。结果显示,ns1蛋白存在单体和二聚体形式,单体大小为43kda,结果如图1。将yfv
‑
ns1浓缩至1mg/ml,冷冻保存于
‑
80℃备用。
64.黄热病毒yfv
‑
ns1 c terminal和其他黄病毒属病毒wnv
‑
ns1、zikv
‑
ns1、 denv1
‑
ns1、denv2
‑
ns1、denv3
‑
ns1、denv4
‑
ns1构建、表达和纯化参考上述 yfv
‑
ns1。
65.黄热病毒yfv
‑
ns1氨基酸序列如seq id no:15所示,yfv
‑
ns1 c terminal氨基酸序列如seq id no:15所示的171
‑
351位置的aa;其他黄病毒属病毒:西尼罗病毒 wnv
‑
ns1(大小为45kda)氨基酸序列如seq id no:16,寨卡病毒zikv
‑
ns1(大小约为45kda)氨基酸序列如seq id no:17,四种血清型登革热病毒denv
‑
ns1(dv1
‑
ns1/ dv2
‑
ns1/dv3
‑
ns1/dv4
‑
ns1蛋白,大小分别为45kda/75kda/43kda/43kda)氨基酸序列如seq id no:18
‑
21。
66.实施例2人源单克隆抗体的制备
67.1、单细胞分选和克隆构建
68.取得康复者知情同意的情况下,采集两名感染yfv 6个月的康复者的外周血样本,分离外周血单核细胞(pbmcs),加入各类血细胞特异性标记抗体和特异性yfv
‑
ns1抗原一起孵育。经facsaria ii(bd biosciences)分选,收集yfv
‑
ns1阳性的记忆型b 细胞至96孔板中,每孔1个细胞。
69.发明人通过rt
‑
pcr和巢式pcr的方法从单个b细胞中扩增抗体可变区基因序列 (vh和vl)。首先,将获得的b细胞通过superscript iii reverse transcriptase试剂盒进行逆转录。获得cdna后,采用hotstar plus酶(qiagen)进行巢式pcr来扩增抗体可变区序列。第一轮pcr反应条件如下:95℃5min;95℃30s,55℃(vh和vκ)或50℃ (vλ)60s,72℃90s,35个循环;72℃7min。将获得的产物作为模板进行第二轮pcr,条件如下:95℃5min;95℃
30s,58℃(重链)/60℃(k链)/64℃(λ链)30s,72℃90s, 35个循环;72℃7min。
70.采用琼脂糖凝胶电泳,分离pcr产物,用凝胶提取试剂盒(cwbio)提取分子量约为400bp的pcr条带,并将纯化后的产物进行测序。利用imgt(international immunogenetics)信息系统和igblast对获得的靶序列进行分析。可变区序列与相对应的恒定区通过搭桥pcr连接,克隆至表达载体pcaggs中,其中重链采用ecori和xhoi 酶切位点,κ链(轻链)采用saci与xhoi酶切位点。
71.2、蛋白表达和纯化
72.将重链和轻链构建质粒转染hek
‑
293t细胞。转染6小时后更换为新鲜的无血清培养基进行培养。第3天和第7天,收集细胞培养上清。将收集的上清与含有20mm磷酸钠(ph 7.0)的缓冲液等体积混合,6500rpm离心30min去掉碎片,经过0.22um的滤膜过滤后,上清液流过hitrap protein a亲和层析柱,然后使用0.1m甘氨酸(ph 3.0)洗脱结合的抗体。收集洗脱液浓缩后进行分子筛层析。目的峰通过sds
‑
page进行鉴定,重链分子量约为 50kda,轻链分子量约为25kda,结果如图2,说明目标蛋白得到正常表达。
73.分离出11种抗体,并在初步elisa的基础上进行抗体的结合亲和力测定,筛选出与 yfv
‑
ns1蛋白结合活性较强的单克隆抗体yb36和yd40。
74.实施例3yb36和yd40抗体功能鉴定
75.1、elisa检测抗体特异性结合yfv
‑
ns1
76.1)使用包被液稀释抗原2μg/ml(yfv
‑
ns1、yfv
‑
ns1 c terminal、wnv
‑
ns1、 zikv
‑
ns1、denv1
‑
ns1、denv2
‑
ns1、denv3
‑
ns1、denv4
‑
ns1),加入至酶标板中,100μl/孔,4℃过夜。
77.2)第二天,加入pbst 200μl/孔,洗板机(bio
‑
tek,405_ls)洗板5次后,加入 5%的脱脂奶粉封闭液,100μl/孔,37℃孵箱孵育1小时。
78.3)pbst漂洗5次,加入抗体yb36或yd40,400ng/孔,37℃孵箱孵育1小时。
79.4)pbst漂洗5次,将hpr标记的羊抗人igg,100μl/孔,37℃孵箱孵育45min。
80.5)pbst漂洗5次,加入tmb显色液,100μl/孔,室温避光,反应2分钟,之后加入2m h2so4终止反应,100μl/孔。
81.6)检测450nm波长处的od值,保存记录原始数据。
82.结果如图3所示,抗体yb36和yd40均为yfv的特异性单抗;与其他黄病毒科ns1 蛋白均无结合。
83.2、表面等离子共振技术(spr)检测抗体与yfv
‑
ns1的结合能力
84.此项实验采用biacore
tm 8k机器完成。具体步骤如下:
85.首先,将抗人的二抗以氨基偶联的方式固定在cm5芯片的通道(flow cell,fc)。固定量控制在10,000响应值(response units,ru)左右。以抗体捕获的方式固定yb36或yd40,捕获量在60ru左右。缓冲液(10mm hepes,150mm nacl,ph 7.4)倍比稀释yfv
‑
ns1 蛋白,依次流过各通道,流速为30μl/min。利用biaeva1uation software(biacore,inc.)软件计算结合动力学常数。
86.spr的结果显示,抗体均可以与yfv
‑
ns1蛋白结合(图4)。得到的各相互作用的结合常数(ka)、解离常数(kd)和平衡解离常数(kd),如表1所示。
87.表1抗体与yfv
‑
ns1蛋白结合的动力学常数
[0088][0089]
3、yb36和yd40结合yfv
‑
ns1不同的表位
[0090]
利用octet red96生物分子相互作用分析仪检测抗体yb36与yd40是否竞争性结合 yfv
‑
ns1蛋白。
[0091]
首先,将yfv
‑
ns1固定于ar2g生物传感器(pall),然后将生物传感器浸泡于含yd40的缓冲液中,反应300s以达到饱和。然后再浸泡于yd40与yb36的混合液中,反应300s以达到饱和。抗体均以相同浓度(1μm)测定。比较结合曲线的变化来判定两种抗体结合抗原的表位。
[0092]
结果如图5所示,生物传感器浸泡于含yd40溶液后曲线有上升,且达到平台后再浸泡于含yb36抗体的溶液时,曲线仍有上升,说明yfv
‑
ns1结合yd40且饱和后仍可以结合yb36,两个抗体结合于yfv
‑
ns1的不同表位,不存在竞争关系。
[0093]
实施例4用yb36与yd40抗体检测yfv
‑
ns1抗原的双抗体夹心elisa法建立
[0094]
考虑到单克隆抗体与抗原yfv
‑
ns1的特异性和亲和力,本发明选择亲和力较强的 yd40作为检测抗体,并用hrp标记用于后续的测定,而yb36作为捕获抗体,建立检测黄热病毒yfv
‑
ns1抗原的双抗夹心的elisa测定方法。
[0095]
elisa方法参照实施例3中elisa方法,根据实验需要,进行了修改。其中,包被 yb36抗体至酶标板上,漂洗和封闭后加入抗原进行孵育,再次漂洗后加入yd40进行反应,然后漂洗后进行显色。
[0096]
将yb36使用包被液进行梯度稀释(如图6a)后包被于酶标板上,封闭漂洗后,依次加入yfv
‑
ns1(10μg/ml,100μl/孔)和yd40
‑
hrp(2μg/ml,100μl/孔)。结果表明, yb36大于200ng/孔时则od值则不再增加,如图6a所示。
[0097]
将200ng/孔的yb36包被于酶标板后,依次加入yfv
‑
ns1(10μg/ml,100μl/孔)和 pbst梯度稀释后的yd40
‑
hrp(如图6b)。结果表明,yd40
‑
hrp的浓度为74.07ng/ml 时即可检测到抗原,超过667ng/ml时,od值达到平台阶段,如图6b所示。
[0098]
综上所述,yb36作为捕获抗体可选择为200ng/孔,yd40作为检测抗体使用浓度为 2μg/ml。
[0099]
为了评估夹心elisa对抗原的检测水平,将yfv
‑
ns1从30μg/ml稀释至1.52ng/ml,并测量od值。结果如图6c所示,yfv
‑
ns1的最低检测浓度约为40ng/ml;当浓度超过 370ng/ml时,od值达到平台阶段。
[0100]
实施例5elisa方法及其试剂盒的性能
[0101]
本发明以yd40作为检测抗体,yb36作为捕获抗体,建立的测定黄热病毒yfv
‑
ns1 蛋白含量的双抗体夹心elisa方法及试剂盒进行性能评价。
[0102]
1、双抗夹心elisa法检测病毒感染后小鼠血清中yfv
‑
ns1的含量,并与q
‑
pcr方法
进行比较。
[0103]1×
105pfu yfv
‑
17d病毒腹腔注射感染9只ifn
‑
αβr
‑
ko小鼠(6周龄),在感染前和感染后第3、5、7、10、14天眼眶采血。血液样本冰上放置60分钟后离心12分钟,6000 rpm/min。取血清并分装保存在
‑
80℃。用q
‑
pcr和本发明建立的双抗夹心elisa法对 yfv
‑
ns1进行定量。yfv
‑
17d病毒制备参考lu x,xiao h,li s,et al.double lock of ahuman neutralizing and protective monoclonal antibody targeting the yellow fever virusenvelope[j].cell reports,2019,26(2):438
‑
446.e5.。
[0104]
结果如图7所示,q
‑
pcr方法(图7a)可以检测到感染第1d和第10d部分小鼠,以及第3天至第7天全部小鼠血清中的病毒;双抗夹心elisa方法(图7b)可以检测到第3d,5d全部小鼠以及第7d部分小鼠血清中yfv
‑
ns1。
[0105]
2、本发明建立的双抗夹心elisa方法检测临床样品
[0106]
发明人于2016年收集了4例yfv感染者在北京地坛医院住院期间的血清以及5例健康人血清进行ns1检测。用本发明双抗夹心elisa法检测患者血清中的ns1从1.6μg/ml 到59μg/ml不等,而健康人血清中ns1低于0.1μg/ml(图8)。结果表明,夹心elisa 可以灵敏而特异性地检测ns1。
[0107]
本发明提供了一种高灵敏,可靠的双抗体夹心elisa方法,可用于检测yfv感染的动物或人血清在内的不同类型样品中的yfv
‑
ns1蛋白抗原,用于黄热病早期的诊断,达到早发现、早隔离,避免传播的目的。
[0108]
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。