1.本发明属于荧光成像技术领域,涉及一种近红外二窗荧光免疫探针及其制备方法与应用。
背景技术:
2.免疫探针是指将抗体用具有特殊物理化学性质的标记物进行偶联标记,从而可对它所识别的抗原进行定性与定量检测的一种偶联物。目前,用于制备免疫探针的标记物包括放射性同位素、胶体金、荧光蛋白和有机荧光染料分子。其中,利用有机荧光染料分子制备的荧光免疫探针由于具有高灵敏度、高安全性、可实时监测等优势,被广泛用于生物大分子的标记、成像和跟踪。
3.然而,用于特异性靶向的生物大分子多为单克隆抗体,分子量比较大,组织或肿瘤的穿透性较弱,难以靶向具有空间位阻的靶点表位。此外,大分子量的igg抗体必须通过哺乳动物细胞表达生产,导致成本非常高昂。为了解决这些问题,人们近年来在积极研发具有更小分子量的抗体分子片段或新结构抗体。其中,目前最有应有前景的一类抗体称为单域抗体,具体是指一类能与抗原结合的最小抗体单位,通常是指只有重链可变区的一类抗体,具备分子量小(约15kda)、稳定性高、可溶性好、易表达及免疫原性低等特征,是一种来源简单、价格低廉、适用于批量生产的小分子抗体。单域抗体主要包括骆驼来源的纳米抗体vhh(或称为nanobody)、鲨鱼来源的vnar以及人源的全人源纳米抗体。近期,有研究者成功筛选到一系列高亲和力全人源纳米抗体,这些抗体均具有非常高的稳定性和表达产量(cell host microbe 2020,27,891
‑
898e895;cell host microbe 2017,22,471
‑
483e475.)。相较骆驼来源的单域抗体,全人源纳米抗体具有更低的人体免疫原性与更好的安全性。特别是这些小分子单域抗体在体内代谢速率快,半衰期一般在一小时内,尤其适合用于荧光免疫探针的构建,使探针同时具有高特异性、易体内代谢、低生产成本等特性。
4.此外,近红外二窗区域(nir
‑
ii;1000
‑
1700nm)的荧光信号受到的来自组织的吸收和散射较少,可以提供相较于传统近红外一窗区域(nir
‑
i;750
‑
900nm)更高灵敏度、更高分辨率、更大穿透深度的非侵入型活体成像,常用于活体精细结构的成像和测量,如血管阻塞判断、血流速度判断、脑肿瘤靶向及成像、活体器官体积测量等。
5.近红外二窗成像荧光基团很多,包括无机纳米材料和有机荧光染料。其中某些无机纳米材料潜在的生物毒性会导致生物体损伤,极大程度局限了nir
‑
ii无机纳米材料在生物上的应用。有机染料种类较少,主要包括苯并双噻二唑(bbtd),其为电子受体;三苯胺,其为电子给体的d
‑
a
‑
d类荧光分子探针;苯并[c,d]吲哚,其为配体的花菁类染料。目前为止报道的大多数荧光染料都表现出较弱的光稳定性和严重的光漂白现象,局限了此类染料在长时间循环追踪上的应用。少数与抗体偶联修饰得到的免疫探针多为物理性混合,导致其成分复杂,稳定性较差,不适用于临床。
[0006]
因此,开发一种光稳定性较好的具有靶向性的近红外二窗荧光免疫探针具有十分重要的意义。
技术实现要素:
[0007]
本发明的目的是提供一种基于单域抗体与小分子荧光染料共价偶联的近红外二窗荧光免疫探针及其制备方法与应用。本发明荧光免疫探针可用于近红外二窗成像,荧光免疫探针与相应抗原结合后,其近红外二窗范围内荧光特异性增强,因而可应用于荧光活体成像技术中。
[0008]
本发明的目的可以通过以下技术方案来实现:
[0009]
一种近红外二窗荧光免疫探针,该荧光免疫探针为近红外荧光染料与单域抗体的偶联物。
[0010]
进一步地,所述的近红外荧光染料包括花菁类荧光染料、罗丹明类荧光染料或bodipy类荧光染料中的一种。
[0011]
本发明中的近红外荧光染料是指一类吸收光谱和发射光谱在600
‑
900nm范围内的荧光染料,具体包括由奇数个碳原子组成共振次甲基(甲川基)共轭链并被两个含氮杂环封端构成的花菁类荧光染料,由3、6位氨基取代的氧杂蒽母体与9位碳原子取代芳基构成的罗丹明类荧光染料,或由二氟化硼二吡咯甲川染料及其衍生物构成的bodipy类荧光染料等。
[0012]
优选地,所述的近红外荧光染料的化学结构式如下:
[0013][0014]
其中,n1、n2、n3分别独立地选自1、2或3;
[0015]
r1、r2、r3分别独立地选自氢原子、未取代的烷基、苯基、苯基取代的烷基或烷磺酸基;
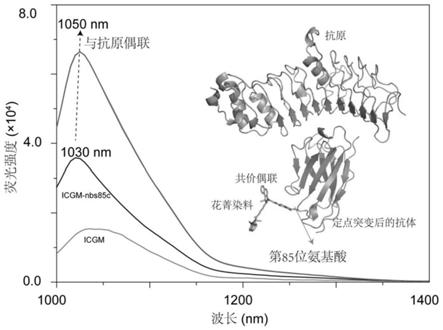
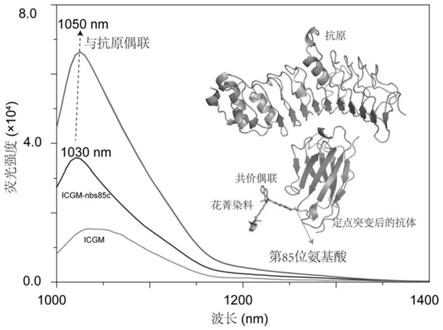
[0016]
r4选自氢原子、未取代的烷基、苯基、苯基取代的烷基、卤素或烷磺酸基;
[0017]
x1、x2分别独立地选自s、o、氢原子、未取代的烷基、苯基取代的烷基或烷磺酸基。
[0018]
优选地,r2或r3的苯基未被取代,或被一个或多个卤素、烷氧基、饱和氨基或烷基取代。
[0019]
优选地,烷基为直链或具有支链的饱和烷烃,进一步优选为甲基、乙基、丙基、丁基、戊基、异丙基或叔丁基。
[0020]
优选地,卤素为氟、氯、溴或碘。
[0021]
优选地,n1为1,n2为1,n3为1,r1为苯基,r2为氢原子,r3为苯基,x1为二甲基,x2为二甲基。
[0022]
本发明中的抗体为单域抗体,主要包括骆驼来源的纳米抗体vhh(或称为
nanobody)、鲨鱼来源的vnar以及人源的全人源纳米抗体,这些抗体均具有非常高的稳定性和表达产量。
[0023]
优选地,所述的单域抗体为将fr3区的丝氨酸特异性突变为半胱氨酸的一类单域抗体。
[0024]
优选地,所述的单域抗体为抗5t4抗体(如n501,见专利201611040981.8)或抗sars
‑
cov
‑
2抗体(如n3130,见专利202010239592.8)。
[0025]
进一步优选地,所述的抗5t4抗体、抗sars
‑
cov
‑
2抗体的氨基酸序列分别如seq id no:1、seq id no:3所示。
[0026]
本发明中所述的抗原是指可诱发免疫反应、产生特定抗体且暴露在病原体外部的生物大分子。
[0027]
优选地,所述的抗原为5t4抗原,具体指在多种肿瘤中也有较高表达,而正常的组织中几乎不存在的一类富含亮氨酸结构(lrr)的跨膜蛋白。
[0028]
进一步优选地,所述的5t4抗原的氨基酸序列如seq id no:2所示。
[0029]
进一步地,所述的偶联为共价偶联。共价偶联是指由几个相邻原子通过共用电子并与共用电子之间形成稳定化学键的偶联方式。
[0030]
一种近红外二窗荧光免疫探针的制备方法,该方法包括以下步骤:
[0031]
1)将单域抗体与还原剂混合,之后振荡反应,再加入溶解在有机溶剂中的近红外荧光染料,得到混合物;
[0032]
2)将步骤1)中的混合物加入至脱盐柱,除去残余的近红外荧光染料,之后离心收集上清液,即得到所述的近红外二窗荧光免疫探针。
[0033]
进一步地,步骤1)中,所述的还原剂是指可将二硫键还原为巯基的一类无机或有机分子,在本发明中用于破坏抗体的二硫键,选自各种有机和无机还原剂,包括但不限于磷酸三(2
‑
氯乙基)酯、二乙基三胺五乙酸或5,5
’‑
二硫代双(2
‑
硝基苯甲酸),优选为磷酸三(2
‑
氯乙基)酯。所述的有机溶剂为n,n
‑
二甲基甲酰胺、n,n
‑
二甲基乙酰胺或二甲基亚砜。
[0034]
进一步地,步骤1)中,振荡反应过程中,反应温度为4
‑
60℃(优选为37℃),反应时间为50
‑
70min(优选为60min);步骤2)中,离心过程中,离心温度为3
‑
5℃(优选为4℃),离心时间为0.5
‑
1.5min(优选为1min),离心转速为7000
‑
9000r/min(优选为8000r/min)。
[0035]
一种近红外二窗荧光免疫探针在荧光活体成像技术中的应用。荧光活体成像技术包括肿瘤靶向、血管成像、体内循环示踪及手术指导等。
[0036]
具体而言,近红外二窗荧光免疫探针在荧光活体成像技术中制备检测溶液与成像的方法如下:
[0037]
(1)将本发明的近红外二窗荧光免疫探针溶解在pbs中,之后用于溶液中荧光量子效率测量。
[0038]
(2)将本发明的近红外二窗荧光免疫探针用于抗原亲和力测试。
[0039]
(3)将本发明的近红外二窗荧光免疫探针用于表达对应抗原的细胞亲和力测试。
[0040]
(4)将本发明的近红外二窗荧光免疫探针用于对应抗原混合后的荧光强度测试。
[0041]
(5)将本发明的近红外二窗荧光免疫探针用于对应抗原和无关抗原混合后的荧光强度测试。
[0042]
(6)将本发明的近红外二窗荧光免疫探针用于腹部血管成像及腹部皮下瘤成像。
[0043]
(7)将本发明的近红外二窗荧光免疫探针用于腹部转移瘤成像。
[0044]
(8)将本发明的近红外二窗荧光免疫探针用于体内循环示踪。
[0045]
本发明中,近红外荧光染料与单域抗体偶联致使荧光特异性增强的机理如图1所示,具体为:抗原与抗体结合过程中,辅助增强了染料icgm的tict(twisted intramolecular charge transfer,分子内键角扭曲)效应,从而导致荧光增强。
[0046]
与现有技术相比,本发明具有以下特点:
[0047]
1)本发明中的荧光免疫探针为近红外荧光染料与单域抗体的偶联物,是首个基于单域抗体的近红外二窗荧光免疫探针,其最大吸收和发射在近红外一窗(650
‑
900nm)区域,与抗原结合后其近红外二窗(1000
‑
1700nm)区域内的荧光强度大幅度增强,从而使其具有较低的光散射、较高的活体成像分辨率、较深的穿透深度及较低的用量,可应用于生物大分子的标记、跟踪和活体成像。
[0048]
2)本发明首次在近红外二窗观察到特异性的抗体抗原结合导致的荧光增强现象;
[0049]
3)本发明中的荧光免疫探针具有单一组分、成本低廉、生物安全、适于成药等优势。
附图说明
[0050]
图1为近红外荧光染料与单域抗体偶联致使荧光特异性增强的机理示意图。
[0051]
图2为本发明中荧光免疫探针的制备过程示意图。
[0052]
图3为实施例1中近红外荧光染料的制备过程示意图。其中,y选自卤素。
[0053]
图4为实施例3中近红外荧光染料icgm的制备过程示意图。
[0054]
图5为实施例3中近红外荧光染料icgm的中间体(3)的结构核磁表征图。
[0055]
图6为实施例3中近红外荧光染料icgm的中间体(6)的结构核磁表征图。
[0056]
图7为实施例3中近红外荧光染料icgm的中间体(7)的结构核磁表征图。
[0057]
图8为实施例3中近红外荧光染料icgm的中间体(8)的结构核磁表征图。
[0058]
图9为实施例3中近红外荧光染料icgm的结构核磁表征图。
[0059]
图10为实施例3中近红外荧光染料icgm与目标抗体共价偶联后得到的icgm
‑
n501及目标抗体n501的sds
‑
page胶图(a)和高效液相色谱图(b)。
[0060]
图11为实施例3中近红外荧光染料icgm与目标抗体共价偶联后得到的icgm
‑
n501的紫外可见光谱图和近红外二窗荧光发射光谱图。
[0061]
图12为实施例3中近红外荧光染料icgm、n501、icgm
‑
n501和无关抗体对目标抗原的亲和力测试图。
[0062]
图13为实施例3中近红外荧光染料icgm
‑
n501被表达目标抗原的癌细胞摄取得到的细胞流式图。
[0063]
图14为实施例3中近红外荧光染料icgm与目标抗体共价偶联后得到的icgm
‑
n501与目标抗原和无关抗原物理性混合后得到的近红外二窗荧光光谱图;其中,a为icgm
‑
n501加入不同浓度的目标抗原后的荧光光谱图;b为icgm
‑
n501加入目标抗原至荧光强度无变化后继续加入无关抗原后得到的对应荧光光谱图;c为icgm及icgm
‑
n501加入同浓度目标抗原和无关抗原后得到的对应荧光光谱图。
[0064]
图15为实施例3中近红外荧光染料icgm与目标抗体共价偶联后得到的icgm
‑
n501
在腹部皮下瘤模型中的活体成像图;其中,a为雌性裸鼠的明场(9周大);b为以808激光器为激发光源(2mw
·
cm
‑2)和1200nm长通滤光片滤去杂光在0分钟得到的腹部成像图,f为相应的3d
‑
图片统计构建和(inset f)二维高斯拟合曲线计算统计图;c为以808激光器为激发光源(2mw
·
cm
‑2)和1200nm长通滤光片滤去杂光在10分钟得到的腹部成像图,g为相应的3d
‑
图片统计构建和(inset g)二维高斯拟合曲线计算统计图;d为以808激光器为激发光源(2mw
·
cm
‑2)和1200nm长通滤光片滤去杂光在158分钟得到的腹部成像图,h为相应的3d
‑
图片统计构建和(inset h)二维高斯拟合曲线计算统计图;e为同一小鼠注射d(
‑
)
‑
荧光素(20mg
·
kg
‑1)20min后,在585
‑
735nm处进行生物荧光成像图,i为手术剥出的肿瘤明场和对应的免疫组化分析图。
[0065]
图16为是实施例3中近红外荧光染料icgm与目标抗体共价偶联后得到的icgm
‑
n501在腹膜转移瘤模型中的活体成像图;其中,a为9周大雌鼠的明场图,b为其在nir
‑
i生物成象仪上585
‑
735nm范围内腹腔注射d(
‑
)
‑
荧光素(670μmol
·
kg
‑1)20分钟后得到的成像图,f为对应的2d荧光强度统计图谱;c为同一小鼠静脉注射icgm
‑
n501(0.21μmol/kg
‑1)后的明场成像图,d为注射后46min的nir
‑
ii生物成像,i为相应的二维荧光强度统计图谱;e为d(
‑
)
‑
荧光素和icgm
‑
n501的结构、外观和用量示意图;g为用于成像的小鼠解剖明场图,h、j至q为以icgm
‑
n501生物成像图为指导切除的组织的成像图及相应的免疫组化分析图。nir
‑
ii生物成像仪器采用1200nm长通滤光片和808nm激光器,功率密度为2mw
·
cm
‑2。
[0066]
图17为实施例3中近红外荧光染料icgm与目标抗体共价偶联后得到的icgm
‑
n501在腹膜转移瘤模型中的体内循环图。
[0067]
图18为实施例7中花菁类荧光染料的核磁氢谱表征图。
[0068]
图19为实施例7中花菁类荧光染料的核磁碳谱表征图。
[0069]
图20为实施例8中罗丹明类荧光染料修饰上马来酰亚胺基团的步骤示意图。
[0070]
图21为实施例8中罗丹明类荧光染料中间体rh的核磁氢谱表征图。
[0071]
图22为实施例8中罗丹明类荧光染料中间体rh的核磁碳谱表征图。
[0072]
图23为实施例8中罗丹明类荧光染料rhm的核磁氢谱表征图。
[0073]
图24为实施例8中罗丹明类荧光染料rhm的核磁碳谱表征图。
[0074]
图25为实施例8中罗丹明类荧光染料rhm修饰抗体n3130后得到的偶联物n3130
‑
rhm的紫外可见吸收光谱图及荧光光谱图汇总。
[0075]
图26为抗体n3130加入同浓度目标抗原和无关抗原后得到的对应近红外二窗荧光光谱图。
具体实施方式
[0076]
下面结合附图和具体实施例对本发明进行详细说明。本实施例以本发明技术方案为前提进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
[0077]
为了能更彻底地理解发明,以下列出一些定义。上述定义意在包含语法等同成分。
[0078]
本发明中的“近红外”意指红外光(near infrared,nir),是介于可见光(vis)和中红外光(mir)之间的电磁波,习惯上又将近红外区划分为近红外一区(750
‑
900nm)和近红外二区(1000
‑
1700nm)两个区域。近红外区域是人们最早发现的非可见光区域。
[0079]
本发明中“抗体偶联物”意指通过一个化学链接将具有生物活性的小分子连接到抗体上,抗体作为载体将小分子靶向运输到目标细胞中。
[0080]
本发明中“抗体”意指由基本上为公认的免疫球蛋白基因的全部或部分所编码的一种或多种多肽组成的蛋白质。所述公认的免疫球蛋白基因,例如在人中,包括kappa(κ)、lambda(λ)和重链基因座,其中包含了无数的可变区基因,以及分别编码igm、igd、igg、ige和iga同种型的恒定区基因mu(μ)、delta(δ)、gamma(γ)、epsilon(ε)、alpha(α)。本发明中的抗体意指包括全长抗体和抗体片段,以及来自任意生物体的天然抗体,工程抗体,或为试验、治疗目的或其它如下所进一步规定的目的而重组产生的抗体。术语“抗体”包括抗体片段,为本领域所公知,诸如fab、fab’、f(ab’)2、fv,scfv或抗体的抗原结合的其它亚序列,或通过修饰完整抗体或使用重组dna技术重新合成的那些抗体而产生的抗体片段。术语“抗体”包括单克隆以及多克隆抗体。抗体可以是拮抗剂、激动剂、中和性抗体、抑制性抗体或刺激性抗体。本发明的抗体可以是非人抗体、嵌合抗体、人源化抗体或完全人抗体。
[0081]
本发明中使用的“抗原”意指可以在动物体内刺激抗体产生或t细胞反应的化合物、组合物或物质,包括注射或吸收到动物体内的组合物,可以是蛋白质、糖类、脂质或其它病原体。
[0082]
本发明中使用的“氨基酸”意指20种天然存在的氨基酸之一或任一非天然类似物,它们可位于具体规定的位置。本发明中“蛋白质”意指至少两个共价连接的氨基酸,其包括蛋白质、多肽、寡肽和肽。蛋白质可由天然存在的氨基酸和肽键构成,或由合成的肽模拟物结构构成,该肽模拟物即“类似物”。因此本发明中使用的“氨基酸”或“肽残基”意指天然存在和合成的氨基酸。举例来说,对于本发明目的而言,高苯基丙氨酸、瓜氨酸和降亮氨酸被认为是用于本发明目的的氨基酸。“氨基酸”也包括诸如脯氨酸和羟脯氨酸的亚氨基酸残基。侧链可以是(r)或(s)构型。在优选的实施方案中,氨基酸以(s)或l
‑
构型存在。如果使用非天然存在的侧链,可使用非氨基酸取代,例如以阻止或延迟体内降解。
[0083]
除非另外说明,否则本发明使用的所有技术和科学术语具有与本公开所属领域的普通技术人员通常理解的含义相同的含义。除非上下文另有明确说明,否则单数术语“一”,“一个”和“该”包括复数指示物。尽管与本发明描述的那些类似或等同的方法和材料可用于本公开的实践或测试,但下文描述了合适的方法和材料。术语“包含”表示“包括”。本发明提及的所有出版物、专利申请、专利和其他参考文献均通过引用整体并入。如果发生冲突,将以本说明书(包括术语解释)为准。另外,材料、方法和实施例仅是说明性的而不是限制性的。
[0084]
实施例中使用的标准的重组dna技术和分子克隆技术是本领域所熟知的(ausubel,f.m等人,current protocols in molecular biology,greene publishing assoc.和wiley
‑
interscience出版),适用于微生物生长的材料和方法是本领域熟知的。主要化学、生物试剂购自kapa biosystems,new england biolabs,transgen biotech,thermo fisher scientific,omega bio
‑
tek等,或可按本领域已知方法制备(a)a.l.antaris,h.chen,k.cheng,y.sun,g.hong,c.qu,s.diao,z.deng,x.hu,b.zhang,x.zhang,o.k.yaghi,z.r.alamparambil,x.hong,z.chengh.dai,nat.mater.2016,15,235
‑
242.;(b)k.k.maiti,a.samanta,m.vendrell,k.s.soh,m.olivoy.t.chang,chem.commun.2011,47,3514
‑
3516.。
[0085]
实施例1:
[0086]
一种典型的近红外荧光染料的制备方法如图3所示,包括以下步骤:
[0087]
(1)中间体(2)的制备
[0088]
将化合物(1)溶解在溶剂1(甲苯、苯、二甲基亚砜、n,n
‑
二甲基甲酰胺或n,n
‑
二甲基乙酰胺等)中,逐滴加入盛有磺酸内酯的茄型瓶中,反应温度为40
‑
120℃(优选为110℃),反应时间优选2小时,得到中间体(2)。
[0089]
(2)中间体(3)的制备
[0090]
将中间体(a)和碱溶解在溶剂中,分批加入至盛有中间体(2)的茄形瓶中并搅拌,反应温度为40
‑
90℃(优选80℃),反应时间优选60分钟,得到中间体(3)。所述的碱选自各种有机碱或无机碱,优选碳酸钠、碳酸氢钠、碳酸钾、碳酸氢钾或乙酸钾。所述的溶剂选自乙酸酐、乙酸、n,n
‑
二甲基甲酰胺、n,n
‑
二甲基乙酰胺或二甲基亚砜等。
[0091]
(3)中间体(5)的制备
[0092]
将化合物(4)和化合物(b)固体状态下研磨至混合均匀,反应温度为100
‑
200℃(优选140℃),反应时间优选2小时,得到中间体(5)。
[0093]
(4)中间体(6)的制备
[0094]
将化合物(5)溶解在含有(boc)2o和铵盐的溶剂2中,反应温度为40
‑
90℃(优选60℃),反应时间优选6小时,得到中间体(6)。所述的铵盐选自三乙胺、二乙胺或dipea等,优选为三乙胺,所述的溶剂2选自甲苯、苯、二甲基亚砜、n,n
‑
二甲基甲酰胺、n,n
‑
二甲基乙酰胺、三氯甲烷、二氯甲烷、乙腈或乙酸乙酯等,优选三氯甲烷。
[0095]
(5)中间体(7)的制备
[0096]
将中间体(6)和碱溶解在溶剂中,分批加入至盛有中间体(3)的茄形瓶中并搅拌,反应温度为40
‑
90℃(优选80℃),反应时间优选60分钟,得到化合物(7)。所述的碱选自各种有机碱或无机碱,优选碳酸钠、碳酸氢钠、碳酸钾、碳酸氢钾或乙酸钾。所述的有机溶剂选自乙酸酐、乙酸、n,n
‑
二甲基甲酰胺、n,n
‑
二甲基乙酰胺、二甲基亚砜等。
[0097]
(6)中间体(8)的制备
[0098]
将中间体(7)溶解在溶剂3中后加入到含有酸的茄形瓶中,搅拌反应,反应温度为40
‑
90℃(优选60℃),反应时间优选6小时,得到中间体(8)。所述的酸选自各种有机酸或无机酸,优选三氟乙酸、乙酸、甲酸或盐酸等,所述的溶剂3选自甲苯、苯、二甲基亚砜、n,n
‑
二甲基甲酰胺、n,n
‑
二甲基乙酰胺、三氯甲烷、二氯甲烷、乙腈或乙酸乙酯等,优选三氯甲烷。
[0099]
(7)化合物(9)的制备
[0100]
将中间体(8)溶解在溶剂3中后加入到含有化合物(c)和碱的茄形瓶中,搅拌反应,反应温度为25
‑
60℃(优选37℃),反应时间优选6小时,得到化合物(9)。所述的碱选自各种有机碱或无机碱,优选碳酸钠、碳酸氢钠、碳酸钾、碳酸氢钾或乙酸钾。所述的溶剂3选自甲苯、苯、二甲基亚砜、n,n
‑
二甲基甲酰胺、n,n
‑
二甲基乙酰胺、三氯甲烷、二氯甲烷、乙腈或乙酸乙酯等,优选三氯甲烷。
[0101]
实施例2:
[0102]
近红外荧光染料与单域抗体的偶联物的制备按图2所示步骤进行,具体如下:
[0103]
(1)单域抗体和还原剂混合后,振荡反应一段时间,近红外荧光染料溶解在有机溶剂中,分批加入至盛有抗体和还原剂的混合液中,得到混合物。还原剂用于破坏抗体的二硫
键,选自各种有机和无机还原剂,优选磷酸三(2
‑
氯乙基)酯、二乙基三胺五乙酸、5,5'
‑
二硫代双(2
‑
硝基苯甲酸)。有机溶剂选自n,n
‑
二甲基甲酰胺、n,n
‑
二甲基乙酰胺、二甲基亚砜等,反应温度为4
‑
60℃,优选37℃,反应时间优选60分钟。
[0104]
(2)将步骤(1)所得混合物加入脱盐柱。收集小分子染料对应颜色的流分,在离心机上离心一段时间,收上清液。离心温度优选4℃,离心时间优选1分钟,离心转速优选8000rpm。得到目标近红外荧光染料与单域抗体的偶联物。
[0105]
实施例3:
[0106]
一种近红外荧光染料icgm的制备按图4所示步骤进行,具体如下:
[0107]
(1)中间体(2)的制备
[0108]
化合物(1)(2.09g,10mmol)溶解在5ml甲苯中,逐滴加入盛有1,3
‑
丙烷磺酸内酯的茄型瓶中,在110℃反应8小时,过滤收集暗灰色固体,用20ml三氯甲烷分三次洗涤,得到中间体(2)。
[0109]
(2)中间体(3)的制备
[0110]
将中间体(2)(3.31g,10mmol)和盐酸谷氨酸二胍(2.85g,10mmol)加入含有乙酸酐(3ml)和乙酸钾(0.98g,10mmol)的50ml圆底瓶中。整个混合物加热至70℃后保持1小时,冷却至室温,倒入饱和碳酸氢钠溶液中。红色沉淀用乙醚洗涤。最终产物经洗脱剂ch2cl2/meoh(20/1;v/v)过柱分离,得到红色固体。1h nmr(400mhz,cd3od)δ7.40(dd,j=11.0,5.8hz,2h),7.32(d,j=8.9hz,1h),7.27(d,j=8.2hz,1h),7.20(dd,j=15.0,11.3hz,1h),7.00(d,j=8.9hz,1h),6.94(t,j=7.2hz,1h),6.85(t,j=7.2hz,1h),6.77(t,j=7.9hz,3h),6.59
–
6.53(m,1h),6.50(d,j=15.0hz,1h),6.43(d,j=8.1hz,2h),5.80(dd,j=14.2,11.3hz,1h),4.64(dd,j=13.6,11.7hz,1h),4.54(dd,j=3.5,2.5hz,1h),4.08
–
4.00(m,2h),2.18
–
2.10(m,2h),1.17(s,9h).emi
‑
ms:calcd(c
31
h
32
n2o4s):528.66,found:527.70[m
‑
1].
[0111]
(3)中间体(5)的制备
[0112]
将化合物(4)(4.18g,20mmol)和2
‑
溴乙胺氢溴化物(2.04g,10mmol)碾磨后加入到圆底烧瓶中,加热至130℃反应8小时。将混合物冷却至室温,用30ml氯仿洗涤得到红灰色沉淀。emi
‑
ms:calcd(c17h21n2):253.36,found:254.14。
[0113]
(4)中间体(6)的制备
[0114]
将中间体(5)(3.48g,10mmol)、二碳酸二叔丁酯(2.18g,10mmol)加入含n,n
’‑
二异丙基乙胺(3.23g,25mmol)的三氯甲烷30ml中。将混合物加热至60℃,加热6小时。最后的溶液用水清洗,然后用乙醚萃取。最终产物经洗脱剂ch2cl2/meoh(50/1;v/v)柱层析分离,得到中间体(6)。1h nmr(400mhz,cdcl3)δ7.93(d,j=8.5hz,1h),7.73(d,j=8.2hz,1h),7.65(d,j=8.7hz,1h),7.36(t,j=7.7hz,1h),7.16(t,j=7.5hz,1h),7.02(d,j=8.6hz,1h),4.65(t,j=7.0hz,1h),3.95(s,2h),3.76(t,j=5.5hz,2h),3.47
–
3.33(m,2h),1.64(s,6h),1.42(d,j=12.0hz,10h).
[0115]
(5)中间体(7)的制备
[0116]
将中间体(3)(0.528g,1mmol)和中间体(6)(0.353g,1mmol)加入含有乙酸酐(3ml)和乙酸钾(0.098g,10mmol)的50ml圆底烧瓶中。将混合物全部加热至80℃后保持10分钟,变绿,冷却至室温,用乙醚洗涤。绿色沉淀经层析纯化,洗脱剂为ch2cl2/meoh(20/1;v/v),得到
2020,27,891
‑
898e895;nat.mater.2016,15,235
‑
242.)。
[0125]
附图10为近红外荧光染料icgm与目标抗体共价偶联后得到的icgm
‑
n501及目标抗体n501的sds
‑
page胶图(a)和高效液相色谱图(b),结果显示所得产物icgm
‑
n501稳定均一。
[0126]
实施例5:
[0127]
近红外荧光免疫探针的性能实验
[0128]
1.icgm
‑
n501的紫外可见吸收光谱和荧光发射光谱
[0129]
图11为荧光染料icgm与目标抗体共价偶联后得到的icgm
‑
n501的紫外可见光谱图和近红外二窗荧光发射光谱图;icgm
‑
n501的浓度为6.7μm,激发光源为808nm激光器(北京品傲光电科技有限公司)。如图11所示,6.7μm溶于pbs的icgm
‑
n501溶液在780nm处有吸收,在1050nm处发射。
[0130]
2.icgm
‑
n501的亲和力测试
[0131]
图1为荧光染料icgm、n501、icgm
‑
n501和无关抗体对目标抗原(5t4抗原,购买自博奥派克生物公司)的基于酶联免疫吸附测定法(elisa)的亲和力测试图(具体检测方法和步骤见文献cell host microbe 2020)。亲和力测试结果显示抗体n501和荧光染料icgm的共价偶联对亲和力无影响。
[0132]
3.icgm
‑
n501的细胞亲和力测试
[0133]
图13为荧光染料icgm
‑
n501被表达目标抗原的癌细胞(购自明舟生物)摄取得到的细胞流式图。具体实验步骤或方法引自文献mabs
‑
austin 2015,7,922
‑
930。如图13所示,四种表达目标5t4抗原的细胞系4t1乳腺癌细胞系,skov
‑
3卵巢癌细胞系,mda
‑
mb
‑
468胃癌细胞系和pa
‑
1胃癌细胞系均对icgm
‑
n501有不同程度的摄取,印证其细胞层次上的亲和力。
[0134]
4.icgm
‑
n501与目标抗原结合引起的特异性近红外二窗荧光增强现象
[0135]
图14为荧光染料icgm与目标抗体共价偶联后得到的icgm
‑
n501与目标抗原和无关抗原物理性混合后得到的近红外二窗荧光光谱图;其中,(a)是icgm
‑
n501(1.4μmol
·
l
‑1)加入不同浓度(4.45nmol
·
l
‑1/次)的目标抗原后的荧光光谱图,可以观察到随着5t4抗原的加入,近红外二窗范围内的荧光强度在逐渐增强,且到一定浓度(22.25nmol
·
l
‑1)后,该荧光强度趋于不变;(b)属于竞争性试验,是对icgm
‑
n501加入目标抗原至荧光强度无变化后继续加入无关抗原后得到的对应荧光光谱图进行了总结,无关抗原包括il
‑
15rβ、gp140、mesothelin、tim3
‑
ecd和vegf,均未能引起荧光强度的增强;(c)是icgm及icgm
‑
n501加入同浓度(4.45nmol
·
l
‑1)目标抗原和无关抗原il
‑
15rβ、gp140、mesothelin、tim3
‑
ecd和vegf后得到的对应荧光光谱图,虽然无关抗原也引起了荧光强度的变化,但是大多数是荧光强度降低或小幅度增强。以上实验证明,icgm
‑
n501与目标抗原的特异性结合可以引起近红外二窗范围内荧光的特异性增强。
[0136]
实施例6:
[0137]
近红外荧光免疫探针的应用实验:
[0138]
1.icgm
‑
n501作为血管造影剂的应用
[0139]
如图15为荧光染料icgm与目标抗体共价偶联后得到的icgm
‑
n501在腹部皮下瘤模型中的活体成像图。分别收集了同只9周大雌性裸鼠(购自南通特洛菲饲料科技有限公司)的明场图片(a)、腹腔注射d(
‑
)
‑
荧光素(购自百灵威科技有限公司)(20mg
·
kg
‑1)20min后,在585
‑
735nm处进行生物荧光成像(e)及腹腔注射icgm
‑
n501(0.21μmol/kg
‑1)后以808激光
器(北京品傲光电科技有限公司)为激发光源(2mw
·
cm
‑2)和1200nm长通滤光片滤去杂光在0分钟(b)、10分钟(c)和158分钟(h)得到的腹部成像图,近红外二窗成像所用激光器为808激光器(2mw
·
cm
‑2),所用的滤去杂光的滤光片为1200nm长通滤光片(北京品傲光电科技有限公司)。以上成像图可以发现,icgm
‑
n501不仅可以提供腹膜皮下瘤的成像图,还可以提供腹部血管的分布成像图。对近红外二窗的手术剥出的肿瘤进行拍摄和免疫组化分析(具体分析方法引自文献nat commun 2018,9,2898.),可以发现,剥出肿瘤的大小与基于近红外二窗成像图计算得到的肿瘤大小相吻合。以上实验印证了icgm
‑
n501在血管成像和肿瘤靶向上的应用。
[0140]
2.icgm
‑
n501在靶向腹膜转移瘤上的应用
[0141]
如图16为荧光染料icgm与目标抗体共价偶联后得到的icgm
‑
n501在腹膜转移瘤模型中的活体成像图;其中,活体成像实验是在skov
‑
3卵巢癌细胞(购自明舟生物)注射后第21天进行的。首先通过荧光素酶反应确定肿瘤的位置(具体方法引自文献nat commun 2016,7,11856)。小鼠腹腔注射200μl d(
‑
)荧光素(购自百灵威科技有限公司)(20mg
·
ml
‑1)20分钟后,得到其明场图片(a)和生物发光成像图(b)。小鼠静脉注射icgm
‑
n501(0.21μmol
·
kg
‑1),以808nm激光为激发光源,在功率密度为2mw
·
cm
‑2的条件下于nir
‑
ii生物成像仪(andor technology)上成像,收集1200
‑
1700nm范围内的成像信号(f)并通过高斯二维校准进行分析(i)(具体方法引自文献nat.mater.2016,15,235
‑
242.)。之后在影像学图像引导下进行肿瘤切除,切除后的肿瘤送去做进一步的免疫组化分析(h、j
‑
q)(具体分析方法引自nat commun 2018,9,2898)。以上实验数据印证了icgm
‑
n501比生物发光的荧光强度要强,穿透深度要深,成像所得到的肿瘤影像是不规则的,与手术剥出来的肿瘤边缘更为吻合。印证了icgm
‑
n501在肿瘤靶向和指导手术上的应用潜力。
[0142]
3.icgm
‑
n501在体内的循环过程示踪
[0143]
如图17为荧光染料icgm与目标抗体共价偶联后得到的icgm
‑
n501尾静脉注射后在腹膜转移瘤模型中的体内循环图。可以观察到icgm
‑
n501在尾静脉注射后30
‑
48分钟内分布到肿瘤所在区域,从60分钟开始即出现从肝脏和肾脏代谢的现象,半衰期较短,更适宜于作为临床的诊断试剂。所用腹膜转移瘤模型是提前21天腹腔注射注射2
×
106个skov3卵巢癌细胞到小鼠腹膜后构成的。
[0144]
实施例7:
[0145]
花菁衍生物cy7.5 m的制备步骤参照实施例1,其核磁表征结果如下:
[0146]1h nmr(400mhz,dmso)δ8.35(dd,j=14.8,7.2hz,2h),8.29(d,j=7.5hz,1h),8.25(d,j=8.5hz,2h),8.15(t,j=5.8hz,1h),8.10
–
8.00(m,4h),7.84(d,j=8.8hz,1h),7.70(dd,j=13.0,8.9hz,2h),7.62(dd,j=14.5,7.7hz,2h),7.49(dd,j=15.6,8.2hz,2h),6.60(d,j=14.3hz,1h),6.38(t,j=14.3hz,2h),4.54
–
4.47(m,2h),4.39
–
4.30(m,4h),3.47(d,j=5.4hz,2h),3.40(dd,j=7.0,4.9hz,2h),2.75(dd,j=25.8,6.1hz,4h),2.58(t,j=6.6hz,2h),2.10
–
2.02(m,2h),1.92(s,10h),1.87
–
1.81(m,2h),1.59(s,3h).
[0147]
13
c nmr(126mhz,dmso)δ174.03,173.68,173.54,169.93,147.10,142.45,141.79,141.41,139.84,139.75,139.60,133.72,133.42,133.18,131.43,131.34,131.25,130.40,130.06,129.80,127.67,127.60,127.37,127.33,126.56,126.02,124.95,124.74,122.14,111.77,111.45,101.96,101.25,100.83,54.82,50.67,50.53,48.47,47.59,43.49,43.38,
43.01,36.58,26.90,26.70,25.92,25.82,23.69,22.33,20.48.
[0148]
图18、图19是其结构核磁表征图。
[0149]
实施例8:
[0150]
罗丹明类近红外染料rhm按图20所示的合成路径进行制备。取还原剂tcep(购自默克sigma
‑
aldrich化学试剂)与抗sars
‑
cov
‑
2抗体n3130(抗体的氨基酸序列如seq id no:3所示)以3:1的摩尔比混合,于37℃反应1小时,使n3130键间二硫键打开。将化合物rhm(0.34g,0.05mmol)和dipea(0.006g,0.05mmol)加入到含有tstu(0.02g,0.05mmol)、3
‑
马来酰亚胺丙酸(0.009g,0.05mmol)和2ml ch2cl2的圆底瓶中。全部搅拌6小时,通过tlc薄板层析跟踪。加入乙酸乙酯,高速离心得绿色沉淀,在冻干机中干燥,溶解在30μl dmso,加入到已经打开二硫键的n3130溶液中,在4℃混合震荡,反应1小时,通过thermo scientific zeba脱盐柱除去残余的rhm。所得n3130
‑
rhm,8000rpm离心1分钟,取绿色上清液。
[0151]
其中,罗丹明类近红外染料中间体rh的核磁表征结果如下:
[0152]1h nmr(400mhz,dmso)δ12.78(s,1h),8.67(d,j=14.3hz,1h),8.55
–
8.49(m,2h),8.22(d,j=8.9hz,1h),8.10(td,j=7.8,1.2hz,2h),7.98
–
7.92(m,1h),7.77(t,j=7.5hz,1h),7.71
–
7.62(m,2h),7.29(d,j=7.5hz,1h),6.93(d,j=2.4hz,1h),6.60
–
6.49(m,2h),6.44(d,j=9.0hz,1h),4.80(dd,j=13.3,6.3hz,2h),3.47(q,j=6.9hz,4h),3.34(s,2h),2.64(t,j=5.2hz,2h),2.27
–
2.10(m,2h),1.70(dt,j=19.7,6.5hz,2h),1.51(t,j=7.1hz,3h),1.16(t,j=7.0hz,6h).
[0153]
13
c nmr(101mhz,dmso)δ167.48,158.73,154.81,153.85,150.57,144.84,141.73,140.01,138.86,136.18,134.12,133.63,133.09,131.27,131.02,130.32,130.18,129.35,127.17,126.67,126.59,121.04,120.19,117.92,112.61,112.25,110.11,107.84,97.20,44.91,44.48,26.98,24.71,20.66,13.34,13.08,12.92.
[0154]
图20、图21、图22是其合成路径图结构及中间体rh的核磁表征图。
[0155]
罗丹明类近红外染料rhm的核磁表征结果如下:
[0156]1h nmr(400mhz,dmso)δ8.67(d,j=13.9hz,1h),8.53(dd,j=14.9,7.0hz,2h),8.21(dd,j=18.2,9.3hz,1h),8.14
–
8.05(m,2h),8.00
–
7.90(m,1h),7.76(t,j=7.2hz,1h),7.63(ddd,j=22.2,13.9,7.6hz,3h),7.29(d,j=7.4hz,1h),6.93(d,j=16.0hz,1h),6.50(dt,j=25.3,8.8hz,2h),6.11(d,j=45.0hz,1h),4.80(d,j=6.6hz,2h),3.46(d,j=6.6hz,4h),3.02(ddd,j=28.3,14.7,9.5hz,3h),2.73(d,j=2.9hz,2h),2.61(s,2h),2.26
–
2.09(m,2h),1.80
–
1.64(m,3h),1.50(s,3h),1.16(t,j=6.8hz,5h),1.01
–
0.92(m,2h).
[0157]
13
c nmr(101mhz,dmso)δ171.53,167.46,158.73,154.81,153.84,150.56,141.75,140.02,136.18,134.99,134.11,133.08,131.29,131.01,130.22,129.34,127.77,127.20,127.16,126.59,121.01,120.18,117.92,112.25,110.11,107.83,97.24,54.94,44.48,42.49,36.70,34.58,26.98,25.74,24.70,20.67,16.13,14.78,13.35,13.08,12.88.
[0158]
图23、图24是其rhm的结构核磁表征图。
[0159]
实施例9:
[0160]
单域抗体n3130
‑
rhm的近红外二窗荧光增强现象
[0161]
n3130
‑
rhm按实施例8所示步骤制备,其中单域抗体n3130为抗sars
‑
cov
‑
2抗体。
fr3区的丝氨酸特异性突变为半胱氨酸的单域抗体,其氨基酸序列如seq id no:3所示。
[0162]
图25为实施例8中的荧光染料rhm与目标抗体共价偶联后得到的n3130
‑
rhm的吸收光谱和发射光谱;其中n3130
‑
rhm是一类吸收光谱处于近红外一窗区域的荧光试剂;图26为n3130
‑
rhm(1.4μmol
·
l
‑1)加入同浓度(4.45nmol
·
l
‑1)目标抗原sars
‑
cov
‑
2和无关抗原gp140、mesothelin、和tim3
‑
ecd后得到的对应荧光光谱图,虽然无关抗原也引起了荧光强度的变化,但是大多数是荧光强度降低或小幅度增强。以上实验证明,n3130
‑
rhm与目标抗原的特异性结合可以引起近红外二窗范围内荧光的特异性增强。
[0163]
上述的对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。