1.本发明涉及具有茚满骨架的马来酰亚胺、含有前述马来酰亚胺的固化性树脂组合物、由前述固化性树脂组合物得到的固化物。
背景技术:
2.作为电子设备用的电路基板的材料,正在广泛使用:使环氧树脂系、bt(双马来酰亚胺
‑
三嗪)树脂系等热固性树脂浸渗于玻璃布并进行加热干燥而得到的预浸料、将该预浸料加热固化而成的层叠板、将该层叠板和该预浸料组合并进行加热固化而成的多层板。其中,半导体封装基板正逐渐薄型化,安装时的封装体基板的翘曲成为问题,因此为了抑制这种情况,要求表现高耐热性的材料。
3.另外,近年来,信号的高速化、高频化在进展,期望提供可获得在这些环境下维持足够低的介电常数、并且表现足够低的介电损耗角正切的固化物的热固化性树脂组合物。
4.特别是,最近在各种电子材料用途、尤其是尖端材料用途中,要求耐热性、介电特性所代表的性能的进一步提高、及兼具所述性能的材料、组合物。
5.针对所述要求,马来酰亚胺树脂作为兼具耐热性和低介电常数/低介电损耗角正切的材料正受到关注。但是,以往的马来酰亚胺树脂虽然显示高耐热性,但其介电常数/介电损耗角正切值未达到尖端材料用途所要求的水平,而且因难溶剂溶解性而处理性差,因此强烈希望开发维持耐热性、并且显示进一步的低介电常数/低介电损耗角正切、并且溶剂溶解性也优异的树脂。
6.另外,使用以往的马来酰亚胺树脂的固化物与环氧树脂等相比,耐脆性差,对于得到的固化物也要求挠性、柔软性等。
7.其中,作为兼具高度的介电特性及耐热性的氰酸酯系材料,已知有将苯酚酚醛清漆型氰酸酯树脂、双酚a氰酸酯树脂和非卤素系环氧树脂配混而成的树脂组合物(参照专利文献1)。
8.但是,前述专利文献1记载的树脂组合物虽然固化物的耐热性和介电特性有一些程度改善,但关于耐热性,还未达到近些年要求的水准。
9.现有技术文献
10.专利文献
11.专利文献1:日本特开2004
‑
182850号公报
技术实现要素:
12.发明要解决的问题
13.因此,本发明要解决的问题在于,马来酰亚胺的溶剂溶解性、加热熔融时的流动性、及处理性优异,通过使用前述马来酰亚胺,提供耐脆性、挠性、柔软性、耐热性及介电特性优异的固化物。
14.用于解决问题的方案
15.因此,本发明人等为了解决上述问题而进行了深入研究,结果发现,溶剂溶解性、加热熔融时的流动性、及处理性优异、进而可以有助于耐脆性、耐热性及低介电常数/低介电损耗角正切的具有茚满骨架的马来酰亚胺、及由含有前述马来酰亚胺的固化性树脂组合物得到的固化物的耐脆性、挠性、柔软性、耐热性及介电特性优异,从而完成了本发明。
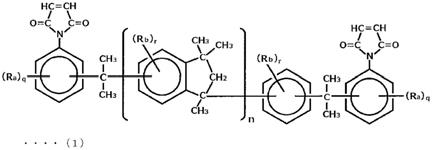
16.即,本发明的特征在于,具有下述通式(1)所示的茚满骨架。
[0017][0018]
(式(1)中,ra各自独立地表示碳数1~10的烷基、烷氧基或烷硫基、碳数6~10的芳基、芳氧基或芳硫基、碳数3~10的环烷基、卤素原子、硝基、羟基或巯基,q表示0~4的整数值。q为2~4时,ra在同一环内任选相同或不同。rb各自独立地表示碳数1~10的烷基、烷氧基或烷硫基、碳数6~10的芳基、芳氧基或芳硫基、碳数3~10的环烷基、卤素原子、羟基或巯基,r表示0~3的整数值。r为2~3时,rb在同一环内任选相同或不同。n为平均重复单元数,表示0.95~10.0的数值。)
[0019]
本发明的马来酰亚胺通过gpc测定得到的分子量分布(mw/mn)优选为1.0~4.0。
[0020]
本发明的马来酰亚胺优选前述式(1)中的ra为选自由碳数1~4的烷基、碳数3~6的环烷基及碳数6~10的芳基组成的组中的至少1种。
[0021]
本发明的马来酰亚胺优选前述式(1)中的q为2~3。
[0022]
本发明的马来酰亚胺优选前述式(1)中的r为0、rb为氢原子。
[0023]
本发明的马来酰亚胺优选前述式(1)中的r为1~3,rb为选自由碳数1~4的烷基、碳数3~6的环烷基及碳数6~10的芳基组成的组中的至少1种。
[0024]
本发明的马来酰亚胺优选前述马来酰亚胺总量100质量%中含有32面积%以下的n为0的前述马来酰亚胺。
[0025]
本发明的固化性树脂组合物优选含有前述马来酰亚胺。
[0026]
本发明的固化物优选由前述固化剂组合物得到。
[0027]
发明的效果
[0028]
本发明的马来酰亚胺的溶剂溶解性、加热熔融时的流动性及处理性优异,进而能够有助于耐脆性、耐热性、及低介电常数/低介电损耗角正切,因此由含有前述马来酰亚胺的固化性树脂组合物得到的固化物的耐脆性、挠性、柔软性、耐热性及介电特性优异,是有用的。
具体实施方式
[0029]
以下,详细地对本发明进行说明。
[0030]
本发明的特征在于,具有下述通式(1)所示的茚满骨架。
[0031][0032]
上述通式(1)中,ra各自独立地表示碳数1~10的烷基、烷氧基或烷硫基、碳数6~10的芳基、芳氧基或芳硫基、碳数3~10的环烷基、卤素原子、硝基、羟基或巯基,q表示0~4的整数值。q为2~4时,ra在同一环内任选相同或不同。rb各自独立地表示碳数1~10的烷基、烷氧基或烷硫基、碳数6~10的芳基、芳氧基或芳硫基、碳数3~10的环烷基、卤素原子、羟基或巯基,r表示0~3的整数值。r为2~3时,rb在同一环内任选相同或不同。n为平均重复单元数,表示0.95~10.0的数值。需要说明的是,前述r及前述q为0的情况下,ra及rb分别指氢原子。
[0033]
前述马来酰亚胺具有茚满骨架,从而与一直以来的马来酰亚胺相比,前述马来酰亚胺的结构中极性官能团的比例少,因此使用前述马来酰亚胺而制造的固化物的介电特性优异,因此优选。另外,使用以往的马来酰亚胺树脂的固化物有脆的倾向,担心耐脆性差,但通过使前述马来酰亚胺具有茚满骨架,挠性及柔软性优异,也可期待耐脆性的改善,是优选的。
[0034]
另外,上述通式(1)的ra优选为碳数1~4的烷基、碳数3~6的环烷基、碳数6~10的芳基中的任意者,通过为前述碳数1~4的烷基等,是溶剂溶解性因马来酰亚胺基附近的平面性的降低、结晶性降低而提高、并且可在不损害马来酰亚胺基的反应性下得到固化物的优选的方式。
[0035]
上述通式(1)中的q优选为2~3、更优选为2。前述q为2的情况下,立体位阻的影响小,芳香环上的电子密度提高,在马来酰亚胺的制造(合成)中是优选的方式。
[0036]
优选上述通式(1)中的r为0,rb为氢原子,另外,优选r为1~3、rb为选自由碳数1~4的烷基、碳数3~6的环烷基、及碳数6~10的芳基组成的组中的至少1种,特别是通过使前述r为0、且rb为氢原子,从而在马来酰亚胺中的茚满骨架的形成时立体位阻变少,对于马来酰亚胺的制造(合成)有利,是优选的方式。
[0037]
<具有茚满骨架的马来酰亚胺的制造方法>
[0038]
以下对前述马来酰亚胺的制造方法进行说明。
[0039]
下述通式(2)为下述化合物:rc各自独立地表示选自由下述通式(3)及(4)组成的组中的一价的官能团,2个rc中的至少一个rc的邻位为氢原子,rb及r表示与上述同样的含义。
[0040][0041][0042]
下述通式(5)为:氨基的邻位、对位中的至少1个为氢原子、ra及q分别表示与前述同样的含义的苯胺或其衍生物,通过使上述通式(2)的化合物与下述通式(5)的化合物在酸催化剂存在下反应,能够得到下述通式(6)所示的中间体胺化合物。需要说明的是,下述通式(6)中的ra、rb、q、及r表示与上述同样的含义。
[0043][0044]
上述通式(6)所示的中间体胺化合物中,在结构中包含具有茚满骨架的下述通式(7),但上述通式(5)所示的苯胺或其衍生物中,q为3以下、并且氨基的邻位和对位中的至少2个为氢原子的情况下,为下述通式(8)所示的结构。其中,下述通式(8)中的ra、rb、q及r与前述相同,m为重复单元数,表示1~20的整数值。另外,下述通式(8)所示的结构有时也包含在上述通式(6)的结构中。
[0045][0046]
作为前述马来酰亚胺的特征的茚满骨架(参照上述通式(7))中,对于平均重复单元数n,为了成为低熔点(低软化点)、并且熔融粘度低、处理性优异,以平均重复单元数n(平均值)计为0.95~10.0,优选为0.98~8.0、更优选为1.0~7.0、进一步优选为1.1~6.0。通过使前述马来酰亚胺的结构中具有茚满骨架,从而与一直以来使用的马来酰亚胺相比,溶剂溶解性优异,是优选的方式。需要说明的是,前述n不足0.95时,前述马来酰亚胺的结构中的高熔点物质的含有比例变高、溶剂溶解性差、进而对挠性有贡献的高分子量成分的比例低,因此有得到的固化物的耐脆性降低、进而挠性、柔软性也降低的担心,不优选。另外,前述n超过10.0时,溶解于溶剂时粘度变高,进而有得到的固化物的耐热性差的担心,进而高分子量成分变得过多,形成固化物时,有流动性降低、处理性差的担心,不优选。另外,作为前述n的值,从固化物的高热变形温度、高玻璃化转变温度等观点出发,特别优选0.98~8.0。
[0047]
本发明中使用的上述通式(2)所示的化合物(以下,“化合物(a)”)没有特别限定,典型而言,使用对二异丙烯基苯及间二异丙烯基苯、对双(α
‑
羟基异丙基)苯及间双(α
‑
羟基异丙基)苯、1
‑
(α
‑
羟基异丙基)
‑3‑
异丙烯基苯、1
‑
(α
‑
羟基异丙基)
‑4‑
异丙烯基苯或它们的混合物。另外也可以使用这些化合物的核烷基取代物、例如二异丙烯基甲苯及双(α
‑
羟基异丙基)甲苯等,进而也可以使用核卤素取代物、例如氯二异丙烯基苯及氯双(α
‑
羟基异丙基)苯等。
[0048]
此外,作为前述化合物(a),例如,可示例出2
‑
氯
‑
1,4
‑
二异丙烯基苯、2
‑
氯
‑
1,4
‑
双(α
‑
羟基异丙基)苯、2
‑
溴
‑
1,4
‑
二异丙烯基苯、2
‑
溴
‑
1,4
‑
双(α
‑
羟基异丙基)苯、2
‑
溴
‑
1,3
‑
二异丙烯基苯、2
‑
溴
‑
1,3
‑
双(α
‑
羟基异丙基)苯、4
‑
溴
‑
1,3
‑
二异丙基苯、4
‑
溴
‑
1,3
‑
双(α
‑
羟基异丙基)苯、5
‑
溴
‑
1,3
‑
二异丙烯基苯、5
‑
溴
‑
1,3
‑
双(α
‑
羟基异丙基)苯、2
‑
甲氧基
‑
1,4
‑
二异丙烯基苯、2
‑
甲氧基
‑
1,4
‑
双(α
‑
羟基异丙基)苯、5
‑
乙氧基
‑
1,3
‑
二异丙烯基苯、5
‑
乙氧基
‑
1,3
‑
双(α
‑
羟基异丙基)苯、2
‑
苯氧基
‑
1,4
‑
二异丙烯基苯、2
‑
苯氧基
‑
1,4
‑
双(α
‑
羟基异丙基)苯、2,4
‑
二异丙烯基苯硫醇、2,4
‑
双(α
‑
羟基异丙基)苯硫醇、2,5
‑
二异丙烯基苯硫醇、
2,5
‑
双(α
‑
羟基异丙基)苯硫醇、2
‑
甲硫基
‑
1,4
‑
二异丙烯基苯、2
‑
甲硫基
‑
1,4
‑
双(α
‑
羟基异丙基)苯、2
‑
苯硫基
‑
1,3
‑
二异丙烯基苯、2
‑
苯硫基
‑
1,3
‑
双(α
‑
羟基异丙基)苯、2
‑
苯基
‑
1,4
‑
二异丙烯基苯、2
‑
苯基
‑
1,4
‑
双(α
‑
羟基异丙基)苯、2
‑
环戊基
‑
1,4
‑
二异丙烯基苯、2
‑
环戊基
‑
1,4
‑
双(α
‑
羟基异丙基)苯、5
‑
萘基
‑
1,3
‑
二异丙烯基苯、5
‑
萘基
‑
1,3
‑
双(α
‑
羟基异丙基)苯、2
‑
甲基
‑
1,4
‑
二异丙烯基苯、2
‑
甲基
‑
1,4
‑
双(α
‑
羟基异丙基)苯、5
‑
丁基
‑
1,3
‑
二异丙烯基苯、5
‑
丁基
‑
1,3
‑
双(α
‑
羟基异丙基)苯、5
‑
环己基
‑
1,3
‑
二异丙烯基苯、5
‑
环己基
‑
1,3
‑
双(α
‑
羟基异丙基)苯等。
[0049]
需要说明的是,作为前述化合物(a)中所含的取代基,没有特别限定,可以使用上述示例的化合物,立体位阻大的取代基的情况下,与立体位阻小的取代基相比,不易发生得到的马来酰亚胺彼此的堆积,不易引起马来酰亚胺彼此的结晶化,即,马来酰亚胺的溶剂溶解性提高,是优选的方式。
[0050]
另外,作为上述通式(5)所示的化合物(以下,“化合物(b)”),典型而言,除了苯胺以外,例如还可以使用二甲基苯胺、二乙基苯胺、二异丙基苯胺、乙基甲基苯胺、环丁基苯胺、环戊基苯胺、环己基苯胺、氯苯胺、二氯苯胺、甲苯胺、二甲苯胺、苯基苯胺、硝基苯胺、氨基苯酚及环己基苯胺等。另外,可示例出甲氧基苯胺、乙氧基苯胺、苯氧基苯胺、萘氧基苯胺、氨基硫醇、甲硫基苯胺、乙硫基苯胺及苯硫基苯胺。
[0051]
需要说明的是,如以往的马来酰亚胺(例如,n
‑
苯基马来酰亚胺)那样马来酰亚胺基直接键合于苯环的情况下,苯环与马来酰亚胺的5元环在同一平面上排列的状态稳定,因此变得容易堆积,会表现出高结晶性。因此,成为溶剂溶解性差的原因。与此相对,本发明的情况下,作为前述化合物(b),没有特别限定,可以使用上述示例的化合物,此外,例如,如2,6
‑
二甲基苯胺那样,具有甲基作为取代基的情况下,因甲基的立体位阻而苯环与马来酰亚胺的5元环呈扭曲的构象,变得不易堆积,因此结晶性降低,溶剂溶解性提高,是优选的方式。其中,若立体位阻过大,则也担心马来酰亚胺的合成时阻碍反应性的情况,因此优选使用例如具有碳数2~4的烷基的化合物(b)。
[0052]
本发明中使用的上述通式(6)所示的中间体胺化合物的制造方法中,将前述化合物(a)和前述化合物(b)以前述化合物(b)相对于前述化合物(a)的摩尔比(化合物(b)/化合物(a))优选为0.1~2.0、更优选为0.2~1.0投入并反应(第1阶段)后,进而将前述化合物(b)以相对于先前加入的前述化合物(a)的摩尔比计优选为0.5~20.0、更优选为0.7~5.0的量进一步加入进行反应(第2阶段),由此能够得到具有茚满骨架的马来酰亚胺。另外,该2个阶段的反应从为了使反应结束或处理性等方面出发均获得了优选的结果。需要说明的是,在第1阶段的反应中,前述化合物(b)以相对于先前加入的前述化合物(a)的摩尔比(化合物(b)/化合物(a))计优选设为0.10~0.49、更优选设为0.20~0.39,从而分子量分布广,低分子量的高熔点物质的含有比例变低,高分子量成分的比例变高,因此能够得到溶剂溶解性优异、进而可以有助于挠性、耐脆性的中间体胺化合物及马来酰亚胺,是优选的。
[0053]
前述反应中使用的酸催化剂例如可以举出磷酸、盐酸、硫酸这样的无机酸、草酸、苯磺酸、甲苯磺酸、甲磺酸、氟甲磺酸等有机酸、活性白土、酸性白土、硅铝、沸石、强酸性离子交换树脂这样的固体酸、杂多酸盐等,反应后可通过过滤简便地去除催化剂的固体酸从处理性的观点出发也是优选的,使用其它酸时,优选反应后进行基于碱的中和和基于水的清洗。
[0054]
对于前述酸催化剂的配混量,相对于最初投入的原料的前述化合物(a)及前述化合物(b)的总量100质量份,以5~40质量份的范围配混酸催化剂,从处理性和经济性的方面出发,优选5~30质量份。反应温度通常为100~300℃的范围即可,为了抑制异构体结构的生成、避免热分解等副反应,优选150~230℃。
[0055]
作为前述反应的时间,时间短时反应不会完全进行,另外设为长时间时会引起产物的热分解反应等副反应,因此在前述反应温度条件下通常为总计2~24小时的范围,优选为总计4~12小时的范围,为了减少低分子量成分、增加高分子量成分,更优选总计8~12小时。
[0056]
前述中间体胺化合物的制造方法中,苯胺或其衍生物兼任溶剂,因此可以不必使用其它溶剂,也可以使用溶剂。例如,兼有脱水反应的反应体系的情况下,具体而言,使具有α
‑
羟基丙基的化合物作为原料进行反应的情况下,可以采用下述方法:使用甲苯、二甲苯、或氯苯等可共沸脱水的溶剂,使脱水反应结束后,将溶剂蒸馏去除,然后在上述反应温度的范围进行反应。
[0057]
本发明中使用的马来酰亚胺可以如下来得到:将通过上述方法得到的上述通式(6)所示的中间体胺化合物投入反应器中,溶解于适当的溶剂后,在马来酸酐、催化剂的存在下进行反应,反应后,通过水洗等将未反应的马来酸酐、其它杂质去除,通过减压将溶剂去除。另外,反应时可以使用脱水剂。
[0058]
本发明中使用的马来酰亚胺包含具有上述通式(1)的骨架、且具有茚满骨架的上述通式(7)所示的结构,在q为3以下并且氨基的邻位和对位中的至少2个为氢原子的情况下,与上述通式(8)对应的结构、即下述通式(9)所示的结构也可以作为上述通式(1)所示的结构而包含。
[0059][0060]
上述通式(9)中的ra、rb、q、r及m表示与上述同样的含义。
[0061]
作为用于合成前述马来酰亚胺的马来酰亚胺化反应中使用的有机溶剂,可列举出丙酮、甲乙酮(mek)、甲基异丁基酮、环己酮、苯乙酮等酮类、n,n
‑
二甲基甲酰胺、n,n
‑
二甲基乙酰胺、二甲基亚砜、n
‑
甲基
‑2‑
吡咯烷酮、乙腈、环丁砜等非质子性溶剂、二氧杂环己烷、四氢呋喃等环状醚类、乙酸乙酯、乙酸丁酯等酯类、苯、甲苯、二甲苯等芳香族系溶剂等,另外,这些可以单独使用,也可以混合使用。
[0062]
前述马来酰亚胺化反应中,优选将前述中间体胺化合物和马来酸酐以马来酸酐相对于中间体胺化合物的氨基当量的当量比为1~1.5的范围进行配混,更优选以1.1~1.2投入,在相对于中间体胺化合物和马来酸酐的合计量为0.5~50的质量比、优选为1~5的质量比的有机溶剂中进行反应是优选的方式。
[0080]
东曹株式会社制“a
‑
1000”[0081]
东曹株式会社制“a
‑
2500”[0082]
东曹株式会社制“a
‑
5000”[0083]
东曹株式会社制“f
‑
1”[0084]
东曹株式会社制“f
‑
2”[0085]
东曹株式会社制“f
‑
4”[0086]
东曹株式会社制“f
‑
10”[0087]
东曹株式会社制“f
‑
20”[0088]
东曹株式会社制“f
‑
40”[0089]
东曹株式会社制“f
‑
80”[0090]
东曹株式会社制“f
‑
128”[0091]
试样:将合成例中得到的马来酰亚胺的以树脂固体成分换算计为1.0质量%的四氢呋喃溶液用微型过滤器过滤而得的物质(50μl)。
[0092]
对于本发明的马来酰亚胺,基于上述gpc测定,前述马来酰亚胺总量100面积%中,优选含有平均重复单元数n为0的前述马来酰亚胺32面积%以下、更优选30面积%以下、进一步优选28面积%以下。通过使前述n为0的马来酰亚胺的含有比例(面积%)少,从而结晶性高的低分子量成分的含有比例降低,在溶剂中的溶解性提高,另外,可长期维持溶解状态,是优选的方式。需要说明的是,为了降低前述n为0的前述马来酰亚胺的含有比例,可以通过在中间体胺化合物的制造工序中减小上述的前述化合物(a)及前述化合物(b)的摩尔比(化合物(b)/化合物(a))来制备。另外,也可以根据中间体胺化合物的制造工序中的催化剂量、反应温度、反应时间适宜制备。
[0093]
<固化性树脂组合物的制备>
[0094]
本发明的固化性树脂组合物优选含有前述马来酰亚胺。前述马来酰亚胺的溶剂溶解性、加热熔融时的流动性及处理性优异,进而能够有助于耐脆性、耐热性及低介电常数/低介电损耗角正切,因此由含有前述马来酰亚胺的固化性树脂组合物得到的固化物的耐脆性、挠性、柔软性、耐热性及介电特性优异,因此是优选的方式。
[0095]
本发明的固化性树脂组合物可以添加固化剂、根据需要的固化促进剂、硅烷偶联剂、脱模剂、颜料、乳化剂、非卤素系阻燃剂、无机填充材料等各种配混剂。另外,只要为不损害本发明的目的的范围,除前述马来酰亚胺以外,也可以适宜配混环氧树脂、酚醛树脂、活性酯树脂、氰酸酯树脂等。
[0096]
<固化物>
[0097]
本发明的固化物优选由前述固化剂组合物得到。前述固化物可以使前述固化性树脂组合物进行固化反应而得到。前述固化性树脂组合物可以通过将上述的各成分均匀地混合来得到,也可以通过与以往已知的方法同样的方法容易地制成固化物。作为前述固化物,可列举出层叠物、浇铸成型物、粘接层、涂膜、薄膜等成型固化物。
[0098]
<耐热材料及电子材料>
[0099]
由含有本发明的马来酰亚胺的固化性树脂组合物得到的固化物的耐热性及介电特性优异,因此可以适合用于耐热构件、电子构件。特别是可以适合用于预浸料、电路基板、半导体密封材料、半导体装置、积层薄膜、积层基板、使用导电性糊剂的粘接剂、抗蚀材料
等。另外,也可以用于纤维增强树脂的基质树脂,特别适合作为高耐热性的预浸料。另外,前述固化性树脂组合物中所含的前述具有茚满骨架的马来酰亚胺在各种溶剂中显示优异的溶解性,因此可以实现涂料化。这样得到的耐热构件、电子构件可以适合用于各种用途,例如可列举出产业用机械部件、通常的机械部件、汽车/铁路/车辆等的部件、宇宙/航空关联部件、电子/电气部件、建筑材料、容器/包装构件、生活用品、运动/休闲用品、风力发电用壳体构件等,但是不限定于这些物体。
[0100]
实施例
[0101]
接着,通过实施例、比较例具体地对本发明进行说明,以下,“份”及“%”只要没有特别说明,则为质量基准。需要说明的是,软化点、胺当量、gpc、及fd
‑
ms谱在以下的条件下测定并进行评价。
[0102]
1)软化点
[0103]
测定法:依据jis k7234(环球法),测定以下示出的合成例中得到的中间胺化合物的软化点(℃)。
[0104]
2)胺当量
[0105]
通过以下的测定法,测定中间体胺化合物的胺当量。
[0106]
在500ml带塞的三角烧瓶中精确称量作为试样的中间体胺化合物约2.5g、吡啶7.5g、乙酸酐2.5g、三苯基膦7.5g后,安装冷凝管并在设定为120℃的油浴中进行150分钟加热回流。
[0107]
冷却后,加入蒸馏水5.0ml、丙二醇单甲醚100ml、四氢呋喃75ml,用0.5mol/l氢氧化钾
‑
乙醇溶液通过电位差滴定法进行滴定。按照同样的方法进行空白试验并进行校正。
[0108]
胺当量(g/eq.)=(s
×
2000)/(blank
‑
a)
[0109]
s:试样的量(g)
[0110]
a:0.5mol/l氢氧化钾
‑
乙醇溶液的消耗量(ml)
[0111]
blank:空白试验中的0.5mol/l氢氧化钾
‑
乙醇溶液的消耗量(ml)
[0112]
3)gpc测定
[0113]
使用以下的测定装置、测定条件进行测定,得到以下所示的合成例中得到的马来酰亚胺的gpc图(图1~图10)。根据前述gpc图的结果,基于数均分子量(mn),测定/算出分子量分布(重均分子量(mw)/数均分子量(mn))及对马来酰亚胺中的茚满骨架有贡献的平均重复单元数“n”。具体而言,对n为0~4的化合物,用理论分子量和gpc中各个实测值分子量在散布图上描点,画近似直线,根据直线上的实测值mn(1)所表示的点求出数均分子量(mn),算出n。进而,基于gpc测定,算出前述马来酰亚胺总量100面积%中平均重复单元数n为0的前述马来酰亚胺的含有比例(面积%)。
[0114]
测定装置:东曹株式会社制“hlc
‑
8320gpc”[0115]
柱:东曹株式会社制保护柱“hxl
‑
l” 东曹株式会社制“tsk
‑
gel g2000hxl” 东曹株式会社制“tsk
‑
gel g2000hxl” 东曹株式会社制“tsk
‑
gel g3000hxl” 东曹株式会社制“tsk
‑
gel g4000hxl”[0116]
检测器:ri(差示折射计)
[0117]
数据处理:东曹株式会社制“gpc工作站ecosec
‑
workstation”[0118]
测定条件:柱温度40℃
[0119]
展开溶剂四氢呋喃
[0120]
流速1.0ml/分钟
[0121]
标准:依据前述“gpc工作站ecosec
‑
workstation”的测定手册,使用分子量已知的下述的单分散聚苯乙烯。
[0122]
(使用聚苯乙烯)
[0123]
东曹株式会社制“a
‑
500”[0124]
东曹株式会社制“a
‑
1000”[0125]
东曹株式会社制“a
‑
2500”[0126]
东曹株式会社制“a
‑
5000”[0127]
东曹株式会社制“f
‑
1”[0128]
东曹株式会社制“f
‑
2”[0129]
东曹株式会社制“f
‑
4”[0130]
东曹株式会社制“f
‑
10”[0131]
东曹株式会社制“f
‑
20”[0132]
东曹株式会社制“f
‑
40”[0133]
东曹株式会社制“f
‑
80”[0134]
东曹株式会社制“f
‑
128”[0135]
试样:将合成例中得到的马来酰亚胺的以树脂固体成分换算计为1.0质量%的四氢呋喃溶液用微型过滤器过滤而得的物质(50μl)。
[0136]
4)fd
‑
ms谱
[0137]
fd
‑
ms谱使用以下的测定装置、测定条件进行测定。
[0138]
测定装置:jms
‑
t100gcaccutof
[0139]
测定条件
[0140]
测定范围:m/z=4.00~2000.00
[0141]
变化率:51.2ma/分钟
[0142]
最终电流值:45ma
[0143]
阴极电压:
‑
10kv
[0144]
记录间隔:0.07秒
[0145]
〔合成例1〕马来酰亚胺化合物a
‑
1的合成
[0146]
(1)中间体胺化合物的合成
[0147]
在安装有温度计、冷凝管、迪安
‑
斯达克榻分水器、搅拌机的1l烧瓶中,投入2,6
‑
二甲基苯胺48.5g(0.4mol)、α,α
’‑
二羟基
‑
1,3
‑
二异丙基苯272.0g(1.4mol)、二甲苯280g及活性白土70g,边搅拌边加热至120℃。进而用迪安
‑
斯达克榻管去除馏出水并升温至210℃,进行3小时反应。其后冷却至140℃,投入2,6
‑
二甲基苯胺145.4g(1.2mol)后,升温至220℃,进行3小时反应。反应后,空气冷却至100℃,用甲苯300g进行稀释,通过过滤将活性白土去除,在减压下将溶剂及未反应物等低分子量物蒸馏去除,由此得到下述通式(a
‑
1)所示的中间体胺化合物364.1g。胺当量为298、软化点为70℃。
[0148][0149]
(2)马来酰亚胺化
[0150]
在安装有温度计、冷凝管、迪安
‑
斯达克榻分水器、搅拌机的2l烧瓶中,投入马来酸酐131.8g(1.3mol)、甲苯700g并在室温下进行搅拌。接着用1小时滴加反应物(a
‑
1)364.1g与dmf 175g的混合溶液。
[0151]
滴加结束后,室温下进一步进行2小时反应。加入对甲苯磺酸一水合物37.1g,对反应液进行加热,将回流下共沸的水和甲苯冷却/分离,然后仅使甲苯返回至体系内并进行8小时脱水反应。空气冷却至室温后,进行减压浓缩,将褐色溶液溶解于乙酸乙酯600g,用离子交换水150g进行3次清洗并用2%碳酸氢钠水溶液150g进行3次清洗,加入硫酸钠进行干燥后,进行减压浓缩,将得到的反应物在80℃下进行4小时真空干燥,得到含有马来酰亚胺化合物a
‑
1的产物413.0g。该马来酰亚胺化合物a
‑
1的fd
‑
ms谱中,确认到m =560、718、876的峰,各峰相当于n为0、1、2的情况。需要说明的是,通过gpc求出前述马来酰亚胺a
‑
1中的茚满骨架部分中的重复单元数n的值(基于数均分子量),结果其gpc图为图1,n=1.47,分子量分布(mw/mn)=1.81。另外,前述马来酰亚胺a
‑
1总量100面积%中,平均重复单元数n为0的前述马来酰亚胺为26.5面积%。
[0152][0153]
〔合成例2〕马来酰亚胺化合物a
‑
2的合成
[0154]
(1)中间体胺化合物的合成
[0155]
在安装有温度计、冷凝管、迪安
‑
斯达克榻分水器、搅拌机的1l烧瓶中,投入2,6
‑
二甲基苯胺48.5g(0.4mol)、α,α
’‑
二羟基
‑
1,3
‑
二异丙基苯233.2g(1.2mol)、二甲苯230g及活性白土66g,边搅拌边加热至120℃。进而用迪安
‑
斯达克榻管将馏出水去除并升温至210℃,进行3小时反应。其后冷却至140℃,投入2,6
‑
二甲基苯胺145.4g(1.2mol)后,升温至220℃,进行3小时反应。反应后,空气冷却至100℃,用甲苯300g进行稀释,通过过滤将活性白土去除,在减压下将溶剂及未反应物等低分子量物蒸馏去除,由此得到下述通式(a
‑
2)所示的中间体胺化合物278.4g。胺当量为294、软化点为65℃。
[0156][0157]
(2)马来酰亚胺化
[0158]
在安装有温度计、冷凝管、迪安
‑
斯达克榻分水器、搅拌机的2l烧瓶中,投入马来酸酐107.9g(1.1mol)、甲苯600g并在室温下进行搅拌。接着用1小时滴加反应物(a
‑
2)278.4g与dmf 150g的混合溶液。
[0159]
滴加结束后,室温下进一步进行2小时反应。加入对甲苯磺酸一水合物27.0g,对反应液进行加热,将回流下共沸的水和甲苯冷却/分离,然后仅使甲苯返回至体系内并进行8小时脱水反应。空气冷却至室温后,进行减压浓缩,将褐色溶液溶解于乙酸乙酯500g,用离子交换水120g进行3次清洗并用2%碳酸氢钠水溶液120g进行3次清洗,加入硫酸钠进行干燥后,进行减压浓缩,将得到的反应物在80℃下进行4小时真空干燥,得到含有马来酰亚胺化合物a
‑
2的产物336.8g。该马来酰亚胺化合物a
‑
2的fd
‑
ms谱中,确认到m =560、718、876的峰,分别相当于n为0、1、2的情况。需要说明的是,通过gpc求出前述马来酰亚胺a
‑
2中的茚满骨架部分中的重复单元数n的值(基于数均分子量),结果其gpc图为图2,n=1.25,分子量分布(mw/mn)=3.29。另外,前述马来酰亚胺a
‑
2总量100面积%中,平均重复单元数n为0的前述马来酰亚胺为33.7面积%。
[0160][0161]
〔合成例3〕马来酰亚胺化合物a
‑
3的合成
[0162]
(1)中间体胺化合物的合成
[0163]
在安装有温度计、冷凝管、迪安
‑
斯达克榻分水器、搅拌机的2l烧瓶中,投入2,6
‑
二甲基苯胺48.5g(0.4mol)、α,α
’‑
二羟基
‑
1,3
‑
二异丙基苯388.6g(2.0mol)、二甲苯350g及活性白土123g,边搅拌边加热至120℃。进而用迪安
‑
斯达克榻管将馏出水去除并升温至210℃,进行3小时反应。其后冷却至140℃,投入2,6
‑
二甲基苯胺145.4g(1.2mol)后,升温至220℃,进行3小时反应。反应后,空气冷却至100℃,用甲苯500g进行稀释,通过过滤将活性白土去除,在减压下将溶剂及未反应物等低分子量物蒸馏去除,由此得到下述通式(a
‑
3)所示的中间体胺化合物402.1g。胺当量为306、软化点为65℃。
[0164][0165]
(2)马来酰亚胺化
[0166]
在安装有温度计、冷凝管、迪安
‑
斯达克榻分水器、搅拌机的2l烧瓶中,投入马来酸酐152.1g(1.5mol)、甲苯700g并在室温下进行搅拌。接着用1小时滴加反应物(a
‑
3)402.1g与dmf 200g的混合溶液。
[0167]
滴加结束后,室温下进一步进行2小时反应。加入对甲苯磺酸一水合物37.5g,对反应液进行加热,将回流下共沸的水和甲苯冷却/分离,然后仅使甲苯返回至体系内并进行8小时脱水反应。空气冷却至室温后,进行减压浓缩,将褐色溶液溶解于乙酸乙酯800g,用离
子交换水200g进行3次清洗并用2%碳酸氢钠水溶液200g进行3次清洗,加入硫酸钠进行干燥后,进行减压浓缩,将得到的反应物在80℃下进行4小时真空干燥,得到含有马来酰亚胺化合物a
‑
3的产物486.9g。该马来酰亚胺化合物a
‑
3的fd
‑
ms谱中,确认到m =560、718、876的峰,分别相当于n为0、1、2的情况。需要说明的是,前述马来酰亚胺a
‑
3中的茚满骨架部分中的重复单元数n的值(基于数均分子量)通过gpc求出,结果其gpc图为图3,n=1.96,分子量分布(mw/mn)=1.52。另外,前述马来酰亚胺a
‑
3总量100面积%中,平均重复单元数n为0的前述马来酰亚胺为17.1面积%。
[0168][0169]
〔合成例4〕马来酰亚胺化合物a
‑
4的合成
[0170]
(1)中间体胺化合物的合成
[0171]
在安装有温度计、冷凝管、迪安
‑
斯达克榻分水器、搅拌机的2l烧瓶中,投入2,6
‑
二乙基苯胺59.7g(0.4mol)、α,α
’‑
二羟基
‑
1,3
‑
二异丙基苯272.0g(1.4mol)、二甲苯350g及活性白土94g,边搅拌边加热至120℃。进而用迪安
‑
斯达克榻管将馏出水去除并升温至210℃,进行3小时反应。其后冷却至140℃,投入2,6
‑
二乙基苯胺179.1g(1.2mol)后,升温至220℃,进行3小时反应。反应后,空气冷却至100℃,用甲苯500g进行稀释,通过过滤将活性白土去除,在减压下将溶剂及未反应物等低分子量物蒸馏去除,由此得到下述通式(a
‑
4)所示的中间体胺化合物342.1g。胺当量为364、软化点为47℃。
[0172][0173]
(2)马来酰亚胺化
[0174]
在安装有温度计、冷凝管、迪安
‑
斯达克榻分水器、搅拌机的2l烧瓶中,投入马来酸酐107.9g(1.1mol)、甲苯600g并在室温下进行搅拌。接着用1小时滴加反应物(a
‑
4)342.1g与dmf 180g的混合溶液。
[0175]
滴加结束后,室温下进一步进行2小时反应。加入对甲苯磺酸一水合物26.8g,对反应液进行加热,将回流下共沸的水和甲苯冷却/分离,然后仅使甲苯返回至体系内并进行8小时脱水反应。空气冷却至室温后,进行减压浓缩,将褐色溶液溶解于乙酸乙酯500g,用离子交换水200g进行3次清洗并用2%碳酸氢钠水溶液200g进行3次清洗,加入硫酸钠进行干燥后,进行减压浓缩,将得到的反应物在80℃下进行4小时真空干燥,得到含有马来酰亚胺化合物a
‑
4的产物388.1g。该马来酰亚胺化合物a
‑
4的fd
‑
ms谱中,确认到m =616、774、932的峰,分别相当于n为0、1、2的情况。需要说明的是,通过gpc求出前述马来酰亚胺a
‑
4中的茚满骨架部分中的重复单元数n的值(基于数均分子量),结果其gpc图为图4,n=1.64,分子量
分布(mw/mn)=1.40。另外,前述马来酰亚胺a
‑
4总量100面积%中,平均重复单元数n为0的前述马来酰亚胺为15.8面积%。
[0176][0177]
〔合成例5〕马来酰亚胺化合物a
‑
5的合成
[0178]
(1)中间体胺化合物的合成
[0179]
在安装有温度计、冷凝管、迪安
‑
斯达克榻分水器、搅拌机的1l烧瓶中,投入2,6
‑
二异丙基苯胺70.9g(0.4mol)、α,α
’‑
二羟基
‑
1,3
‑
二异丙基苯272.0g(1.4mol)、二甲苯350g及活性白土97g,边搅拌边加热至120℃。进而用迪安
‑
斯达克榻管将馏出水去除并升温至210℃,进行3小时反应。其后冷却至140℃,投入2,6
‑
二异丙基苯胺212.7g(1.2mol)后,升温至220℃,进行3小时反应。反应后,空气冷却至100℃,用甲苯500g进行稀释,通过过滤将活性白土去除,在减压下将溶剂及未反应物等低分子量物蒸馏去除,由此得到下述通式(a
‑
5)所示的中间体胺化合物317.5g。胺当量为366、软化点为55℃。
[0180][0181]
(2)马来酰亚胺化
[0182]
在安装有温度计、冷凝管、迪安
‑
斯达克榻分水器、搅拌机的2l烧瓶中,投入马来酸酐107.9g(1.1mol)、甲苯600g并在室温下进行搅拌。接着用1小时滴加反应物(a
‑
5)317.5g与dmf 175g的混合溶液。
[0183]
滴加结束后,室温下进一步进行2小时反应。加入对甲苯磺酸一水合物24.8g,对反应液进行加热,将回流下共沸的水和甲苯冷却/分离,然后仅使甲苯返回至体系内并进行8小时脱水反应。空气冷却至室温后,进行减压浓缩,将褐色溶液溶解于乙酸乙酯600g,用离子交换水200g进行3次清洗并用2%碳酸氢钠水溶液200g进行3次清洗,加入硫酸钠进行干燥后,进行减压浓缩,将得到的反应物在80℃下进行4小时真空干燥,得到含有马来酰亚胺化合物a
‑
5的产物355.9g。该马来酰亚胺化合物a
‑
5的fd
‑
ms谱中,确认到m =672、830、988的峰,分别相当于n为0、1、2的情况。需要说明的是,通过gpc求出前述马来酰亚胺a
‑
5中的茚满骨架部分中的重复单元数n的值(基于数均分子量),结果其gpc图为图5,n=1.56,分子量分布(mw/mn)=1.24。另外,前述马来酰亚胺a
‑
5总量100面积%中,平均重复单元数n为0的前述马来酰亚胺为20.2面积%。
[0184][0185]
〔合成例6〕马来酰亚胺化合物a
‑
7的合成
[0186]
(1)中间体胺化合物的合成
[0187]
在安装有温度计、冷却管、迪安
‑
斯达克榻分水器、搅拌机的1l烧瓶中,投入2,6
‑
二甲基苯胺48.5g(0.4mol)、α,α
’‑
二羟基
‑
1,3
‑
二异丙基苯194.3g(1.0mol)、二甲苯204g及活性白土53g,边搅拌边加热至120℃。进而用迪安
‑
斯达克榻管去除馏出水并升温至210℃,进行3小时反应。其后冷却至140℃,投入2,6
‑
二甲基苯胺168.4g(1.4mol)后,升温至220℃,进行3小时反应。反应后,空气冷却至100℃,用甲苯300g进行稀释,通过过滤将活性白土去除,在减压下将溶剂及未反应物等低分子量物蒸馏去除,由此得到下述式(a
‑
7)所示的中间体胺化合物256.4g。胺当量为292、软化点为64℃。
[0188][0189]
(2)马来酰亚胺化
[0190]
在安装有温度计、冷却管、迪安
‑
斯达克榻分水器、搅拌机的2l烧瓶中,投入马来酸酐107.9g(1.1mol)、甲苯600g并在室温下搅拌。接着用1小时滴加反应物(a
‑
7)256.4g与dmf 150g的混合溶液。
[0191]
滴加结束后,室温下进一步进行2小时反应。加入对甲苯磺酸一水合物28.5g,对反应液进行加热,将回流下共沸的水和甲苯冷却/分离,然后仅使甲苯返回至体系内并进行8小时脱水反应。空气冷却至室温后,进行减压浓缩,将褐色溶液溶解于乙酸乙酯500g,用离子交换水120g进行3次清洗并用2%碳酸氢钠水溶液120g进行3次清洗,加入硫酸钠进行干燥后,进行减压浓缩,将得到的反应物在80℃下进行4小时真空干燥,得到含有马来酰亚胺化合物a
‑
7的产物319.6g。该马来酰亚胺化合物a
‑
7的fd
‑
ms谱中,确认到m =560、718、876的峰,分别相当于n为0、1、2的情况。需要说明的是,通过gpc求出前述马来酰亚胺a
‑
7中的茚满骨架部分中的重复单元数n的值(基于数均分子量),结果其gpc图为图6,n=0.92,分子量分布(mw/mn)=1.45。另外,前述马来酰亚胺a
‑
7总量100面积%中,平均重复单元数n为0的前述马来酰亚胺为38.8面积%。
[0192]
[0193]
〔合成例7〕马来酰亚胺化合物a
‑
8的合成
[0194]
(1)中间体胺化合物的合成
[0195]
前述中间体胺化合物a
‑
1的合成法中,将210℃的反应时间变为6小时、将220℃的反应时间变为3小时,进行同样的操作,得到下述通式(a
‑
8)所示的中间体胺化合物345.2g。胺当量为348、软化点为71℃。
[0196][0197]
(2)马来酰亚胺化
[0198]
根据前述马来酰亚胺化合物a
‑
1的合成法,将中间体替换为a
‑
8,同样地进行操作,得到含有马来酰亚胺化合物a
‑
8的产物407.6g。该马来酰亚胺化合物a
‑
8的fd
‑
ms谱中,确认到m =560、718、876的峰,各峰相当于n为0、1、2的情况。需要说明的是,通过gpc求出前述马来酰亚胺a
‑
8中的茚满骨架部分中的重复单元数n的值(基于数均分子量),结果其gpc图为图7,n=2.59,分子量分布(mw/mn)=1.49。另外,前述马来酰亚胺a
‑
8总量100面积%中,平均重复单元数n为0的前述马来酰亚胺为14.9面积%。
[0199][0200]
〔合成例8〕马来酰亚胺化合物a
‑
9的合成
[0201]
前述中间体胺化合物a
‑
1的合成法中,将210℃的反应时间变为6小时、将220℃的反应时间变为3小时,进行同样的操作,对于合成的中间体胺化合物(胺当量为347、软化点为71℃),将马来酰亚胺化反应中的回流下的脱水反应设为10小时,除此以外,通过设为与前述马来酰亚胺化合物a
‑
1的合成法同样的条件,得到含有马来酰亚胺化合物a
‑
9的产物415.6g。该马来酰亚胺化合物a
‑
9的fd
‑
ms谱中,确认到m =560、718、876的峰,各峰相当于n为0、1、2的情况。需要说明的是,通过gpc求出前述马来酰亚胺a
‑
9中的茚满骨架部分中的重复单元数n的值(基于数均分子量),结果其gpc图为图8,n=2.91,分子量分布(mw/mn)=1.64。另外,前述马来酰亚胺a
‑
9总量100面积%中,平均重复单元数n为0的前述马来酰亚胺为14.2面积%。
[0202][0203]
〔合成例9〕马来酰亚胺化合物a
‑
10的合成
[0204]
前述中间体胺化合物a
‑
1的合成法中,将210℃的反应时间变为9小时、将220℃的反应时间变为3小时,进行同样的操作,对于合成的中间体胺化合物(胺当量为342、软化点为69℃),将马来酰亚胺化反应中的回流下的脱水反应设为10小时,除此以外,通过设为与前述马来酰亚胺化合物a
‑
1的合成法同样的条件,由此得到含有马来酰亚胺化合物a
‑
10的产物398.7g。该马来酰亚胺化合物a
‑
10的fd
‑
ms谱中,确认到m =560、718、876的峰,各峰相当于n为0、1、2的情况。需要说明的是,通过gpc求出前述马来酰亚胺a
‑
10中的茚满骨架部分中的重复单元数n的值(基于数均分子量),结果其gpc图为图9,n=3.68,分子量分布(mw/mn)=2.09。另外,前述马来酰亚胺a
‑
10总量100面积%中,平均重复单元数n为0的前述马来酰亚胺为12.4面积%。
[0205][0206]
〔合成例10〕马来酰亚胺化合物a
‑
11的合成
[0207]
前述中间体胺化合物a
‑
1的合成法中,将210℃的反应时间变为9小时、将220℃的反应时间变为3小时,进行同样的操作,对合成的中间体胺化合物(胺当量为347、软化点为70℃),将马来酰亚胺化反应中的回流下的脱水反应设为12小时,除此以外,通过设为与前述马来酰亚胺化合物a
‑
1的合成法同样的条件,由此得到含有马来酰亚胺化合物a
‑
11的产物422.7g。该马来酰亚胺化合物a
‑
11的fd
‑
ms谱中,确认到m =560、718、876的峰,各峰相当于n为0、1、2的情况。需要说明的是,通过gpc求出前述马来酰亚胺a
‑
11中的茚满骨架部分中的重复单元数n的值(基于数均分子量),结果其gpc图为图10、n=4.29,分子量分布(mw/mn)=3.02。另外,前述马来酰亚胺a
‑
11总量100面积%中,平均重复单元数n为0的前述马来酰亚胺为11.0面积%。
[0208][0209]
〔实施例1~9、及比较例1~2〕
[0210]
<马来酰亚胺的溶剂溶解性>
[0211]
进行合成例1~10中得到的马来酰亚胺(a
‑
1)~(a
‑
5)及(a
‑
7)~(a
‑
11)、以及比较用的市售的马来酰亚胺(a
‑
6)(4,4’二苯基甲烷双马来酰亚胺、“bmi
‑
1000”大和化成工业株式会社制)相对于甲苯、甲乙酮(mek)的溶解性的评价,将评价结果示于表1。
[0212]
作为溶剂溶解性的评价方法,使用上述合成例及比较例中得到的各马来酰亚胺,以不挥发成分成为10、20、30、40、50、60、及70质量%的方式制备甲苯溶液及甲乙酮(mek)溶液。
[0213]
具体而言,将放入有上述合成例及比较例中得到的各马来酰亚胺的小瓶在室温
(25℃)下放置60天,将各不挥发成分组成在各溶液中均匀地溶解的情况(没有不溶解物)评价为〇,将未溶解的情况(有不溶解物)评价为
×
(目视)。需要说明的是,如果在不挥发成分为20质量%以上的情况下能够溶解于溶剂,则实用上是优选的。
[0214]
[表1]
[0215][0216]
根据上述表1的评价结果可以确认:实施例1~9中,使用了具有茚满骨架的马来酰亚胺,因此在制备甲苯溶液时,不挥发成分即使为20质量%也能够溶解,在制备mek溶液时,不挥发成分即使为50质量%也能够溶解,溶剂溶解性优异。另一方面确认了,比较例1中使用的市售的马来酰亚胺在结构中不具有茚满骨架、溶剂溶解性差。另外确认了,比较例2中,
虽然使用了具有茚满骨架的马来酰亚胺,但茚满骨架部分的平均重复单元数n不包含在期望的范围,因此溶剂溶解性差。
[0217]
产业上的可利用性
[0218]
对于本发明的马来酰亚胺,使用前述马来酰亚胺得到的固化物的耐热性及介电特性优异,因此可以适合用于耐热构件、电子构件,特别是可以适合用于半导体密封材料、电路基板、积层薄膜、积层基板等、粘接剂、抗蚀材料。另外,也可以适合用于纤维增强树脂的基质树脂,适合作为高耐热性的预浸料。
附图说明
[0219]
图1为合成例1中得到的马来酰亚胺化合物(a
‑
1)的gpc图。
[0220]
图2为合成例2中得到的马来酰亚胺化合物(a
‑
2)的gpc图。
[0221]
图3为合成例3中得到的马来酰亚胺化合物(a
‑
3)的gpc图。
[0222]
图4为合成例4中得到的马来酰亚胺化合物(a
‑
4)的gpc图。
[0223]
图5为合成例5中得到的马来酰亚胺化合物(a
‑
5)的gpc图。
[0224]
图6为合成例6中得到的马来酰亚胺化合物(a
‑
7)的gpc图。
[0225]
图7为合成例7中得到的马来酰亚胺化合物(a
‑
8)的gpc图。
[0226]
图8为合成例8中得到的马来酰亚胺化合物(a
‑
9)的gpc图。
[0227]
图9为合成例9中得到的马来酰亚胺化合物(a
‑
10)的gpc图。
[0228]
图10为合成例10中得到的马来酰亚胺化合物(a
‑
11)的gpc图。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。