1.本发明属于天然产物提取领域,具体涉及一种软珊瑚多糖及其制备方法与应用。
背景技术:
2.豆荚软珊瑚(lobophytum sp.)在分类学上属于腔肠动物门(coelenterata)、珊瑚虫纲(anthozoa)、八放珊瑚亚纲(octocorallia)、软珊瑚目(alcyonacea)、软珊瑚科(alcyoniidae),是一种海洋低等无脊椎动物,常见于热带和亚热带海域中。豆荚软珊瑚颜色多样,极具观赏性,在海洋中主要以浮游生物为食,是一种海底附着型生物。豆荚软珊瑚几乎不具攻击性,单株珊瑚在生存条件适宜的情况下可以存活几百年。
3.《本草纲目》中记载,珊瑚可药用。海洋中珊瑚礁资源丰富,约占海洋生物总量的22.4%,相关技术中,对于珊瑚的研究仅局限于次级代谢物,而对多糖还少有研究。多糖作为一种具有广阔应用前景的生物大分子,在植物、动物和微生物体内广泛存在,是构成生命的四大基本物质之一。而珊瑚作为一种有药用价值的海洋生物,其必然也蕴含着功能性较强的多糖,因此,加速开发珊瑚中的多糖对于医药领域和食品领域的发展具有极为重要的意义。
技术实现要素:
4.本发明旨在至少解决上述现有技术中存在的技术问题之一。为此,本发明提出一种软珊瑚多糖及其制备方法与应用,本发明首次成功分离得到了一种软珊瑚多糖,其具有较好的免疫调节活性,对raw264.7巨噬细胞无明显的细胞毒性作用,且能显著促进no的释放,提高细胞对中性红的吞噬能力。
5.本发明的第一个方面,提供一种珊瑚多糖,该珊瑚多糖中的单糖组分为:甘露糖、鼠李糖、葡萄糖醛酸、葡萄糖、半乳糖和木糖。
6.根据本发明的第一个方面,在本发明的一些实施方式中,所述珊瑚多糖为豆荚软珊瑚多糖。
7.由于海洋环境的特殊性,珊瑚所产生的多糖结构、多糖的活性作用以及活性强弱也与陆生生物体内的多糖有所不同,因此,针对海洋生物的多糖的研究也显得尤为重要。
8.根据本发明的第一个方面,在本发明的一些实施方式中,按质量比计,所述珊瑚多糖中的单糖组分为:鼠李糖:葡萄糖醛酸:葡萄糖:半乳糖:木糖=(0.15~0.20):(0.20~0.25):(0.01~0.05):(98.5~99.0):(0.45~0.50):(0.25~0.30)。
9.在本发明的一些优选实施方式中,按质量比计,所述珊瑚多糖中的单糖组分为:鼠李糖:葡萄糖醛酸:葡萄糖:半乳糖:木糖=0.19:0.21:0.05:98.8:0.46:0.26。
10.在本发明的一些优选实施方式中,所述珊瑚多糖的核磁共振氢谱为:
[0011]1h nmr(600mhz,d2o)δ6.77
–
4.68(m,64h),4.78(s,3h),4.72(s,7h),4.70(s,45h),4.89
–
3.67(m,80h),3.46(d,j=136.8hz,15h),3.07(s,4h),3.05
–
2.68(m,2h)。
[0012]
在本发明的一些优选实施方式中,所述珊瑚多糖的核磁共振碳谱为:
[0013]
13
c nmr(151mhz,d2o)δ99.29(d,j=212.4hz),77.72(s),74.11(s),74.11(s),74.03
–
72.65(m),71.72(s),70.66(dd,j=243.3,116.1hz),61.51(d,j=288.7hz),38.71(s)。
[0014]
在本发明的一些优选实施方式中,所述珊瑚多糖的的分子量为(4.90
±
0.2)
×
106da。
[0015]
在本发明的一些优选实施方式中,所述珊瑚多糖的的分子量优选为4.90
×
106da。
[0016]
本发明的第二个方面,提供一种珊瑚多糖的制备方法,包括如下步骤:
[0017]
(1)除去珊瑚样品中的脂质类成分和色素;
[0018]
(2)加热,水提,过滤,取滤液,醇沉,离心,得醇沉沉淀;
[0019]
(3)取步骤(2)得到的醇沉沉淀复溶,加入蛋白酶酶解,离心除去沉淀的蛋白质,加入脱蛋白试剂除尽剩余的蛋白,得到脱蛋白珊瑚粗多糖;
[0020]
(4)取脱蛋白珊瑚粗多糖,使用deae
‑
52纤维素离子交换柱分离,以水或氯化钠洗脱,得到珊瑚多糖。
[0021]
根据本发明的第二个方面,在本发明的一些实施方式中,该方法具体为:
[0022]
(1)除去珊瑚样品中的脂质:
[0023]
取珊瑚样品,加入4倍体积的石油醚进行索氏提取,去除软珊瑚中的脂质类成分和部分色素分子。85℃虹吸7~9次后结束反应,将处理过的珊瑚样品放置烘箱过夜烘干。
[0024]
(2)水提与醇沉:
[0025]
将步骤(1)中烘干后的珊瑚样品按料液比1g:(7~30)ml的量加水混合,60~95℃提取4h,重复提取2~5次,过滤,合并滤液。60℃减压浓缩,得到浓缩液,加入4倍体积的95%乙醇,得到75%乙醇的醇沉溶液,于4℃冰箱过夜放置。
[0026]
在本发明的一些优选实施方式中,步骤(2)中的料液比为1g:20ml。
[0027]
在本发明的一些优选实施方式中,步骤(2)中的水提温度为90℃。
[0028]
在本发明的一些优选实施方式中,步骤(2)中的水提次数为2次。
[0029]
(3)除蛋白:
[0030]
取步骤(2)中得到的醇沉溶液,5000rpm离心20min,弃去上清,所得沉淀即为珊瑚粗提多糖,用去离子水复溶珊瑚粗提多糖,加入蛋白酶,在60℃下持续搅拌反应4h。反应结束后100℃加热15min,冷却至室温(25~30℃)后,5000rpm离心20min,所得沉淀为珊瑚蛋白质,弃去沉淀,取上清。在上清中按(5~15):1的体积比(上清:脱蛋白试剂=(5~15):1)加入脱蛋白试剂(氯仿:正丁醇=4:1,v/v),涡旋5min,5000rpm离心15min。离心后的溶液会分为三层,下层为有机试剂层,中层为蛋白质层,上层为珊瑚多糖层。取上层的珊瑚多糖层,再次按(5~15):1的体积比(珊瑚多糖层:脱蛋白试剂=(5~15):1)加入脱蛋白试剂,重复提取4~5次,以充分除尽溶液中的珊瑚蛋白质。将除尽珊瑚蛋白质的珊瑚多糖层溶液用旋转蒸发仪旋干,除去其中的有机试剂,用少量去离子水复溶,透析24小时,每三个小时换一次水。真空冷冻干燥,即得脱蛋白珊瑚粗多糖。
[0031]
在本发明的一些优选实施方式中,步骤(3)中的上清:脱蛋白试剂以及珊瑚多糖层:脱蛋白试剂的体积比为10:1。
[0032]
(4)deae
‑
52纤维素离子交换柱分离:
[0033]
取步骤(3)获得的脱蛋白珊瑚粗多糖(400mg),加水复溶。以5ml为上样量,使用
deae
‑
52纤维素离子交换柱(2.6
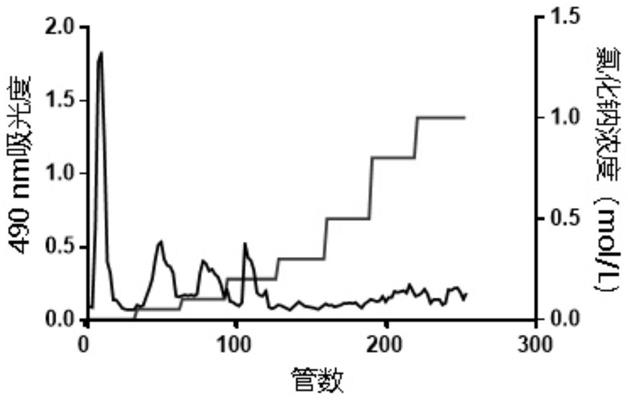
×
30cm(直径
×
柱高),填料购自北京索莱宝科技有限公司)进行分离,并依次用浓度为0、0.05、0.1、0.2、0.3、0.5、0.8、1.0m的nacl溶液进行洗脱,自动收样器收集每个浓度溶液30管,收样速度为0.8ml/min,每管10min。收集产物,分别浓缩、透析24小时,每三个小时换一次水。真空冻干,即得不同组分的豆荚软珊瑚多糖。
[0034]
根据本发明的第二个方面,在本发明的一些实施方式中,所述方法还包括:
[0035]
(5)取用水洗脱得到的珊瑚多糖,使用葡聚糖凝胶色谱柱分离,以氯化钠洗脱。
[0036]
在本发明的一些优选实施方式中,步骤(5)具体为:
[0037]
取步骤(4)以0m的nacl溶液(即纯水)洗脱得到的豆荚软珊瑚多糖组分(60mg),加水复溶。以5ml为上样量,使用sephacryl 300hr葡聚糖凝胶柱(1.6
×
90cm,填料购自上海源叶生物科技)分离,用0.1m的nacl溶液进行洗脱,用自动收样器收集60管,收样速度为0.5ml/min,每管10min。收集产物,分别浓缩、透析24小时,每三个小时换一次水。真空冻干,即得豆荚软珊瑚多糖纯化多糖lcps
‑1‑
a。
[0038]
根据本发明的第二个方面,在本发明的一些实施方式中,步骤(2)中所述醇提使用的醇溶液包括:乙醇溶液。
[0039]
在本发明的一些优选实施方式中,步骤(2)中所述醇提使用的醇溶液为乙醇溶液。
[0040]
根据本发明的第二个方面,在本发明的一些实施方式中,步骤(2)中所述蛋白酶包括:木瓜蛋白酶、胰蛋白酶、胃蛋白酶和碱性蛋白酶中的任意一种。
[0041]
在本发明的一些优选实施方式中,步骤(2)中所述蛋白酶为木瓜蛋白酶,终浓度为1mg/ml。
[0042]
根据本发明的第二个方面,在本发明的一些实施方式中,步骤(2)中所述脱蛋白试剂包括:sevag试剂、三氟三氯乙烷和三氯醋酸中的任意一种。
[0043]
在本发明的一些优选实施方式中,步骤(2)中所述脱蛋白试剂为sevag试剂。
[0044]
本发明的第三个方面,提供本发明第一个方面所述的珊瑚多糖或本发明第二个方面所述制备方法制备得到的珊瑚多糖在制备药物中的应用。
[0045]
根据本发明的第三个方面,在本发明的一些实施方式中,所述药物包括免疫调节剂。
[0046]
在本发明的一些优选实施方式中,所述免疫调节剂为免疫激活剂。
[0047]
根据本发明的第三个方面,在本发明的一些实施方式中,所述药物用于改善免疫力,促进免疫细胞增殖,促进免疫细胞因子的表达和分泌。
[0048]
在本发明的一些优选实施方式中,所述免疫细胞为巨噬细胞,所述巨噬细胞具体为raw264.7巨噬细胞。
[0049]
在本发明的一些优选实施方式中,所述免疫细胞因子包括no以及il
‑
1β、tnf
‑
α、il
‑
6。
[0050]
在本发明中,发明人首次发现了豆荚软珊瑚(lobophytum sp.)多糖,并从中分离出一种具有良好免疫活调节活性的纯化多糖lcps
‑1‑
a,该纯化多糖为天然安全的提取产物,能够促进raw264.7巨噬细胞增殖,并促进细胞分泌no以及il
‑
1β、tnf
‑
α、il
‑
6等细胞因子,还可提高细胞的吞噬能力,可作为一种较好的免疫调节剂,具有重要的研究意义与开发价值。
[0051]
本发明的第四个方面,提供本发明第一个方面所述的珊瑚多糖或本发明第二个方
面所述制备方法制备得到的珊瑚多糖在制备食品中的应用。
[0052]
本发明的有益效果是:
[0053]
1.本发明首次从豆荚软珊瑚(lobophytum sp.)提取分离得到豆荚软珊瑚(lobophytum sp.)多糖lcps
‑1‑
a,为珊瑚多糖的提取工艺提供了有效的技术参考。
[0054]
2.本发明中的豆荚软珊瑚多糖lcps
‑1‑
a能够促进raw264.7巨噬细胞增殖,并促进细胞分泌no以及il
‑
1β、tnf
‑
α、il
‑
6等细胞因子,还可提高细胞的吞噬能力,可作为一种较好的免疫调节剂,具有重要的研究意义与开发价值。
附图说明
[0055]
图1为本发明实施例中的软珊瑚粗多糖deae
‑
52纤维素柱分离结果;
[0056]
图2为本发明实施例中的以0m nacl溶液洗脱所得多糖组分通过sephcryl 300hr葡聚糖凝胶的分离结果;
[0057]
图3为不同给药组的raw264.7巨噬细胞的增殖分化情况,其中,a为空白对照,b为lcps
‑1‑
a给药组,c为lps组,d为lcps
‑1‑
b给药组;
[0058]
图4为不同给药组的raw264.7巨噬细胞的mtt实验结果;
[0059]
图5为不同给药组的raw264.7巨噬细胞的no含量测定结果;
[0060]
图6为不同给药组的raw264.7巨噬细胞的中性红吞噬作用结果;
[0061]
图7为不同给药组的raw264.7巨噬细胞的il
‑
1β、tnf
‑
α以及il
‑
6的表达情况,其中,a为il
‑
1β,b为tnf
‑
α,c为il
‑
6;
[0062]
图8为软珊瑚纯化多糖lcps
‑1‑
a的分子量色谱图;
[0063]
图9为单糖组成色谱图,其中,a为混合单糖标准品的色谱图,b为lcps
‑1‑
a的色谱图,1为甘露糖;2为鼠李糖;3为葡萄糖醛酸;4为半乳糖醛酸;5为葡萄糖;6为半乳糖;7为木糖;8为阿拉伯糖;9为岩藻糖;
[0064]
图10为软珊瑚纯化多糖lcps
‑1‑
a的核磁图谱,a为lcps
‑1‑
a的氢谱图,b为lcps
‑1‑
a氢谱图的部分峰值局部放大图;
[0065]
图11为软珊瑚纯化多糖lcps
‑1‑
a的碳谱图;
[0066]
图12为软珊瑚纯化多糖lcps
‑1‑
a的红外图谱;
[0067]
图13为软珊瑚纯化多糖lcps
‑1‑
a的紫外扫描图谱。
具体实施方式
[0068]
为了使本发明的发明目的、技术方案及其技术效果更加清晰,以下结合具体实施方式,对本发明进行进一步详细说明。应当理解的是,本说明书中描述的具体实施方式仅仅是为了解释本发明,并非为了限定本发明。
[0069]
所使用的实验材料和试剂,若无特别说明,均为常规可从商业途径所获得的耗材和试剂。
[0070]
豆荚软珊瑚多糖的制备
[0071]
具体步骤包括:
[0072]
(1)前处理(除去脂质类成分及色素的杂质):
[0073]
取新鲜豆荚软珊瑚,自然晾干粉碎,过40目筛,得到豆荚软珊瑚粉末。称取100g豆
荚软珊瑚粉末至滤纸筒内,加入4倍体积的石油醚进行索氏提取,去除软珊瑚中的脂质类成分和部分色素分子。85℃虹吸7~9次后结束反应,将处理过的豆荚软珊瑚粉末放置烘箱过夜烘干。
[0074]
(2)豆荚软珊瑚多糖的提取:
[0075]
将步骤(1)中烘干后的豆荚软珊瑚粉末按料液比1g:20ml的量加水混合,90℃提取4h,重复提取2次,过滤,合并2次的滤液。60℃减压浓缩,得到浓缩液,加入4倍体积的95%乙醇,得到75%乙醇的醇沉溶液,于4℃冰箱过夜放置。
[0076]
(3)除蛋白:
[0077]
取步骤(2)中得到的醇沉溶液,5000rpm离心20min,弃去上清,所得沉淀即为珊瑚粗提多糖。用去离子水复溶珊瑚粗提多糖,加入木瓜蛋白酶(终浓度为1mg/ml),在60℃下持续搅拌反应4h。反应结束后100℃加热15min,冷却至室温(25~30℃)后,5000rpm离心20min,所得沉淀为珊瑚蛋白质,弃去沉淀,取上清。在上清中按10:1的体积比(上清:sevag试剂=10:1)加入sevag试剂(氯仿:正丁醇=4:1,v/v),涡旋5min,5000rpm离心15min。离心后的溶液会分为三层,下层为有机试剂层,中层为蛋白质层,上层为珊瑚多糖层。取上层的珊瑚多糖层,再次按10:1的体积比(珊瑚多糖层:sevag试剂=10:1)加入sevag试剂,重复提取4~5次,以充分除尽溶液中的珊瑚蛋白质。将除尽珊瑚蛋白质的珊瑚多糖层溶液用旋转蒸发仪旋干,除去其中的有机试剂,用少量去离子水复溶,透析24小时,每三个小时换一次水。真空冷冻干燥,即得除蛋白珊瑚多糖(命名为lcps)。
[0078]
(4)珊瑚粗提多糖的分离纯化:
[0079]
取步骤(3)获得的lcps 0.4g,加水复溶(终浓度80mg/ml)。以5ml为上样量,使用deae
‑
52纤维素离子交换柱(2.6
×
30cm,填料购自北京索莱宝科技有限公司)进行分离,并依次用浓度为0、0.05、0.1、0.2、0.3、0.5、0.8、1.0m的nacl溶液进行洗脱,自动收样器收集每个浓度溶液30管,收样速度为0.8ml/min,每管10min。用苯酚硫酸法检测溶液是否含有多糖,收集产物,分别浓缩、透析24小时,每三个小时换一次水。真空冻干,即得不同组分的豆荚软珊瑚多糖。
[0080]
离子交换柱层析纯化结果如图1所示。
[0081]
可以发现,使用浓度为0、0.05、0.1、0.2m的nacl溶液进行洗脱时有较强的紫外吸收峰,即lcps经过deae
‑
52纤维素离子交换柱可分离得到4个不同组分的豆荚软珊瑚多糖。
[0082]
(5)不同组分豆荚软珊瑚多糖的分离纯化:
[0083]
分别取步骤(4)获得的不同组分豆荚软珊瑚多糖60mg,加水配制为终浓度为12mg/ml的溶液。以5ml为上样量,使用sephacryl 300hr葡聚糖凝胶柱(1.6
×
90cm,填料购自上海源叶生物科技)分离,用0.1m的nacl溶液进行洗脱,每个组分的豆荚软珊瑚多糖分别用自动收样器收集60管,收样速度为0.5ml/min,每管10min。用苯酚硫酸法检测溶液是否含有多糖,收集产物,分别浓缩、透析24小时,每三个小时换一次水真空冻干,即得不同组分豆荚软珊瑚多糖的纯化多糖。
[0084]
凝胶柱层析纯化结果如图2所示。
[0085]
在本步骤中,实际可得到两种豆荚软珊瑚多糖纯化多糖,两种豆荚软珊瑚多糖纯化多糖均是来源于在步骤(4)中以0m的nacl溶液(即纯水)洗脱得到的豆荚软珊瑚多糖组分,该组分经步骤(5)中凝胶柱分离得到的两种豆荚软珊瑚多糖纯化多糖分别命名为lcps
‑
1
‑
a(第17~23管)和lcps
‑1‑
b(第27~33管),其中,仅lcps
‑1‑
a具有免疫调节活性。
[0086]
豆荚软珊瑚多糖纯化多糖的免疫调节活性检测
[0087]
本实施例以raw264.7巨噬细胞为对象,检测豆荚软珊瑚多糖纯化多糖的免疫调节活性。
[0088]
具体检测步骤包括:
[0089]
(1)raw264.7巨噬细胞的复苏与培养:
[0090]
取raw264.7细胞株,37℃水浴加热,快速摇晃使其融化。将融化后的细胞液转移至15ml无菌灭酶的离心管中,加入2ml含有10%fbs的完全培养基,1000rpm离心3min。除去上清,加入1ml培养基(含10%fbs的完全培养基,购自美国gibco公司)吹打均匀。将混合好的细胞液转移至5ml培养基(含10%fbs的完全培养基)中重悬细胞,在37℃、5%co2、饱和湿度的条件下孵育,待细胞密度长至80%~90%时即可传代。
[0091]
(2)豆荚软珊瑚多糖纯化多糖对raw264.7巨噬细胞生长的影响:
[0092]
将对数生长期的raw264.7巨噬细胞按2万/孔的浓度接种于96孔板中,每孔加入100μl细胞培养基(含10%fbs的完全培养基),贴壁生长12h。弃去旧培养基,分别加入含有终浓度为0、2、4、6、8、10μg/ml豆荚软珊瑚多糖纯化多糖的培养基(含10%fbs的完全培养基)100μl,继续培养24h。孵育结束后,于显微镜下观察细胞形态,观察完毕后弃去培养基,每孔加入20μl 5mg/ml的mtt溶液,孵育4h后将上清吸出,每孔加入200μl的二甲基亚砜溶液,水平摇床上摇10min后用酶标仪测定490nm下的吸光度。
[0093]
设置空白对照和阳性组(使用100μl 1μg/ml的脂多糖(lps))。
[0094]
结果如图3和4所示。
[0095]
由图3知,对照组和lcps
‑1‑
b组细胞未出现分化现象,而lcps
‑1‑
a与lps组细胞都会长出触角,由此可知,lcps
‑
1a具有一定的免疫调节活性,而lcps
‑1‑
b不具这一作用。
[0096]
(3)豆荚软珊瑚多糖纯化多糖对raw264.7巨噬细胞no分泌量的影响:
[0097]
将对数生长期的raw264.7巨噬细胞按20万/孔的浓度接种于96孔板中,每孔加入100μl含10%fbs的完全培养基,贴壁生长12h。弃去旧培养基,分别加入含有终浓度为0、2、4、6、8、10、12μg/ml豆荚软珊瑚多糖纯化多糖的含10%fbs的完全培养基100μl,阳性对照lps组加入100μl 1μg/ml lps的培养基,继续培养24h后,吸取50μl上清,按no试剂盒(碧云天no检测试剂盒)说明书检测各组中的no含量。
[0098]
设置空白对照。
[0099]
结果如图5所示。
[0100]
如图5所示,给药组细胞分泌的no含量会随着药物浓度的增加而增加,表明lcps
‑
1a具有一定的免疫调节活性。
[0101]
(4)中性红(cas:553
‑
24
‑
2)检测豆荚软珊瑚多糖纯化多糖对raw264.7巨噬细胞吞噬的影响:
[0102]
将对数生长期的raw264.7巨噬细胞按10万/孔的浓度接种于96孔板中,每孔加入100μl含10%fbs的完全培养基,贴壁生长12h。弃去旧培养基,分别加入含有终浓度为0、2、4、6、8、10、12μg/ml豆荚软珊瑚多糖纯化多糖的含10%fbs的完全培养基100μl,阳性对照lps组加入100μl 1μg/ml lps的含10%fbs的完全培养基,继续培养24h。弃去旧培养基,用pbs润洗3次,然后在每孔中加入100μl的终浓度为0.75mg/ml的中性红
‑
pbs溶液,孵育
detector,elsd),检测器的设定温度为60℃,增益值为10,柱温为35℃,以超纯水为流动相,流速为1.0ml/min,进样量为20μl进行检测。
[0121]
以同浓度葡聚糖标准品作为对照,得到分子量和保留时间的标准曲线。
[0122]
结果如图8所示。
[0123]
可以发现,在豆荚软珊瑚多糖纯化多糖lcps
‑1‑
a分子量色谱图中,lcps
‑1‑
a的保留时间在5.11min左右,将其代入由同浓度葡聚糖标准品得到的标准曲线。
[0124]
其中,标准曲线为:
[0125]
lgmw=
‑
0.8867t 11.316;
[0126]
其中,mw表示分子量;t表示保留时间。
[0127]
可以得到豆荚软珊瑚多糖纯化多糖lcps
‑1‑
a的分子量为4.90
×
106da。
[0128]
(2)lcps
‑1‑
a单糖组成分析:
[0129]
具体分析步骤如下:
[0130]
①
混合单糖标准品的测定:
[0131]
分别取50μl 2mm的单糖标准品(甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖、岩藻糖)加入0.3mol/l的naoh溶液400μl和0.5mol/l的1
‑
苯基
‑3‑
甲基
‑5‑
吡唑啉酮(pmp)
‑
甲醇溶液400μl,混匀后在70℃条件下反应30min。反应结束后加入410μl的0.3mol/l hcl中和。加入1ml氯仿,14000rpm离心8min,取上清,再次加入1ml氯仿14000rpm离心8min,重复三次,以充分除尽pmp。取上清,经0.45μm滤膜过滤,使用hplc进行检测,色谱条件:高效液相色谱仪为岛津lc
‑
20at,色谱柱为symmetry c18(waters,4.6
×
250mm),检测器为二极管阵列检测器(检测波长:250nm),以0.05m磷酸盐缓冲液(ph 6.7)
‑
乙腈(v/v:83:17),流速为1.0ml/min,进样量为20μl。
[0132]
②
lcps
‑1‑
a的pmp衍生化:
[0133]
取5mg上述实施例中制备得到的豆荚软珊瑚多糖纯化多糖lcps
‑1‑
a,加入2ml的3mol/l三氟乙酸(tfa),120℃条件下反应6h。反应结束后,加1~2ml甲醇,旋干反应液,再次加1~2ml甲醇,旋干,重复3次,以充分除尽tfa。加入800μl去离子水复溶。取100μl复溶多糖溶液,加入100μl 0.3mol/l的naoh和100μl 0.5mol/l的pmp甲醇溶液,混匀后在70℃条件下反应30min。反应结束后加入105μl的0.3mol/l hcl中和。加入200μl去离子水稀释溶液。加入700μl氯仿,14000rpm离心8min,取上清,再次加入700μl氯仿14000rpm离心8min,重复三次,以充分除尽pmp。取上清,经0.45μm滤膜过滤,使用hplc进行检测,色谱条件如上。
[0134]
结果如图9所示。
[0135]
对比混合单糖标准品和豆荚软珊瑚多糖纯化多糖lcps
‑1‑
a的色谱图,可以得到豆荚软珊瑚多糖纯化多糖lcps
‑1‑
a的单糖组成为甘露糖:鼠李糖:葡萄糖醛酸:葡萄糖:半乳糖:木糖=0.19:0.21:0.05:98.8:0.46:0.26(百分含量wt%)。
[0136]
(3)lcps
‑1‑
a核磁共振分析:
[0137]
取30mg上述实施例中制备得到的豆荚软珊瑚多糖纯化多糖lcps
‑1‑
a溶于0.55ml的重水中,反复冻干三次。使用600mhz核磁共振仪进行测定。
[0138]
结果如图10和11所示。
[0139]
豆荚软珊瑚多糖纯化多糖lcps
‑1‑
a的氢谱为:
[0140]1h nmr(600mhz,d2o)δ6.77
–
4.68(m,64h),4.78(s,3h),4.72(s,7h),4.70(s,45h),
4.89
–
3.67(m,80h),3.46(d,j=136.8hz,15h),3.07(s,4h),3.05
–
2.68(m,2h)。
[0141]
碳谱为:
[0142]
13
c nmr(151mhz,d2o)δ99.29(d,j=212.4hz),77.72(s),74.11(s),74.11(s),74.03
–
72.65(m),71.72(s),70.66(dd,j=243.3,116.1hz),61.51(d,j=288.7hz),38.71(s)。
[0143]
根据图10和11可知,lcps
‑1‑
a在异头质子区有两个主要的信号峰,1h
‑
nmr谱中两个主要的信号峰分别为5.29ppm和4.90ppm,由此可以推断lcps
‑1‑
a可能有两种糖残基。4.70ppm的信号来自于溶剂重水,而3.0ppm到4.5ppm之间的信号峰叠加,难以辨别与归属,因此一般不做分析。
13
c
‑
nmr谱中,异头碳的化学范围在90~110ppm。由谱图可知,异头碳区域主要有两个信号峰,分别为99.99ppm与98.58ppm,结果与氢谱相对应。结合氢谱和碳谱的信号峰可知,lcps
‑1‑
a的两种糖残基均为α构型糖苷键(碳谱的信号峰在97
‑
103ppm之间属于α构型糖苷键,结果与氢谱相互应证)。
[0144]
(4)lcps
‑1‑
a的红外分析:
[0145]
将背景调零后,取适量上述实施例中制备得到的豆荚软珊瑚多糖纯化多糖lcps
‑1‑
a,用红外光谱仪在4000~400cm
‑1的范围内进行扫描。
[0146]
结果如图12所示。
[0147]
可以发现,lcps
‑1‑
a在3326cm
‑1处有强而宽的馒头峰,该馒头峰是由
‑
oh伸缩振动所引起的,属于多糖的特征吸收峰。在2900cm
‑1附近的峰则是由c
‑
h伸缩振动导致的,属于多糖的另一特征吸收峰。而1640cm
‑1处的峰为水峰,表明多糖中含有一定量的结合水。1356cm
‑1处的峰是由c
‑
o伸缩振动与c
‑
h弯曲振动所引起的。1152cm
‑1与1078cm
‑1处的特征峰表明lcps
‑1‑
a归属于α构型的阿拉伯呋喃糖,1025cm
‑1处的吸收峰也可以证明α
‑
(1
→
6)糖苷键与吡喃糖的存在。此外,578cm
‑1附近的吸收峰也表明了糖苷键的存在。由此可知,lcps
‑1‑
a是典型的多糖化合物。
[0148]
(5)lcps
‑1‑
a的紫外扫描:
[0149]
取适量上述实施例中制备得到的豆荚软珊瑚多糖纯化多糖lcps
‑1‑
a与水配制成1mg/ml的溶液,于190~400nm进行紫外扫描。
[0150]
结果如图13所示。
[0151]
可以发现,lcps
‑1‑
a在260nm与280nm处无明显紫外吸收,提示lcps
‑1‑
a几乎没有核酸与蛋白质的存在,是一种纯度较高的多糖。
[0152]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。