基于cyp3a4酶抑制法的生鲜果蔬中农药残留的快速检测方法
技术领域
1.本发明属于农药残留快速检测领域,具体涉及荧光探针底物及其在农药残留检测中的应用。
背景技术:
2.在社会经济发展的新时期,我国食用农产品的种类与数量不断增长,在这一背景下,杀虫剂、杀菌剂、生长素等农药被广泛使用,致使蔬菜水果质量安全控制过程面临着严峻挑战。因此,探索高效、快速筛查低浓度农药残留的检测方法对于保障食品安全具有重要意义。目前,国内外传统的农药残留检测技术主要包括气相色谱法、高效液相色谱法及其和质谱技术的联用等,上述方法对样品的前处理过程繁琐、具有破坏性,且检测仪器笨重、价格昂贵,无法实现市场迫切需要的农药残留的快速检测。近年来荧光探针技术发展越来越成熟,已逐步应用于生物体内酶活性检测领域,将酶抑制法原理与荧光探针技术相结合,为实现高通量、广谱、快速检测农药残留提供了新的思路。中国发明专利(zl201810408171.6)是基于胆碱酯酶和检测其活性的荧光探针的酶抑制方法,开发的一种快速检测氨基甲酸酯和有机磷类农药残留。
3.细胞色素氧化酶(cyp3a4,源于肝微粒体)的表达受多种刺激的影响,包括杀虫剂和杀菌剂等环境因素,其个体差异可通过调节性激素代谢物水平在乳腺癌和前列腺癌的发生中起作用,农药对酶的抑制率与农药的含量存在线性关系。因此cyp3a4不但具有非常重要的生理功能,还是检测农药的重要生物标志物。已报道的大部分用于检测cyp3a4的荧光探针特异性差,选择性弱,通常是与cyp1a1和cyp1a2而非cyp3a4的优先反应。中国发明专利(cn109928927
‑
a)通过采用二维分子设计策略,成功开发出首个用于选择性检测cyp3a4的双光子荧光探针nen,为体外和体内内源性cyp3a4活性的定量表征提供了新方法。国家标准gb 2763
‑
2019(食品安全国家标准食品中农药最大残留限量,气相色谱及高效液相色谱法)关于农残检出限提出了更高的标准。基于cyp3a4酶抑制原理和nen荧光探针技术开发的农药残留快速检测方法,具有检测快速、操作方便、检测限低等优点。
附图说明
4.图1是cyp3a4与荧光探针nen的荧光响应机制。
5.图2是体系内荧光强度随反应时间的变化。
6.图3是人肝微粒体蛋白浓度对检测体系影响。
7.图4是cyp3a4与探针nen反应的的动力学曲线。
8.图5是烯酰吗啉的浓度对数与酶抑制率的标准曲线。
9.图6是咪鲜胺的浓度对数与酶抑制率的标准曲线。
10.图7是苯醚甲环唑的浓度对数与酶抑制率的标准曲线。
11.图8是氯氰菊酯的浓度对数与酶抑制率的标准曲线。
12.图9是毒死蜱的浓度对数与酶抑制率的标准曲线。
13.图10是百菌清的浓度对数与酶抑制率的标准曲线。
14.图11是哒螨灵的浓度对数与酶抑制率的标准曲线。
15.图12是甲基毒死蜱的浓度对数与酶抑制率的标准曲线。
具体实施方式
16.实例1:荧光探针底物nen的合成
17.合成路线:
[0018][0019]
将1,8
‑
萘酸酐(5mmol)和乙胺(thf中为2.0mol/l,5.5mmol)溶解在30ml乙醇中,搅拌回流12小时。冷却至室温后,分离沉淀物,用乙醇洗涤,并干燥,得到乳白色固体,产率为63%。1h nmr(500mhz,cdcl3)δ8.65
–
8.58(m,2h),8.21(d,j=8.3hz,2h),7.79
–
7.73(m,2h),4.26(q,j=7.1hz,2h),1.34(t,j=7.1hz,3h).
[0020]
实施例2:荧光强度随cyp3a4与探针nen反应时间的变化
[0021]
(1)设置反应时间分别为5、10、15、20、25、30、35、40、45、50min十个梯度的实验组,其他条件均相同。孵育体系为100mm磷酸缓冲液,总体积300μl,其中包括:nadph生成系统(1mm nadp
、10mm葡萄糖
‑6‑
磷酸、1unit/ml葡萄糖
‑6‑
磷酸脱氢酶)、4mm mgcl2、人肝微粒体(hlm,终浓度为50μg/ml);
[0022]
(2)cyp3a4酶的探针底物nen(终浓度为10μg/ml)在hlm存在的体系下于37℃孵育锅中预孵3分钟;
[0023]
(3)向反应体系中加入nadp
作为辅因子起始反应;
[0024]
(4)每个实验组在相应时间反应完毕后,加入200μl冰乙腈沉淀蛋白终止催化反应,然后在4℃,20000g条件下,离心10min,取上清液于比色皿中;
[0025]
(5)启动荧光检测仪,与手机app连接,激发波长设置为465nm,发射信号采集为560nm;
[0026]
(6)将比色皿放入检测仪,在手机app上读取数据,保存
[0027]
实施例3:cyp3a4蛋白浓度对体系影响
[0028]
(1)孵育体系为100mm磷酸缓冲液,总体积300μl,其中包括:nadph生成系统(1mm nadp
、10mm葡萄糖
‑6‑
磷酸、1unit/ml葡萄糖
‑6‑
磷酸脱氢酶)、4mm mgcl2、hlm(终浓度分别为0、10、20、30、40、50、60、70、80μg/ml);
[0029]
(2)cyp3a4酶的探针底物nen(终浓度为10μg/ml)在hlm存在的体系下于37℃孵育锅中预孵3分钟;
[0030]
(3)向反应体系中加入nadp 作为辅因子起始反应;
[0031]
(4)30分钟后加入200μl冰乙腈沉淀蛋白终止催化反应,然后在4℃,20000g条件下,离心10min,取上清液于比色皿中;
[0032]
(5)启动荧光检测仪,与手机app连接,激发波长设置为465nm,发射信号采集为
560nm;(6)将比色皿放入检测仪,在手机app上读取数据,保存
[0033]
实施例4:cyp3a4与探针nen反应的动力学行为
[0034]
(1)孵育体系为100mm磷酸缓冲液,总体积300μl,其中包括:nadph生成系统(1mm nadp
、10mm葡萄糖
‑6‑
磷酸、1unit/ml葡萄糖
‑6‑
磷酸脱氢酶)、4mm mgcl2、hlm(终浓度为50μg/ml);
[0035]
(2)cyp3a4酶的探针底物nen(终浓度分别为0、1、2、5、10、20、30、40、50μg/ml)在hlm存在的体系下于37℃孵育锅中预孵3分钟;
[0036]
(3)向反应体系中加入nadp 作为辅因子起始反应;
[0037]
(4)30分钟后加入200μl冰乙腈沉淀蛋白终止催化反应,然后在4℃,20000g条件下,离心10min,取上清液于比色皿中;
[0038]
(5)启动荧光检测仪,与手机app连接,激发波长设置为465nm,发射信号采集为560nm;
[0039]
(6)将比色皿放入检测仪,在手机app上读取数据,保存
[0040]
计算得到酶与荧光探针的动力学常数,km=12.4,vmax=960
[0041]
实例5:果蔬中农残萃取方法
[0042]
蔬菜、水果的可食用部分,称取试样0.3g于2ml的离心管中,加入1.5ml萃取液(乙酸乙酯/丙酮=9:1),在震荡混合器萃取5min。离心后,取100μl上清液至2ml离心管中,吹干。加入0.6ml pbs(100mm,ph=7.4)溶解,待测。
[0043]
实例6:农药残留检测方法
[0044]
(1)取pbs溶解后的萃取液300μl加入4mm mgcl2、探针底物nen(终浓度为10μg/ml)、hlm人肝微粒体(终浓度为50μg/ml),在37℃孵育锅中预孵反应3min;
[0045]
(2)取预孵溶液300μl加入1mm nadp
、10mm葡萄糖
‑6‑
磷酸、1unit/ml葡萄糖
‑6‑
磷酸脱氢酶进行起始反应;
[0046]
(3)30分钟后加入200μl冰乙腈沉淀蛋白终止催化反应,然后在4℃,20000g条件下,离心10min,取上清液于比色皿中;
[0047]
(4)启动荧光检测仪,与手机app连接,激发波长设置为465nm,发射信号采集为560nm;
[0048]
(5)将比色皿放入检测仪,在手机app上读取数据,保存;
[0049]
(6)酶活性抑制率计算公式:抑制率(%)=[(a0–
a1)/a0]
·
100
[0050]
式中,a0为空白(无农药)相对荧光强度,a1为测试组(含农药)相对荧光强度。
[0051]
实例7:烯酰吗啉、咪鲜胺等八种农药的浓度标准曲线
[0052]
(1)孵育体系为100mm磷酸缓冲液,总体积300μl,其中包括:nadph生成系统(1mm nadp
、10mm葡萄糖
‑6‑
磷酸、1unit/ml葡萄糖
‑6‑
磷酸脱氢酶)、4mm mgcl2、hlm(终浓度为50μg/ml)、不同种类不同梯度的农药标准品;
[0053]
(2)先将农药、探针底物nen(终浓度为10μg/ml)在hlm存在的体系下于37℃孵育锅中预孵3分钟;
[0054]
(3)向反应体系中加入nadp
作为辅因子起始反应;
[0055]
(4)30分钟后加入200μl冰乙腈沉淀蛋白终止催化反应,然后在4℃,20000g条件下,离心10min,取上清液于比色皿中;
[0056]
(5)启动荧光检测仪,与手机app连接,激发波长设置为465nm,发射信号采集为560nm;(6)将比色皿放入检测仪,在手机app上读取数据,保存;
[0057]
(7)酶活性抑制率计算公式:抑制率(%)=[(a0–
a1)/a0]
·
100
[0058]
式中,a0为空白(无农药)相对荧光强度,a1为测试组(含农药)相对荧光强度。
[0059]
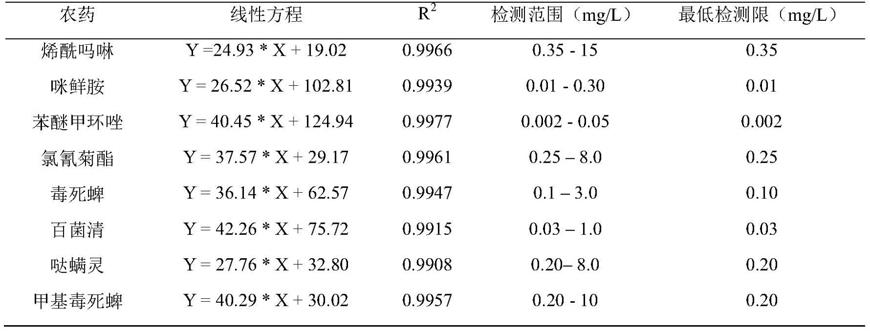
(8)八种农药的线性方程、r2值、检测范围及最低检测限见表1。
[0060]
表1八种农药的线性方程、r2值、检测范围及最低检测限
[0061][0062]
表2烯酰吗啉加标回收率
[0063][0064]
表3咪鲜胺加标回收率
[0065][0066]
表4苯醚甲环唑加标回收率
[0067][0068]
表5氯氰菊酯加标回收率
[0069][0070]
表6毒死蜱加标回收率
[0071][0072]
表7百菌清加标回收率
[0073][0074]
表8哒螨灵加标回收率
[0075][0076][0077]
表9甲基毒死蜱加标回收率
[0078][0079]
实施例8:测试果蔬样品中农药加标回收实验
[0080]
称取一定质量的苹果、西红柿、青辣椒、芹菜各7份,其中2份做空白对照组(不喷洒农药),5份作为实验组。在0.30g果蔬表面喷洒烯酰吗啉(甲醇溶,15mg/l)20μl,室温下晾干后(20
‑
30min左右),按照实例5进行萃取,最后按照实例6检测,根据抑制率计算结果再乘以总稀释倍数。将得到的抑制率代入到之前得到的抑制率
‑
农药浓度对数标准曲线方程中,得到计算浓度,求得加标回收率。
[0081]
其他农药的处理步骤与上面相同,只是加样浓度不同。最终8种农药的理论回收浓度分别为:烯酰吗啉、氯氰菊酯、毒死蜱、百菌清、哒螨灵、甲基毒死蜱均为15mg/l;咪鲜胺和苯醚甲环唑均为0.3mg/l。
[0082]
本发明的检测方法,对果蔬中农残的加标回收率达到行业80
‑
110%标准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。