本发明涉及与B7-H3特异性结合的抗B7-H3抗体及其用途,更详细地,涉及抗B7-H3抗体或其抗原结合片段、编码其的核酸、包含所述核酸的载体、用所述载体进行转化的细胞、所述抗体或其抗原结合片段的制备方法、包含所述抗体或其抗原结合片段的抗体-药物偶联物(Antibody-drugconjugate)或多特异性抗体、包含其的用于预防或治疗癌症、自身免疫疾病或炎症性疾病的药物组合物、或包含其的用于诊断癌症、自身免疫疾病或炎症性疾病的组合物。
背景技术:
我们的免疫系统是被微调的,以有效地消除入侵的病原体,同时保持对自身抗原的耐受性。其中,T淋巴细胞(Tlymphocyte)是能够消除肿瘤细胞的主要细胞(Effectorcell)。免疫检查点(Immunecheckpoint)作为对T淋巴细胞活性起到重要作用的共信号分子,通过调节来抑制(inhibitory)或刺激(stimulatory)TCR(T细胞受体)信号(Immunologicalreviews2017,276:52-65)。作为逃避免疫监视(immunesurveillance)的一环,一些肿瘤细胞会在细胞表面表达负责抑制的免疫检查点分子的配体蛋白,从而阻碍T淋巴细胞的功能并造成肿瘤微环境(tumormicro-environment)的变化,进而抑制免疫。在成功的肿瘤免疫疗法中具有代表性的包括作为抑制性免疫检查点分子的CTLA-4(cytotoxicTlymphocyteantigen-4,细胞毒性T淋巴细胞相关抗原4)和PD-1(programmeddeath-1,程序性死亡受体1)、作为与此相应的抗原递呈细胞和肿瘤细胞配体的来自B7家族分子的B7.1(CD80)及B7.2(CD86)和B7-H1/PD-L1(programmeddeath-ligand-1,程序性死亡配体1)的单克隆抗体阻断剂(blockade)(新英格兰医学期刊(NEnglJMed.),2011,364(26):2517-2526;新英格兰医学期刊,2012,366(26)2455-2465;和新英格兰医学期刊,2013,369(2):134-144)。B7-H3(B7同源物3,或CD276(分化簇276))作为B7家族的成员,与B7.1(CD80)、B7.2(CD86)、B7-H1(PD-L1)、B7-DC(PD-L2)、B7-H2(ICOSL)、B7-H4(B7S1,B7x,Vtcn1)、B7-H5(VISTA,GI24,Dies1,PD-1H)、B7-H6(NCR3LG1)及B7-H7(HHLA2)具有20至30%的结构同源性(血液(Blood)2013,121(5):734-744;及分子癌症治疗学(MolecularCancerTherapeutics)2017,16(7):1203-1211),是具有多种生物学功能的系统性保守蛋白质。在首次发现的2001年被介绍为共刺激分子配体(自然免疫学(NatureImmunology)2001,2(3):269274),但根据最近的研究结果发现,作为在活化的T细胞或NK细胞上表达的某种免疫抑制受体的配体形成结合体时,可以对抗原受体信号进行负调控(欧洲免疫学杂志(EurJimmunol.)2009,39(7):1754-1764等),其结合伴侣尚不清楚。B7-H3mRNA存在于各种正常组织中,但很少表达蛋白质。当给予免疫激活信号时,在单核细胞、巨噬细胞或树突细胞等中会诱导蛋白质表达,但在各种实体肿瘤中过表达,并且在前列腺癌、卵巢癌、乳腺(breast)癌、结肠癌、肾癌、非小细胞肺(non-smallcelllung)癌、胰腺癌、头颈(headandneck)癌、黑素瘤(melanoma)、胶质母细胞瘤(glioblastoma)、神经母细胞瘤(neuroblastoma)及其他肿瘤(例如儿童小圆蓝细胞瘤(smallroundbluecelltumorsofchildhood))等中观察到表达。在人B7-H3中,4Ig-B7-H3(IgV-IgC-IgV-IgC)是主要形式,并少量发现2Ig-B7-H3,而在鼠(Murine)中是2Ig-B7-H3形式。然而,两种形式都显示出相似的功能(基因生物学(GenomeBiol.)2005,6:233.1-233.7;美国国家科学院院刊(PNAS)2008,105(30):10277-10278)。4Ig-B7-H3能够抑制自然杀伤细胞(Naturalkillercell)的抗肿瘤作用(美国国家科学院院刊2004,101(34):12640-12645)。据推测B7-H3抑制信号是通过与参与TCR信号传导的分子(NF-kB、AP-1、NFAT等)的相互作用而产生,在动物实验中观察到抑制Th1(辅助T细胞)、Th2或Th17(免疫学杂志(J.Immunol.)2004,173:2500-2506;免疫评论(Immunol.Rev.)2009,229(1):145-151)。B7-H3在正常细胞中蛋白表达非常有限,但在原发性(primary)和转移性(metastatic)肿瘤以及肿瘤血管系统(tumorvasculature)中会显著增加,并且在包括已分化的(differentiated)肿瘤细胞、肿瘤起始(initiating)或癌症干(cancerstem)细胞在内的多数细胞类型中发现(Medicographia2014,36(2):285-292;癌细胞(Cancercell)2017,31:501-515),其表达在某些肿瘤类型中与不良预后(prognosis)密切相关。在包括针对B7-H3的单克隆抗体在内的各种修饰抗体的开发过程中,已获得有希望的治疗效果,并且正在进行临床开发(Medicographia2014,36(2):285-292)。在此技术背景下,本发明人开发了一种抗B7-H3抗体,其对人B7-H3以及非人(Non-human;例如猕猴、小鼠、大鼠等)B7-H3具有亲和力并特异性结合,证实了该抗体与细胞表面B7-H3结合后被引入到细胞内,并能够作为所需的免疫抗癌剂、或自身免疫疾病或炎症疾病的治疗剂发挥作用,从而完成了本发明。在
背景技术:
中描述的上述信息仅用于提高对本发明背景的理解,并且对本领域的普通技术人员来说其中可能未包括构成已知现有技术的信息。技术实现要素:本发明的目的在于提供一种与B7-H3特异性结合的抗B7-H3抗体或其抗原结合片段。本发明的另一个目的在于提供一种编码所述抗体或其抗原结合片段的核酸及包含其的载体。本发明的又另一个目的在于提供一种用所述载体进行转化(transformation)的细胞、以及使用其制备所述抗体或其抗原结合片段的方法。本发明的又另一个目的在于提供一种包含所述抗体或其抗原结合片段的用于预防或治疗癌症或肿瘤、自身免疫疾病或炎症性疾病的药物组合物、以及使用其治疗所述疾病的方法。本发明的又另一个目的在于提供一种包含所述抗体或其抗原结合片段的抗体-药物偶联物或多特异性抗体。本发明的又另一个目的在于提供一种用于预防或治疗癌症或肿瘤、自身免疫疾病或炎症性疾病的药物组合物、以及使用其治疗所述疾病的方法,其中所述药物组合物包含所述抗体或其抗原结合片段、所述抗体-药物偶联物或多特异性抗体。本发明的又另一个目的在于提供一种用于诊断癌症或肿瘤、自身免疫疾病或炎症性疾病的组合物、以及使用其诊断所述疾病的方法,其中所述组合物包含所述抗体或其抗原结合片段、所述抗体-药物偶联物或多特异性抗体。为了实现上述目的,本发明提供一种抗B7-H3抗体或其抗原结合片段,其包含选自SEQIDNo:1、7、13及19所示的重链CDR1;选自SEQIDNo:2、8、14及20所示的重链CDR2;选自SEQIDNo:3、9、15及21所示的重链CDR3;选自SEQIDNo:4、10、16、22、24、26、28、30、33及35所示的轻链CDR1;选自SEQIDNo:5、11、17及31所示的轻链CDR2;以及选自SEQIDNo:6、12、18、23、25、27、29、32、34及36所示的轻链CDR3。本发明还提供一种编码所述抗B7-H3抗体或其抗原结合片段的核酸、包含所述核酸的重组表达载体、及用所述重组表达载体进行转化的细胞。本发明还提供一种抗B7-H3抗体或其抗原结合片段的制备方法,包括:(i)培养所述转化的细胞的步骤;以及(ii)从获得的细胞培养物中回收抗B7-H3抗体或其抗原结合片段的步骤。本发明还提供一种包含所述抗B7-H3抗体或其抗原结合片段、及药物的抗体-药物偶联物(antibody-drugconjugate,ADC)。本发明还提供一种包含所述抗B7-H3抗体或其抗原结合片段的多特异性抗体。本发明还提供一种用于预防或治疗癌症或肿瘤、自身免疫疾病或炎症性疾病的药物组合物、以及使用其治疗所述疾病的方法,其中所述药物组合物包含作为有效成分的所述抗B7-H3抗体或其抗原结合片段、所述抗体-药物偶联物或所述多特异性抗体、及药学上可接受的添加剂。本发明还提供一种用于诊断癌症或肿瘤、自身免疫疾病或炎症性疾病的组合物、以及使用其诊断所述疾病的方法,其中所述组合物包含所述抗B7-H3抗体或其抗原结合片段、所述抗体-药物偶联物或所述多特异性抗体。附图说明图1为B7-H3表达载体的示意图。图2示出了在不同淘选次数下多scFV-噬菌体对B7-H3抗原的结合能力的测定结果。图3示出了确认单scFV-噬菌体的B7-H3-His特异性结合能力的ELISA测定结果。图4示出了通过SDS-PAGE确认筛选的B7-H3抗体的结果。图5示出了对每个细胞系测定B7-H3表达水平的FACs结果。图6a至图6d示出了用FACs测定筛选的B7-H3抗体对细胞表面B7-H3的结合力的结果,图6a示出了CD276-033E03抗体对各细胞系的结合力测定结果,图6b示出了CD276-051H04抗体对各细胞系的结合力测定结果,图6c示出了CD276-039C05及CD276-040F10抗体对各细胞系的结合力测定结果,图6d分别示出了6个抗体对各细胞系的结合力测定结果。图7a至图7e示出了测定筛选的B7-H3抗体对多种B7-H3抗原的结合力的ELISA结果。图8示出了测定筛选的B7-H3抗体和FcRn复合蛋白质的结合力的ELISA结果。图9a及图9b示出了筛选的B7-H3抗体和细胞表面B7-H3抗原的复合体的细胞内流入的测定结果,图9a示出了筛选的B7-H3抗体随时间的细胞内流入的确认结果,图9b示出了在第18小时测定抗体的细胞内流入程度的结果。图10示出了筛选的B7-H3抗体流入细胞内而引起的细胞毒性测定结果。具体实施方式除非另有定义,否则在本说明书中使用的所有技术术语和科学术语的含义与本发明所属领域技术人员通常理解的含义相同。通常,本说明书中使用的命名法是在本
技术领域:
中公知且通常使用的。作为根据本发明的抗B7-H3抗体或其抗原结合片段的抗原,B7-H3蛋白质与免疫细胞的活性抑制密切相关,是存在于免疫细胞表面的膜蛋白质,作为免疫细胞的辅助抑制受体而起作用。所述B7-H3可以来源于哺乳动物,例如人和猴等灵长类动物、小鼠和大鼠等啮齿类动物。在本说明书中,术语“B7-H3”是统指由细胞天然表达的B7-H3的任意变体、同种型(isotype)及种同源物的概念。优选地,是指人的B7-H3,但不限于此,并且可以是包括其他哺乳动物的B7-H3在内的概念。在本发明中,所述抗B7-H3抗体或其抗原结合片段优选与SEQIDNO:65所示的人B7-H3蛋白质的氨基酸序列或其一部分特异性结合,但不限于此。在本说明书所用的术语“抗体(antibody)”是指与B7-H3特异性结合的抗B7-H3抗体。本发明的范围不仅包括与B7-H3特异性结合的完全抗体形式,还包括所述抗体分子的抗原结合片段。完全抗体的结构具有两条全长轻链和两条全长重链,每条轻链通过二硫键与重链相连。重链恒定区具有γ、μ、α、δ和ε类型,并具有作为子类的γ1、γ2、γ3、γ4、α1和α2。轻链的恒定区具有κ和λ类型。抗体的“抗原结合片段”或“抗体片段”是指具有抗原结合功能的片段,可为Fab、F(ab')、F(ab')2和Fv等的形式。在抗体片段中,Fab的结构具有轻链及重链的可变区和轻链的恒定区及重链的第一恒定区(CH1),并具有一个抗原结合位点。Fab'与Fab的不同之处在于,Fab'在重链CH1域的C末端具有包含一个或多个半胱氨酸残基的铰链区(hingeregion)。F(ab')2抗体是由两个Fab'的铰链区的半胱氨酸残基通过形成二硫键而生成。Fv是指仅具有重链可变区和轻链可变区的最小的抗体片段。在双链Fv(two-chainFv)中重链可变区和轻链可变区通过非共价键相连,在单链Fv(single-chainFv,scFv)中一般是通过肽键使重链可变区和轻链可变区连接或在C末端直接连接,因此可以像双链Fv一样形成如二聚体(dimer)的结构。这种抗体片段可利用蛋白水解酶获得(例如,针对整个抗体,用木瓜蛋白酶进行限制性剪切则可以获得Fab,用胃蛋白酶进行剪切则可以获得F(ab')2片段),也可以通过基因重组技术来制得。在一个实施例中,根据本发明的抗体为Fv(例如scFv)形式或完全抗体形式。此外,重链恒定区可为γ、μ、α、δ或ε中的任一种同种型。例如,恒定区为γ1(IgG1)、γ3(IgG3)或γ4(IgG4)。轻链恒定区可为κ型或λ型。本发明的抗体包括单克隆抗体、多特异性抗体、人抗体、人源化抗体、嵌合抗体(chimeraantibody)、单链Fvs(scFV)、单链抗体、Fab片段、F(ab')片段、二硫键连接的Fvs(sdFV)及抗-独特型(抗-Id)抗体、或所述抗体的表位结合片段等,但不限于此。例如,本发明的抗体可为构成抗体的所有氨基酸序列均由人免疫球蛋白序列组成的人抗体序列,并且根据需要可按照本领域已知的方法修饰成人源化抗体、嵌合抗体等的各种形式。如本申请中所用,“抗体可变域”是指包含互补决定区(ComplementarityDeterminingRegion;CDR)和框架区(FrameworkRegion;FR)的氨基酸序列的抗体分子的轻链和重链部分。VH是指重链的可变域。VL是指轻链的可变域。“互补决定区”(CDR;即CDR1、CDR2、及CDR3)是指抗原结合所需的抗体可变域的氨基酸残基。各个可变域通常具有被确认为CDR1、CDR2及CDR3的三个CDR区。本发明提供一种抗B7-H3抗体或其抗原结合片段,其包含选自SEQIDNo:1、7、13及19所示的重链CDR1;选自SEQIDNo:2、8、14及20所示的重链CDR2;选自SEQIDNo:3、9、15及21所示的重链CDR3;选自SEQIDNo:4、10、16、22、24、26、28、30、33及35所示的轻链CDR1;选自SEQIDNo:5、11、17及31所示的轻链CDR2;以及选自SEQIDNo:6、12、18、23、25、27、29、32、34及36所示的轻链CDR3。具体地,本发明的抗B7-H3抗体或其抗原结合片段包含,SEQIDNO:1所示的重链CDR1、SEQIDNO:2所示的重链CDR2、SEQIDNO:3所示的重链CDR3、SEQIDNO:4所示的轻链CDR1、SEQIDNO:5所示的轻链CDR2、及SEQIDNO:6所示的轻链CDR3;SEQIDNO:7所示的重链CDR1、SEQIDNO:8所示的重链CDR2、SEQIDNO:9所示的重链CDR3、SEQIDNO:10所示的轻链CDR1、SEQIDNO:11所示的轻链CDR2、及SEQIDNO:12所示的轻链CDR3;SEQIDNO:13所示的重链CDR1、SEQIDNO:14所示的重链CDR2、SEQIDNO:15所示的重链CDR3、SEQIDNO:16所示的轻链CDR1、SEQIDNO:17所示的轻链CDR2、及SEQIDNO:18所示的轻链CDR3;SEQIDNO:19所示的重链CDR1、SEQIDNO:20所示的重链CDR2、SEQIDNO:21所示的重链CDR3、SEQIDNO:22所示的轻链CDR1、SEQIDNO:11所示的轻链CDR2、及SEQIDNO:23所示的轻链CDR3;SEQIDNO:19所示的重链CDR1、SEQIDNO:20所示的重链CDR2、SEQIDNO:21所示的重链CDR3、SEQIDNO:24所示的轻链CDR1、SEQIDNO:11所示的轻链CDR2、及SEQIDNO:25所示的轻链CDR3;SEQIDNO:19所示的重链CDR1、SEQIDNO:20所示的重链CDR2、SEQIDNO:21所示的重链CDR3、SEQIDNO:26所示的轻链CDR1、SEQIDNO:11所示的轻链CDR2、及SEQIDNO:27所示的轻链CDR3;SEQIDNO:19所示的重链CDR1、SEQIDNO:20所示的重链CDR2、SEQIDNO:21所示的重链CDR3、SEQIDNO:28所示的轻链CDR1、SEQIDNO:5所示的轻链CDR2、及SEQIDNO:29所示的轻链CDR3;SEQIDNO:19所示的重链CDR1、SEQIDNO:20所示的重链CDR2、SEQIDNO:21所示的重链CDR3、SEQIDNO:30所示的轻链CDR1、SEQIDNO:31所示的轻链CDR2、及SEQIDNO:32所示的轻链CDR3;SEQIDNO:19所示的重链CDR1、SEQIDNO:20所示的重链CDR2、SEQIDNO:21所示的重链CDR3、SEQIDNO:33所示的轻链CDR1、SEQIDNO:11所示的轻链CDR2、及SEQIDNO:34所示的轻链CDR3;或SEQIDNO:19所示的重链CDR1、SEQIDNO:20所示的重链CDR2、SEQIDNO:21所示的重链CDR3、SEQIDNO:35所示的轻链CDR1、SEQIDNO:11所示的轻链CDR2、及SEQIDNO:36所示的轻链CDR3。此外,本发明的抗B7-H3抗体或其抗原结合片段可包含SEQIDNo:37、39、41或43所示的重链可变区,或包含SEQIDNo:38、40、42、44、45、46、47、48、49或50所示的轻链可变区。具体地,可包含SEQIDNO:37所示的重链可变区和SEQIDNO:38所示的轻链可变区;SEQIDNO:39所示的重链可变区和SEQIDNO:40所示的轻链可变区;SEQIDNO:41所示的重链可变区和SEQIDNO:42所示的轻链可变区;SEQIDNO:43所示的重链可变区和SEQIDNO:44所示的轻链可变区;SEQIDNO:43所示的重链可变区和SEQIDNO:45所示的轻链可变区;SEQIDNO:43所示的重链可变区和SEQIDNO:46所示的轻链可变区;SEQIDNO:43所示的重链可变区和SEQIDNO:47所示的轻链可变区;SEQIDNO:43所示的重链可变区和SEQIDNO:48所示的轻链可变区;SEQIDNO:43所示的重链可变区和SEQIDNO:49所示的轻链可变区;或SEQIDNO:43所示的重链可变区和SEQIDNO:50所示的轻链可变区。“框架区”(FR)是CDR残基以外的可变域残基。各个可变域通常具有被确认为FR1、FR2、FR3及FR4的四个FR。所述抗体为单价或二价,并且包含单链或双链。在功能上,所述抗体的结合亲和力(KD)的范围为10-8M至10-12M。例如,所述抗体的结合亲和力为10-8M至10-12M、10-9M至10-12M、10-10M至10-12M、10-8M至10-11M、10-9M至10-11M、10-10M至10-11M、10-8M至10-10M、10-9M至10-10M、或10-8M至10-9M。“噬菌体展示”是一种将变体多肽在噬菌体例如丝状噬菌体颗粒的表面上与外壳蛋白的至少一部分的融合蛋白进行展示的技术。噬菌体展示的用处在于,针对大型的随机化蛋白质变体文库,能够对与靶抗原以高亲和力结合的序列进行迅速且有效地分类。将肽和蛋白质文库展示在噬菌体上的技术已被用于筛选数百万个多肽,以寻找具有特异性结合特性的多肽。与用于制备具有所需特性的抗体的常规杂交瘤和重组方法相比,噬菌体展示技术的优点在于能够在短时间内生成具有各种序列的大型抗体文库的优势。此外,由于完全不需要免疫,噬菌体抗体文库针对有毒性或低抗原性的抗原也能够生成抗体。通过使用噬菌体抗体文库,还可以生成和确认新型治疗性抗体。能够从噬菌体展示文库中确认和分离高亲和力抗体的技术对于治疗用新型抗体的分离非常重要。从文库(library)中分离高亲和力抗体可能取决于文库的大小、细菌细胞的生产效率和文库的多样性。本发明的抗B7-H3抗体或其抗原结合片段也包括在抗B7-H3抗体或其抗原结合片段中氨基酸序列的一部分通过保守性置换而被置换的抗体或其抗原结合片段。在本说明书中,“保守性置换”是指多肽的修饰,其包括将一个或多个氨基酸置换为不引起该多肽的生物或生化功能的损失且具有相似生化特性的氨基酸。“保守性氨基酸置换”是将氨基酸残基置换为具有相似侧链的氨基酸残基的置换。具有相似侧链的氨基酸残基类别在本领域中已被定义且已知。这些类别包括具有碱性侧链的氨基酸(例如赖氨酸、精氨酸、组氨酸)、具有酸性侧链的氨基酸(例如天冬氨酸、谷氨酸)、具有不带电荷的极性侧链的氨基酸(例如甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸)、具有非极性侧链的氨基酸(例如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸)、具有β-支链侧链的氨基酸(例如苏氨酸、缬氨酸、异亮氨酸)及具有芳香族侧链的氨基酸(例如酪氨酸、苯丙氨酸、色氨酸、组氨酸)。本发明的抗体即使存在如上所述的保守性氨基酸置换仍可保持活性。本发明还提供一种编码根据本发明的抗B7-H3抗体或其抗原结合片段的核酸。在本说明书中使用的核酸可存在于细胞、细胞溶解产物(lysate)中,或者可以以部分纯化形式或实质上纯净的形式而存在。核酸在通过标准技术从其他细胞成分或其他污染物质(例如其他细胞的核酸或蛋白质)中纯化而出时,即为“离析”或“实质上纯净”的,其中标准技术包括碱/SDS处理、CsCl带化(banding)、柱层析、琼脂糖凝胶电泳及该
技术领域:
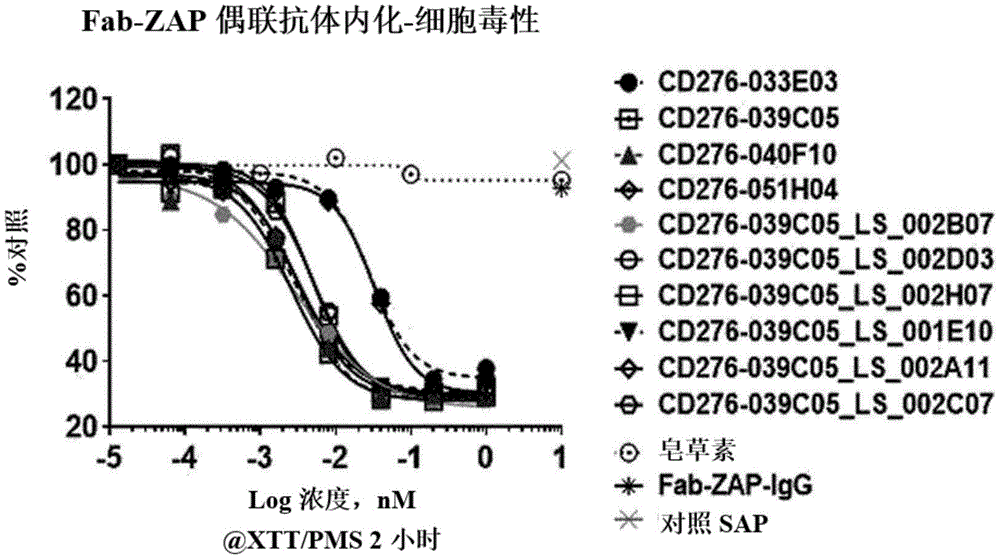
中公知的其他技术。本发明的核酸例如可为DNA或RNA,并且可包含或不包含内含子序列。在核酸中,核酸的基本组成单位核苷酸不仅包括天然核苷酸,还包括糖或碱基区域被修饰的类似物(analogue)。本发明的编码重链和轻链可变区的核酸的序列可被修饰。所述修饰包括核苷酸的添加、缺失、或非保守性置换或保守性置换。在本发明中,编码所述抗B7-H3抗体的核酸可包含选自编码重链可变区的SEQIDNo:51、53、55及57所示的多核苷酸;及编码轻链可变区的SEQIDNo:52、54、56及58至64所示的多核苷酸中的一个或多个序列。考虑到上述具有生物学等效活性的修饰,可认为本发明的抗体或编码其的核酸分子也包含相对于序列编号所示序列具有实质同一性(substantialidentity)的序列。上述的实质同一性意味着,在将上述本发明的序列与任意其他序列最大限度地对应排列,并利用本领域中通常使用的算法对排列的序列进行分析时,显示出90%或以上的同源性、优选95%或以上的同源性、更优选96%或以上、97%或以上、98%或以上、或99%或以上的同源性的序列。这种同源性可按照本领域已知的方法通过序列比较和/或比对(alignment)来确定。例如,可通过使用序列比较算法(例如,NCBI基本局部比对搜索工具;BLAST)、手动比对、肉眼检查等来确定本发明的核酸或蛋白质的序列同源性。在另一个方面,本发明涉及包含所述核酸的重组表达载体。为了根据本发明的抗B7-H3抗体或其抗原结合片段的表达,编码部分或全长的轻链和重链的DNA可通过标准分子生物学技术(例如,PCR扩增或使用了表达靶抗体的杂交瘤的cDNA克隆)获得,并且DNA可通过“可操作地连接”至转录及翻译控制序列而插入到表达载体中。载体成分通常包含但不限于选自以下中的一种或多种:信号序列、复制起点、一个或多个标记基因、增强子因子、启动子和转录终止序列。在本说明书中使用的术语“载体”是指用于在宿主细胞中表达靶基因的手段,包括质粒载体;粘粒载体;病毒载体如细菌噬菌体载体、腺病毒载体、逆转录病毒载体及腺相关病毒载体等。在所述载体中,编码抗体或其抗原结合片段的核酸与启动子可操作地连接。在本说明书中使用的术语“可操作地连接”是指,编码抗体或其抗原结合片段的基因接合(ligation)于载体中,使得载体中的转录及翻译控制序列起到调节抗体基因的转录和翻译的预期功能。所选的表达载体和表达控制序列应与所使用的表达用细胞相容。将抗体的轻链基因和重链基因插入至不同的载体中,或将两种基因插入至相同的表达载体中。通过标准方法(例如,抗体基因片段和载体上的互补限制性内切酶位点的接合,或者如果不存在限制性内切酶位点则为平(blunt)端接合),将抗体基因插入至表达载体中。在某些情况下,所述重组表达载体可包含编码信号肽的序列,所述信号肽有助于从转化的细胞中分泌抗体链。所述抗体链基因和信号肽-编码序列可按框(frame)被克隆到载体中,以使信号肽与抗体链的氨基末端结合并表达。信号肽可为免疫球蛋白信号肽或异源信号肽(即源自除免疫球蛋白之外的蛋白质的信号肽)。此外,所述重组表达载体可包含在转化的细胞中控制抗体链基因表达的调控序列。“调控序列”可包括控制抗体链基因的转录或翻译的启动子、增强子及其他表达控制因子(例如聚腺苷酸化信号)。本领域技术人员可以理解,表达载体的设计将根据待转化细胞的选择、蛋白质表达水平等因素选择不同的调控序列而可能变化。本发明的载体还可以包含与抗体基因融合的其他序列,以促进从载体表达的抗体的纯化。该序列例如可为谷胱甘肽S-转移酶(Pharmacia,美国)、麦芽糖结合蛋白(NEB,美国)、FLAG(IBI,美国)、6xHis(六聚组氨酸;Quiagen,美国)等基因。所述载体包含作为选择标记的本领域常用的抗生素抗性基因,这种基因包括例如氨苄青霉素、庆大霉素、羧苄青霉素、氯霉素、链霉素、卡那霉素、遗传霉素、新霉素和四环素的抗性基因。本发明还提供一种用所述重组表达载体进行转化的细胞。根据本发明的细胞可为动物细胞、植物细胞、酵母、大肠杆菌及昆虫细胞等,但不限于此。具体地,根据本发明的细胞可为原核细胞如大肠杆菌(E.coli)、枯草芽孢杆菌(Bacillussubtilis)、链霉菌属(Streptomycessp.)、假单胞菌属(Pseudomonassp.)、奇异变形杆菌(Proteusmirabilis)或葡萄球菌属(Staphylococcussp.)。此外,可为真菌如曲霉属(Aspergillussp.)、低级真核细胞如毕赤酵母(Pichiapastoris)、酿酒酵母(Saccharomycescerevisiae)、裂殖酵母属(Schizosaccharomycessp.)及粗糙脉孢菌(Neurosporacrassa)等、以及真核细胞如高级真核生物(例如昆虫)的细胞。此外,根据本发明的细胞可来源于植物或哺乳动物。例如,可利用COS-7(monkeykidneycells7,猴肾细胞7)、BHK(babyhamsterkidney,幼仓鼠肾)、CHO(Chinesehamsterovary,中国仓鼠卵巢)、CHOK1、DXB-11、DG-44、CHO/-DHFR、CV1、HEK293、BHK、TM4、VERO、HELA、MDCK、BRL3A、W138、HepG2、SK-Hep、MMT、TRI、MRC5、FS4、3T3、RIN、A549、PC12、K562、PER.C6、SP2/0、NS0、U20S或HT1080等,但不限于此。优选地,可使用COS7细胞、NSO细胞、SP2/0细胞、CHO细胞、W138、BHK细胞、MDCK、骨髓瘤细胞系、HuT78细胞及HEK293细胞,尤其优选CHO细胞。为了表达根据本发明的抗B7-H3抗体,可利用多种细胞/载体组合。具体地,适合于真核细胞的表达载体包括源自SV40、牛乳头瘤病毒、腺病毒、腺相关病毒、巨细胞病毒和逆转录病毒的表达载体,但不限于此。可用于细菌细胞的表达载体包括源自大肠杆菌的细菌质粒如pET、pRSET、pBluescript、pGEX2T、pUC、colE1、pCR1、pBR322、pMB9及它们的衍生物;宿主范围更广的质粒如RP4;噬菌体DNA如λgt10、λgt11和NM989等各种噬菌体λ衍生物;以及其他DNA噬菌体如M13和丝状单链DNA噬菌体。对酵母细胞有用的表达载体为YEp质粒及其衍生物。对昆虫细胞有用的载体为pVL941。所述载体被转染或转染(transfection)到细胞中。为了实现“转染”,可使用在将外源核酸(DNA或RNA)引入至原核或真核细胞时通常所用的各种类型的技术,例如电泳法、磷酸钙沉淀法、DEAE-葡聚糖转染或脂质转染(lipofection)等。本发明还提供一种所述抗体或其抗原结合片段的制备方法,所述方法包括如下步骤:(i)培养所述转化的细胞;以及(ii)从获得的细胞培养物中回收抗B7-H3抗体或其抗原结合片段。当能够表达所述抗B7-H3抗体或其抗原结合片段的重组表达载体被引入到哺乳动物细胞中时,对细胞进行一定时间的培养,使得足以在细胞中表达抗体,或更优选使得抗体足以分泌到培养有细胞的培养基中,从而可制备所述抗体或其抗原结合片段。所述细胞可在各种培养基中培养,并且作为培养基可不受限制地使用市售的培养基。还可包含适当浓度的本领域技术人员已知的所有其他必需补充剂。在所选宿主细胞中,已使用适合于蛋白质表达的培养条件,例如温度、pH等,这对本领域技术人员来说是显而易见的。在某些情况下,可将表达的抗体从细胞培养基中分离并均匀地纯化。所述抗体的分离或纯化可通过常规的蛋白质分离和纯化方法进行,例如层析法。所述层析法可包括例如使用蛋白A柱或蛋白G柱的亲和层析、离子交换层析、疏水层析、或羟基磷灰石层析。除上述层析法外,可进一步通过结合过滤、超滤、盐析、透析等对抗体进行分离、纯化。本发明还提供一种包含所述抗体或其抗原结合片段、及药物的抗体-药物偶联物。在抗体-药物偶联物中,抗癌药物被递送到靶癌细胞之前,抗癌药物必须与抗体稳定结合。递送至靶标的药物必须从抗体中释放并诱导靶细胞死亡。为此,药物在与抗体稳定结合的同时,需具有在靶细胞中被释放时足以诱导靶细胞死亡的细胞毒性。所述药物是表现出药理学效果的制剂,能够与本发明的抗体或其抗原结合片段结合,并且在酸性条件下能够与所述抗体或其抗原结合片段分离,是指对靶细胞表现出治疗作用的化合物。所述药物可为细胞毒素(cytotoxin)、放射性同位素、抗增殖剂、促凋亡剂(pro-apoptoticagent)、化学治疗剂及用于治疗的核酸,但不限于此。所述抗体-药物偶联物可内化到细胞中,并可介导抗体依赖性细胞毒性。如本说明书使用的术语“细胞毒性活性”是指抗体-药物偶联物或抗体-药物偶联物的细胞内代谢物的细胞死亡、细胞增殖抑制或生长抑制效果。细胞毒性活性可表示为IC50值,即一半细胞所存活的每单位体积的浓度(摩尔或质量)。术语“细胞毒素”通常是指抑制或阻止细胞功能、和/或破坏细胞的制剂。代表性的细胞毒素包括抗生素、微管蛋白聚合抑制剂、与DNA结合并破坏其的烷化剂、以及破坏必需细胞蛋白质功能或蛋白质合成的制剂如蛋白激酶、磷酸酶、拓扑异构酶、酶和细胞周期蛋白。细胞毒素的例包括紫杉醇、细胞松弛素B(cytochalasinB)、短杆菌肽D(gramicidinD)、溴化乙锭(ethidiumbromide)、吐根碱(emetine)、丝裂霉素(mitomycin)、依托泊苷(etoposide)、替尼泊苷(tenoposide)、长春新碱(vincristine)、长春花碱(vinblastine)、秋水仙碱(colchicin)、阿霉素(doxorubicin)、柔毛霉素(daunorubicin)、二羟基蒽二酮(dihydroxyanthracindione)、米托蒽醌(mitoxantrone)、光神霉素(mithramycin)、放线菌素D(actinomycinD)、1-去氢睾酮(1-dehydrotestosterone)、糖皮质激素(glucocorticoids)、普鲁卡因(procaine)、丁卡因(tetracaine)、利多卡因(lidocaine)、普萘洛尔(propranolol)、及它们的类似物或同系物,但不限于此。本发明的抗体可包含高能放射性同位素,以应用于放射疗法。该同位素例如可在存在于抗体内的半胱氨酸残基处与抗体直接结合,或者可使用螯合物来介导抗体与放射性同位素的结合。适合于放射疗法的放射性同位素包括但不限于α发射体、β发射体和俄歇电子(augerelectron)。对应用于诊断有用的放射性同位素包括正电子发射体和γ发射体。抗增殖剂和促凋亡剂包括PPAR-γ(例如环戊烯酮前列腺素(cyPGs))、类视黄醇、三萜类化合物(例如环阿尔廷(cycloartane)、羽扇烷(lupane)、乌索烷(ursane)、齐墩果烷、木栓烷(friedelane)、达玛烷(dammarane)、葫芦素(cucurbitacin)及柠檬苦素(limonoid)型三萜类化合物)、EGF受体的抑制剂(例如HER4)、雷帕霉素、骨化三醇(CALCITRIOL;1,25-二羟基胆钙化醇(维生素D))、芳香酶抑制剂(FEMARA(retrozone))、端粒酶抑制剂、铁螯合剂(3-氨基吡啶-2-甲醛缩氨基硫脲(Triapine))、凋亡素(病毒蛋白3-鸡贫血病毒的VP3)、Bcl-2和Bcl-X(L)的抑制剂、TNF-α、FAS配体、TNF相关凋亡诱导配体(TRAIL/Apo2L)、TNF-α/FAS配体/TNF相关凋亡诱导配体(TRAIL/Apo2L)信号传导的激活剂、及PI3K-Akt存活通路信号传导的抑制剂(例如UCN-01和格尔德霉素)。“化疗剂”是对癌症治疗有用的化合物,与其作用机制无关。化疗剂的类别包括但不限于烷化剂、抗代谢物、纺锤体毒素植物生物碱、细胞毒性/抗肿瘤抗生素、拓扑异构酶抑制剂、抗体、光敏剂和激酶抑制剂。化疗剂包括“靶向治疗”和传统化疗中使用的化合物。所述偶联物可按照已知方法通过将药物与抗体或其抗原结合片段结合来制备。抗体和药物可通过它们自身所具有的连接基团等直接结合,也可通过连接子或其他物质间接结合。药物从抗体上被剪切的主要机制包括溶酶体(腙、缩醛和顺乌头酸样酰胺)在酸性pH下的水解、溶酶体酶(组织蛋白酶和其他溶酶体酶)引起的肽裂解、及二硫化物的还原。对于这些多种剪切机制的结果,药物与抗体连接的机制非常多样,可使用任何合适的连接子。用于结合抗体与药物的合适的连接基团是本领域公知的,包括例如二硫基、硫醚基、酸可裂解基团、光可裂解基团、肽酶可裂解基团和酯酶可裂解基团。当药物被直接结合时,连接基团(linkinggroup)例如可为使用SH基团的二硫键、或由马来酰亚胺介导的键。例如,抗体Fc区的分子内二硫键和药物的二硫键被还原,两者通过二硫键连接。还有通过马来酰亚胺的方法和通过遗传工程学将半胱氨酸引入到抗体的方法。抗体和药物还可通过其他物质(连接子(Linker))间接结合。优选地,连接子具有与抗体、药物或前两者反应的一个或多个种类的官能团。官能团可包括例如氨基、羧基、巯基、马来酰亚胺基、吡啶基等。本发明还提供一种包含所述抗体或其抗原结合片段的多特异性抗体。多特异性抗体是指能够与两种或以上的不同类型的抗原(靶蛋白)结合的抗体,是通过遗传工程学或任意方法而制备的形式。多特异性(multi-specific)抗体包括双特异性抗体、三特异性抗体或四特异性抗体。优选地,多特异性抗体为根据本发明的抗B7-H3抗体结合于对免疫效应细胞-特异性靶分子具有结合能力的抗体或其片段的形式。优选地,免疫效应细胞-特异性靶分子选自TCR/CD3、CD16(FcγRIIIa)CD44、CD56、CD69、CD64(FcγRI)、CD89和CD11b/CD18(CR3),但不限于此。优选地,多特异性抗体为根据本发明的抗B7-H3抗体结合于对刺激或抑制免疫的细胞因子具有结合能力的抗体或其片段的形式。优选地,刺激或抑制免疫的细胞因子例如选自IL-2、IL-6、IL-7、IFNα、GM-CSF、IL-10和TGF-β,但不限于此。优选地,多特异性抗体为根据本发明的抗B7-H3抗体结合于对用于癌症治疗的靶标具有结合能力的抗体或其片段的形式,所述靶标例如为PD-1、PD-L1、VEGF、EGFR、Her2/neu、VEGF受体、其他生长因子受体、CD20、CD40、CTLA-4、TIGIT、TIM-3、LAG-3、OX-40、4-IBB及ICOS,但不限于此。属于多特异性抗体的抗体可分为基于scFv的抗体、基于Fab的抗体和基于IgG的抗体等。在双特异性抗体的情况下,由于能够同时抑制或放大两个信号,因此相对于抑制/放大一个信号的情况可能更有效,并且与各个信号分别用各自的信号抑制剂处理的情况相比,能够实现低剂量给药,能够在相同时间及空间抑制/放大两个信号。双特异性抗体的制备方法是众所周知的。通常,双特异性抗体的重组生产基于在两个重链具有不同特异性的条件下共表达两个免疫球蛋白重链/轻链对。在基于scFv的双特异性抗体的情况下,可通过将不同scFv的VL和VH各自相互组合来制备异源二聚体(heterodimer)形式的杂合scFv,以形成双体抗体(diabody),并且可通过将不同scFv相互连接来制备串联(tendem)scFv,可通过将Fab的CH1和CL分别表达在scFv的末端以制备异质二聚体微型抗体(miniantibody),可通过将作为Fc的同源二聚体域的CH3域的一部分氨基酸置换并变更为'knobintohole’形式的异源二聚体结构,将这些被变更的CH3域分别表达在不同的各scFv末端,以制备异源二聚体scFv形式的微抗体。在基于Fab的双特异性抗体的情况下,可通过二硫键或介体将特定抗原的个别Fab'相互组合以制备异源二聚体Fab形式,并且可通过在特定Fab的重链或轻链的末端表达不同抗原的scFv以使抗原结合价(valency)为二价,或通过在Fab和scFv之间放置铰链区以使制备的同源二聚体形式具有四价抗原结合价。此外,通过在Fab的轻链末端和重链末端融合不同抗原的scFv而得到的抗原结合价为三价的双靶抗体(bibody)及Fab的轻链末端和重链末端分别融合不同的scFv,从而可制备抗原结合价为三价的三靶抗体(bibody)形式,或者可通过化学偶联三个不同的Fab来制备。在基于IgG的双特异性抗体的情况下,已知通过将小鼠和大鼠的杂交瘤重新杂交以制备杂种杂交瘤(又名四源杂交瘤(quadromas))来生产双特异性抗体的方法。此外,在共有轻链部分的同时,可通过修饰不同重链的Fc的CH3同源二聚体域的一部分氨基酸来制备异源二聚体形式,即'HolesandKnob’形式的双特异性抗体。还可通过将两个不同的scFv分别融合并表达到IgG的轻链和重链的恒定域而不是可变域,以制备同源二聚体形式的(scFv)4-IgG。本发明还提供一种用于预防或治疗癌症或肿瘤、自身免疫疾病或炎症性疾病的药物组合物,所述药物组合物包含作为有效成分的所述抗B7-H3抗体或其抗原结合片段、或包含其的所述多特异性抗体或抗体-药物偶联物及药学上可接受的添加剂。所述癌症或肿瘤、自身免疫疾病或炎症性疾病可与B7-H3的表达或过表达有关。在本发明中,“癌症”和“肿瘤”以基本相同的含义使用,是指或意指通常以不受调节的细胞生长和增殖为特征的哺乳动物的生理状况。“预防”是指通过施用根据本发明的组合物以对癌症或肿瘤、自身免疫疾病或炎症性疾病进行抑制或延缓进展的所有行为,“治疗”是指抑制癌症或肿瘤的发展,减轻或消除癌症或肿瘤,抑制、减轻或消除自身免疫疾病或炎症性疾病。能够用本发明的组合物治疗的癌症或癌瘤不受特别限制,包括实体癌和血液癌。这些癌症的实例可选自皮肤癌如黑素瘤、肝癌、肝细胞癌、胃癌、乳腺癌、肺癌、卵巢癌、支气管癌、鼻咽癌、喉癌、胰腺癌、膀胱癌、结肠直肠癌、结肠癌、胰脏癌、宫颈癌、脑癌、前列腺癌、非小细胞肺癌、骨癌、皮肤癌、甲状腺癌、甲状旁腺癌、肾癌、食道癌、胆道癌、睾丸癌、直肠癌、头颈癌、颈椎癌、输尿管癌、骨肉瘤、神经母细胞瘤、纤维肉瘤、横纹肌肉瘤、星形细胞瘤、胶质母细胞瘤(glioblastoma)、神经母细胞瘤(neuroblastoma)、神经胶质瘤及其他肿瘤(例如儿童小圆蓝细胞瘤),但不限于此。更优选地,所述癌症或肿瘤可以以表达有B7-H3蛋白质为特征,并且以选自前列腺癌、卵巢癌、乳腺癌、结肠癌、肾癌、非小细胞肺癌、胰腺癌、头颈癌、黑素瘤、胶质母细胞瘤、神经母细胞瘤及其他肿瘤(例如儿童小圆蓝细胞瘤)为特征。所述癌症可为原发性癌症或转移性癌症。在本发明中,所述自身免疫疾病(autoimmunedisease)或炎症性疾病(inflammatorydisease)可为哮喘、类风湿性关节炎、或多发性硬化症(multiplesclerosis),但不限于此。在本发明中,所述药物组合物包含治疗性有效剂量的抗B7-H3抗体或其抗原结合片段、以及药学上可接受的添加剂。“药学上可接受的添加剂”是能够添加到活性成分中以有助于药物组合物的剂型化或稳定化的物质,并且不会对患者造成显着毒性效果。所述添加剂是指对患者无刺激且不阻碍所给药化合物的生物活性和特性的载体或稀释剂等。在剂型化为液体溶液的组合物中,作为可接受的药物载体可使用无菌及生物相容的盐水、无菌水、林格氏溶液、缓冲盐水、白蛋白注射液、右旋糖溶液、麦芽糊精溶液、甘油、乙醇和它们的混合物,并且根据需要可添加其他常规添加剂,例如抗氧化剂、缓冲剂和抑菌剂等。此外,可进一步添加稀释剂、分散剂、表面活性剂、粘合剂和润滑剂,以剂型化为如水溶液、悬浮液、乳浊液等的注射用剂型、丸剂、胶囊剂、颗粒剂或片剂。药学上可接受的载体包括无菌水溶液或分散液及无菌粉末,以制备用于即时给药(extemporaneous)的无菌且可注射的溶液或分散液。优选地,组合物被制备成用于肠胃外注射。组合物可被制备成溶液、微乳液、脂质体、或其他适合于高药物浓度的定制剂型。载体可为包含例如水、乙醇、多元醇(例如甘油、丙二醇及液体聚乙二醇等)及它们的合适混合物的溶剂或分散介质。在一些情况下,组合物中可包含等渗剂,例如糖、多元醇,例如甘露醇、山梨糖醇或氯化钠。可使用制药领域中公知的方法来制备各种制剂。根据本发明的药物组合物的给药剂量不受特别限制,可根据包括患者的健康状况和体重、疾病的严重程度、药物类型、给药途径和给药时间在内的各种因素而改变。根据本发明的药物组合物可通过包括人、大鼠、小鼠、家畜等的哺乳动物的通常被接受的口服或肠胃外途径等各种途径,以每天一次或多次的剂量进行给药。具体地,可按照常规方式通过口服、直肠内、局部、静脉内、腹腔内、肌内、动脉内、经皮、鼻内、吸入、眼内、肺内或皮内途径进行给药,但不限于此。根据本发明的药物组合物可根据需要通过推注或连续输注给药于患者。例如,以Fab片段为代表的本发明的抗B7-H3抗体的抗原结合片段的推注给药剂量可为0.0025mg/kg至100mg/kg体重、0.025mg/kg至0.25mg/kg、0.010mg/kg至0.10mg/kg、或0.10mg/kg至0.50mg/kg。在连续输注的情况下,以Fab片段为代表的本发明的抗B7-H3抗体的抗原结合片段可以以0.001至100mg/kg体重/min、0.0125至1.25mg/kg/min、0.010至0.75mg/kg/min、0.010至1.0mg/kg/min或0.10至0.50mg/kg/min的剂量进行1小时至24小时、1小时至12小时、2小时至12小时、6小时至12小时、2小时至8小时、或1小时至2小时的给药。当给药本发明的抗B7-H3抗体或其抗原结合片段时,给药剂量可为约1至10mg/kg体重、2至8mg/kg、3至7mg/kg、或4至6mg/kg。全长抗B7-H3抗体通常通过30分钟至35分钟的持续输注进行给药。给药频率将根据病情的严重程度而不同。频率可为一周三次至每一周或两周一次。本发明还涉及一种癌症或肿瘤、自身免疫疾病或炎症性疾病的预防或治疗方法,所述方法包括以下步骤:将治疗性有效剂量的所述抗B7-H3抗体或其抗原结合片段或所述多特异性抗体或抗体-药物偶联物给药于需要预防或治疗癌症或肿瘤、自身免疫疾病或炎症性疾病的患者。所述预防或治疗方法在所述给药步骤之前,可进一步包括确认需要预防或治疗所述疾病的患者的步骤。在某些情况下,通过将所述抗体或其抗原结合片段与现有的其他抗癌治疗剂联合使用,可有效地靶向表达B7-H3的肿瘤细胞,并增加抗肿瘤T细胞活性以增强免疫反应。所述抗体或其抗原结合片段可与以下物质或方法联合使用:其他抗肿瘤剂或免疫原性剂,例如被弱化的癌细胞、肿瘤抗原(包括重组蛋白、肽和碳水化合物分子)、抗原呈递细胞(例如,用来源于肿瘤的抗原或核酸进行脉冲的树突细胞)、免疫刺激细胞因子(例如IL-2、IFNα2、GM-CSF)、及用编码免疫刺激细胞因子的基因进行转染的细胞;标准癌症治疗法,例如化疗法、放射疗法或手术;或其他抗体,例如PD-1、PD-L1、VEGF、EGFR、Her2/neu、VEGF受体、其他生长因子受体、CD20、CD40、CTLA-4、OX-40、4-IBB及ICOS的抗体。根据本发明的抗B7-H3抗体或其抗原结合片段、以及包含其的药物组合物与现有的抗癌治疗剂可同时给药、或依次给药。本发明还提供一种用于诊断癌症或肿瘤、自身免疫疾病或炎症性疾病的组合物、以及使用其诊断所述疾病的方法,其中所述组合物包含所述抗B7-H3抗体或其抗原结合片段、所述抗体-药物偶联物、或所述多特异性抗体。通过根据本发明的所述抗B7-H3抗体或其抗原结合片段、所述抗体-药物偶联物、或所述多特异性抗体来测定试样中的B7-H3表达水平,从而可诊断癌症或肿瘤、自身免疫疾病或炎症性疾病。表达水平可根据常规的免疫分析测定法来测定,并且可通过利用所述B7-H3的抗体的放射免疫分析、放射免疫沉淀、免疫沉淀、免疫组织化学染色、ELISA(酶联免疫吸附测定)、捕获ELISA、抑制或竞争分析、夹心分析、流式细胞术分析(flowcytometry)、免疫荧光染色及免疫亲和纯化来测定,但不限于此。在所述免疫分析结果中,当生物试样中的B7-H3蛋白质表达高于正常生物试样(例如正常胃组织、血液、血浆或血清)时,可诊断为所述疾病。本发明还提供一种包含所述用于诊断的组合物的诊断用试剂盒。根据本发明的试剂盒可包含根据本发明的抗B7-H3抗体或其抗原结合片段、或包含其的抗体-药物偶联物或多特异性抗体、以及产生可检测信号的标记(label)。所述标记可包括与抗体结合的化学物质(例如生物素)、酶(碱性磷酸酶、β-半乳糖苷酶、辣根过氧化物酶、萤光素酶或细胞色素P450)、放射性物质(例如C14、I125、P32及S35)、荧光物质(例如荧光素)、发光物质、化学发光物质(chemiluminescent)、及FRET(fluorescenceresonanceenergytransfer,荧光共振能量转移),但不限于此。在这种情况下,当作为酶使用碱性磷酸酶时,酶的底物可使用显色反应底物如溴氯吲哚基磷酸盐(BCIP)、硝基四氮唑蓝(NBT)、萘酚AS-BI磷酸盐(naphthol-AS-B1-phosphate)及ECF(enhancedchemifluorescence,增强化学荧光),当使用辣根过氧化物酶时,底物可使用氯萘酚、氨基乙基咔唑、二氨基联苯胺、D-荧光素、光泽精(双-N-甲基吖啶硝酸盐)、苄氧基试卤灵(Resorufinbenzylether)、鲁米诺、Amplex红试剂(10-乙酰基-3,7-二羟基吩嗪)、HYR(对苯二胺-HCl和邻苯二酚)、TMB(四甲基联苯胺)、ABTS(2,2'-叠氮二[3-乙基苯并噻唑啉磺酸盐])、邻苯二胺(OPD)及萘酚/派若宁、葡萄糖氧化酶和t-NBT(氮蓝四唑)及m-PMS(吩嗪硫酸甲酯),但不限于此。通过对试样与抗体反应所显示的信号强度进行分析,从而可诊断癌症或肿瘤、自身免疫性疾病或炎症性疾病。为了诊断而使用的酶的活性测定或信号测定可根据本领域公知的各种方法进行,以此可对B7-H3表达进行定性或定量的分析。以下,将参考实施例对本发明进行更详细的描述。这些实施例仅用于描述本发明,本发明的范围并不受这些实施例的限制。【实施例1】B7-H3抗原的表达和纯化【实施例1-1】B7-H3蛋白质表达载体的构建为了仅克隆B7-H3的胞外域(extracellulardomain),通过使用Jurkat细胞cDNA文库(Stratagene,美国)及在5'和3'处含有限制性内切酶SfiI位点的B7-H3的引物对(表1)来进行聚合酶链反应(PCR)。使用获得的PCR产物和N293F载体构建表达载体,所述表达载体分别表达在B7-H3的胞外域的羧基末端融合有8xHis、人Fc或小鼠Fc的蛋白质(图1)。【表1】用于B7-H3克隆的引物名称5‘→3’序列SEQIDNo:B7-H3-FCTGGAGGTCCAGGTCCCTGAAGACC66B7-H3-RGGCCTCTGGGGGGAATGTCATAGGC67【实施例1-2】B7-H3抗原的表达和纯化在优化条件下通过使用PEI(聚乙烯亚胺,23966,Polysciences)进行转染。将人HEK293F细胞以5x105个细胞/ml接种到培养基(#Freestyle293AGT型;AG100009P1,Thermo.)中,并培养至达到1x106个细胞/ml。将实施例1-1中获得的各表达载体与PEI进行混合以形成复合物(polyplex),然后添加到所述细胞以进行转化,然后加入5g/L的大豆蛋白胨(Soytone;#212488,DIFCO)并进一步培养6天。通过依次使用蛋白A琼脂糖和Superdex200(1.5cm*100cm)凝胶过滤层析对表达的B7-H3-Fc抗原进行纯化。将各抗原生产培养液在8,000rpm下进行30分钟的离心分离以去除细胞碎片,使用孔径为0.22μm的瓶顶过滤器进行过滤。将3ml的Ni-NTA树脂(#30230,QIAGEN)放入空柱中,然后用20ml的结合缓冲液(10mM咪唑)填充(packing)树脂,以进行纯化。使过滤的培养液以重力流速(gravity-flow)流入填充的树脂,从而以每分钟0.2ml的速率与树脂结合。用100ml的洗涤缓冲液(20mM咪唑)进行洗涤后,用洗脱缓冲液(250mM咪唑)进行洗脱。将利用洗脱缓冲液而获得的洗脱液通过透析(dialysis)并用DPBS(Dulbecco′s磷酸盐缓冲盐水)进行缓冲液交换(1L,3次)。蛋白质的浓度通过纳米滴(Nano-drop)来测定。使用SDS-PAGE和尺寸排阻色谱(#TSK-GELG-3000SWXLSize-exclusionchromatography(SEC),Tosoh)对各蛋白质进行纯化并确认纯度,其纯度均为95%或以上。【实施例2】B7-H3人抗体的选别【实施例2-1】抗原的准备将50μg的实施例1中制备的B7-H3-His和购自莱恩生物科技有限公司(SinoBiologicalInc.)的B7-H3-his(#11188-H08H)和B7-H3-Fc(#11188-H02H)抗原分别涂在免疫吸附管(Immunosorbtube),然后进行封闭(blocking)。【实施例2-2】人抗体文库噬菌体的准备将2.7×1010的具有多样性的人scFv文库噬菌体(YBiologics公司)感染到大肠杆菌,然后在30℃下对获得的大肠杆菌进行16小时的培养。将培养液进行离心分离,上清液用PEG(聚乙二醇)进行浓缩,然后将其溶解在PBS(磷酸盐缓冲盐水)缓冲液中,以制备人抗体文库噬菌体。【实施例2-3】生物淘选(Biopanning)将实施例2-2中得到的文库噬菌体放入实施例2-1中准备的免疫吸附管中,在室温下反应2小时,用1xPBST和1xPBS进行洗涤,然后用100mM的TAE和Tris-HCl(pH7.5)溶液依次进行处理,从而仅洗脱与抗原特异性结合的scFv-噬菌体。通过将洗脱的噬菌体再次感染到大肠杆菌并扩增的淘选过程而获得阳性噬菌体池(pool),在第一轮淘选中对扩增的噬菌体在PBST(PBS 吐温20)洗涤步骤中仅增加次数,其余按照相同的方法进行第二轮和第三轮淘选。其结果,如表2所示,确认到在第三轮淘选中与抗原结合的噬菌体数量略有增加。【表2】根据淘选的抗体的滴度比较淘选次数噬菌体的流入数噬菌体的结合数第一轮3x10122x105第二轮4x10123x106第三轮4x10125x107【实施例2-4】多噬菌体ELISA进行多噬菌体ELISA,以确认通过各轮淘选获得的阳性多scFv-噬菌体(polyscFv-phage)抗体池的抗原特异性。通过利用分别涂有抗原B7-H3-His(Sino)和B7-H3-His(自制(inhouse))的免疫板(immuno-plate)、以及涂有用作非特异性结合指标的ITGA6-Fc蛋白质的免疫板,对各轮获得的噬菌体池同时进行ELISA。作为ELISA的阴性对照组,一同使用没有展示抗体的M13噬菌体,即#38。其结果如图2所示,对B7-H3-His抗原的结合能力从第二轮淘选的阳性噬菌体池开始增加,从而可确认到抗B7-H3噬菌体抗体成功增加。【实施例2-5】阳性噬菌体的筛选在经多噬菌体ELISA证实具有高结合能力的第三轮淘选的阳性噬菌体池中筛选出数千个单克隆,在96深孔板(96-deepwellplate)中用辅助噬菌体对它们进行感染并培养,然后将存在于上清液的单scFv-噬菌体转移到涂有B7-H3抗原的免疫板,以进行ELISA。此时,同时进行B7-H3-His(Sino)或B7-H3-His(inhouse)的单噬菌体ELISA和非特异性抗原对照组ITGA6-Fc蛋白质的ELISA,从而确认得到的阳性噬菌体克隆是否对B7-H3具有特异性。其结果,如图3所示,确认到单scFv-噬菌体克隆仅对B7-H3-His具有强结合能力,并且筛选出数十种初步抗体克隆。另外,尝试通过特性分析筛选的CD276-039C05克隆的亲和力增加淘选,从而进一步得到优异的抗体克隆。【实施例2-6】阳性噬菌体抗体的碱基序列分析对于筛选出的单克隆,使用DNA纯化试剂盒(Qiagen,德国)分离噬菌粒DNA并分析碱基序列。经过重链和轻链的CDR3部位序列的分析结果,确认到如表3所示的克隆。【表3】B7-H3单克隆的特性另外,重链和轻链的CDR及可变区的氨基酸序列如表4和表5中所示。在以下表6中示出了编码所述重链和轻链可变区的多核苷酸序列。【表4】重链CDR和轻链CDR的氨基酸序列【表5】重链和轻链可变区氨基酸序列【表6】编码重链和轻链可变区的多核苷酸序列【实施例3】B7-H3人抗体的生产【实施例3-1】scFv形式到IgG形式的转换(conversion)为了将实施例2中筛选的单克隆噬菌体抗体从scFv形式转换为IgG形式,通过利用限制性内切酶SfiI/NheI位点将重链可变区的碱基序列克隆到pNATVH(Y-Biologics),以制备N293FHC载体,并通过利用限制性内切酶SfiI/BglII位点将轻链可变区的碱基序列克隆到pNATVL(Y-Biologics),以制备N293FLC载体。【实施例3-2】人抗体的生产和纯化将N293FHC和N293FLC载体共转染(co-transfection)到HEK293F细胞,在培养第7天收集培养液,通过离心分离和0.22μm的顶滤过滤去除细胞和悬浮物质,然后收集上清液并通过蛋白A磁珠(proteinAbead)进行纯化。通过使用SDS-PAGE来分析抗B7-H3抗体的纯度(图4)。(1)蛋白A层析将培养液在8,000rpm下进行30分钟的离心分离以去除细胞碎片,使用孔径为0.22μm的瓶顶过滤器(Steritop-GPFilterUnit.#SCGPS01RE,Millipore)进行过滤。另外,将4ml的蛋白A琼脂糖树脂浆液(KANEKAKanCapATM,目录号:KKC20170403_01)放入空柱(#BR731-1550,Bio-rad),然后用100ml的DPBS(#LB001-02)填充树脂并进行洗涤。将过滤的培养基加载到填充的树脂上,以每分钟1ml的速率流动(#EP-1Econopump,Bio-Rad)。用150ml的DPBS绩效洗涤后,用10ml的0.1M甘氨酸-HCl(pH3.3)进行洗脱。在洗脱液中添加10%的1MTris-HCl(pH9.0)以中和pH,并使用AmiconUltra-10(#UFC901096,Millipore)将缓冲液更换为DPBS。该过程进行约3次,然后浓缩至约1ml时停止,并用纳米滴测定浓度。(2)SDS-PAGE进行SDS-PAGE,以确认纯化结束后的蛋白质纯度。将3μg的纯化蛋白质样品分别与5μl的还原样品缓冲液和非还原样品缓冲液进行混合,并在100℃下煮沸(boiling)3分钟。将12%的凝胶装入电泳槽(#165-8027,Bio-Rad),将1x电泳缓冲液填满凝胶内侧并填至凝胶外侧约1/3处,使用移液器将准备的样品加载到孔中并防止气泡进入。将4μl的AccuBand预染色蛋白质标记物加载到最左侧的孔中。安装凝胶室的顶盖并连接电源,在200V、1小时的条件下进行电泳。一小时后,将凝胶从槽中分离,并以浸入染色缓冲液的程度在搅拌器上染色1小时。然后弃去染色液,在与脱色液搅拌约1小时的同时进行脱色,再次更换脱色液以再次脱色。用蒸馏水对脱色结束后的凝胶进行洗涤,然后用图像装置保存图像。(3)蛋白质印迹法如(2)中对SDS-PAGE进行1小时的电泳后,将凝胶从槽中分离,将NC膜置于凝胶下方并固定卡盒,以放入转移槽(#165-8027,Bio-Rad),在其中填入转移缓冲液后,在110V下进行约2小时的电泳。如果预计转移已完成,则停止转移,然后取出NC膜,用封闭液(1%脱脂牛奶/PBS)在常温下封闭1小时。然后,将作为二抗的抗hFc-HRP(#31413,Thermo)和抗His-HRP(#A7058,Sigma)在封闭液中按1:4000进行稀释,然后置于NC膜上,在常温下进行1小时的反应。NC膜用1xPBST以每次10ml进行5次洗涤。之后,将ECL溶液(#16024,Intron)分散在NC膜上,然后检测ChemiDoc(UVITEC,miniHD),曝光时间分别设为1秒、30秒、1分钟,选择最佳的图像并保存。【实施例4】B7-H3单克隆抗体的特性【实施例4-1】对表达在细胞表面的人B7-H3的特异性结合力(FACs)通过准备使表达人B7-H3的细胞在每个试样中达到0.5x106个细胞,将抗体分别稀释至一定的倍数,然后与准备的细胞在4℃下反应30分钟。此后,将细胞用含有2%胎牛血清的PBS(#LB001-02,welgene)进行3次洗涤,使用结合有FITC(异硫氰酸荧光素)荧光物质的抗-人IgG抗体(#FI-3000,Vectorlabs)或PE-抗-hIgG抗体(#555787,BD)在4℃下进行20分钟的反应后,按照上述相同的方法进行洗涤。将细胞悬浮在含有0.5ml的2%FBS(#26140-079,Thermo)的PBS中,然后使用FACSCantoII流式细胞分析仪(BDBiosciences,美国)分析结合力。其结果,通过几何平均值确认到B7-H3抗体以浓度依赖性方式与在细胞表面表达的B7-H3结合,并且与通过不表达B7-H3的Raji细胞、几乎不表达B7-H3的Jurkat细胞、及shRNA(GIPZhumanCD276shRNA转染起始试剂盒,#V3LHS_306029,Thermo)抑制(Knock-down)B7-H3的HEK293E/KD细胞系未结合(图6a至图6d、及表7)。各细胞系中B7-H3的表达与否通过使用结合有PE荧光物质的抗人CD276抗体(#331606,Biolegend)来测定(图5)。【表7】在不表达或几乎不表达B7-H3的细胞系中B7-H3抗体的FACS结合力【实施例4-2】抗B7-H3抗体的热稳定性使用差示扫描荧光测定法(DifferentialScanningFluorimetry)对抗体的热稳定性进行测试。将抗体蛋白质在DPBS中稀释至3μM、45μl,然后与5μl的200xsypro橙色染料(#S6650,Thermo)混合,每个qPCR管(#TLS0851-white,Bio-Rad)中分株50μl并盖上盖子(#TCS0803,Bio-Rad)。使用BioradCFX96实时PCR仪器进行qPCR。qPCR在25℃下反应30秒,然后以0.5℃单位升温至99℃,并在各个温度下反应0.5分钟,最后在25℃下反应10秒后结束。作为抗体结构解旋的速率常数使用MeltTm(熔融温度)。其结果如下表8所示。【表8】熔融温度(MeltTm,Meltingtemperature)【实施例4-3】对B7-H3抗原的亲和力(OCTET)通过使用OctetQK仪器(FortebioInc.)并基于BLI(生物膜层干涉)原理来测定抗体对B7-H3抗原的结合亲和力。将筛选的抗B7-H3抗体固定在AHC(Anti-HumanIgGFcCapture)生物传感器(FortebioInc.)上,在其上结合不同浓缩的人B7-H3抗原,以求出亲和力(KD)。所有缓冲液使用的是Kinetic缓冲液(FortebioInc.)。首先,将生物传感器浸入缓冲液中使其稳定,使缓冲液中溶解浓度为10μg/ml的抗B7-H3抗体反应约5分钟,并固定在AHC生物传感器上。生物传感器用缓冲液洗涤3至5分钟以去除未固定的抗体,与不同浓度(30nM至0.24nM)的B7-H3抗原进行10分钟的结合反应,然后进行10分钟的解离反应。所有实验均在30℃、1,000rpm的条件下进行,并在结合和解离过程中收集根据时间的传感图(sensorgram)数据。根据Octet数据分析软件9.0,通过应用1:1全局结合拟合模型(1:1globalbindingfittingmodel)求出平衡解离常数(KD)。其结果,KD值为0.04至2.0nM,对B7-H3抗原显示出高亲和力。其结果如下表9所示。【表9】抗B7-H3抗体对B7-H3抗原的亲和力(OCTET)名称KD(M)Kon(1/Ms)Koff(1/s)CD276-033E032x10-91x1062x10-4CD276-040F105x10-117x1054x10-5CD276-051H043x10-101x1064x10-4CD276-039C054x10-116x1053x10-5CD276-39C05-LS-001E106x10-111x1067x10-5CD276-39C05_LS_002A111.2x10-101.3x1061.5x10-4CD276-39C05-LS-002B072x10-103x1066x10-4CD276-39C05_LS_002D033.0x10-101.6x1064.7x10-4CD276-39C05-LS-002H073x10-109x1053x10-4【实施例4-4】对B7-H3抗原的结合力(ELISA)将His标记的B7-H3放入PierceTM镍包被板(#152,pierce)的孔中并在常温下包被1小时,或者将Fc标记的B7-H3放入免疫板(#4394454,Thermo)的孔中并在4℃下包被过夜。将小鼠B7-H3(#50973-M08H,Sino)、大鼠B7-H3(#80380-R08H,Sino)、猕猴B7-H3(#90806-C08H,Sino)和人B7-H3(#S1435,Ybiologics)用作抗原。用洗涤液(含有0.05%吐温20(#P9416,Sigma-Aldrich)的PBS)洗涤3次后,根据条件加入300μl的封闭液4%脱脂牛奶(#232120,Becton,DickinsonandCompany)/PBS并在常温下放置1小时,以阻断非特异性结合。加入按一定的稀释倍数进行连续稀释的抗体,并在常温下进行1小时的震荡(rocking)以进行反应。按照相同方法洗涤后,加入结合有HRP的抗人κ抗体(#A7164,Sigma)并在常温下放置1小时。用洗涤液进行5次洗涤后,加入TMB底物溶液(#T0440-1L,Sigma),并在遮光及室温条件下进行3分钟或以上的反应以确认显色,加入1N的硫酸溶液(#S1478,Samchun)以终止反应。使用分光光度计(#GM3000,Promega或SpectraMaxM5,Moleculardevices)在450nm处测定吸光度。确认到筛选的单B7-H3抗体不仅对人B7-H3抗原具有浓度相关的结合力,而且对小鼠、大鼠和猕猴B7-H3抗原也具有浓度相关的结合力(图7a至图7e)。【实施例4-5】在不同pH下对FcRN的结合力(ELISA)使用EZ-LinkTMSulfo-NHS-生物素(#15508,Thermo)将生物素偶联于FCGRT&B2M异源二聚体蛋白质(#CT009-H08H,Sino),然后准备使得达到0.5mg/mL,并在用卵清蛋白(#A5503,Sigma)封闭的PierceTMNeutrAvidinTM高容量包被板的每个孔中放入100ul,在室温下震荡2小时以进行包被。用通过滴定达到pH6.0和pH7.2的磷酸钠溶液对各孔进行3次洗涤后,每个孔中加入100ul的按一定倍数稀释于各溶液的抗体,并在室温下振荡1小时以进行反应。用各溶液进行3次洗涤后,每个孔中加入100ul的稀释为1:5000的过氧化物酶标记亲和纯化F(ab')2片段山羊抗人IgG(H L)(#109-036-003,Jackson),并在室温下振荡1小时以进行反应。用pH6.0的磷酸钠溶液进行3次洗涤后,加入TMB底物,在遮光条件下进行反应,观察到颜色变化时用0.5M/L的硫酸溶液使反应终止。在GlomaxTMDiscover系统(#GM3000,Promega)中测定450nm处的吸光度。确认到抗B7-H3抗体仅在pH6.0下以浓度梯度依赖性方式与FcRN-B2M复合体结合,而在pH7.2下未结合(图8)。【实施例4-6】B7-H3抗原-抗体复合体的细胞内流入(Incucyte)在1ml生长培养基(RPMI1640(#A10491-01,Gibco)、10%FBS(#26140-079,Gibco)、1XAntibiotic-Antimycotic(#15240-062,Gibco)、100xMEMNEAA(#11140-050,Gibco))中将Calu-6细胞系稀释至1、2或4x105个,然后向96孔板(#3595,Corning)的每个孔中加入50μl,并在37℃、CO2培养箱中培养24小时或以上。在1ml生长培养基(DMEM(#SH30243.01,HyclonTM)、10%FBS(#26140-079,Gibco)、1XAntibiotic-Antimycotic(#15240-062,Gibco)、100xMEMNEAA(#11140-050,Gibco))中将A498细胞系稀释至1、2或4x104个,然后向96孔板(#3595,Corning)的每个孔中加入50μl,并在37℃、CO2培养箱中培养24小时或以上。另外,将待测抗体与IncuCyteTMFabFluor红(#4722,essenbioscience)混合至达到1:3的摩尔比,并在37℃下静置15分钟,然后将50μl小心地添加到装有细胞的孔中。将板放入安装有IncuCyteZOOM(essenbioscience,美国)的CO2培养箱中并观察内化(Internalization)。扫描条件为在24小时期间每30分钟用100或200倍放大率进行测定,在每个测定时间点扫描各孔中4处的图像。在IncuCyteZOOM2016B程序中对扫描的图像进行编辑,并使用GraphpadPRISM的非线性拟合中的单相关联函数(Onephaseassociationfunction)进行分析(图9a)。或者,在进行24小时或以上的培养后,在GlomaxTMDiscover系统(#GM3000,Promega)中的荧光滤光片(激发:627nm,发射:660~720nm)中测定红色荧光的强度(图9b)。IncucyteFabFlour红试剂的特性为,在中性pH下不显示荧光,而随着酸性pH的增加会发出红色荧光。细胞表面B7-H3抗原与抗体结合后,通过内体流入细胞内,当与溶酶体融合时,因暴露在酸性pH(~4.7)环境中而发出强烈的红色荧光。用抗B7-H3抗体进行处理后,可确认到细胞内侧呈红色的细胞随时间增加(红色对象物数/孔或红色对象物总面积,um2/孔)。由此可知,细胞表面的B7-H3是抗体流入细胞内的靶标,并且抗B7-H3抗体的细胞内流入会随时间增加。【实施例4-7】B7-H3抗原-抗体复合体的细胞内流入(FabZAP)通过使用AdvancedTargetingSystem公司的FabZAP抗体内化试剂盒(#IT-51)并用细胞毒性功效来确认抗体的细胞内流入。皂草素作为核糖体抑制剂,当流入细胞并释放时,会引起细胞毒性。在生长培养基中将偶联有皂草素的FabZAP蛋白质稀释至45nM,用该溶液将抗体稀释至一定比例,然后在常温下放置15分钟,从而与皂草素进行偶联反应。用作阴性对照组的皂草素是被制备为10uM的溶液后按一定比例进行连续稀释的,作为另一个阴性对照组的对照-SAP是被制备为100nM的溶液后按一定比例进行稀释的。用各物质进行处理的前一天,将A498肾癌细胞系用生长培养基进行稀释,以1x10e3/孔接种到96孔培养板,并在37℃、CO2培养箱中进行16小时或以上的培养。用抗体和各物质进行处理并经过72小时后,在每个孔中加入50ul的用PBS制备的XTT底物溶液,并在37℃、CO2培养箱中反应2小时,然后使用GloMaxTMDiscover系统在450nm处测定吸光度。皂草素物质因无法穿透细胞膜而不显示细胞毒性,没有特异性抗原结合的对照-SAP对细胞生长没有任何影响。与此相反地,确认到偶联有FabZAP的抗B7-H3抗体的细胞毒性效果随着抗体浓度的增加而增加。这表明与表达在A498细胞系表面的B7-H3结合的抗B7-H3抗体已进入细胞内,并且由溶酶体释放的皂草素引起细胞毒性(图10)。工业应用性由于根据本发明的抗B7-H3抗体或其抗原结合片段能够以高亲和力与人和非人B7-H3结合,并且结合后能够流入细胞内,因此所述抗B7-H3抗体或其抗原结合片段、包含其的抗体-药物偶联物或多特异性抗体可有效地应用于癌症或肿瘤、自身免疫疾病或炎症性疾病的预防或治疗或诊断。如上所述,已详细描述了本
发明内容的特定部分,本领域技术人员应理解的是,这些具体的技术仅为优选实施例,本发明的范围不限于此。因此,本发明的保护范围将由所附权利要求书及其等同物限定。【序列表自由文字】附上电子文件。<110>Y生物股份有限公司<120>与B7-H3(CD276)特异性结合的抗体及其用途<130>2435<150>KR10-2019-0082492<151>2019-07-09<160>67<170>PatentInversion3.5<210>1<211>8<212>PRT<213>ArtificialSequence<220><223>CDRH1ofCD276-040F10<400>1GlyTyrThrPheSerSerTyrTrp15<210>2<211>8<212>PRT<213>ArtificialSequence<220><223>CDRH2ofCD276-040F10<400>2IleAsnProGlyAsnGlyHisThr15<210>3<211>16<212>PRT<213>ArtificialSequence<220><223>CDRH3ofCD276-040F10<400>3ValAlaAspProArgArgProLysValProThrAlaLeuPheValTyr151015<210>4<211>6<212>PRT<213>ArtificialSequence<220><223>CDRL1ofCD276-040F10<400>4GlnGlyIleGlyThrTrp15<210>5<211>3<212>PRT<213>ArtificialSequence<220><223>CDRL2ofCD276-040F10<400>5AlaAlaSer1<210>6<211>9<212>PRT<213>ArtificialSequence<220><223>CDRL3ofCD276-040F10<400>6GlnGlnAlaIleAsnPheProIleThr15<210>7<211>8<212>PRT<213>ArtificialSequence<220><223>CDRH1ofCD276-051H04<400>7GlyPheAsnPheHisAspTyrAla15<210>8<211>10<212>PRT<213>ArtificialSequence<220><223>CDRH2ofCD276-051H04<400>8IleArgHisGlnArgTyrGlyGlyThrThr1510<210>9<211>15<212>PRT<213>ArtificialSequence<220><223>CDRH3ofCD276-051H04<400>9AlaArgGlySerSerSerSerSerTrpTyrLeuProAsnAspTyr151015<210>10<211>6<212>PRT<213>ArtificialSequence<220><223>CDRL1ofCD276-051H04<400>10GlnAspIleSerThrTrp15<210>11<211>3<212>PRT<213>ArtificialSequence<220><223>CDRL2ofCD276-051H04,CD276-039C05<400>11LysAlaSer1<210>12<211>8<212>PRT<213>ArtificialSequence<220><223>CDRL3ofCD276-051H04<400>12GlnGlnTyrAsnArgPheTrpThr15<210>13<211>8<212>PRT<213>ArtificialSequence<220><223>CDRH1ofCD276-033E03<400>13GlyPheThrPheSerSerTyrAla15<210>14<211>8<212>PRT<213>ArtificialSequence<220><223>CDRH2ofCD276-033E03<400>14IleSerGlySerGlyGlySerArg15<210>15<211>11<212>PRT<213>ArtificialSequence<220><223>CDRH3ofCD276-033E03<400>15AlaSerHisThrIleProGlyAlaTrpAspVal1510<210>16<211>9<212>PRT<213>ArtificialSequence<220><223>CDRL1ofCD276-033E03<400>16ThrArgAspValGlyGlyTyrAsnTyr15<210>17<211>3<212>PRT<213>ArtificialSequence<220><223>CDRL2ofCD276-033E03<400>17AspValAsn1<210>18<211>10<212>PRT<213>ArtificialSequence<220><223>CDRL3ofCD276-033E03<400>18SerSerTyrThrThrSerSerArgArgVal1510<210>19<211>8<212>PRT<213>ArtificialSequence<220><223>CDRH1ofCD276-039C05<400>19GlyGlyThrPheSerSerTyrAla15<210>20<211>8<212>PRT<213>ArtificialSequence<220><223>CDRH2ofCD276-039C05<400>20IleIleProIleLeuGlyIleAla15<210>21<211>14<212>PRT<213>ArtificialSequence<220><223>CDRH3ofCD276-039C05<400>21AlaAsnGlyGlyAspSerSerSerTrpTyrThrPheAspTyr1510<210>22<211>6<212>PRT<213>ArtificialSequence<220><223>CDRL1ofCD276-039C05<400>22GlnSerIleSerArgTrp15<210>23<211>9<212>PRT<213>ArtificialSequence<220><223>CDRL3ofCD276-039C05<400>23GlnGlnTyrAsnThrPheProLeuThr15<210>24<211>6<212>PRT<213>ArtificialSequence<220><223>CDRL1ofCD276-039C05_LS_001E10<400>24GlnThrIleAsnSerTrp15<210>25<211>9<212>PRT<213>ArtificialSequence<220><223>CDRL3ofCD276-039C05_LS_001E10<400>25GlnGlnTyrAsnSerTyrSerLeuThr15<210>26<211>6<212>PRT<213>ArtificialSequence<220><223>CDRL1ofCD276-039C05_LS_002A11<400>26GlnAsnIleAsnSerTrp15<210>27<211>9<212>PRT<213>ArtificialSequence<220><223>CDRL3ofCD276-039C05_LS_002A11<400>27GlnGlnTyrAspSerAsnProLeuThr15<210>28<211>6<212>PRT<213>ArtificialSequence<220><223>CDRL1ofCD276-039C05_LS_002B07<400>28GlnGlyIleSerSerTyr15<210>29<211>9<212>PRT<213>ArtificialSequence<220><223>CDRL3ofCD276-039C05_LS_002B07<400>29GlnGlnTyrTyrSerPheProLeuThr15<210>30<211>6<212>PRT<213>ArtificialSequence<220><223>CDRL1ofCD276-039C05_LS_002C07<400>30GlnSerIleArgSerTrp15<210>31<211>3<212>PRT<213>ArtificialSequence<220><223>CDRL2ofCD276-039C05_LS_002C07<400>31LysAlaTyr1<210>32<211>9<212>PRT<213>ArtificialSequence<220><223>CDRL3ofCD276-039C05_LS_002C07<400>32GlnGlnTyrAsnThrSerProLeuThr15<210>33<211>6<212>PRT<213>ArtificialSequence<220><223>CDRL1ofCD276-039C05_LS_002D03<400>33GluThrIleSerSerTrp15<210>34<211>9<212>PRT<213>ArtificialSequence<220><223>CDRL3ofCD276-039C05_LS_002D03<400>34GlnGlnTyrTyrSerTyrProIleThr15<210>35<211>6<212>PRT<213>ArtificialSequence<220><223>CDRL1ofCD276-039C05_LS_002H07<400>35GlnSerIleAspAsnTrp15<210>36<211>9<212>PRT<213>ArtificialSequence<220><223>CDRL3ofCD276-039C05_LS_002H07<400>36GlnGlnTyrAspSerAsnProLeuThr15<210>37<211>123<212>PRT<213>ArtificialSequence<220><223>VH<400>37GlnValGlnLeuValGluSerGlyAlaGluValLysLysProGlyAla151015SerValLysLeuSerCysLysAlaSerGlyTyrThrPheSerSerTyr202530TrpMetHisTrpValArgGlnAlaProGlyGlnArgLeuGluTrpMet354045GlyGluIleAsnProGlyAsnGlyHisThrAsnTyrAsnGluLysPhe505560LysSerArgValThrIleThrValAspLysSerAlaSerThrAlaTyr65707580MetGluLeuSerSerLeuArgSerGluAspThrAlaValTyrTyrCys859095ValAlaAspProArgArgProLysValProThrAlaLeuPheValTyr100105110TrpGlyGlnGlyThrLeuValThrValSerSer115120<210>38<211>107<212>PRT<213>ArtificialSequence<220><223>VL<400>38AspIleGlnMetThrGlnSerProSerSerValSerAlaSerValGly151015AspArgValThrIleSerCysArgAlaSerGlnGlyIleGlyThrTrp202530LeuAlaTrpTyrGlnGlnLysProGlyLysAlaProArgLeuLeuIle354045TyrAlaAlaSerSerLeuAspSerGlyValProSerArgPheSerAla505560SerGlySerGlyThrAspPheThrLeuThrIleSerSerLeuGlnPro65707580GluAspPheAlaThrTyrTyrCysGlnGlnAlaIleAsnPheProIle859095ThrPheGlyGlnGlyThrArgLeuGluIleLys100105<210>39<211>124<212>PRT<213>ArtificialSequence<220><223>VH<400>39GlnValGlnLeuValGluSerGlyGlyGlyLeuValGlnProGlyArg151015SerLeuArgLeuSerCysThrThrSerGlyPheAsnPheHisAspTyr202530AlaLeuSerTrpValArgGlnAlaProGlyLysGlyLeuGluTrpVal354045SerPheIleArgHisGlnArgTyrGlyGlyThrThrGlnTyrAlaAla505560SerValLysGlyArgPheThrIleSerArgAspAspSerLysGlyIle65707580AlaTyrLeuGlnMetAsnSerLeuArgAlaGluAspThrAlaValTyr859095TyrCysAlaArgGlySerSerSerSerSerTrpTyrLeuProAsnAsp100105110TyrTrpGlyGlnGlyThrLeuValThrValSerSer115120<210>40<211>106<212>PRT<213>ArtificialSequence<220><223>VL<400>40AspIleGlnMetThrGlnSerProSerThrLeuSerAlaSerValGly151015AspArgValThrIleThrCysArgAlaSerGlnAspIleSerThrTrp202530LeuAlaTrpTyrGlnGlnLysProGlyLysAlaProLysLeuLeuIle354045TyrLysAlaSerSerLeuGlnSerGlyValProSerArgPheSerGly505560SerGlySerGlyThrGluPheThrLeuThrIleSerSerLeuGlnPro65707580AspAspPheAlaThrTyrTyrCysGlnGlnTyrAsnArgPheTrpThr859095PheGlyGlnGlyThrLysValGluIleLys100105<210>41<211>118<212>PRT<213>ArtificialSequence<220><223>VH<400>41GlnValGlnLeuValGluSerGlyGlyGlyLeuValGlnSerGlyGly151015SerLeuArgLeuSerCysAlaAlaSerGlyPheThrPheSerSerTyr202530AlaMetSerTrpValArgGlnAlaProGlyLysGlyLeuGluTrpVal354045SerValIleSerGlySerGlyGlySerArgTyrTyrAlaAspSerVal505560LysGlyArgPheThrIleSerArgAspAsnSerLysAsnThrLeuTyr65707580LeuGlnMetAsnSerLeuArgAlaGluAspThrAlaValTyrTyrCys859095AlaSerHisThrIleProGlyAlaTrpAspValTrpGlyGlnGlyThr100105110LeuValThrValSerSer115<210>42<211>110<212>PRT<213>ArtificialSequence<220><223>VL<400>42GlnSerAlaLeuThrGlnProAlaSerValSerGlySerProGlyGln151015SerIleThrIleSerCysThrGlyThrThrArgAspValGlyGlyTyr202530AsnTyrValSerTrpTyrGlnGlnHisProGlyLysAlaProLysLeu354045MetIleTyrAspValAsnAsnArgProSerGlyValSerTyrArgPhe505560SerGlySerLysSerGlyAsnThrAlaSerLeuThrIleSerGlyLeu65707580GlnAlaGluAspGluAlaAspTyrTyrCysSerSerTyrThrThrSer859095SerArgArgValPheGlyThrGlyThrLysValThrValLeu100105110<210>43<211>121<212>PRT<213>ArtificialSequence<220><223>VH<400>43GlnValGlnLeuValGluSerGlyAlaGluValLysLysProGlySer151015SerValLysValSerCysLysAlaSerGlyGlyThrPheSerSerTyr202530AlaIleSerTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpMet354045GlyArgIleIleProIleLeuGlyIleAlaAsnTyrAlaGlnLysPhe505560GlnGlyArgValThrIleThrAlaAspLysSerThrSerThrAlaTyr65707580MetGluLeuSerSerLeuArgSerGluAspThrAlaValTyrTyrCys859095AlaAsnGlyGlyAspSerSerSerTrpTyrThrPheAspTyrTrpGly100105110GlnGlyThrLeuIleThrValSerSer115120<210>44<211>107<212>PRT<213>ArtificialSequence<220><223>VL<400>44AspIleGlnMetThrGlnSerProSerThrLeuSerAlaSerValGly151015AspLysLeuThrLeuThrCysArgAlaSerGlnSerIleSerArgTrp202530LeuAlaTrpTyrGlnGlnLysProGlyLysAlaProLysLeuLeuIle354045TyrLysAlaSerTyrLeuGlnThrGlyValProSerArgPheSerGly505560SerGlyThrGlyThrGluPheThrLeuThrIleSerSerLeuGlnPro65707580AspAspPheAlaThrTyrTyrCysGlnGlnTyrAsnThrPheProLeu859095ThrPheAlaGlyGlyThrLysValGluIleLys100105<210>45<211>107<212>PRT<213>ArtificialSequence<220><223>VL<400>45AspIleGlnMetThrGlnSerProSerThrLeuSerAlaSerValGly151015AspArgValAsnIleThrCysArgAlaSerGlnThrIleAsnSerTrp202530LeuAlaTrpTyrGlnGlnLysProGlyLysAlaProLysLeuLeuIle354045TyrLysAlaSerTyrLeuGlnThrGlyValProSerArgPheSerGly505560SerGlyAlaGlyThrGluPheThrLeuThrIleSerSerLeuGlnPro65707580AspAspPheAlaThrTyrTyrCysGlnGlnTyrAsnSerTyrSerLeu859095ThrPheGlyGlyGlyThrLysValGluIleLys100105<210>46<211>107<212>PRT<213>ArtificialSequence<220><223>VL<400>46AspIleGlnMetThrGlnSerProSerThrLeuSerAlaSerValGly151015AspArgLeuThrIleThrCysArgAlaSerGlnAsnIleAsnSerTrp202530LeuAlaTrpTyrGlnGlnLysProGlyLysAlaProLysLeuLeuIle354045TyrLysAlaSerTyrLeuGlnThrGlyValProSerArgPheSerGly505560SerGlySerGlyThrGluPheThrLeuThrIleThrSerLeuGlnPro65707580AspAspPheAlaSerTyrTyrCysGlnGlnTyrAspSerAsnProLeu859095ThrPheGlyGlyGlyThrLysValGluIleLys100105<210>47<211>107<212>PRT<213>ArtificialSequence<220><223>VL<400>47AspIleGlnMetThrGlnSerProSerSerLeuSerAlaSerValGly151015AspArgValThrIleThrCysArgAlaSerGlnGlyIleSerSerTyr202530LeuAlaTrpTyrGlnGlnLysProGlyLysAlaProLysLeuLeuIle354045TyrAlaAlaSerThrLeuGlnSerGlyValProSerArgPheSerGly505560SerGlySerGlyThrAspPheThrLeuThrIleSerSerLeuGlnPro65707580GluAspPheAlaThrTyrTyrCysGlnGlnTyrTyrSerPheProLeu859095ThrPheGlyGlyGlyThrLysValGluIleLys100105<210>48<211>107<212>PRT<213>ArtificialSequence<220><223>VL<400>48AspIleGlnMetThrGlnSerProSerThrLeuSerAlaSerValGly151015AspArgValThrIleThrCysArgAlaGlyGlnSerIleArgSerTrp202530LeuAlaTrpTyrGlnGlnLysProGlyGluAlaProLysLeuLeuIle354045TyrLysAlaTyrTyrLeuGlnThrGlyValProSerArgPheSerGly505560SerGlyAlaGlyThrGluPheThrLeuThrIleSerSerLeuGlnPro65707580AspAspPheAlaThrTyrTyrCysGlnGlnTyrAsnThrSerProLeu859095ThrPheGlyGlyGlyThrLysValGluIleLys100105<210>49<211>107<212>PRT<213>ArtificialSequence<220><223>VL<400>49AspIleGlnMetThrGlnSerProSerThrLeuSerAlaSerValGly151015AspArgValThrIleThrCysArgAlaSerGluThrIleSerSerTrp202530LeuAlaTrpTyrGlnGlnLysProGlyLysAlaProLysLeuLeuIle354045TyrLysAlaSerSerLeuGlnSerGlyValProSerArgPheSerGly505560SerGlySerGlyThrGluPheThrLeuThrIleSerSerLeuGlnPro65707580AspAspPheAlaThrTyrTyrCysGlnGlnTyrTyrSerTyrProIle859095ThrPheGlyGlnGlyThrArgLeuGluIleLys100105<210>50<211>107<212>PRT<213>ArtificialSequence<220><223>VL<400>50AspIleGlnMetThrGlnSerProSerThrLeuSerAlaSerValGly151015AspArgValThrIleThrCysArgAlaSerGlnSerIleAspAsnTrp202530LeuAlaTrpTyrGlnGlnLysProGlyLysAlaProLysLeuLeuIle354045TyrLysAlaSerSerLeuGlnSerGlyValProSerArgPheSerGly505560SerGlySerGlyThrGluPheThrLeuThrIleSerSerLeuGlnPro65707580AspAspPheAlaSerTyrTyrCysGlnGlnTyrAspSerAsnProLeu859095ThrPheGlyGlyGlyThrLysValGluIleLys100105<210>51<211>354<212>DNA<213>ArtificialSequence<220><223>VH<400>51caggtgcagctggtggagtctgggggaggcttggtacagtcgggggggtccctgagactc60tcctgtgcagcctctggattcacctttagcagctatgccatgagctgggtccgccaggct120ccagggaaggggctggagtgggtctcagttattagtggtagtggtggtagcagatactac180gcagactccgtgaagggccggttcaccatctccagagacaattccaagaacacgctgtat240ctgcaaatgaacagtctgagagccgaggacacggccgtgtattactgtgcgagtcatact300ataccaggagcttgggatgtctggggccaagggacactggtcaccgtctcctca354<210>52<211>330<212>DNA<213>ArtificialSequence<220><223>VL<400>52cagtctgccctgactcagcctgcctccgtgtctgggtctcctggacagtcgatcaccatc60tcctgcactggaaccacccgtgacgtcggtggttataactatgtctcctggtaccaacaa120caccccggcaaagcccccaaactcatgatttatgatgtcaataatcggccctcaggggtt180tcttatcgcttctctggctccaagtctggcaacacggcctccctgaccatctctgggctc240caggctgaggacgaggctgattattactgcagctcatatacaaccagcagcagaagggtc300ttcggaactgggaccaaggtcaccgtccta330<210>53<211>369<212>DNA<213>ArtificialSequence<220><223>VH<400>53caggtgcagctggtagagtctggggctgaagtgaagaagcctggggcttcagtgaagctg60tcctgcaaggcttctggctacaccttcagcagctactggatgcactgggtgcgccaggcc120cctggacaacgccttgagtggatgggagagattaatcctggcaacggtcatactaactac180aacgagaagttcaagtcacgcgtgacaatcactgtagacaaatccgcgagcacagcctac240atggagctcagcagcctgagatctgaggacacggccgtgtattactgtgttgcagatccg300agaaggcctaaagtaccaactgctttgtttgtctattggggccagggaaccctggtcacc360gtctcctca369<210>54<211>321<212>DNA<213>ArtificialSequence<220><223>VL<400>54gacatccagatgacccagtctccatcttccgtgtctgcatctgtaggagacagagtcacc60atcagttgtcgggcgagtcagggtattggcacctggttagcctggtatcagcagaagcca120ggtaaagcccctagactcttgatctatgctgcatccagtttggacagtggggtcccatcg180agattcagcgccagtggatctgggacagatttcactctcaccatcagcagcctgcagcct240gaagattttgcaacttactactgtcaacaggctatcaatttcccgatcaccttcggccaa300gggacacgactggaaatcaaa321<210>55<211>372<212>DNA<213>ArtificialSequence<220><223>VH<400>55caggtgcagctggtggagtctgggggaggcttggtacagccaggacggtccctgagactc60tcctgtacaacctctggattcaatttccatgattatgctctgtcctgggtccggcaggct120ccagggaaggggctggaatgggtgagtttcattagacaccaacgttatggtgggacaacg180cagtacgccgcgtctgtgaaaggcagattcaccatctcaagagacgattccaaaggcatc240gcatacctgcaaatgaacagtctgagagccgaggacacggccgtgtattactgtgcgaga300ggatcttccagcagcagctggtaccttccaaatgactactggggccagggaaccctggtc360accgtctcctca372<210>56<211>318<212>DNA<213>ArtificialSequence<220><223>VL<400>56gacatccagatgacccagtctccttccaccctgtctgcatctgtaggagacagagtcacc60atcacttgccgggccagtcaggacattagtacctggttggcctggtatcagcagaagcca120gggaaagcccctaaactcctgatctataaggcgtctagtttacaaagtggggtcccatca180agattcagcggcagtggatctgggacagaattcactctcactatcagcagcctgcagcct240gatgattttgcaacttattactgccaacagtataataggttttggacattcggccaaggg300accaaggtggaaatcaaa318<210>57<211>363<212>DNA<213>ArtificialSequence<220><223>VH<400>57caggtgcagctggtggagtctggggctgaggtgaagaagcctgggtcctcggtgaaggtc60tcctgcaaggcttctggaggcaccttcagcagctatgctatcagctgggtgcgacaggcc120cctggacaagggcttgagtggatgggaaggatcatccctatccttggtatagcaaactac180gcacagaagttccagggcagagtcacgattaccgcggacaaatccacgagcacagcctac240atggagctgagcagcctgagatctgaggacacggccgtgtattactgtgcgaatggaggg300gatagcagcagctggtacacctttgactactggggccagggaaccctgatcaccgtctcc360tca363<210>58<211>321<212>DNA<213>ArtificialSequence<220><223>VL<400>58gacatccagatgacccagtctccttccaccctgtctgcatctgtaggagacaaactcacc60ctcacctgccgggccagtcagagtattagtagatggttggcctggtatcagcagaaacct120ggaaaagcccctaaactcctcatctataaggcatcttatttacaaactggggtcccgtca180agattcagcggcagtggaactgggacagaattcactctcaccatcagcagcctgcagcct240gatgattttgcgacttattactgccaacaatataatactttcccgctcactttcgccgga300gggaccaaggtggaaatcaaa321<210>59<211>321<212>DNA<213>ArtificialSequence<220><223>VL<400>59gacatccagatgacccagtctccttccaccctgtctgcttctgtaggagacagagtcaat60atcacttgccgggccagtcaaactattaatagttggttggcctggtatcagcagaaacca120gggaaagcccctaaactcctcatctataaggcatcttatttacaaactggggtcccgtca180agattcagcggcagtggagctgggacagaattcactctcaccatcagcagcctgcagcct240gatgattttgcgacttattactgccaacagtataatagttattctcttactttcggcgga300gggaccaaggtagagatcaaa321<210>60<211>321<212>DNA<213>ArtificialSequence<220><223>VL<400>60gacatccagatgacccagtctccttccaccctgtctgcatctgttggtgacagactcacc60atcacttgtcgggccagtcagaatattaatagttggttggcctggtatcagcagaaacct120ggaaaagcccctaaactcctcatctataaggcatcttatttacaaactggggtcccgtca180agattcagcggcagtggatctgggacagaattcaccctcaccatcaccagcctgcagcct240gacgattttgcaagttattactgccaacagtatgacagtaatccgctcactttcggcgga300gggaccaaggtggaaatcaaa321<210>61<211>321<212>DNA<213>ArtificialSequence<220><223>VL<400>61gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagacagagtcacc60atcacttgccgggccagtcagggcattagcagttatttagcctggtatcagcaaaaacca120gggaaagcccctaagctcctgatctatgctgcatccactttgcaaagtggggtcccatca180aggttcagcggcagtggatctgggacggatttcactctcaccatcagcagcctgcagcct240gaagattttgcaacttattactgccaacagtattattcttttccgctcactttcggcgga300gggaccaaggtggaaatcaaa321<210>62<211>321<212>DNA<213>ArtificialSequence<220><223>VL<400>62gacatccagatgacccagtctccttctaccctgtctgcttctgtcggggacagagtcacc60atcacttgccgggccggtcagagtattcgtagttggctggcctggtatcagcagaaacca120ggggaggcccctaaactcctcatctataaggcatattatttacaaactggggtcccgtca180agattcagcggcagtggagctgggacagaattcactctcaccatcagcagcctgcagcct240gatgattttgcgacttattactgccaacaatataatacttcccccctcactttcggcgga300gggaccaaggtggaaatcaaa321<210>63<211>321<212>DNA<213>ArtificialSequence<220><223>VL<400>63gacatccagatgacccagtctccttccaccctgtctgcatctgtaggagacagagtcacc60atcacttgccgggccagtgagactattagtagctggttggcctggtatcagcagaaacca120gggaaagcccctaagctcctgatctataaggcatctagtttacaaagtggggtcccatca180aggttcagcggcagcggatctgggacagaattcactctcaccatcagcagcctgcagcct240gatgattttgcaacttattactgccaacagtattatagttatccgatcaccttcggccaa300gggacacgactggagatcaaa321<210>64<211>321<212>DNA<213>ArtificialSequence<220><223>VL<400>64gacatccagatgacccagtctccttccaccctgtctgcatctgttggagacagagtcacc60atcacttgccgggccagtcagagtattgataattggttggcctggtatcagcagaagcca120gggaaagcccctaagctcctgatctataaggcgtctagtttacaaagtggggtcccatca180aggttcagcggcagtggatctgggacagaattcactctcaccatcagcagcctgcagcct240gacgattttgcaagttattactgccaacagtatgacagtaatccgctcactttcggcgga300gggaccaaggtggaaatcaaa321<210>65<211>438<212>PRT<213>ArtificialSequence<220><223>B7-H3<400>65LeuGluValGlnValProGluAspProValValAlaLeuValGlyThr151015AspAlaThrLeuCysCysSerPheSerProGluProGlyPheSerLeu202530AlaGlnLeuAsnLeuIleTrpGlnLeuThrAspThrLysGlnLeuVal354045HisSerPheAlaGluGlyGlnAspGlnGlySerAlaTyrAlaAsnArg505560ThrAlaLeuPheProAspLeuLeuAlaGlnGlyAsnAlaSerLeuArg65707580LeuGlnArgValArgValAlaAspGluGlySerPheThrCysPheVal859095SerIleArgAspPheGlySerAlaAlaValSerLeuGlnValAlaAla100105110ProTyrSerLysProSerMetThrLeuGluProAsnLysAspLeuArg115120125ProGlyAspThrValThrIleThrCysSerSerTyrGlnGlyTyrPro130135140GluAlaGluValPheTrpGlnAspGlyGlnGlyValProLeuThrGly145150155160AsnValThrThrSerGlnMetAlaAsnGluGlnGlyLeuPheAspVal165170175HisSerIleLeuArgValValLeuGlyAlaAsnGlyThrTyrSerCys180185190LeuValArgAsnProValLeuGlnGlnAspAlaHisSerSerValThr195200205IleThrProGlnArgSerProThrGlyAlaValGluValGlnValPro210215220GluAspProValValAlaLeuValGlyThrAspAlaThrLeuArgCys225230235240SerPheSerProGluProGlyPheSerLeuAlaGlnLeuAsnLeuIle245250255TrpGlnLeuThrAspThrLysGlnLeuValHisSerPheThrGluGly260265270ArgAspGlnGlySerAlaTyrAlaAsnArgThrAlaLeuPheProAsp275280285LeuLeuAlaGlnGlyAsnAlaSerLeuArgLeuGlnArgValArgVal290295300AlaAspGluGlySerPheThrCysPheValSerIleArgAspPheGly305310315320SerAlaAlaValSerLeuGlnValAlaAlaProTyrSerLysProSer325330335MetThrLeuGluProAsnLysAspLeuArgProGlyAspThrValThr340345350IleThrCysSerSerTyrArgGlyTyrProGluAlaGluValPheTrp355360365GlnAspGlyGlnGlyValProLeuThrGlyAsnValThrThrSerGln370375380MetAlaAsnGluGlnGlyLeuPheAspValHisSerValLeuArgVal385390395400ValLeuGlyAlaAsnGlyThrTyrSerCysLeuValArgAsnProVal405410415LeuGlnGlnAspAlaHisGlySerValThrIleThrGlyGlnProMet420425430ThrPheProProGluAla435<210>66<211>25<212>DNA<213>ArtificialSequence<220><223>Primer<400>66ctggaggtccaggtccctgaagacc25<210>67<211>25<212>DNA<213>ArtificialSequence<220><223>Primer<400>67ggcctctggggggaatgtcataggc25当前第1页12
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。