1.本发明属于有机合成技术领域,具体是指一种苯甲酰基喹啉类化合物的合成方法。
背景技术:
2.喹啉是天然产物和药物活性物质中普遍存在的结构单元之一。而喹啉衍生物被广泛应用于药物化学,特别是在抗病毒、抗癌、抗结核和抗疟疾方面有广泛的使用。其中,苯甲酰基喹啉化合物具有抗疟疾的活性,也可与其他药物一同治疗艾滋病。
3.在现有的羰基喹啉化合物的合成研究中,最常用的手段是利用povarov反应。例如:等人(org.lett.2011,13,6066
–
6069)报道了α-氨基羰基化合物和烯基化合物以fecl3作为催化剂的条件下合成了一系列的羰基酯类喹啉化合物,反应收率中等;wang课题组(org.lett.2012,14,4030
–
4033)以incl3为添加剂,使得α-氨基羰基化合物和烯基化合物反应生成羰基酯类喹啉衍生物;wu课题组(j.org.chem.2015,80,5984-5991)开发了一种用单质碘为催化剂,合成苯甲酰基喹啉衍生物的方法,反应收率中等。但是利用povarov反应,所需要的羰基喹啉类化合物是非常罕见的。ma等人(org.lett.2019,21,4812-4815)报道了一种通过c-h键活化的环化反应,通过[ru(p-cymene)cl2]2催化,使得烯基c-h键活化,生成苯甲酰基喹啉的方法。
[0004]
然而,在许多情况下,上述方法需要使用大量强氧化剂、昂贵或剧毒的添加剂、贵金属催化剂以及较高的温度,这使得这些方法的实用性大大降低。因此,开发方便、实用的方法从稳定且容易获得的底物中获取羰基喹啉骨架仍然具有重要意义。
技术实现要素:
[0005]
本发明的目的是为了克服现有技术存在的缺点和不足,而提供一种苯甲酰基喹啉类化合物的合成方法。该方法以2-(1-苯乙烯基)苯胺类化合物与硫叶立德为原料,在温和条件下,实现了高效广泛的苯甲酰基喹啉类化合物的合成。
[0006]
为实现上述目的,本发明的技术方案是在无溶剂、含氧气体氛围下,使用酞菁铁作为催化剂,对下式(ⅰ)和(ⅱ)化合物进行催化环化反应,反应结束后经后处理,从而得到所述式(ⅲ)化合物,其化学反应式为:
[0007][0008]
其中,r1选自h、卤素、烷基、甲氧基、芳基;r2选自h、卤素;r3选卤素、烷基、甲氧基、三氟甲基、芳基、杂环。
[0009]
进一步设置是所述反应中还添加有辅助物,该辅助物为碳酸钾、碳酸钠、甲醇钠、三乙胺中任意一种。
[0010]
进一步设置是含氧气体氛围为空气、氧气中的任意一种。
[0011]
进一步设置是所述辅助物的用量为25~100mmol%。
[0012]
进一步设置是所述的酞菁铁的用量为2.5~10mmol%。
[0013]
进一步设置是所述反应温度为50~60℃。
[0014]
进一步设置是所述反应时间为12~18h。
[0015]
进一步设置是反应结束后的后处理为硅胶柱色谱分离,具体的可为:反应完成后,加入适量的二氯甲烷溶解,并将反应液转移、过滤,将滤液浓缩后,直接进行硅胶柱色谱分离,以体积比为1:0.01-0.05的石油醚与乙酸乙酯的混合物作为洗脱剂,收集洗脱液,再次减压蒸馏浓缩,从而得到所述式(iii)化合物。其中,反应完成后的所加入的二氯甲烷的用量并没有特别的限定,只要其能将反应原液完全转移,以及方便后续处理即可,本技术领域人员可进行核实的选择和确定,在此不再赘述。
[0016]
进一步设置是所述辅助物为碳酸钠,该碳酸钠的用量为0.25~1.0个当量,以原料式(ⅰ)所示化合物为2-(1-苯乙烯基)苯胺为基数。
[0017]
进一步设置是所述酞菁铁的用量为0.025~0.1当量,以原料式(ⅰ)所示化合物为2-(1-苯乙烯基)苯胺为基数。
[0018]
本发明的优点和技术效果为:本发明可以用于喹啉结构的合成,可以取得良好的产物产率,从而在该类喹啉结构的合成中具有良好的用途。
[0019]
本发明提供了一种苯甲酰基喹啉结构的合成方法,所述合成方法通过无溶剂的方法可以得到产率良好的目标产物,为苯甲酰基喹啉类化合物的合成提供了全新方法。
[0020]
本发明以2-(1-苯乙烯基)苯胺类化合物与硫叶立德为原料,在温和条件下,实现了高效广泛的苯甲酰基喹啉类化合物的合成,本发明使用的促进剂为碳酸钠,廉价易得,且原料合成简单,相比现有技术,本发明更具有实际应用价值,能够推广和应用。
附图说明
[0021]
图1本发明实施例1的1h nmr(500mhz,cdcl3)(上图)和
13
cnmr(125mhz,cdcl3)(下图)的谱图;
[0022]
图2本发明实施例2的1h nmr(500mhz,cdcl3)(上图)和
13
cnmr(125mhz,cdcl3)(下图)的谱图;
[0023]
图3本发明实施例3的1h nmr(500mhz,cdcl3)(上图)和
13
cnmr(125mhz,cdcl3)(下图)的谱图;
[0024]
图4本发明实施例4的1h nmr(500mhz,cdcl3)(上图)和
13
cnmr(125mhz,cdcl3)(下图)的谱图;
[0025]
图5本发明实施例5的1h nmr(500mhz,cdcl3)(上图)和
13
cnmr(125mhz,cdcl3)(下图)的谱图;
[0026]
图6本发明实施例6的1h nmr(500mhz,cdcl3)(上图)和
13
cnmr(125mhz,cdcl3)(下图)的谱图;
[0027]
图7本发明实施例7的1h nmr(500mhz,cdcl3)(上图)和
13
cnmr(125mhz,cdcl3)(下
图)的谱图;
[0028]
图8本发明实施例8的1h nmr(500mhz,cdcl3)(上图)和
13
cnmr(125mhz,cdcl3)(下图)的谱图;
[0029]
图9本发明实施例9的1h nmr(500mhz,cdcl3)(上图)和
13
cnmr(125mhz,cdcl3)(下图)的谱图;
[0030]
图10本发明实施例10的1h nmr(500mhz,cdcl3)(上图)和
13
cnmr(125mhz,cdcl3)(下图)的谱图;
[0031]
图11本发明实施例11的1h nmr(500mhz,cdcl3)(上图)和
13
cnmr(125mhz,cdcl3)(下图)的谱图。
具体实施方式
[0032]
为使本发明的目的、技术方案和优点更加清楚,下面将结合实施例对本发明作进一步地详细描述。
[0033]
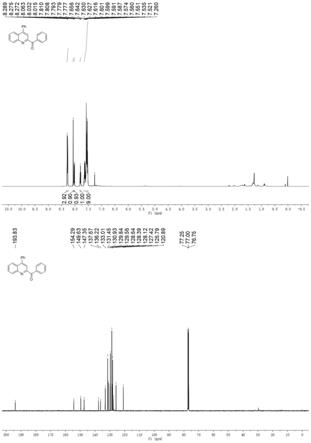
实例1:4-苯基-2-苯甲酰基喹啉
[0034][0035]
向15ml石英反应管中依次加入2-(1-苯乙烯基)苯胺(39.1mg,0.2mmol),苯基硫叶立德(58.9mg,0.3mmol),酞菁铁(5.7mg,0.01mmol),碳酸钠(21.2mg,0.2mmol)。将此反应混合物放在蓝光下并在加热的条件下搅拌18h后取出冷却至室温,加入适量的二氯甲烷溶解,并将反应液转移、过滤,将滤液浓缩后,直接进行硅胶柱色谱分离,以体积比为60:1的石油醚与乙酸乙酯的混合物作为洗脱剂,使用柱层析色谱分离后得到,收率为94%。
[0036]1h nmr(500mhz,cdcl3):δ8.29-8.27(m,3h),8.06(s,1h),8.02(d,j=8.5hz,1h),7.81-7.78(m,1h),7.66-7.52(m,9h).
13
c nmr(125mhz,cdcl3):δ193.8,154.3,149.6,147.4,137.7,136.2,133.0,131.5,130.9,129.8,129.6,128.6,128.4,128.1,127.4,125.8,120.9.
[0037]
实例2:4-苯基-2-苯甲酰基-6-甲氧基喹啉
[0038]
向15ml石英反应管中依次加入4-甲氧基-2-(1-苯乙烯基)苯胺(45.1mg,0.2mmol),苯基硫叶立德(58.9mg,0.3mmol),酞菁铁(5.7mg,0.01mmol),碳酸钠(21.2mg,0.2mmol)。将此反应混合物放在蓝光下并在加热的条件下搅拌18h后取出冷却至室温,加入适量的二氯甲烷溶解,并将反应液转移、过滤,将滤液浓缩后,直接进行硅胶柱色谱分离,以体积比为60:1的石油醚与乙酸乙酯的混合物作为洗脱剂,使用柱层析色谱分离后得到,收率为97%。
[0039]1h nmr(500mhz,cdcl3):δ8.27(d,j=8.0hz,2h),8.16(d,j=9.5hz,1h),8.06(s,1h),7.64-7.51(m,8h),7.44(dd,j=9.0,2.5hz,1h),7.27(d,j=2.5hz,1h),3.83(s,3h).
13
c nmr(125mhz,cdcl3):δ193.8,159.5,152.0,147.9,143.4,138.0,136.5,132.8,132.5,131.4,129.3,128.8,128.8,128.6,128.1,122.5,121.5,103.5,55.5.
[0040]
实例3:4-苯基-6-甲基-2-苯甲酰基喹啉
[0041][0042]
向15ml石英反应管中依次加入4-甲基-2-(1-苯乙烯基)苯胺(41.9mg,0.2mmol),苯基硫叶立德(58.9mg,0.3mmol),酞菁铁(5.7mg,0.01mmol),碳酸钠(21.2mg,0.2mmol)。将此反应混合物放在蓝光下并在加热的条件下搅拌18h后取出冷却至室温,加入适量的二氯甲烷溶解,并将反应液转移、过滤,将滤液浓缩后,直接进行硅胶柱色谱分离,以体积比为60:1的石油醚与乙酸乙酯的混合物作为洗脱剂,使用柱层析色谱分离后得到,收率为91%。
[0043]1h nmr(500mhz,cdcl3):δ8.28(d,j=8.0hz,2h),8.17(d,j=8.5hz,1h),8.04(s,1h),7.76(s,1h),7.65-7.51(m,9h),2.52(s,3h).
13
c nmr(125mhz,cdcl3):δ193.9,153.4,148.8,145.9,138.8,137.9,136.3,132.9,132.2,131.5,130.7,129.5,128.6,128.5,128.1,127.4,124.5,121.1,22.0.
[0044]
实例4:4-苯基-2-苯甲酰基-6-氟喹啉
[0045]
向15ml石英反应管中依次加入4-氟-2-(1-苯乙烯基)苯胺(42.7mg,0.2mmol),苯基硫叶立德(58.9mg,0.3mmol),酞菁铁(5.7mg,0.01mmol),碳酸钠(21.2mg,0.2mmol)。将此反应混合物放在蓝光下并在加热的条件下搅拌18h后取出冷却至室温,加入适量的二氯甲烷溶解,并将反应液转移、过滤,将滤液浓缩后,直接进行硅胶柱色谱分离,以体积比为60:1的石油醚与乙酸乙酯的混合物作为洗脱剂,使用柱层析色谱分离后得到,收率为81%。
[0046]1h nmr(500mhz,cdcl3):δ8.29-8.25(m,3h),8.09(s,1h),7.66-7.62(m,2h),7.58-7.52(m,8h).
13
c nmr(125mhz,cdcl3):δ193.5,161.9(d,j=248.8hz),153.7,149.2(d,j=5.0hz),144.4,137.2,136.1,133.5(d,j=10.0hz),133.1,131.4,129.4,128.9,128.9,128.5(d,j=10.0hz),128.2,121.5,120.3(d,j=26.3hz),109.3(d,j=22.5hz).
[0047]
实例5:4-苯基-2-苯甲酰基-8-甲氧基喹啉
[0048][0049]
向15ml石英反应管中依次加入2-甲氧基-6-(1-苯乙烯基)苯胺(45.1mg,0.2mmol),苯基硫叶立德(58.9mg,0.3mmol),酞菁铁(5.7mg,0.01mmol),碳酸钠(21.2mg,0.2mmol)。将此反应混合物放在蓝光下并在加热的条件下搅拌18h后取出冷却至室温,加入适量的二氯甲烷溶解,并将反应液转移、过滤,将滤液浓缩后,直接进行硅胶柱色谱分离,以体积比为20:1的石油醚与乙酸乙酯的混合物作为洗脱剂,使用柱层析色谱分离后得到,收率为86%。
[0050]1h nmr(500mhz,cdcl3):δ8.40(d,j=7.0hz,2h),8.08(s,1h),7.61(t,j=7.5hz,
1h),7.56-7.50(m,9h),7.12(dd,j=7.5,1.0hz,1h),4.08(s,3h).
13
c nmr(125mhz,cdcl3):δ193.2,156.5,152.9,149.5,139.4,138.0,136.2,132.9,131.9,129.5,128.7,128.6,128.6,128.1,121.6,117.5,108.2,56.3.
[0051]
实例6:4-苯基-2-(4-甲基)苯甲酰基喹啉
[0052][0053]
向15ml石英反应管中依次加入2-(1-苯乙烯基)苯胺(39.1mg,0.2mmol),对甲基苯基硫叶立德(67.9mg,0.3mmol),酞菁铁(5.7mg,0.01mmol),碳酸钠(21.2mg,0.2mmol)。将此反应混合物放在蓝光下并在加热的条件下搅拌18h后取出冷却至室温,加入适量的二氯甲烷溶解,并将反应液转移、过滤,将滤液浓缩后,直接进行硅胶柱色谱分离,以体积比为60:1的石油醚与乙酸乙酯的混合物作为洗脱剂,使用柱层析色谱分离后得到,收率为94%。1h nmr(500mhz,cdcl3):δ8.28(d,j=8.5hz,1h),8.19(d,j=8.0hz,2h),8.03(s,1h),8.02(d,j=8.5hz,1h),7.81-7.77(m,1h),7.62-7.52(m,6h),7.34(d,j=8.0hz,2h),2.47(s,3h).
13
c nmr(125mhz,cdcl3):δ193.5,154.7,149.6,147.3,143.9,137.7,133.6,131.6,130.9,129.8,129.6,128.9,128.6,128.3,127.4,125.8,120.9,21.7.
[0054]
实例7:4-苯基-2-(4-三氟甲基)苯甲酰基喹啉
[0055][0056]
向15ml石英反应管中依次加入2-(1-苯乙烯基)苯胺(39.1mg,0.2mmol),对三氟甲基苯基硫叶立德(53.9mg,0.3mmol),酞菁铁(5.7mg,0.01mmol),碳酸钠(21.2mg,0.2mmol)。将此反应混合物放在蓝光下并在加热的条件下搅拌18h后取出冷却至室温,加入适量的二氯甲烷溶解,并将反应液转移、过滤,将滤液浓缩后,直接进行硅胶柱色谱分离,以体积比为100:1的石油醚与乙酸乙酯的混合物作为洗脱剂,使用柱层析色谱分离后得到,收率为82%。1h nmr(500mhz,cdcl3):δ8.40(d,j=8.0hz,2h),8.25(d,j=8.0hz,1h),8.14(s,1h),8.03(d,j=8.0hz,1h),7.83-7.79(m,3h),7.66-7.53(m,6h).
13
c nmr(125mhz,cdcl3):δ192.7,153.2,150.0,147.3,139.3,137.5,134.0(q,j=32.5hz),131.7,131.0,130.1,129.6,128.9,128.8,128.7,127.7,125.9,125.0(q,j=3.8hz),123.8(q,j=271.3hz),120.7.
[0057]
实例8:4-苯基-2-(4-氟)苯甲酰基喹啉
[0058][0059]
向15ml石英反应管中依次加入2-(1-苯乙烯基)苯胺(39.1mg,0.2mmol),对氟苯基硫叶立德(64.3mg,0.3mmol),酞菁铁(5.7mg,0.01mmol),碳酸钠(21.2mg,0.2mmol)。将此反
应混合物放在蓝光下并在加热的条件下搅拌18h后取出冷却至室温,加入适量的二氯甲烷溶解,并将反应液转移、过滤,将滤液浓缩后,直接进行硅胶柱色谱分离,以体积比为60:1的石油醚与乙酸乙酯的混合物作为洗脱剂,使用柱层析色谱分离后得到,收率为86%。1h nmr(500mhz,cdcl3):δ8.39-8.35(m,2h),8.26(d,j=8.5hz,1h),8.07(s,1h),8.02(d,j=8.5hz,1h),7.82-7.79(m,1h),7.64-7.53(m,6h),7.23-7.19(m,2h).
13
c nmr(125mhz,cdcl3):δ192.1,165.9(d,j=253.8hz,),154.0,149.8,147.2,137.6,134.3(d,j=10.0hz),132.5(d,j=2.5hz),130.9,130.0,129.6,128.7,128.7,128.5,127.5,125.8,120.9,115.3(d,j=21.3hz).
[0060]
实施例9:4-苯基-2-(4-氯)苯甲酰基喹啉
[0061][0062]
向15ml石英反应管中依次加入2-(1-苯乙烯基)苯胺(39.1mg,0.2mmol),对氯苯基硫叶立德(69.2mg,0.3mmol),酞菁铁(5.7mg,0.01mmol),碳酸钠(21.2mg,0.2mmol)。将此反应混合物放在蓝光下并在加热的条件下搅拌18h后取出冷却至室温,加入适量的二氯甲烷溶解,并将反应液转移、过滤,将滤液浓缩后,直接进行硅胶柱色谱分离,以体积比为100:1的石油醚与乙酸乙酯的混合物作为洗脱剂,使用柱层析色谱分离后得到,收率为92%。1h nmr(500mhz,cdcl3):δ8.28-8.25(m,3h),8.07(s,1h),8.02(d,j=8.5hz,1h),7.82-7.79(m,1h),7.64-7.61(m,1h),7.57-7.50(m,7h).
13
c nmr(125mhz,cdcl3):δ192.5,153.8,149.8,147.3,139.6,137.6,134.5,132.9,130.9,130.0,129.6,128.7,128.7,128.6,128.5,127.5,125.9,120.9.
[0063]
实施例10:4-苯基-2-(3-甲基)苯甲酰基喹啉
[0064][0065]
向15ml石英反应管中依次加入2-(1-苯乙烯基)苯胺(39.1mg,0.2mmol),间甲基苯基硫叶立德(63.1mg,0.3mmol),酞菁铁(5.7mg,0.01mmol),碳酸钠(21.2mg,0.2mmol)。将此反应混合物放在蓝光下并在加热的条件下搅拌18h后取出冷却至室温,加入适量的二氯甲烷溶解,并将反应液转移、过滤,将滤液浓缩后,直接进行硅胶柱色谱分离,以体积比为60:1的石油醚与乙酸乙酯的混合物作为洗脱剂,使用柱层析色谱分离后得到,收率为86%。1h nmr(500mhz,cdcl3):δ8.29(d,j=8.5hz,1h),8.08-8.02(m,4h),7.81-7.78(m,1h),7.63-7.52(m,6h),7.47-7.42(m,2h),2.46(s,3h).
13
c nmr(125mhz,cdcl3):δ194.2,154.4,149.5,147.3,137.9,137.6,136.1,133.8,131.6,130.9,129.8,129.5,128.8,128.6,128.3,127.9,127.3,125.7,120.9,21.4。
[0066]
实施例11:4-苯基-2-呋喃甲酰基喹啉
[0067][0068]
向15ml石英反应管中依次加入2-(1-苯乙烯基)苯胺(39.1mg,0.2mmol),呋喃基硫叶立德(55.9mg,0.3mmol),酞菁铁(5.7mg,0.01mmol),碳酸钠(21.2mg,0.2mmol)。将此反应混合物放在蓝光下并在加热的条件下搅拌18h后取出冷却至室温,加入适量的二氯甲烷溶解,并将反应液转移、过滤,将滤液浓缩后,直接进行硅胶柱色谱分离,以体积比为40:1的石油醚与乙酸乙酯的混合物作为洗脱剂,使用柱层析色谱分离后得到,收率为85%。1h nmr(500mhz,cdcl3):δ8.33-8.29(m,2h),8.19(s,1h),8.00(d,j=8.5hz,1h),7.82-7.79(m,2h),7.62-7.50(m,6h),6.68(dd,j=3.5,1.5hz,1h).
13
c nmr(125mhz,cdcl3):δ179.4,153.0,151.2,149.6,147.8,147.5,137.5,130.8,129.9,129.5,128.6,128.6,128.6,127.8,125.9,124.8,120.1,112.5。
[0069]
对比例1-5:铁化合物的考察
[0070]
除分别将对比例1-5中的铁化合物替换成如下的其他铁化合物外,其它操作均完全相同,从而重复操作了实例1,得到对比例1-5,所使用的配体、对应实施例和产物产率见下表1。
[0071][0072]
由此可见,在所筛选的铁化合物中,酞菁铁具有最好的效果。
[0073]
通过上述实例1-13和对比例1-5,利用酞菁铁作为促进剂,能够得到良好的反应效果,且收率较高,并通过nmr色谱,对产物进行结构分析,能够确证其为苯甲酰基喹啉化合物,说明本发明提供的催化反应方法能够有效得到苯甲酰基喹啉类化合物
[0074]
综上所述,本发明提供了一种催化2-苯乙烯基苯胺类化合物与硫叶立德通过环加成反应来合成喹啉类化合物的方法,所述合成方法通过酞菁铁和碳酸钠及各个组分、条件之间的相互协同和促进作用,从而可以高产率得到目标产物,为喹啉类化合物的合成提供了全新方法,具有很好的研究价值和应用潜力。
[0075]
以上所揭露的仅为本发明较佳实施例而已,当然不能以此来限定本发明之权利范围,因此依本发明权利要求所作的等同变化,仍属本发明所涵盖的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。