一种通过使用马昔瑞林诊断儿科患者中生长激素缺乏症的筛选方法
1.发明背景
2.生长激素(gh)是主要的身体全系统(system-wide)代谢激素,其调节蛋白质、脂质和碳水化合物体内稳态,是身心生长、发育和维持所必需的。gh在下丘脑腺的生长激素释放激素(ghrh)刺激下在垂体腺前叶产生。gh在24小时期间内以约6-10个随机爆发(burst)的搏动方式从垂体分泌。
3.根据gh缺乏症(deficiency)的来源,生长激素缺乏症(ghd)可以大致分为四类:1)垂体或“经典”ghd,2)下丘脑ghd,3)功能性ghd和4)特发性ghd。ghd在儿童或成年人中可能在临床上变得明显。在usa,据估计儿童ghd的发病率在4,000分之一至10,000分之一之间。在us,有超过50,000名成年人患有ghd,据报道,每年有6,000个新病例,包括转变为ghd成年人的ghd儿童(人成长基金会www.hgfound.org)。
4.ghd是一种儿童疾病,其特征在于生长学(auxological)参数的降低,如生长障碍和身材矮小。儿童ghd可以是先天性的或获得性的,并且可以是分离的或与其他垂体激素缺陷组合。存在许多明确病因的儿童ghd,但病因通常是未知的(特发性ghd)。各种类型ghd的定义和身材矮小的其它病因在international classification of pediatric endocrine diagnoses(icped)中给出。如果不治疗,童年发病的ghd会导致永久性身材矮小。在儿童中,ghd的诊断依赖于详细病史、临床特征、生长学(auxological)分析、gh-igf轴(gh=生长激素;igf=胰岛素样生长因子)组分的生化试验和使用mri的骨骼成熟和垂体解剖的放射学评估(ghrs,2000)。
5.与成年人的情况相似,儿童ghd的诊断依赖于生化试验,其是基于生长激素刺激试验(ghst),测定可用已知刺激gh释放的试剂诱导的gh水平。目前使用的ghst,如胰岛素耐量试验(itt)或胰高血糖素刺激试验(gst),尚未被开发并被特别批准用于该目的,但是是根据其它适应症调整的,因此在性能特征如特异性的灵敏性、安全性或可行性方面具有局限性(molitch et al.,2011;cook et al.,2009)。
6.itt被认为是评估ghd的黄金标准。静脉内施用胰岛素用于引起低血糖,其进而导致gh释放。然而,该试验是劳动密集型的,因为由于与低血糖(其与症状如震颤、嗜睡和心动过速)有关的潜在风险,因此需要对受试者进行密集的医学监测。通常,将副作用报导为是危险的。此外,itt禁用于患有癫痫障碍和缺血性心脏病的受试者(yuen 2011;yuen 2013)。因此,itt因为其不方便和安全性问题而没有广泛地使用。
7.gst是一种使用增长的替代品(molitch 2011;yuen 2011;yuen 2013)。gst的常见副作用包括恶心,呕吐和头痛。此外,试验持续时间(3-4小时)存在限制,并且需要肌肉注射。实际上,对于安全和可靠的替代试验,医疗需求仍未得到真正满足。
8.larsen在wo 2007/093820 a1中已经公开了一种基于马昔瑞林(macimorelin)的诊断ghd的试验,马昔瑞林是一种具有生长激素促分泌素(ghs)活性的口服可用的拟肽胃促生长素(ghrelin)受体激动剂。
9.胃促生长素有效刺激gh释放[kojima 1999]。胃促生长素的gh释放作用被认为是
由主要以垂体和下丘脑水平存在的特定受体介导的[nogueiras 2006]。在含有衍生自人下丘脑和垂体腺的ghs受体的膜制品中,据证实马昔瑞林显示与人ghs受体的结合效力和马昔瑞林与ghs受体的天然配体胃促生长素的结合效力相当[broglio 2002]。马昔瑞林容易从胃肠道吸收,并被认为以与胃促生长素相同的方式发挥其作用。
[0010]
基于马昔瑞林在健康受试者口服施用后不久释放gh脉冲的能力,马昔瑞林已经被开发为成年人gh缺乏症的口服诊断剂。
[0011]
martinez等人在wo 01/96300 a1中已经公开了马昔瑞林作为化合物及其在ghd治疗中的用途。
[0012]
garcia等人公开了马昔瑞林在成年人ghd(aghd)中的ghst(j clin endocrinol metab.2013,2422-9,在j clin endocrinol metab.2018,3083
–
3093和题为“validation of macimorelin asadiagnostic test for adult growth hormone deficiency(aghd):a phase 3 study in comparison with the insulin tolerance test(itt)”的海报中,其在2017年内分泌学会第99届年会上被呈现)。
[0013]
在wo 2019/121762 a1中,已经公开了用于测量人或动物受试者中生长激素水平的方法。所述方法包括向受试者口服施用含有马昔瑞林的组合物,在施用之后25-95分钟的范围内从所述受试者收集一、二或三个施用后样品,并将一、二或三个样品中的生长激素水平与单个阈值进行比较,其中所述单个阈值为2.8ng/ml,并且其中“单个阈值”指用于指示充分响应马昔瑞林刺激的生长激素水平阈值。
[0014]
关于gh刺激试验在儿科患者中的作用存在相当大的争论,因为在激发试验中经常发生低gh水平,并且存在关于ghst的有效性和再现性的担忧。
[0015]
因此,儿童ghd诊断指南通常需要两个ghst的结果来对ghd的诊断作出结论,除非存在仅需要使用一个ghst的典型脑缺陷(ghrs,2000,ghrs 2019)。
[0016]
2000年公布的gh研究会的共识指南(ghrs,2000)以及2003年公布的美国临床内分泌学家协会指南(gharib,2003)和国家指南(binder,2014)建议在良好标准化的ghst方案中,在禁食过夜之后应当使用有限数的ghst剂。这些包括精氨酸(arg)、可乐定、胰高血糖素、胰岛素和左旋多巴。
[0017]
gh研究会的共识指南指出,ghrh和arg的组合作为ghst被认为在儿童和成人期的ghd诊断中是有价值的,只要应用了合适的截止点(ghrs,2000)。该组合显示在儿童和青少年(magnhie,2002)、晚期青少年和年轻人(corneli,2007)中具有高灵敏度和高特异性。在该后者的试验中,仅在瘦患者中建立截止点。考虑到gh分泌随体重和肥胖变化(colao,2009),仍然需要定义适合于超重和肥胖的儿科患者的截止点(考虑年龄、bmi和腰围)。
[0018]
在具有ghd临床标准的儿童中,低于10ng/ml的gh峰浓度传统上用作支持诊断的截止点。最近综述了不同研究中用于不同ghst的灵敏性、特异性和gh截止点(van vught,2009)。
[0019]
在这种背景下,临床实践中使用了多个ghst,通过重复相同的ghst或通过连续进行两个不同的ghst,可变地满足了作为标准诊断方法一部分的两种ghst的要求。
[0020]
这两个ghst在同一天或连续两天进行,每个试验需要4-6个血液样品。尤其是在小孩中,认为采集血液量是安全性问题,并且要注意安全容量限制,如例如who(howie 2011)推荐的。除了这个安全性主题之外,应当注意,进行两个试验是耗时和耗费资源的,并且对
于儿童和他们的父母以及对于儿科内分泌学家的相关负担是高的。
[0021]
因此,已证明需要具有已证明的安全性、耐受性、易于应用、在灵敏性和特异性上的强试验特性以及可靠的可重复性的单个试验代替两个试验。2020年发表了关于本发明的简短新闻稿,宣布了在马昔瑞林的剂量发现儿科研究中的成果。
[0022]
发明简述
[0023]
在一个方面,本发明提供一种通过使用马昔瑞林诊断儿科患者中生长激素缺乏症的筛选方法,其包括:
[0024]
(a)提供一个至五个血液样品,其是在施用有效诱导生长激素分泌的量的马昔瑞林之后约15至约100分钟的范围内从受试者采集的;
[0025]
(b)测量步骤(a)中提供的每个血液样品的生长激素水平;
[0026]
(c)将在步骤(b)中获得的测量的生长激素水平与单个阈值进行比较,其中所述单个阈值为10.0ng/ml或更高;
[0027]
(d)确定在步骤(b)中获得的血液样品中其最高生长激素水平低于所述单个阈值的受试者患有生长激素缺乏症,和确定在步骤(b)中获得的血液样品的其最高生长激素水平不低于所述单个阈值的受试者未患有生长激素缺乏症。
[0028]
在另一个方面,本发明涉及用于诊断儿科患者中生长激素缺乏症的物质马昔瑞林,其中,
[0029]
(a)提供一个至五个血液样品,其是在施用有效诱导生长激素分泌的量的马昔瑞林之后约15至约100分钟的范围内从受试者采集的;
[0030]
(b)测量步骤(a)中提供的每个血液样品的生长激素水平;
[0031]
(c)将在步骤(b)中获得的测量的生长激素水平与单个阈值进行比较,其中所述单个阈值为10.0ng/ml或更高;
[0032]
(d)确定在步骤(b)中获得的血液样品中其最高生长激素水平低于所述单个阈值的受试者患有生长激素缺乏症,和确定在步骤(b)中获得的血液样品的其最高生长激素水平不低于所述单个阈值的受试者未患有生长激素缺乏症。
[0033]
在一个进一步的方面,本发明涉及一种通过使用马昔瑞林诊断儿科患者中生长激素缺乏症的筛选方法,其包括:
[0034]
(a)提供至少一个血液样品,其是在施用有效诱导生长激素分泌的量的马昔瑞林之后约15至约100分钟的范围内从受试者采集的;
[0035]
(b)测量每个血液样品的生长激素水平;
[0036]
(c)比较每个测量的生长激素水平与单个阈值;
[0037]
(d)基于比较在所述至少一个血液样品中在步骤(b)中测量的生长激素水平与所述单个阈值,诊断受试者是否患有生长激素缺乏症;其中确定所述受试者患有或未患有生长激素缺乏症只是基于施用单次马昔瑞林诱导的生长激素水平。
[0038]
定义
[0039]
除非在说明书或权利要求书中另外指出,否则用于解释本发明方法的术语总是具有以下含义。
[0040]
如本文使用的“受试者”或“儿科患者”是年龄为约2岁至小于18岁之间的任何性别(男性或女性)的人类儿童。例如,受试者的年龄在约3至小于18、约4至小于18、约5至小于
18、约6至小于18、约7至小于18、约8至小于18、约9至小于18、约10至小于18、约11至小于18、约12至小于18、约2至小于17、约2至小于16、约2至小于15、约2至小于14、约2至小于13、约2至小于12、约2至小于10、约2至小于9或约2至小于8岁。
[0041]
如本文使用的“马昔瑞林”指起具有生长激素促分泌素(ghs)活性的胃促生长素受体激动剂作用的拟肽化合物。其化学结构和在ghd治疗中的用途公开在美国专利6,861,409、wo01/96300和wo2007/093820中。
[0042]
如本文使用的术语“有效量”指在量方面足以产生预期效果的给定物质的量。例如,用于在接受者中诱导生长激素分泌的马昔瑞林的有效量是在将其施用至受试者时能够实现可检测的生长激素分泌增加的化合物的量。
[0043]
如本技术中使用的术语“试验”描述了基于受试者的症状导致疑似存在特定病症的行为和所述病症存在或不存在的鉴别。换句话说,“试验”病症涵盖确认或排除病症。
[0044]
如本技术中使用的术语“治疗”描述导致相关病症的任何症状的消除、减少、减轻、逆转或预防或延迟发作或复发的行为。
[0045]
如本文使用的术语“血液样品”涵盖全血液样品以及全血的一部分,例如血清或血浆样品。只要在同一方法方案中使用两个或更多个血液样品进行试验,这些血液样品就属于同一类型。例如,如果第一个样品是血清,则第二个样品和任何后续样品也是血清。此外,如果提供多于一个的血液样品,则术语“血液样品”指在施用有效诱导激素激素分泌的量的马昔瑞林之后在不同时间点采集的血液样品。两个血液样品可以指在施用有效诱导激素分泌的量的马昔瑞林之后,例如在约30
±
10分钟和约45
±
10分钟或在约30
±
10分钟和约60
±
10分钟时采集的血液样品。三个血液样品可以指在施用有效诱导激素分泌的量的马昔瑞林之后,例如在约30
±
10分钟、约45
±
10分钟和约60
±
10分钟或优选约30
±
10分钟、约45
±
10分钟和约90
±
10分钟或,可选地,在约30
±
10分钟、约60
±
10分钟和约90
±
10分钟时采集的血液样品。
[0046]
如本文使用的术语“约”表示参考值的
±
10%的范围。例如,“约10”限定9至11的范围。
[0047]
术语“单个阈值”涉及指示对马昔瑞林刺激的足够响应:而不是在成人试验中通常使用的2.8ng/ml阈值的阈值生长激素水平,在本发明方法中使用的阈值在约10.0ng/ml或更高的较高范围内,例如约10.0-25.0ng/ml、约10.0-20.0ng/ml、约10.1-19.5ng/ml、约10.2-19.0ng/ml、约10.3-18.5ng/ml、约10.4-18.0ng/ml、约10.5-17.5ng/ml、约10.6-17.0ng/ml、约11.0-16.5ng/ml、约12.0-16.0ng/ml、约13.0-15.5ng/ml、约14.0-15.0ng/ml、约15.0-16.0ng/ml、约15.5-18.0ng/ml、约16.0-18.0ng/ml、约16.5-18.0ng/ml、约17.0-18.0ng/ml、约17.5-20.0ng/ml、约18.0-19.0ng/ml、约18.5-19.5ng/ml、约19.0-20.0ng/ml、约20.0-21.0ng/ml或约25.0-30.0ng/ml。本发明方法中使用的单个阈值也可以是单个值,例如10.5ng/ml、11.0ng/ml、11.5ng/ml、12.0ng/ml、12.5ng/ml、13.0ng/ml、13.5ng/ml、14.0ng/ml、14.5ng/ml、15.0ng/ml、15.5ng/ml、16.0ng/ml、16.5ng/ml、17.0ng/ml、17.5ng/ml、18.0ng/ml、18.5ng/ml、19.0ng/ml、20.0ng/ml或25.0ng/ml。另外,单个阈值指在全血或血清/血浆中的ng/ml。最优选地,单个阈值指血清中的ng/ml。术语“单个阈值”和“截止点”可互换使用。
[0048]
重量百分比、重量%、%w/w等是同义词,其指物质的重量除以组合物的重量并乘
以100得到的物质浓度。
[0049]
在本技术中引用的所有专利、专利申请和其他出版物通过引用整体并入本文以用于所有目的。
[0050]
附图
[0051]
图1显示对于群组1(即0.25mg/kg体重),相对于时间的个体马昔瑞林浓度,线性标度(药代动力学分析组(pks),患者数(n)=24)。
[0052]
图2显示对于群组2(即0.5mg/kg体重),相对于时间的个体马昔瑞林浓度,线性标度(pks,n=24)。
[0053]
图3显示对于群组3(即1.0mg/kg体重),相对于时间的个体马昔瑞林浓度,线性标度(pks,n=24)。
[0054]
图4显示对于群组1(即0.25mg/kg体重),相对于时间的马昔瑞林ghst之后的个体gh浓度,线性标度(药效动力学分析组(pks),n=24)。
[0055]
图5显示对于群组2(即0.5mg/kg体重),相对于时间的马昔瑞林ghst之后的个体gh浓度,线性标度(pds,n=24)。
[0056]
图6显示了对于群组3(即1.0mg/kg体重),相对于时间的马昔瑞林ghst之后的个体gh浓度,线性标度(pds,n=24)。
[0057]
图7显示对于群组1(即0.25mg/kg体重),马昔瑞林ghst的接受者操作特征(roc)分析,(pds,n=24)。
[0058]
图8显示对于群组2(即0.5mg/kg体重),马昔瑞林ghst的接受者操作特征(roc)分析,(pds,n=24)。
[0059]
图9显示对于群组3(即1.0mg/kg体重),马昔瑞林ghst的接受者操作特征(roc)分析,(pds,n=24)。
[0060]
发明详述
[0061]
本发明的一个目的是提供一种用于测量儿科患者中生长激素水平和用于检测儿科患者中ghd的独立方法。所述目的是开发一种新方法,其不仅通过减少试验持续时间和抽血次数来减少试验管理者和试验对象的负担,而且将提供安全、可靠和优越的诊断性能。
[0062]
在一个方面,令人惊奇地通过提供一种通过使用马昔瑞林诊断儿科患者中生长激素缺乏症的筛选方法解决了本发明的目的,所述方法包括:
[0063]
(a)提供一个至五个血液样品,其是在施用有效诱导生长激素分泌的量的马昔瑞林之后约15至约100分钟的范围内从受试者采集的;
[0064]
(b)测量步骤(a)中提供的每个血液样品的生长激素水平;
[0065]
(c)将在步骤(b)中获得的测量的生长激素水平与单个阈值进行比较,其中所述单个阈值为10.0ng/ml或更高;
[0066]
(d)确定在步骤(b)中获得的血液样品中其最高生长激素水平低于所述单个阈值的受试者患有生长激素缺乏症,和确定在步骤(b)中获得的血液样品的其最高生长激素水平不低于所述单个阈值的受试者未患有生长激素缺乏症。
[0067]
因此,一个至五个血液样品是在施用有效诱导生长激素分泌的量的马昔瑞林之后不早于约15分钟且施用有效诱导生长激素分泌的量的马昔瑞林之后不迟于约100分钟从受试者采集的。
[0068]
例如,如果血液样品中的单个生长激素水平不低于单个阈值,则确定受试者未患有生长激素缺乏症。或者,如果所有血液样品中的生长激素水平低于单个阈值,则确定受试者患有生长激素缺乏症。
[0069]
在一个优选的实施方案中,通过使用马昔瑞林诊断儿科患者中生长激素缺乏症的筛选方法是通过使用马昔瑞林诊断儿科患者中生长激素缺乏症的体外筛选方法。
[0070]
在一个优选的实施方案中,生长激素的单个阈值在约10.0-约25.0ng/ml,优选约10.2-约20.0ng/ml,进一步优选约12.0-约19.0ng/ml,进一步优选约14.0-约18.0ng/ml,更优选约16.0-约18.0ng/ml,最优选约17.0-约18.0ng/ml的范围内。
[0071]
在一个优选的实施方案中,在步骤(a)中提供一至四个血液样品,优选地其中在步骤(a)中提供一至三个血液样品,更优选地其中在步骤(a)中提供两个或三个血液样品。如上所述,如果提供多于一个血液样品,则这些血液样品在施用有效诱导激素分泌的量的马昔瑞林之后的不同时间点采集。
[0072]
在另一个优选的实施方案中,在步骤(a)中,在施用有效诱导生长激素分泌的量的马昔瑞林之后,在约20至约100分钟的范围内,优选在约25至约100分钟的范围内,更优选在约25至约95分钟的范围内,最优选在约30至约90分钟的范围内从受试者采集血液样品。因此,在施用有效诱导生长激素分泌的量的马昔瑞林之后,例如在不早于约20分钟但不晚于约100分钟,优选不早于约25分钟但不晚于约100分钟,更优选不早于约25分钟但不晚于约95分钟,最优选不早于约30分钟但不晚于约90分钟采集血液样品。
[0073]
在仍然另一个优选的实施方案中,如果提供多于一个血液样品,则以约10至约60分钟的间隔,优选约15至约30分钟的间隔,从所述受试者采集血液样品。或者,可以在主治医师认为合适的任何时间间隔采集血液样品。例如,可以以约5、约10、约15、约20、约25、约30、约35、约40、约45、约50、约45或约60分钟的间隔采集血液样品。
[0074]
在一个进一步优选的实施方案中,在步骤(a)中,血液样品是全血液样品、血清样品或血浆样品。优选地,在步骤(a)中,血液样品是血清样品或血浆样品。如果采集多于一个血液样品,则两个或更多个血液样品来自同一类型,并且因此,这些血液样品是全血液样品、血清样品或血浆样品。最优选地,血液样品是血清样品。
[0075]
在一个进一步优选的实施方案中,在步骤(a)中,每kg受试者体重施用约0.8mg至约1.2mg的马昔瑞林,优选地其中在步骤(a)中,每kg受试者体重施用约1.0mg的马昔瑞林。典型地,马昔瑞林的有效量可以为在低端点(low-end)每kg受试者体重约0.8至约0.9mg的范围内,在高端点每kg受试者体重约1.0、约1.1至约1.2mg,或在由低端点量中的任一个和高端点量中的任一个所限定的范围内,例如,约0.9至约1.1mg/kg体重。马昔瑞林的有效量也可以是单个值,例如,约0.8、约0.9、约1.0、约1.1或约1.2mg/kg体重。体重(以kg记录)可以优选四舍五入为最接近的整数。最优选地,在步骤(a)中,每kg受试者体重施用约1.0mg的马昔瑞林。
[0076]
例如,一个马昔瑞林单位剂量由1817.2mg用于制备水中的口服混悬液的组合物组成。通常,所制备的混悬液含有0.5mg的马昔瑞林/ml混悬液。将体重调节的等份重构混悬液施用于儿科受试者,产生儿童剂量1.0mg/kg体重。所述单位剂量定义为以100%含量的游离碱计的马昔瑞林。所述单位剂量内的马昔瑞林游离碱或其游离碱等效物的质量根据含量调节。
[0077]
在优选的实施方案中,在步骤(a)中,马昔瑞林以包含呈合适的药用盐的马昔瑞林的组合物施用,其中优选地,合适的药用盐选自马昔瑞林乙酸盐、马昔瑞林三氟乙酸盐或其组合。
[0078]
在一个进一步优选的实施方案中,在步骤(a)中,马昔瑞林的施用是口服施用。
[0079]
如果马昔瑞林的施用是口服施用,则马昔瑞林可以制备为口服混悬液。混悬液可以在制备口服混悬液之后约90分钟内,优选约60分钟内,更优选约30分钟内施用。优选地,口服混悬液的饮用不超过约1分钟的时间段,优选不超过约30秒的时间段。
[0080]
在一个进一步优选的实施方案中,在施用马昔瑞林之前,受试者已经禁食约10小时,优选约9小时,更优选约8小时。进一步优选地,在步骤(a)中,受试者在施用马昔瑞林之后禁食约100分钟,这意味着在步骤(a)中,受试者可以在施用马昔瑞林之后约100分钟、约95分钟或约90分钟期间禁食。
[0081]
在一个进一步优选的实施方案中,在步骤(a)中,提供一个血液样品,其在施用马昔瑞林之后约60
±
30分钟从受试者采集。一个血液样品可以可选地在施用马昔瑞林之后在约30
±
10、约40
±
10、约45
±
10、约50
±
10、约60
±
10、约70
±
10、约80
±
10、约90
±
10或约100
±
10分钟从所述受试者采集。一个血液样品可以在施用马昔瑞林之后约15至约100分钟范围内被主治医师认为是合适的任何时间点采集。
[0082]
在另一个进一步优选的实施方案中,在步骤(a)中,提供两个血液样品,其在施用马昔瑞林之后约30
±
10分钟和约45
±
10分钟从受试者采集。两个血液样品可以可选地在施用马昔瑞林之后在约20
±
10、约30
±
10、约40
±
10、约45
±
10、约50
±
10、约60
±
10、约70
±
10、约80
±
10、约90
±
10或约100
±
10分钟从受试者采集。两个血液样品可以在施用马昔瑞林之后约15至约100分钟范围内被主治医师认为是合适的任何时间点采集。
[0083]
在另一个优选的实施方案中,在步骤(a)中,提供两个血液样品,其在施用马昔瑞林之后约30
±
10分钟和约60
±
10分钟从受试者采集。
[0084]
在另一个优选的实施方案中,其中在步骤(a)中,提供三个血液样品,其在施用马昔瑞林之后约30
±
10分钟、约45
±
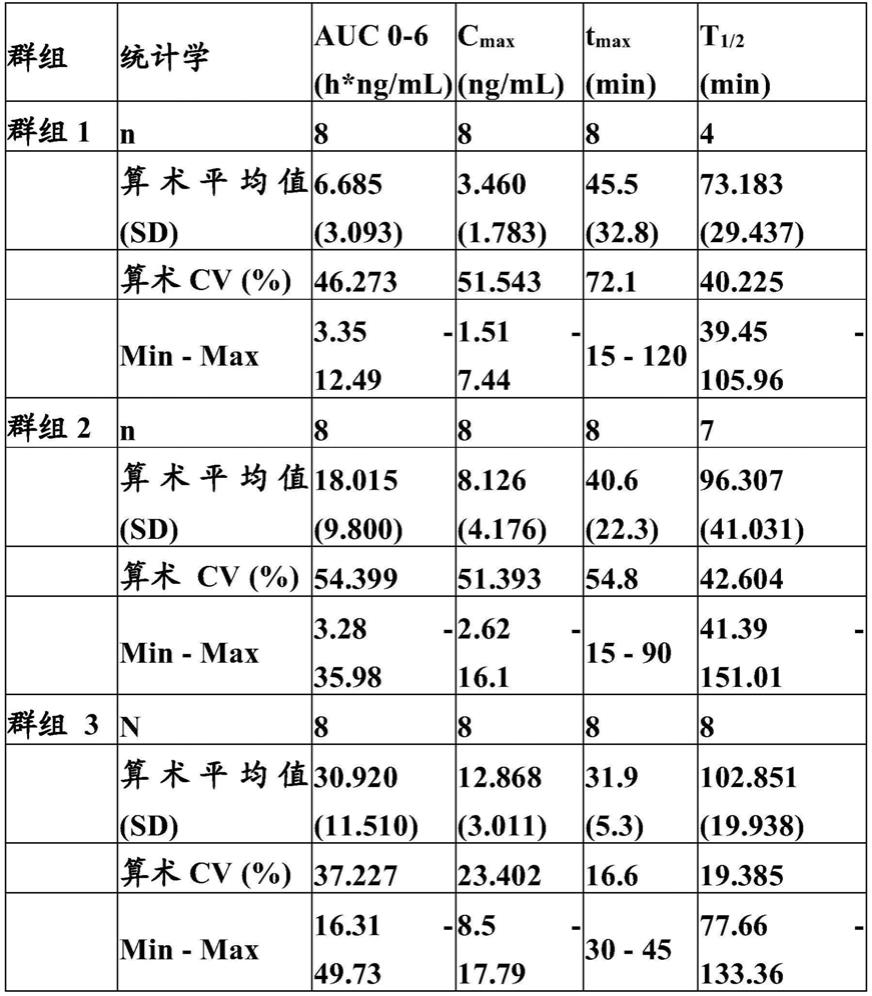
10分钟和约60
±
10分钟从受试者采集,或其中在步骤(a)中提供三个血液样品,其在施用马昔瑞林之后约30
±
10分钟、约45
±
10分钟和约90
±
10分钟从受试者采集,或其中在步骤(a)中提供三个血液样品,其在施用马昔瑞林之后约30
±
10分钟、约60
±
10分钟和约90
±
10分钟从受试者采集。三个血液样品可以可选地在施用马昔瑞林之后在约20
±
10、约30
±
10、约40
±
10、约45
±
10、约50
±
10、约60
±
10、约70
±
10、约80
±
10、约90
±
10或约100
±
10分钟从受试者采集。三个血液样品可以在施用马昔瑞林之后约15至约100分钟范围内被主治医师认为是合适的任何时间点采集。
[0085]
如果在步骤(a)中提供超过三个血液样品,则这些血液样品可以在施用马昔瑞林之后约15至约100分钟范围内被主治医师认为是合适的的任何时间点采集。例如,合适的时间点为在施用马昔瑞林之后约20
±
10、约30
±
10、约40
±
10、约45
±
10、约50
±
10、约60
±
10、约70
±
10、约80
±
10、约90
±
10或约100
±
10分钟。
[0086]
在一个特别优选的方法中,在步骤(a)中,提供一个至四个、进一步优选一个至三个、更优选两个或三个血液样品,其是在施用马昔瑞林之后在选自约30
±
10分钟、约45
±
10分钟、约60
±
10分钟和约90
±
10分钟的时间从受试者采集的。
[0087]
在一个进一步优选的实施方案中,在步骤(a)中,马昔瑞林以包含马昔瑞林和任选
的其他可药用赋形剂如载体物质的组合物施用。优选地,马昔瑞林以包含马昔瑞林和甜味剂的组合物施用。合适的甜味剂为例如糖精。有利地,发现糖精是马昔瑞林的合适的掩味剂。
[0088]
在一个进一步优选的实施方案中,在步骤(a)中,马昔瑞林以包含约3.5%(w/w)的马昔瑞林(以游离碱计算)、约93.1%(w/w)喷雾干燥的乳糖一水合物、约2.0%(w/w)的交聚维酮a型、约0.1%(w/w)的胶态二氧化硅、约1.0%(w/w)的硬脂酰富马酸钠和约0.3%(w/w)的糖精钠二水合物的组合物施用。
[0089]
在一个进一步优选的实施方案中,受试者是年龄为2岁至小于18岁的人类儿童,优选地,受试者是年龄为2岁至小于17岁的人类儿童,更优选地,受试者是年龄为2岁至小于16岁的人类儿童。
[0090]
在一个进一步优选的实施方案中,所述方法是独立试验,不需要重复,并且不需要为了可靠地诊断儿科患者的生长激素缺乏症的另外的生长激素刺激试验。
[0091]
在一个进一步优选的实施方案中,根据步骤(d)确定所述受试者患有或未患有生长激素缺乏症只是基于单次施用马昔瑞林诱导的生长激素水平。
[0092]
令人惊奇地,已经发现本发明的方法适合作为独立试验,因为不需要为了可靠地诊断儿科患者的ghd的另外的ghst。
[0093]
在另一个方面,通过提供用于诊断儿科患者中生长激素缺乏症的物质马昔瑞林令人惊奇地解决了本发明的目的,其中
[0094]
(a)提供一个至五个血液样品,其是在施用有效诱导生长激素分泌的量的马昔瑞林之后约15至约100分钟的范围内从受试者采集的;
[0095]
(b)测量步骤(a)中提供的每个血液样品的生长激素水平;
[0096]
(c)将在步骤(b)中获得的测量的生长激素水平与单个阈值进行比较,其中所述单个阈值为10.0ng/ml或更高;
[0097]
(d)确定在步骤(b)中获得的血液样品中其最高生长激素水平低于所述单个阈值的受试者患有生长激素缺乏症,和确定在步骤(b)中获得的血液样品的其最高生长激素水平不低于所述单个阈值的受试者未患有生长激素缺乏症。
[0098]
所述一个至五个血液样品是在施用有效诱导生长激素分泌的量的马昔瑞林之后不早于约15分钟且施用有效诱导生长激素分泌的量的马昔瑞林之后不迟于约100分钟从受试者采集的。
[0099]
在一个优选的实施方案中,用于诊断儿科患者中生长激素缺乏症的物质马昔瑞林是用于体外诊断儿科患者中生长激素缺乏症的物质马昔瑞林。
[0100]
在一个优选的实施方案中,生长激素的单个阈值在约10.0-约25.0ng/ml,优选约10.2-约20.0ng/ml,进一步优选约12.0-约19.0ng/ml,进一步优选约14.0-约18.0ng/ml,更优选约16.0-约18.0ng/ml,最优选约17.0-约18.0ng/ml的范围内。
[0101]
在一个优选的实施方案中,在步骤(a)中提供一个至四个血液样品,优选地其中在步骤(a)中提供一个至三个血液样品,更优选地其中在步骤(a)中提供两个或三个血液样品。如果提供多于一个的血液样品,则在施用有效诱导激素分泌的量的马昔瑞林之后的不同时间点采集这些血液样品。
[0102]
在另一个优选的实施方案中,在步骤(a)中,在施用有效诱导生长激素分泌的量的
马昔瑞林之后,在约20至约100分钟的范围内,优选在约25至约100分钟的范围内,更优选在约25至约95分钟的范围内,最优选在约30至约90分钟的范围内从受试者采集血液样品。因此,在施用有效诱导生长激素分泌的量的马昔瑞林之后,例如在不早于约20分钟但不晚于约100分钟,优选不早于约25分钟但不晚于约100分钟,更优选不早于约25分钟但不晚于约95分钟,最优选不早于约30分钟但不晚于约90分钟,采集血液样品。
[0103]
在仍然另一个优选的实施方案中,如果提供多于一个血液样品,则以约10至约60分钟的间隔,优选约15至约30分钟的间隔,从所述受试者采集血液样品。或者,可以在主治医师认为合适的任何时间间隔采集血液样品。例如,可以以约5、约10、约15、约20、约25、约30、约35、约40、约45、约50、约45或约60分钟的间隔采集血液样品。
[0104]
在一个进一步优选的实施方案中,在步骤(a)中,血液样品是全血样品、血清样品或血浆样品。优选地,在步骤(a)中,血液样品是血清样品或血浆样品。如果采集多于一个血液样品,则两个或更多个血液样品来自同一类型,并且因此,这些血液样品是全血样品、血清样品或血浆样品。最优选地,血液样品是血清样品。
[0105]
在一个进一步优选的实施方案中,在步骤(a)中,每kg受试者体重施用约0.8mg至约1.2mg的马昔瑞林,优选地其中在步骤(a)中,每kg受试者体重施用约1.0mg的马昔瑞林。典型地,马昔瑞林的有效量可以为在低端点每kg受试者体重约0.8至约0.9mg的范围内,在高端点每kg受试者体重约1.0、约1.1至约1.2mg,或在由低端点量中的任一个和高端点量中的任一个所限定的范围内,例如,约0.9至约1.1mg/kg体重。马昔瑞林的有效量也可以是单个值,例如,约0.8、约0.9、约1.0、约1.1或约1.2mg/kg体重。体重(以kg记录)可以优选四舍五入为最接近的整数。
[0106]
例如,一个马昔瑞林单位剂量由1817.2mg用于制备水中的口服混悬液的组合物组成。通常,所制备的混悬液含有0.5mg的马昔瑞林/ml混悬液。将体重调节的等份重构混悬液施用于儿科受试者,产生儿童剂量1.0mg/kg体重。所述单位剂量定义为以100%含量的游离碱计的马昔瑞林。所述单位剂量内的马昔瑞林游离碱或其游离碱等效物的质量根据含量调节。
[0107]
在一个优选的实施方案中,在步骤(a)中,马昔瑞林以包含呈合适的药用盐的马昔瑞林的组合物施用,其中优选地,合适的药用盐选自马昔瑞林乙酸盐、马昔瑞林三氟乙酸盐或其组合。
[0108]
在一个进一步优选的实施方案中,在步骤(a)中,马昔瑞林的施用是口服施用。
[0109]
如果马昔瑞林的施用是口服施用,则马昔瑞林可以制备为口服混悬液。混悬液可以在制备口服混悬液之后约90分钟内,优选约60分钟内,更优选约30分钟内施用。优选地,口服混悬液的饮用不超过约1分钟的时间段,优选不超过约30秒的时间段。
[0110]
在一个进一步优选的实施方案中,在施用马昔瑞林之前,受试者已经禁食约10小时,优选约9小时,更优选约8小时。进一步优选地,在步骤(a)中,受试者在施用马昔瑞林之后禁食约100分钟,这意味着在步骤(a)中,受试者可以在施用马昔瑞林之后约100分钟、约95分钟或约90分钟期间禁食。
[0111]
在一个进一步优选的实施方案中,在步骤(a)中,提供一个血液样品,其在施用马昔瑞林之后约60
±
30分钟从受试者采集。一个血液样品可以可选地在施用马昔瑞林之后在约30
±
10、约40
±
10、约45
±
10、约50
±
10、约60
±
10、约70
±
10、约80
±
10、约90
±
10、约100
±
10分钟从受试者采集。一个血液样品可以在施用马昔瑞林之后约15至约100分钟范围内被主治医师认为是合适的的任何时间点采集。
[0112]
在另一个进一步优选的实施方案中,在步骤(a)中,提供两个血液样品,其在施用马昔瑞林之后约30
±
10分钟和约45
±
10分钟从受试者采集。两个血液样品可以可选地在施用马昔瑞林之后在约20
±
10、约30
±
10、约40
±
10、约45
±
10、约50
±
10、约60
±
10、约70
±
10、约80
±
10、约90
±
10或约100
±
10分钟从受试者采集。两个血液样品可以在施用马昔瑞林之后约15至约100分钟范围内被主治医师认为是合适的的任何时间点采集。
[0113]
在另一个优选的实施方案中,在步骤(a)中,提供两个血液样品,其在施用马昔瑞林之后约30
±
10分钟和约60
±
10分钟从受试者采集。
[0114]
在另一个优选的实施方案中,其中在步骤(a)中,提供三个血液样品,其在施用马昔瑞林之后约30
±
10分钟、约45
±
10分钟和约60
±
10分钟从受试者采集,或其中在步骤(a)中提供三个血液样品,其在施用马昔瑞林之后约30
±
10分钟、约45
±
10分钟和约90
±
10分钟从受试者采集,或其中在步骤(a)中提供三个血液样品,其在施用马昔瑞林之后约30
±
10分钟、约60
±
10分钟和约90
±
10分钟从受试者采集。三个血液样品可以可选地在施用马昔瑞林之后在约20
±
10、约30
±
10、约40
±
10、约45
±
10、约50
±
10、约60
±
10、约70
±
10、约80
±
10、约90
±
10或约100
±
10分钟从受试者采集。三个血液样品可以在施用马昔瑞林之后约15至约100分钟范围内被主治医师认为是合适的的任何时间点采集。
[0115]
如果提供多于三个血液样品,则这些血液样品可以在施用马昔瑞林之后约15至约100分钟范围内被主治医师认为是合适的的任何时间点采集。例如,合适的时间点为在施用马昔瑞林之后约20
±
10、约30
±
10、约40
±
10、约45
±
10、约50
±
10、约60
±
10、约70
±
10、约80
±
10、约90
±
10或约100
±
10分钟。
[0116]
在一个特别优选的实施方案中,在步骤(a)中,提供一个至四个、进一步优选一个至三个、更优选两个或三个血液样品,其是在施用马昔瑞林之后在选自约30
±
10分钟、约45
±
10分钟、约60
±
10分钟和约90
±
10分钟的时间从受试者采集的。
[0117]
在一个进一步优选的实施方案中,在步骤(a)中,马昔瑞林以包含马昔瑞林和任选的其他可药用赋形剂如载体物质的组合物施用。优选地,马昔瑞林以包含马昔瑞林和甜味剂的组合物施用。合适的甜味剂为例如糖精。有利地,发现糖精是马昔瑞林的合适的掩味剂。
[0118]
在一个进一步优选的实施方案中,在步骤(a)中,马昔瑞林以包含约3.5%(w/w)的马昔瑞林(以游离碱计算)、约93.1%(w/w)喷雾干燥的乳糖一水合物、约2.0%(w/w)的交聚维酮a型、约0.1%(w/w)的胶态二氧化硅、约1.0%(w/w)的硬脂酰富马酸钠和约0.3%(w/w)的糖精钠二水合物的组合物施用。
[0119]
在一个进一步优选的实施方案中,受试者是年龄为2岁至小于18岁的人类儿童,优选地,受试者是年龄为2岁至小于17岁的人类儿童,更优选地,受试者是年龄为2岁至小于16岁的人类儿童。
[0120]
在一个进一步优选的实施方案中,所述物质用于独立试验,不需要重复,并且不需要为了可靠地诊断儿科患者的生长激素缺乏症的另外的生长激素刺激试验。
[0121]
在一个进一步优选的实施方案中,根据步骤(d)确定受试者患有或未患有生长激素缺乏症仅仅基于通过单次施用马昔瑞林诱导的生长激素水平。
[0122]
令人惊奇地,已经发现本发明的方法适合作为独立试验,因为不需要为了可靠地诊断儿科患者的ghd的另外的ghst。
[0123]
在一个进一步的方面,令人惊讶地通过提供一种通过使用马昔瑞林诊断儿科患者中生长激素缺乏症的筛选方法实现了本发明的目的,所述方法包括:
[0124]
(a)提供至少一个血液样品,其是在施用有效诱导生长激素分泌的量的马昔瑞林之后约15至约100分钟的范围内从受试者采集的;
[0125]
(b)测量每个血液样品的生长激素水平;
[0126]
(c)比较每个测量的生长激素水平与单个阈值;
[0127]
(d)基于比较在所述至少一个血液样品中在步骤(b)中测量的生长激素水平与所述单个阈值,诊断受试者是否患有生长激素缺乏症;
[0128]
其中确定所述受试者患有或未患有生长激素缺乏症只是基于施用单次马昔瑞林诱导的生长激素水平。
[0129]
在一个优选的实施方案中,通过使用马昔瑞林诊断儿科患者中生长激素缺乏症的筛选方法是通过使用马昔瑞林诊断儿科患者中生长激素缺乏症的体外筛选方法。
[0130]
在一个优选的方法中,在步骤(a)中,提供一个至四个、进一步优选一个至三个、更优选两个或三个血液样品,其是在施用马昔瑞林之后在选自约30
±
10分钟、约45
±
10分钟、约60
±
10分钟和约90
±
10分钟的时间从受试者采集的。
[0131]
在一个优选的实施方案中,在步骤(d)中,确定在步骤(b)中测量的其最高生长激素水平低于所述单个阈值的受试者患有生长激素缺乏症,和确定在步骤(b)中测量的其最高生长激素水平不低于所述单个阈值的受试者未患有生长激素缺乏症。
[0132]
在另一个优选的实施方案中,生长激素的单个阈值在约10.0-约25.0ng/ml,优选约10.2-约20.0ng/ml,进一步优选约12.0-约19.0ng/ml,进一步优选约14.0-约18.0ng/ml,更优选约16.0-约18.0ng/ml,最优选约17.0-约18.0ng/ml的范围内。
[0133]
在仍然进一步优选的实施方案中,在步骤(a)中,每kg受试者体重施用约0.8mg至约1.2mg的马昔瑞林,优选地其中在步骤(a)中,每kg受试者体重施用约1.0mg的马昔瑞林。
[0134]
在一个进一步优选的实施方案中,受试者是年龄为2岁至小于18岁的人类儿童,优选地,受试者是年龄为2岁至小于17岁的人类儿童,更优选地,受试者是年龄为2岁至小于16岁的人类儿童。
[0135]
与目前由医学专业人员使用的标准两个-试验形式相比,本发明方法的一个主要特征是单个刺激试验形式。与具有至少间隔一天进行且包括多达8-12次抽血的两个独立试验不同,本发明的新方法只需要一个试验(one test),并且仅需要少至1-5次、优选2-4次抽血,以便在检测生长激素缺乏症的准确性、特异性和灵敏性方面获得可靠的诊断性能,从而极大降低了试验负担和对被试验儿童的潜在危害。有利地,这些血液样品可以在短时间内收集,例如在施用马昔瑞林之后总共约90分钟的时间内,以约15至约30分钟的间隔收集。
[0136]
令人惊奇的,本发明的方法通过使用较高的阈值获得了诊断生长激素缺乏症的显著改善。通常,当试验成人患者的ghd时,使用约2-3ng/ml的单个阈值,而当试验儿科患者的ghd时,使用低于10ng/ml的单个阈值。本发明人出乎意料地发现,当使用10.0ng/ml或更高的较高单个阈值时,可以实现儿科患者的更好的诊断性能。例如,已经发现约16.0-19.0ng/ml,优选约17.0-18.0ng/ml的单个阈值非常有效地指示本发明独立方法中的ghd。
[0137]
另外,本发明的方法通过使用较高的马昔瑞林剂量获得了诊断生长激素缺乏症的显著改善。尽管目前实践中使用的马昔瑞林的常规剂量,特别是当对成人患者进行ghd试验时,为0.5mg/kg患者体重,本发明人出乎意料地发现,当在儿科患者的生长激素刺激试验中使用较高剂量的马昔瑞林时,可以获得更好的诊断性能。例如,已经发现约0.8-1.2mg/kg体重,优选约1.0mg/kg体重的马昔瑞林剂量非常有效地指示本发明的一个试验(one-test)方法中的ghd。
[0138]
本发明提供用于测量人类儿童中生长激素水平的方法,包括在向儿童单次口服施用马昔瑞林之后,评估人类儿童垂体相关的gh缺乏的方法:
[0139]-作为独立试验(仅需要一个试验方法和单个gh刺激),
[0140]-在施用马昔瑞林之后,例如总共约90分钟的时间段内,以约15至约30分钟的间隔,收集两个至四个血液样品
[0141]-gh截止点在约10.0ng/ml或更高,优选约10.0ng/ml至约25.0ng/ml,更优选约10.2ng/ml至约20ng/ml,最优选约17.0至大约18.0ng/ml的范围内。
[0142]
提供以下实施例仅作为示例,而不是限制。本领域技术人员将容易认识到可以改变或修饰各种非关键参数以得到基本上相同或相似的结果。
实施例
[0143]
儿童生长激素缺乏症(ghd)是罕见的、病因学上不同的导致生长障碍和身材矮小的病症。ghd的诊断需要对两种不同的生长激素刺激试验(ghst)的响应不足。马昔瑞林乙酸盐,一种有效的口服施用的生长激素(gh)促分泌素,被fda和ema批准用于诊断成人的ghd(aghd)。本研究(aezs-130-p01)设计用于研究马昔瑞林乙酸盐作为疑似ghd的儿童的诊断试验。
[0144]
这是一个开放标记、分组比较、剂量递增试验,用于研究单剂量0.25、0.5和1.0mg/kg口服马昔瑞林盐酸盐在具有疑似ghd的儿科受试者中的安全性、耐受性、药代动力学和药效学。在两个标准ghst之间施用马昔瑞林ghst,按照当地临床实践进行,试验之间的恢复期为7-28天。在剂量给药前(
±
15分钟)和在摄入马昔瑞林乙酸盐之后的15、30、45、60、90、120和360分钟收集血液样品。
[0145]
总之,24名儿科受试者(每个群组8名[c1,c2,c3])被包括在药代动力学/药效学(pk/pd)分析中。在c1和c2中观察了五名男性和3名女性,在c3中观察了7名男性和1名女性。在所有三个群组中,至少3名受试者代表tanner i或ii期。所有24名受试者(100%)都是白人,具有9.8、9.0和10.5岁的中值年龄(范围4-15岁),且在筛选时16.1kg/m2(12.4-21.4kg/m2)的中值体重指数。总之,报道了88个不良事件,许多与标准ghst有关;没有一个被认为与马昔瑞林试验有关。主要在30-45分钟之间观察到马昔瑞林的最大血浆浓度。c1、c2和c3的平均c
max
值分别是3.46、8.13和12.87ng/ml。auc随剂量增加;平均auc
0-6
值为6.69、18.02和30.92h*ng/ml。平均消除半衰期分别为1.22、1.61和1.71小时。所有三个群组的pk和pd曲线是可比较的,峰值gh水平主要在摄入马昔瑞林之后30-60分钟内观察到。
[0146]
在所有给药群组中,马昔瑞林乙酸盐都是安全和良好耐受的。儿童和青少年中马昔瑞林的c
max
和auc的剂量依赖性增加与成年人受试者的数据密切相关。也获得了强的剂量比例的gh响应。pd结果显示所有剂量组中的gh反应是相当的,在较高的马昔瑞林剂量下,有
轻微向较早的t
max
的转变。
[0147]
而且,马昔瑞林ghst的结果与两个标准ghst的结果以及由主要研究人员评估的最终诊断结果显示了令人惊奇地高度一致性。在c3中,在所有8个患者中明显地刺激了gh分泌。最后,作为单一试验应用的马昔瑞林ghst的结果显示与两个sghst组合的结果以及8名受试者中7名的pi评估一致。
[0148]
实施例1:一种用于诊断cghd的含马昔瑞林的组合物
[0149]
含马昔瑞林的组合物包括如表1中所列的以下成分。
[0150]
表1:每单位剂量的组合物
[0151]
组合物单位量百分比量马昔瑞林(含量=100%)63.6mg3.5%乳糖一水合物,喷雾干燥的1691.8mg93.1%交聚维酮,a型36.3mg2.0%胶体二氧化硅1.8mg0.1%硬脂酰醇富马酸钠18.2mg1.0%糖精钠,二水合物5.5mg0.3%总计1817.2mg100.0%
[0152]
一个马昔瑞林单位剂量由1817.2mg用于制备水中的口服混悬液的组合物组成。通常,所制备的混悬液含有0.5mg的马昔瑞林/ml混悬液。
[0153]
将体重调节的等份重构混悬液施用于儿科受试者,得到剂量1.0mg/kg儿童体重。应当注意,在成人中,施用体重调节的等份重构混悬液,得到剂量0.5mg/kg成人受试者体重。
[0154]
所述单位剂量被定义为以100%含量的游离碱计的马昔瑞林。根据含量调节所述单位剂量内的马昔瑞林游离碱或其游离碱等效物的质量。
[0155]
马昔瑞林可以呈合适的药用盐包括在所述单位剂量中。合适的药用盐的实例是乙酸盐和三氟乙酸盐。
[0156]
所述单位剂量可以被填充到合适的容器中,用于ghd试验的易获得性。合适容器的实例是由玻璃或塑料制成的合适尺寸的小袋或容器。
[0157]
对于60kg的受试者,容器是由聚乙烯层压铝箔制成的小袋,具有的含马昔瑞林的组合物包含63.6mg的马昔瑞林、1691.8mg喷雾干燥的乳糖一水合物、36.3mg的交聚维酮a型、1.8mg的胶体二氧化硅、18.2mg的硬脂酰富马酸钠和5.5mg的糖精钠二水合物。当在120ml的水中重构时,2ml提供1.0mg的马昔瑞林。
[0158]
实施例2:糖精在含有马昔瑞林的组合物中掩蔽不良味道的用途
[0159]
在多中心、随机、双向、交叉研究中,100名具有证实的成年人生长激素缺乏症(aghd)的受试者接受ghrh l-arg和马昔瑞林作为ghst,以确定马昔瑞林对aghd的诊断功效。
[0160]
该研究分两部分进行。在第一部分中,使用实施例1中描述的含马昔瑞林的组合物,且剂量为0.5mg/kg,但是没有使用糖精,且52名受试者中的12个(21%)报告了轻度至中度的不良味道。
[0161]
在研究停止期间,发现糖精是合适的掩味剂,尽管苦味仍然没有被完全掩蔽。在研
究的第二部分中,使用实施例1中描述的含马昔瑞林的组合物(含有糖精),并且48名试验受试者中仅1名(2%)报告轻微强度的不良味道。
[0162]
实施例3:作为诊断试验的马昔瑞林的药代动力学、药效学以及探索性试验特征
[0163]
研究aezs-130-p01是一个开放标记、分组比较、剂量递增试验,以研究在患有疑似ghd的儿科患者中单次口服施用0.25mg/kg、0.5mg/kg和1mg/kg的马昔瑞林乙酸盐的安全性、耐受性、药代动力学(pk)和药效学(pd)。
[0164]
目标定义如下:
[0165]
主要目标:
[0166]
·
为了研究在疑似ghd的儿科患者中递增单次口服剂量的马昔瑞林之后,马昔瑞林乙酸盐的安全性和耐受性。
[0167]
次要目标:
[0168]
·
为了研究在患有疑似ghd的儿科患者中马昔瑞林乙酸盐的pk,
[0169]
·
为了研究如通过在患有疑似ghd的儿科患者中生长激素(gh)释放测量的马昔瑞林乙酸盐的pd,
[0170]
·
为了研究在患有疑似ghd的儿科患者中单次口服剂量施用马昔瑞林乙酸盐之后的pk/pd关系。
[0171]
方法:
[0172]
在中心实验室中分析马昔瑞林的血浆浓度和gh的血清浓度。
[0173]
马昔瑞林的血浆浓度:在德国prolytic gmbh的中心实验室,使用检测限为0.2ng/ml的验证的液相色谱-质谱(lcms/ms)方法(franz,2005)进行血浆样品中马昔瑞林浓度的分析。
[0174]
初步药物动力学(pk)通过采样期间马昔瑞林血浆浓度的最大测量浓度时间的时间(t
max
)和最大浓度(c
max
)确定。
[0175]
gh血清浓度:在中心实验室,通过验证的免疫化学发光测定(ids-isys人生长激素(hgh),immunodiagnostic systems ltd[uk])(manolopoulou等,2012)进行血清样品gh浓度的分析。将该测定标准化为重组生长激素校准标准who98/574,并且符合如clemmons(clemmons等,2011)总结的关于测定标准化的推荐。
[0176]
用于gh应用的分析实验室是:central laboratory synevokrakusa str.28,93-515poland.定量的下限<0.05ng/ml。
[0177]
患者数量
[0178]
总之,将马昔瑞林以单次口服剂量施用至24名患有疑似ghd的儿科患者,其中每个剂量组8名患者。在这8名患者中,每个剂量组中至少3名患者分别处于青春前期(tanner i期)和青春期(tanner ii-iv期)。
[0179]
患者入选的主要标准:受试者必须满足所有以下标准才能有资格进入试验:
[0180]
1.2至小于18岁的男性或女性儿科受试者;
[0181]
2.基于生长学(auxological)和临床标准,疑似ghd;
[0182]
3.进行刺激性生长激素刺激试验(ghst)的指标。
[0183]
在ghst之前具有性类固醇引发(priming)(这是标准诊断程序的一部分)的受试者也必须具有对于马昔瑞林ghst的性类固醇引发。
[0184]
研究的药用产品(imp)马昔瑞林
[0185]
单次使用的铝小袋(同义词:小袋)含有63.6mg的马昔瑞林,当溶解在120ml水中时,其提供0.5mg/ml的马昔瑞林。
[0186]
试验参与者的连续的群组接受递增的单次口服剂量的马昔瑞林:即,第1组(c1)0.25mg/kg体重,第2组(c2)0.5mg/kg体重,和第3组(c3)1mg/kg体重。
[0187]
为了测定马昔瑞林pk/pd,在给药前、施用马昔瑞林之后15、30、45、60、90、120和360分钟采集血液样品。
[0188]
作为试验,在马昔瑞林ghst当天,向患者施用单次口服剂量的马昔瑞林乙酸盐。
[0189]
马昔瑞林ghst制剂
[0190]
马昔瑞林口服混悬液由试验人员制备,并根据以下说明(步骤#1-步骤#5)给药,这里考虑作为实例的群组c3的剂量(即1.0mg/kg):
[0191]
1.给患者称重,并确定所需小袋/小药袋的数量(患者需要一个小袋)。体重(以kg记录)将四舍五入到最接近的整数;
[0192]
2.在合适的透明玻璃或聚丙烯容器中,将小袋的全部内容物溶解在120ml的水中(即,当可行时,一个小袋溶解在120ml中,两个小袋溶解在240ml中),并轻轻搅拌至少3分钟(将残留少量未溶解的颗粒);
[0193]
3.基于1.0mg/kg的马昔瑞林剂量,确定与患者体重相对应需要的混悬液体积,即需要的混悬液体积为2ml/kg(例如,需要1.0mg/kg马昔瑞林剂量的30kg患者将需要60ml制备的混悬液);
[0194]
4.通过使用带刻度的注射器测量患者需要的体积,并将其转移到饮用玻璃杯中(应当用口服注射器施用低于20ml的体积,以使不完全排空损失的风险最小化;参见下文的说明);
[0195]
5.混悬液必须在制备之后30分钟内使用。
[0196]
在ghst之前禁食
[0197]
患者在开始之前和整个马昔瑞林刺激试验的采样期间必须禁食8小时。
[0198]
施用
[0199]
在试验人员的监督下进行马昔瑞林口服混悬液的施用。建议患者饮用-在不超过30秒期间—如上给出的特定剂量群组的步骤#4中制备的玻璃容器的全部内容物。
[0200]
血液采集
[0201]
在以下时间点收集血液样品:给药前(采样时间窗: /-15分钟),然后在施用马昔瑞林之后15、30、45、60、90、120分钟( /-5分钟窗)和360分钟( /-10分钟窗)。在中心实验室中分析gh的血清浓度和马昔瑞林的血浆浓度。
[0202]
在已经完成第一个sghst之后,进行研究的马昔瑞林ghst。在ghst之间引入至少1周且最多4周的恢复期,以避免后续ghst之间的延续效应或干扰,并提供足够的随访期,以观察对先前使用的刺激剂的可能的药物相关不良事件。
[0203]
研究p01中使用的标准ghst
[0204]
根据当地实践,必须在患者中进行两个标准生长激素刺激试验(sghst)。sghst试剂被认为是“背景”而不是imps。
[0205]
对于sghsts,接受以下药理学试剂:胰岛素(胰岛素耐受试验(itt))、精氨酸/生长
激素释放激素(ghrh)、可乐定、胰高血糖素、左旋多巴。
[0206]
在sghst当天,肌内(i.m.)、静脉内(i.v.)、皮下(s.c.)或经口(取决于制剂)施用单剂量的sghst剂。批号现场记录在患者病历和“标准ghst患者责任日志”中。
[0207]
评估标准
[0208]
试验终点
[0209]
安全性和耐受性
[0210]
·
患者耐受性(包括味道的可接受性和对于睡眠、食欲和消化系统症状的影响)、不良事件(ae);
[0211]
·
与安全性相关的实验室参数变化的测定;
[0212]
·
对生命参数(脉搏率、血压、ecg)的影响。
[0213]
药代动力学
[0214]
·
马昔瑞林的浓度-时间曲线;
[0215]
·
目标参数:auc、c
max
、t
max
、t
1/2
.
[0216]
药效学
[0217]
·
gh的浓度-时间曲线;
[0218]
·
目标参数:c
max
、t
max
;
[0219]
·
初步pk/pd:马昔瑞林的t
max vs.gh的t
max
;马昔瑞林的c
max vs.gh的c
max
。
[0220]
其它
[0221]
·
在患有疑似ghd的儿科患者中用于诊断目的推荐剂量的建立;
[0222]
·
探索用于后续试验的合适的gh截止点,以建立儿科患者中ghd的诊断。
[0223]
统计方法:
[0224]
所有统计分析都被认为实际上是探索性的。使用sas版本9.3或更高分析数据集。
[0225]
通常,定量变量的汇总统计量(n,算术平均值,标准偏差,中值,最小值和最大值)和定性数据的频率表由剂量组呈现。
[0226]
马昔瑞林的pk:针对pk分析组(pks)分析pk参数,并通过n(测量次数)、算术平均值、标准偏差和变异系数(cv)、中值、最小值、最大值以及另外(t
max
除外)通过几何平均值、几何标准偏差和几何cv进行总结。对于t
max
,另外给出了频率计数以及中值、最小值和最大值。
[0227]
马昔瑞林pd:不考虑pk数据的可用性,针对pd分析组(pds)分析gh浓度数据。将gh峰浓度与临床诊断方法的结果(ghd的诊断证实或未证实)相关联。
[0228]
pk/pd分析:将单独患者的马昔瑞林的血浆浓度与相同时间点的相应gh浓度以及临床诊断程序的结果(ghd的诊断证实或未证实)相关联。
[0229]
结果和结论:
[0230]
在筛选的总共27名患者中,24名患者施用了马昔瑞林试验,三个给药群组(c1,c2和c3)中的每个群组有8名患者。
[0231]
因此,安全性群体(saf)以及pk分析组(pks)、pd分析组(pds)和pk/pd组由24名患者组成。
[0232]
基线特征:
[0233]
总共,17名(70.8%)患者为男性,7名(29.2%)为女性,100%为白种人来源。在筛
选时,所有三个给药群组的中值参数是年龄10.5岁(范围:4-15岁)、身高123.35cm(范围:46.0-152.5cm)、体重25.5kg(范围:12-43kg)和体重指数(bmi)16.1kg/m2(范围:12.4-21.4kg/m2)。
[0234]
tanner状态分布如下:在c1以及c3中,4名患者显示tanner i,4名患者显示tanner ii,在c2中,5名患者显示tanner i和3名患者显示tanner ii。通过肌内(i.m.)施用睾酮贮库制剂,在c3中的两名男性患者中应用性类固醇引发。
[0235]
关于基线病史,仅对于c2中的两名患者,报道了其它垂体轴缺乏(即甲状腺缺乏)。作为标准“诊断后处理”的一部分,将igf-1和igf-bp3值记录在电子病例报告表(ecrf)中,如根据当地诊断标准收集的。
[0236]
针对c1中的7名患者和针对c2和c3中各自8名患者,给出igf-1值,c1中的中值为88.00μg/l(sd68.72),c2中的中值为100.00μg/l(sd97.90),c3中的中值为119.50μg/l(sd68.88)。一个c3患者可获得igf-bp3值。
[0237]
骨龄以中值显示,为102.2个月的值(范围:24-156个月)。作为生长学(auxology)参数的一部分,身高sds为中值-2.35(范围-3.2-1.7),bmi sds-0.60(范围-2.1-2.0),年高度速度sds-1.50(范围:-3.3-0.5)。
[0238]
sghsts:总之,将itt施用于22名患者(即,在第1次就诊(v1)时施用于5名患者(20.8%),并在第3次就诊(v3)时施用于17名患者(70.8%)),在v1时将精氨酸施用于8名患者(33.3%),以及在v1将可乐定施用于16名患者(即在v1,11名患者(45.8%)和在v3,5名患者(20.8%)。仅向一名患者施用胰高血糖素,且根本没有施用左旋多巴。
[0239]
在所有三个群组中,马昔瑞林的治疗依从性为100%。
[0240]
药代动力学和药效学结果:
[0241]
血浆浓度数据
[0242]
通常,马昔瑞林的血浆浓度显示剂量依赖性增加(图1),具有高的个体间变化性。在施用马昔瑞林之后,血浆浓度显示快速增加,在0.25和2小时之间观察到最大水平。在施用之后6小时的最后采样点,血浆浓度剧烈降低。
[0243]
药代动力学:
[0244]
通常,马昔瑞林的血浆浓度显示剂量依赖性增加(图1),具有高的个体间变化性。在施用马昔瑞林之后,血浆浓度显示快速增加,在0.25和2小时之间观察到最大水平。在施用之后6小时的最后采样点,血浆浓度剧烈降低。
[0245]
马昔瑞林的auc和c
max
显示剂量依赖性增加,其中算术平均值auc0-6在c1中为6.69ng/ml,c2中为18.02ng/ml,c3中为30.92ng/ml,算术平均c
max
在c1中为3.46ng/ml,c2中为8.13ng/ml,和c3中为12.87ng/ml(表2)。
[0246]
所有三组的平均t
max
相当,算术平均值c1中为45.5分钟,c2中为40.6分钟,c3中为31.9分钟。平均t
1/2
显示随剂量增加而稍微增加,即c1中为73.18分钟,c2中为96.31分钟,c3中为102.85分钟。
[0247]
表2:主要药代动力学参数的总结(pk组,n=24)
[0248][0249]
药效学:
[0250]
如图2所示,在施用马昔瑞林之后,gh浓度增加,具有随剂量递增而具有值更高的倾向。预期在疑似患有ghd的观察群组中有大的患者间变化性。
[0251]
在施用马昔瑞林之后,c1中观察到峰gh水平在0.5-1小时内(52.5分钟的平均t
max
(sd11.3)),c2中在0.25-1小时内(平均t
max 37.5分钟(sd13.9),以及c3中在0.5-0.75小时内(平均t
max
37.5分钟(sd8.0))(参见表3)。
[0252]
表3:药效学参数的总结(pk/pd组,n=24)
[0253][0254]
gh截止点的探索性分析:
[0255]
基于ghst结果和研究者的评估,比较通过ghd诊断的gh峰值。列出了作为截止点试验的gh值的诊断特征(即,灵敏性、特异性和youden指数(未加权的、加权的)),其中对于c1在10.03ng/ml的峰gh处、对于c2在10.43ng/ml的峰gh处和对于c3在17.13ng/ml处,注意到诊断特征的最稳固的实体表达(most solid expression)。
[0256]
ghst的诊断结果呈现在表4中。在该表中,如果两个sghst都可用,且都导致gh峰≤7ng/ml,则sghst的诊断结果被认为是“确认的”,或者如果至少一个峰高于7ng/ml,则认为是“未确认的”。如果两个sghst结果都可用且gh峰高于7ng/ml,则结果“未确认”被归类为“排除”,如果情况不适合上述任何一种,则归类为“不明确的(equivocal)”。研究者的评估是基于当地诊断标准实践。针对由单独峰值gh值计算的截止点试验马昔瑞林ghst。
[0257]
表4:ghst的诊断结果(受试者数量=24)
[0258]
[0259]
[0260][0261]
基于上述考虑事项,表4给出了主要研究者(pi)的评估和两个sghst结果之间的一致性:在21名(87.5%)患者(即8名确认的和13名未确认的)中,研究者的评估和sghst结果之间存在一致性。在3名(12.5%)患者中,研究者推断ghd,而sghst排除(在1名患者中)诊断或是不明确的(在2名患者中)。
[0262]
此外,诊断结果可总结如下(表5):在所有三个群组中,研究者评估为“ghd”的全部11名患者中,只有c2中1名(9.09%)患者的马昔瑞林ghst显示“ghd未确认”。
[0263]
从研究者评价为患有ghd“未确认的”的总计13名患者,马昔瑞林ghst分别在c1中3名(23.08%)患者中和在c3中1名(7.69%)患者中确认了ghd。
[0264]
表5:马昔瑞林ghst对比sghst和对比研究者的评估的诊断结果总结
[0265][0266]
考虑到上述数据,在c3中观察到马昔瑞林试验的最强试验特征;在所有8名患者中明显刺激了gh分泌。最后,作为单个试验应用的马昔瑞林ghst的结果显示与两个sghst组合的结果以及8名受试者中7名的pi评估一致。
[0267]
接受者操作特征(roc)分析
[0268]
对于所有试验的gh截止点,如果与c2和c3比较,c1的roc曲线显示最低的灵敏性和特异性(图3)。曲线下相关面积(auc)随着剂量递增而增加。
[0269]
当比较三个群组之间gh截止点的特征时,c3的17.130ng/ml gh截止点显示最强的试验特征,灵敏度为1.0,特异性为0.8,youden指数≥0.80,和roc auc为0.93(参见表6)。
[0270]
基于归类为“确认的”vs.“未确认的”的sghst的试验结果,进行灵敏性分析,观察roc auc的发展。同样,对于c3表达最强的试验特征,与c2(灵敏性0.75,特异性0.75,roc auc 0.563)和c1(灵敏性1.0,特异性0.71,roc auc 0.714)相比,具有例如灵敏性1.00,特
异性0.80,和roc auc 0.933。
[0271]
表6:roc分析的总结:由群组的auc和截止点特征(pds,n=24)
[0272][0273]
npv=阴性预测值,ppv=阳性预测值
[0274]
pk和pd总结
[0275]
总之,c1、c2和c3的马昔瑞林pk和pd显示可比较的特性:
[0276]
·
所有三个组的马昔瑞林t
max
是可比较的,平均t
max
值为约0.5至0.75小时;
[0277]
·
平均马昔瑞林c
max
显示剂量成比例增加;
[0278]
·
auc随马昔瑞林剂量增加;
[0279]
·
在施用马昔瑞林之后0.25至2小时,观察到最大gh释放,平均t
max
值为约0.5至1小时。
[0280]
在1.0mg/kg体重的马昔瑞林剂量给药下,在c3中观察到auc和c
max
的最大值。此外,灵敏性分析支持c3的剂量给药具有最强的试验特征,在约17ng/ml gh的截止点表达,特异性为0.80,灵敏性为1.00,youden指数为0.80和roc auc为0.933。
[0281]
安全性结果:
[0282]
总之,在saf的23位患者中记录了88个ae,即c1的8名患者中有27个事件,c2的8名患者中有28个事件,和c3的7名患者中有33个事件。
[0283]
在saf患者的21名患者中记录了总共70个治疗突发不良事件(teae),即c1患者的8名患者中有22个事件,c2患者的6名患者中有24个事件,和c3患者的7名患者中有24个事件。
[0284]
没有一个teae被报道与马昔瑞林试验有关。
[0285]
在该试验过程中报道没有sae或严重的teae。报道的ae或teae中没有一个引起患者撤回。
[0286]
大多数ae与itt相关,即21名(91.3%)患者中有62个(70.5%)事件。在7名
(30.4%)患者中观察到可乐定相关的ae(13(14.8%)),和在1名(4.3%)患者中报道了精氨酸相关的ae。应当注意,将itt施用于22名患者,将精氨酸施用于8名患者(33.3%),将可乐定施用于16名患者,和将胰高血糖素仅施用于一名患者。
[0287]
由于ae报道为感染性疾病,仅有一例肛裂,以及用于sghst的试验试剂的副作用。
[0288]
ae主要为轻度至中度强度。itt相关的ae包括低血糖症状(例如震颤、出汗),这是sghst的临床终点。与可乐定相关,报道了低血压相关症状,其是该sghst试剂的已知副作用。
[0289]
在群组1中报道了一名患者的teae的严重强度:5个ae(即,心悸、心动过速、饥饿、多汗和震颤)是itt期间患者hu0101中出现的预期低血糖症的一部分。
[0290]
临床实验室、生命体征、身体发现、ecg:
[0291]
安全性临床实验室参数、生命体征和体检没有观察到任何临床显著的变化。没有描述临床上显著的异常和ecg参数中的显著变化。
[0292]
耐受性调查问卷:
[0293]
ghst耐受性调查问卷由患者或父母/法定监护人完成。
[0294]
总之,对于所有三个给药组中的马昔瑞林,注意到与预先定义的陈述大部分一致性或强一致性。
[0295]
在c1中,在一个涉及“可接受的味道”的病例中和在一个涉及“第二天胃感觉良好”的病例中描述了不一致性。在一个病例中,记录到“第二天排便”的强不一致性。
[0296]
对于与c2调查问卷相关的任一个马昔瑞林试验,没有发现强不一致性或不一致性。c3中描述了一种与“可接受的味道”不一致的情况。
[0297]
作为手写注释,两名按照马昔瑞林ghst的患者报告了“苦味”。这些注释中没有一个被研究者评价为ae。
[0298]
总之,在马昔瑞林试验之后,由患者或父母/法定监护人提供的反馈证明了该试验的良好耐受性和安全性。
[0299]
结论:
[0300]
进行该试验以研究在患有疑似ghd的儿科患者中,在单次口服给药0.25mg/kg、0.5mg/kg和1.0mg/kg之后,马昔瑞林乙酸盐的安全性、耐受性、pk和pd。此外,其用于鉴定合适的马昔瑞林剂量以在测试验证试验(test validation trial)中进一步试验,并用于探索用于试验的gh截止点。
[0301]
对于所有三个给药群组,发现马昔瑞林血浆水平的c
max
和t
max
在成年人发展程序所预期的范围内。
[0302]
在观察的儿科群体中,观察到了马昔瑞林c
max
(3.46vs.8.13vs.12.87ng/ml)以及平均auc0-6(6.69vs.18.02vs.30.92h*ng/ml)剂量依赖性增加。消除半衰期t1/2在1.25-1.75小时的范围内。
[0303]
通常,儿科群体中的pk参数与成年人中的pk参数在类似的范围内。
[0304]
0.25mg/kg的马昔瑞林剂量(c1)没有导致儿童gh分泌的最大刺激,这在pk/pd数据的评估以及与探索的gh截止点相对于pi评估和sghst结果之间的一致性的比较中变得明显。
[0305]
0.5mg/kg的剂量(c2)显示强的gh释放,基于马昔瑞林ghst相对于sghst的主要研
究者(pi)评估以及0.80的roc auc之间的高水平一致性。然而,1.0mg/kg(c3)的剂量似乎导致更一致的、强的gh刺激,最可能是由于在所有受试者中马昔瑞林的暴露足够高。
[0306]
最后,灵敏性分析支持在c3中给药,其具有在约17ng/ml gh的截止点处表达的最强的试验特征,特异性为0.80,灵敏性为1.00,youden指数为0.80,roc auc为0.93。
[0307]
此外,马昔瑞林ghst的结果与两个标准ghst的结果以及由主要研究人员评估的最终诊断显示了令人惊奇的高一致性。在c3中,在所有8名患者中,gh分泌受到明显刺激。最后,作为单个试验应用的马昔瑞林ghst的结果显示与两个sghst组合的结果以及8名受试者中7名的pi评估一致。
[0308]
总之,在所有三个给药群组中,马昔瑞林显示了良好的安全性和耐受性,而没有观察到群组中报道有任何ae。pk和pd特征在成年人发展程序所预期的范围内。在该第一次儿科试验中,马昔瑞林的总体表征支持选择1.0mg/kg的马昔瑞林剂量用于研究3期试验中的试验有效性。
[0309]
参考文献列表
[0310]
[0311]
[0312]
[0313]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
