rna分子、嵌合体型na分子、双链rna分子及双链嵌合体型na分子
技术领域
1.本发明涉及一种用于rna干涉法的rna分子、嵌合体型na分子、双链rna分子、及双链嵌合体型na分子。
背景技术:
2.rna干涉法为一种用于在细胞内特异性抑制特定靶基因的表达的简便且有效的方法。
3.然而,已知该方法会超出预计对即便原本并非为靶标的基因(脱靶(off-target))也抑制其表达(jackson,a.l.et al.,(2003)nature biotechnology vol.21,p.635-7)。尤其是,已知若sirna对靶基因的亲和力变强,则脱靶效果也变大(ui-tei,k.et al.,(2008)nucleic acids res.vol.36,p.7100-7109)。
技术实现要素:
本发明要解决的技术问题
4.本发明目的在于提供一种新型的rna分子、新型的嵌合体型na分子、新型的双链rna分子及新型的双链嵌合体型na分子。解决技术问题的技术手段
5.本技术的发明人为了确定脱靶效果低的rna序列,进行了不懈努力,结果发现通过使第5个或第6个碱基不匹配,并在第6-8个或第7-8个核糖核苷酸中修饰五碳糖的第2’位,对于第10个或第11个碱基,特别是脱靶效果降低。据此,通过在以相对于某个基因的野生型等位基因具有一个碱基的点突变的突变型等位基因为靶基因的rna干涉法中,以使第10个或第11个碱基对应于点突变的位置并为突变型等位基因所具有的碱基的方式设计rna分子,并将以该rna分子为向导链的双链rna分子用于rna干涉法,从而成功地主要抑制突变型等位基因的表达且事实上不抑制野生型等位基因的表达,完成了本发明。
6.[1]普通的基因[1-1]本发明的一个实施方案为一种rna分子,其用于以相对于基因的野生型等位基因具有一个碱基的点突变的突变型等位基因为靶基因的rna干涉法,所述rna分子满足以下的要件:(1)具有除下述(2-1)中规定的碱基以外与所述突变型等位基因的编码区互补的碱基序列;(2)从与所述突变型等位基因互补的碱基序列的最靠近5’侧的碱基开始计数,(2-1)第5个或第6个碱基与所述突变型等位基因的碱基不匹配;(2-2)第10位或第11位对应于所述点突变的位置,第10个或第11个碱基对应于所述突变型等位基因所具有的碱基;及(2-3)在第6-8个或第7-8个核糖核苷酸中,五碳糖的第2’位被och3、卤素或lna修
饰。所述卤素可以为f。当上述(1)中的规定的碱基序列的5’末端的碱基并非腺嘌呤或尿嘧啶时,该碱基可以被腺嘌呤或尿嘧啶取代。当上述(1)中规定的碱基序列的3’末端的碱基并非胞嘧啶或鸟嘌呤时,该碱基可以被胞嘧啶或鸟嘌呤取代。上述任一rna分子可由13~28个核苷酸构成。上述任一rna分子可以为一个或多个核糖核苷酸被脱氧核糖核苷酸、人工核酸或核酸类似物取代而成的嵌合体型na分子。
[0007]
[1-2]本发明的另一个实施方案为一种双链rna分子,其中,上述任一rna分子为向导链,具有与所述rna分子互补的序列的rna分子为随从链。向导链的3’末端和/或随从链的3’末端可具有单链突出端(overhang)部分,所述单链突出端部分可以由1~3个核苷酸构成。上述任一双链rna分子可以为一个或多个核糖核苷酸被脱氧核糖核苷酸、人工核酸或核酸类似物取代而成的双链嵌合体型na分子。
[0008]
[1-3]本发明的另一个实施方案为一种在rna干涉法中用作向导链的rna分子的制备方法,所述制备方法包括制备上述任一rna分子的工序。rna分子可以为一个或多个核糖核苷酸被脱氧核糖核苷酸、人工核酸或核酸类似物取代而成的嵌合体型na分子。
[0009]
[1-4]本发明的另一个实施方案为一种rna干涉法,其为在具有基因的野生型等位基因、及具有一个碱基的点突变的所述基因的突变型等位基因的细胞中,以所述突变型等位基因为靶基因的rna干涉法,其中,所述rna干涉法包括将上述任一rna分子、嵌合体型na分子、双链rna分子或上述任一双链嵌合体型na分子导入所述细胞中的工序。
[0010]
[1-5]本发明的另一个实施方案为一种治疗药,其为具有包含肿瘤细胞的肿瘤的患者的治疗药,所述肿瘤细胞具有肿瘤基因的野生型等位基因、及具有一个碱基的点突变的所述肿瘤基因的突变型等位基因,且所述点突变为肿瘤发生的原因,其中,所述治疗药以上述任一rna分子、嵌合体型na分子、双链rna分子或上述任一双链嵌合体型na分子作为有效成分。
[0011]
[1-6]本发明的另一个实施方案为一种rna分子、嵌合体型na分子、双链rna分子或双链嵌合体型na分子的筛选方法,其为筛选用于用以抑制靶基因的rna干涉法的rna分子、嵌合体型na分子、双链rna分子或双链嵌合体型na分子的方法,所述筛选方法包括:通过分别使用多个上述任一rna分子、嵌合体型na分子、双链rna分子或上述任一双链嵌合体型na分子以离体(in vitro)进行上述rna干涉法,从而考察所述多个rna分子、嵌合体型na分子、双链rna分子或双链嵌合体型na分子对所述靶基因的特异性抑制基因表达的能力的工序;及筛选所述特异性抑制基因表达的能力为规定水平以上的rna分子、嵌合体型na分子、双链rna分子或双链嵌合体型na分子的工序。
[0012]
[2]k-ras基因[2-1]作为本发明的另一个实施方案,对于[1-1]所述的任一rna分子,所述基因为k-ras基因,所述野生型等位基因为k-ras(wt)等位基因,所述突变等位基因为k-ras(c.35g>a)等位基因、k-ras(c.35g>t)等位基因或k-ras(c.35g>c)等位基因。包括所述(2-1)中规定的碱基的与所述突变型等位基因的编码区互补的碱基序列可以具有下述中的任一种。此外,所述rna分子中的一个或多个核糖核苷酸可以被脱氧核糖核苷酸、人工核酸或核酸类似物取代。5
’‑
uccuacgccaucagcucca-3’(seq id no:1)5
’‑
uccuacgccaacagcucca-3’(seq id no:2)5’‑
uccuacgccagcagcucca-3’(seq id no:3)
[0013]
[2-2]作为本发明的另一个实施方案,对于[1-2]所述的任一双链rna分子,所述基因为k-ras基因,所述野生型等位基因为k-ras(wt)等位基因,所述突变等位基因为k-ras(c.35g>a)等位基因、k-ras(c.35g>t)等位基因或k-ras(c.35g>c)等位基因。在所述向导链中,包括所述(2-1)中规定的碱基的与所述突变型等位基因的编码区互补的碱基序列可以具有下述中的任一种。此外,所述双链rna分子中的一个或多个核糖核苷酸可以被脱氧核糖核苷酸、人工核酸或核酸类似物取代。5
’‑
uccuacgccaucagcucca-3’(seq id no:1)5
’‑
uccuacgccaacagcucca-3’(seq id no:2)5
’‑
uccuacgccagcagcucca-3’(seq id no:3)
[0014]
[2-3]作为本发明的另一个实施方案,在[1-3]所述的任一制备方法中,所述基因为k-ras基因,所述野生型等位基因为k-ras(wt)等位基因,所述突变等位基因为k-ras(c.35g>a)等位基因、k-ras(c.35g>t)等位基因或k-ras(c.35g>c)等位基因。包括所述(2-1)中规定的碱基的与所述突变型等位基因的编码区互补的碱基序列可以具有下述中的任一种。此外,所述rna分子中的一个或多个核糖核苷酸可以被脱氧核糖核苷酸、人工核酸或核酸类似物取代。5
’‑
uccuacgccaucagcucca-3’(seq id no:1)5
’‑
uccuacgccaacagcucca-3’(seq id no:2)5
’‑
uccuacgccagcagcucca-3’(seq id no:3)
[0015]
[2-4]作为本发明的另一个实施方案,在[1-4]所述的任一rna干涉法中,所述基因为k-ras基因,所述野生型等位基因为k-ras(wt)等位基因,所述突变等位基因为k-ras(c.35g>a)等位基因、k-ras(c.35g>t)等位基因或k-ras(c.35g>c)等位基因。在所述向导链中,包括所述(2-1)中规定的碱基的与所述突变型等位基因的编码区互补的碱基序列可以具有下述中的任一种。此外,所述双链rna分子中的一个或多个核糖核苷酸可以被脱氧核糖核苷酸、人工核酸或核酸类似物取代。5
’‑
uccuacgccaucagcucca-3’(seq id no:1)5
’‑
uccuacgccaacagcucca-3’(seq id no:2)5
’‑
uccuacgccagcagcucca-3’(seq id no:3)
[0016]
[2-5]作为本发明的另一个实施方案,对于[1-5]所述的任一治疗药,所述肿瘤基因为k-ras基因,所述野生型等位基因为k-ras(wt)等位基因,所述突变等位基因为k-ras(c.35g>a)等位基因、k-ras(c.35g>t)等位基因或k-ras(c.35g>c)等位基因。在所述向导链中,包括所述(2-1)中规定的碱基的与所述突变型等位基因的编码区互补的碱基序列可以具有下述中的任一种。此外,所述双链rna分子中的一个或多个核糖核苷酸可以被脱氧核糖核苷酸、人工核酸或核酸类似物取代。5
’‑
uccuacgccaucagcucca-3’(seq id no:1)5
’‑
uccuacgccaacagcucca-3’(seq id no:2)5
’‑
uccuacgccagcagcucca-3’(seq id no:3)
[0017]
[2-6]作为本发明的另一个实施方案,在[1-6]所述的任一筛选方法中,所述基因为k-ras基因,所述野生型等位基因为k-ras(wt)等位基因,所述突变等位基因为k-ras
(c.35g>a)等位基因、k-ras(c.35g>t)等位基因或k-ras(c.35g>c)等位基因。
[0018]
[3]n-ras基因[3-1]作为本发明的另一个实施方案,对于[1-1]所述的任一rna分子,所述基因为n-ras基因,所述野生型等位基因为n-ras(wt)等位基因,所述突变等位基因为n-ras(c.35g>a)或n-ras(c.182a>g)等位基因。包括所述(2-1)中规定的碱基的与所述突变型等位基因的编码区互补的碱基序列可以具有下述中的任一种。此外,所述rna分子中的一个或多个核糖核苷酸可以被脱氧核糖核苷酸、人工核酸或核酸类似物取代。5
’‑
cccaacaccaccugcucca-3’(seq id no:146)5
’‑
guacucuucuuguccagcu-3’(seq id no:147)
[0019]
[3-2]作为本发明的另一个实施方案,对于[1-2]所述的任一双链rna分子,所述基因为n-ras基因,所述野生型等位基因为n-ras(wt)等位基因,所述突变等位基因为n-ras(c.35g>a)或n-ras(c.182a>g)等位基因。在所述向导链中,包括所述(2-1)中规定的碱基的与所述突变型等位基因的编码区互补的碱基序列可以具有下述中的任一种。此外,所述双链rna分子中的一个或多个核糖核苷酸可以被脱氧核糖核苷酸、人工核酸或核酸类似物取代。5
’‑
cccaacaccaccugcucca-3’(seq id no:146)5
’‑
guacucuucuuguccagcu-3’(seq id no:147)
[0020]
[3-3]作为本发明的另一个实施方案,在[1-3]所述的任一制备方法中,所述基因为n-ras基因,所述野生型等位基因为n-ras(wt)等位基因,所述突变等位基因为n-ras(c.35g>a)或n-ras(c.182a>g)等位基因。包括所述(2-1)中规定的碱基的与所述突变型等位基因的编码区互补的碱基序列可以具有下述中的任一种。此外,所述rna分子中的一个或多个核糖核苷酸可以被脱氧核糖核苷酸、人工核酸或核酸类似物取代。5
’‑
cccaacaccaccugcucca-3’(seq id no:146)5
’‑
guacucuucuuguccagcu-3’(seq id no:147)
[0021]
[3-4]作为本发明的另一个实施方案,在[1-4]所述的任一rna干涉法中,所述基因为n-ras基因,所述野生型等位基因为n-ras(wt)等位基因,所述突变等位基因为n-ras(c.35g>a)或n-ras(c.182a>g)等位基因。在所述向导链中,包括所述(2-1)中规定的碱基的与所述突变型等位基因的编码区互补的碱基序列可以具有下述中的任一种。此外,所述双链rna分子中的一个或多个核糖核苷酸可以被脱氧核糖核苷酸、人工核酸或核酸类似物取代。5
’‑
cccaacaccaccugcucca-3’(seq id no:146)5
’‑
guacucuucuuguccagcu-3’(seq id no:147)
[0022]
[3-5]作为本发明的另一个实施方案,对于[1-5]所述的任一治疗药,所述肿瘤基因为n-ras基因,所述野生型等位基因为n-ras(wt)等位基因,所述突变等位基因为n-ras(c.35g>a)或n-ras(c.182a>g)等位基因。在所述向导链中,包括所述(2-1)中规定的碱基的与所述突变型等位基因的编码区互补的碱基序列可以具有下述中的任一种。此外,所述双链rna分子中的一个或多个核糖核苷酸可以被脱氧核糖核苷酸、人工核酸或核酸类似物取代。5
’‑
cccaacaccaccugcucca-3’(seq id no:146)5’‑
guacucuucuuguccagcu-3’(seq id no:147)
[0023]
[3-6]作为本发明的另一个实施方案,在[1-6]所述的任一筛选方法中,所述基因为n-ras基因,所述野生型等位基因为n-ras(wt)等位基因,所述突变等位基因为n-ras(c.35g>a)或n-ras(c.182a>g)等位基因。
[0024]
[4]其他基因[4-1]作为本发明的另一个实施方案,对于[1-1]所述的任一rna分子,所述基因为brca2基因,所述野生型等位基因为brca2(wt),所述突变等位基因为a1114c突变型等位基因;或者,对于上述任一rna分子,所述基因为stk11基因,所述野生型等位基因为stk11(wt),所述突变等位基因为c1062g突变型等位基因;或者,对于上述任一rna分子,所述基因为pten基因,所述野生型等位基因为pten(wt),所述突变等位基因为c388g突变型等位基因;或者,对于上述任一rna分子,所述基因为apc基因,所述野生型等位基因为apc(wt),所述突变等位基因为c4348t突变型等位基因;或者,对于上述任一rna分子,所述基因为gata2基因,所述野生型等位基因为gata2(wt),所述突变等位基因为c953t突变型等位基因;或者,对于上述任一rna分子,所述基因为myd88基因,所述野生型等位基因为myd88(wt),所述突变等位基因为t818c突变型等位基因;或者,对于上述任一rna分子,所述基因为gnaq基因,所述野生型等位基因为gnaq(wt),所述突变等位基因为a626t突变型等位基因;或者,对于上述任一rna分子,所述基因为idh1基因,所述野生型等位基因为idh1(wt),所述突变等位基因为g395a突变型等位基因。在所述向导链中,包括所述(2-1)中规定的碱基的与所述突变型等位基因的编码区互补的碱基序列可分别具有下述序列。此外,所述双链rna分子中的一个或多个核糖核苷酸可以被脱氧核糖核苷酸、人工核酸或核酸类似物取代。5
’‑
ggcuucugauuugcuacau-3’(seq id no:148)5
’‑
ccucgaugucgaagagguc-3’(seq id no:149)5
’‑
acaccaguucgucccuuuc-3’(seq id no:150)5
’‑
gguacuucucgcuugguuu-3’(seq id no:151)5
’‑
gaggccacaggcauugcac-3’(seq id no:152)5
’‑
gauggggaucagucgcuuc-3’(seq id no:153)5
’‑
cucugaccuuuggcccccu-3’(seq id no:154)及5
’‑
auaagcaugacgaccuaug-3’(seq id no:155)
[0025]
[4-2]作为本发明的另一个实施方案,对于[1-2]所述的任一双链rna分子,所述基因为brca2基因,所述野生型等位基因为brca2(wt),所述突变等位基因为a1114c突变型等位基因;或者,对于上述任一rna分子,所述基因为stk11基因,所述野生型等位基因为stk11(wt),所述突变等位基因为c1062g突变型等位基因;或者,对于上述任一rna分子,所述基因为pten基因,所述野生型等位基因为pten(wt),所述突变等位基因为c388g突变型等位基因;或者,对于上述任一rna分子,所述基因为apc基因,所述野生型等位基因为apc(wt),所述突变等位基因为c4348t突变型等位基因;或者,对于上述任一rna分子,所述基因为gata2基因,所述野生型等位基因为gata2(wt),所述突变等位基因为c953t突变型等位基因;或者,对于上述任一rna分子,所述基因为myd88基因,所述野生型等位基因为myd88(wt),所述突变等位基因为t818c突变型等位基因;或者,对于上述任一rna分子,所述基因为gnaq基
因,所述野生型等位基因为gnaq(wt),所述突变等位基因为a626t突变型等位基因;或者,对于上述任一rna分子,所述基因为idh1基因,所述野生型等位基因为idh1(wt),所述突变等位基因为g395a突变型等位基因。在所述向导链中,包括所述(2-1)中规定的碱基的与所述突变型等位基因的编码区互补的碱基序列可分别具有下述序列。此外,所述双链rna分子中的一个或多个核糖核苷酸可以被脱氧核糖核苷酸、人工核酸或核酸类似物取代。5
’‑
ggcuucugauuugcuacau-3’(seq id no:148)5
’‑
ccucgaugucgaagagguc-3’(seq id no:149)5
’‑
acaccaguucgucccuuuc-3’(seq id no:150)5
’‑
gguacuucucgcuugguuu-3’(seq id no:151)5
’‑
gaggccacaggcauugcac-3’(seq id no:152)5
’‑
gauggggaucagucgcuuc-3’(seq id no:153)5
’‑
cucugaccuuuggcccccu-3’(seq id no:154)及5
’‑
auaagcaugacgaccuaug-3’(seq id no:155)
[0026]
[4-3]作为本发明的另一个实施方案,在[1-3]所述的任一制备方法中,所述基因为brca2基因,所述野生型等位基因为brca2(wt),所述突变等位基因为a1114c突变型等位基因;或者,对于上述任一rna分子,所述基因为stk11基因,所述野生型等位基因为stk11(wt),所述突变等位基因为c1062g突变型等位基因;或者,对于上述任一rna分子,所述基因为pten基因,所述野生型等位基因为pten(wt),所述突变等位基因为c388g突变型等位基因;或者,对于上述任一rna分子,所述基因为apc基因,所述野生型等位基因为apc(wt),所述突变等位基因为c4348t突变型等位基因;或者,对于上述任一rna分子,所述基因为gata2基因,所述野生型等位基因为gata2(wt),所述突变等位基因为c953t突变型等位基因;或者,对于上述任一rna分子,所述基因为myd88基因,所述野生型等位基因为myd88(wt),所述突变等位基因为t818c突变型等位基因;或者,对于上述任一rna分子,所述基因为gnaq基因,所述野生型等位基因为gnaq(wt),所述突变等位基因为a626t突变型等位基因;或者,对于上述任一rna分子,所述基因为idh1基因,所述野生型等位基因为idh1(wt),所述突变等位基因为g395a突变型等位基因。在所述向导链中,包括所述(2-1)中规定的碱基的与所述突变型等位基因的编码区互补的碱基序列可分别具有下述序列。此外,所述双链rna分子中的一个或多个核糖核苷酸可以被脱氧核糖核苷酸、人工核酸或核酸类似物取代。5
’‑
ggcuucugauuugcuacau-3’(seq id no:148)5
’‑
ccucgaugucgaagagguc-3’(seq id no:149)5
’‑
acaccaguucgucccuuuc-3’(seq id no:150)5
’‑
gguacuucucgcuugguuu-3’(seq id no:151)5
’‑
gaggccacaggcauugcac-3’(seq id no:152)5
’‑
gauggggaucagucgcuuc-3’(seq id no:153)5
’‑
cucugaccuuuggcccccu-3’(seq id no:154)及5
’‑
auaagcaugacgaccuaug-3’(seq id no:155)
[0027]
[4-4]作为本发明的另一个实施方案,在[1-4]所述的任一rna干涉法中,所述基因
为brca2基因,所述野生型等位基因为brca2(wt),所述突变等位基因为a1114c突变型等位基因;或者,对于上述任一rna分子,所述基因为stk11基因,所述野生型等位基因为stk11(wt),所述突变等位基因为c1062g突变型等位基因;或者,对于上述任一rna分子,所述基因为pten基因,所述野生型等位基因为pten(wt),所述突变等位基因为c388g突变型等位基因;或者,对于上述任一rna分子,所述基因为apc基因,所述野生型等位基因为apc(wt),所述突变等位基因为c4348t突变型等位基因;或者,对于上述任一rna分子,所述基因为gata2基因,所述野生型等位基因为gata2(wt),所述突变等位基因为c953t突变型等位基因;或者,对于上述任一rna分子,所述基因为myd88基因,所述野生型等位基因为myd88(wt),所述突变等位基因为t818c突变型等位基因;或者,对于上述任一rna分子,所述基因为gnaq基因,所述野生型等位基因为gnaq(wt),所述突变等位基因为a626t突变型等位基因;或者,对于上述任一rna分子,所述基因为idh1基因,所述野生型等位基因为idh1(wt),所述突变等位基因为g395a突变型等位基因。在所述向导链中,包括所述(2-1)中规定的碱基的与所述突变型等位基因的编码区互补的碱基序列可分别具有下述序列。此外,所述双链rna分子中的一个或多个核糖核苷酸可以被脱氧核糖核苷酸、人工核酸或核酸类似物取代。5
’‑
ggcuucugauuugcuacau-3’(seq id no:148)5
’‑
ccucgaugucgaagagguc-3’(seq id no:149)5
’‑
acaccaguucgucccuuuc-3’(seq id no:150)5
’‑
gguacuucucgcuugguuu-3’(seq id no:151)5
’‑
gaggccacaggcauugcac-3’(seq id no:152)5
’‑
gauggggaucagucgcuuc-3’(seq id no:153)5
’‑
cucugaccuuuggcccccu-3’(seq id no:154)及5
’‑
auaagcaugacgaccuaug-3’(seq id no:155)
[0028]
[4-5]作为本发明的另一个实施方案,对于[1-5]所述的任一治疗药,所述肿瘤基因为brca2基因,所述野生型等位基因为brca2(wt),所述突变等位基因为a1114c突变型等位基因;或者,对于上述任一rna分子,所述基因为stk11基因,所述野生型等位基因为stk11(wt),所述突变等位基因为c1062g突变型等位基因;或者,对于上述任一rna分子,所述基因为pten基因,所述野生型等位基因为pten(wt),所述突变等位基因为c388g突变型等位基因;或者,对于上述任一rna分子,所述基因为apc基因,所述野生型等位基因为apc(wt),所述突变等位基因为c4348t突变型等位基因;或者,对于上述任一rna分子,所述基因为gata2基因,所述野生型等位基因为gata2(wt),所述突变等位基因为c953t突变型等位基因;或者,对于上述任一rna分子,所述基因为myd88基因,所述野生型等位基因为myd88(wt),所述突变等位基因为t818c突变型等位基因;或者,对于上述任一rna分子,所述基因为gnaq基因,所述野生型等位基因为gnaq(wt),所述突变等位基因为a626t突变型等位基因;或者,对于上述任一rna分子,所述基因为idh1基因,所述野生型等位基因为idh1(wt),所述突变等位基因为g395a突变型等位基因。在所述向导链中,包括所述(2-1)中规定的碱基的与所述突变型等位基因的编码区互补的碱基序列可分别具有下述序列。此外,所述双链rna分子中的一个或多个核糖核苷酸可以被脱氧核糖核苷酸、人工核酸或核酸类似物取代。5’‑
ggcuucugauuugcuacau-3’(seq id no:148)5
’‑
ccucgaugucgaagagguc-3’(seq id no:149)5
’‑
acaccaguucgucccuuuc-3’(seq id no:150)5
’‑
gguacuucucgcuugguuu-3’(seq id no:151)5
’‑
gaggccacaggcauugcac-3’(seq id no:152)5
’‑
gauggggaucagucgcuuc-3’(seq id no:153)5
’‑
cucugaccuuuggcccccu-3’(seq id no:154)及5
’‑
auaagcaugacgaccuaug-3’(seq id no:155)
[0029]
[4-6]作为本发明的另一个实施方案,在[1-6]所述的任一筛选方法中,所述基因为brca2基因,所述野生型等位基因为brca2(wt),所述突变等位基因为a1114c突变型等位基因;或者,对于上述任一rna分子,所述基因为stk11基因,所述野生型等位基因为stk11(wt),所述突变等位基因为c1062g突变型等位基因;或者,对于上述任一rna分子,所述基因为pten基因,所述野生型等位基因为pten(wt),所述突变等位基因为c388g突变型等位基因;或者,对于上述任一rna分子,所述基因为apc基因,所述野生型等位基因为apc(wt),所述突变等位基因为c4348t突变型等位基因;或者,对于上述任一rna分子,所述基因为gata2基因,所述野生型等位基因为gata2(wt),所述突变等位基因为c953t突变型等位基因;或者,对于上述任一rna分子,所述基因为myd88基因,所述野生型等位基因为myd88(wt),所述突变等位基因为t818c突变型等位基因;或者,对于上述任一rna分子,所述基因为gnaq基因,所述野生型等位基因为gnaq(wt),所述突变等位基因为a626t突变型等位基因;或者,对于上述任一rna分子,所述基因为idh1基因,所述野生型等位基因为idh1(wt),所述突变等位基因为g395a突变型等位基因。==与相关文献的交叉引用==本技术主张基于2019年7月16日提出申请的日本专利申请2019-130966的优先权,并通过引用该基础申请,使其包含在本说明书中。
附图说明
[0030]
图1为示出本发明的一个实施例中的如下sirna的表达抑制能力的考察结果的图表:使以k-ras基因为靶标的sirna的第9~11位对应于点突变的位置时的sirna。图2为示出在本发明的一个实施例中使用如下sirna时的sirna的表达抑制能力的考察结果的图表:使以k-ras基因为靶标的sirna的第11位对应于点突变的位置,并将sirna的向导链的5’末端的碱基由鸟嘌呤取代为尿嘧啶,将随从链的5’末端的碱基由尿嘧啶取代为鸟嘌呤的sirna。图3为示出本发明的一个实施例中的如下sirna的表达抑制能力的考察结果的图表:使以k-ras基因为靶标的sirna的第11位对应于点突变的位置,并将sirna的向导链的5’末端的碱基由鸟嘌呤取代为尿嘧啶,将随从链的5’末端的碱基由尿嘧啶取代为鸟嘌呤,在sirna的向导链的第6个至第8个核糖核苷酸中将五碳糖的第2’位取代为och3时的sirna。图4为示出本发明的一个实施例中的如下sirna的表达抑制能力的考察结果的图表:使以k-ras基因为靶标的sirna的第11位对应于点突变的位置,并将sirna的向导链的5’末端的碱基由鸟嘌呤取代为尿嘧啶,将随从链的5’末端的碱基由尿嘧啶取代为鸟嘌呤,使
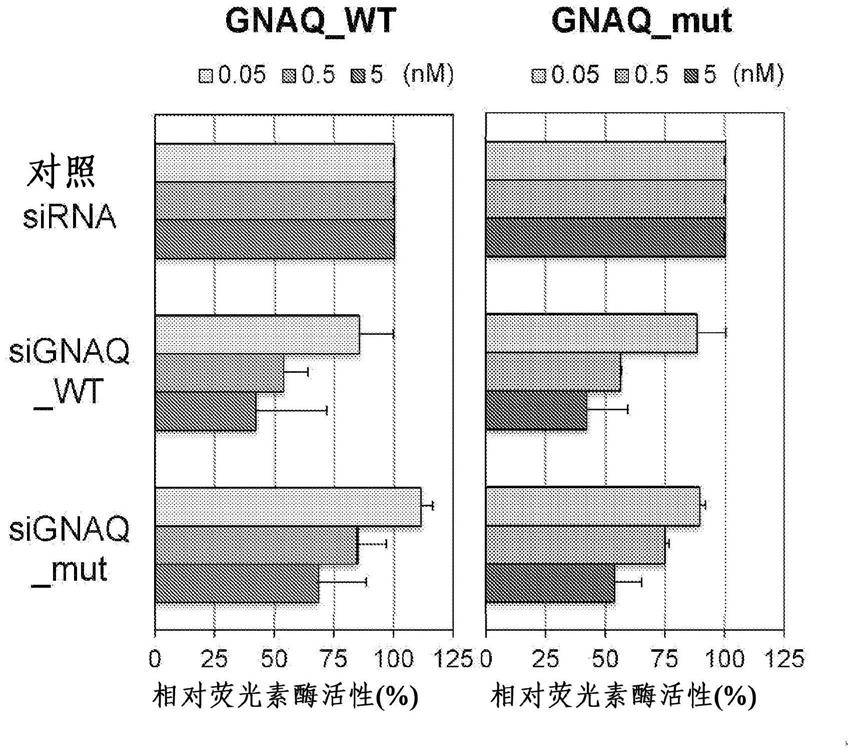
sirna的向导链的第3~7个碱基与a突变型等位基因的碱基不匹配时的sirna。图5为示出本发明的一个实施例中的如下sirna的表达抑制能力的考察结果的图表:使以k-ras基因为靶标的sirna的第11位对应于点突变的位置,并将sirna的向导链的5’末端的碱基由鸟嘌呤取代为尿嘧啶,将随从链的5’末端的碱基由尿嘧啶取代为鸟嘌呤,在sirna的向导链的第6个至第8个核糖核苷酸中将五碳糖的第2’位取代为och3,使sirna的向导链的第3~7个碱基与a突变型等位基因的碱基不匹配时的sirna。图6为示出本发明的一个实施例中的对k-ras基因的a突变型等位基因表现出特异性的sirna对野生型等位基因、t突变型k-ras(c.35g>t)等位基因及c突变型k-ras(c.35g>c)等位基因的表达抑制能力的考察结果的图表。图7为示出本发明的一个实施例中的对k-ras基因的t突变型等位基因表现出特异性的sirna对野生型等位基因、a突变型等位基因及c突变型等位基因的表达抑制能力的考察结果的图表。图8为示出本发明的一个实施例中的对k-ras基因的c突变型等位基因表现出特异性的sirna对野生型等位基因、a突变型等位基因及t突变型等位基因的表达抑制能力的考察结果的图表。图9为示出本发明的一个实施例中的如下sirna的表达抑制能力的考察结果的图表:以n-ras基因的cdna第35个核苷酸中的点突变为对象,并使sirna的第11位对应于a突变型n-ras(c.35g>a)等位基因(以下,称为a突变型n35等位基因)的点突变的位置,将sirna的向导链的5’末端的碱基由胞嘧啶取代为尿嘧啶,将随从链的5’末端的碱基由腺嘌呤取代为鸟嘌呤,在向导链的第6个至第8个核糖核苷酸中将五碳糖的第2’位取代为och3,且使sirna的向导链的第5个碱基与a突变型n35等位基因的碱基不匹配时的sirna。图10为示出本发明的一个实施例中的如下sirna的表达抑制能力的考察结果的图表:以n-ras基因的cdna第182个核苷酸中的点突变为对象,并使sirna的第11位对应于a突变型n-ras(c.182a>g)等位基因(以下,称为g突变型n182等位基因)的点突变的位置,将sirna的向导链的5’末端的碱基由鸟嘌呤取代为尿嘧啶,将随从链的5’末端的碱基由腺嘌呤取代为鸟嘌呤,在向导链的第6个至第8个核糖核苷酸中将五碳糖的第2’位取代为och3,且使sirna的向导链的第5个碱基与g突变型n182等位基因的碱基不匹配时的sirna。图11a为示出如下结果的图表:在本发明的一个实施例中,对于brca2基因的野生型等位基因与a1114c突变型等位基因而言,具有本发明公开的序列的sirna几乎不抑制来自野生型等位基因的表达,但强烈抑制来自突变型等位基因的表达。图11b为示出如下结果的图表:对于stk11基因的野生型等位基因与c1062g突变型等位基因而言,具有本发明公开的序列的sirna几乎不抑制来自野生型等位基因的表达,但强烈抑制来自突变型等位基因的表达。图11c为示出如下结果的图表:对于pten基因的野生型等位基因与c388g突变型等位基因而言,具有本发明公开的序列的sirna几乎不抑制来自野生型等位基因的表达,但强烈抑制来自突变型等位基因的表达。图11d为示出如下结果的图表:对于apc基因的野生型等位基因与c4348t突变型等位基因而言,具有本发明公开的序列的sirna几乎不抑制来自野生型等位基因的表达,但强烈抑制来自突变型等位基因的表达。
图11e为示出如下结果的图表:对于gata2基因的野生型等位基因与c953t突变型等位基因而言,具有本发明公开的序列的sirna几乎不抑制来自野生型等位基因的表达,但强烈抑制来自突变型等位基因的表达。图11f为示出如下结果的图表:对于myd88基因的野生型等位基因与t818c突变型等位基因而言,具有本发明公开的序列的sirna几乎不抑制来自野生型等位基因的表达,但强烈抑制来自突变型等位基因的表达。图11g为示出如下结果的图表:对于gnaq基因的野生型等位基因与a626t突变型等位基因而言,具有本发明公开的序列的sirna几乎不抑制来自野生型等位基因的表达,但强烈抑制来自突变型等位基因的表达。图11h为示出如下结果的图表:对于idh1基因的野生型等位基因与g395a突变型等位基因而言,具有本发明公开的序列的sirna几乎不抑制来自野生型等位基因的表达,但强烈抑制来自突变型等位基因的表达。图12为示出如下结果的图表:在本发明的一个实施例中,在培养细胞中,对于来自外源性的报告基因的表达特异性抑制来自突变型等位基因的表达的sirna,即便对于内源性基因的表达也具有同样的特异性。图13为示出如下结果的图表:在本发明的一个实施例中,sikras-a能够在离体下抑制肿瘤细胞的增殖。
具体实施方式
[0031]
根据本说明书的记载,本发明的目的、特征、优点及其构思对本领域技术人员而言是显而易见的,只要是本领域技术人员则能够根据本说明书的记载容易地再现本发明。以下记载的发明的实施方式及具体的实施例等用于示出本发明的优选实施方案,仅用于例示或说明,本发明并不受限于此。能够在本说明书中公开的本发明的意图以及范围内基于本说明书的记载进行各种改变以及修饰这一点,对于本领域技术人员而言是显而易见的。
[0032]
==rna分子==本发明的一个实施方案为一种用于以相对于基因的野生型等位基因具有一个碱基的点突变的突变型等位基因为靶基因的rna干涉法的rna分子。对于作为对象的基因,只要能够设计本发明公开的rna分子,则没有特别限定,但优选为因点突变而导致正常细胞发生癌化的癌基因。构成rna分子的核苷酸的个数没有特别限定,可以为13个以上且100个以下,可以为13个以上且50个以下,可以为13个以上且28个以下,可以为15个以上且25个以下,可以为17个以上且21个以下,优选为19个以上且21个以下。此外,1个或多个(可以为2个以上且18个以下,可以为2个以上且15个以下,可以为2个以上且12个以下,可以为2个以上且9个以下,可以为2个以上且6个以下,可以为2个以上且3个以下。)核糖核苷酸可以被脱氧核糖核苷酸、人工核酸或肌苷、吗啉代等核酸类似物取代。在本说明书中,将这种rna分子称为嵌合体型na分子,但在本发明公开中,对于rna分子,以包括嵌合体型na分子的形式进行说明。
[0033]
对于该rna分子,从与突变型等位基因互补的碱基序列的最靠近5’侧的碱基开始计数,第5个或第6个碱基与突变型等位基因的碱基不匹配,且该rna分子具有除此以外的部分与突变型等位基因的编码区互补的碱基序列。该rna分子可以具有除与突变型等位基因
的编码区互补的碱基序列以外的序列,例如可以具有与该互补的碱基序列互补的序列,由此可以进行自退火(self-annealing),并作为sirna而发挥功能。作为这样的单链rna,可例示bonac核酸。或者,可以在3’末端键合有1~3个核苷酸,其碱基序列没有特别限定。当互补的碱基序列的最靠近5’侧的碱基并非腺嘌呤或尿嘧啶时,该碱基可以被腺嘌呤或尿嘧啶或胸腺嘧啶取代。此外,当互补的碱基序列的最靠近3’侧的碱基并非胞嘧啶或鸟嘌呤时,该碱基可以被胞嘧啶或鸟嘌呤取代。通过这些操作,当该rna分子作为sirna的向导链而发挥功能时,能够提高抑制基因表达的功能。此外,该rna分子可以具有除核酸以外的化学物质以进行传递、提高膜通透性或提高血中滞留性。例如,rna分子可以与galnac或peg缀合(conjugate)。此外,rna分子可以具有除了除第5个或第6个碱基以外与突变型等位基因的编码区互补的碱基序列之外的序列。另外,rna分子虽具有除第5个或第6个碱基以外与突变型等位基因互补的碱基序列,但优选具有90%以上的互补性,更优选具有95%以上的互补性,进一步优选具有98%以上的互补性,最优选具有100%的互补性。第5个或第6个碱基只要与突变型等位基因不匹配则没有特别限定,只要为该位置的突变型等位基因的碱基以外的碱基,则a、u、c、g、t、i或除此以外的人工核酸
·
核酸类似物均可。
[0034]
此外,在该rna分子中,从与突变型等位基因互补的碱基序列的最靠近5’侧的碱基开始计数,第10位或第11位对应于点突变的位置,其碱基为对应于突变型等位基因所具有的碱基的碱基。即,当突变型等位基因所具有的发生突变的碱基为腺嘌呤、胞嘧啶、鸟嘌呤、胸腺嘧啶时,rna分子的第10位或第11位分别为腺嘌呤、胞嘧啶、鸟嘌呤、尿嘧啶(或胸腺嘧啶)。
[0035]
此外,该rna分子中,从与突变型等位基因互补的碱基序列的最靠近5’侧的碱基开始计数,第6-8个或第7-8个核苷酸所具有的五碳糖的第2’位被och3、卤素或lna修饰(即,取代)。例如,五碳糖的第2’位被-och3取代的rna(以下,称为2
’‑
o-甲基rna)具有下述通式的结构。
[0036]
[化学式1]卤素的种类没有特别限定,但从分子的大小较小的角度出发,优选氟。对于除这些位置以外的核苷酸,可以一部分或全部被修饰,优选所有的核苷酸均未被修饰。核苷酸的修饰没有特别限定,可例示出其所具有的五碳糖的第2’位被选自由h、or、r、卤素、sh、sr、nh2、nhr、nr2、cn、coor及lna(式中,r为c
1-c6烷基、烯基、炔基或芳基;卤素为f、cl、br或i)组成的组中的基团取代。
[0037]
rna分子对靶基因的ic50优选为1nm以下,更优选为500pm以下,进一步优选为200pm以下。
[0038]
将该rna分子以单链直接应用于rna干涉法时,优选其5’末端被磷酸化、或能够以in situ或in vivo而被磷酸化。
[0039]
该rna分子的设计方法包括以下工序。
[0040]
首先,进行将突变型等位基因所具有的发生突变的碱基设为从最靠近5’侧的碱基开始计数时的第10位或第11位,选定具有与突变型等位基因的碱基序列互补的序列的规定长度的碱基序列的工序。接着,进行将从最靠近5’侧的碱基开始计数时的第5个或第6个碱基制成不匹配的碱基的工序。然后,将从最靠近5’侧的碱基开始计数时的第6-8个或第7-8个核苷酸制成这些核苷酸所具有的五碳糖的第2’位被och3、卤素或lna修饰的核苷酸。此处,当互补的碱基序列的最靠近5’侧的碱基并非腺嘌呤或尿嘧啶时,也可以进行用腺嘌呤或尿嘧啶或胸腺嘧啶进行取代的工序。此外,当互补的碱基序列的最靠近3’侧的碱基并非胞嘧啶或鸟嘌呤时,也可以进行被胞嘧啶或鸟嘌呤取代的工序。最后,也可以进行在3’侧加成1-3个的碱基的工序。能够以上述方式设计碱基序列。可以制作用于使该设计方法在计算机中运行的程序,可以将该程序存储在计算机可读的记录介质上。具有以上述方式设计的碱基序列的核苷酸可按照常规方法进行化学合成。
[0041]
==双链rna分子==本发明的一个实施方案为一种双链rna分子,其中,所述rna分子(以下,称为第一rna分子)为向导链,具有与第一rna分子互补的序列的第二rna分子为随从链。第二rna分子具有与第一rna分子互补的序列,并在生理条件下与第一rna分子形成双链,优选具有90%以上的互补性,更优选具有95%以上的互补性,进一步优选具有98%以上的互补性,最优选具有100%的互补性。
[0042]
随从链的链长没有特别限定,可以远远短于第一rna分子,例如可以为第一rna分子的一半以下,但优选为与第一rna分子相同长度。当随从链比第一rna分子短时,会在第一rna分子上产生单链部分,该部分可以为单链的状态,也可以键合有与第一rna分子互补的第三rna分子。当第二rna分子与第三rna分子键合于第一rna分子整体时,成为与一条随从链上存在切口(nick)而分成两条链的情况相同的状态。
[0043]
双链rna分子的两端可以为平滑末端,也可在作为向导链的第一rna分子的3’末端和/或作为随从链的第二rna分子的3’末端具有单链突出端。单链突出端的核苷酸数虽然没有特别限定,但优选为1~3个。
[0044]
可以为向导链及随从链中的任一核苷酸链中的一个或多个核糖核苷酸被脱氧核糖核苷酸、人工核酸或核酸类似物取代而成的双链嵌合体型na分子。
[0045]
构成随从链的核苷酸可以被修饰,但优选未被修饰。核苷酸的修饰没有特别限定,可例示出其所具有的五碳糖的第2’位被选自由h、or、r、卤素、sh、sr1、nh2、nhr、nr2、cn、coor及lna(式中,r为c
1-c6烷基、烯基、炔基或芳基;卤素为f、cl、br或i)组成的组中的基团取代。
[0046]
随从链也能够按照公知技术容易地设计、容易地制备。另外,向导链与随从链可以以接头(linker)键合。接头的构成材料没有特别限定,可以为肽或peg等。
[0047]
==rna干涉法==本发明的一个实施方案为一种rna干涉法,所述rna干涉法为在具有目标基因的野生型等位基因、及具有一个碱基的点突变的基因的突变型等位基因的细胞中,以突变型等位基因为靶基因的rna干涉法。该rna干涉法包括将包括嵌合体型na分子的第一rna分子、或
包括双链嵌合体型na分子的上述双链rna分子导入具有野生型等位基因与突变型等位基因的细胞中的工序。
[0048]
rna干涉法能够按照公知技术容易地进行。例如,通过对表达靶基因的培养细胞、或人或者除人以外的生物个体导入第一rna分子或双链rna分子,能够下调靶基因的表达。
[0049]
通过在进行rna干涉法时使用上述第一rna分子或双链rna分子,能够主要抑制来自突变型等位基因的表达且事实上不抑制目标基因的野生型等位基因的表达。此处,对于野生型等位基因的表达,只要达到野生型等位基因发挥功能并带来正常的表现型的程度,则即便被抑制也无妨。对于突变型等位基因的表达,只要被抑制至突变型等位基因不发挥功能且不能带来异常的表现型的程度即可。由此,例如当突变型等位基因具有显性突变时,能够使突变产生的表现型不表达而使细胞正常地发挥功能。
[0050]
==治疗药==当本发明公开的sirna被用作治疗药时,作为其对象的疾病没有特别限定,本发明的一个实施方案为具有包含肿瘤细胞的肿瘤的患者的治疗药,所述肿瘤细胞具有肿瘤基因(有时也称为原癌基因、肿瘤抑制基因、抑癌基因等)的野生型等位基因、及具有一个碱基的点突变的肿瘤基因的突变型等位基因,且点突变为肿瘤发生的原因,所述治疗药以包括上述嵌合体型na分子的rna分子、或包括双链嵌合体型na分子的双链rna分子作为有效成分。
[0051]
给药方法没有特别限定,优选为注射,更优选为静脉注射。此时,除有效成分以外,还可以在治疗药中添加ph调节剂、缓冲剂、稳定化剂、等渗剂、局麻剂等。
[0052]
用量没有特别限定,可根据所含成分的有效性、给药形式、给药途径、疾病的种类、对象的性质(体重、年龄、病状及是否使用其他药物等)、及责任医师的判断等适当选择。==作为治疗药的对象的疾病==
[0053]
本发明公开的sirna作为治疗药时的疾病没有特别限定,只要该疾病为因突变基因的表达而产生的疾病即可,如上所述,优选为肿瘤。在后述的实施例中,将k-ras基因、n-ras基因、brca基因、stk11基因、pten基因、apc基因、gata2基因、myd88基因、gnaq基因、idh1基因作为抑制对象,且分别已知:k-ras基因的突变会导致大肠癌、肺癌、胰腺癌、白血病等;n-ras基因的突变会导致大肠癌、甲状腺癌、皮肤癌等;brca基因的突变会导致乳腺癌、卵巢癌等;stk11基因的突变会导致宫颈恶性腺瘤、peutz-jeghers综合征、胃癌、乳腺癌、卵巢癌等;pten基因的突变会导致cowden综合征、lhermitte-duclos病、bannayan-riley-ruvalcaba综合征、proteus综合征等pten错构瘤综合征等;apc基因的突变会导致家族性腺瘤性息肉病(fap)、肝癌等;gata2基因的突变会导致monomac综合征、急性巨核细胞白血病等;myd88基因的突变会导致淋巴瘤等;gnaq基因的突变会导致葡萄膜恶性黑色素瘤、sturge-weber综合征、gnas基因、brca基因血管瘤等;以及idh1基因的突变会导致胶质瘤等,至少可作为这些疾病的治疗药。==筛选方法==本发明的一个实施方案为筛选用于用以抑制靶基因的rna干涉法的rna分子、嵌合体型na分子、双链rna分子或双链嵌合体型na分子的方法,所述筛选方法包括:通过使用多个上述rna分子、嵌合体型na分子、双链rna分子或双链嵌合体型na分子以离体进行rna干涉法,从而考察特异性抑制基因表达的能力的工序;及筛选特异性抑制基因表达的能力为规定水平以上的rna分子、嵌合体型na分子、双链rna分子或双链嵌合体型na分子的工序。
[0054]
以离体进行rna干涉法时,使用基因的野生型等位基因及具有一个碱基的点突变的突变型等位基因作为对象基因,选择不以规定水平以上的水平抑制野生型等位基因的表达但以规定水平以上的水平抑制突变型等位基因的表达的分子。由此,能够得到抑制突变型等位基因的表达且不抑制野生型等位基因的表达的分子。此处,规定水平的数值没有特别限定,优选为50%,更优选为70%,进一步优选为90%。
[0055]
在离体下利用rna干涉的检测方法是技术常识,并且基因的选择、细胞的选择、向细胞导入rna分子等对于本领域技术人员而言是公知的。实施例
[0056]
实施例1
[0057]
本实施例中示出:本说明书中公开的sirna在培养细胞中,对于来自外源性的报告基因的表达,不抑制来自野生型等位基因的表达,但特异性抑制来自突变型等位基因的表达。(方法)将含10%fbs的dmem中培养的hela细胞以1x105个/ml的密度接种于24孔板,并将100ng的各报告基因及100ng的内部标准用质粒(pgl3)及双链sirna与2μl的脂质体2000(lipofectamine2000)一起共转染。双链sirna的浓度示于各图。另外,作为对照的sirna,导入了sigy441。24小时后回收细胞,使用dual-luciferase报告基因检测系统(promega公司)测定萤火虫荧光素酶(firefly luciferase)及海肾荧光素酶(renilla luciferase)的活性,使用萤火虫荧光素酶的测定值,将海肾荧光素酶的测定值标准化。此外,将双链sirna所得到的测定值以sigy441所得到的测定值为100%的方式示于图表。[实施例1a]
[0058]
在本实施例中,作为表达受抑制的靶基因,使用k-ras基因。
[0059]
(实施例1a-1)本实施例中示出:通过使sirna的第10位或第11位对应于a突变型k-ras(c.35g>a)等位基因(在cdna(gene id:3845)中,第35个碱基由g突变为a)(以下,称为a突变型等位基因)的点突变的位置,rna分子的相对于野生型k-ras等位基因(以下,称为野生型等位基因)的对a突变型k-ras(c.35g>a)等位基因的表达抑制能力的特异性增高。
[0060]
首先,作为用于考察基因表达抑制效果的报告基因,化学合成具有与野生型k-ras(wt)等位基因及a突变型k-ras(c.35g>a)等位基因相同的碱基序列的dna,并插入至表达载体(psicheck)的荧光素酶基因的3
’‑
utr,制作野生型k报告基因及a突变型k报告基因。将导入载体中的部分的序列分别示于以下。
[0061]
野生型k报告基因:a突变型k报告基因:接着,作为sirna,化学合成具有下述序列的双链rna。作为sirna的k(35)9a、k(35)10a及k(35)11a,第9位、第10位及第11位分别对应于a突变型k-ras(c.35g>a)等位基因的
点突变的位置。另外,下述序列中,将对应于点突变的位置的碱基对用
□
包围。
[0062]
k(35)9a:k(35)10a:k(35)11a:
[0063]
图1中示出各sirna的基因表达抑制效果。k(35)9a对a突变型等位基因及野生型等位基因均具有较强的表达抑制效果。对于k(35)10a及k(35)11a,虽然表达抑制效果稍微减弱,但相较于野生型等位基因,更强烈地抑制了a突变型等位基因的表达。
[0064]
(实施例1a-2)本实施例中示出:通过使用在使sirna的第11位对应于a突变型等位基因的点突变的位置的基础上,将sirna的向导链的5’末端的碱基由鸟嘌呤取代为尿嘧啶,并将随从链的5’末端的碱基由尿嘧啶取代为鸟嘌呤的sirna,rna分子对a突变型等位基因的表达抑制能力变强,其特异性进一步增高。
[0065]
作为用于考察基因表达抑制效果的报告基因,使用野生型k报告基因及a突变型k报告基因,作为sirna,化学合成具有下述序列的双链rna,作为对照,使用k(35)11a。另外,下述序列中,将对应于点突变的位置的碱基对、和向导链及随从链的5’末端的取代后的碱基对用
□
包围。
[0066]
k(35)11arev:
[0067]
图2中示出各sirna的基因表达抑制效果。相较于野生型等位基因,k(35)11a更强烈地抑制了a突变型等位基因的表达,而k(35)11arev对上述两种等位基因的表达抑制效果均变强,且相较于野生型等位基因,进一步强烈地抑制了a突变型等位基因的表达。
[0068]
(实施例1a-3)本实施例中示出:通过在使sirna的第11位对应于a突变型等位基因的点突变的位置,并将sirna的向导链的5’末端的碱基由鸟嘌呤取代为尿嘧啶,将随从链的5’末端的碱基由尿嘧啶取代为鸟嘌呤的基础上,在sirna的向导链的第6个至第8个核糖核苷酸中将五碳糖的第2’位取代为och3,rna分子对a突变型等位基因的表达抑制能力变强,其特异性进一步增高。
[0069]
作为用于考察基因表达抑制效果的报告基因,使用野生型k报告基因及a突变型k报告基因,作为sirna,化学合成具有下述序列的双链rna,作为对照,使用k(35)11arev。另
外,下述序列中,将对应于点突变的位置的碱基对、和向导链及随从链的5’末端的取代后的碱基对用
□
包围,并将五碳糖的第2’位被取代为och3的核苷酸用阴影标记。
[0070]
k(35)11arevom(2-5):k(35)11arevom(6-8):
[0071]
图3中示出各sirna的基因表达抑制效果。相较于野生型等位基因,k(35)11arev更强烈地抑制了a突变型等位基因的表达,而k(35)11arevom(6-8)对上述两种等位基因的表达抑制效果均变强,且相较于野生型等位基因,更强烈地抑制了a突变型等位基因的表达。作为另一个对照的k(35)11arevom(2-5)(在向导链的第2个至第5个核糖核苷酸中,五碳糖的第2’位被取代为och3)对上述两种等位基因的表达抑制效果均相当弱。
[0072]
(实施例1a-4)本实施例中示出:若在使sirna的第11位对应于a突变型等位基因的点突变的位置,并将sirna的向导链的5’末端的碱基由鸟嘌呤取代为尿嘧啶,将随从链的5’末端的碱基由尿嘧啶取代为鸟嘌呤的基础上,使sirna的向导链的第5个或第6个碱基与a突变型等位基因的碱基不匹配,则rna分子对野生型等位基因的表达抑制能力变弱,其结果,对a突变型等位基因的特异性进一步增高。
[0073]
作为用于考察基因表达抑制效果的报告基因,使用野生型k报告基因及a突变型k报告基因,作为sirna,以k(35)11arev为基础,化学合成使第3~7个碱基不匹配的下述序列的双链rna,作为对照,使用k(35)11arev。另外,下述序列中,将对应于点突变的位置的碱基对、向导链及随从链的5’末端的取代后的碱基对、及不匹配的碱基对用
□
包围。
[0074]
k(35)11arevm3:k(35)11arevm4:k(35)11arevm5:k(35)11arevm6:k(35)11arevm7:
[0075]
图4中示出各sirna的基因表达抑制效果。相较于野生型等位基因,k(35)11arev更强烈地抑制了a突变型等位基因的表达,而对于k(35)11arevm5及k(35)11arevm6,rna分子对野生型等位基因的表达抑制能力非常弱,其结果,对a突变型等位基因的特异性进一步增高。
[0076]
(实施例1a-5)本实施例中示出:若在使sirna的第11位对应于a突变型等位基因的点突变的位置,并将sirna的向导链的5’末端的碱基由鸟嘌呤取代为尿嘧啶,将随从链的5’末端的碱基由尿嘧啶取代为鸟嘌呤的基础上,在sirna的向导链的第6个至第8个核糖核苷酸中将五碳糖的第2’位取代为och3,在sirna的向导链的第6个至第8个核糖核苷酸中将五碳糖的第2’位取代为och3,且使sirna的向导链的第5个或第6个碱基与a突变型等位基因的碱基不匹配,则对a突变型等位基因的特异性进一步增高。
[0077]
作为用于考察基因表达抑制效果的报告基因,使用野生型k报告基因及a突变型k报告基因,作为sirna,以k(35)11arev为基础,化学合成第3~7个碱基不匹配的下述序列的双链rna,作为对照,使用k(35)11arev。另外,下述序列中,将对应于点突变的位置的碱基对、向导链及随从链的5’末端的取代后的碱基对、及不匹配的碱基对用
□
包围,并将五碳糖的第2’位被取代为och3的核苷酸用阴影标记。
[0078]
k(35)11arevom(6-8)m3:k(35)11arevom(6-8)m4:k(35)11arevom(6-8)m5:k(35)11arevom(6-8)m6:k(35)11arevom(6-8)m7:
[0079]
图5中示出各sirna的基因表达抑制效果。对于k(35)11arevom(6-8)m5及k(35)11arevom(6-8)m6,rna分子对野生型等位基因的表达抑制能力非常弱,其结果,对a突变型等位基因的特异性进一步增高。
[0080]
(实施例1a-6)
本实施例中示出:对a突变型等位基因表现出特异性的sirna不仅对野生型等位基因的表达抑制能力低,对t突变型k-ras(c.35g>t)等位基因(在cdna中,第35个碱基由g突变为t)及c突变型k-ras(c.35g>c)等位基因(在cdna中,第35个碱基由g突变为c)的表达抑制能力也低。
[0081]
作为用于考察基因表达抑制效果的报告基因,使用下述为k-ras报告基因的、野生型k报告基因、a突变型k报告基因、t突变型k-ras(c.35g>t)报告基因(以下,称为t突变型k报告基因)、c突变型k-ras(c.35g>c)报告基因(以下,称为c突变型k报告基因),作为sirna,使用k(35)11arevom(6-8)m5及k(35)11arevom(6-8)m6,作为对照,使用k(35)11arev。另外,下述序列中,将对应于点突变的位置的碱基对用
□
包围。
[0082]
t突变型k报告基因:c突变型k报告基因:
[0083]
图6中示出对各报告基因的基因表达抑制效果。任一sirna对a突变型k报告基因的表达抑制效果均最强,但尤其是k(35)11arevom(6-8)m5及k(35)11arevom(6-8)m6对t突变型k报告基因及c突变型k报告基因的表达抑制效果较弱。
[0084]
(实施例1a-7)本实施例中示出:对t突变型等位基因表现出特异性的sirna不仅对野生型等位基因的表达抑制能力低,对a突变型等位基因及c突变型等位基因的表达抑制能力也低。
[0085]
作为用于考察基因表达抑制效果的报告基因,使用为k-ras报告基因的、野生型k报告基因、a突变型k报告基因、t突变型t突变型k报告基因、c突变型k报告基因,作为sirna,使用k(35)11trevom(6-8)m5及k(35)11trevom(6-8)m6,作为对照,使用k(35)11trev。另外,下述序列中,将对应于点突变的位置的碱基对、向导链及随从链的5’末端的取代后的碱基对、及不匹配的碱基对用
□
包围,并将五碳糖的第2’位被取代为och3的核苷酸用阴影标记。
[0086]
k(35)11trev:k(35)11trevom(6-8)m5:k(35)11trevom(6-8)m6:
[0087]
图7中示出对各报告基因的基因表达抑制效果。任一sirna对t突变型k报告基因的表达抑制效果均最强,但尤其是k(35)11trevom
(6-8)m5及k(35)11trevom(6-8)m6对t突变型k报告基因及c突变型k报告基因的表达抑制效果较弱。
[0088]
(实施例1a-8)本实施例中示出:对c突变型等位基因表现出特异性的sirna不仅对野生型等位基因的表达抑制能力低,对a突变型等位基因及t突变型等位基因的表达抑制能力也低。
[0089]
作为用于考察基因表达抑制效果的报告基因,使用上述为k-ras报告基因的、野生型k报告基因、a突变型k报告基因、t突变型t突变型k报告基因、c突变型k报告基因,作为sirna,使用k(35)11crevom(6-8)m5及k(35)11crevom(6-8)m6,作为对照,使用k(35)11crev。另外,下述序列中,将对应于点突变的位置的碱基对、向导链及随从链的5’末端的取代后的碱基对、及不匹配的碱基对用
□
包围,并将五碳糖的第2’位被取代为och3的核苷酸用阴影标记。
[0090]
k(35)11crev:k(35)11crevom(6-8)m5:k(35)11crevom(6-8)m6:
[0091]
图8中示出对各报告基因的基因表达抑制效果。任一sirna对c突变型k报告基因的表达抑制效果均最强,但尤其是k(35)11crevom(6-8)m5及k(35)11crevom(6-8)m6对a突变型k报告基因及t突变型k报告基因的表达抑制效果较弱。[实施例1b]
[0092]
在本实施例中,作为表达受抑制的靶基因,使用n-ras基因。
[0093]
(实施例1b-1)本实施例中示出:若将n-ras基因的cdna第35个核苷酸中的点突变作为对象,并使sirna的第11位对应于a突变型n-ras(c.35g>a)等位基因(以下,称为a突变型n35等位基因)的点突变的位置,将sirna的向导链的5’末端的碱基由胞嘧啶取代为尿嘧啶,将随从链的5’末端的碱基由腺嘌呤取代为鸟嘌呤,在向导链的第6个至第8个核糖核苷酸中将五碳糖的第2’位取代为och3,且使sirna的向导链的第5个碱基与a突变型n35等位基因的碱基不匹配,则相较于野生型n-ras(wt)等位基因(以下、野生型n等位基因)的表达,更加特异性抑制a突变型n35等位基因的表达。
[0094]
作为用于考察基因表达抑制效果的报告基因,将具有与野生型n等位基因及a突变型n35等位基因相同的碱基序列的dna插入至表达载体(psicheck)的荧光素酶基因的3
’‑
utr,制作野生型n35报告基因及a突变型n报告基因。将进行化学合成、导入载体的序列示于以下。另外,下述序列中,将对应于点突变的位置的碱基对用
□
包围。
[0095]
野生型n35报告基因:a突变型n35报告基因:
[0096]
作为sirna,化学合成具有下述序列的双链rna。n(35)11g具有与野生型n等位基因互补的序列。n(35)11a为使第11个核苷酸对应于a突变型n35等位基因的点突变的位置的sirna。n(35)11arevom(6-8)m5为下述sirna:使第11个核苷酸对应于a突变型n35等位基因的点突变的位置,并将向导链的5’末端的碱基由胞嘧啶取代为尿嘧啶,将随从链的5’末端的碱基由尿嘧啶取代为胞嘧啶,在向导链的第6个至第8个核糖核苷酸中将五碳糖的第2’位取代为och3,且使sirna的向导链的第5个碱基与a突变型n35等位基因的碱基不匹配的sirna。另外,下述序列中,将对应于点突变的位置的碱基对、向导链及随从链的5’末端的取代后的碱基对、及不匹配的碱基对用
□
包围,并将五碳糖的第2’位被取代为och3的核苷酸用阴影标记。
[0097]
n(35)11g:n(35)11a:n(35)11arevom(6-8)m5:
[0098]
图9中示出各sirna的基因表达抑制效果。对于n(35)11g,相较于a突变型n35等位基因的表达,其更加有效抑制了野生型n等位基因的表达,与之相反,对于n(35)11a,相较于野生型n等位基因的表达,其更加有效抑制了a突变型n35等位基因的表达。n(35)11arevom(6-8)m5对野生型等位基因的表达抑制能力非常弱,但对a突变型n35等位基因的表达抑制能力强,其结果,对a突变型n35等位基因的特异性增高。
[0099]
(实施例1b-2)本实施例中示出:若将n-ras基因的cdna第182个核苷酸中的点突变作为对象,并使sirna的第11位对应于a突变型n-ras(c.182a>g)等位基因(以下,称为g突变型n182等位基因)的点突变的位置,将sirna的向导链的5’末端的碱基由鸟嘌呤取代为尿嘧啶,将随从链的5’末端的碱基由腺嘌呤取代为鸟嘌呤,在向导链的第6个至第8个核糖核苷酸中将五碳糖的第2’位取代为och3,且使sirna的向导链的第5个碱基与g突变型n182等位基因的碱基不匹配,则相较于野生型n-ras(wt)等位基因(以下,称为野生型n等位基因)的表达,更有效抑制g突变型n182等位基因的表达。
[0100]
作为用于考察基因表达抑制效果的报告基因,将具有与g突变型n182等位基因相同的碱基序列的dna插入至表达载体(psicheck)的荧光素酶基因的3
’‑
utr,制作g突变型n182报告基因。将进行化学合成、导入载体的序列示于以下。
[0101]
野生型n182报告基因:g突变型n182报告基因:
[0102]
作为sirna,化学合成具有下述序列的双链rna。n(182)11a具有与野生型n等位基因互补的序列。n(182)11g为使第11个核苷酸对应于g突变型n182等位基因的点突变的位置的sirna。n(182)11grevom(6-8)m5为下述sirna:使第11个核苷酸对应于a182突变型n等位基因的点突变的位置,并将向导链的5’末端的碱基由鸟嘌呤取代为尿嘧啶,将随从链的5’末端的碱基由腺嘌呤取代为鸟嘌呤,在向导链的第6个至第8个核糖核苷酸中将五碳糖的第2’位取代为och3,且使sirna的向导链的第5个碱基与g突变型182n等位基因的碱基不匹配的sirna。另外,下述序列中,将对应于点突变的位置的碱基对、向导链及随从链的5’末端的取代后的碱基对、及不匹配的碱基对用
□
包围,并将五碳糖的第2’位被取代为och3的核苷酸用阴影标记。
[0103]
n(182)11a:n(182)11g:n(182)11grevom(6-8)m5:图10中示出各sirna的基因表达抑制效果。
[0104]
对于n(182)11a,相较于g突变型n182等位基因的表达,其更加有效抑制野生型n182等位基因的表达,与之相反,对于n(182)11g,相较于野生型n182等位基因的表达,其更加有效抑制a突变型n182等位基因的表达。n(182)11arevom(6-8)m5对野生型等位基因的表达抑制能力消失,且对g突变型n182等位基因的表达抑制能力稍微弱,其结果,对g突变型182等位基因的特异性增高。
[0105]
[实施例1c]本实施例中示出:对于brca2基因的野生型等位基因与a1114c突变型等位基因(在cdna(gene id:675)中,第1114个碱基由a突变为c)、stk11基因的野生型等位基因与c1062g突变型等位基因(在cdna(gene id:6794)中,第1062个碱基由c突变为g)、pten基因的野生型等位基因与c388g突变型等位基因(在cdna(gene id:5728)中,第388个碱基由c突变为
g)、apc基因的野生型等位基因与c4348t突变型等位基因(在cdna(gene id:324)中,第4348个碱基由c突变为t)、gata2基因的野生型等位基因与c953t突变型等位基因(在cdna(gene id:2624)中,第953个碱基由c突变为t)、myd88基因的野生型等位基因与t818c突变型等位基因(在cdna(gene id:4615)中,第818个碱基由t突变为c)、gnaq基因的野生型等位基因与a626t突变型等位基因(在cdna(gene id:2776)中,第626个碱基由a突变为t)、idh1基因的野生型等位基因与g395a突变型等位基因(在cdna(gene id:3417)中,第395个碱基由g突变为a)各组,具有本发明公开的序列的sirna几乎不抑制来自野生型等位基因的表达,而强烈地抑制来自突变型等位基因的表达。
[0106]
首先,作为用于考察基因表达抑制效果的报告基因,化学合成具有与各等位基因相同的碱基序列的dna,并插入至表达载体(psicheck)的荧光素酶基因的3
’‑
utr,制作报告基因。将导入载体的部分的序列示于以下。
[0107]
brca2_wt报告基因:brca2_mut报告基因:stk11_wt报告基因:stk11_mut报告基因:pten_wt报告基因:pten_mut报告基因:apc_wt报告基因:apc_mut报告基因:gata2_wt报告基因:
gata2_mut报告基因:myd88_wt报告基因:myd88_mut报告基因:gnaq_wt报告基因:gnaq_wt报告基因:gnaq_mut报告基因:idh1_wt报告基因:idh1_mut报告基因:
[0108]
接着,作为sirna,化学合成具有下述序列的双链rna,并使用这些报告基因及sirna,以与实施例1a相同的方式进行报告基因检测。在图11中示出各自的结果。另外,作为对照的sirna,导入sibrca2_wt,将双链sirna所得到的测定值以sibrca2_wt所得到的测定值为100%的方式示于图11的图表。
[0109]
另外,下述序列中,wt为基于野生型基因的序列而制作的sirna。将对应于点突变的位置的碱基对、向导链及随从链的5’末端的取代后的碱基对、及不匹配的碱基对用
□
包围,并将五碳糖的第2’位被取代为och3的核苷酸用阴影标记。
[0110]
sibrca2_wt:sibrca2_mut:sistk11_wt:sistk11_mut:
sipten_wt:sipten_mut:siapc_wt:siapc_mut:sigata2_wt:sigata2_mut:simyd88_wt:simyd88_mut:signaq_wt:signaq_mut:siidh1_wt:siidh1_mut:
[0111]
由图11的图表可知,对应于野生型序列的sirna抑制来自野生型等位基因及突变型等位基因的表达,而本说明书中公开的sirna几乎不抑制来自野生型等位基因的表达且强烈地抑制来自突变型等位基因的表达。实施例2
[0112]
本实施例中示出:在培养细胞中,对于来自外源性的报告基因的表达特异性抑制来自突变型等位基因的表达的sirna即便对内源性基因的表达也具有同样的特异性。
[0113]
首先,将均为来自胰腺癌的细胞株的、bxpc-3(第35个碱基为g/g:野生型纯合)、aspc-1(第35个碱基为a/a:a型突变纯合)、及panc-1(第35个碱基为g/a:a型突变杂合)的各细胞进行粘附培养,使用lipofectamine rnaimax(thermo fisher scientific公司),以及sigy441(阴性对照)、sikras-62(阳性对照:抑制所有的k-ras的mrna的sirna)、sikras-wt(对野生型k-ras表现出特异性的sirna)及sikras-a(对a突变型表现出特异性的sirna:k(35)11arevom(6-8)m6),以各50nm的浓度进行一天一次的转染,并连续进行3天。在第3次转染的第二天,从一部分细胞中分离mrna,通过逆转录反应制作cdna,利用定量pcr法,将k-ras的mrna定量。对于各细胞,将sigy441的表达量设为100,将导入各sirna时的表达量以相对值的形式进行表示。将其结果示于图12。
[0114]
将本实施例中使用的碱基序列记载于以下。下述序列中,wt为基于野生型基因的序列而制作的sirna。将对应于点突变的位置的碱基对、向导链及随从链的5’末端的取代后的碱基对、及不匹配的碱基对用
□
包围,并将五碳糖的第2’位被取代为och3的核苷酸用阴影标记。
[0115]
sigy441:sikras-62:sikras-wt:sikras-a(k(35)11arevom(6-8)m6):
[0116]
如图表所示,对于为野生型纯合的bxpc-3,sikras-62与sikras-wt强烈地抑制了表达,对于为a型突变纯合的aspc-1,sikras-62与sikras-a强烈地抑制了表达,对于为a突变杂合的panc-1,sikras-62强烈地抑制了表达,sikras-wt与sikras-a较弱地抑制了表达,即便对于内源性基因,各细胞的基因型与各sirna的特异性也是相对应的。如此,各sirna能够以与报告基因这种外源性的基因表达相同的特异性对内源性的基因表达进行表达抑制。实施例3
[0117]
本实施例中示出:sikras-a能够在离体下抑制肿瘤细胞的增殖。在3只裸鼠(balb/cajcl-foxn1
null
)的皮下在5-6处各移植1.0
×
106个aspc-1细胞,并用游标卡尺每周测量2次肿瘤的体积,由此评价肿瘤的增殖能力。与移植第3天相比,移植后第10天的肿瘤大小增加至2倍左右,因此判断进入了增殖期,从移植后第11天起每隔1周,使用27g的注射针对各肿瘤直接给予5μg的sirna(sicont、sikras-wt或sikras-a)与作为转染试剂的in vivo jet pei(polyplus transfection公司)的混合液。另外,对每1个个体仅给予1种sirna。将结果以图表的形式示于图13。相较于sicont或sikras-wt的给予组,给予了sikras-a的组的肿瘤大小在移植后第24天以后显著变小。如此,对于k-ras突变依赖性增殖的细胞,sikras-a能够抑制其增殖。工业实用性
[0118]
通过本发明,能够提供一种新型的rna分子、新型的嵌合体型na分子、新型的双链rna分子及新型的双链嵌合体型na分子。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
