具有mmp2抑制作用的多肽
技术领域
1.本发明涉及具有抑制基质金属蛋白酶2(以下,适当地简称为“mmp2”)作用的被取代的多肽化合物。
背景技术:
2.基质金属蛋白酶是以锌为活性中心的内肽酶,已知有24种基因。由于mmp降解胶原或明胶等细胞外基质,因此不仅参与骨重塑或伤口愈合等生理现象,还参与炎症或癌症的进展等的病理过程(参照非专利文献1)。
3.至今为止,关注到基于mmp抑制的抗癌作用,尽管已经实施了多个mmp抑制剂的临床试验,但由于被认为是对于各种mmp亚型相对地非选择性的抑制作用的原因的骨骼肌疼痛等的副作用或促进癌转移的可能性而被放弃(参照非专利文献2和3)。
4.有报道称mmp2的活化在癌细胞的浸润以及转移中发挥重要的作用。癌细胞的浸润和转移是影响恶性肿瘤预后的重要因素,抑制mmp2活性在控制癌症中可成为有效的治疗手段。有报道称在mmp2基因缺陷动物中,癌症的増殖得到抑制,mmp2在癌症的増殖中发挥重要的作用(参照非专利文献4)。而且,据报道在乳腺癌、胰腺癌、膀胱癌、大肠癌、卵巢癌、前列腺癌、脑肿瘤、胃癌、肝细胞癌、头颈部癌、黑色素瘤、子宫癌、食道癌、肾细胞癌、肺癌、神经胶质瘤等各种癌症患者中mmp2与病态进展相关联(参照非专利文献5和6)。另一方面,据报道mmp2在非肿瘤性疾病中也参与了它们的病态形成。
5.据报道在慢性肾病中,mmp2通过改变肾小管基底膜结构而引起肾小管的上皮间质转化,从而诱发肾小管萎缩、纤维化以及肾功能下降(参照非专利文献7)。而且,在慢性肾病患者中,观察到血液中的mmp2浓度上升(参照非专利文献8和9)。另外,据报道在mmp2基因缺陷动物中因单侧输尿管结扎而诱导的肾脏纤维化得到抑制(参照非专利文献10和11)。因此,抑制mmp2活性以控制慢性肾病的病态进展可成为有效的治疗手段。
6.在特发性肺纤维化中,观察到在肺胞上皮细胞、成纤维细胞和巨噬细胞中mmp2的表达亢进,特别是在伴有快速进展的特发性肺纤维化患者中,观察到肺胞灌洗液中的mmp2的表达亢进(参照非专利文献12和13)。另外,据报道,非选择性mmp抑制剂具有使博莱霉素诱发肺纤维化小鼠的肺中胶原含量降低的效果(参照非专利文献14)或具有抑制由tgfβ诱发的肺实质成纤维细胞的转化的效果(参照非专利文献15)。因此,抑制mmp2活性以控制特发性肺纤维化的病态进展可成为有效的治疗手段。
7.而且,在多发性硬化症、脑梗塞、动脉硬化、腹主动脉瘤、腹膜硬化症、心肌梗塞、急性肾功能障碍、糖尿病性肾病、肾硬化症、肾小球肾炎、多发性肾囊肿、多发性肝囊肿、酒精性肝病、非酒精性脂肪肝、胆汁淤积性肝损伤、慢性阻塞性肺病、间质性肺炎、糖尿病视网膜病变、老年性黄斑变性、干燥综合征(sjogren's syndrome)、脑膜炎、肌营养不良症、硬皮病、炎症性肠病、结核等非肿瘤性疾病中,暗示与mmp2的相关联(参照非专利文献16)。
8.从这些事实来看,寻找选择性地抑制mmp2的手段是建立mmp2相关疾病的有效治疗法的可行性高的方法。
9.那么,作为具有mmp2抑制作用的低分子化合物,有将羟肟酸或羧酸作为锌螯合剂而导入的化合物的报道。然而,显示选择性mmp2抑制作用的情况尚属未知(例如,参照非专利文献17和18)。
10.另外,据报道由10个天然氨基酸构成的肽化合物“β-淀粉样前体蛋白(app-ip、ile-ser-tyr-gly-asn-asp-ala-leu-met-pro)”显示选择性mmp2抑制作用(参照非专利文献19)。然而,通常已知由于肽化合物在体内迅速代谢、排泄,因此即使给予肽化合物,也不能维持所期待的药理作用。
11.现有技术文献
12.非专利文献
13.非专利文献1:h.j.ra and w.c.parks matrix biol.,2007,26(8),587-596;
14.非专利文献2:a.h.drummond等人.ann n y acad sci.,1999,878,228-235;
15.非专利文献3:a.d.baxter等人.bioorg med chem lett.,2001,11,1465-1468;
16.非专利文献4:t.itoh等人.cancer res.,1998,58,1048-1051;
17.非专利文献5:r.roy等人.j clin oncol.,2009,27,5287-5297;
18.非专利文献6:t.turpeenniemi-hujanen biochimie.,2005,87,287-297;
19.非专利文献7:s.cheng等人.faseb j.,2006,20,1898-1900;
20.非专利文献8:k.pawlak等人.clin biochem.,2011,44,838-843;
21.非专利文献9:h.r.chang等人.clin chim acta.,2006,366,243-248;
22.非专利文献10:x.du等人.lab invest.,2012,92,1149-1160;
23.非专利文献11:m.k.tveitaras等人.plos one.,2015,10,e0143390;
24.非专利文献12:m.selman等人.am j physiol lung cell mol physiol.,2000,279,l562-l574;
25.非专利文献13:m.suga等人.am j respir crit care med.,2000,162,1949-1956;
26.非专利文献14:m.corbel等人.j pathol.,2001,193,538-545;
27.非专利文献15:j.michael等人.am j respir cell mol biol.,2009,41,731-741;
28.非专利文献16:a.tokito等人.int j mol sci.,2016,17,e1178;
29.非专利文献17:d.e.levy等人.j med chem.,1998,41,199-223;
30.非专利文献18:y.tamura等人.j med chem.,1998,41,640-649;
31.非专利文献19:s.higashi等人.j biol chem.,2003,278,14020-14028。
技术实现要素:
32.发明所要解决的课题
33.本发明的目的在于提供新型的mmp2抑制剂。
34.用于解决课题的手段
35.本发明人为了实现上述课题而进行深入研究的结果,发现了由下述式[i']表示的化合物(以下,有时也记载为化合物[i'])具有抑制mmp2的作用。
[0036]
以下,对本发明进行详细地说明。
[0037]
即,本发明的方案如下所示。
[0038]
(1)作为本发明的一个方案,提供由下述式[i']表示的被取代的多肽或其制药学上可接受的盐,
[0039][0040]
(上述式[i']中,
[0041]
aa1表示:
[0042]
asp、
[0043]
β-asp、β-(d)-asp、γ-glu、或γ-(d)-glu,
[0044]
aa2表示选自下述的1个基团:
[0045]
ala、
[0046]
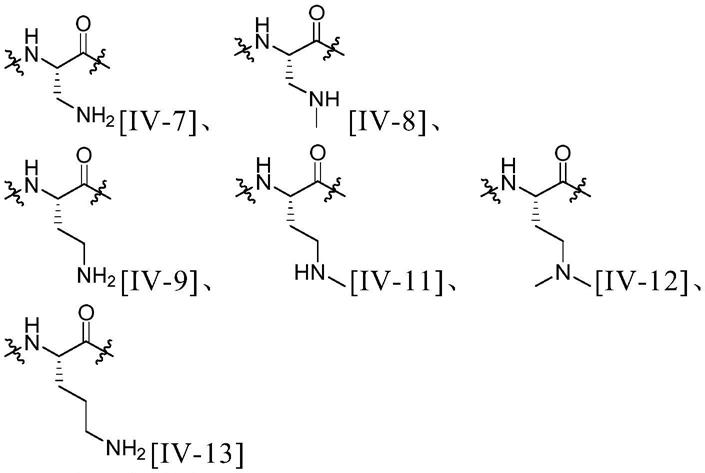
由下述式[iv-7]、[iv-8]、[iv-9]、[iv-11]、[iv-12]、[iv-13]
[0047][0048]
表示的基团、
[0049]
由下述式[iv-27]
[0050][0051]
表示的基团、
[0052]
pro、由下述式[ii-1]和[ii-2]
[0053][0054]
表示的基团,
[0055]
在此,r
aa2
表示羟基或氨基,
[0056]
另外,aa1和aa2可一起形成由下述式[iv-32]
[0057][0058]
表示的结构,
[0059]
aa3表示选自下述的1个基团:
[0060]
val、leu、ile、由下述式[iv-2]
[0061][0062]
表示的基团、
[0063]
phe、trp、
[0064]
tyr、lys、由下述式[iv-3]、[iv-4]、[iv-5]
[0065][0066]
表示的基团、和
[0067]
由下述式[iv-9]
[0068][0069]
表示的基团,
[0070]
aa4表示选自下述的1个基团:
[0071]
单键、
[0072]
gly、(d)-ala、(n-me)ala、(n-me)val、(n-me)leu、(n-me)ile、
[0073]
pro、(d)-pro、
[0074]
(n-me)phe、(d)-phe、
[0075]
(n-me)tyr、(d)-tyr、
[0076]
(n-me)ser、(d)-ser、homoser、(d)-thr、
[0077]
met、(n-me)met、
[0078]
(n-me)asp、glu、(n-me)glu、(d)-(n-me)glu、homoglu、
[0079]
(n-me)asn、
[0080]
(n-me)arg、(d)-arg、
[0081]
由下述式[iv-7]、[iv-9]、[iv-13]
[0082][0083]
表示的基团、
[0084]
lys、和(n-me)lys,
[0085]
在此,在aa4表示lys的情况下,
[0086]
该lys的侧链的氨基可被末端被羧基取代的c
2-16
烷基羰基取代,
[0087]
aa5表示选自下述的1个基团:
[0088]
单键、
[0089]
ala、由下述式[iv-1]
[0090][0091]
表示的基团、
[0092]
由下述式[iv-27]、[iv-28]、[iv-29]
[0093][0094]
表示的基团、
[0095]
pro、(d)-pro、β-homopro、homopro、由下述式[ii-1’]
[0096][0097]
表示的基团,
[0098]
phe、his、
[0099]
thr、
[0100]
arg、(d)-arg、
[0101]
由下述式[iv-7]、[iv-9]、[iv-13]
[0102]
[0103]
表示的基团、
[0104]
lys、(d)-lys、
[0105]
β-ala、(n-me)-β-ala、gaba、ape、acp、
[0106]
由下述式[iii-6]~[iii-13]
[0107][0108]
表示的基团、
[0109]
由下述式[iv-25]和[iv-26]
[0110][0111]
表示的基团,
[0112]
w1表示-l
1-或-l1’‑
l1”‑
,
[0113]
l1表示单键,
[0114]
l1’
表示选自下述的1个基团:
[0115]
单键、
[0116]
β-ala、gaba、(n-me)gaba、ape、acp、
[0117]
由下述式[iii-6]~[iii-13]
[0118][0119]
表示的基团、
[0120]
由下述式[iv-23]和[iv-24]
[0121][0122]
表示的基团,
[0123]
l
1”表示选自下述的1个基团:
[0124]
单键、
[0125]
gly、(n-me)gly、
[0126]
ala、(n-me)ala、(d)-ala、val、(n-me)val、(n-me)leu、(n-me)ile、
[0127]
由下述式[iv-27]
[0128][0129]
表示的基团、
[0130]
pro、(d)-pro、homopro、phe、(n-me)phe、(d)-phe、
[0131]
his、(d)-his、trp、(n-me)trp、(d)-trp、
[0132]
tyr、(n-me)tyr、(d)-tyr、
[0133]
(d)-ser、homoser、thr、(n-me)thr、(d)-thr、
[0134]
cys、(d)-cys、met、(n-me)met、
[0135]
(n-me)asp、glu、(n-me)glu、(d)-glu、
[0136]
asn、(n-me)asn、(d)-asn、gln、(n-me)gln、(d)-gln、
[0137]
arg、(n-me)arg、(d)-arg、cit、(d)-cit、
[0138]
由下述式[iv-7]、[iv-9]、[iv-10]、[iv-13]
[0139][0140]
表示的基团、
[0141]
lys、(n-me)lys、(d)-lys、由下述式[iv-14]
[0142][0143]
表示的基团、
[0144]
β-ala、
[0145]
β-asp、β-(d)-asp、
[0146]
由下述式[iii-6]和[iii-7]
[0147][0148]
表示的基团,
[0149]
在此,在l
1”表示lys或(d)-lys的情况下,
[0150]
该lys和(d)-lys的侧链的氨基可被由下述式[vii-1]表示的基团取代,
[0151]
fa
n-aa
n5-aa
n4-aa
n3-aa
n2-aa
n1
‑ꢀꢀ
[vii-1]
[0152]
所述式[vii-1]中,
[0153]
fan表示末端被羧基取代的c
2-16
烷基羰基,
[0154]
aa
n5
表示:
[0155]
单键、
[0156]
arg、(d)-arg、
[0157]
lys、(d)-lys、
[0158]
γ-glu、或
[0159]
由下述式[iv-24]
[0160][0161]
表示的基团,
[0162]
aa
n4
表示:
[0163]
单键、
[0164]
arg、(d)-arg、
[0165]
lys、(d)-lys、或
[0166]
由下述式[iv-24]
[0167][0168]
表示的基团,
[0169]
aa
n3
表示:
[0170]
单键、
[0171]
arg、(d)-arg、
[0172]
lys、(d)-lys、
[0173]
γ-glu、或
[0174]
由下述式[iv-24]
[0175][0176]
表示的基团,
[0177]
aa
n2
表示单键、或(d)-lys,
[0178]
aa
n1
表示单键、或(d)-lys,
[0179]
另外,在l
1”由glu表示的情况下、且aa3由lys表示的情况下,
[0180]
如下述式[i'-α]所示,由所述式[i']表示的化合物可与l3一起形成环状结构,所述l3分别与该2个氨基酸的侧链的官能团键合,
[0181]
此时,该l3表示gly、β-ala、或gaba,
[0182][0183]
l
n1
表示式-c(=o)-或式-s(=o)
2-,
[0184]
l
n2
表示:单键、
[0185]c1-3
烷烃二基、
[0186]c2-3
烯烃二基、
[0187]
乙炔二基、
[0188]
式-o-、
[0189]
式-c(=o)-、式-c(=o)-nh-、或
[0190]
三唑二基,
[0191]
l2表示单键,
[0192]
环a表示芳香环或杂芳香环,
[0193]ra1
、r
a2
独立表示:氢原子、
[0194]
卤素原子、
[0195]c1-6
烷基、或
[0196]c1-6
烷氧基,
[0197]
环b表示芳基或杂芳基,
[0198]rb1
、r
b2
、r
b3
独立表示:
[0199]
氢原子、
[0200]
氨基甲酰基、
[0201]
氰基、
[0202]
卤素原子、
[0203]c1-6
烷基(该c
1-6
烷基可被1个羟基取代)、卤代c
1-6
烷基、
[0204]c1-6
烷氧基(该c
1-6
烷氧基可被1个羟基取代)、卤代c
1-6
烷氧基、
[0205]c1-6
烷基羰基、
[0206]c1-6
烷基羰基氨基、
[0207]
单c
1-6
烷基氨基羰基、二c
1-6
烷基氨基羰基(该单c
1-6
烷基氨基羰基和二c
1-6
烷基氨基羰基中的烷基可被选自羟基、羧基、氨基甲酰基、和氨基的1个基团取代)、
[0208]c1-6
烷基磺酰基、或
[0209]
芳基,
[0210]
wc为单键或由1~3个氨基酸构成的接头,
[0211]
在此,形成该接头的1~3个氨基酸分别相同或不同地选自下述的基团:
[0212]
gly、
[0213]
pro、
[0214]
arg、(d)-arg、
[0215]
lys、(d)-lys、
[0216]
β-ala、gaba、和ape,
[0217]
在此,在由wc表示的基团中包含lys或(d)-lys的情况下,
[0218]
该lys和(d)-lys的侧链的氨基可被末端被羧基取代的c
2-16
烷基羰基、lys(该lys的侧链的氨基可被末端被羧基取代的c
2-16
烷基羰基取代)、或(d)-lys(该(d)-lys的侧链的氨基可被末端被羧基取代的c
2-16
烷基羰基取代)取代,
[0219]
rc为:
[0220]
式-oh、式-nh2、
[0221]c1-6
烷基氨基(该c
1-6
烷基氨基的c
1-6
烷基可被选自下述的1个基团取代:羟基、氨基、c
1-6
烷氧基、和包含1个氮原子、还可包含1个杂原子的4~7元的饱和杂环基)、或
[0222]
包含1个氮原子、还可包含1个杂原子的4~7元的饱和杂环基(该包含1个氮原子、还可包含1个杂原子的4~7元的饱和杂环基可被选自下述的1个基团取代:羟基、氨基、和c
1-6
烷基(该c
1-6
烷基可被1个氨基甲酰基取代),而且,该包含1个氮原子、还可包含1个杂原子的4~7元的饱和杂环基中的2个碳原子可通过c
1-4
烷烃二基进行交联))。
[0223]
(2)作为本发明的其他方案,提供(1)所述的被取代的多肽或其制药学上可接受的盐,其中,
[0224]
wc为:
[0225]
单键、
[0226]
pro、
[0227]
arg、(d)-arg、
[0228]
lys、(d)-lys、
[0229]
β-ala、gaba、ape、
[0230]
gly-(d)-lys、gly-(d)-lys-(d)-lys、gly-(d)-lys-(d)-arg、gly-(d)-arg-(d)-lys、
[0231]
lys-lys、(d)-lys-(d)-lys、(d)-lys-(d)-lys-(d)-lys、
[0232]
arg-arg、(d)-arg-(d)-arg、(d)-arg-(d)-lys、
[0233]
lys-(d)-lys-(d)-lys、(d)-lys-lys-(d)-lys、(d)-lys-(d)-lys-lys、
[0234]
β-ala-(d)-lys、β-ala-(d)-lys-(d)-arg、β-ala-(d)-arg-(d)-lys、或β-ala-(d)-arg-(d)-arg,
[0235]
在此,在由wc表示的基团中包含lys的情况下,
[0236]
该lys的侧链的氨基可被末端被羧基取代的c
2-16
烷基羰基或(d)-lys(该(d)-lys的侧链的氨基可被末端被羧基取代的c
2-16
烷基羰基取代)取代。
[0237]
(3)作为本发明的其他方案,提供(1)或(2)所述的被取代的多肽或其制药学上可接受的盐,其中,
[0238]
环a为苯环、噻吩环、或吡啶环,
[0239]ra1
、r
a2
独立为氢原子、或卤素原子,
[0240]
环b为苯基、噁唑基、噻二唑基、吡啶基、或苯并呋喃基,
[0241]rb1
、r
b2
、r
b3
独立为:
[0242]
氢原子、
[0243]
氨基甲酰基、
[0244]
氰基、
[0245]
卤素原子、
[0246]c1-6
烷基(该c
1-6
烷基可被1个羟基取代)、卤代c
1-6
烷基、
[0247]c1-6
烷氧基(该c
1-6
烷氧基可被1个羟基取代)、卤代c
1-6
烷氧基、
[0248]c1-6
烷基羰基、
[0249]
单c
1-6
烷基氨基羰基、二c
1-6
烷基氨基羰基(该单c
1-6
烷基氨基羰基和二c
1-6
烷基氨基羰基中的烷基可被选自羟基、羧基、氨基甲酰基、和氨基的1个基团取代)、或
[0250]c1-6
烷基磺酰基,
[0251]
rc为:
[0252]
式-oh、式-nh2、
[0253]c1-6
烷基氨基(该c
1-6
烷基氨基的c
1-6
烷基可被选自羟基、氨基、c
1-6
烷氧基、和吗啉基的1个基团取代)、
[0254]
氮杂环丁烷基、吡咯烷基、哌啶基、吗啉基、或哌嗪基(该氮杂环丁烷基、吡咯烷基、哌啶基、吗啉基、和哌嗪基可被选自羟基、氨基、和c
1-6
烷基(该c
1-6
烷基可被1个氨基甲酰基取代)的1个基团取代,而且,该氮杂环丁烷基、吡咯烷基、哌啶基、吗啉基、和哌嗪基中的2个碳原子可通过c
1-4
烷烃二基进行交联)。
[0255]
(4)作为本发明的其他方案,提供(1)~(3)中任一项所述的被取代的多肽或其制药学上可接受的盐,其中,在由所述式[i']表示的被取代的多肽中,
[0256]
环a为苯环,
[0257]
环b为苯基,
[0258]
l
1”为选自下述的1个基团:
[0259]
单键、
[0260]
gly、(n-me)gly、
[0261]
ala、(n-me)ala、(d)-ala、val、(n-me)val、(n-me)leu、(n-me)ile、
[0262]
由下述式[iv-27]
[0263][0264]
表示的基团、
[0265]
pro、(d)-pro、homopro、phe、(n-me)phe、(d)-phe、
[0266]
his、(d)-his、trp、(n-me)trp、(d)-trp、
[0267]
tyr、(n-me)tyr、(d)-tyr、
[0268]
(d)-ser、homoser、thr、(n-me)thr、(d)-thr、
[0269]
cys、(d)-cys、met、(n-me)met、
[0270]
(n-me)asp、glu、(n-me)glu、(d)-glu、
[0271]
asn、(n-me)asn、(d)-asn、gln、(n-me)gln、(d)-gln、
[0272]
arg、(n-me)arg、(d)-arg、cit、(d)-cit、
[0273]
由下述式[iv-7]、[iv-9]、[iv-10]、[iv-13]
[0274][0275][0276]
表示的基团、
[0277]
lys、(n-me)lys、(d)-lys、由下述式[iv-14]
[0278]
[0279]
表示的基团、
[0280]
β-ala、
[0281]
β-asp、β-(d)-asp、
[0282]
由下述式[iii-6]和[iii-7]
[0283][0284]
表示的基团,
[0285]
wc为:
[0286]
单键、
[0287]
pro、
[0288]
arg、(d)-arg、
[0289]
lys、(d)-lys、
[0290]
β-ala、gaba、ape、
[0291]
gly-(d)-lys、gly-(d)-lys-(d)-lys、gly-(d)-lys-(d)-arg、gly-(d)-arg-(d)-lys、
[0292]
lys-lys、(d)-lys-(d)-lys、(d)-lys-(d)-lys-(d)-lys、
[0293]
arg-arg、(d)-arg-(d)-arg、(d)-arg-(d)-lys、
[0294]
lys-(d)-lys-(d)-lys、(d)-lys-lys-(d)-lys、(d)-lys-(d)-lys-lys、
[0295]
β-ala-(d)-lys、β-ala-(d)-lys-(d)-arg、β-ala-(d)-arg-(d)-lys、或β-ala-(d)-arg-(d)-arg。
[0296]
(5)作为本发明的其他方案,提供(1)~(4)中任一项所述的被取代的多肽或其制药学上可接受的盐,其中,在由所述式[i']表示的被取代的多肽中,
[0297]
aa2为选自下述的1个基团:
[0298]
由下述式[ii-1]
[0299][0300]
表示的基团,
[0301]
由下述式[iv-7]、[iv-8]、[iv-9]、[iv-11]、和[iv-12]
[0302][0303]
表示的基团,
[0304]
在此,r
aa2
为氨基,
[0305]
aa3为val、leu、ile、phe、或trp,
[0306]
aa4为(n-me)val、(n-me)leu、(n-me)ile、(n-me)asp、或(n-me)glu,
[0307]
aa5为β-ala、gaba、ape、acp、pro、(d)-pro、或β-homopro,
[0308]
wc为单键、arg、(d)-arg、lys、或(d)-lys,
[0309]
rc为式-oh或式-nh2。
[0310]
(6)作为本发明的其他方案,提供(1)~(5)中任一项所述的被取代的多肽或其制药学上可接受的盐,其中,在由所述式[i']表示的被取代的多肽中,
[0311]
w1为-l1’‑
l1”‑
,
[0312]
l2为单键,
[0313]
aa1为asp,
[0314]
l1’
为选自下述的1个基团:
[0315]
β-ala、gaba、ape、acp、由下述式[iv-23]和[iv-24]
[0316][0317]
表示的基团,
[0318]
l
1”为单键、asn、(d)-ser、(d)-thr、或glu,
[0319]
l
n1
为式-c(=o)-或式-s(=o)
2-,
[0320]
l
n2
为式-o-或式-c(=o)-nh-,
[0321]ra1
、r
a2
分别为氢原子,
[0322]rb1
、r
b2
、r
b3
独立为氢原子、氨基甲酰基、卤素原子、c
1-6
烷氧基、或卤代c
1-6
烷氧基。
[0323]
(7)作为本发明的其他方案,提供(1)~(5)中任一项所述的被取代的多肽或其制药学上可接受的盐,其中,在由所述式[i']表示的被取代的多肽中,
[0324]
w1为-l
1-,在此,l1为单键,
[0325]
l2为单键,
[0326]
aa1为β-asp、β-(d)-asp、γ-glu、或γ-(d)-glu,
[0327]
aa2为选自下述的1个基团:
[0328]
由下述式[ii-1]
[0329][0330]
表示的基团、
[0331]
由下述式[iv-7]、[iv-8]、[iv-9]、[iv-11]、和[iv-12]
[0332][0333]
表示的基团,
[0334]
在此,r
aa2
为氨基,
[0335]
aa3为val、leu、ile、phe、或trp,
[0336]
aa4为(n-me)val、(n-me)leu、(n-me)ile、(n-me)asp、或(n-me)glu,
[0337]
aa5为β-ala、gaba、ape、acp、或β-homopro,
[0338]
l
n1
为式-c(=o)-、或式-s(=o)
2-,
[0339]
l
n2
为单键、式-o-、或式-c(=o)-nh-,
[0340]ra1
、r
a2
分别为氢原子,
[0341]rb1
、r
b2
、r
b3
独立为氢原子、氨基甲酰基、卤素原子、c
1-6
烷氧基、或卤代c
1-6
烷氧基。
[0342]
(8)作为本发明的其他方案,提供(1)~(4)中任一项所述的被取代的多肽或其制药学上可接受的盐,其中,由所述式[i']表示的被取代的多肽为由下述式[i]表示的被取代的多肽,
[0343][0344]
上述式[i]中,
[0345]
aa1为β-asp、γ-glu、或γ-(d)-glu,
[0346]
aa2为由下述式[ii-1]或式[ii-2]
[0347][0348]
表示的基团,
[0349]
在此,r
aa2
为羟基或氨基,
[0350]
aa3为val、leu、ile、phe、或trp,
[0351]
aa4为单键、pro、(n-me)ala、(n-me)val、(n-me)leu、(n-me)ile、(n-me)phe、(n-me)tyr、(n-me)ser、(n-me)asp、或(n-me)glu,
[0352]
aa5为单键、pro、(d)-pro、β-homopro、arg、(d)-arg、lys、(d)-lys、β-ala、gaba、ape、或acp,
[0353]
l1为单键,
[0354]
l2为单键,
[0355]
l
n1
为式-c(=o)-、或式-s(=o)
2-,
[0356]
l
n2
为单键、c
1-3
烷烃二基、式-o-、或式-c(=o)-nh-,
[0357]
ra为氢原子、卤素原子、c
1-6
烷基、或c
1-6
烷氧基,
[0358]
rb为氢原子、氨基甲酰基、卤素原子、c
1-6
烷基、或c
1-6
烷氧基,
[0359]
lc为单键、pro、arg、(d)-arg、lys、(d)-lys、或(d)-lys-(d)-ly s,
[0360]
rc为式-oh、或式-nh2。
[0361]
(9)作为本发明的其他方案,提供(1)~(5)中任一项所述的被取代的多肽或其制药学上可接受的盐,其中,在由所述式[i']表示的被取代的多肽中,
[0362]
aa1为asp、β-(d)-asp、或γ-(d)-glu,
[0363]
aa2为选自下述的1个基团:
[0364]
由下述式[ii-1]
[0365][0366]
表示的基团、
[0367]
由下述式[iv-7]和[iv-9]
[0368][0369]
表示的基团,
[0370]
在此,r
aa2
为氨基,
[0371]
aa3为val、leu、或ile,
[0372]
aa4为(n-me)ile、或(n-me)glu,
[0373]
aa5为ape、或β-homopro,
[0374]
w1为-l
1-、或-l1’‑
l1”‑
,
[0375]
在此,l1为单键,
[0376]
l1’
为gaba、或ape,
[0377]
l
1”为asn、(d)-ser、(d)-thr、或glu,
[0378]
l
n1
为式-c(=o)-、或式-s(=o)
2-,
[0379]
l
n2
为式-o-、或式-c(=o)-nh-,
[0380]ra1
、r
a2
分别为氢原子,
[0381]rb1
、r
b2
、r
b3
独立为氢原子、氨基甲酰基、卤素原子、c
1-6
烷氧基、或卤代c
1-6
烷氧基,
[0382]
wc为单键、或(d)-lys,
[0383]
rc为式-nh2。
[0384]
(10)作为本发明的其他方案,提供(1)~(5)中任一项所述的被取代的多肽或其制药学上可接受的盐,其选自以下所示的化合物:
[0385]
[0386]
[0387][0388]
(11)作为本发明的其他方案,提供含有(1)~(10)中任一项所述的被取代的多肽或其制药学上可接受的盐作为有效成分的药物。
[0389]
(12)作为本发明的其他方案,提供含有(1)~(10)中任一项所述的被取代的多肽或其制药学上可接受的盐作为有效成分的mmp2抑制剂。
[0390]
(13)作为本发明的其他方案,提供含有(1)~(10)中任一项所述的被取代的多肽或其制药学上可接受的盐作为有效成分的癌细胞的増殖、浸润、或转移的抑制剂。
[0391]
(14)作为本发明的其他方案,提供含有(1)~(10)中任一项所述的被取代的多肽或其制药学上可接受的盐作为有效成分的纤维化抑制剂。
[0392]
(15)作为本发明的其他方案,提供含有(1)~(10)中任一项所述的被取代的多肽或其制药学上可接受的盐作为有效成分的癌疾病或器官纤维化、或与癌疾病或器官纤维化相关联的症状的预防药或治疗药。
[0393]
发明效果
[0394]
本发明的化合物(以下,也记载为“本发明化合物”)具有抑制mmp2的作用。另外,在本发明化合物之中,也包含具有选择性抑制mmp2作用的化合物。
具体实施方式
[0395]
本发明提供具有抑制mmp2作用的由所述式[i']表示的被取代的多肽或其制药学上可接受的盐。
[0396]
以下,对本发明的化合物进一步进行详细地说明,但本发明不限于所示例的化合物。
[0397]
本说明书中,“氨基酸”广义上是指,具有氨基和羧基两者的官能团的有机化合物。另一方面,狭义上(特别是在生物化学领域)是指,成为生物体的蛋白质的构成单元的“α-氨基酸”(该α-氨基酸是指,氨基也键合到羧基所键合的碳(α碳)上的氨基酸)。
[0398]
作为本说明书中的氨基酸,例如可举出:天然蛋白原性l-氨基酸;天然非蛋白原性氨基酸;非天然氨基酸。在此,作为非天然氨基酸,可举出:天然蛋白原性l-氨基酸的d型;氨基酸变异体和衍生物等化学修饰的氨基酸;和具有作为氨基酸特征的本领域中已知特性的化学合成的化合物等。
[0399]
本说明书中,在将“氨基酸”不缩写成例如3字母表示或1字母表示等而记载其名称的情况下,表示l型或d型、或包含该两者的氨基酸。
[0400]
本说明书中,在将“氨基酸”通过3字母表示或1字母表示等缩写而记载的情况下,表示l型的氨基酸。在某种情况下,也在“氨基酸”之前附加“l”或“l”以明确为l型氨基酸。
[0401]
本说明书中,在“氨基酸”之前附加“d”或“d”的情况下,表示d型氨基酸。
[0402]
本说明书中,“天然蛋白原性l-氨基酸”是指,构成蛋白质的天然存在的l型氨基酸,例如可举出:gly或ala、val、leu、ile、pro、phe、his、trp、tyr、ser、thr、met、cys、asp、glu、asn、gln、lys、arg等。
[0403]
本说明书中,“天然蛋白原性l-氨基酸的d型”是指,所述的天然蛋白原性l-氨基酸的对映体。甘氨酸以外的天然蛋白原性l-氨基酸具有至少1个不对称碳且为光学活性。根据甘油醛的l型、d型的结构,这些氨基酸的结构有别于l型、d型。
[0404]
需要说明的是,在天然蛋白原性l-氨基酸以外的氨基酸中也可存在d型氨基酸。
[0405]
本说明书中,“天然非蛋白原性氨基酸”是指,不构成蛋白质的天然存在的氨基酸,例如可举出:l-正亮氨酸(以下,也记载为nle;需要说明的是,以下,本说明书中“括弧内的一并记载”表示缩写)或β-丙氨酸(β-ala)、l-鸟氨酸(orn)。
[0406]
需要说明的是,在天然非蛋白原性氨基酸具有不对称碳的情况下,该氨基酸中存在l型和d型。另外,在天然非蛋白原性氨基酸以外的氨基酸中也可存在l型和d型。
[0407]
本说明书中,“非天然氨基酸”是指,不构成蛋白质、主要是人工制造的氨基酸,是
指所述的“天然蛋白原性l-氨基酸和天然非蛋白原性氨基酸”以外的氨基酸。作为非天然氨基酸,例如可举出:天然蛋白原性l-氨基酸的d型(d-cys、d-ser等);α-甲基氨基酸(2-氨基异丁酸(aib)等);侧链中具有过量亚甲基的氨基酸(l-β-高脯氨酸(β-hep或β-homopro)、l-高丝氨酸(hes或homoser)、l-高半胱氨酸(hec或homocys)、l-高脯氨酸(homopro)、l-高谷氨酸(homoglu)等“高”氨基酸);侧链中的羧酸官能团氨基酸被磺酸基取代的氨基酸(l-半胱氨酸等);氨基酸变异体和衍生物等化学修饰的氨基酸(羟脯氨酸、l-2,3-二氨基丙酸(dap)、l-2,4-二氨基丁酸(dab)、n-甲基甘氨酸等);和具有作为氨基酸特征的本领域中已知特性的化学合成的化合物(4-氨基苯甲酸等)。
[0408]
需要说明的是,在非天然氨基酸具有不对称碳的情况下,该氨基酸中存在l型和d型。
[0409]
作为本说明书中的“非天然氨基酸”的具体例,例如可举出:以下的例子。
[0410]
·
(d)-pro、(d)-ser、(d)-thr、(d)-asp、(d)-glu、(d)-arg、(d)-lys;
[0411]
·
β-homopro;
[0412]
·
β-ala、gaba、ape、acp;
[0413]
·
(n-me)ala、(n-me)val、(n-me)leu、(n-me)ile、(n-me)phe、(n-me)tyr、(n-me)ser、(n-me)asp、(n-me)glu;
[0414]
·
由下述式[ii-1]或式[ii-2]
[0415][0416]
表示的基团(在此,r
aa2
为羟基或氨基);
[0417]
·
后述的表1和表2中记载的氨基酸。
[0418]
需要说明的是,本说明书中的参与氨基酸肽键的氮原子可被烷基化。在这种情况下,该氨基酸也称为“n-烷基氨基酸”。在此,作为该烷基,例如可举出:甲基或乙基。
[0419]
本说明书中,在记载为“β-asp”的情况下,如由下述式[iii-1]表示的结构所示,是指经由侧链的羧基参与主链的酰胺键的天冬氨酸。同样地,在记载为“β-(d)-asp”、“γ-glu”、“γ-(d)-glu”的情况下,分别是指由下述式[iii-2]~式[iii-4]表示的结构。
[0420][0421]
另外,在记载为“(n-me)glu(otbu)”的情况下,如由下述式[iii-5]表示的结构所示,是指该氨基酸(glu(otbu))的n-甲基形式。
[0422][0423]
而且,本说明书中,在将aa2所对应的结构记载为“(2s,4s)-(4-氨基)pro”的情况下,是指由下述式[ii-3]表示的结构。同样地,在记载为“(2s,4r)-(4-氨基)pro”、“(2s,4s)-(4-羟基)pro”、“(2s,4r)-(4-羟基)pro”的情况下,分别是指由下述式[ii-4]~式[ii-6]表示的结构。而且,在记载为“(s)-哌嗪”的情况下,是指由下述式[ii-2]表示的结构。
[0424][0425]
本说明书中,“n”表示“正(normal)”、“i”表示“异(iso)”、“s”表示“仲(secondary)”、“t”和“tert”表示“叔(tertiary)”、“c”表示“环(cyclo)”、“o”表示“邻位(ortho)”、“m”表示“间位(meta)”、“p”表示“对位(para)”。
[0426]“卤素原子”表示氟原子、氯原子、溴原子、碘原子。
[0427]“c
1-6
烷基”表示具有1~6个碳原子的直链状或支链状的烷基。例如可举出:甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、正己基。
[0428]“卤代c
1-6
烷基”表示被卤素原子取代的、具有1~6个碳原子的直链状或支链状的烷基。卤素原子的优选的取代数为1~5个,优选的卤素原子为氟原子。例如可举出:单氟甲基、二氟甲基、三氟甲基、1-氟乙基、1,1-二氟乙基、1,1,2,2,-四氟乙基、1,1,2,2,2-五氟乙基、2-氟乙基、2-氟-2-甲基丙基、2,2-二氟丙基、1-氟-2-甲基丙烷-2-基、1,1-二氟-2-甲基丙烷-2-基、1-氟戊基、1-氟己基、2,2,2-三氟-1-甲基乙基等。
[0429]“芳基”表示具有6~14个碳原子的单环式芳族烃基或稠合多环式芳族烃基。例如可举出:苯基、萘基、蒽基等。
[0430]“芳香环”表示具有6~14个碳原子的单环式芳族烃环或稠合多环式芳族烃环。例如可举出:苯环、萘环、蒽环等。
[0431]
另外,部分饱和的芳基也包含在“芳基”中。这也同样适用于芳香环。“部分饱和的芳基”和作为与其对应的芳香环的“部分饱和的芳香环”表示:具有6~14个碳原子的单环式
芳族烃基或稠合多环式芳族烃基被部分饱和的基团、和具有这种结构的环。例如可举出:二氢茚基、二氢茚环等。
[0432]“杂芳基”表示由相同或不同地选自氧原子、硫原子和氮原子的1个以上原子和1~6个碳原子构成的5~7元单环式芳族杂环基或由相同或不同地选自氧原子、硫原子和氮原子的1个以上原子和1~13个碳原子所构成的9~14个原子构成的稠合多环式芳族杂环基。例如可举出:咪唑基、吡唑基、噻吩基、噻唑基、异噻唑基、噻二唑基、噁唑基、异噁唑基、噁二唑基、吡咯基、三唑基、四唑基、吡啶基、嘧啶基、吡嗪基、哒嗪基、三嗪基、吲哚基、苯并吡唑基、苯并三唑基、苯并呋喃基、苯并噻吩基、喹啉基、异喹啉基、喹喔啉基等。
[0433]“杂芳香环”表示由相同或不同地选自氧原子、硫原子和氮原子的1个以上原子和1~6个碳原子构成的5~7元单环式芳族杂环或由相同或不同地选自氧原子、硫原子和氮原子的1个以上原子和1~13个碳原子所构成的9~14个原子构成的稠合多环式芳族杂环。例如可举出:咪唑环、吡唑环、噻吩环、噻唑环、异噻唑环、噻二唑环、噁唑环、异噁唑环、噁二唑环、吡咯环、三唑环、四唑环、吡啶环、嘧啶环、吡嗪环、哒嗪环、三嗪环、吲哚环、苯并吡唑环、苯并三唑环、苯并呋喃环、苯并噻吩环、喹啉环、异喹啉环、喹喔啉环。
[0434]
另外,部分饱和的杂芳基也包含在“杂芳基”中。这也同样适用于杂芳香环。“部分饱和的杂芳基”和作为与其对应的杂芳香环的“部分饱和的杂芳香环”表示:由相同或不同地选自氧原子、硫原子和氮原子的1个以上原子和1~6个碳原子构成的5~7元部分饱和的单环式杂环基或由相同或不同地选自氧原子、硫原子和氮原子的1个以上原子和1~13个碳原子所构成的9~14个原子构成的部分饱和的稠合多环式杂环基团和具有这种结构的环。例如可举出:噁唑烷基、噻唑啉基、二氢吡啶基、二氢苯并呋喃基、色满基、二氢吡喃并吡啶基、二氢呋喃并吡啶基、四氢喹啉基、二氢苯并二氧杂环己烯基(dihydrobenzodioxynyl)、四氢三唑并吖庚因基、噁唑烷环、噻唑啉环、二氢吡啶环、二氢苯并呋喃环、色满环、二氢吡喃并吡啶环、二氢呋喃并吡啶环、四氢喹啉环、四氢喹啉环、二氢苯并二氧杂环己烯环、四氢三唑并吖庚因环等。
[0435]“包含氮原子的4~7元饱和杂环基”表示由1个氮原子和3~6个碳原子构成的4~7元单环式饱和杂环基,在此,除了所述的氮原子之外,还可包含选自氧原子、硫原子和氮原子的1个原子。例如可举出:氮杂环丁烷基、吡咯烷基、哌啶基、氮杂环庚烷基、吗啉基、硫代吗啉基、哌嗪基。
[0436]“包含1个氮原子、还可包含1个杂原子的4~7元饱和杂环基”表示由1个氮原子和3~6个碳原子构成的4~7元单环式饱和杂环基,在此,除了所述的氮原子之外,还可包含选自氧原子、硫原子和氮原子的1个原子。例如可举出:氮杂环丁烷基、吡咯烷基、哌啶基、氮杂环庚烷基、吗啉基、硫代吗啉基、哌嗪基。
[0437]
另外,作为“可通过c
1-4
烷烃二基进行交联的、包含1个氮原子、还可包含1个杂原子的4~7元饱和杂环基”,例如可举出:8-氧杂-3-氮杂双环[3.2.1]辛烷-3-基(由下述式[vi-16]表示的基团)、3,8-二氮杂双环[3.2.1]辛烷-3-基(由下述式[vi-18]表示的基团)。
[0438][0439]“c
1-6
烷氧基”表示具有1~6个碳原子的直链状或支链状的烷氧基。例如可举出:甲
羧基十五烷酰基等。
[0451]“c
1-6
烷基磺酰基”表示所述“c
1-6
烷基”与磺酰基键合的基团。例如可举出:甲基磺酰基、乙基磺酰基、正丙基磺酰基、异丙基磺酰基、正丁基磺酰基、异丁基磺酰基、仲丁基磺酰基、叔丁基磺酰基、正戊基磺酰基、正己基磺酰基。
[0452]“c
1-3
烷烃二基”表示从具有1~3个碳原子的烷基中去除1个氢原子而成的2价烃。例如可举出:甲烷二基、乙烷-1,1-二基、乙烷-1,2-二基、丙烷-1,1-二基、丙烷-1,3-二基、丙烷-2,2-二基。
[0453]“c
1-4
烷烃二基”表示从具有1~4个碳原子的烷基中去除1个氢原子而成的2价烃。例如可举出:甲烷二基、乙烷-1,1-二基、乙烷-1,2-二基、丙烷-1,1-二基、丙烷-1,3-二基、丙烷-2,2-二基、丁烷-1,4-二基。
[0454]“c
2-3
烯烃二基”表示从具有2~3个碳原子的烯基中去除1个氢原子而成的2价不饱和烃。例如可举出:乙烯-1,1-二基、乙烯-1,2-二基、丙-1-烯-1,1-二基、丙-2-烯-1,1-二基、丙-1-烯-1,3-二基、丙-2-烯-1,3-二基、丙-1-烯-2,2-二基。
[0455]“三唑二基”表示从三唑环中去除2个氢原子而成的2价三唑。例如可举出:由下述式[viii-1]~[viii-5]表示的结构。
[0456][0457]
本说明书中使用的缩写是指由下述表1~表4表示的结构。
[0458]
[表1-1]
[0459][0460]
[表2-1]
[0461][0462]
[表2-2]
[0463]
[0464][0465]
[表2-3]
[0466]
[0467][0468]
[表2-4]
[0469]
[0470][0471]
[表3-1]
[0472][0473]
[表4-1]
[0474]
[0475][0476]
[表4-2]
[0477]
[0478][0479]
本发明的由所述式[i']表示的被取代的多肽或其制药学上可接受的盐的优选方案如下所示。
[0480]
优选的aa1为asp、β-asp、β-(d)-asp、γ-glu、或γ-(d)-glu,
[0481]
一个更优选的aa1为β-asp、γ-glu、或γ-(d)-glu,
[0482]
此时,进一步优选的aa1为γ-(d)-glu,
[0483]
其他更优选的aa1为β-(d)-asp或γ-(d)-glu,
[0484]
此时,进一步优选的aa1为β-(d)-asp,
[0485]
其他更优选的aa1为asp。
[0486]
优选的aa2为由下述式[ii-1]或式[ii-2]
[0487][0488]
表示的基团、
[0489]
由下述式[iv-7]、[iv-8]、[iv-9]、[iv-11]或[iv-12]
[0490][0491]
表示的基团、
[0492]
ala、
[0493]
由下述式[iv-27]
[0494][0495]
表示的基团、或
[0496]
pro,
[0497]
在此,优选的r
aa2
为羟基或氨基,
[0498]
更优选的aa2为由下述式[ii-1]
[0499][0500]
表示的基团、
[0501]
由下述式[iv-7]、[iv-8]、[iv-9]、[iv-11]、或[iv-12]
[0502][0503]
表示的基团,
[0504]
在此,优选的r
aa2
为氨基,
[0505]
进一步优选的aa2为由下述式[iv-7]或[iv-9]
[0506][0507]
表示的基团、或由下述式[ii-1]
[0508][0509]
表示的基团,
[0510]
在此,优选的r
aa2
为氨基,
[0511]
一个特别优选的aa2为由下述式[ii-1]
[0512][0513]
表示的基团,
[0514]
在此,优选的r
aa2
为氨基,
[0515]
其他特别优选的aa2为由下述式[iv-7]或[iv-9]
[0516][0517]
表示的基团。
[0518]
优选的aa3为val、leu、ile、由下述式[iv-2]
[0519][0520]
表示的基团、
[0521]
phe、由下述式[iv-3]、[iv-4]、或[iv-5]
[0522][0523]
表示的基团、或
[0524]
trp,
[0525]
更优选的aa3为val、leu、ile、phe、或trp,
[0526]
进一步优选的aa3为val、leu、或ile,
[0527]
一个特别优选的aa3为val,
[0528]
其他特别优选的aa3为leu,
[0529]
其他特别优选的aa3为ile。
[0530]
优选的aa4为单键、pro、gly、homoser、met、glu、(n-me)ala、(n-me)val、(n-me)leu、(n-me)ile、(n-me)phe、(n-me)tyr、(n-me)ser、(n-me)met、(n-me)asp、(n-me)glu、(d)-pro、(d)-ala、(d)-phe、(d)-tyr、(d)-ser、(d)-thr、或(d)-(n-me)glu,
[0531]
更优选的aa4为(n-me)ala、(n-me)val、(n-me)leu、(n-me)ile、(n-me)phe、(n-me)tyr、(n-me)ser、(n-me)met、(n-me)asp、(n-me)glu)、(d)-pro、(d)-ala、(d)-phe、(d)-tyr、(d)-ser、(d)-thr、或(d)-(n-me)glu,
[0532]
一个进一步优选的aa4为(n-me)glu或(n-me)asp,
[0533]
此时,特别优选的aa4为(n-me)glu,
[0534]
其他进一步优选的aa4为(n-me)ile、(n-me)val、或(n-me)leu,
[0535]
此时,特别优选的aa4为(n-me)ile。
[0536]
优选的aa5为下述基团的任一个:
[0537]
β-ala、gaba、ape、acp、pro、(d)-pro、β-homopro、单键、arg、(d)-arg、
[0538]
由下述式[iv-7]、[iv-9]、[iv-13]
[0539][0540]
表示的基团、
[0541]
lys、(d)-lys、
[0542]
ala、由下述式[iv-1]
[0543][0544]
表示的基团、
[0545]
由下述式[iv-27]、[iv-28]、[iv-29]
[0546][0547]
表示的基团、
[0548]
phe、his、thr、
[0549]
由下述式[iii-6]~[iii-13]
[0550][0551]
表示的基团,
[0552]
更优选的aa5为β-ala、gaba、ape、acp、pro、(d)-pro、β-ho mopro、单键、arg、(d)-arg、
[0553]
由下述式[iv-7]、[iv-9]、[iv-13]
[0554][0555]
表示的基团、
[0556]
lys、或(d)-lys,
[0557]
进一步优选的aa5为β-ala、gaba、ape、acp、pro、(d)-pro、或β-homopro,
[0558]
特别优选的aa5为β-ala、gaba、ape、acp、或β-homopro。
[0559]
优选的w1为-l
1-或-l1’‑
l1”‑
,
[0560]
在此,l1为单键,
[0561]
另外,l1’
为选自下述的基团:
[0562]
β-ala、gaba、ape、acp、
[0563]
由下述式[iii-6]~[iii-13]
[0564][0565]
表示的基团、
[0566]
由下述式[iv-23]和[iv-24]
[0567][0568]
表示的基团,
[0569]
l
1”为单键、asn、(d)-ser、(d)-thr、lys、arg、或glu,
[0570]
一个更优选的w1为-l
1-或-l1’‑
l1”‑
,
[0571]
在此,l1为单键,
[0572]
另外,l1’
为下述基团的任一个:
[0573]
β-ala、gaba、ape、acp、
[0574]
由下述式[iii-6]~[iii-13]
[0575][0576][0577]
表示的基团,
[0578]
l
1”为asn、(d)-ser、(d)-thr、或glu,
[0579]
此时,进一步优选的w1为-l
1-或-l1’‑
l1”‑
,
[0580]
在此,l1为单键,
[0581]
另外,l1’
为β-ala、gaba、ape、或acp,
[0582]
l
1”为asn、(d)-ser、(d)-thr、或glu,
[0583]
此时,特别优选的w1为-l
1-,
[0584]
在此,l1为单键,
[0585]
其他更优选的w1为-l1’‑
l1”‑
,
[0586]
在此,l1’
为由下述式[iv-23]或[iv-24]
[0587][0588]
表示的基团,
[0589]
l
1”为单键。
[0590]
优选的l2为单键。
[0591]
优选的l
n1
为式-c(=o)-或式-s(=o)
2-,
[0592]
一个更优选的l
n1
为式-c(=o)-,
[0593]
其他更优选的l
n1
为式-s(=o)
2-。
[0594]
优选的l
n2
为单键、式-o-、或式-c(=o)-nh-,
[0595]
更优选的l
n2
为式-o-或式-c(=o)-nh-,
[0596]
一个进一步优选的l
n2
为式-o-,
[0597]
其他进一步优选的l
n2
为式-c(=o)-nh-。
[0598]
优选的环a为苯环或吡啶环,
[0599]
更优选的环a为苯环,
[0600]
优选的r
a1
、r
a2
独立为氢原子、或卤素原子,
[0601]
更优选的r
a1
、r
a2
为氢原子。
[0602]
优选的环b为苯基或吡啶基,
[0603]
更优选的环b为苯基,
[0604]
优选的r
b1
、r
b2
、r
b3
独立为氢原子、氨基甲酰基、卤素原子、c
1-6
烷基、卤代c
1-6
烷基、c
1-6
烷氧基、或卤代c
1-6
烷氧基,
[0605]
更优选的r
b1
、r
b2
、r
b3
独立为氢原子、氨基甲酰基、卤素原子、c
1-6
烷氧基、或卤代c
1-6
烷氧基。
[0606]
优选的wc为单键或由1~3个氨基酸构成的接头,
[0607]
在此,对形成该接头的1~3个氨基酸没有特别限定,优选为分别相同或不同地选自gly、pro、arg、(d)-arg、lys、(d)-lys、β-ala、gaba、和ape,
[0608]
在此,在由wc表示的基团中包含lys或(d)-lys的情况下,
[0609]
该lys和(d)-lys的侧链的氨基可被末端被羧基取代的c
2-16
烷基羰基、lys(该lys的侧链的氨基可被末端被羧基取代的c
2-16
烷基羰基取代)、或(d)-lys(该(d)-lys的侧链的氨基可被末端被羧基取代的c
2-16
烷基羰基取代)取代,
[0610]
更优选的wc为单键、pro、arg、(d)-arg、lys、(d)-lys、或(d)-lys-(d)-lys,
[0611]
进一步优选的wc为单键、arg、(d)-arg、lys、或(d)-lys,
[0612]
一个特别优选的wc为单键,
[0613]
其他特别优选的wc为(d)-lys。
[0614]
优选的rc为式-oh、式-nh2、c
1-6
烷基氨基(该c
1-6
烷基氨基的c
1-6
烷基可被选自羟基、氨基、和包含氮原子的4~7元的饱和杂环基的1个基团取代)、或包含1个氮原子、还可包含1个杂原子的4~7元的饱和杂环基(该包含1个氮原子、还可包含1个杂原子的4~7元的饱和杂环基可被选自羟基、和c
1-6
烷基(该c
1-6
烷基可被1个氨基甲酰基取代)的1个基团取代,而且,该包含1个氮原子、还可包含1个杂原子的4~7元的饱和杂环基中的2个碳原子可通过c
1-4
烷烃二基进行交联),
[0615]
更优选的rc为式-oh或式-nh2,
[0616]
进一步优选的rc为式-nh2。
[0617]
本发明的化合物的其它优选方案为由所述式[i']表示的被取代的多肽或其制药学上可接受的盐,其中,
[0618]
aa1为β-asp、γ-glu、或γ-(d)-glu,
[0619]
aa2为由下述式[ii-1]或式[ii-2]
[0620][0621]
表示的基团,
[0622]
在此,r
aa2
为羟基或氨基,
[0623]
aa3为val、leu、ile、phe、或trp,
[0624]
aa4为单键、pro、(n-me)ala、(n-me)val、(n-me)leu、(n-me)ile、(n-me)phe、(n-me)tyr、(n-me)ser、(n-me)asp、或(n-me)glu,
[0625]
aa5为单键、pro、(d)-pro、β-homopro、arg、(d)-arg、lys、(d)-lys、β-ala、gaba、
ape、或acp,
[0626]
w1为l1,l1为单键,
[0627]
l2为单键,
[0628]
l
n1
为式-s(=o)
2-,
[0629]
l
n2
为单键、式-o-、或式-c(=o)-nh-,
[0630]
环a为苯环,
[0631]ra1
、r
a2
为氢原子,
[0632]
环b为苯基,
[0633]rb1
、r
b2
、r
b3
独立为氢原子、氨基甲酰基、卤素原子、或c
1-6
烷氧基,
[0634]
wc为单键、pro、arg、(d)-arg、lys、(d)-lys、或(d)-lys-(d)-lys,
[0635]
rc为式-nh2。
[0636]
本发明的其他优选方案为由式[i']表示的被取代的多肽或其制药学上可接受的盐,其中,
[0637]
aa1为β-asp、γ-glu、或γ-(d)-glu,
[0638]
此时,进一步优选的aa1为γ-(d)-glu,
[0639]
aa2为由下述式[ii-1]
[0640][0641]
表示的基团,
[0642]
在此,r
aa2
为氨基,
[0643]
aa3为val、leu、或ile,
[0644]
在此,
[0645]
一个进一步优选的aa3为val,
[0646]
其他进一步优选的aa3为leu,
[0647]
其他进一步优选的aa3为ile,
[0648]
aa4为(n-me)val、(n-me)leu、(n-me)ile、(n-me)asp、或(n-me)glu,
[0649]
在此,
[0650]
一个进一步优选的aa4为(n-me)val、(n-me)leu、或(n-me)ile,
[0651]
此时,特别优选的aa4为(n-me)ile,
[0652]
其他进一步优选的aa4为(n-me)asp或(n-me)glu,
[0653]
此时,特别优选的aa4为(n-me)glu,
[0654]
aa5为pro、(d)-pro、β-homopro、β-ala、gaba、ape、或acp,
[0655]
在此,
[0656]
一个进一步优选的aa5为pro、(d)-pro、或β-homopro,
[0657]
此时,特别优选的aa5为β-homopro,
[0658]
其他进一步优选的aa5为β-ala、gaba、ape、或acp,
[0659]
此时,特别优选的aa5为β-ala、gaba、或ape,
[0660]
w1为l1,
[0661]
l1为单键,
[0662]
l2为单键,
[0663]
l
n1
为式-s(=o)
2-,
[0664]
l
n2
为单键、式-o-、或式-c(=o)-nh-,
[0665]
在此,
[0666]
一个进一步优选的l
n1
为式-c(=o)-,
[0667]
其他进一步优选的l
n1
为式-s(=o)
2-,
[0668]
环a为苯环,
[0669]ra1
、r
a2
为氢原子,
[0670]
环b为苯基,
[0671]rb1
、r
b2
、r
b3
独立为氢原子、氨基甲酰基、卤素原子、或c
1-6
烷氧基,
[0672]
wc为单键或(d)-lys,
[0673]
在此,
[0674]
一个进一步优选的wc为单键,
[0675]
其他进一步优选的wc为(d)-lys,
[0676]
rc为式-nh2。
[0677]
本发明的化合物的其它优选方案是w1为-l1’‑
l1”‑
、l2为单键的由下述式[i'-a]表示的被取代的多肽或其制药学上可接受的盐,
[0678][0679]
其中,aa2、aa3、aa4、aa5、l1’
、l
1”、l
n1
、l
n2
、r
b1
、r
b2
、r
b3
、wc、和rc的优选方案如上所述。
[0680]
在由上述式[i'-a]表示的多肽或其制药学上可接受的盐中,更优选方案如下所示。
[0681]
aa2为由下述式[ii-1]
[0682][0683]
表示的基团、
[0684]
由下述式[iv-7]、[iv-8]、[iv-9]、[iv-11]、或[iv-12]
[0685][0686]
表示的基团,
[0687]
在此,r
aa2
为氨基,
[0688]
aa3为val、leu、ile、phe、或trp,
[0689]
aa4为(n-me)val、(n-me)leu、(n-me)ile、(n-me)asp、或(n-me)glu,
[0690]
aa5为β-ala、gaba、ape、acp、pro、(d)-pro、或β-homopro,
[0691]
l1’
为β-ala、gaba、ape、acp、由下述式[iv-23]或[iv-24]
[0692][0693]
表示的基团,
[0694]
l
1”为单键、asn、(d)-ser、(d)-thr、或glu,
[0695]
l
n1
为式-c(=o)-或式-s(=o)
2-,
[0696]
l
n2
为式-o-或式-c(=o)-nh-,
[0697]rb1
、r
b2
、r
b3
独立为氢原子、氨基甲酰基、卤素原子、c
1-6
烷氧基、或卤代c
1-6
烷氧基,
[0698]
wc为单键、arg、(d)-arg、lys、或(d)-lys,
[0699]
rc为式-oh或式-nh2。
[0700]
在由上述式[i'-a]表示的多肽或其制药学上可接受的盐中,进一步优选方案如下所示。
[0701]
aa2为由下述式[iv-7]或[iv-9]
[0702][0703]
表示的基团,
[0704]
aa3为val、leu、或ile,
[0705]
aa4为(n-me)ile或(n-me)glu,
[0706]
aa5为β-ala、gaba、ape、acp、或β-homopro,
[0707]
l1’
为gaba或ape,
[0708]
l
1”为asn、glu、(d)-ser、或(d)-thr,
[0709]
l
n1
为式-c(=o)-或式-s(=o)
2-,
[0710]
l
n2
为式-o-或式-c(=o)-nh-,
[0711]rb1
为氨基甲酰基或氟原子,
[0712]rb2
为氢原子,
[0713]rb3
为氢原子,
[0714]
wc为单键,
[0715]
rc为式-nh2。
[0716]
而且,在本方案中,一个特别优选方案如下所示。
[0717]
在由上述式[i'-a]表示的多肽或其制药学上可接受的盐中,
[0718]
aa2为由下述式[iv-7]或[iv-9]
[0719][0720]
表示的基团,
[0721]
aa3为val,
[0722]
aa3可为leu,
[0723]
aa3可为ile,
[0724]
aa4为(n-me)ile,
[0725]
aa4可为(n-me)glu,
[0726]
aa5为β-ala、gaba、ape、或acp,
[0727]
aa5可为β-homopro,
[0728]
l1’
为gaba或ape,
[0729]
l
1”为asn、glu、(d)-ser、或(d)-thr,
[0730]
l1’
和l
1”的组合优选为gaba-asn、ape-asn、ape-glu、ape-(d)-ser、或ape-(d)-thr,
[0731]
l
n1
为式-c(=o)-,
[0732]
l
n1
可为式-s(=o)
2-,
[0733]
l
n2
为式-o-,l
n2
可为式-c(=o)-nh-,
[0734]rb1
为氨基甲酰基或氟原子,
[0735]rb2
为氢原子,
[0736]rb3
为氢原子,
[0737]
wc为单键,
[0738]
rc为式-nh2。
[0739]
另外,在本方案中,其他特别优选方案如下所示。
[0740]
所述的由式[i'-a]表示的被取代的多肽为以下的任一种情况:
[0741][0742]
本发明的化合物的其它优选方案是w1为-l
1-、且在此l1为单键、l2为单键的由下述式[i'-b]表示的被取代的多肽或其制药学上可接受的盐,
[0743][0744]
其中,aa1、aa2、aa3、aa4、aa5、l
n1
、l
n2
、r
b1
、r
b2
、r
b3
、wc、和rc的优选方案如上所述。
[0745]
在由上述式[i'-b]表示的多肽或其制药学上可接受的盐中,更优选方案如下所示。
[0746]
aa1为β-asp、β-(d)-asp、γ-glu、或γ-(d)-glu,
[0747]
aa2为由下述式[ii-1]
[0748][0749]
表示的基团、
[0750]
由下述式[iv-7]、[iv-8]、[iv-9]、[iv-11]、或[iv-12]
[0751][0752]
表示的基团,
[0753]
在此,r
aa2
为氨基,
[0754]
aa3为val、leu、ile、phe、或trp,
[0755]
aa4为(n-me)val、(n-me)leu、(n-me)ile、(n-me)asp、或(n-me)glu,
[0756]
aa5为β-ala、gaba、ape、acp、或β-homopro,
[0757]
l
n1
为式-c(=o)-或式-s(=o)
2-,
[0758]
l
n2
为单键、式-o-或式-c(=o)-nh-,
[0759]rb1
、r
b2
、r
b3
独立为氢原子、氨基甲酰基、卤素原子、c
1-6
烷氧基、或卤代c
1-6
烷氧基,
[0760]
wc为单键、arg、(d)-arg、lys、或(d)-lys,
[0761]
rc为式-oh或式-nh2。
[0762]
在由上述式[i'-b]表示的多肽或其制药学上可接受的盐中,进一步优选方案如下所示。
[0763]
aa1为β-(d)-asp或γ-(d)-glu,
[0764]
aa2为由下述式[ii-1]
[0765][0766]
表示的基团、
[0767]
由下述式[iv-7]或[iv-9]
[0768][0769]
表示的基团,
[0770]
在此,r
aa2
为氨基,
[0771]
aa3为val、leu、或ile,
[0772]
aa4为(n-me)ile或(n-me)glu,
[0773]
aa5为β-ala、gaba、ape、acp、或β-homopro,
[0774]
l
n1
为式-c(=o)-或式-s(=o)
2-,
[0775]
l
n2
为式-o-或式-c(=o)-nh-,
[0776]rb1
为氨基甲酰基、氯原子、溴原子、甲氧基、或三氟甲氧基,
[0777]rb2
为氢原子,
[0778]rb3
为氢原子,
[0779]
wc为单键或(d)-lys,
[0780]
rc为式-nh2。
[0781]
而且,在本方案中,一个特别优选方案如下所示。
[0782]
在由上述式[i'-b]表示的多肽或其制药学上可接受的盐中,
[0783]
aa1为β-(d)-asp,
[0784]
aa1可为γ-(d)-glu,
[0785]
aa2为由下述式[ii-1]
[0786][0787]
表示的基团,
[0788]
在此,r
aa2
为氨基,
[0789]
aa2可为由下述式[iv-7]或[iv-9]
[0790][0791]
表示的基团,
[0792]
aa3为val,
[0793]
aa3可为leu,
[0794]
aa3可为ile,
[0795]
aa4为(n-me)ile,
[0796]
aa4可为(n-me)glu,
[0797]
aa5为β-ala、gaba、ape、或acp,
[0798]
aa5可为β-homopro,
[0799]
l
n1
为式-c(=o)-,
[0800]
l
n1
可为式-s(=o)
2-,
[0801]
l
n2
为式-o-,
[0802]
l
n2
可为式-c(=o)-nh-,
[0803]rb1
为氨基甲酰基、氯原子、溴原子、甲氧基、或三氟甲氧基,
[0804]rb2
为氢原子,
[0805]rb3
为氢原子,
[0806]
wc为单键,
[0807]
wc可为(d)-lys,
[0808]
rc为式-nh2。
[0809]
另外,在本方案中,其他特别优选方案如下所示。
[0810]
由所述式[i'-b]表示的被取代的多肽为以下的任一种的情况:
[0811]
[0812]
[0813][0814]
本发明的化合物的其它优选方案是l2为单键的由下述式[i'-c]表示的被取代的多肽或其制药学上可接受的盐,
[0815][0816]
其中,aa1、aa2、aa3、aa4、aa5、w1、l
n1
、l
n2
、r
b1
、r
b2
、r
b3
、wc、和rc的优选方案如上所述。
[0817]
在由上述式[i'-c]表示的多肽或其制药学上可接受的盐中,更优选方案如下所示。
[0818]
aa1为asp、β-(d)-asp、或γ-(d)-glu,
[0819]
aa2为由下述式[iv-7]或[iv-9]
[0820][0821]
表示的基团、或
[0822]
由下述式[ii-1]
[0823][0824]
表示的基团,
[0825]
在此,r
aa2
为氨基,
[0826]
aa3为val、leu、或ile,
[0827]
aa4为(n-me)ile或(n-me)glu,
[0828]
aa5为ape或β-homopro,
[0829]
w1为-l
1-或-l1’‑
l1”‑
,
[0830]
在此,l1为单键,
[0831]
另外,l1’
为gaba或ape,
[0832]
l
1”为asn、(d)-ser、(d)-thr、或glu,
[0833]
l
n1
为式-c(=o)-或式-s(=o)
2-,
[0834]
l
n2
为式-o-或式-c(=o)-nh-,
[0835]rb1
、r
b2
、r
b3
独立为氢原子、氨基甲酰基、卤素原子、c
1-6
烷氧基、或卤代c
1-6
烷氧基,
[0836]
wc为单键或(d)-lys,
[0837]
rc为式-nh2。
[0838]
在由上述式[i'-c]表示的多肽或其制药学上可接受的盐中,进一步优选方案如下所示。
[0839]
aa1为asp,
[0840]
aa1可为β-(d)-asp,
[0841]
aa1可为γ-(d)-glu,
[0842]
aa2为由下述式[iv-7]或[iv-9]
[0843][0844]
表示的基团,
[0845]
aa2可为由下述式[ii-1’]
[0846][0847]
表示的基团,
[0848]
在此,r
aa2
为氨基,
[0849]
aa3为val,
[0850]
aa3可为leu,
[0851]
aa3可为ile,
[0852]
aa4为(n-me)ile,
[0853]
aa4可为(n-me)glu,
[0854]
aa5为ape,
[0855]
aa5可为β-homopro,
[0856]
w1为-l
1-或-l1’‑
l1”‑
,
[0857]
l1为单键,
[0858]
l1’
和l
1”的组合(-l1’‑
l1”‑
)为gaba-asn、ape-asn、ape-glu、ape-(d)-ser、或ape-(d)-thr,
[0859]
l
n1
为式-c(=o)-,
[0860]
l
n1
可为式-s(=o)
2-,
[0861]
l
n2
为式-o-,
[0862]
l
n2
可为式-c(=o)-nh-,
[0863]rb1
为氨基甲酰基、氯原子、溴原子、甲氧基、或三氟甲氧基,
[0864]rb2
为氢原子,
[0865]rb3
为氢原子,
[0866]
wc为单键,
[0867]
wc可为(d)-lys,
[0868]
rc为式-nh2。
[0869]
在本方案中,一个特别优选方案如下所示。
[0870]
由所述式[i'-c]表示的被取代的多肽为以下的任一种的情况:
[0871]
[0872]
[0873]
[0874][0875]
另外,在本方案中,其他特别优选方案如下所示。
[0876]
由所述式[i'-c]表示的被取代的多肽为以下的情况:
[0877][0878]
另外,在本方案中,其他特别优选方案如下所示。
[0879]
由所述式[i'-c]表示的被取代的多肽为以下的情况:
[0880][0881]
另外,在本方案中,其他特别优选方案如下所示。
[0882]
由所述式[i'-c]表示的被取代的多肽为以下的情况:
[0883][0884]
另外,在本方案中,其他特别优选方案如下所示。
[0885]
由所述式[i'-c]表示的被取代的多肽为以下的情况:
[0886][0887]
另外,在本方案中,其他特别优选方案如下所示。
[0888]
由所述式[i'-c]表示的被取代的多肽我以下的情况:
[0889][0890]
另外,在本方案中,其他特别优选方案如下所示。
[0891]
由所述式[i'-c]表示的被取代的多肽为以下的情况:
[0892][0893]
另外,在本方案中,其他特别优选方案如下所示。
[0894]
由所述式[i'-c]表示的被取代的多肽为以下的情况:
[0895][0896]
另外,在本方案中,其他特别优选方案如下所示。
[0897]
由所述式[i'-c]表示的被取代的多肽为以下的情况:
[0898][0899]
另外,在本方案中,其他特别优选方案如下所示。
[0900]
由所述式[i'-c]表示的被取代的多肽为以下的情况:
[0901][0902]
另外,在本方案中,其他特别优选方案如下所示。
[0903]
由所述式[i'-c]表示的被取代的多肽为以下的情况:
[0904][0905]
另外,在本方案中,其他特别优选方案如下所示。
[0906]
由所述式[i'-c]表示的被取代的多肽为以下的情况:
[0907][0908]
另外,在本方案中,其他特别优选方案如下所示。
[0909]
由所述式[i'-c]表示的被取代的多肽为以下的情况:
[0910][0911]
另外,在本方案中,其他特别优选方案如下所示。
[0912]
由所述式[i'-c]表示的被取代的多肽为以下的情况:
[0913][0914]
另外,在本方案中,其他特别优选方案如下所示。
[0915]
由所述式[i'-c]表示的被取代的多肽为以下的情况:
[0916][0917]
另外,在本方案中,其他特别优选方案如下所示。
[0918]
由所述式[i'-c]表示的被取代的多肽为以下的情况:
[0919][0920]
本发明的化合物的另外的优选方案为由所述式[i]表示的被取代的多肽或其制药学上可接受的盐,其中,
[0921]
aa1为β-asp、γ-glu、或γ-(d)-glu,
[0922]
aa2为由下述式[ii-1]或式[ii-2]
[0923][0924]
表示的基团,
[0925]
在此,r
aa2
为羟基或氨基,
[0926]
aa3为val、leu、ile、phe、或trp,
[0927]
aa4为单键、pro、(n-me)ala、(n-me)val、(n-me)leu、(n-me)ile、(n-me)phe、(n-me)tyr、(n-me)ser、(n-me)asp、或(n-me)glu,
[0928]
aa5为单键、pro、(d)-pro、β-homopro、arg、(d)-arg、lys、(d)-lys、β-ala、gaba、ape、或acp,
[0929]
l1为单键,
[0930]
l2为单键,
[0931]
l
n1
为式-s(=o)
2-,
[0932]
l
n2
为单键、式-o-、或式-c(=o)-nh-,
[0933]
ra为氢原子,
[0934]
rb为氢原子、氨基甲酰基、卤素原子、或c
1-6
烷氧基,
[0935]
lc为单键、pro、arg、(d)-arg、lys、(d)-lys、或(d)-lys-(d)-lys,
[0936]
rc为式-nh2。
[0937]
本发明的化合物是以由3~7个氨基酸构成的多肽为基本骨架、而且具有被取代的苯甲酰基或被取代的苯基磺酰基的化合物,可为其制药学上可接受的盐。
[0938]
作为制药学上可接受的盐,例如可举出:盐酸盐、氢溴酸盐、氢碘酸盐、磷酸盐、硫酸盐、硝酸盐等无机酸盐;甲磺酸盐、乙磺酸盐、苯磺酸盐、对甲苯磺酸盐、三氟甲磺酸盐等磺酸盐;草酸盐、酒石酸盐、柠檬酸盐、马来酸盐、琥珀酸盐、乙酸盐、三氟乙酸盐、苯甲酸盐、扁桃酸盐、抗坏血酸盐、乳酸盐、葡萄糖酸盐、苹果酸盐这样的有机酸盐等酸加成盐;甘氨酸盐、赖氨酸盐、精氨酸盐、鸟氨酸盐、谷氨酸盐、天冬氨酸盐等氨基酸盐;或锂盐、钠盐、钾盐、钙盐、镁盐等无机盐或铵盐、三乙胺盐、二异丙胺盐、环己胺盐等与有机碱的盐。需要说明的是,在盐中包含含水盐。
[0939]
本发明的化合物可具有不对称中心,这种情况下存在各种光学异构体。因此,本发明的化合物可作为(r)和(s)的单独的光学活性体、以及作为外消旋体或(rs)混合物存在。另外,在具有2个以上不对称中心的化合物的情况下,还存在基于各自的光学异构的非对映体。本发明的化合物还包括以任意比例包含所有这些类型的混合物。例如,非对映体可通过本领域技术人员所熟知的方法、例如分级结晶法等进行分离,另外,光学活性体可通过为此目的所熟知的有机化学的方法而得到。另外,本发明的化合物中可存在顺式、反式等几何异构体。而且,本发明的化合物具有互变异构、且存在各种的互变异构体。本发明的化合物还包括它们的异构体、和以任意比例包含这些异构体的混合物。
[0940]
而且,在本发明的化合物或其盐形成水合物或溶剂和物的情况下,它们也包含在本发明的化合物或其盐的范围内。
[0941]“基质金属蛋白酶2(mmp2)”是一种以锌为活性中心的内肽酶。
[0942]
如上所述,由于mmp2降解胶原或明胶等细胞外基质,因此参与细胞浸润/迁移或转移等,并参与癌疾病或器官纤维化等病态。
[0943]
因此,通过抑制mmp2,可预防或治疗癌疾病和器官纤维化、以及与癌疾病和器官纤维化相关联的症状。
[0944]
本发明的化合物具有抑制mmp2的作用。因此,本发明的化合物可用作mmp2抑制剂、或癌疾病和器官纤维化的预防药或治疗药的有效成分。
[0945]
另外,本发明的化合物还可用作与癌疾病和器官纤维化相关联的症状的预防药或治疗药的有效成分。
[0946]
在此,“癌疾病”可举出:乳腺癌、胰腺癌、膀胱癌、大肠癌、卵巢癌、前列腺癌、脑肿瘤、胃癌、肝细胞癌、头颈部癌、黑色素瘤、子宫癌、食道癌、肾细胞癌、肺癌、神经胶质瘤等。另外,作为“与癌疾病相关联的症状”,可举出:新生细胞增加或肿瘤生长所伴随的疼痛、体重减轻、肿瘤伴随综合征等。
[0947]
在此,“器官纤维化”可举出:慢性肾病、间质性肺炎、特发性肺纤维化等。另外,作为“与器官纤维化相关联的症状”,可举出:慢性肾病中的蛋白尿或肾功能异常等、间质性肺炎和特发性肺纤维化中的劳累性呼吸困难或干咳等。
[0948]
需要说明的是,为了评价本发明的化合物抑制mmp2的作用,例如可按照后述的本说明书的试验例中记载的方法等、已知的方法来进行。
[0949]
关于本发明所涉及的药物,所含有的作为本发明的化合物的具有抑制mmp2作用的化合物或其制药学上可接受的盐,可单独、或与药学上或药剂学上可接受的添加剂一同给药。
[0950]
作为添加剂,可使用常用的赋形剂或稀释剂、而且根据需要可使用通常所使用的粘合剂、崩解剂、润滑剂、包覆剂、糖衣剂、ph调节剂、溶解剂或水性或非水性溶剂。具体而言,可举出:水、乳糖、葡萄糖、果糖、蔗糖、山梨糖醇、甘露醇、聚乙二醇、丙二醇、淀粉、玉米淀粉、树胶、明胶、藻酸盐、硅酸钙、磷酸钙、纤维素、水糖浆、甲基纤维素、聚乙烯吡咯烷酮、对羟基苯甲酸烷基酯、滑石、硬脂酸、硬脂酸镁、琼脂、果胶、阿拉伯树胶、甘油、芝麻油、橄榄油、大豆油可可脂、乙二醇、低粘度羟基丙基纤维素(hpc-l)、微晶纤维素、羧甲基纤维素(cmc)、羧甲基纤维素钠(cmc-na)等或其他常用的添加剂。
[0951]
本发明所涉及的药物可以是固体组合物、液体组合物和其他组合物的任何形式,
可根据需要选择最佳的组合物。
[0952]
本发明所涉及的药物可在本发明的化合物中添加所述的添加剂,通过常用的制剂技术,调制成片剂、丸剂、胶囊剂、颗粒剂、粉剂、散剂、液剂、乳剂、悬浮剂、注射剂等。
[0953]
另外,本发明所涉及的药物可通过使本发明的化合物与α、β或γ-环糊精或甲基化环糊精等形成包合化合物而进行制剂化。
[0954]
关于本发明所涉及的药物,针对可与本发明的化合物联合的化合物,可制成单一的制剂(配方剂)、或分开进行制剂化而得到的2种以上的制剂(联合剂)。
[0955]
在将这些化合物分开进行制剂化而制成2种以上制剂的情况下,可将各自的制剂同时或隔开一定的时间间隔进行给药。这种情况下,先给予哪一种均可。该2种以上的制剂也可在1天中以各自不同的次数进行给药。另外,该2种以上的制剂也可通过不同的途径进行给药。
[0956]
在将这些化合物分开进行制剂化而制成2种制剂的情况下,也可同时或以极短的间隔进行给药,例如,优选在市售的药物的附带说明书或销售手册等的说明书中记载将各自进行联合的目的。
[0957]
另外,还优选将这些有效成分分开进行制剂化而制成包含2种制剂的试剂盒的形式。
[0958]
在将本发明的化合物用作mmp2抑制剂等的情况下,对给药形式没有特别限制,可将本发明的化合物直接口服给药或胃肠外给药。另外,也可作为包含本发明的化合物作为有效成分的制剂,进行口服给药或胃肠外给药。
[0959]
另外,在将本发明的化合物用作癌疾病和器官纤维化、以及与癌疾病和器官纤维化相关联的症状的预防或改善剂等的情况下,也可将本发明的化合物直接进行口服给药或胃肠外给药。另外,也可作为包含本发明的化合物作为有效成分的制剂,进行口服给药或胃肠外给药。
[0960]
在此,作为胃肠外给药,优选静脉内给药、皮下给药、或经皮给药。
[0961]
另外,作为胃肠外给药的情况的剂型,可举出:注射剂、输液剂、植入剂、经皮吸收剂、经粘膜吸收剂、贴剂等,并且可以是微球制剂。
[0962]
本发明的化合物的给药量根据给药对象、给药途径、对象疾病、症状等而不同,例如,在对成人患者进行口服给药或胃肠外给药的情况下,通常作为1次量为0.1mg~1000mg、优选为1mg~200mg,理想的是将该量在1天中进行1次~3次给药、或在2天~3天中进行1次给药。
[0963]
本发明的化合物的制剂的制造例如下所示。
[0964]
制剂例1
[0965]
制造含有以下成分的颗粒剂。
[0966]
成分:由通式[i']表示的化合物、乳糖、玉米淀粉、hpc-l。
[0967]
将由通式[i']表示的化合物和乳糖过筛。将玉米淀粉过筛。将它们在混合机中进行混合。在混合粉末中添加hpc-l水溶液,进行混炼、造粒(挤出造粒)后,进行干燥。将所得的干燥颗粒利用振动筛进行筛分,得到颗粒剂。
[0968]
制剂例2
[0969]
制造含有以下成分的胶囊充填用散剂。
[0970]
成分:由通式[i']表示的化合物、乳糖、玉米淀粉、硬脂酸镁。
[0971]
将由通式[i']表示的化合物和乳糖过筛。将玉米淀粉过筛。将它们和硬脂酸镁在混合机中进行混合,得到散剂。所得的散剂可填充至胶囊中。
[0972]
制剂例3
[0973]
制造含有以下成分的胶囊充填用颗粒剂。
[0974]
成分:由通式[i']表示的化合物、乳糖、玉米淀粉、hpc-l。
[0975]
将由通式[i']表示的化合物和乳糖过筛。将玉米淀粉过筛。将它们在混合机中进行混合。在混合粉末中添加hpc-l水溶液,进行混炼、造粒后,进行干燥。将所得的干燥颗粒利用振动筛进行筛分且整粒,得到颗粒。所得的颗粒可填充至胶囊中。
[0976]
制剂例4
[0977]
制造含有以下成分的片剂。
[0978]
成分:由通式[i']表示的化合物、乳糖、微晶纤维素、硬脂酸镁、cmc-na。
[0979]
将由通式[i']表示的化合物、乳糖、微晶纤维素和cmc-na过筛并进行混合。在混合粉末中添加硬脂酸镁,得到制剂用混合粉末。将该混合粉末直接压制,得到片剂。
[0980]
制剂例5
[0981]
制造含有以下成分的注射剂。
[0982]
成分:由通式[i']表示的化合物、纯化蛋黄卵磷脂、油酸、纯化大豆油、甘油、注射用水。
[0983]
将由通式[i']表示的化合物、纯化蛋黄卵磷脂和油酸加入到纯化大豆油中,溶解后,添加混合有甘油的注射用水,利用乳化机进行乳化。向其中添加注射用水,分装到安瓿中,进行密封、灭菌,制成注射剂。
[0984]
以下,对本发明所涉及的化合物[i']的制造方法进行详细地说明,制造方法不特别限定于所示例的方法。另外,制造中所使用的溶剂,只要是不抑制各反应的溶剂即可,也不特别限定于下述的记载。
[0985]
在化合物[i']的制造中,可将该制造中的步骤顺序进行适当更换。
[0986]
需要说明的是,在该制造中,原料化合物可用作盐,作为盐,例如可举出:所述的“制药学上可接受的盐”。
[0987]
化合物[i']可通过固相合成或液相合成或它们的组合进行制造。需要说明的是,在以下的制造方法中,示出基于固相合成的制造例。
[0988]
化合物[i']可通过图解1~9所记载的方法或这些方法的组合进行制造。
[0989]
需要说明的是,在形成化合物[i']的多肽部分的氨基酸中,其侧链可具有官能团,该官能团也可被保护基保护。在此,作为该保护基,例如可举出:对于羧基的tbu、对于氨基甲酰基的trt、对于羟基的tbu、对于酚式羟基的tbu、对于硫醇(硫烷基)的tbu、对于氨基的boc、对于咪唑基的trt、对于吲哚基的boc、对于胍基的pbf。需要说明的是,这些保护基均可通过用酸进行处理来脱保护。
[0990]
另外,该氨基酸即使侧链的官能团不被保护也可在制造中使用。
[0991]
制造多肽部分的n末端氨基酸的氨基被磺酰化的化合物、且c末端氨基酸的羧基被酰胺化(-conh2)的化合物[1-f]的方法(a法)
[0992]
该化合物[1-f]例如可通过以下概述的固相合成进行制造(图解1)。
[0993]
图解1
[0994][0995]
(图解1中,
[0996]ra1
、r
a2
、r
b1
、r
b2
、r
b3
、l
n2
、环a、和环b与所述的定义相同。
[0997]
h-z
x-oh表示氨基酸,
[0998]
x表示1~m的整数,
[0999]
m表示2~15的整数,
[1000]
在此,z
x
相当于由式[i']表示的化合物中的aa
x
、l2、w1、或wc,另外,也表示单键,
[1001]
pg
x
表示保护氨基酸(h-z
x-oh)的氨基的脂溶性保护基。)
[1002]
(1)[步骤1-1]
[1003]
在具有被fmoc保护的氨基的树脂(化合物[1-a])中,使用碱,进行脱fmoc。
[1004]
(2)[步骤1-2]
[1005]
使氨基被脂溶性保护基(pg
x
)保护的氨基酸(化合物[1-b])与上述(1)中得到的树脂进行反应,而使该树脂中的游离氨基与该化合物[1-b]中的羧基进行酰胺化反应。
[1006]
(3)[步骤1-3]
[1007]
将上述(2)中得到的化合物的、多肽部分的n末端氨基酸的氨基的脂溶性保护基进行脱保护。
[1008]
(4)通过重复2次以上的上述(2)和(3)的步骤,可制造多肽部分的c末端氨基酸的羧基与树脂键合、n末端氨基酸的氨基游离的化合物[1-c]。
[1009]
(5)[步骤1-4]
[1010]
使化合物[1-d]与上述(4)中得到的化合物[1-c]进行反应,将化合物[1-c]中的游离氨基进行磺酰化,由此可制造化合物[1-e]。
[1011]
(6)[步骤1-5]
[1012]
对上述(5)中得到的化合物[1-e]通过使用酸切断与树脂的键合,可制造由化合物[1-f]表示的本发明化合物。作为可在本步骤中使用的酸,例如可举出:tfa。
[1013]
另外,此时,在形成多肽部分的氨基酸中其侧链上存在被保护的官能团的情况下,可同时对该官能团的保护基进行脱保护。
[1014]
如此得到的化合物[1-f]可通过已知的分离纯化手段、例如浓缩、减压浓缩、再沉淀、溶剂萃取、结晶、色谱等进行单离(分离)纯化。
[1015]
需要说明的是,在上述图解1所记载的方法中,用作原料化合物的树脂[1-a]、化合物[1-b]和化合物[1-d]可通过自身已知的方法进行制造、或可通过购入市售品来获取。
[1016]
制造多肽部分的n末端氨基酸的氨基被酰化的化合物、且c末端氨基酸的羧基被酰胺化(-conh2)的化合物[2-c]的方法(b法)
[1017]
该化合物[2-c]例如可将化合物[1-c]作为起始物质通过以下概述的固相合成进行制造(图解2)。
[1018]
图解2
[1019][1020]
(图解2中,
[1021]ra1
、r
a2
、r
b1
、r
b2
、r
b3
、l
n2
、环a、环b、h-z
x-oh、x、m、和z
x
与所述的定义相同。
[1022]
y1表示羟基或氯原子。)
[1023]
(1)[步骤2-1]
[1024]
使化合物[2-a]与化合物[1-c]作用而进行酰胺化反应,由此可制造化合物[2-b]。
[1025]
(2)[步骤2-2]
[1026]
对上述(1)中得到的化合物[2-b]通过使用酸切断与树脂的键合,可制造由化合物[2-c]表示的本发明化合物。作为可在本步骤中使用的酸,例如可举出:tfa。
[1027]
另外,此时,在形成多肽部分的氨基酸中其侧链上存在被保护的官能团的情况下,可同时对该官能团的保护基进行脱保护。
[1028]
如此得到的化合物[2-c]可通过已知的分离纯化手段、例如浓缩、减压浓缩、再沉淀、溶剂萃取、结晶、色谱等进行单离纯化。
[1029]
需要说明的是,在上述图解2所记载的方法中,用作原料化合物的化合物[2-a]可通过自身已知的方法进行制造、或可通过购入市售品来获取。另外,化合物[1-c]可通过上述图解1所记载的方法进行制造。
[1030]
制造多肽部分的n末端氨基酸的氨基被磺酰化或酰化的化合物、且c末端氨基酸的羧基被仲酰胺化或叔酰胺化的化合物[3-h]的方法(c-1法)
[1031]
该化合物[3-h]例如可通过以下概述的固相合成进行制造(图解3)。
[1032]
需要说明的是,作为可在本制造法中使用的树脂(树脂[3-a]),例如可举出:氯三苯甲基氯树脂、王树脂。
[1033]
图解3
[1034][1035]
(图解3中,
[1036]ra1
、r
a2
、r
b1
、r
b2
、r
b3
、l
n1
、l
n2
、环a、环b、h-z
x-oh、x、m、z
x
、pg
x
、和y1与所述的定义相同。
[1037]rr
表示羟基或氯原子,
[1038]rc’、r
c”相同或不同地表示氢原子或c
1-6
烷基,在此,该c
1-6
烷基可被选自羟基、氨基、和c
1-6
烷氧基的1个基团取代,
[1039]
另外,r
c’、r
c”可与相邻的氮原子一起形成包含氮原子的4~7元的饱和杂环,
[1040]
而且,r
c’和r
c”与相邻的氮原子一起形成的包含氮原子的4~7元的饱和杂环可被选自羟基、氨基、c
1-6
烷基、和c
1-6
烷氧基的1个基团取代,
[1041]
而且,r
c’和r
c”与相邻的氮原子一起形成的、包含氮原子的4~7元的饱和杂环中的2个碳原子可通过c
1-4
烷烃二基进行交联。)
[1042]
(1)[步骤3-1]
[1043]
使氨基被脂溶性保护基(pg1)保护的氨基酸(化合物[3-b])与树脂(化合物[3-a])进行反应,由此可制造化合物[3-c]。
[1044]
(2)[步骤3-2]
[1045]
将上述(1)中得到的化合物[3-c]中的脂溶性保护基(pg1)进行脱保护。
[1046]
(3)[步骤3-3]
[1047]
使氨基被脂溶性保护基(pg
x
)保护的氨基酸(化合物[1-b])与上述(2)中得到的化合物进行反应,而使上述(1)中得到的化合物中的游离氨基和该化合物[1-b]中的羧基进行酰胺化反应。
[1048]
(4)[步骤3-4]
[1049]
将上述(3)中得到的化合物的、多肽部分的n末端氨基酸的氨基的脂溶性保护基进行脱保护。
[1050]
(5)通过重复2次以上的上述(3)和(4)的步骤,可制造多肽部分的c末端氨基酸的羧基与树脂键合、n末端氨基酸的氨基游离的化合物[3-d]。
[1051]
(6)[步骤3-5]
[1052]
使化合物[1-d]或化合物[2-a]与上述(5)中得到的化合物[3-d]进行反应,将化合物[3-d]中的游离氨基进行磺酰化或酰化,由此可制造化合物[3-e]。
[1053]
(7)[步骤3-6]
[1054]
对上述(6)中得到的化合物[3-e]通过使用酸切断与树脂的键合,可制造多肽部分的c末端氨基酸的羧基游离的化合物[3-f]。作为可在本步骤中使用的酸,例如可举出:tfa。
[1055]
另外,此时,在形成多肽部分的氨基酸中其侧链上存在被保护的官能团的情况下,可同时对该官能团的保护基进行脱保护。
[1056]
(8)[步骤3-7]
[1057]
使化合物[3-g]与上述(7)中得到的化合物[3-f]作用而进行酰胺化反应,由此可制造由化合物[3-h]表示的本发明化合物。
[1058]
如此得到的化合物[3-h]可通过已知的分离纯化手段、例如浓缩、减压浓缩、再沉淀、溶剂萃取、结晶、色谱等进行单离纯化。
[1059]
需要说明的是,在上述图解3所记载的方法中,用作原料化合物的化合物[3-a]、化合物[3-b]、化合物[1-b]、化合物[1-d]、化合物[2-a]、和[3-g]可通过自身已知的方法进行制造、或可通过购入市售品来获取。
[1060]
制造多肽部分的n末端氨基酸的氨基被磺酰化或酰化的化合物、且c末端氨基酸的羧基被仲酰胺化或叔酰胺化的化合物[4-e]的方法(c-2法)
[1061]
该化合物[4-e]也可通过以下概述的固相合成进行制造(图解4)。
[1062]
需要说明的是,在图解4中示例了化合物[4-e]的制造方法,该化合物在自多肽部分的c末端氨基酸起的第m'位的氨基酸侧链上存在官能团。
[1063]
作为可在本制造法中使用的树脂,与图解3同样,例如可举出:氯三苯甲基氯树脂、王树脂。
[1064]
图解4
[1065][1066]
(图解4中,
[1067]ra1
、r
a2
、r
b1
、r
b2
、r
b3
、l
n1
、l
n2
、环a、环b、h-z
x-oh、x、m、z
x
、r
c'
、和r
c”与所述的定义相同。
[1068]
m'表示1~15的整数,其中,为“m'≤m”的关系,
[1069]
l
sc
表示c
1-4
烷烃二基,
[1070]
fg
sc
表示所述在自多肽部分的c末端氨基酸起的第m'位的氨基酸侧链上所存在的官能团,
[1071]
在此,作为该官能团,例如可举出:式-o-(式-oh)、式-s-(式-sh)、式-nh-(式-nh2)、式-c(=o)o-(式-c(=o)oh)、式-c(=o)nh-(式-c(=o)nh2)、式-nhc(=nh)nh-(-nhc(=nh)nh2),
[1072]
pg
sc
表示对该官能团的保护基,
[1073]
在此,作为该官能团,如上所述,例如可举出:tbu、trt、boc、pbf。)
[1074]
(1)[步骤4-1]
[1075]
对化合物[4-a]通过使用酸切断与树脂的键合,可制造多肽部分的c末端氨基酸的羧基游离的化合物[4-b]。
[1076]
此时,通过使用弱酸作为酸,可防止在自该c末端氨基酸起的第m'位的氨基酸侧链上所存在的保护基(pg
sc
)的脱保护。作为该弱酸,例如可举出:hfip、乙酸、所稀释的tfa。
[1077]
(2)[步骤4-2]
[1078]
使化合物“4-c”与上述(1)中得到的化合物[4-b]进行作用,而使该化合物[4-b]中的游离羧基与化合物[4-c]中的氨基进行酰胺化反应,由此可制造化合物[4-d]。
[1079]
(3)[步骤4-3]
[1080]
通过使用酸将所述在自c末端氨基酸起的第m'位的氨基酸侧链上所存在的保护基(pg
sc
)进行脱保护,可制造由化合物[4-e]表示的本发明化合物。作为可在本步骤中使用的酸,例如可举出:tfa。
[1081]
如此得到的化合物[4-e]可通过已知的分离纯化手段、例如浓缩、减压浓缩、再沉淀、溶剂萃取、结晶、色谱等进行单离纯化。
[1082]
需要说明的是,在上述图解4所记载的方法中,用作原料化合物的化合物[4-c]可通过自身已知的方法进行制造、或可通过购入市售品来获取。另外,化合物[4-a]可通过上述图解3所记载的方法进行制造。
[1083]
在形成多肽部分的氨基酸中其氨基酸的侧链上存在官能团的情况下,制造该官能团被多肽接头取代、而且该多肽接头的n末端氨基酸的氨基被“被羧基取代的c
1-20
烷基羰基”取代的化合物[5-f]的方法(d法)
[1084]
该化合物[5-f]可通过以下概述的固相合成进行制造(图解5)。
[1085]
在此,该多肽接头由1~5个氨基酸构成。
[1086]
需要说明的是,在图解5中示例了化合物[5-f]的制造方法,该化合物在自多肽部分的c末端氨基酸起的第m'位的氨基酸侧链上存在官能团、该官能团被多肽接头取代、而且该多肽接头的n末端氨基酸的氨基被“被羧基取代的c
1-20
烷基羰基”取代。
[1087]
图解5
[1088][1089]
(图解5中,
[1090]ra1
、r
a2
、r
b1
、r
b2
、r
b3
、l
n1
、l
n2
、环a、环b、h-z
x-oh、x、m、m'、z
x
、和l
sc
与所述的定义相同。
[1091]
pg
s'
表示对所述存在于氨基酸侧链上的官能团(fg
sc'
)的保护基,在此,作为该保护
基,例如可举出:对氨基的dde、ivdde、alloc、mtt,
[1092]
h-z
scy-oh表示官能团(fg
sc'
)被取代的形成多肽接头的氨基酸,
[1093]
y表示1~p的整数,
[1094]
p表示0~5的整数,
[1095]
pg
scy
表示保护氨基酸(h-z
scy-oh)的氨基的脂溶性保护基。
[1096]
fg
sc’表示存在于氨基酸侧链上的官能团。作为该官能团,例如可举出:式-nh-(式-nh2)、式-coo-(式-cooh)。需要说明的是,在上述的图解5中,fg
sc’表示为式-nh-(式-nh2)的情况。
[1097]
n表示1~20的整数。)
[1098]
(1)[步骤5-1]
[1099]
将化合物[5-a]中的在自多肽部分的c末端氨基酸起的第m'位的氨基酸侧链上所存在的官能团的保护基(pg
s’)选择性地进行脱保护。
[1100]
(2)[步骤5-2]
[1101]
使氨基被脂溶性保护基(pg
scy
)保护的氨基酸(化合物[5-b])与上述(1)中得到的化合物进行反应,而使上述(1)中得到的化合物中的游离官能团(fg
sc’)与该化合物[5-b]中的羧基进行酰胺化反应。
[1102]
(3)[步骤5-3]
[1103]
将脂溶性保护基(pg
scy
)进行脱保护。
[1104]
(4)通过重复1次以上的上述(2)和(3)的步骤,可制造多肽部分的c末端氨基酸的羧基与树脂键合、在自该c末端氨基酸起的第m'位的氨基酸侧链上所存在的官能团被多肽接头取代、而且该多肽接头的n末端氨基酸的氨基游离的化合物[5-c]。
[1105]
(5)[步骤5-4]
[1106]
使作为链烷二羧酸的化合物[5-d]与上述(4)中得到的化合物[5-c]进行反应,而将化合物[5-c]中的游离氨基与该化合物[5-d]中的1个羧基进行酰胺化反应,由此可制造化合物[5-e]。
[1107]
(6)[步骤5-5]
[1108]
对上述(5)中得到的化合物[5-e]通过使用酸切断与树脂的键合,可制造由化合物[5-f]表示的本发明化合物。作为可在本步骤中使用的酸,例如可举出:tfa。
[1109]
另外,此时,在形成多肽部分的氨基酸中其侧链上存在被保护的官能团的情况下,可同时对该官能团的保护基进行脱保护。
[1110]
如此得到的化合物[5-f]可通过已知的分离纯化手段、例如浓缩、减压浓缩、再沉淀、溶剂萃取、结晶、色谱等进行单离纯化。
[1111]
需要说明的是,在上述图解5所记载的方法中,用作原料化合物的化合物[5-b]和化合物[5-d]可通过自身已知的方法进行制造、或可通过购入市售品来获取。另外,化合物[5-a]可通过上述图解1或图解2所记载的方法或可通过与它们类似的方法进行制造。
[1112]
制造化合物[6-c]的方法(e法),其中,在形成多肽部分的2个氨基酸中,在这些氨基酸的各自的侧链上存在官能团、各自的官能团被相同多肽接头(-z
sc1-z
sc2
‑…‑zscy'-)取代而形成环
[1113]
该化合物[6-c]例如可通过以下概述的固相合成进行制造(图解6)。
[1114]
在此,该多肽接头由1~4个氨基酸构成。
[1115]
需要说明的是,在图解6中示例了化合物[6-a]的制造方法,该化合物在自多肽部分的c末端氨基酸起的第m'位和第m”位的氨基酸侧链上分别存在官能团、该官能团被相同多肽接头取代而形成环。
[1116]
图解6
[1117][1118]
(图解6中,
[1119]ra1
、r
a2
、r
b1
、r
b2
、r
b3
、l
n1
、l
n2
、环a、环b、h-z
x-oh、x、m、m’、z
x
、和l
sc
与所述的定义相同。
[1120]
m”表示2~15的整数,其中,为“m’《m”≤m”的关系,
[1121]
化合物[6-c]中的多肽接头(-z
sc1-z
sc2
‑…‑zscy
’-)相当于由式[i']表示的化合物中的l3(在此,该l3表示gly、β-ala、或gaba),
[1122]
y’表示1~p’的整数,
[1123]
p’表示1~4的整数。
[1124]
l
sc’和l
sc”表示c
1-4
烷烃二基。
[1125]
fg
sc’和fg
sc”表示存在于氨基酸侧链上的官能团。需要说明的是,该官能团例如表示式-o-(式-oh)、式-s-(式-sh)、式-nh-(式-nh2)、式-c(=o)o-(式-c(=o)oh)、式-c(=o)
nh-(式-c(=o)nh2)。
[1126]
pg
sc’和pg
sc”表示对存在于氨基酸侧链上的官能团的保护基。该官能团例如为dde、ivdde、alloc、烯丙基。)
[1127]
(1)[步骤6-1]
[1128]
将化合物[6-a]中的在自多肽部分的c末端氨基酸起的第m'位的氨基酸侧链上所存在的官能团的保护基(pg
sc’)选择性地进行脱保护。
[1129]
(2)[步骤6-2]
[1130]
使氨基被脂溶性保护基(pg
scy’)保护的氨基酸(化合物[6-d])与上述(1)中得到的化合物进行反应,而使上述(1)中得到的化合物中的游离官能团(fg
sc’)与氨基被脂溶性保护基保护的该化合物[6-d]中的羧基进行酰胺化反应。
[1131]
(3)[步骤6-3]
[1132]
将脂溶性保护基进行脱保护。
[1133]
(4)通过重复1次以上的上述(2)和(3)的步骤,可制造在自多肽部分的c末端氨基酸起的第m'位的氨基酸侧链上所存在的官能团被多肽接头取代、而且该多肽接头的n末端氨基酸的氨基游离、且在自c末端氨基酸起的第m”位的氨基酸侧链上所存在的官能团(fg
sc”)被保护基(pg
sc”)保护的化合物[6-b]。
[1134]
(5)[步骤6-4]
[1135]
将化合物[6-b]中的在自多肽部分的c末端氨基酸起的第m”位的氨基酸侧链上所存在的保护基(pg
sc”)选择性地进行脱保护。
[1136]
(6)[步骤6-5]
[1137]
使上述(5)中得到的化合物中的“游离官能团(fg
sc”)”与“z
scp’中的游离氨基”进行反应,而进行分子内环化反应。
[1138]
(7)[步骤6-6]
[1139]
对上述(6)中得到的化合物通过使用酸切断与树脂的键合,可制造由化合物[6-c]表示的本发明化合物。作为可在本步骤中使用的酸,例如可举出:tfa。
[1140]
另外,此时,在形成多肽部分的氨基酸中其侧链上存在被保护的官能团的情况下,可同时对该官能团的保护基进行脱保护。
[1141]
如此得到的化合物[6-c]可通过已知的分离纯化手段、例如浓缩、减压浓缩、再沉淀、溶剂萃取、结晶、色谱等进行单离纯化。
[1142]
需要说明的是,在上述图解6所记载的方法中,用作原料化合物的化合物[6-d]可通过自身已知的方法进行制造、或可通过购入市售品来获取。另外,化合物[6-a]可通过上述的图解1或图解2所记载的方法或可通过与它们类似的方法进行制造。
[1143]
制造在环b上具有取代基“被官能团取代的烷基氨基羰基”的化合物[7-f]的方法(f法)
[1144]
该化合物[7-f]例如可通过以下概述的固相合成进行制造(图解7)。
[1145]
图解7
[1146][1147]
(图解7中,
[1148]ra1
、r
a2
、r
b1
、r
b2
、l
n1
、l
n2
、环a、环b、h-z
x-oh、x、m、z
x
、和y1与所述的定义相同。
[1149]
lr表示c
1-4
烷烃二基,
[1150]
fgr表示被存在于环b上的取代基“烷基氨基羰基(l
r-nhc(=o)-)”的“烷基(lr)”取代的官能团,例如可举出:式-o-(式-oh)、式-s-(式-sh)、式-nh-(式-nh2)、式-c(=o)o-(式-c(=o)oh)、式-c(=o)nh-(式-c(=o)nh2)。
[1151]
pgr表示上述官能团(fgr)的保护基,作为该保护基,例如可举出:对于羧基的tbu、对于氨基甲酰基的trt、对于羟基的tbu、对于硫醇(硫烷基)的tbu、对于氨基的boc。需要说明的是,这些保护基均可通过用酸进行处理来脱保护。)
[1152]
(1)[步骤7-1]
[1153]
通过使化合物[7-a]或化合物[7-b]与化合物[1-c]进行反应,而将化合物[1-c]中的多肽部分的n末端氨基酸的游离氨基进行磺酰化或酰化,由此可制造在环b上具有羧基的化合物[7-c]。
[1154]
(2)[步骤7-2]
[1155]
通过使化合物[7-d]与化合物[7-c]进行反应,而使化合物[7-c]中的羧基与化合物[7-d]中的氨基进行酰胺化反应,由此可制造化合物[7-e]。
[1156]
(3)[步骤7-3]
[1157]
对上述(2)中得到的化合物[7-e]通过使用酸切断与树脂的键合,同时将存在于环b上的“被官能团(fgr)取代的烷基氨基羰基”的该官能团的保护基(pgr)进行脱保护,可制造由化合物[7-f]表示的本发明化合物。作为可在本步骤中使用的酸,例如可举出:tfa。
[1158]
另外,此时,在形成多肽部分的氨基酸中其侧链上存在被保护的官能团的情况下,可同时对该官能团的保护基进行脱保护。
[1159]
如此得到的化合物[7-f]可通过已知的分离纯化手段、例如浓缩、减压浓缩、再沉
淀、溶剂萃取、结晶、色谱等进行单离纯化。
[1160]
需要说明的是,在上述图解7所记载的方法中,用作原料化合物的化合物[7-a]、化合物[7-b]和化合物[7-d]可通过自身已知的方法进行制造、或可通过购入市售品来获取。另外,化合物[1-c]可通过上述的图解1所记载的方法或可通过与它们类似的方法进行制造。
[1161]
制造环a被环b直接取代的化合物[8-f]的方法(g法)
[1162]
该化合物[8-f]例如可通过以下概述的固相合成进行制造(图解8)。
[1163]
图解8
[1164][1165]
(图解8中,
[1166]ra1
、r
a2
、r
b1
、r
b2
、r
b3
、l
n1
、环a、环b、h-z
x-oh、x、m、z
x
、和y1与所述的定义相同。
[1167]
lga表示离去基团,作为该离去基团,例如可举出:氯原子、溴原子、碘原子、卤代c
1-6
烷基磺酰基氧基,
[1168]
mb表示硼酸、硼酸酯、烷基锡、烷基硅烷、或烷氧基硅烷。)
[1169]
(1)[步骤8-1]
[1170]
通过使化合物[8-a]或化合物[8-b]与化合物[1-c]进行反应,而将化合物[1-c]中的多肽部分的n末端氨基酸的游离氨基进行磺酰化或酰化,由此可制造化合物[8-c]。
[1171]
(2)[步骤8-2]
[1172]
通过使化合物[8-c]在金属催化剂和碱的存在下与化合物[8-d]进行偶联反应,可制造环a被环b直接取代的化合物[8-e]。作为该金属催化剂,例如可举出:四(三苯基膦)钯、乙酸钯、三(二亚苄基丙酮)二钯。作为该碱,例如可举出:碳酸铯、碳酸钾、碳酸钠等金属碳酸盐、磷酸钾、氟化铯、氟化钾、氟化四丁基铵。
[1173]
(3)[步骤8-3]
[1174]
对上述(2)中得到的化合物[8-e]通过使用酸切断与树脂的键合,可制造由化合物[8-f]表示的本发明化合物。作为可在本步骤中使用的酸,例如可举出:tfa。
[1175]
另外,此时,在形成多肽部分的氨基酸中其侧链上存在被保护的官能团的情况下,可同时对该官能团的保护基进行脱保护。
[1176]
如此得到的化合物[8-f]可通过已知的分离纯化手段、例如浓缩、减压浓缩、再沉淀、溶剂萃取、结晶、色谱等进行单离纯化。
[1177]
需要说明的是,在上述图解8所记载的方法中,用作原料化合物的化合物[8-a]、化合物[8-b]和化合物[8-d]可通过自身已知的方法进行制造、或可通过购入市售品来获取。另外,化合物[1-c]可通过上述的图解1所记载的方法或可通过与它们类似的方法进行制造。
[1178]
制造在环a上具有取代基“芳基羰基氨基(式环b-c(=o)nh-)的化合物[9-f]的方法(h法)
[1179]
该化合物[9-f]例如可通过以下概述的固相合成进行制造(图解9)。
[1180]
图解9
[1181][1182]
(图解9中,
[1183]ra1
、r
a2
、r
b1
、r
b2
、r
b3
、l
n1
、环a、环b、h-z
x-oh、x、m、z
x
、和y1与所述的定义相同。
[1184]
y2表示羟基或氯原子,
[1185]
pga表示保护存在于环a上的氨基的脂溶性保护基,
[1186]
在此,作为该脂溶性保护基,例如可举出:fmoc。)
[1187]
(1)[步骤9-1]
[1188]
与图解8的步骤8-1同样,通过使化合物[9-a]或化合物[9-b]与化合物[1-c]进行反应,而将化合物[1-c]中的多肽部分的n末端氨基酸的游离氨基进行磺酰化或酰化,由此可制造化合物[9-c]。
[1189]
(2)[步骤9-2]
[1190]
将上述(1)中得到的化合物[9-c]中的脂溶性保护基(pga)进行脱保护。
[1191]
(3)[步骤9-3]
[1192]
使化合物[9-d]与上述(2)中得到的化合物进行反应,而使上述(2)中得到的化合物中的游离氨基与该化合物[9-d]中的羧基进行酰胺化(酰化)反应,由此可制造化合物[9-e]。
[1193]
(4)[步骤9-4]
[1194]
对上述(3)中得到的化合物[9-e]通过使用酸切断与树脂的键合,可制造由化合物[9-f]表示的本发明化合物。作为可在本步骤中使用的酸,例如可举出:tfa。
[1195]
另外,此时,在形成多肽部分的氨基酸中其侧链上存在被保护的官能团的情况下,可同时对该官能团的保护基进行脱保护。
[1196]
如此得到的化合物[9-f]可通过已知的分离纯化手段、例如浓缩、减压浓缩、再沉淀、溶剂萃取、结晶、色谱等进行单离纯化。
[1197]
需要说明的是,在上述图解9所记载的方法中,用作原料化合物的化合物[9-a]、化合物[9-b]和化合物[9-d]可通过自身已知的方法进行制造、或可通过购入市售品来获取。另外,化合物[1-c]可通过上述的图解1所记载的方法或可通过与它们类似的方法进行制造。
[1198]
在所述的图解1~9所示的本发明所涉及的化合物[i']的制造方法中,作为氨基酸,可使用所有的氨基酸,例如可举出:作为天然蛋白原性l-氨基酸的、gly或ala、val、leu、ile、pro、phe、his、trp、tyr、ser、thr、met、cys、asp、glu、asn、gln、lys、arg。
[1199]
另外,本制造方法中,还可使用天然非蛋白原性氨基酸、或以上述天然蛋白原性l-氨基酸的d型为代表的非天然氨基酸。
[1200]
在此,作为可在本制造方法中使用的非天然氨基酸,例如可举出:以下的例子。
[1201]
·
(d)-pro、(d)-ser、(d)-thr、(d)-asp、(d)-glu、(d)-arg、(d)-lys;
[1202]
·
β-homopro;
[1203]
·
β-ala、gaba、ape、acp;
[1204]
·
(n-me)ala、(n-me)val、(n-me)leu、(n-me)ile、(n-me)phe、(n-me)tyr、(n-me)ser、(n-me)asp、(n-me)glu;
[1205]
·
由下述式[ii-1]或式[ii-2]
[1206][1207]
表示的基团(在此,r
aa2
为羟基或氨基);
[1208]
·
所述表1和表2中记载的氨基酸。
[1209]
作为脂溶性保护基,例如可举出:9-芴基甲氧基羰基(fmoc)、叔丁基氧基羰基(boc)、苄基(bn)、烯丙基(allyl)、烯丙基氧基羰基(alloc)、乙酰基(ac)等碳酸酯系、酰胺系、或烷基系的保护基。为了对氨基酸导入脂溶性保护基,例如在导入fmoc的情况下,可通过加入9-芴甲基-n-琥珀酰亚胺基碳酸酯(9-
フルオレニルメチル
-n-
スクシニジルカーボネート
)和碳酸氢钠进行反应而导入。反应可在0~50℃下、优选在室温下进行约1~5小时左右。
[1210]
作为用脂溶性保护基保护的氨基酸,可使用市售品。例如可举出:fmoc-ser-oh、fmoc-asn-oh、fmoc-val-oh、fmoc-leu-oh、fmoc-ile-oh、fmoc-ala-oh、fmoc-tyr-oh、fmoc-gly-oh、fmoc-lys-oh、fmoc-arg-oh、fmoc-his-oh、fmoc-asp-oh、fmoc-glu-oh、fmoc-gln-oh、fmoc-thr-oh、fmoc-cys-oh、fmoc-met-oh、fmoc-phe-oh、fmoc-trp-oh、fmoc-pro-oh。
[1211]
另外,作为用脂溶性保护基保护的氨基酸、且侧链上导入有保护基的氨基酸,例如可举出:fmoc-arg(pbf)-oh、fmoc-asn(trt)-oh、fmoc-asp(otbu)-oh、fmoc-cys(tbu)-oh、fmoc-glu(otbu)-oh、fmoc-gln(trt)-oh、fmoc-his(trt)-oh、fmoc-lys(boc)-oh、fmoc-ser
(tbu)-oh、fmoc-thr(tbu)-oh、fmoc-trp(boc)-oh、fmoc-tyr(tbu)-oh。
[1212]
作为树脂(resin),通常只要是固相合成中使用的树脂即可,例如可使用:被氯原子官能化的2-氯三苯甲基氯树脂、王树脂、hmpa-pega树脂、被氨基官能化的氨基-pega树脂。
[1213]
作为得到肽c末端的酰胺体(酰胺化合物)的方法,可使用酰胺体合成用树脂进行固相合成。例如可使用:rink-amide-am树脂、sal-peg树脂、sal-mbha树脂、rink-amide-pega树脂。可通过用酸将这些树脂与肽进行切断,得到肽c末端的酰胺体。
[1214]
关于氨基被脂溶性保护基保护的氨基酸与树脂的键合,例如,在使用具有羟基的树脂或被氯原子官能化的树脂的情况下,可通过使氨基酸的羧基与树脂进行酯键合,来进行键合。
[1215]
另外,在使用被氨基官能化的树脂的情况下,可通过使氨基酸的羧基与树脂进行酰胺键合,来进行键合。
[1216]
在使用2-氯三苯甲基氯树脂的情况下,可通过使用二异丙基乙胺(dipea)、三乙胺、吡啶、2,4,6-三甲基吡啶等碱进行酯化。
[1217]
在使用具有羟基的树脂的情况下,作为酯化催化剂,例如可使用1-(均三甲苯-2-磺酰基)-3-硝基-1,2,4,-三唑(msnt)、二环己基碳二亚胺(dcc)、二异丙基碳二亚胺(dic)等已知的脱水稠合剂(脱水缩合剂)。关于氨基酸与脱水稠合剂的使用比例,相对于1当量的前者,后者通常为1~10当量、优选为2~5当量。
[1218]
酯化反应优选例如通过将树脂装入固相柱中,用溶剂洗涤该树脂,之后加入氨基酸的溶液来进行。作为洗涤用溶剂,例如可举出:氯仿、二甲基甲酰胺(dmf)、2-丙醇、二氯甲烷等。作为溶解氨基酸的溶剂,例如可举出:氯仿、二甲基亚砜(dmso)、dmf、二氯甲烷等。酯化反应可在0~50℃下、优选在室温下进行约10分钟~30小时左右、优选15分钟~24小时左右。
[1219]
此时,还优选将固相上的未反应羟基使用乙酸酐等进行乙酰化并封端。
[1220]
脂溶性保护基的离去例如可通过用碱处理来进行。作为碱,例如可举出:哌啶、吗啉等。此时,优选在溶剂的存在下来进行。作为溶剂,例如可举出:dmf、dmso、乙醇等。
[1221]
优选游离的氨基、与氨基被脂溶性保护基保护的任意氨基酸的羧基的酰胺化反应在活化剂和溶剂的存在下来进行。
[1222]
作为活化剂,例如可举出:二环己基碳二亚胺(dcc)、1-乙基-3-(二甲基氨基丙基)碳二亚胺盐酸盐(wsc/hcl)、二苯基磷酰基叠氮化物(dppa)、羰基二咪唑(cdi)、氰基膦酸二乙酯(depc)、苯并三唑-1-基氧基-三吡咯烷基鏻(dipci)、苯并三唑-1-基氧基-三吡咯烷基鏻六氟磷酸盐(pybop)、1-羟基苯并三唑(hobt)、羟基琥珀酰亚胺(hosu)、二甲基氨基吡啶(dmap)、1-羟基-7-氮杂苯并三唑(hoat)、羟基邻苯二甲酰亚胺(hopht)、五氟苯酚(pfp-oh)、2-(1h-苯并三唑-1-基)-1,1,3,3,-四甲基脲六氟磷酸盐(hbtu)、1-[双(二甲基氨基)亚甲基]-5-氯-1h-苯并三唑鎓3-氧化物六氟磷酸盐(hctu)、o-(7-氮杂苯并三唑-1-基)-1,1,3,3-四甲基脲六氟膦酸盐(hatu)、o-苯并三唑-1-基-1,1,3,3-四甲基脲四氟硼酸盐(tbtu)、3,4-二氢-3-羟基-4-氧杂-1,2,3-苯并三嗪(dhht)、n-[1-(氰基-2-乙氧基-2-氧代亚乙基氨基氧基)二甲基氨基(吗啉代)]脲六氟磷酸盐(comu)、氰基(羟基亚氨基)乙酸乙酯(oxyma)等。
[1223]
相对于氨基被脂溶性保护基保护的任意氨基酸,优选活化剂的使用量为1~20当量、优选为1~10当量、进一步优选为1~5当量。
[1224]
作为溶剂,例如可举出:dmf、dmso、二氯甲烷等。反应可在0~50℃、优选在室温下进行约10分钟~30小时左右、优选15分钟~2小时左右。
[1225]
在自树脂切断肽链的情况下,可通过基于酸的处理来进行。作为酸,例如可举出:三氟乙酸(tfa)、氟化氢(hf)。脱树脂反应可在0~50℃下、优选在室温下进行约10分钟~10小时左右、优选30分钟~4小时左右。
[1226]
通过以下的实施例、参考例和试验例对本发明进行更详细地说明,但本发明不限于这些,并且可在不脱离本发明范围的范围内进行改变。
[1227]
本说明书中的缩写如下所示。
[1228]
apci:大气压化学离子化法;
[1229]
arg(pbf):n
ω-2,2,4,6,7-五甲基二氢苯并呋喃磺酰精氨酸;
[1230]
bu:丁基;
[1231]
buoh:丁醇;
[1232]
dde:1-(4,4-二甲基-2,6-二氧代环己亚基)-3-乙基;
[1233]
dmso-d6:六氘代二甲基亚砜;
[1234]
elsd:蒸发光散射检测器;
[1235]
esi:电喷雾离子化法;
[1236]
hplc:高效液相色谱;
[1237]
ivdde:1-(4,4-二甲基-2,6-二氧代环己亚基)-3-甲基丁基;
[1238]
lcms:液体色谱质谱法;
[1239]
nmp:1-甲基-2-吡咯烷酮;
[1240]
trt:三苯甲基;
[1241]
uv:紫外线。
[1242]
本说明书中,除非另有说明,否则“室温”是指20~30℃。
[1243]
除非另有说明,否则“冰冷下”是指0~5℃。
[1244]
本说明书中,关于使用柱色谱进行纯化时的“silica gel cartridge(硅胶柱)”,使用了biotage公司制造的biotage(注册商标)snap ultra或buchi公司制造的reveleris(注册商标)silica 40μm。
[1245]
关于使用反相柱色谱的纯化(以下,有时也记载为制备lcms),从下述的2个条件中适当选择并进行纯化。
[1246]
制备装置:agilent公司agilent 1260infinity和agilent 6130(离子化法:electron spray ionization:esi)、在连接elsd检测器的情况下使用了agilent 385-elsd。
[1247]
溶剂:a液;含0.1%甲酸的水、b液;含0.1%甲酸的乙腈;
[1248]
流速:50ml/分钟。
[1249]
柱使用以下的任一种:
[1250]
waters xbridge prep c18、5μm、30
×
50mm;
[1251]
waters xselect csh c18、5μm、30
×
50mm。
[1252]
(制备条件a)
[1253]
0.0-0.5分钟(a液/b液=90/10);
[1254]
0.5-7.5分钟(a液/b液=90/10~20/80);
[1255]
7.5-7.95分钟(a液/b液=20/80);
[1256]
7.95-8.0分钟(a液/b液=20/80~5/95);
[1257]
8.0-9.0分钟(a液/b液=5/95)。
[1258]
(制备条件b)
[1259]
0.0-0.5分钟(a液/b液=95/5);
[1260]
0.5-7.5分钟(a液/b液=95/5~50/50);
[1261]
7.5-7.95分钟(a液/b液=50/50);
[1262]
7.95-8.0分钟(a液/b液=50/50~5/95);
[1263]
8.0-9.0分钟(a液/b液=5/95)。
[1264]
本说明书中记载的各仪器数据利用以下的仪器进行测定。
[1265]
微波反应装置:initiator(biotage ab);
[1266]
nmr谱:[1h-nmr]600mhz:jnm-eca600(日本电子)、400mhz:avance iii hd 400(bruker)。
[1267]
本说明书中的高效液相色谱质谱(lcms)和保留时间(rt)利用以下所示的条件进行测定。
[1268]
测定仪器:shimadzu公司lcms-2010ev;
[1269]
柱:shimadzu xr-ods、2.2μm、2.0
×
30mm;
[1270]
离子化法:esi/apci双源;
[1271]
溶剂:a液;含0.1%甲酸的水、b液;含0.1%甲酸的乙腈;
[1272]
流速:0.6ml/分钟、检测法:uv210nm、254nm。
[1273]
(分析条件a)
[1274]
0.0-1.0分钟(a液/b液=90/10~60/40);
[1275]
1.0-2.0分钟(a液/b液=60/40~1/99);
[1276]
2.0-2.6分钟(a液/b液=1/99)。
[1277]
(分析条件b)
[1278]
0.0-0.5分钟(a液/b液=90/10);
[1279]
0.5=1.5分钟(a液/b液=90/10~70/30);
[1280]
1.5-2.5分钟(a液/b液=70/30~1/99);
[1281]
2.5-5.0分钟(a液/b液=1/99)。
[1282]
制造例、参考例、和实施例中的化合物名称通过“acd/name 20l9.1.2(acdlabs 20l9.1.2,advanced chemistry development inc.)”进行命名。
[1283]
参考例1 4-(4-氨基甲酰基苯甲酰胺)苯磺酰氯
[1284][1285]
向4-氨基甲酰基苯甲酸(150g)的dmf(180ml)溶液中加入wsc一盐酸盐(209g)、hobt一水合物(167g)和dipea(380ml)。在室温下搅拌5分钟后,加入苯胺(99ml),在室温下搅拌72小时。向反应液中加入水,滤取所析出的固体,得到了作为黄色无定形的n-苯基对苯二甲酰胺(147g)。
[1286]
向所得的n-苯基对苯二甲酰胺中加入氯磺酸(407ml),在60℃下加热搅拌1小时。将反应混合物冰冷后,加入到冰水中。滤取所析出的固体,用水洗涤后,进行干燥,得到了作为淡黄色固体的标题化合物(198g)。
[1287]1h nmr(400mhz,dmso-d6)δppm 7.54(bs,1h),7.62(d,j=8.2hz,2h),7.79(d,j=8.2hz,2h),7.96-8.09(m,4h),8.14(bs,1h),10.46(s,1h)
[1288]
参考例2 4-(4-(三氟甲氧基)苯甲酰胺)苯磺酰氯
[1289][1290]
使用与参考例1同样的方法,由对应的原料得到了作为黄色固体的标题化合物。
[1291]1h nmr(400mhz,dmso-d6)δppm 7.52(d,j=8.3hz,2h),7.58(d,j=8.3hz,2h),7.72(d,j=8.3hz,2h),8.08(d,j=8.3hz,2h),10.42(s,1h)
[1292]
参考例3 4-(4-(甲基氨基甲酰基)苯甲酰胺)苯磺酰氯
[1293][1294]
使用与参考例1同样的方法,由对应的原料得到了作为灰色固体的标题化合物。
[1295]1h nmr(600mhz,dmso-d6)δppm 2.81(d,j=4.1hz,3h),7.57-7.61(m,2h),7.72-7.78(m,2h),7.96(d,j=8.7hz,2h),8.03(d,j=8.7hz,2h),8.62(q,j=4.1,1h),10.42(s,1h)
[1296]
参考例4 4-(4-(二甲基氨基甲酰基)苯甲酰胺)苯磺酰氯
[1297][1298]
使用与参考例1同样的方法,由对应的原料得到了作为茶色固体的标题化合物。
[1299]1h nmr(600mhz,dmso-d6)δppm 2.91(s,3h),3.01(s,3h),7.54(d,j=8.3hz,2h),7.58(d,j=8.3hz,2h),7.74(d,j=8.3hz,2h),8.01(d,j=8.3hz,2h),10.41(s,1h)
[1300]
参考例5 4-(4-(三氟甲基)苯甲酰胺)苯磺酰氯
[1301][1302]
使用与参考例1同样的方法,由对应的原料得到了作为白色固体的标题化合物。
[1303]1h nmr(400mhz,chloroform-d)δppm 7.81(d,j=8.2hz,2h),7.93(d,j=8.1hz,2h),8.01(d,j=8.2hz,2h),8.08(d,j=8.1hz,3h)
[1304]
参考例6 4-(4-氰基苯甲酰胺)苯磺酰氯
[1305][1306]
使用与参考例1同样的方法,由对应的原料得到了作为淡褐色固体的标题化合物。
[1307]1h nmr(600mhz,dmso-d6)δppm 7.58(d,j=8.3hz,2h),7.74(d,j=8.3hz,2h),7.99(d,j=8.3hz,2h),8.01(d,j=8.3hz,2h),10.42(s,1h)
[1308]
参考例7 4-(4-(1,1,2,2-四氟乙氧基)苯甲酰胺)苯磺酰氯
[1309][1310]
使用与参考例1同样的方法,由对应的原料得到了作为黄色固体的标题化合物。
[1311]1h nmr(400mhz,chloroform-d)δppm 5.95(tt,j=53.2hz,2.8hz,1h),7.37(d,j=8,6hz,2h),7.92(d,j=7.2hz,2h),7.94(d,j=7.2hz,2h),8.05(d,j=8.6hz,2h),8.12(s,1h)
[1312]
参考例8 4-(2-氟苯甲酰胺)苯磺酰氯
[1313][1314]
使用与参考例1同样的方法,由对应的原料得到了作为白色固体的标题化合物。
[1315]1h nmr(400mhz,chloroform-d)δppm 7.20-7.27(m,1h),7.37(dd,j=7.6hz,7.6hz,1h),7.56-7.63(m,1h),7.95(d,j=9.1hz,2h),8.06(d,j=9.1hz,2h),8.20(td,j=8.0hz,1.8hz,1h),8.75(d,j=16.9hz,1h)
[1316]
参考例9 2-氟-4-苯氧基苯甲酸
[1317][1318]
向2,4-二氟苯甲醛(250mg)和苯酚(199mg)的dmf(10ml)溶液中加入碳酸钾(535mg),在120℃下加热搅拌4小时。放冷至室温后,将反应液用乙酸乙酯进行稀释,并用水进行洗涤。将有机层用无水硫酸镁进行干燥,在减压下进行浓缩,得到了2-氟-4-苯氧基苯甲醛。
[1319]
将所得的2-氟-4-苯氧基苯甲醛溶解于四氢呋喃(5ml)和水(5ml)中,加入磷酸二氢钠(844mg)、2-甲基-2-丁烯(1.49ml)和亚氯酸钠(636mg),在室温下搅拌3小时。向反应液中加入氯仿,用水进行洗涤。将有机层通过分相器,在减压下进行浓缩,得到了作为白色固体的标题化合物(182mg)。
[1320]1h nmr(400mhz,dmso-d6)δppm 6.75-6.92(m,2h),7.17(d,j=7.5hz,2h),7.24-7.33(m,1h),7.43-7.55(m,2h),7.83-7.97(m,1h),13.0(br s,1h)
[1321]
参考例10 4-(4-氨基甲酰基-2-氟苯氧基)苯甲酸
[1322][1323]
使用与参考例9同样的方法,由对应的原料得到了作为白色固体的标题化合物。
[1324]1h nmr(400mhz,dmso-d6)δppm 7.12(d,j=8.4hz,1h),7.19(d,j=8.4hz,2h),7.40(t,j=8.3hz,1h),7.53(br s,1h),7.82(t,j=8.3hz,1h),7.90-8.00(m,2h),8.07(br s,1h),9.95(s,1h)
[1325]
参考例11 3-氟-4-(2-氟苯氧基)苯甲酸
[1326][1327]
使用与参考例9同样的方法,由对应的原料得到了作为白色固体的标题化合物。
[1328]1h nmr(400mhz,chloroform-d)δppm 6.89(t,j=8.1hz,1h),7.10-7.25(m,4h),
7.80(d,j=8.4hz,1h),7.89(d,j=11.3hz,1h)
[1329]
参考例12 5-((4-(4-氨基甲酰基苯氧基)苯基)磺酰胺)戊酸
[1330][1331]
在冰冷下向5-氨基戊酸苄酯/甲苯磺酸盐(1.48g)的氯仿(20ml)溶液中加入三乙胺(2.3ml)和4-氟苯磺酰氯(800mg),在冰冷下搅拌1小时。反应结束后,向反应混合物中加入饱和碳酸氢钠水溶液,用氯仿进行萃取。将有机层通过分相器,在减压下进行浓缩。将残渣用柱色谱(silica gel cartridge、己烷∶乙酸乙酯=80∶20~50∶50)进行纯化,得到了作为无色油状物质的5-((4-氟苯基)磺酰胺)戊酸苄酯(1.24g)。
[1332]1h nmr(400mhz,chloroform-d)δppm 1.46-1.56(m,2h),1.58-1.68(m,2h),2.33(t,j=7.0hz,2h),2.96(q,j=6.5hz,2h),4.40-4.47(m,1h),5.09(s,2h),7.18(t,j=8.2hz,2h),7.31-7.39(m,5h),7.86(dd,j=7.6hz,5.3hz,2h)
[1333]
(2)
[1334][1335]
向上述(1)中得到的5-((4-氟苯基)磺酰胺)戊酸苄酯(500mg)的dmf(13ml)溶液中加入4-羟基苄腈(179mg)和碳酸钾(567mg),在微波照射下、在180℃下搅拌1小时。将反应液放冷后,向反应混合物中加入乙酸乙酯和水进行分液。将水层用乙酸乙酯洗涤后,用1m盐酸水溶液调节成ph值为1,用乙酸乙酯/甲苯的混合溶剂进行萃取。将有机层用水洗涤后,用无水硫酸镁进行干燥,在减压下进行浓缩,得到了作为白色固体的5-((4-(4-氰基苯氧基)苯基)磺酰胺)戊酸(285mg)。
[1336]1h nmr(400mhz,dmso-d6)δppm 1.32-1.49(m,4h),2.10-2.17(m,2h),2.69-2.78(m,2h),7.23-7.31(m,2h),7.43(t,j=8.7hz,2h),7.59-7.66(m,1h),7.81-7.87(m,3h),7.91(d,j=8.3hz,1h)
[1337]
(3)向上述(2)中得到的5-((4-(4-氰基苯氧基)苯基)磺酰胺)戊酸(100mg)的dmso(2ml)溶液中加入碳酸钾(81mg)和30%过氧化氢水溶液(0.15ml),在室温下搅拌2小时。反应结束后,加入硫代硫酸钠水溶液和1m盐酸水溶液,用乙酸乙酯进行萃取。将有机层用水洗涤后,用无水硫酸镁进行干燥,在减压下进行浓缩,得到了作为白色固体的标题化合物(89mg)。
[1338]1h nmr(400mhz,dmso-d6)δppm 1.32-1.50(m,4h),2.10-2.18(m,2h),2.69-2.78(m,2h),7.16(d,j=8.2hz,1h),7.19(d,j=8.6hz,1h),7.34(br s,1h),7.43(t,j=8.6hz,2h),7.52-7.58(m,1h),7.59-7.66(m,1h),7.86-7.79(m3h),7.96(d,j=7.7hz,1h),12.0
(br s,1h)
[1339]
实施例1作为化合物编号1的化合物(n-[4-(4-氨基甲酰基苯甲酰胺基)苯-1-磺酰基]-d-γ-谷氨酰基-(4s)-4-氨基-l-脯氨酰基-l-亮氨酰基-n-(5-氨基-5-氧代戊烷基)-n
2-甲基-l-α-谷氨酰胺)的合成
[1340][1341]
(1)将fmoc-rink amide am树脂(0.10mmol)用哌啶的dmf溶液(浓度:40%、1.6ml)处理3分钟后,用哌啶的dmf溶液(浓度:20%、1.6ml)处理12分钟而将树脂的fmoc进行脱保护。接下来,加入fmoc-ape-oh(0.40mmol)的dmf(0.8ml)溶液、comu(0.40mmol)和oxym a(0.40mmol)的dmf(0.8ml)溶液、dipea(0.80mmol)的nmp(0.4ml)溶液,在室温下振荡40分钟,导入了ape残基。以同样的方式重复进行fmoc的脱保护和稠合,具体而言,依次将fmoc-(n-me)glu(otbu)-oh、fmoc-leu-oh、fmoc-(2s,4s)-(4-nhboc)pro-oh、fmoc-(d)-gl u-otbu进行稠合,将所得到的树脂的n末端fmoc利用与上述同样的方法通过哌啶/dmf处理进行脱保护,由此合成了处于键合有肽的状态的树脂h-γ-(d)-glu(otbu)-(2s,4s)-(4-nhboc)pro-leu-(n-me)glu(otbu)-ape-rink amide am树脂。
[1342]
(2)向上述(1)中得到的树脂中加入参考例1中得到的4-(4-氨基甲酰基苯甲酰胺)苯磺酰氯(0.30mmol)、dipea(0.60mmol)的dmf(3ml)溶液,在室温下振荡1小时。反应结束后,用dmf(3ml
×
3次)和氯仿(3ml
×
3次)洗涤所得到的树脂。
[1343]
(3)向上述(2)中得到的树脂中加入tfa:水:三异丙基硅烷(92.5:2.5:5、4ml),在室温下振荡1.5小时,通过过滤去除了树脂。向滤液中加入已冷却的二乙醚,通过离心分离使已析出的白色粉末沉淀,重复3次通过倾析去除二乙醚的操作,得到了肽的粗体。针对所得到的粗体,通过制备lcms(制备条件b)进行纯化。将洗脱液在试验管中进行分级,收集包含目标物的洗脱级分并进行冻干,得到了作为白色粉末的标题化合物(46mg)。
[1344]
实施例2作为化合物编号106的化合物(n
2-[4-(4-苯氧基苯甲酰胺基)丁酰基]-l-天冬酰胺基-n-[(2s)-4-氨基-1-({(2s)-1-[{(2s,3s)-1-[(2s)-2-(2-氨基-2-氧代乙基)吡咯烷-1-基]-3-甲基-1-氧代戊烷-2-基}(甲基)氨基]-4-甲基-1-氧代戊烷-2-基}氨基)-1-氧代丁烷-2-基]-l-α-天冬酰胺)的合成
[1345][1346]
(1)将fmoc-nh-sal-peg树脂(0.12mmol)用哌啶的dmf溶液(浓度:40%、1.9ml)处
理3分钟后,用哌啶的dmf溶液(浓度:20%、1.9ml)处理12分钟而将树脂的fmoc进行脱保护。接下来,加入fmoc-β-homopro-oh(0.48mmol)的dmf(1.0ml)溶液、comu(0.48mmol)和oxyma(0.48mmol)的dmf(1.0ml)溶液、dipea(0.96mmol)的nmp(0.48ml)溶液,在室温下振荡40分钟,导入了β-homopro残基。以同样的方式重复进行fmoc的脱保护和稠合,具体而言,依次将fmoc-(n-me)ile-oh、fmoc-leu-oh、fmoc-dab(boc)-oh、fmoc-asp(otbu)-oh、fmoc-asn(trt)-oh、fmoc-gaba-oh、4-苯氧基苯甲酸进行稠合,合成了处于键合有肽的状态的树脂ph-o-ph-co-gaba-asn(trt)-asp(otbu)-dab(boc)-leu-(n-me)ile-β-homopro-nh-sal-peg树脂。反应结束后,用dmf(3ml
×
3次)和氯仿(3ml
×
3次)洗涤所得到的树脂。
[1347]
(2)向上述(1)中得到的树脂中加入tfa:水:三异丙基硅烷:二硫苏糖醇(90:2.5:5:2.5、4ml),在室温下振荡2小时,通过过滤去除了树脂。向滤液中加入已冷却的二乙醚,通过离心分离使已析出的白色粉末沉淀,重复3次通过倾析去除二乙醚的操作,得到了肽的粗体。针对所得到的粗体,通过制备lcms(制备条件a)进行纯化。将洗脱液在试验管中进行分级,收集包含目标物的洗脱级分并进行冻干,得到了作为白色粉末的标题化合物(14mg)。
[1348]
实施例3作为化合物编号177的化合物(n
2-(4-{4-[4-(甲基氨基甲酰基)苯氧基]苯甲酰胺基}丁酰基)-l-天冬酰胺基-l-α-天冬氨酰基-l-丙氨酰基-l-亮氨酰基-l-甲硫氨酰基-l-脯氨酰胺)的合成
[1349][1350]
(1)将fmoc-nh-sal-peg树脂(0.10mmol)用哌啶的dmf溶液(浓度:40%、1.6ml)处理3分钟后,用哌啶的dmf溶液(浓度:20%、1.6ml)处理12分钟而将树脂的fmoc进行脱保护。接下来,加入fmoc-pro-oh(0.40mmol)的dmf(0.8ml)溶液、comu(0.40mmol)和oxyma(0.40mmol)的dmf(0.8ml)溶液、dipea(0.80mmol)的nmp(0.4ml)溶液,在室温下振荡40分钟,导入了pro残基。以同样的方式重复进行fmoc的脱保护和稠合,具体而言,依次将fmoc-met-oh、fmoc-le u-oh、fmoc-ala-oh、fmoc-asp(otbu)-oh、fmoc-asn(trt)-oh、fmoc-gaba-oh进行稠合,将所得到的树脂的n末端fmoc利用与上述同样的方法通过哌啶/dmf处理进行脱保护,由此合成了处于键合有肽的状态的树脂h-gaba-asn(trt)-asp(otbu)-ala-leu-met-pro-nh-sal-peg树脂。
[1351]
(2)在上述(1)中得到的树脂中加入4,4
’‑
氧基双苯甲酸(0.75mmol)、hatu(0.15mmol)、dipea(2.0mmol)的dmf(3ml)溶液,在室温下振荡2小时。反应结束后,用dmf(3ml
×
3次)洗涤所得到的树脂。
[1352]
(3)向上述(2)中得到的树脂中加入hatu(0.30mmol)、dipea(0.60mmol)和甲胺的乙醇溶液(浓度:9.8mol/l、0.30mmol)的dmf(3ml)溶液,在室温下搅拌4小时。反应结束后,用dmf(3ml
×
3次)和氯仿(3ml
×
3次)洗涤所得到的树脂。
[1353]
(4)向上述(3)中得到的树脂中加入tfa:水:三异丙基硅烷:二硫苏糖醇(90:2.5:5:2.5、4ml),在室温下振荡2小时,通过过滤去除了树脂。向滤液中加入已冷却的二乙醚,通
基)苯-1-磺酰基]-d-谷氨酰胺)的合成
[1361][1362]
(1)将fmoc-rink amide am树脂(0.10mmol)用哌啶的dmf溶液(浓度:40%、1.6ml)处理3分钟后,用哌啶的dmf溶液(浓度:20%、1.6ml)处理12分钟而将树脂的fmoc进行脱保护。接下来,加入fmoc-β-homopro-oh(0.40mmol)的dmf(0.8ml)溶液、comu(0.40mmol)和oxyma(0.40mmol)的dmf(0.8ml)溶液、dipea(0.80mmol)的nmp(0.4ml)溶液,在室温下振荡40分钟,导入了β-homopro残基。以同样的方式重复进行fmoc的脱保护和稠合,具体而言,依次将fmoc-(n-me)ile-oh、fmoc-leu-oh、fmoc-dab(boc)-oh、fmoc-(d)-glu-otbu进行稠合,将所得到的树脂的n末端fmoc利用与上述同样的方法通过哌啶/dmf处理进行脱保护,由此合成了处于键合有肽的状态的树脂h-γ-(d)-glu(otbu)-dab(boc)-leu-(n-me)ile-β-homopro-rink amide am树脂。
[1363]
(2)向上述(1)中得到的树脂中加入4-溴苯磺酰氯(0.30mmol)、dipea(0.60mmol)的dmf(2ml)溶液,在室温下振荡2小时。反应结束后,用dmf(2ml
×
3次)洗涤所得到的树脂。
[1364]
(3)向上述(2)中得到的树脂中加入三甲基甲硅烷基乙炔(0.30mmol)、双(三苯基膦)二氯化钯(ii)(0.03mmol)、碘化铜(0.03mmol)的dmf(2ml)溶液,在微波照射下、在80℃下加热搅拌30分钟。反应结束后,用dmf(2ml
×
3次)和氯仿(2ml
×
3次)洗涤所得到的树脂。
[1365]
向所得到的树脂中加入四丁基氟化铵的四氢呋喃溶液(浓度:0.33mol/l、0.50mmol),在室温下振荡1小时。反应结束后,用dmf(2ml
×
3次)和氯仿(2ml
×
3次)洗涤所得到的树脂。
[1366]
(4)向上述(3)中得到的树脂中加入叠氮苯(0.20mmol)、硫酸銅(ii)五水合物(0.40mmol)、抗坏血酸(0.40mmol)的水(2ml)和tbuoh(1ml)溶液,在微波照射下、在60℃下加热搅拌1小时。反应结束后,用dmf(2ml
×
3次)和氯仿(2ml
×
3次)洗涤所得到的树脂。
[1367]
(5)向上述(4)中得到的树脂中加入tfa:水:三异丙基硅烷(92.5:2.5:5、4ml),在室温下振荡2小时、通过过滤去除了树脂。向滤液中加入已冷却的二乙醚,通过离心分离使已析出的白色粉末沉淀,重复3次通过倾析去除二乙醚的操作,得到了肽的粗体。针对所得到的粗体,通过制备lcms(制备条件a)进行纯化。将洗脱液在试验管中进行分级,收集包含目标物的洗脱级分并进行冻干,得到了作为白色粉末的标题化合物(12mg)。
[1368]
实施例6作为化合物编号634的化合物(n
2-(4'-乙酰基[1,1'-联苯基]-4-磺酰基)-n-[(2s)-1-({(2s)-1-[{(2s,3s)-1-[(2s)-2-(2-氨基-2-氧代乙基)吡咯烷-1-基]-3-甲基-1-氧代戊烷-2-基}(甲基)氨基]-4-甲基-1-氧代戊烷-2-基}氨基)-1-氧代丙烷-2-基]-d-天冬酰胺)的合成
[1369][1370]
(1)将fmoc-nh-sal-peg树脂(0.10mmol)用哌啶的dmf溶液(浓度:40%、1.6ml)处理3分钟后,用哌啶的dmf溶液(浓度:20%、1.6ml)处理12分钟而将树脂的fmoc进行脱保护。接下来,加入fmoc-β-homopro-oh(0.40mmol)的dmf(0.8ml)溶液、comu(0.40mmol)和oxyma(0.40mmol)的dmf(0.8ml)溶液、dipea(0.80mmol)的nmp(0.4ml)溶液,在室温下振荡40分钟,导入了β-homopro残基。以同样的方式重复进行fmoc的脱保护和稠合,具体而言,依次将fmoc-(n-me)ile-oh、fmoc-leu-oh、fmoc-ala-oh、fmoc-(d)-asp-otbu进行稠合,通过将所得到的树脂的n末端fmoc利用与上述同样的方法进行哌啶/dmf处理而脱保护,由此合成了处于键合有肽的状态的树脂h-β-(d)-asp(otbu)-ala-leu-(n-me)ile-β-homopro-nh-sal-peg树脂。
[1371]
(2)向上述(1)中得到的树脂中加入4-碘苯磺酰氯(0.30mmol)、dipea(0.60mmol)的dmf(2ml)溶液,在室温下振荡2小时。反应结束后,用dmf(2ml
×
3次)和氯仿(2ml
×
3次)洗涤所得到的树脂。
[1372]
(3)向上述(2)中得到的树脂中加入4-乙酰基苯硼酸(0.40mmol)、四(三苯基膦)钯(0)(0.03mmol)、磷酸钾(0.50mmol)的1,4-二噁烷(1.5ml)和水(1.5ml)溶液,在微波照射下、在100℃下加热搅拌30分钟。反应结束后,用dmf(2ml
×
3次)和氯仿(2ml
×
3次)洗涤所得到的树脂。
[1373]
(4)向上述(3)中得到的树脂中加入tfa:水:三异丙基硅烷(92.5:2.5:5、4ml),在室温下振荡2小时,通过过滤去除了树脂。向滤液中加入已冷却的二乙醚,通过离心分离使已析出的白色粉末沉淀,重复3次通过倾析去除二乙醚的操作,得到了肽的粗体。针对所得到的粗体,通过制备lcms(制备条件a)进行纯化。将洗脱液在试验管中进行分级,收集包含目标物的洗脱级分并进行冻干,得到了作为白色粉末的标题化合物(8mg)。
[1374]
实施例7作为化合物编号692的化合物(n-[(2s)-3-氨基-1-({(2s)-1-[{(2s,3s)-1-[(2s)-2-(2-氨基-2-氧代乙基)吡咯烷-1-基]-3-甲基-1-氧代戊烷-2-基}(甲基)氨基]-4-甲基-1-氧代戊烷-2-基}氨基)-1-氧代丙烷-2-基]-n
2-[4-(4-甲氧基苯甲酰胺基)苯-1-磺酰基]-d-天冬酰胺)的合成
[1375][1376]
(1)将fmoc-rink amide am树脂(0.10mmol)用哌啶的dmf溶液(浓度:40%、1.6ml)处理3分钟后,用哌啶的dmf溶液(浓度:20%、1.6ml)处理12分钟而将树脂的fmoc进行脱保
护。接下来,加入fmoc-β-homopro-oh(0.40mmol)的dmf(0.8ml)溶液、comu(0.40mmol)和oxyma(0.40mmol)的dmf(0.8ml)溶液、dipea(0.80mmol)的nmp(0.4ml)溶液,在室温下振荡40分钟,导入了β-homopro残基。以同样的方式重复进行fmoc的脱保护和稠合,具体而言,依次将fmoc-(n-me)ile-oh、fmoc-leu-oh、fmoc-dap(boc)-oh、fmoc-(d)-asp-otbu进行稠合,将所得到的树脂的n末端fmoc利用与上述同样的方法通过哌啶/dmf处理进行脱保护,由此合成了处于键合有肽的状态的树脂h-γ-(d)-asp(otbu)-dap(boc)-leu-(n-me)ile-β-homopro-rink amide am树脂。
[1377]
(2)向上述(1)中得到的树脂中加入(9h-芴-9-基)甲基(4-(氯磺酰基)苯基)氨基甲酸酯(0.30mmol)、dipea(0.60mmol)的1,4-二噁烷(3ml)溶液,在室温下振荡1小时。反应结束后,用dmf(3ml
×
3次)洗涤所得到的树脂。接下来,加入哌啶的dmf溶液(浓度:20%、3ml)和oxyma(0.01mmol),在室温下振荡10分钟。
[1378]
(3)向上述(2)中得到的树脂中加入4-甲氧基苯甲酰氯(0.30mmol)、dipea(0.60mmol)的1,4-二噁烷(2ml)溶液,在室温下振荡3小时。反应结束后,用氯仿(3ml
×
3次)洗涤所得到的树脂。
[1379]
(4)向上述(3)中得到的树脂中加入tfa:水:三异丙基硅烷:二硫苏糖醇(90:2.5:5:2.5、4ml),在室温下振荡2小时,通过过滤去除了树脂。向滤液中加入已冷却的二乙醚,通过离心分离使已析出的白色粉末沉淀,重复3次通过倾析去除二乙醚的操作,得到了肽的粗体。针对所得到的粗体,通过制备lcms(制备条件a)进行纯化。将洗脱液在试验管中进行分级,收集包含目标物的洗脱级分并进行冻干,得到了作为白色粉末的标题化合物(12mg)。
[1380]
实施例8作为化合物编号892的化合物([(2s,5s,8s,20s)-8-[{(2s,3s)-1-[(2s)-2-(2-氨基-2-氧代乙基)吡咯烷-1-基]-3-甲基-1-氧代戊烷-2-基}(甲基)氨基甲酰基]-5-甲基-3,6,14,17,21-五氧代-20-{4-[(4-苯氧基苯-1-磺酰基)氨基]丁酰胺基}-1,4,7,13,16-五氮杂环二十一烷-2-基]乙酸)的合成
[1381][1382]
(1)将fmoc-nh-sal-peg树脂(0.12mmol)用哌啶的dmf溶液(浓度:40%、1.9ml)处理3分钟后,用哌啶的dmf溶液(浓度:20%、1.9ml)处理12分钟而将树脂的fmoc进行脱保护。接下来,加入fmoc-β-homopro-oh(0.48mmol)的dmf(1.0ml)溶液、comu(0.48mmol)和oxyma(0.48mmol)的dmf(1.0ml)溶液、dipea(0.96mmol)的nmp(0.48ml)溶液,在室温下振荡40分钟,导入了β-homopro残基。以同样的方式重复进行fmoc的脱保护和稠合,具体而言,依次将fmoc-(n-me)ile-oh、fmoc-lys(dde)-oh、fmoc-ala-oh、fmoc-asp(otbu)-oh、fmoc-glu(oallyl)-oh、fmoc-gaba-oh进行稠合,将所得到的树脂的n末端fmoc利用与上述同样的方法通过哌啶/dmf处理进行脱保护,由此合成了处于键合有肽的状态的树脂h-gaba-glu
(oallyl)-asp(otbu)-ala-lys(dde)-(n-me)ile-β-homopro-sal-peg树脂。
[1383]
(2)向上述(1)中得到的树脂中加入4-苯氧基苯磺酰氯(0.36mmol)、dipea(0.72mmol)的dmf(3ml)溶液,在室温下振荡1.5小时。反应结束后,用dmf(3ml
×
3次)洗涤所得到的树脂。
[1384]
(3)向上述(2)中得到的树脂中加入肼一水合物的dmf溶液(浓度:5%、3ml)和烯丙醇(3.1mmol),在室温下振荡30分钟,将lys侧链的dde进行脱保护。接下来,加入fmoc-gly-oh(0.48mmol)、comu(0.48mmol)、oxyma(0.48mmol)、和dipea(0.96mmol)的dmf(3ml)溶液,在室温下振荡30分钟,导入了gly残基。反应结束后,用dmf(3ml
×
3次)和氯仿(3ml
×
3次)洗涤所得到的树脂。
[1385]
(4)向上述(3)中得到的树脂中加入四(三苯基膦)钯(0)(0.12mmol)、苯基硅烷(0.60mmol)的氯仿(4ml)溶液,在室温下振荡1.5小时,将glu侧链的allyl进行脱保护。接下来,加入哌啶的dmf溶液(浓度:20%、3ml),在室温下振荡30分钟,将fmoc进行脱保护。反应结束后,用dmf(3ml
×
5次)洗涤所得到的树脂。
[1386]
(5)向上述(4)中得到的树脂中加入pybop(0.36mmol)、dipea(0.12mmol)的dmf(4ml)溶液,在室温下振荡2小时。反应结束后,用dmf(3ml
×
3次)和氯仿(3ml
×
3次)洗涤所得到的树脂。
[1387]
(6)向上述(5)中得到的树脂中加入tfa:水:三异丙基硅烷:二硫苏糖醇(90:2.5:5:2.5、4ml),在室温下振荡2小时,通过过滤去除了树脂。向滤液中加入已冷却的二乙醚,通过离心分离使已析出的白色粉末沉淀,重复3次通过倾析去除二乙醚的操作,得到了肽的粗体。针对所得到的粗体,通过制备lcms(制备条件a)进行纯化。将洗脱液在试验管中进行分级,收集包含目标物的洗脱级分并进行冻干,得到了作为白色粉末的标题化合物(10mg)。
[1388]
实施例9作为化合物编号903的化合物((2s,5s,32r)-2-{[(2s)-1-({(2s)-1-[{(2s,3s)-1-[(2s)-2-(2-氨基-2-氧代乙基)吡咯烷-1-基]-3-甲基-1-氧代戊烷-2-基}(甲基)氨基]-4-甲基-1-氧代戊烷-2-基}氨基)-1-氧代丙烷-2-基]氨基甲酰基}-4,11,20,29,34-五氧代-5-{4-[(4-苯氧基苯-1-磺酰基)氨基]丁酰胺基}-13,16,22,25-四氧杂-3,10,19,28,33-五氮杂四十八烷-1,32,48-三甲酸)的合成
[1389][1390]
(1)将fmoc-rink amide am树脂(0.12mmol)用哌啶的dmf溶液(浓度:40%、1.9ml)处理3分钟后,用哌啶的dmf溶液(浓度:20%、1.9ml)处理12分钟而将树脂的fmoc进行脱保护。接下来,加入fmoc-β-homopro-oh(0.48mmol)的dmf(1.0ml)溶液、comu(0.48mmol)和oxyma(0.48mmol)的dmf(1.0ml)溶液、dipea(0.96mmol)的nmp(0.48ml)溶液,在室温下振荡40分钟,导入了β-homopro残基。以同样的方式重复进行fmoc的脱保护和稠合,具体而言,依次将fmoc-(n-me)ile-oh、fmoc-leu-oh、fmoc-ala-oh、fmoc-asp(otbu)-oh、fmoc-lys(dde)-oh、fmoc-gaba-oh进行稠合,将所得到的树脂的n末端fmoc利用与上述同样的方法通过哌啶/dmf处理进行脱保护,合成了处于键合有肽的状态的树脂h-gaba-lys(dde)-asp(otbu)-ala-leu-(n-me)ile-β-homopro-rink amide am树脂。
[1391]
(2)向上述(1)中得到的树脂中加入4-苯氧基苯磺酰氯(0.36mmol)、dipea(0.72mmol)的dmf(3ml)溶液,在室温下振荡2小时。反应结束后,用dmf(3ml
×
3次)洗涤所得到的树脂。
[1392]
(3)向上述(2)中得到的树脂中加入肼一水合物的dmf溶液(浓度:5%、3ml),重复4次在室温下振荡30分钟的操作,将lys侧链的dde进行脱保护。对于所得到的树脂,重复进行稠合和脱fmoc,具体而言,依次将fmoc-adox-oh、fmoc-adox-oh、fmoc-glu-otbu进行稠合,在lys侧链上延伸了肽。将lys侧链的n末端fmoc通过哌啶/dmf处理进行脱保护。
[1393]
(4)向上述(3)中得到的树脂中加入十六烷二酸(0.96mmol)、comu(0.18mmol)、oxyma(0.18mmol)、dipea(0.96mmol)的dmf(3ml)溶液,在室温下振荡1小时。反应结束后,用dmf(3ml
×
4次)和氯仿(3ml
×
3次)洗涤所得到的树脂。
[1394]
(5)向上述(4)中得到的树脂中加入tfa:水:三异丙基硅烷:二硫苏糖醇(90:2.5:5:2.5、4ml),在室温下振荡2小时,通过过滤去除了树脂。向滤液中加入已冷却的二乙醚,通过离心分离使已析出的白色粉末沉淀,重复3次通过倾析去除二乙醚的操作,得到了肽的粗体。针对所得到的粗体,通过制备lcms(制备条件a)进行纯化。将洗脱液在试验管中进行分级,收集包含目标物的洗脱级分并进行冻干,得到了作为白色粉末的标题化合物(29mg)。
[1395]
将由式[i'-1]表示的、利用实施例1或与实施例1同样的方法合成的化合物的结构示于以下的表中。
[1396][1397]
[表5]
[1398]
[1399][1400]
将由式[i'-2]表示的、利用与实施例1同样的方法合成的化合物的结构示于以下的表中。
[1401][1402]
[表6]
[1403][1404]
将由式[i'-3]表示的、利用与实施例1同样的方法合成的化合物的结构示于以下的表中。
[1405][1406]
[表7]
[1407][1408]
将由式[i'-4]表示的、利用与实施例1同样的方法合成的化合物的结构示于以下的表中。
[1409][1410]
[表8]
[1411][1412]
将由式[i'-5]表示的、利用与实施例1同样的方法合成的化合物的结构示于以下的表中。
[1413][1414]
[表9]
[1415][1416]
将由式[i'-6]表示的、利用与实施例1同样的方法合成的化合物的结构示于以下的表中。
[1417][1418]
[表10]
[1419][1420]
将由式[i'-7]表示的、利用与实施例1同样的方法合成的化合物的结构示于以下的表中。
[1421][1422]
[表11]
[1423][1424]
将由式[i'-8]表示的、利用与实施例1同样的方法合成的化合物的结构示于以下的表中。
[1425][1426]
[表12]
[1427]
[1428]
[1429][1430]
将由式[i'-9]表示的、利用实施例2或与实施例2同样的方法合成的化合物的结构示于以下的表中。
[1431][1432]
[表13]
[1433]
[1434]
[1435]
[1436][1437]
将由式[i'-10]表示的、利用与实施例9同样的方法合成的化合物的结构示于以下的表中。
[1438][1439]
[表14]
[1440][1441]
将由式[i'-9]表示的、利用实施例2或与实施例2同样的方法合成的化合物的结构示于以下的表中。
[1442][1443]
[表15]
[1444][1445]
将由式[i'-9]表示的、利用实施例3或与实施例3同样的方法合成的化合物的结构示于以下的表中。
[1446][1447]
[表16]
[1448]
[1449][1450]
将由式[i'-11]表示的、利用与实施例2同样的方法合成的化合物的结构示于以下的表中。
[1451][1452]
[表17]
[1453][1454]
将由式[i'-12]表示的、利用与实施例2同样的方法合成的化合物的结构示于以下的表中。
[1455][1456]
[表18]
[1457][1458]
将由式[i'-13]表示的、利用与实施例2同样的方法合成的化合物的结构示于以下的表中。
[1459][1460]
[表19]
[1461][1462]
将由式[i'-14]表示的、利用与实施例2同样的方法合成的化合物的结构示于以下的表中。
[1463][1464]
[表20]
[1465]
[1466]
[1467]
[1468]
[1469][1470]
将由式[i'-15]表示的、利用与实施例2同样的方法合成的化合物的结构示于以下的表中。
[1471][1472]
[表21]
[1473][1474]
将由式[i'-14]表示的、利用与实施例2同样的方法合成的化合物的结构示于以下的表中。
[1475][1476]
[表22]
[1477]
[1478]
[1479]
[1480]
[1481]
[1482]
[1483]
[1484]
[1485]
[1486]
[1487]
[1488]
[1489][1490]
将由式[i'-16]表示的、利用实施例4或与实施例4同样的方法合成的化合物的结构示于以下的表中。
[1491][1492]
[表23]
[1493][1494]
将由式[i'-17]表示的、利用与实施例2同样的方法合成的化合物的结构示于以下的表中。
[1495][1496]
[表24]
[1497][1498]
将由式[i'-18]表示的、利用与实施例2同样的方法合成的化合物的结构示于以下的表中。
[1499][1500]
[表25]
[1501][1502]
将由式[i'-19]表示的、利用与实施例2同样的方法合成的化合物的结构示于以下的表中。
[1503][1504]
[表26]
[1505]
[1506]
将由式[i'-20]表示的、利用与实施例1同样的方法合成的化合物的结构示于以下的表中。
[1507][1508]
[表27]
[1509][1510]
将由式[i'-21]表示的、利用与实施例1同样的方法合成的化合物的结构示于以下的表中。
[1511][1512]
[表28]
[1513][1514]
将由式[i'-22]表示的、利用与实施例2同样的方法合成的化合物的结构示于以下的表中。
[1515][1516]
[表29]
[1517][1518]
将由式[i'-23]表示的、利用与实施例2同样的方法合成的化合物的结构示于以下的表中。
[1519][1520]
[表30]
[1521][1522]
将由式[i'-24]表示的、利用与实施例2同样的方法合成的化合物的结构示于以下的表中。
[1523][1524]
[表31]
[1525][1526]
将由式[i'-25]表示的、利用与实施例2同样的方法合成的化合物的结构示于以下的表中。
[1527][1528]
[表32]
[1529][1530]
将由式[i'-26]表示的、利用与实施例2同样的方法合成的化合物的结构示于以下的表中。
[1531][1532]
[表33]
[1533][1534]
将由式[i'-27]表示的、利用与实施例1同样的方法合成的化合物的结构示于以下的表中。
[1535][1536]
[表34]
[1537][1538]
将由式[i'-28]表示的、利用与实施例1同样的方法合成的化合物的结构示于以下的表中。
[1539][1540]
[表35]
[1541][1542]
将由式[i'-29]表示的、利用与实施例1同样的方法合成的化合物的结构示于以下的表中。
[1543][1544]
[表36]
[1545][1546]
将由式[i'-30]表示的、利用实施例5中记载的方法合成的化合物的结构示于以下的表中。
[1547][1548]
[表37]
[1549][1550]
将由式[i'-31]表示的、利用与实施例5同样的方法合成的化合物的结构示于以下的表中。
[1551][1552]
[表38]
[1553][1554]
将由式[i'-32]表示的、利用与实施例1同样的方法合成的化合物的结构示于以下的表中。
[1555][1556]
[表39]
[1557]
[1558]
[1559][1560]
将由式[i'-32]表示的、利用实施例6或与实施例6同样的方法合成的化合物的结构示于以下的表中。
[1561][1562]
[表40]
[1563]
[1564][1565]
将由式[i'-33]表示的、利用与实施例1同样的方法合成的化合物的结构示于以下的表中。
[1566][1567]
[表41]
[1568][1569]
将由式[i'-34]表示的、利用与实施例1同样的方法合成的化合物的结构示于以下的表中。
[1570][1571]
[表42]
[1572]
[1573]
[1574]
[1575][1576]
将由式[i'-34]表示的、利用实施例7或与实施例7同样的方法合成的化合物的结构示于以下的表中。
[1577][1578]
[表43]
[1579][1580]
将由式[i'-35]表示的、利用与实施例1同样的方法合成的化合物的结构示于以下的表中。
[1581][1582]
[表44]
[1583]
[1584]
[1585]
[1586]
[1587]
[1588][1589]
将由式[i'-36]表示的、利用与实施例1同样的方法合成的化合物的结构示于以下的表中。
[1590][1591]
[表45]
[1592]
[1593]
[1594]
[1595]
[1596]
[1597]
[1598]
[1599][1600]
将由式[i'-37]表示的、利用实施例8或与实施例8同样的方法合成的化合物的结构示于以下的表中。
[1601][1602]
[表46]
[1603][1604]
将由式[i'-38]表示的、利用实施例9或与实施例9同样的方法合成的化合物的结构示于以下的表中。
[1605][1606]
[表47]
[1607][1608]
将由式[i'-39]表示的、利用与实施例9同样的方法合成的化合物的结构示于以下的表中。
[1609]
[1610]
[表48]
[1611]
[1612]
[1613]
[1614][1615]
将由式[i'-40]表示的、利用与实施例9同样的方法合成的化合物的结构示于以下的表中。
[1616][1617]
(上述式[i'-40]中,
[1618]
由下述式[vii-2]
[1619]-aa
wc1-aa
wc2-aa
wc3-aa
wc4-aa
wc5
‑ꢀꢀ
[vii-2]
[1620]
表示的结构,在由所述式[i']表示的化合物中相当于wc,其是“由1~3个氨基酸构成的接头”,
[1621]
在此,
[1622]
aa
wc1
、aa
wc2
、aa
wc4
、和aa
wc5
分别相同或不同地选自单键和(d)-lys,
[1623]
aa
wc3
为lys或(d)-lys,
[1624]
aa
wcs
为单键或(d)-lys。)
[1625]
[表49]
[1626][1627]
将本发明化合物的高效液相色谱质谱(lcms)、保留时间(rt)和分析条件示于以下的表中。
[1628]
[表50]
[1629]
[1630]
[1631]
[1632]
[1633]
[1634]
[1635]
[1636]
[1637]
[1638]
[1639]
[1640]
[1641]
[1642]
[1643]
[1644]
[1645]
[1646]
[1647]
[1648]
[1649]
[1650]
[1651]
[1652]
[1653]
[1654][1655]
通过以下的试验例1-1~1-2中记载的方法测定本发明化合物对mmp2的抑制作用。
[1656]
试验例1-1:本发明的各化合物对人mmp2的抑制作用评价试验(方法1)
[1657]
通过使用mocac-pro-leu-gly-leu-a2pr(dnp)-ala-arg-nh2作为底物的酶分析法测定各化合物的人mmp2抑制作用。将100μg/ml人重组mmp2酶和1mmol/l乙酸-4-氨基苯汞在反应液[50mmol/l tris-hcl(ph7.5)、150mmol/l nacl、10mmol/l cacl2、0.05%brij l23]中进行混合,在37℃下反应60分钟。在96孔微孔板中注入通过反应而活化的人mmp2使最终浓度达到0.7ng/ml或7ng/ml。进一步添加稀释成各种浓度的本发明的各化合物,在室温下静置15分钟。然后,添加mocac-pro-leu-gly-leu-a2pr(dnp)-ala-arg-nh2使最终浓度达到5μmol/l或16μmol/l,开始酶反应。在室温下反应2小时后,利用酶标仪测定荧光强度(ex 320nm/em 400nm)。使用所测定的荧光值按照下述式算出酶抑制率(%),算出各发明化合物的50%抑制浓度(ic
50
值)。
[1658]
酶抑制率(%)=[1-(a-b)/(c-b)]
×
100
[1659]
a:化合物添加时的荧光值;
[1660]
b:化合物和酶未添加时的荧光值;
[1661]
c:化合物未添加时的荧光值。
[1662]
试验例1-2:本发明的各化合物对人mmp2的抑制作用评价试验(方法2)
[1663]
通过使用mocac-pro-leu-gly-leu-a2pr(dnp)-ala-arg-nh2作为底物的酶分析法测定各化合物的人mmp2抑制作用。将12.5μg/ml人重组mmp2酶和1mmol/l乙酸-4-氨基苯汞在反应液[50mmol/l tris-hcl(ph7.5)、150mmol/l nacl、10mmol/l cacl2、0.05%brij l23]中进行混合,在37℃下反应60分钟。在384孔微孔板中注入通过反应而活化的人mmp2使最终浓度达到7ng/ml或2.8ng/ml。进一步添加稀释成各种浓度的本发明的各化合物,在室温下静置10分钟。然后,添加mocac-pro-leu-gly-leu-a2pr(dnp)-ala-arg-nh2使最终浓度达到16μmol/l或5μmol/l,开始酶反应。在室温下反应1~2小时后,利用酶标仪测定荧光强度(ex 320nm/em 405nm)。使用所测定的荧光值按照下述式算出酶抑制率(%),算出各发明化合物的50%抑制浓度(ic
50
值)。
[1664]
酶抑制率(%)=[1-(a-b)/(c-b)]
×
100
[1665]
a:化合物添加时的荧光值;
[1666]
b:化合物和酶未添加时的荧光值;
[1667]
c:化合物未添加时的荧光值。
[1668]
将本发明化合物对人mmp2酶活性的抑制作用的结果示于以下的表中。
[1669]
[表51-1]
[1670][1671][1672]
[表51-2]
[1673][1674][1675]
[表51-3]
[1676][1677][1678]
[表51-4]
[1679][1680][1681]
[表51-5]
[1682][1683]
[表51-6]
[1684][1685]
[表51-7]
[1686]
[1687][1688]
[表51-8]
[1689]
[1690][1691]
[表51-9]
[1692]
[1693][1694]
[表51-10]
[1695]
[1696][1697]
[表51-11]
[1698]
[1699][1700]
[表51-12]
[1701][1702]
[表51-13]
[1703][1704]
[表51-14]
[1705]
[1706][1707]
[表51-15]
[1708]
[1709][1710]
[表51-16]
[1711]
[1712][1713]
[表51-17]
[1714][1715]
另外,本发明化合物对各mmp的抑制作用可利用试验例2~9中记载的方法进行测定。
[1716]
试验例2:本发明的各化合物对人mmp1的抑制作用评价试验
[1717]
通过使用mocac-lys-pro-leu-gly-leu-a2pr(dnp)-ala-arg-nh2作为底物的酶分析法测定各化合物的人mmp1抑制作用。将50μg/ml人重组mmp1酶和1mmol/l乙酸-4-氨基苯汞在反应液[50mmol/l tris-hcl(ph7.5)、150mmol/l nacl、10mmol/l cacl2、0.05%brij l23]中进行混合,在37℃下反应120分钟。在96孔微孔板中注入通过反应而活化的人mmp1使最终浓度达到8ng/ml。进一步添加稀释成各种浓度的本发明的各化合物,在室温下静置15分钟。然后,添加mocac-lys-pro-leu-gly-leu-a2pr(dnp)-ala-arg-nh2使最终浓度达到11μmol/l,开始酶反应。在室温下反应1小时后,利用酶标仪测定荧光强度(ex 320nm/em 400nm)。使用所测定的荧光值按照下述式算出酶抑制率(%),算出各发明化合物的50%抑
制浓度(ic
50
值)。
[1718]
酶抑制率(%)=[1-(a-b)/(c-b)]
×
100
[1719]
a:化合物添加时的荧光值;
[1720]
b:化合物和酶未添加时的荧光值;
[1721]
c:化合物未添加时的荧光值。
[1722]
试验例3:本发明的各化合物对人mmp3的抑制作用评价试验
[1723]
通过使用mocac-arg-pro-lys-pro-val-glu-nva-trp-arg-lys(dnp)-nh2作为底物的酶分析法测定各化合物的人mmp3抑制作用。将3μg/ml人重组mmp3酶和5μg/ml胰凝乳蛋白酶在反应液[50mmol/l tris-hcl(ph7.5)、150mmol/l nacl、10mmol/l cacl2、0.05%brij l23]中进行混合。在37℃下反应30分钟后,添加pmsf使达到2mmol/l而使反应停止。在96孔微孔板中注入通过反应而活化的人mmp3使最终浓度达到52ng/ml。进一步添加稀释成各种浓度的本发明的各化合物,在室温下静置15分钟。然后,添加mocac-arg-pro-lys-pro-val-glu-nva-trp-arg-lys(dnp)-nh2使最终浓度达到26μmol/l,开始酶反应。在室温下反应1小时后,利用酶标仪测定荧光强度(ex 320nm/em 400nm)。使用所测定的荧光值按照下述式算出酶抑制率(%),算出各发明化合物的50%抑制浓度(ic
50
值)。
[1724]
酶抑制率(%)=[1-(a-b)/(c-b)]
×
100
[1725]
a:化合物添加时的荧光值;
[1726]
b:化合物和酶未添加时的荧光值;
[1727]
c:化合物未添加时的荧光值。
[1728]
试验例4:本发明的各化合物对人mmp7的抑制作用评价试验
[1729]
通过使用mocac-pro-leu-gly-leu-a2pr(dnp)-ala-arg-nh2作为底物的酶分析法测定各化合物的人mmp7抑制作用。将50μg/ml人重组mmp7酶和1mmol/l乙酸-4-氨基苯汞在反应液[50mmol/l tris-hcl(ph7.5)、150mmol/l nacl、10mmol/l cacl2、0.05%brij l23]中进行混合,在37℃下反应60分钟。在96孔微孔板中注入通过反应而活化的人mmp7使最终浓度达到18ng/ml。进一步添加稀释成各种浓度的本发明的各化合物,在室温下静置15分钟。然后,添加mocac-pro-leu-gly-leu-a2pr(dnp)-ala-arg-nh2使最终浓度达到22μmol/l,开始酶反应。在室温下反应1小时后,利用酶标仪测定荧光强度(ex 320nm/em 400nm)。使用所测定的荧光值按照下述式算出酶抑制率(%),算出各发明化合物的50%抑制浓度(ic
50
值)。
[1730]
酶抑制率(%)=[1-(a-b)/(c-b)]
×
100
[1731]
a:化合物添加时的荧光值;
[1732]
b:化合物和酶未添加时的荧光值;
[1733]
c:化合物未添加时的荧光值。
[1734]
试验例5:本发明的各化合物对人mmp8的抑制作用评价试验
[1735]
通过使用mocac-pro-leu-gly-leu-a2pr(dnp)-ala-arg-nh2作为底物的酶分析法测定各化合物的人mmp8抑制作用。将100μg/ml人重组mmp8酶和1mmol/l乙酸-4-氨基苯汞在反应液[50mmol/l tris-hcl(ph7.5)、150mmol/l nacl、10mmol/l cacl2、0.05%brij l23]中进行混合,在37℃下反应60分钟。在96孔微孔板中注入通过反应而活化的人mmp8使最终浓度达到149ng/ml。进一步添加稀释成各种浓度的本发明的各化合物,在室温下静置15分
钟。然后,添加mocac-pro-leu-gly-leu-a2pr(dnp)-ala-arg-nh2使最终浓度达到25μmol/l,开始酶反应。在室温下反应1小时后,利用酶标仪测定荧光强度(ex 320nm/em 400nm)。使用所测定的荧光值按照下述式算出酶抑制率(%),算出各发明化合物的50%抑制浓度(ic
50
值)。
[1736]
酶抑制率(%)=[1-(a-b)/(c-b)]
×
100
[1737]
a:化合物添加时的荧光值;
[1738]
b:化合物和酶未添加时的荧光值;
[1739]
c:化合物未添加时的荧光值。
[1740]
试验例6:本发明的各化合物对人mmp9的抑制作用评价试验
[1741]
通过使用mocac-pro-leu-gly-leu-a2pr(dnp)-ala-arg-nh2作为底物的酶分析法测定各化合物的人mmp9抑制作用。将50μg/ml人重组mmp9酶和1mmol/l乙酸-4-氨基苯汞在反应液[50mmol/l tris-hcl(ph7.5)、150mmol/l nacl、10mmol/l cacl2、0.05%brij l23]中进行混合,在37℃下反应24小时。在96孔微孔板中注入通过反应而活化的人mmp9使最终浓度达到58ng/ml。进一步添加稀释成各种浓度的本发明的各化合物,在室温下静置15分钟。然后,添加mocac-pro-leu-gly-leu-a2pr(dnp)-ala-arg-nh2使最终浓度达到3μmol/l,开始酶反应。在室温下反应1小时后,利用酶标仪测定荧光强度(ex 320nm/em 400nm)。使用所测定的荧光值按照下述式算出酶抑制率(%),算出各发明化合物的50%抑制浓度(ic
50
值)。
[1742]
酶抑制率(%)=[1-(a-b)/(c-b)]
×
100
[1743]
a:化合物添加时的荧光值;
[1744]
b:化合物和酶未添加时的荧光值;
[1745]
c:化合物未添加时的荧光值。
[1746]
试验例7:本发明的各化合物对人mmp12的抑制作用评价试验
[1747]
通过使用mocac-pro-leu-gly-leu-a2pr(dnp)-ala-arg-nh2作为底物的酶分析法测定各化合物的人mmp12抑制作用。将50μg/ml人重组mmp12酶和1mmol/l乙酸-4-氨基苯汞在反应液[50mmol/l tris-hcl(ph7.5)、150mmol/l nacl、10mmol/l cacl2、0.05%brij l23]中进行混合,在37℃下反应4小时或24小时。在96孔微孔板中注入通过反应而活化的人mmp12使最终浓度达到17ng/ml或5.2ng/ml。进一步添加稀释成各种浓度的本发明的各化合物,在室温下静置15分钟。然后,添加mocac-pro-leu-gly-leu-a2pr(dnp)-ala-arg-nh2使最终浓度达到5μmol/l或14μmol/l,开始酶反应。在室温下反应1小时后,利用酶标仪测定荧光强度(ex 320nm/em 400nm)。使用所测定的荧光值按照下述式算出酶抑制率(%),算出各发明化合物的50%抑制浓度(ic
50
值)。
[1748]
酶抑制率(%)=[1-(a-b)/(c-b)]
×
100
[1749]
a:化合物添加时的荧光值;
[1750]
b:化合物和酶未添加时的荧光值;
[1751]
c:化合物未添加时的荧光值。
[1752]
将各发明化合物对人mmp12酶活性的抑制作用的结果示于以下的表中。
[1753]
[表52]
[1754][1755]
试验例8:本发明的各化合物对人mmp13的抑制作用评价试验
[1756]
通过使用mocac-pro-leu-gly-leu-a2pr(dnp)-ala-arg-nh2作为底物的酶分析法测定各化合物的人mmp13抑制作用。将50μg/ml人重组mmp13酶和1mmol/l乙酸-4-氨基苯汞在反应液[50mmol/l tris-hcl(ph7.5)、150mmol/l nacl、10mmol/l cacl2、0.05%brij l23]中进行混合,在37℃下反应2小时。在96孔微孔板中注入通过反应而活化的人mmp13使最终浓度达到5ng/ml。进一步添加稀释成各种浓度的本发明的各化合物,在室温下静置15分钟。然后,添加mocac-pro-leu-gly-leu-a2pr(dnp)-ala-arg-nh2使最终浓度达到6μmol/l,开始酶反应。在室温下反应1小时后,利用酶标仪测定荧光强度(ex 320nm/em 400nm)。使用所测定的荧光值按照下述式算出酶抑制率(%),算出各发明化合物的50%抑制浓度(ic
50
值)。
[1757]
酶抑制率(%)=[1-(a-b)/(c-b)]
×
100
[1758]
a:化合物添加时的荧光值;
[1759]
b:化合物和酶未添加时的荧光值;
[1760]
c:化合物未添加时的荧光值。
[1761]
将各发明化合物对人mmp13酶活性的抑制作用的结果示于以下的表中。
[1762]
[表53]
[1763][1764]
试验例9:本发明的各化合物对人mmp14的抑制作用评价试验
[1765]
通过使用mocac-lys-pro-leu-gly-leu-a2pr(dnp)-ala-arg-nh2作为底物的酶分析法测定各化合物的人mmp14抑制作用。将100μg/ml人重组mmp14酶和5μg/ml胰蛋白酶在反应液[50mmol/l tris-hcl(ph7.5)、200mmol/l nacl、5mmol/l cacl2、20μmol/l znso4、0.05%brij l23]中进行混合。在室温下反应25分钟后,添加胰蛋白酶抑制剂使达到25μg/ml而使反应停止。在96孔微孔板中注入通过反应而活化的人mmp14使最终浓度达到6ng/ml。进一步添加稀释成各种浓度的本发明的各化合物,在室温下静置15分钟。然后,添加mocac-lys-pro-leu-gly-leu-a2pr(dnp)-ala-arg-nh2使最终浓度达到5μmol/l,开始酶反应。在室温下反应1小时后,利用酶标仪测定荧光强度(ex 320nm/em 400nm)。使用所测定的荧光值按照下述式算出酶抑制率(%),算出各发明化合物的50%抑制浓度(ic
50
值)。
[1766]
酶抑制率(%)=[1-(a-b)/(c-b)]
×
100
[1767]
a:化合物添加时的荧光值;
[1768]
b:化合物和酶未添加时的荧光值;
[1769]
c:化合物未添加时的荧光值。
[1770]
产业实用性
[1771]
本发明的化合物具有抑制mmp2的优异作用,通过本发明可提供对癌疾病和器官纤维化、以及对与癌疾病和器官纤维化相关联的症状的预防或治疗有效的医药,可期待减轻患者的负担,且有助于医药产业的发展。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
