1.本公开涉及一种用于检测硫化氢的新化合物和结构体。
背景技术:
2.为了检测水性试样中的硫化氢,不仅需要检测硫化氢本身,还需要检测作为酶反应产物的硫化氢。示例包括:检查工厂、工业废物处理厂、污水处理厂和周边地区的土壤和水;动态分析作为生物活性物质的活体和活细胞;呼气测试;检测和定量测定体液中半胱氨酸、甲硫氨酸、同型半胱氨酸等。半胱氨酸、甲硫氨酸、同型半胱氨酸等可以从通过与诸如裂解酶的特定酶反应产生的硫化氢的量来检测。这种情况需要检测和定量测定硫化氢。
3.在硫化氢存在下引起可检测颜色变化(吸收或发光)的功能性着色剂可以用于检测硫化氢。
4.功能性着色剂可以是与硫化氢反应的2-氰基-3-苯基丙烯酸甲酯衍生物键合的邻甲基荧光素。已知该化合物与硫化氢反应并在520nm附近的可见光区域发出荧光(org lett.2012,14,2184-2187,以下称为非专利文献1)。
技术实现要素:
5.为了检测诸如生物样本的水性试样中的硫化氢及其代谢物,本发明人研究了非专利文献1中作为检测材料公开的化合物是否能够检测中性磷酸盐缓冲盐水中的硫化氢。发现在溶液中会形成检测材料的沉淀或聚集体,从而降低与硫化氢的反应性,并且使得难以以高灵敏度检测硫化氢。因此,本公开人发现需要一种增加检测材料的水溶性的方法以增加硫化氢的检测灵敏度。
6.本发明人发现具有羟基作为亲水基团的荧光素比邻甲基荧光素具有更高的水溶性。还发现利用结合了荧光素与2-氰基-3-苯基丙烯酸甲酯衍生物的荧光素,硫化氢的检测很困难,因为无论硫化氢存在与否,该荧光素总是发出荧光。
7.本公开提供了一种用于以高灵敏度检测诸如生物样本的水性试样中的硫化氢的新型材料。
8.本公开的化合物由式1表示:
[0009][0010]
在式1中,
[0011]
dye(染料)是指这样的光吸收剂,其在350nm至700nm波长范围内有光吸收,且最高
分子吸收系数为104m-1
cm-1
或更大,
[0012]
a1表示取代或未取代的具有3至12个碳原子的亚烷基或烷氧基,
[0013]
b1表示选自由-c(=o)-、-s(=o)
2-,和-ch
2-组成的组中的成员,
[0014]
b2表示选自由-h、-nhc(=s)nh-(ch2ch2o)
n-ch3和-nhc(=s)氨基酸组成的组中的成员,其中n表示在范围为1到25的整数,以及
[0015]
b3表示选自由-oh、-nh2、-nhch3、-nhch2ch3、-n(ch3)2和-n(ch2ch3)2组成的组中的成员。
[0016]
通过参考附图对示例性实施例的以下描述,本公开的进一步特征将变得显而易见。
附图说明
[0017]
图1是根据本实施例的用于检测硫化氢的结构体的一个示例的示意图。
具体实施方式
[0018]
尽管下面描述了本公开的一些实施例,但是本公开不限于这些实施例。
[0019]
第一实施例
[0020]
化合物
[0021]
根据本实施例的化合物由式1表示:
[0022][0023]
下面详细描述式1。
[0024]
染料
[0025]
式1中的染料表示在350nm至700nm波长范围内光吸收且最高分子吸收系数为104m-1
cm-1
或更大的光吸收剂。此外,根据本实施例的染料优选在365nm至650nm的波长范围内光吸收。
[0026]
根据本实施例的“染料”可以是各自具有离子或非离子官能团的染料、颜料、荧光材料、非荧光材料、着色剂、金纳米颗粒、金胶体或银纳米颗粒。
[0027]
例如,当根据本实施例的“染料”为着色剂时,该染料可以为偶氮着色剂、呫吨着色剂、香豆素着色剂、三芳基甲烷着色剂或溴化乙锭。根据本实施例的染料可以为选自由偶氮着色剂、呫吨着色剂和香豆素着色剂组成的组中的至少一种,特别是具有作为淬灭剂功能的偶氮着色剂。
[0028]
式1中的染料可以用式2表示:
[0029][0030]
式2中的*表示式1中nh的n的位置。
[0031]
可用于本实施例的式1中染料的结构的具体示例包括下式(d1)至(d18)。*表示式1中nh的n的位置。换言之,*表示与式1中-nh的n键合的键臂。以下的*表示相同内容。
[0032]
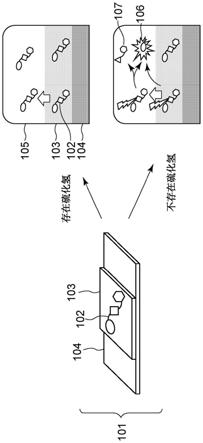
[0033]
[0034][0035]
a1[0036]
本实施例中的a1表示取代或未取代的、碳原子数为3至12的亚烷基或烷氧基官能团。这是因为呫吨着色剂和染料之间的更短距离可导致它们之间更高的能量转移效率和更大的淬灭。本实施例中的a1可以是未取代的具有3个碳原子的亚烷基。
[0037]
b1[0038]
本实施例中的b1表示选自由-c(=o)-、-s(=o)
2-和-ch
2-组成的组中的成员。在具有中性ph的水溶液中,诸如在生理条件下,环结构打开并转变为水溶性官能团,诸如-co
2-、-so
3-或-ch2oh。这可以增加由式1表示的化合物的水溶性并防止由于沉淀或聚集引起的检测灵敏度降低。为了增加水溶性,本实施例中的b1可以表示-c(=o)-。
[0039]
b2[0040]
本实施例中的b2表示选自由-h、-nhc(=s)nh-(ch
2 ch2o)
n-ch3和-nhc(=s)氨基酸
组成的组中的成员,其中n表示1至25范围内的整数。这些是水溶性官能团,可以增加化合物的水溶性,并且防止由于沉淀或聚集引起的检测灵敏度下降。为了增加水溶性,本实施例中的b2可以表示-h,-nhc(=s)nh-(ch2ch2o)
n-ch3,或-nhc(=s)nh-chr-cooh,其中r表示氨基酸侧链,n可以为4至22的范围。当本实施例中的b2表示-nhc(=s)nh-ch
2-cooh,-nhc(=s)氨基酸的氨基酸是甘氨酸。
[0041]
b3[0042]
本实施例中的b3表示选自由-oh、-nh2、-nhch3、-nhch2ch3、-n(ch3)2和-n(ch2ch3)2组成的组中的成员。本实施例中的b3可以表示-oh或-nh2,特别是-oh。这些是水溶性官能团,可以增加化合物的水溶性并防止由于沉淀或聚集而引起的检测灵敏度降低。为了增加水溶性,本实施例中的b3可以表示-oh或-nh2,特别是-oh。
[0043]
操作优势
[0044]
如上所述,根据本实施例的化合物含有大量水溶性官能团,因此具有高水溶性。
[0045]
如式1所示,使用2-氰基-3-苯基丙烯酸酯衍生物作为连接剂将呫吨着色剂连接至染料。因此,在呫吨着色剂和染料之间发生荧光共振能量转移(fret)现象。因此,特定波长的激发光的照射会引起在与特定波长不同的两种不同波长处的淬灭或荧光。2-氰基-3-苯基丙烯酸酯衍生物与硫化氢反应以从染料中将呫吨着色剂分离。分离防止了fret现象并增加了荧光强度或改变了两种不同波长的荧光强度比。因此,可以通过与硫化氢反应引起的荧光强度增加的量或比率、或强度比的变化量来估计硫化氢的量。对于fret现象中的能量转移,呫吨着色剂可以充当供体,而染料可以充当受体。或者,呫吨着色剂可以充当受体,而染料可以充当供体。非专利文献1公开了如下方法,该方法利用硫化氢与2-氰基-3-苯基丙烯酸甲酯衍生物的乙烯基碳的迈克尔加成作为引发反应,然后通过分子内环化反应裂解酯键以引起分解。
[0046]
少量硫化氢将少量呫吨着色剂从染料中分离。相比之下,大量的硫化氢会从染料中分离大量的呫吨着色剂。因此,硫化氢的量也可以通过测定所分离的呫吨着色剂或染料的量来估计。硫化氢的量也可以通过测定呫吨着色剂、染料或呫吨着色剂和染料两者的荧光或吸光度来估计。因此,根据各实施例的化合物中硫化氢的检测机理与非专利文献1中记载的仅使用呫吨着色剂结构的公知的检测机理不同,不易受沉淀或聚集的影响。
[0047]
因此,根据本实施例的化合物能够以高灵敏度检测生物样本等水性试样中的硫化氢。
[0048]
生物样本
[0049]
本实施例中的生物样本可以是尿液、血液、汗液、眼泪、唾液或粘液,或其液体样本,或其含有增加或减少量的水的稀释或浓缩液体。对于这些样本中的待检测分析物,生物样本中待检测的代谢物的量和浓度可以通过使生物样本与酶和硫化氢检测装置接触来测定。
[0050]
待检测分析物
[0051]
在本实施例中的待检测分析物可以是与生物体的疾病、身体状况、生物体的压力程度等相关的生物标志物。根据本公开的实施例,待检测分析物可以是但不限于硫化氢、甲硫醇、半胱氨酸或同型半胱氨酸。待检测分析物可以包含在尿液、血液、汗液、眼泪、唾液等中。
[0052]
用途
[0053]
根据本实施例的化合物可以用于根据第二实施例的结构体,或可以用于其他装置或测量设备。该装置或测量设备可以是临床用自动血液分析仪、医疗用简易测试设备、快速诊断测试设备或生化测试设备。装置或测量设备还可以是但不限于侧流测试芯片、流通测试芯片、试纸条、微流体芯片、微化学芯片或生物芯片。
[0054]
第二实施例
[0055]
结构体
[0056]
根据本实施例的结构体包括基材和位于基材上的根据第一实施例的化合物。
[0057]
基材
[0058]
在本实施例中,基材可以是固体材料并且可以具有与硫化氢的低反应性。在本实施例中的基材可以是玻璃、陶瓷、硅树脂、由纤维素或μ-纤维制成的纸、毡、针织织物、非织造织物、多孔材料或滤纸,并且从可用性方面可以是纸质材料。
[0059]
本实施例中的基材也可以是蚀刻有流路或圆形的玻璃或用疏水性材料印刷有流路或圆形框的纸质材料。本实施例中的疏水材料可以是但不限于选自蜡、蜡笔、石蜡、su-8、硅、油性记号笔、聚丙烯酸、丙烯酸漆、烷基酮二聚体、聚苯乙烯、十八烷基三氯硅烷、聚二甲基硅氧烷、聚丙烯酸酯和环烯烃共聚物组成的组中的至少一种材料。本实施例中的基材也可以是用含有环烯烃共聚物和塑料成分的材料印刷有圆形框的纸质材料。根据第一实施例的化合物可以施加于流路或圆形框,以将根据第一实施例的化合物保持在框内,并且以高灵敏度检测基材上的硫化氢。圆形框内的区域可以是硫化氢感测区域。在根据本实施例的结构体中,施加于基材的根据第一实施例的化合物容易释放到水性生物样本中,或者水性生物样本容易渗透到施加该化合物的基材中。因此,水溶性低的硫化氢检测材料通过疏水作用强吸附在基材上,很少与硫化氢接触,检测灵敏度较低。相比之下,根据本实施例的化合物水溶性高,从基材中大量释放,或在基材上吸附较弱,容易与硫化氢接触,检测灵敏度下降幅度较小。由于化合物的高水溶性,根据本实施例的结构体可以高灵敏度地检测基材上的硫化氢。
[0060]
结构体的一个示例
[0061]
附图示出了根据本实施例的结构体的示例。在图中,用于检测硫化氢的结构体101包括硫化氢检测材料(根据第一实施例的化合物)102和基材103。如果需要,结构体101可以包括支撑件104。
[0062]
通过添加生物样本105,使吸附在基材103上的检测材料102从基材释放到试样中或渗透到试样中,从而使检测材料102与水性试样(生物样本)混合。在硫化氢存在下,基材上或水性试样中的检测材料102与硫化氢反应并分离成呫吨着色剂106和染料107。可以通过测定水性试样或基材上的荧光强度或亮度来识别硫化氢。
[0063]
图中所示的结构体仅为示例,本公开不限于此。
[0064]
或者,结构体101可以浸渍在含有硫化氢的溶液。由硫化氢分离的呫吨着色剂106或染料107溶解在溶液中。也可以通过观察溶解在溶液中的呫吨着色剂或染料的着色量来识别硫化氢。如本文所用,术语“着色量”是指颜色强度或荧光强度的信号强度。
[0065]
用途
[0066]
根据本实施例的结构体包括根据第一实施例的化合物,因此可以检测硫化氢。可
以在基材上提供从用作底物的待检测代谢物来产生硫化氢的酶。例如,同型半胱氨酸α,γ-裂解酶可作为酶来检测同型半胱氨酸。可通过检测作为酶促反应产物的硫化氢来确定待检测分析物的量。还可以通过使用预先添加酶以从待检测分析物产生硫化氢的水性试样来检测待检测分析物。待检测分析物可以是酶。更具体地,可以包含用于待检测酶的底物以检测酶。
[0067]
酶
[0068]
在本实施例中的酶可以是,但不限于,选自由胱硫醚γ-裂解酶、3-巯基丙酮酸硫转移酶、硫代硫酸盐还原酶、甲硫醇氧化酶、硫氢化酶、硫氧化酶/还原酶、甲基化硫醇-辅酶m甲基转移酶、o-磷酸丝氨酸巯基水解酶、二硫化碳水解酶、羰基硫水解酶、同型半胱氨酸脱硫酶(同型半胱氨酸α,γ-裂解酶)、l-3-氰基丙氨酸合成酶、d-半胱氨酸脱硫酶、l-半胱氨酸脱硫酶、l-甲硫氨酸γ-裂解酶和胱硫醚β合成酶组成的组中的成员。
[0069]
第三实施例
[0070]
检测装置
[0071]
根据本公开的第三实施例的检测装置包括在根据第二实施例的结构体的基材上的血细胞分离膜。血细胞分离膜能够检测血液中的硫化氢。此外,如在第二实施例中,基材上的同型半胱氨酸α,γ-裂解酶可以检测血液中的同型半胱氨酸。
[0072]
第四实施例
[0073]
根据本公开的第四实施例的微通道装置包括根据第一实施例的基材和化合物。基材包括:感测区域,在感测区域中,根据第一实施例的化合物施加在基材上;血滴区域,在血滴区域中,血细胞分离膜位于基材上;以及流路,血浆或血清可以通过所述流路从血滴区域移动到感测区域。
[0074]
流路
[0075]
本实施例中的流路可以是血浆或血清可以通过毛细血管移动通过的显影流路。
[0076]
在本实施例中,基材包括用含环烯烃共聚物和塑料成分的材料印刷有哑铃形框的纸质材料,所述感测区域和血滴区域分别位于哑铃形的各端。
[0077]
第五实施例
[0078]
根据本公开的第五实施例的检测方法包括接触步骤和测定步骤,所述接触步骤使用于检测硫化氢的染料与生物样本接触,所述测定步骤测定由所述接触步骤产生的着色的量或荧光的量。用于检测硫化氢的染料可以是根据第一实施例的化合物。
[0079]
在本实施例中,可以使含有硫化氢检测用染料的固体或分散有该固体的溶液与可能含有硫化氢的诸如生物样本等水性试样接触。
[0080]
装置的感测区域可以浸入容器中的生物样本中(其中添加了用于产生硫化氢的酶),以与生物样本接触。或者,生物样本可以通过利用毛细管在基材上作为纸色谱显影以与感测区域接触。酶可以预先施加到基材上。
[0081]
按照这样的方法,在生物样本与基材的感测区域接触一定时间段后,通过视觉观察或使用反射密度计或荧光分光密度计,测定感测区域的颜色强度或荧光强度的信号强度的变化量。这样,可以计算待检测分析物的量。
[0082]
少量的待检测分析物会引起感测区域的少量变化。大量待检测分析物会导致感测区域的大量变化。变化量也可以根据感测区域的着色强度或感测区域中由于紫外线灯的紫
外线照射或可见光照射的荧光强度来确定。
[0083]
根据本公开的第四实施例提供了用于检测硫化氢的结构体,包括根据第一实施例所述的化合物、基材和用于从用作底物的待测代谢物生成硫化氢的酶。
[0084]
第六实施例
[0085]
检测试剂盒
[0086]
根据本公开的第六实施例的检测试剂盒包括根据第一实施例的化合物或含有该化合物的溶液,以及根据第二实施例的基材。根据本实施例的检测试剂盒可以包括基材和单独的容器,该容器包含所述化合物或含有所述化合物的溶液。为了检测硫化氢,将化合物施加在基材上。硫化氢的量和浓度可以通过将可能含有硫化氢的生物样本直接滴到涂覆的基材(也称为结构体)上来测定。还可以提供单独的容器以允许生物样本渗透到结构体中。单独的容器使生物样本能够均匀地渗透到结构体中。
[0087]
固体酶或含有酶的水溶液可以预先包含在单独的容器中。生物样本可以在渗透到结构体中的同时添加到容器中。或者,可以将生物样本添加到容器中并放置一段时间,在产生硫化氢后,允许生物样本渗透到结构体中。
[0088]
根据本实施例的检测试剂盒可以包括色调、亮度或颜色饱和度的颜色样本,以观察结构体根据硫化氢或代谢物的量或浓度的颜色(荧光)变化。它可以印刷在纸、塑料板等上。生物样本中硫化氢或代谢物的量或浓度也可以通过目测观察而比较结构体变化后的颜色与颜色样本来半定量确定。
[0089]
根据本实施例的检测试剂盒可以包括单独的led灯,特别是发出365nm至500nm波长范围内的光的led灯。通过用led光的光作为激发光照射感测区域,可以视觉观察到感测区域中的荧光变化。还可以使用小型数码相机或使用智能手机的相机功能来获取感测区域的图像数据,并使用应用来测定感测区域的颜色或荧光变化作为强度值。因此,可以定量确定生物样本中硫化氢或代谢物的量或浓度。
[0090]
根据本实施例的检测试剂盒可以包括长通滤波器,优选截止波长范围为400nm至650nm。也可以通过长通滤波器观察或检测感测区域中的荧光变化来选择性地仅检测荧光,以切断激发光的散射和反射。此外,也可以使用具有低激发光透射率和高荧光透射率的彩色玻璃纸。
[0091]
根据本实施例的检测试剂盒可以包括小室,其中可以添加或插入生物样本、根据第一实施例的化合物或根据第二实施例的结构体。根据本实施例的检测试剂盒可以是带有用于阻挡外部光(诸如太阳光或荧光)的内部结构的小室。这是因为荧光可以在不受外部光影响的情况下选择性地检测。小室可以集成有led灯或长通滤波器,并可以具有窗口,通过该窗口可以通过视觉观察或使用小型数码相机、智能手机的相机功能等从外面观察到小室的内部。此外,小室可以具有支架功能,以安装小型数码相机或智能手机。
[0092]
示例性实施例
[0093]
尽管在以下示例性实施例中进一步描述了本公开,但是在不脱离本公开的精神的情况下,本公开不限于这些示例性实施例。
[0094]
《化合物的鉴定》
[0095]
下述合成化合物(染料)用1h-nmr测量设备(bruker avance 500,bruker制造,共振频率:500mhz)进行鉴定。
[0096]
制备例1:化合物1-1的合成
[0097]
将参考org biomol chem.2011,9,pp.3530-3540(非专利文献3)合成的3.11g 3-[[(叔丁氧基)羰基]氨基]丙基-2-氰基乙酸酯,滴加到溶解有参照chem.commun.2019,55,pp.13610-13613(非专利文献2)合成的2.15g 2-甲酰基苯甲酸叔丁酯的30ml四氢呋喃中。在滴加2ml二氮杂双环十一碳烯后,室温搅拌过夜。蒸除溶剂后,混合物通过硅胶柱色谱纯化。由此,制备了1.60g无色油。
[0098]
制备例2:化合物1-2的合成
[0099]
将0.89g的化合物1-1添加到12ml三氟乙酸和二氯甲烷(v/v=1/1)的液体混合物中,并将混合物在室温下搅拌3小时。蒸馏除去溶剂后,向混合物中添加25ml的n,n-二甲基甲酰胺和2ml三乙胺。添加0.07g的二甲氨基吡啶和0.76g的n-琥珀酰亚胺-4-[4-(二甲氨基)苯基偶氮]苯甲酸酯(东京化学工业株式会社制造)后,在室温下搅拌混合物过夜。蒸除溶剂后,混合物通过硅胶柱色谱纯化。由此,制备了0.60g红色固体。
[0100]
制备例3:化合物1的合成
[0101]
将280mg的化合物1-2和336mg水溶性碳二亚胺添加到20ml的n,n-二甲基甲酰胺中,并将混合物在室温下搅拌1小时。向混合物中添加73mg二甲氨基吡啶(由东京化学工业株式会社制造)和392mg荧光素(由东京化学工业株式会社制造),并将该混合物在室温下搅拌过夜。蒸除溶剂后,混合物通过硅胶柱色谱纯化。由此,制备了19mg红色固体。1h-nmr(cd3od)(ppm):9.02(s,1h),8.32(m,1h),8.02-7.75(m,9h),7.68-7.60(m,2h),7.20-7.11(m,2h),6.87-6.55(m,8h),4.48-4.42(m,2h),3.66-3.63(m,2h),3.10(s,6h),2.12-2.10(m,2h)。
[0102][0103]
制备例4:化合物2的合成
[0104]
参照非专利文献1,制备白色固体64mg。
[0105]
[0106]
制备例5:化合物3-1的合成
[0107]
将79mg的异硫氰酸荧光素异构体i(由sigma-aldrich corporation制造)、39mg甘氨酸叔丁酯盐酸盐(由东京化学工业株式会社制造)、以及0.1ml的三乙胺添加到5ml n,n-二甲基甲酰胺中,混合物在室温下搅拌3小时。蒸除溶剂后,混合物通过硅胶柱色谱纯化。由此,制备了80mg橙色固体。
[0108]
制备例6:化合物3-2的合成
[0109]
将20mg的化合物1-2、25mg水溶性碳二亚胺和5mg的二甲氨基吡啶添加到5ml n,n-二甲基甲酰胺中,并将混合物在室温下搅拌1小时。向混合物中添加46mg化合物3-1,并将混合物在室温下搅拌一夜。蒸除溶剂后,向混合物中添加乙酸乙酯,并用水洗涤混合物。收集乙酸乙酯相,用硫酸钠干燥,并过滤。蒸除滤液的溶剂后,残留物用硅胶柱色谱纯化。由此,制备了10mg红色固体。
[0110]
制备例7:化合物3的合成
[0111]
向10mg的化合物3-2中添加三氟乙酸(2ml),室温下搅拌3小时。蒸除溶剂。由此,制备了10mg红色固体。1h-nmr(cd
3 od/cdcl3=1/1)(ppm):9.02(s,1h),7.96-7.84(m,11h),7.35-7.32(m,1h),7.20-7.15(m),1h),6.93-6.73(m,8h),4.43-4.41(m,4h),3.73-3.69(m,2h),3.16(s,6h),2.14-2.11(m,2h)。
[0112][0113]
制备例8:化合物4的合成
[0114]
将19mg的化合物1-2、23mg的水溶性碳二亚胺和5mg的二甲氨基吡啶添加到5ml的n,n-二甲基甲酰胺中,并将混合物在室温下搅拌30分钟。将32mg的2',7'-二氯荧光素(东京化成工业株式会社制造)添加到混合物中,在室温下搅拌一夜。蒸除溶剂后,混合物通过硅胶柱色谱纯化。因此,制备了20mg红色固体。1h-nmr(cdcl3)(ppm):9.04(s,1h),8.08-7.82(m,12h),7.75-7.66(m,2h),7.20-7.11(m,2h),6.77-6.67(m,6h)、4.49-4.42(m,2h)、3.66-3.62(m,2h)、3.11(s,6h)、2.14-2.11(m,2h)。
[0115][0116]
(式中:2',7'-difluorofluorescein为2',7'-二氟荧光素)
[0117]
制备例9:化合物5-1的合成
[0118]
将70mg的异硫氰酸荧光素异构体i(sigma-aldrich corporation制造)、38mg 3,6,9,12-四氧癸烷胺(东京化学工业株式会社制造)和0.1ml三乙胺添加到1ml n,n-二甲基甲酰胺中,并将混合物在室温下搅拌一夜。蒸除溶剂后,混合物通过硅胶柱色谱纯化。由此,制备了95mg橙色固体。
[0119]
制备例10:化合物5的合成
[0120]
将23mg的化合物1-2、25mg水溶性碳二亚胺和6mg的二甲氨基吡啶添加到3ml n,n-二甲基甲酰胺中,并将混合物在室温下搅拌1小时。将47mg的化合物5-1添加到混合物中,并将混合物在室温下搅拌一夜。蒸除溶剂后,混合物通过硅胶柱色谱纯化。因此,制备了11mg红色固体。1h-nmr(cdcl3)(ppm):9.01(s,1h),8.78(br,1h),8.32-8.31(m,1h),8.07(br,1h),7.99-7.97(m,1h),7.90-7.77(m,9h),7.10-7.05(m,3h),6.87-6.85(m,1h),6.77-6.66(m,6h),6.57-6.55(m,2h),4.42(t,2h,j=5.5hz),3.88-3.83(m,2h),3.72-3.58(m,16h),3.32(s,3h),3.10(s,6h),2.12-2.08(m,2h)。
[0121][0122]
制备例11:化合物6的合成
[0123]
将12mg的化合物1-2,16mg的水溶性碳化二亚胺和3mg的二甲基氨基吡啶添加到1毫升的n,n-二甲基甲酰胺中,并将该混合物在室温下搅拌30分钟。10mg的2',7'-二氟荧光素(赛默飞世尔科技公司(thermo fisher scientific inc.)制造)添加到该混合物中,并将该混合物在室温下搅拌一夜。蒸除溶剂后,将混合物通过硅胶柱色谱纯化。由此,制备了2mg红色固体。
[0124]
[0125]
(式中:2',7'-difluorofluorescein为2',7'-二氟荧光素)
[0126]
制备例12:化合物7的合成
[0127]
将27mg的化合物1-2,30mg水溶性碳化二亚胺和7mg二甲氨基吡啶添加至2ml的n,n-二甲基甲酰胺,并将该混合物在室温下搅拌2小时。48mg 3,4,5,6-四氯荧光素(由东京化学工业株式会社制造)添加到混合物中,并将该混合物在室温下搅拌一夜。蒸除溶剂后,将混合物通过硅胶柱色谱纯化。由此,制备了9mg红色固体。1h-nmr(cdcl3)(ppm):9.04(s,1h),8.58(br,1h),7.90-7.85(m,7h),7.83(m,1h),7.78(m,1h),7.13-7.12(m,1h),6.98-6.94(m,1h),6.90-6.88(m,1h),6.77-6.71(m,4h),6.62-6.60(m,1h),6.57-6.54(m,1h),5.76(br,1h),4.45(t,2h,j=6.0hz),3.68-3.64(m,2h),3.11(s,6h),2.15-2.10(m,2h)。
[0128][0129]
(式中,3,4,5,6-tetrachlorofluorescein为3,4,5,6-四氯荧光素)
[0130]
示例性实施例1
[0131]
将化合物1以5μm的浓度添加到1
×
磷酸盐缓冲盐水(3毫升,ph 7.4)中。立即用荧光分光光度计f-4500(由日立高新技术株式会社(hitachi high-technologies corporation)制造)测定溶液的荧光强度。然后将用作硫化氢供体的硫化钠以0.2mm的浓度添加到溶液中。静置10分钟后,测定溶液的荧光强度。添加硫化钠的前荧光强度为f1,添加硫化钠后10分钟的荧光强度为f2。由于添加硫化钠引起的荧光强度变化量(δf)使用公式f
2-f1计算。硫化钠的浓度改变为0mm,溶液的荧光强度变化量(δf0)以相同的方式计算出。计算存在或不存在硫化钠的情况下荧光强度的变化量之差(δf-δf0)。表1示出了计算的值。
[0132]
示例性实施例2
[0133]
除了将化合物1替换为化合物3之外,示例性实施例2以与示例性实施例1相同的方式进行。
[0134]
示例性实施例3
[0135]
除了将化合物1替换为化合物5之外,示例性实施例3以与示例性实施例1相同的方式进行。
[0136]
比较例1
[0137]
除了将化合物1替换为化合物2之外,比较例1以与示例性实施例1相同的方式进行。
[0138]
比较例2
[0139]
除了将化合物1替换为化合物4之外,比较例2以与示例性实施例1相同的方式进行。
[0140]
比较例3
[0141]
除了将化合物1替换为化合物6之外,比较例3以与示例性实施例1相同的方式进行。
[0142]
比较例4
[0143]
除了将化合物1替换为化合物7之外,比较例4以与示例性实施例1相同的方式进行。
[0144]
[灵敏度]
[0145]
在本公开的示例性实施例中,基于以下标准进行评估。a到c是可接受的水平,而d是不可接受的水平。δf-δf0越大,说明硫化氢的检测灵敏度越高。
[0146]
a:δf-δf0大于或等于40。
[0147]
b:δf-δf0大于或等于25且小于40。
[0148]
c:δf-δf0大于或等于15且小于25。
[0149]
d:δf-δf0小于15。
[0150]
表1示出各示例性实施例和比较例的溶液中的荧光强度的变化量δf和δf0,存在或不存在硫化钠的情况下荧光强度的变化量的差δf-δf0,以及评价结果。
[0151]
表明使用根据本公开的示例性实施例的化合物可以高灵敏度地检测硫化氢。
[0152]
表1
[0153][0154]
根据本公开的新化合物可以以高灵敏度地检测诸如生物样本的水性试样中的硫化氢。
[0155]
虽然本公开已参照示意性实施例说明,但应理解,本公开不限于所公开的典型实施例。所附权利要求的范围应被赋予最宽的解释,以使其涵盖所有这种修改和等同结构和功能。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。