1.本发明属于有机化合物合成领域,具体涉及到一种水相中一次性合成2,3-二取代的茚酮衍生物的方法。
背景技术:
2.茚酮衍生物广泛存在于许多天然产物和生物药物中,经常作为转化中间体应用于有机合成中。尤其是2,3-二取代的茚酮类化合物显示出独特的生物活性[p.-c.huo,x.-q.guan,p.liu,y.-q.song,m.-r.sun,r.-j.he,l.-w.zou,l.-j.xue,j.-h.shi,n.zhang,z.-g.liu and g.-b.ge,eur.j.med.chem.,2021,209,112856;s.mozaffarnia,r.teimuri-mofrad and m.-r.rashidi,eur.j.med.chem.,2020,191,112140;y.yang,r.zhang,z.li,l.mei,s.wan,h.ding,z.chen,j.xing,h.feng,j.han,h.jiang,m.zheng,c.luo and b.zhou,j.med.chem.,2020,63,1337]。例如,pauciflorol f具有有效的抗癌特性,pterosin b具有抗炎活性。
[0003]
因此,许多研究工作致力于快速简便地制备茚酮骨架[v.hanchate,r.devarajappa,and k.r.prabhu,org.lett.,2020,22,2878]。其中,分子内氢酰化是一种有效的可直接构建碳环的方法[s.k.banjare,t.nanda,b.v.pati,p.biswal,p.c.ravikumar,chem.commun.,2021,57,3630;w.-w.chen and m.-h.xu,org.biomol.chem.,2017,15,1029;a.gosh,k.f.johnson,k.l.vickerman,j.a.walker,jr.and l.m.stanley,org.chem.front.,2016,3,639]。以金属铑或钴试剂作为催化剂是合成进程中开创性的尝试,此外,最近还开发了两种成功的无金属分子内氢酰化的策略。
[0004]
但是,氢酰化反应需要以繁杂的步骤制备前体才能进一步环化,并且对于二取代烯烃的底物范围适用地十分有限。据我们所知,只有两个氢酰化反应的例子可以由三取代烯烃作为底物生成2,3-二取代的茚醇。另外,过渡金属催化的分子间碳环化反应可以很好地构建2,3-二取代的茚醇,随后需要进一步地转化来得到相应的2,3-二取代的茚酮[m.ueda,t.ueno,y.suyama and i.ryu,tetrahedron lett.,2017,58,2972;c.-x.gu,w.-w.chen and m.-h.xu,j.org.chem.,2020,85,3887;b.gourdet,m.e.rudkin and h.w.lam,org.lett.,2010,12,2554]。自此,从hayashi和murakami的开创性工作以来,用这种环合方法来构建二取代茚酮成为了直接有效的通用途径。
[0005]
直到最近,孔望清教授的研究小组清晰地证明了一种镍催化炔烃和邻溴代芳基醛的多米诺还原环化反应,通过氢自转移过程得到茚酮[y.chen,z.ding,y.wang,w.liu and w.kong,angew.chem.int.ed.,2021,60,5273]。然而,上述策略的成功高度依赖于超化学计量还原剂的使用、高温、外源双膦配体和有机溶剂的选择。
技术实现要素:
[0006]
本部分的目的在于概述本发明的实施例的一些方面以及简要介绍一些较佳实施例。在本部分以及本技术的说明书摘要和发明名称中可能会做些简化或省略以避免使本部
分、说明书摘要和发明名称的目的模糊,而这种简化或省略不能用于限制本发明的范围。
[0007]
鉴于上述和/或现有技术中存在的问题,提出了本发明。
[0008]
因此,本发明的目的是,克服现有技术中的不足,提供一种水相中一次性合成2,3-二取代的茚酮衍生物的方法。
[0009]
为解决上述技术问题,本发明提供了如下技术方案:一种水相中一次性合成2,3-二取代的茚酮衍生物的方法,包括,
[0010]
在无氧条件下,将铑催化剂、三乙胺、内炔与2-甲酰基苯硼酸混合物于水中,搅拌反应,制得2,3-二取代的茚酮衍生物。
[0011]
作为本发明所述水相中一次性合成2,3-二取代的茚酮衍生物的方法的一种优选方案,其中:所述搅拌反应,其中,搅拌反应温度为50~55℃,搅拌反应时间为16~18h。
[0012]
作为本发明所述水相中一次性合成2,3-二取代的茚酮衍生物的方法的一种优选方案,其中:所述搅拌反应温度为50℃,搅拌反应时间为16h。
[0013]
作为本发明所述水相中一次性合成2,3-二取代的茚酮衍生物的方法的一种优选方案,其中:所述铑催化剂[rhcl(cod)]2的摩尔用量为内炔的5~6mol%。
[0014]
作为本发明所述水相中一次性合成2,3-二取代的茚酮衍生物的方法的一种优选方案,其中:溶剂为水,溶剂与内炔的体积摩尔比以ml:mmol计为0.5:0.15~0.2。
[0015]
作为本发明所述水相中一次性合成2,3-二取代的茚酮衍生物的方法的一种优选方案,其中:内炔与2-甲酰基苯硼酸的摩尔比为1:1.5。
[0016]
作为本发明所述水相中一次性合成2,3-二取代的茚酮衍生物的方法的一种优选方案,其中:内炔与三乙胺的摩尔比为1:2。
[0017]
作为本发明所述水相中一次性合成2,3-二取代的茚酮衍生物的方法的一种优选方案,其中:所述炔烃包括二苯基乙炔、1,2-双(4-甲基苯基)乙炔、1,2-双(4-氟苯基)乙炔、4-辛炔、苯乙炔、1-己炔、苯己炔、对氟苯己炔、对甲氧基苯己炔和对甲基苯己炔中的一种。
[0018]
本发明有益效果:
[0019]
(1)本发明提供一种水相中一次性合成2,3-二取代的茚酮衍生物的方法,不需要外源配体,本发明简单易操作,仅使用水作为溶剂,方法中所需物品毒性小,安全环保,产物转化率高,且在室温下可以储存。
[0020]
(2)本发明的特点是非常绿色和可持续的条件,反应活性高,底物拓展范围广,产率高。
附图说明
[0021]
为了更清楚地说明本发明实施例的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其它的附图。其中:
[0022]
图1为本发明实施例1制备的产物的核磁共振氢谱图;
[0023]
图2为本发明实施例1制备的产物的核磁共振碳谱图。
具体实施方式
[0024]
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合说明书实施例对本发明的具体实施方式做详细的说明。
[0025]
在下面的描述中阐述了很多具体细节以便于充分理解本发明,但是本发明还可以采用其他不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似推广,因此本发明不受下面公开的具体实施例的限制。
[0026]
其次,此处所称的“一个实施例”或“实施例”是指可包含于本发明至少一个实现方式中的特定特征、结构或特性。在本说明书中不同地方出现的“在一个实施例中”并非均指同一个实施例,也不是单独的或选择性的与其他实施例互相排斥的实施例。
[0027]
本发明中原料,无特殊说明,均为普通市售产品。
[0028]
实施例1
[0029]
[rhcl(cod)]2催化二苯基乙炔与2-甲酰基苯硼酸的反应,过程如下:
[0030]
在氮气保护下,在反应瓶中依次加入[rhcl(cod)]25mol%,二苯基乙炔0.15mmol,2-甲酰基苯硼酸0.225mmol,三乙胺45μl,水0.5ml,50℃搅拌16h,得到42.1mg的产物,分离产率98%。
[0031]
对产物进行表征,结果为:1h nmr(400mhz,chloroform-d)δ7.91(d,j=7.7hz,1h),7.65(t,j=7.5hz,1h),7.50(t,j=7.5hz,1h),7.31(m,j=12.1,7.0hz,7h),7.12(t,j=7.0hz,4h),4.60(d,j=4.8hz,1h),3.83(d,j=4.8hz,1h).
13
cnmr(151mhz,chloroform-d)δ205.3,156.2,142.5,138.5,136.2,135.5,129.0,128.9,128.4,128.3,127.9,127.2(d,j=2.0hz),126.7,124.1,64.7,54.9.
[0032]
产物结构式为:
[0033][0034]
实施例2
[0035]
[rhcl(cod)]2催化1,2-双(4-甲基苯基)乙炔与2-甲酰基苯硼酸的反应,过程如下:
[0036]
在氮气保护下,在反应瓶中依次加入[rhcl(cod)]25mol%,1,2-双(4-甲基苯基)乙炔0.15mmol,2-甲酰基苯硼酸0.225mmol,三乙胺45μl,水0.5ml,50℃搅拌16h,得到35.1mg的产物,分离产率75%。
[0037]
对产物进行表征,结果为:1h nmr(400mhz,chloroform-d)δ7.89(d,j=7.7hz,1h),7.63(t,j=7.5hz,1h),7.48(t,j=7.4hz,1h),7.31(d,j=7.7hz,1h),7.13(dd,j=8.1,2.3hz,4h),7.00(dd,j=7.8,5.6hz,4h),4.53(d,j=4.8hz,1h),3.77(d,j=4.8hz,1h),2.34(d,j=4.4hz,6h).
13
c nmr(151mhz,chloroform-d)δ205.6,156.4,139.6,136.8,136.2,135.6,135.3,129.6(d,j=4.7hz),128.3,128.2,127.8,126.7,124.0,64.4,54.6,21.1(d,j=5.6hz).
[0038]
产物结构式为:
[0039][0040]
实施例3
[0041]
[rhcl(cod)]2催化1,2-双(4-氟苯基)乙炔与2-甲酰基苯硼酸的反应,过程如下:
[0042]
在氮气保护下,在反应瓶中依次加入[rhcl(cod)]25mol%,1,2-双(4-氟苯基)乙炔0.15mmol,2-甲酰基苯硼酸0.225mmol,三乙胺45μl,水0.5ml,50℃搅拌16h,得到46.3mg的产物,分离产率96%。
[0043]
对产物进行表征,结果为:1h nmr(400mhz,chloroform-d)δ7.89(d,j=7.7hz,1h),7.66(t,j=7.5hz,1h),7.51(t,j=7.5hz,1h),7.29(d,j=7.7hz,1h),7.19-6.91(m,8h),4.50(d,j=5.2hz,1h),3.73(d,j=5.2hz,1h).
13
c nmr(101mhz,chloroform-d)δ204.9,162.2(d,j=247.4hz),162.1(d,j=247.1hz),155.6,137.9(d,j=3.5hz),136.0,135.8,133.9(d,j=3.5hz),130.1(d,j=8.2hz),129.5(d,j=8.3hz),128.7,126.6,124.2,115.99(d,j=21.7hz),115.98(d,j=21.6hz),64.2,54.4.
[0044]
产物结构式为:
[0045][0046]
实施例4
[0047]
[rhcl(cod)]2催化4-辛炔与2-甲酰基苯硼酸的反应,过程如下:
[0048]
在氮气保护下,在反应瓶中依次加入[rhcl(cod)]25mol%,4-辛炔0.15mmol,2-甲酰基苯硼酸0.225mmol,三乙胺45μl,水0.5ml,50℃搅拌16h,得到28.0mg的产物,分离产率86%。
[0049]
对产物进行表征,结果为:1h nmr(600mhz,chloroform-d)δ7.71(dt,j=7.6,1.0hz,1h),7.58(td,j=7.5,1.2hz,1h),7.47(dd,j=7.6,1.0hz,1h),7.39-7.31(m,1h),3.06(ddd,j=8.1,4.8,2.7hz,1h),2.36(ddd,j=8.1,5.3,2.8hz,1h),1.88-1.68(m,2h),1.68-1.51(m,2h),1.48-1.33(m,3h),0.94(dt,j=12.5,7.3hz,6h).
13
c nmr(151mhz,chloroform-d)δ209.2,158.0,136.3,134.6,127.4,125.7,123.7,53.6,44.7,38.6,34.4,20.5,20.4,14.3,14.27.
[0050]
产物结构式为:
[0051]
[0052]
实施例5
[0053]
[rhcl(cod)]2催化苯乙炔与2-甲酰基苯硼酸的反应,过程如下:
[0054]
在氮气保护下,在反应瓶中依次加入[rhcl(cod)]25mol%,苯乙炔0.15mmol,2-甲酰基苯硼酸0.225mmol,三乙胺45μl,水0.5ml,50℃搅拌16h,得到15.2mg的产物,分离产率48%。
[0055]
对产物进行表征,结果为:1h nmr(600mhz,chloroform-d)δ7.82(d,j=7.7hz,1h),7.65(t,j=7.5hz,1h),7.54(d,j=7.7hz,1h),7.43(t,j=7.5hz,1h),7.32(t,j=7.6hz,2h),7.26(d,j=3.3hz,1h),7.19(d,j=7.4hz,2h),3.90(dd,j=8.3,4.1hz,1h),3.70(dd,j=17.4,8.3hz,1h),3.28(dd,j=17.4,4.1hz,1h).
13
c nmr(151mhz,chloroform-d)δ206.0,153.7,139.7,136.3,135.0,128.9,127.9,127.8,127.0,126.4,124.6,53.4,35.9.
[0056]
产物结构式为:
[0057][0058]
实施例6
[0059]
[rhcl(cod)]2催化1-己炔与2-甲酰基苯硼酸的反应,过程如下:
[0060]
在氮气保护下,在反应瓶中依次加入[rhcl(cod)]25mol%,1-己炔0.15mmol,2-甲酰基苯硼酸0.225mmol,三乙胺45μl,水0.5ml,50℃搅拌16h,得到15.2mg的产物,分离产率54%。
[0061]
对产物进行表征,结果为:1h nmr(600mhz,chloroform-d)δ7.75(d,j=7.7hz,1h),7.58(t,j=7.4hz,1h),7.45(d,j=7.6hz,1h),7.36(t,j=7.4hz,1h),3.32(dd,j=17.1,7.8hz,1h),2.82(dd,j=17.1,3.9hz,1h),2.67
–
2.63(m,1h),1.98
–
1.93(m,1h),1.48
–
1.44(m,1h),1.43
–
1.33(m,4h),0.91(t,j=7.1hz,3h).
13
c nmr(151mhz,chloroform-d)δ209.2,153.8,136.9,134.6,127.3,126.5,123.9,47.5,32.9,31.2,29.6,22.7,14.0.
[0062]
产物结构式为:
[0063][0064]
实施例7
[0065]
[rhcl(cod)]2催化苯己炔与2-甲酰基苯硼酸的反应,过程如下:
[0066]
在氮气保护下,在反应瓶中依次加入[rhcl(cod)]25mol%,苯己炔0.15mmol,2-甲酰基苯硼酸0.225mmol,三乙胺45μl,水0.5ml,50℃搅拌16h,得到40.2mg的产物,分离产率92%。
[0067]
对产物进行表征,结果为:1h nmr(600mhz,chloroform-d)δ7.83(d,j=7.7hz,1h),7.69(td,j=7.5,1.3hz,1h),7.60(d,j=7.7hz,1h),7.46(t,j=7.4hz,1h),7.40-7.25(m,2h),7.24-7.11(m,2h),3.56(d,j=3.7hz,1h),3.51(dt,j=8.5,4.2hz,1h),2.02(m,1h),1.87-1.68(m,1h),1.55-1.24(m,4h),0.90(t,j=7.2hz,3h).
13
c nmr(151mhz,chloroform-d)δ205.8,157.8,140.0,135.9,135.1,128.8,128.1,127.9,127.0,125.5,124.3,60.7,48.0,35.5,29.4,22.8,13.9.
[0068]
产物结构式为:
[0069][0070]
实施例8
[0071]
[rhcl(cod)]2催化对氟苯己炔与2-甲酰基苯硼酸的反应,过程如下:
[0072]
在氮气保护下,在反应瓶中依次加入[rhcl(cod)]25mol%,对氟苯己炔0.15mmol,2-甲酰基苯硼酸0.225mmol,三乙胺45μl,水0.5ml,50℃搅拌16h,得到32.3mg的产物,分离产率80%。
[0073]
对产物进行表征,结果为:1h nmr(400mhz,chloroform-d)δ7.79(d,j=7.7hz,1h),7.67(t,j=7.5hz,1h),7.56(d,j=7.8hz,1h),7.43(t,j=7.5hz,1h),7.11(dd,j=8.5,5.4hz,2h),7.00(t,j=8.6hz,2h),3.73-2.73(m,2h),2.07-1.94(m,1h),1.79-1.65(m,1h),1.43-1.17(m,4h),0.87(t,j=7.0hz,3h).
13
cnmr(101mhz,chloroform-d)δ205.8,161.9(d,j=245.1hz),157.6,135.8,135.7(d,j=3.6hz),135.3,129.7(d,j=7.7hz),128.1,125.5,124.4,115.8(d,j=21.6hz),59.9,48.1,35.4,29.5,22.9,13.8.
[0074]
产物结构式为:
[0075][0076]
实施例9
[0077]
[rhcl(cod)]2催化对甲氧基苯己炔与2-甲酰基苯硼酸的反应,过程如下:
[0078]
在氮气保护下,在反应瓶中依次加入[rhcl(cod)]25mol%,对甲氧基苯己炔0.15mmol,2-甲酰基苯硼酸0.225mmol,三乙胺45μl,水0.5ml,50℃搅拌16h,得到26.2mg的产物,分离产率62%。
[0079]
对产物进行表征,结果为:1h nmr(600mhz,chloroform-d)δ7.79(d,j=7.6hz,1h),7.66(t,j=7.4hz,1h),7.56(d,j=7.7hz,1h),7.42(t,j=7.4hz,1h),7.07(d,j=8.6hz,2h),6.85(dd,j=8.6,1.2hz,2h),3.78(d,j=1.1hz,3h),3.47(d,j=3.9hz,1h),3.43(dt,j=8.6,4.2hz,1h),2.05-1.92(m,1h),1.76-1.67(m,1h),1.44-1.25(m,4h),0.89-0.86(m,3h).
13
c nmr(151mhz,chloroform-d)δ206.2,158.6,157.7,135.9,135.0,132.0,129.1,127.8,125.4,124.3,114.3,59.9,55.3,48.0,35.4,29.4,22.8,13.9.
[0080]
产物结构式为:
[0081][0082]
实施例10
[0083]
[rhcl(cod)]2催化对甲基苯己炔与2-甲酰基苯硼酸的反应,过程如下:
[0084]
在氮气保护下,在反应瓶中依次加入[rhcl(cod)]25mol%,对甲基苯己炔0.15mmol,2-甲酰基苯硼酸0.225mmol,三乙胺45μl,水0.5ml,50℃搅拌16h,得到31.3mg的产物,分离产率75%。
[0085]
对产物进行表征,结果为:1h nmr(600mhz,chloroform-d)δ7.79(d,j=7.6hz,1h),7.66(td,j=7.5,1.3hz,1h),7.56(dd,j=7.7,1.0hz,1h),7.43(t,j=7.4hz,1h),7.12(d,j=7.8hz,2h),7.04(d,j=8.1hz,2h),3.50(d,j=3.8hz,1h),3.46(dt,j=8.6,4.2hz,1h),2.32(s,3h),1.99(m,1h),1.77-1.67(m,1h),1.44-1.24(m,4h),0.88(t,j=7.2hz,3h).
13
c nmr(151mhz,chloroform-d)δ206.0,157.8,136.9,136.5,136.0,135.0,129.5,128.0,127.8,125.4,124.3,60.3,48.0,35.5,29.4,22.8,21.1,13.9.
[0086]
产物结构式为:
[0087][0088]
实施例11
[0089]
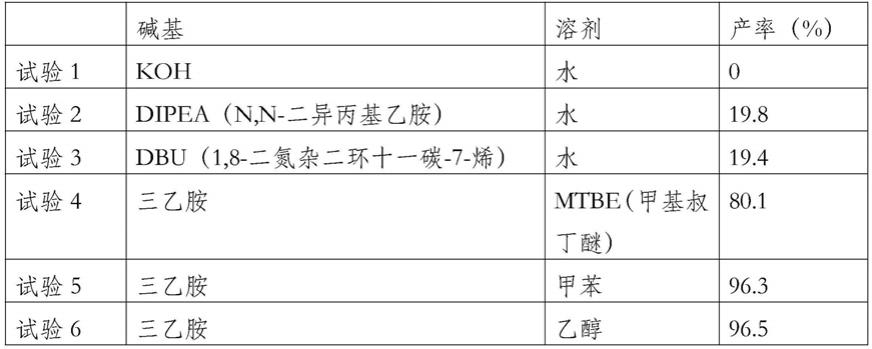
在实施例1的制备条件下,控制不同的反应条件对产率的影响,条件和结果见表1。
[0090]
表1
[0091][0092]
本发明提供一种水相中一次性合成2,3-二取代的茚酮衍生物的方法,不需要外源配体,本发明简单易操作,仅使用水作为溶剂,方法中所需物品毒性小,安全环保,产物转化率高,且在室温下可以储存。本发明的特点是非常绿色和可持续的条件,反应活性高,底物拓展范围广,产率高。
[0093]
应说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围当中。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
