用抗ox40抗体和多重激酶抑制剂治疗癌症
技术领域
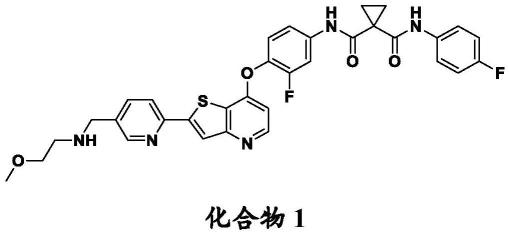
1.本文披露了用与人ox40结合的抗体或其抗原结合片段和多重激酶抑制剂(例如n-(3-氟-4-((2-(5-(((2-甲氧基乙基)氨基)甲基)吡啶-2-基)噻吩并[3,2-b]吡啶-7-基)氧基)苯基)-n-(4-氟苯基)环丙烷-1,1-二甲酰胺或其药学上可接受的盐)治疗癌症的方法。
背景技术:
[0002]
ox40(也称为act35、cd134或tnfrsf4)是一种大约50kd的i型跨膜糖蛋白并且是肿瘤坏死因子受体超家族(tnfrsf)的成员(croft,2010;gough和weinberg,2009)。成熟人ox40由249个氨基酸(aa)残基组成,具有37个aa胞质尾区和185个aa细胞外区域。ox40的细胞外结构域含有三个完整的富含半胱氨酸的结构域(crd)和一个不完整的富含半胱氨酸的结构域。ox40的细胞内结构域含有一种保守的信号传导相关的qee基序,该基序介导与几种tnfr相关因子(traf)(包括traf2、traf3以及traf5)的结合,允许ox40与细胞内激酶连接(arch和thompson,1998;willoughby等人,2017)。
[0003]
ox40最初是在活化的大鼠cd4
t细胞发现的,并且随后从t细胞克隆鼠和人同源物(al-shamkhani等人,1996;calderhead等人,1993)。除了在活化的cd4
t细胞(包括t辅助(th)1细胞、th2细胞、th17细胞以及调节性t(treg)细胞)上表达外,还在活化的cd8
t细胞、自然杀伤(nk)t细胞、嗜中性粒细胞以及nk细胞的表面上发现了ox40表达(croft,2010)。相比之下,在初始cd4
和cd8
t细胞以及在大多静息记忆t细胞上发现低的ox40表达(croft,2010;soroosh等人,2007)。初始t细胞上的ox40的表面表达是瞬时的。在tcr活化后,t细胞上的ox40表达在24小时内大大增加,并在2-3天内达到峰值,持续5-6天(gramaglia等人,1998)。
[0004]
ox40配体(ox40l,也称为gp34、cd252或tnfsf4)是ox40的唯一配体。与其他tnfsf(肿瘤坏死因子超家族)成员相似,ox40l是ii型糖蛋白,含有183个aa(具有23个aa细胞内结构域和133个aa细胞外结构域)(croft,2010;gough和weinberg,2009)。ox40l在细胞表面上天然形成同源三聚体复合物。配体三聚体在配体单体-单体界面上,主要通过受体的crd1、crd2以及部分crd3区域(但不涉及crd4)与三个拷贝的ox40相互作用(compaan和hymowitz,2006)。ox40l主要在活化的抗原呈递细胞(apc)(包括活化的b细胞(stuber等人,1995)、成熟常规树突状细胞(dc)(ohshima等人,1997)、浆细胞样dc(pdc)(ito等人,2004)、巨噬细胞(weinberg等人,1999)以及朗格汉斯细胞(sato等人,2002))上表达。此外,已发现ox40l在其他细胞类型上表达,如nk细胞、肥大细胞、活化的t细胞的亚群以及血管内皮细胞和平滑肌细胞(croft,2010;croft等人,2009)。
[0005]
通过由三聚体ox40l连接的ox40三聚化或通过激动性抗体的二聚化有助于衔接分子traf2、traf3和/或traf5向其细胞内qee基序的募集和对接(arch和thompson,1998;willoughby等人,2017)。traf2和traf3的募集和对接可以进一步导致经典的nf-κb1途径和非经典的nf-κb2途径的活化,其在调节t细胞的存活、分化、扩增、细胞因子产生以及效应子功能中起关键作用(croft,2010;gramaglia等人,1998;huddleston等人,2006;rogers等
人,2001;ruby和weinberg,2009;song等人,2005a;song等人,2005b;song等人,2008)。
[0006]
在正常组织中,ox40表达量低并且主要在淋巴器官中的淋巴细胞上表达(durkop等人,1995)。然而,在动物模型和具有病理病症(redmond和weinberg,2007)(如自身免疫性疾病(carboni等人,2003;jacquemin等人,2015;szypowska等人,2014)和癌症(kjaergaard等人,2000;vetto等人,1997;weinberg等人,2000))的人类患者中,均已频繁观察到ox40在免疫细胞上表达上调。值得注意的是,增加的ox40表达与患有结直肠癌和皮肤黑色素瘤的患者的更长存活期相关,并且与远端转移和更晚期的肿瘤特征的发生呈负相关(ladanyi等人,2004;petty等人,2002;sarff等人,2008)。还已显示抗ox40抗体治疗可以在不同小鼠模型中引起抗肿瘤功效(aspeslagh等人,2016),表明ox40作为免疫治疗靶标的潜力。在由curti等人进行的癌症患者首次临床试验中,用激动性抗ox40单克隆抗体观察到抗肿瘤功效和肿瘤特异性t细胞的活化的证据,表明ox40抗体在增强抗肿瘤t细胞应答中具有效用(curti等人,2013)。
[0007]
已主要在小鼠肿瘤模型中研究了激动性抗ox40抗体在介导抗肿瘤功效中的作用机理(weinberg等人,2000)。直到最近,才将激动性抗ox40抗体在肿瘤中的作用机理归因于它们触发效应t细胞中共刺激信号传导途径的能力,以及对treg细胞的分化和功能的抑制作用(aspeslagh等人,2016;ito等人,2006;st rose等人,2013;voo等人,2013)。最近的研究已显示在动物肿瘤模型和癌症患者两者中,肿瘤浸润treg表达的ox40水平高于效应t细胞(cd4
和cd8
)和外周treg(lai等人,2016;marabelle等人,2013b;montler等人,2016;soroosh等人,2007;timperi等人,2016)。因此,抗ox40抗体触发抗肿瘤应答的继发效应依赖于它们通过抗体依赖性细胞毒性(adcc)和/或抗体依赖性细胞吞噬作用(adcp)耗减肿瘤内ox40
treg细胞的fc介导的效应子功能(aspeslagh等人,2016;bulliard等人,2014;marabelle等人,2013a;marabelle等人,2013b;smyth等人,2014)。这项工作证明具有fc介导的效应子功能的激动性抗ox40抗体可以优先耗减肿瘤内treg,并且改善在肿瘤微环境(tme)中cd8
效应t细胞与treg的比率,导致改善的抗肿瘤免疫应答、增加的肿瘤消退以及改善的存活(bulliard等人,2014;carboni等人,2003;jacquemin等人,2015;marabelle等人,2013b)。基于这些发现,开发具有激动性活性和fc介导的效应子功能的激动性抗ox40抗体的医疗需求尚未满足。
[0008]
迄今为止,临床上的激动性抗ox40抗体主要是阻断ox40-ox40l相互作用的配体竞争性抗体(例如wo 2016196228 a1)。由于ox40-ox40l相互作用对增强有效的抗肿瘤免疫力至关重要,因此ox40-ox40l的阻断限制了这些配体竞争性抗体的功效。因此,与ox40特异性结合而不干扰ox40与ox40l相互作用的ox40激动剂抗体在通过单一疗法和组合疗法两者治疗癌症和自身免疫性障碍中都具有效用。
技术实现要素:
[0009]
本披露的发明人发现,抗ox40抗体与多重激酶抑制剂(例如n-(3-氟-4-((2-(5-(((2-甲氧基乙基)氨基)甲基)吡啶-2-基)噻吩并[3,2-b]吡啶-7-基)氧基)苯基)-n-(4-氟苯基)环丙烷-1,1-二甲酰胺或其药学上可接受的盐)的组合与单独使用以上每种活性药剂的单一疗法相比,对癌症中的肿瘤生长产生了显著的抑制。
[0010]
本披露涉及活化ox40并在免疫细胞中诱导信号传导,从而促进抗肿瘤免疫力的激
动性抗ox40抗体和其抗原结合片段与多重酪氨酸激酶抑制剂的组合。
[0011]
在一个实施例中,激动性抗体和其抗原结合片段与人ox40或其抗原结合片段结合。在一个实施例中,激动性抗体和其抗原结合片段不与ox40l竞争,或不干扰ox40与其配体ox40l的结合。
[0012]
本披露包括以下实施例。
[0013]
一种癌症治疗的方法,该方法包括向受试者施用有效量的抗ox40抗体或其抗原结合片段与多重酪氨酸激酶抑制剂的组合。
[0014]
一种癌症治疗的方法,该方法包括向受试者施用有效量的非竞争性抗ox40抗体或其抗原结合片段与多重酪氨酸激酶抑制剂的组合。
[0015]
一种癌症治疗的方法,该方法包括向受试者施用有效量的抗体或其抗原结合片段,该抗体或其抗原结合片段与人ox40特异性结合,并且包含:(i)重链可变区,该重链可变区包含(a)seq id no:3的hcdr(重链互补决定区)1、(b)seq id no:24的hcdr2、以及(c)seq id no:5的hcdr3;和轻链可变区,该轻链可变区包含(d)seq id no:25的lcdr(轻链互补决定区)1、(e)seq id no:19的lcdr2、以及(f)seq id no:8的lcdr3;(ii)重链可变区,该重链可变区包含(a)seq id no:3的hcdr1、(b)seq id no:18的hcdr2、以及(c)seq id no:5的hcdr3;和轻链可变区,该轻链可变区包含:(d)seq id no:6的lcdr1、(e)seq id no:19的lcdr2、以及(f)seq id no:8的lcdr3;(iii)重链可变区,该重链可变区包含(a)seq id no:3的hcdr1、(b)seq id no:13的hcdr2、以及(c)seq id no:5的hcdr3;和轻链可变区,该轻链可变区包含:(d)seq id no:6的lcdr1、(e)seq id no:7的lcdr2、以及(f)seq id no:8的lcdr3;或(iv)重链可变区,该重链可变区包含(a)seq id no:3的hcdr1、(b)seq id no:4的hcdr2、以及(c)seq id no:5的hcdr3;和轻链可变区,该轻链可变区包含:(d)seq id no:6的lcdr1、(e)seq id no:7的lcdr2、以及(f)seq id no:8的lcdr3,与多重酪氨酸激酶抑制剂的组合。
[0016]
该方法,其中该抗体或抗原结合包含:(i)含有seq id no:26的重链可变区(vh)和含有seq id no:28的轻链可变区(vl);(ii)含有seq id no:20的重链可变区(vh)和含有seq id no:22的轻链可变区(vl);(iii)含有seq id no:14的重链可变区(vh)和含有seq id no:16的轻链可变区(vl);或(iv)含有seq id no:9的重链可变区(vh)和含有seq id no:11的轻链可变区(vl)。
[0017]
该方法,其中该多重酪氨酸激酶抑制剂是n-(3-氟-4-((2-(5-(((2-甲氧基乙基)氨基)甲基)吡啶-2-基)噻吩并[3,2-b]吡啶-7-基)氧基)苯基)-n-(4-氟苯基)环丙烷-1,1-二甲酰胺(以下称为化合物1),
或其立体异构体、或其药学上可接受的盐。
[0018]
该方法,其中化合物1呈结晶形式。
[0019]
化合物1披露于国际公开wo 2009/026717 a,其已证明对紧密相关的酪氨酸激酶(包括ret、cbl、chr4q12、ddr和trk)的光谱具有有效抑制,这些酪氨酸激酶是导致细胞生长、存活和肿瘤进展的信号传导途径的关键调节剂。
[0020]
该方法,其中该癌症是实体癌或肿瘤。
[0021]
该方法,其中该实体癌是多重酪氨酸激酶相关的癌症。
[0022]
该方法,其中该癌症是结肠癌(cc)、非小细胞肺癌(nsclc)、非鳞状非小细胞肺癌、卵巢癌(oc)、上皮卵巢癌、肾细胞癌(rcc)和黑色素瘤。
[0023]
该方法,其中该结肠癌是难治性或抗性结肠癌(cc)。
[0024]
该方法,其中该非小细胞肺癌(nsclc)是难治性或抗性nsclc。
[0025]
该方法,其中该非小细胞肺癌(nsclc)是非鳞状非小细胞肺癌。
[0026]
该方法,其中肾细胞癌(rcc)是难治性或抗性rcc。
[0027]
该方法,其中该黑色素瘤是难治性/抗性不可切除或转移性黑色素瘤。
[0028]
该方法,其中该卵巢癌(oc)是难治性或抗性上皮卵巢癌。
[0029]
该方法,其中该卵巢癌是铂-抗性卵巢癌。
[0030]
在一个实施例中,该抗体或其抗原结合片段包含一个或多个互补决定区(cdr),这些互补决定区具有选自由以下组成的组的氨基酸序列:seq id no:3、seq id no:4、seq id no:5、seq id no:6、seq id no:7、seq id no:8、seq id no:13、seq id no:18、seq id no:19、seq id no:24以及seq id no:25。
[0031]
在另一个实施例中,该抗体或其抗原结合片段包含:(a)含有一个或多个互补决定区(hcdr)的重链可变区,这些互补决定区具有选自由以下组成的组的氨基酸序列:seq id no:3、seq id no:4、seq id no:13、seq id no:18、seq id no:24以及seq id no:5;和/或(b)含有一个或多个互补决定区(lcdr)的轻链可变区,这些互补决定区具有选自由以下组成的组的氨基酸序列:seq id no:6、seq id no:25、seq id no:7、seq id no:19以及seq id no:8。
[0032]
在另一个实施例中,该抗体或其抗原结合片段包含:(a)含有三个互补决定区(hcdr)的重链可变区,这些互补决定区是具有seq id no:3的氨基酸序列的hcdr1;具有seq id no:4、seq id no:13、seq id no:18或seq id no:24的氨基酸序列的hcdr2;以及具有seq id no:5的氨基酸序列的hcdr3;和/或(b)包含三个互补决定区(lcdr)的轻链可变区,这些互补决定区是具有seq id no:6或seq id no:25的氨基酸序列的lcdr1;具有seq id no:7或seq id no:19的氨基酸序列的lcdr2;以及具有seq id no:8的氨基酸序列的lcdr3。
[0033]
在另一个实施例中,该抗体或其抗原结合片段包含:(a)含有三个互补决定区(hcdr)的重链可变区,这些互补决定区是具有seq id no:3的氨基酸序列的hcdr1、具有seq id no:4的氨基酸序列的hcdr2、以及具有seq id no:5的氨基酸序列的hcdr3;或具有seq id no:3的氨基酸序列的hcdr1、具有seq id no:13的氨基酸序列的hcdr2、以及具有seq id no:5的氨基酸序列的hcdr3;或具有seq id no:3的氨基酸序列的hcdr1、具有seq id no:18的氨基酸序列的hcdr2、以及具有seq id no:5的氨基酸序列的hcdr3;或具有seq id no:3的氨基酸序列的hcdr1、具有seq id no:24的氨基酸序列的hcdr2、以及具有seq id no:5的氨基酸序列的hcdr3;和/或(b)包含三个互补决定区(lcdr)的轻链可变区,这些互补决定区是具有seq id no:6的氨基酸序列的lcdr1、具有seq id no:7的氨基酸序列的lcdr2、以及具有seq id no:8的氨基酸序列的lcdr3;或具有seq id no:6的氨基酸序列的lcdr1、具有seq id no:19的氨基酸序列的lcdr2、以及具有seq id no:8的氨基酸序列的lcdr3;或具有seq id no:25的氨基酸序列的lcdr1、具有seq id no:19的氨基酸序列的lcdr2、以及具有seq id no:8的氨基酸序列的lcdr3。
[0034]
在另一个实施例中,本披露的抗体或抗原结合片段包含:重链可变区,该重链可变区包含具有seq id no:3的氨基酸序列的hcdr1、具有seq id no:4的氨基酸序列的hcdr2、以及具有seq id no:5的氨基酸序列的hcdr3;和轻链可变区,该轻链可变区包含具有seq id no:6的氨基酸序列的lcdr1、具有seq id no:7的氨基酸序列的lcdr2、以及具有seq id no:8的氨基酸序列的lcdr3。
[0035]
在一个实施例中,本披露的抗体或抗原结合片段包含:重链可变区,该重链可变区包含具有seq id no:3的氨基酸序列的hcdr1、具有seq id no:13的氨基酸序列的hcdr2、以及具有seq id no:5的氨基酸序列的hcdr3;和轻链可变区,该轻链可变区包含具有seq id no:6的氨基酸序列的lcdr1、具有seq id no:7的氨基酸序列的lcdr2、以及具有seq id no:8的氨基酸序列的lcdr3。
[0036]
在另一个实施例中,本披露的抗体或抗原结合片段包含:重链可变区,该重链可变区包含具有seq id no:3的氨基酸序列的hcdr1、具有seq id no:18的氨基酸序列的hcdr2、以及具有seq id no:5的氨基酸序列的hcdr3;和轻链可变区,该轻链可变区包含具有seq id no:6的氨基酸序列的lcdr1、具有seq id no:19的氨基酸序列的lcdr2、以及具有seq id no:8的氨基酸序列的lcdr3。
[0037]
在另一个实施例中,本披露的抗体或抗原结合片段包含:重链可变区,该重链可变区包含具有seq id no:3的氨基酸序列的hcdr1、具有seq id no:24的氨基酸序列的hcdr2、以及具有seq id no:5的氨基酸序列的hcdr3;和轻链可变区,该轻链可变区包含具有seq id no:25的氨基酸序列的lcdr1、具有seq id no:19的氨基酸序列的lcdr2、以及具有seq id no:8的氨基酸序列的lcdr3。
[0038]
在一个实施例中,本披露的抗体或其抗原结合片段包含:(a)重链可变区,该重链可变区具有seq id no:9、seq id no:14、seq id no:20或seq id no:26的氨基酸序列,或与seq id no:9、seq id no:14、seq id no:20或seq id no:26中的任一个具有至少95%、96%、97%、98%或99%同一性的氨基酸序列;和/或(b)轻链可变区,该轻链可变区具有seq id no:11、seq id no:16、seq id no:22或seq id no:28的氨基酸序列,或与seq id no:11、seq id no:16、seq id no:22或seq id no:28中的任一个具有至少95%、96%、97%、
98%或99%同一性的氨基酸序列。
[0039]
在另一个实施例中,本披露的抗体或其抗原结合片段包含:(a)重链可变区,该重链可变区具有seq id no:9、seq id no:14、seq id no:20或seq id no:26的氨基酸序列,或在seq id no:9、seq id no:14、seq id no:20或seq id no:26的氨基酸序列中具有一个、两个或三个氨基酸取代的氨基酸序列;和/或(b)轻链可变区,该轻链可变区具有seq id no:11、seq id no:16、seq id no:22或seq id no:28的氨基酸序列,或在seq id no:11、seq id no:16、seq id no:22或seq id no:28的氨基酸序列中具有一个、两个、三个、四个、或五个氨基酸取代的氨基酸序列。在另一个实施例中,这些氨基酸取代是保守氨基酸取代。
[0040]
在一个实施例中,本披露的抗体或其抗原结合片段包含:(a)具有seq id no:9的氨基酸序列的重链可变区,和具有seq id no:11的氨基酸序列的轻链可变区;或(b)具有seq id no:14的氨基酸序列的重链可变区,和具有seq id no:16的氨基酸序列的轻链可变区;或(c)具有seq id no:20的氨基酸序列的重链可变区,和具有seq id no:22的氨基酸序列的轻链可变区;或(d)具有seq id no:26的氨基酸序列的重链可变区,和具有seq id no:28的氨基酸序列的轻链可变区。
[0041]
在一个实施例中,本披露的抗体是igg1、igg2、igg3或igg4同种型。在更特定的实施例中,本披露的抗体包含野生型人igg1(也称为人igg1wt或huigg1)或igg2的fc结构域。在另一个实施例中,本披露的抗体包含具有s228p和/或r409k取代(根据eu编号系统)的人igg4的fc结构域。
[0042]
在一个实施例中,本披露的抗体以1x10-6
m至1x10-10
m的结合亲和力(kd)与ox40结合。在另一个实施例中,本披露的抗体以约1x10-6
m、约1x10-7
m、约1x10-8
m、约1x10-9
m或约1x10-10
m的结合亲和力(kd)与ox40结合。
[0043]
在另一个实施例中,本披露的抗人ox40抗体显示对食蟹猴ox40的跨物种结合活性。
[0044]
在一个实施例中,本披露的抗ox40抗体在ox40-ox40l相互作用界面外与人ox40的表位结合。在另一个实施例中,本披露的抗ox40抗体不与ox40配体竞争结合ox40。在又另一个实施例中,本披露的抗ox40抗体不阻断ox40和其配体ox40l之间的相互作用。
[0045]
本披露的抗体是激动性的,并且显著增强免疫应答。在实施例中,在混合淋巴细胞反应(mlr)测定中,本披露的抗体可以显著刺激原代t细胞以产生il-2。
[0046]
在一个实施例中,本披露的抗体具有强的fc介导的效应子功能。抗体通过nk细胞介导针对ox40
hi
靶细胞(如调节性t细胞(treg细胞))的抗体依赖性细胞毒性(adcc)。在一方面,本披露提供了基于不同的ox40表达水平,评估抗ox40抗体介导的体外特异性t细胞亚群的耗减的方法。
[0047]
本披露的抗体或抗原结合片段不阻断ox40-ox40l相互作用。此外,如动物模型中所示,ox40抗体表现出体内剂量依赖性抗肿瘤活性。该剂量依赖性活性与阻断ox40-ox40l相互作用的抗ox40抗体的活性特征有区别。
[0048]
本披露涉及分离的核酸,这些分离的核酸包含编码该抗体或抗原结合片段的氨基
酸序列的核苷酸序列。在一个实施例中,分离的核酸包含seq id no:10、seq id no:15、seq id no:21、或seq id no:27的vh核苷酸序列,或与seq id no:10、seq id no:15、seq id no:21、或seq id no:27具有至少95%、96%、97%、98%或99%同一性的核苷酸序列,并且编码本披露的抗体或抗原结合片段的vh区。可替代地或另外地,分离的核酸包含seq id no:12、seq id no:17、seq id no:23、或seq id no:29的vl核苷酸序列,或与seq id no:12、seq id no:17、seq id no:23、或seq id no:29具有至少95%、96%、97%、98%或99%同一性的核苷酸序列,并且编码本披露的抗体或抗原结合片段的vl区。
[0049]
本披露提供了用抗ox40抗体与多重酪氨酸激酶抑制剂(例如,n-(3-氟-4-((2-(5-(((2-甲氧基乙基)氨基)甲基)吡啶-2-基)噻吩并[3,2-b]吡啶-7-基)氧基)苯基)-n-(4-氟苯基)环丙烷-1,1-二甲酰胺(化合物1)或其立体异构体、或其药学上可接受的盐)的组合治疗的方法,其中与单独使用以上每种活性药剂的单一疗法相比,该组合减少了癌症中的肿瘤生长。抗ox40抗体与化合物1组合的治疗是有希望的,在多种癌症(包括结肠癌(cc)和非小细胞肺癌(nsclc))中均具有抗肿瘤活性。
[0050]
在一方面,本文披露了用于治疗受试者癌症的方法,该方法包括向有需要的受试者施用治疗有效量的抗ox40抗体与多重酪氨酸激酶抑制剂(例如化合物1或其立体异构体、或其药学上可接受的盐)的组合。
[0051]
在第二方面,本文披露了用于在治疗癌症中使用的药物组合,该药物组合包含抗ox40抗体和多重酪氨酸激酶抑制剂(例如,化合物1或其立体异构体、或其药学上可接受的盐)。
[0052]
本文还披露了抗ox40抗体与多重酪氨酸激酶抑制剂(例如,化合物1或其立体异构体、或其药学上可接受的盐)的组合,其用于在治疗癌症中使用。在一个实施例中,本文披露了用于在治疗癌症中使用的抗ox40抗体与多重酪氨酸激酶抑制剂(例如,化合物1或其立体异构体、或其药学上可接受的盐)的组合。
[0053]
在另一方面,本文披露了药物组合在制造用于治疗癌症的药物中的用途,所述药物组合包含抗ox40抗体和多重酪氨酸激酶抑制剂(例如,化合物1或其立体异构体、或其药学上可接受的盐)。
[0054]
本披露还提供了制品或“试剂盒”,该制品或试剂盒包含第一容器、第二容器和药品说明书(package insert),其中该第一容器包含至少一个剂量的药物,该药物包含抗ox40抗体,该第二容器包含至少一个剂量的多重酪氨酸激酶抑制剂(例如n-(3-氟-4-((2-(5-(((2-甲氧基乙基)氨基)甲基)吡啶-2-基)噻吩并[3,2-b]吡啶-7-基)氧基)苯基)-n-(4-氟苯基)环丙烷-1,1-二甲酰胺(化合物1)或其立体异构体、或其药学上可接受的盐),并且该药品说明书包含使用这些药物治疗患有癌症的受试者的说明书。
[0055]
本文披露的方法和药物组合(作为组合疗法)比施用抗ox40抗体或多重激酶抑制剂(当作为单一药剂施用时)更显著有效。
[0056]
在实施例中,该癌症是结肠癌(cc)、肺癌、非小细胞肺癌(nsclc)、非鳞状非小细胞肺癌、卵巢癌(oc)、上皮卵巢癌、肾细胞癌(rcc)和黑色素瘤。
[0057]
在本披露的实施例中,该结肠癌、肺癌、非小细胞肺癌(nsclc)、非鳞状非小细胞肺癌、卵巢癌(oc)、上皮卵巢癌、肾细胞癌(rcc)和黑色素瘤是难治性/抗性转移性的。在一方面,黑色素瘤是难治性/抗性不可切除或转移性黑色素瘤。在另一方面,卵巢癌(oc)是初治
复发性和铂-抗性上皮oc。
附图说明
[0058]
图1是ox40-migg2a、ox40-huigg1和ox40-his构建体的示意图。ox40 ecd:ox40细胞外结构域。n:n-末端。c:c-末端。
[0059]
图2显示通过表面等离子体共振(spr)测定纯化嵌合(ch445)和人源化(445-1、445-2、445-3和445-3igg4)抗ox40抗体的亲和力。
[0060]
图3证明了通过流式细胞术测定ox40结合。将ox40阳性hut78/ox40细胞与不同抗ox40抗体(抗体ch445、445-1、445-2、445-3和445-3igg4)孵育,并进行facs分析。通过平均荧光强度(mfi,y轴)示出结果。
[0061]
图4显示通过流式细胞术的ox40抗体的结合。将hut78/ox40和hut78/cynoox40细胞用抗体445-3染色,并通过流式细胞术确定平均荧光强度(mfi,在y轴上示出)。
[0062]
图5描绘了通过表面等离子体共振(spr)测定445-3fab对ox40野生型和点突变体的亲和力。
[0063]
图6显示抗体445-3与其在ox40上的表位之间的详细相互作用。分别以浅灰色和黑色描绘抗体445-3和ox40。氢键或盐桥、π-π堆积和范德华力(vdw)相互作用分别用虚线、双虚线以及实线表示。
[0064]
图7证明了抗体445-3不干扰ox40l结合。在hek293/ox40l细胞染色之前,将ox40小鼠igg2a(ox40-migg2a)融合蛋白与人igg( huigg)、抗体445-3( 445-3)或抗体1a7.gr1( 1a7.gr1,参见us 2015/0307617),以1:1的摩尔比预孵育。通过hek293/ox40l细胞和ox40-migg2a/抗ox40抗体复合物共孵育,随后与抗小鼠igg二级ab反应,以及流式细胞术确定ox40l与ox40-migg2a/抗ox40抗体复合物的结合。结果以两次重复的平均值
±
sd表示。统计学显著性:*:p《0.05;**:p《0.01。
[0065]
图8显示了ox40/445-3fab与报道的ox40/ox40l复合物(pdb代码:2hev)的结构比对。ox40l显示为白色,445-3fab显示为灰色,并且ox40显示为黑色。
[0066]
图9a-b显示抗ox40抗体445-3联合tcr刺激诱导il-2产生。在抗ox40抗体存在下,将ox40阳性hut78/ox40细胞(图9a)与人工抗原呈递细胞(apc)系(hek293/os8
低-fcγri)共培养过夜,并将il-2产生用作t细胞刺激的读数(图9b)。通过elisa检测培养上清液中的il-2。结果以三次重复的平均值
±
sd表示。
[0067]
图10表示抗ox40抗体增强了mlr应答。在抗ox40抗体(0.1-10μg/ml)存在下,将体外分化的树突状细胞(dc)与同种异体cd4
t细胞共培养2天。通过elisa检测上清液中的il-2。所有测试一式四份进行,并且结果显示为平均值
±
sd。统计学显著性:*:p《0.05;**:p《0.01。
[0068]
图11证明了抗ox40抗体445-3诱导adcc。在抗ox40抗体(0.004-3μg/ml)或对照存在下,使用nk92mi/cd16v细胞(作为效应细胞)和hut78/ox40细胞(作为靶细胞)进行adcc测定。在检测乳酸脱氢酶(ldh)释放之前,将相同数量的效应细胞和靶细胞共培养5小时。基于如实例12中所述的制造商的方案计算细胞毒性的百分比(y轴)。结果以三次重复的平均值
±
sd表示。
[0069]
图12a-12c显示抗ox40抗体445-3与nk细胞的组合增加了体外活化的pbmc中cd8
效应t细胞与treg的比率。将人pbmc通过pha-l(1μg/ml)预活化,并且然后在抗ox40抗体或对照存在下与nk92mi/cd16v细胞共培养。通过流式细胞术确定不同t细胞亚群的百分比。进一步计算cd8
效应t细胞与treg的比率。图12a显示cd8 /总t细胞的比率。图12b是treg/总t细胞比率。图12c显示cd8 /treg比率。数据以两次重复的平均值
±
sd表示。显示指定浓度下445-3和1a7.gr1之间的统计学显著性。*:p《0.05;**:p《0.01。
[0070]
图13a-13b显示在ox40人源化小鼠的mc38结直肠癌同基因模型中,抗ox40抗体445-3(而不是1a7.gr1)展示剂量依赖性抗肿瘤活性。将mc38鼠结肠癌细胞(2
×
107)皮下植入雌性人ox40转基因小鼠中。根据肿瘤体积随机化后,如所示,每周一次将抗ox40抗体或同种型对照腹膜内注射到动物中,共三次。图13a比较了增加剂量的445-3抗体和增加剂量的1a7.gr1抗体,以及肿瘤生长的降低。图13b展示所有用特定剂量治疗的小鼠的数据。数据表示为每组6只小鼠的平均肿瘤体积
±
平均值的标准差(sem)。统计学显著性:*:p《0.05相对于同种型对照。
[0071]
图14a-14b是ox40抗体中进行的氨基酸改变的表。
[0072]
图15显示抗ox40抗体和化合物1组合在小鼠结肠(ct26)肿瘤模型中的功效。
[0073]
图16显示抗ox40抗体和化合物1组合在小鼠结肠(mc38)肿瘤模型中的功效。
[0074]
图17展示了化合物1的结晶形式d(化合物1形式d)的x射线粉末衍射(xrpd)图。
[0075]
图18展示了通过elisa表征的抗体1a7.gr1与小鼠ox40的结合。定义
[0076]
除非在本文件的其他地方具体定义,否则本文所用的所有其他技术和科学术语具有本领域的普通技术人员通常理解的含义。
[0077]
如本文所用的,包括所附权利要求,除非上下文另外明确说明,否则例如“一个”、“一种”和“该”的单数形式包括它们相应的复数指代。
[0078]
除非上下文另外明确说明,否则术语“或”意指术语“和/或”并且可与术语“和/或”互换使用。
[0079]
如本文所用的,术语“抗癌剂”是指可用于治疗细胞增殖性障碍(如癌症)的任何药剂,包括但不限于细胞毒性剂、化学治疗剂、放射疗法和放射治疗剂、靶向性抗癌剂、和免疫治疗剂。
[0080]
术语“ox40”是指一种大约50kd的i型跨膜糖蛋白,其是肿瘤坏死因子受体超家族的成员。ox40也称为act35、cd134或tnfrsf4。人ox40的氨基酸序列(seq id no:1)也可在登录号np_003318中找到,并且编码ox40蛋白的核苷酸序列的登录号为:x75962.1。术语“ox40配体”或“ox40l”是指ox40的唯一配体,并且可以与gp34、cd252或tnfsf4互换。
[0081]
本文中的术语“施用(administration/administering)”和“治疗(treating/treatment)”,当应用于动物、人、实验受试者、细胞、组织、器官或生物流体时,意指外源性药物、治疗剂、诊断剂或组合物与该动物、人、受试者、细胞、组织、器官或生物流体接触。细胞的处理涵盖试剂与细胞的接触以及试剂与流体的接触,其中该流体与细胞接触。术语“施用”和“治疗”还意指通过试剂、诊断剂、结合化合物或另一种细胞进行的例如细胞的体外和离体处理。本文中的术语“受试者”包括任何生物,优选动物,更优选哺乳动物(例如,大鼠、小鼠、狗、猫、兔),最优选人。在一方面,治疗任何疾病或障碍是指改善该疾病或障碍(即,减缓或阻止或减少疾病或其至少一种临床症状的发展)。在另一方面,“治疗(treat/
treating/treatment)”是指缓解或改善至少一个身体参数,包括患者可能无法辨别的那些。在又另一方面,“治疗(treat/treating/treatment)”是指在身体上(例如,可辨别症状的稳定化)、在生理上(例如,身体参数的稳定化)或两者上调节疾病或障碍。在又另一方面,“治疗(treat/treating/treatment)”是指预防或延迟疾病或障碍的发作或发展或进展。
[0082]
在本披露的上下文中,术语“受试者”是哺乳动物,例如,灵长类动物,优选高等灵长类动物,例如人(例如,患有本文所述的障碍或处于患有本文所述的障碍的风险的患者)。
[0083]
如本文所用的,术语“亲和力”是指抗体和抗原之间相互作用的强度。在抗原内,抗体“臂(arm)”的可变区通过非共价力与抗原在许多位点相互作用;相互作用越多,亲和力越强。
[0084]
如本文所用的,术语“抗体”是指免疫球蛋白家族的多肽,其可以非共价地、可逆地和以特异性方式结合相应的抗原。例如,天然存在的igg抗体是包含通过二硫键相互连接的至少两条重(h)链和两条轻(l)链的四聚体。每条重链由重链可变区(本文缩写为vh)和重链恒定区构成。重链恒定区由三个结构域ch1、ch2和ch3构成。每条轻链由轻链可变区(本文缩写为vl)和轻链恒定区构成。轻链恒定区由一个结构域cl构成。vh和vl区可以进一步细分为高变区,称为互补决定区(cdr),其间插有更保守的区域,称为框架区(fr)。每个vh和vl由从氨基末端到羧基末端按以下顺序排列的三个cdr和四个fr组成:fr1、cdr1、fr2、cdr2、fr3、cdr3和fr4。重链和轻链的可变区含有与抗原相互作用的结合结构域。抗体的恒定区可以介导免疫球蛋白与宿主组织或因子(包括免疫系统的各种细胞(例如,效应细胞)以及经典补体系统的第一组分(clq))的结合。
[0085]
术语“抗体”包括但不限于单克隆抗体、人抗体、人源化抗体、嵌合抗体和抗独特型(抗id)抗体。抗体可以是任何同种型/类别(例如igg、ige、igm、igd、iga和igy)或亚类(例如igg1、igg2、igg3、igg4、iga1和iga2)。
[0086]
在一些实施例中,这些抗ox40抗体包含至少一个抗原结合位点或至少一个可变区。在一些实施例中,这些抗ox40抗体包含来自本文所述的ox40抗体的抗原结合片段。在一些实施例中,该抗ox40抗体是分离的或重组的。
[0087]
本文中的术语“单克隆抗体”或“mab”或“mab”是指基本上同质的抗体的群体,即,除了可能少量存在的可能天然发生的突变外,该群体中包含的抗体分子在氨基酸序列上是相同的。相比之下,常规(多克隆)抗体制剂典型地包括在其可变结构域中具有不同氨基酸序列的多种不同抗体,特别地其互补决定区(cdr),它们通常对不同的表位具有特异性。修饰语“单克隆”指示获得自基本上均质的抗体群体的抗体的特征并且不应理解为要求通过任何特定方法产生抗体。可以通过本领域技术人员已知的方法获得单克隆抗体(mab)。参见,例如kohler等人,nature[自然]1975 256:495-497;美国专利号4,376,110;ausubel等人,current protocols in molecular biology[分子生物学现代方法]1992;harlow等人,antibodies:alaboratory manual[抗体:实验室手册],cold spring harbor laboratory[冷泉港实验室]1988;以及colligan等人,current protocols in immunology[当代免疫学方案]1993。本文披露的抗体可以是任何免疫球蛋白类别(包括igg、igm、igd、ige、iga),及其任何亚类(例如igg1、igg2、igg3、igg4)。产生单克隆抗体的杂交瘤可以在体外或在体内培养。高效价的单克隆抗体可以在体内产生中获得,其中将来自单个杂交瘤的细胞腹膜内注射到小鼠中,例如原始引发的balb/c小鼠,以产生含有高浓度所需抗体的腹水。可以使
用本领域技术人员熟知的柱层析方法从这样的腹水,或从培养上清液中纯化同种型igm或igg的单克隆抗体。
[0088]
通常,基本抗体结构单元包含四聚体。每个四聚体包括两对相同的多肽链,每对具有一条“轻链”(约25kda)和一条“重链”(约50-70kda)。每条链的氨基末端部分包括主要负责抗原识别的约100至110或更多个氨基酸的可变区。重链的羧基末端部分可以定义为主要负责效应子功能的恒定区。典型地,人轻链被分类为κ和λ轻链。此外,人重链典型地分类为α、δ、ε、γ或μ,并且分别将抗体的同种型定义为iga、igd、ige、igg和igm。在轻链和重链内,可变区和恒定区通过约12个或更多个氨基酸的“j”区连接,重链还包括约10个以上氨基酸的“d”区。
[0089]
每个轻链/重链(vl/vh)对的可变区形成抗体结合位点。因此,一般而言,完整抗体具有两个结合位点。除了双功能或双特异性抗体外,一般而言两个结合位点是相同的。
[0090]
典型地,重链和轻链的可变结构域包含三个高变区,也称为“互补决定区(cdr)”,其位于相对保守的框架区(fr)之间。cdr通常由框架区对齐,使得能够结合特异性表位。一般而言,从n-末端到c-末端,轻链和重链可变结构域两者都包含fr-1(或fr1)、cdr-1(或cdr1)、fr-2(fr2)、cdr-2(cdr2)、fr-3(或fr3)、cdr-3(cdr3)和fr-4(或fr4)。cdr和框架区的位置可以使用本领域熟知的多种定义确定,例如卡巴特(kabat)、乔西亚(chothia)和abm(参见,例如johnson等人,nucleic acids res.[核酸研究],29:205-206(2001);chothia和lesk,j.mol.biol.[分子生物学杂志],196:901-917(1987);chothia等人,nature[自然],342:877-883(1989);chothia等人,j.mol.biol.[分子生物学杂志],227:799-817(1992);al-lazikani等人,j.mol.biol.[分子生物学杂志],273:927-748(1997))。抗原结合位点的定义还在以下文献中描述:ruiz等人,nucleic acids res.[核酸研究],28:219-221(2000);和lefranc,m.p.,nucleic acids res.[核酸研究],29:207-209(2001);maccallum等人,j.mol.biol.[分子生物学杂志],262:732-745(1996);和martin等人,proc.natl.acad.sci.usa[美国国家科学院院刊],86:9268-9272(1989);martin等人,methods enzymol.[酶学方法],203:121-153(1991);和rees等人,在sternberg m.j.e.(编),protein structure prediction[蛋白质结构预测],oxford university press[牛津大学出版社],牛津,141-172(1996)中。在组合的卡巴特和乔西亚编号方案中,在一些实施例中,cdr对应于为kabat cdr、chothia cdr或两者的一部分的氨基酸残基。例如,cdr对应于vh(例如,哺乳动物vh,例如人vh)中的氨基酸残基26-35(hc cdr1)、50-65(hc cdr2)和95-102(hc cdr3);和vl(例如,哺乳动物vl,例如人vl)中的氨基酸残基24-34(lc cdr1)、50-56(lc cdr2)和89-97(lc cdr3)。
[0091]
术语“高变区”是指抗体中负责抗原结合的氨基酸残基。高变区包含来自“cdr”(即,轻链可变结构域中的vl-cdr1、vl-cdr2和vl-cdr3以及重链可变结构域中的vh-cdr1、vh-cdr2和vh-cdr3)的氨基酸残基。参见,kabat等人(1991)sequences of proteins of immunological interest[免疫学上感兴趣的蛋白质序列],第5版public health service[公共卫生署],national institutes of health[国立卫生研究院],贝塞斯达,马里兰州(通过序列定义抗体的cdr区);还参见chothia和lesk(1987)j.mol.biol.[分子生物学杂志]196:901-917(通过结构定义抗体的cdr区)。术语“框架”或“fr”残基意指除了本文定义为cdr残基的高变区残基之外的那些可变结构域残基。
[0092]
除非另外说明,否则“抗原结合片段”是指抗体的抗原结合片段,即保留与全长抗体结合的抗原特异性结合的能力的抗体片段,例如保留一个或多个cdr区的片段。抗原结合片段的实例包括但不限于fab、fab'、f(ab')2和fv片段;双抗体;线性抗体;单链抗体分子(例如,单链fv(scfv));纳米抗体以及从抗体片段形成的多特异性抗体。
[0093]
抗体“特异性结合”靶蛋白,是指与其他蛋白相比,抗体表现出优先结合靶标,但这种特异性不需要绝对的结合特异性。如果抗体的结合决定了样品中靶蛋白的存在,例如,没有产生不希望的结果,如假阳性,则抗体被认为是对其预期靶标为“特异性的”。可用于本披露的抗体或其抗原结合片段会以比非靶蛋白的亲和力高至少2倍,优选高至少10倍,更优选高至少20倍,和最优选高至少100倍的亲和力结合至靶蛋白。将本文的抗体称作与包含给定氨基酸序列(例如人ox40分子的氨基酸序列)的多肽特异性结合,如果其与包含该序列的多肽结合但不与缺乏该序列的蛋白质结合。
[0094]
本文中的术语“人抗体”意指仅包含人免疫球蛋白蛋白质序列的抗体。如果在小鼠、小鼠细胞或源自小鼠细胞的杂交瘤中产生,人抗体可以含有鼠碳水化合物链。类似地,“小鼠抗体”或“大鼠抗体”意指分别仅包含小鼠或大鼠免疫球蛋白蛋白质序列的抗体。
[0095]
术语“人源化抗体”意指含有来自非人(例如鼠)抗体以及人抗体的序列的抗体形式。此类抗体含有源自非人免疫球蛋白的最小序列。通常,人源化抗体将包含基本上至少一个、并且典型地两个可变结构域的全部,其高变环的全部或基本上全部对应于非人免疫球蛋白的那些,并且fr的全部或基本上全部是人免疫球蛋白序列的那些。人源化抗体还将任选地包含免疫球蛋白恒定区(fc)的至少一部分,典型地是人免疫球蛋白的至少一部分。当有必要区分人源化抗体与亲本啮齿动物抗体时,将前缀“hum”、“hu”、“hu”或“h”添加到抗体克隆名称中。人源化形式的啮齿动物抗体会通常包含亲本啮齿动物抗体的相同cdr序列,但是可包括某些氨基酸取代以增加亲和力,增加人源化抗体的稳定性,除去翻译后修饰或出于其他原因。
[0096]
如本文所用的,术语“非竞争性”意指抗体结合发生并且不干扰配体与受体的结合。
[0097]
术语“相应的人种系序列”是指编码人可变区氨基酸序列或亚序列的核酸序列,与由人种系免疫球蛋白可变区序列编码的所有其他已知可变区氨基酸序列相比,其与参考可变区氨基酸序列或亚序列具有最高确定的氨基酸序列同一性。相应的人种系序列也可以指与所有其他评估的可变区氨基酸序列相比,与参考可变区氨基酸序列或亚序列具有最高氨基酸序列同一性的人可变区氨基酸序列或亚序列。相应的人种系序列可以仅是框架区,仅互补决定区,框架和互补决定区,可变区段(如上定义),或包含可变区的序列或亚序列的其他组合。可以使用本文所述的方法确定序列同一性,例如使用blast、align或本领域已知的另一种比对算法比对两个序列。相应的人种系核酸或氨基酸序列可以与参考可变区核酸或氨基酸序列具有至少约90%、91、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性。
[0098]
术语“平衡解离常数(kd,m)”是指解离速率常数(kd,时间-1
)除以缔合速率常数(ka,时间-1
,m-l
)。平衡解离常数可以使用本领域任何已知的方法测量。本披露的抗体通常具有小于约10-7
或10-8
m,例如小于约10-9
m或10-10
m,在一些方面,小于约10-11
m、10-12
m或10-13
m的平衡解离常数。
[0099]
本文中的术语“癌症”或“肿瘤”具有如本领域理解的最广泛的含义,并且是指哺乳动物中典型地以不受调控的细胞生长为特征的生理病症。在本披露的上下文中,癌症不限于某个类型或位置。
[0100]
术语“组合疗法”是指施用两种或更多种治疗剂以治疗本披露中所述的治疗病症或障碍。这种施用涵盖以基本上同时的方式共同施用这些治疗剂。这种施用也涵盖在多个容器中或在每种活性成分的独立容器(例如,胶囊、粉末和液体)中共同施用。可以将粉末和/或液体在施用之前重构或稀释到所需剂量。此外,这种施用也涵盖在大致相同的时间或在不同的时间以顺序方式使用每种类型的治疗剂。在任何一种情况下,治疗方案将在治疗本文所述的病症或障碍方面提供药物组合的有益作用。
[0101]
在本发明的上下文中,当提及氨基酸序列时,术语“保守取代”意指用新氨基酸取代原始氨基酸,该新氨基酸基本上不改变抗体或片段的化学、物理和/或功能性质,例如其与ox40的结合亲和力。特别地,氨基酸的常见保守取代如下表所示并且是本领域熟知的。示例性保守氨基酸取代示例性保守氨基酸取代
[0102]
适用于确定序列同一性百分比和序列相似性的算法的实例是blast算法,这些算法分别描述于altschul等人,nuc.acids res.[核酸研究]25:3389-3402,1977;和altschul等人,j.mol.biol.[分子生物学杂志]215:403-410,1990中。用于进行blast分析的软件可通过国家生物技术信息中心(national center for biotechnology information)披露获得。此算法包括首先通过鉴定查询序列中短字长w鉴定高得分序列对(hsp),当与数据库序列中相同字长比对时,其匹配或满足一些正值阈值得分t。t被称为邻域字得分阈值。这些初
始邻域字命中作为开始搜索以找到包含它们的较长hsp的值。字命中沿着每个序列在两个方向上延伸,直到累积比对得分可以增加为止。对于核苷酸序列,使用参数m(一对匹配残基的奖励得分;始终》0)和n(错配残基的罚分;始终《0)来计算累积得分。对于氨基酸序列,使用得分矩阵来计算累积得分。在以下情况下,将停止字命中在每个方向上的延伸:累积比对得分从其最大实现值下降了数量x;由于一个或多个负得分残基比对的累积,累积得分趋于零或更低;或者到达任一序列的末端。blast算法参数w、t和x决定了比对的灵敏度和速度。blastn程序(对于核苷酸序列)默认使用字长(w)11,期望值(e)10,m=5,n=-4并比较两条链。对于氨基酸序列,blast程序默认使用字长3,期望值(e)10和blosum62得分矩阵(参见henikoff和henikoff,(1989)proc.natl.acad.sci.usa[美国国家科学院学报]89:10915)比对(b)50,期望值(e)10,m=5,n=-4并比较两条链。
[0103]
blast算法还对两个序列之间的相似性进行统计分析(参见例如karlin和altschul,proc.natl.acad.sci.usa[美国国家科学院学报]90:5873-5787,1993)。blast算法提供的一种相似性度量是最小总和概率(p(n)),其提供了两个核苷酸或氨基酸序列之间偶然发生匹配的概率的指示。例如,如果测试核酸与参考核酸的比较中最小总和概率小于约0.2,更优选小于约0.01,最优选小于约0.001,则认为该核酸与参考序列相似。
[0104]
两个氨基酸序列之间的同一性百分比还可使用以下的算法来确定:e.meyers和w.miller,comput.appl.biosci.[生物科学中的计算机应用]4:11-17,(1988),其已并入align程序(2.0版本),使用pam120权重残基表,空位长度罚分为12,空位罚分为4。此外,可以使用以下确定两个氨基酸序列之间的同一性百分比:needleman和wunsch,j.mol.biol.[分子生物学杂志]48:444-453(1970)的算法,其已并入gcg软件包中的gap程序中,使用blosum62矩阵或pam250矩阵,空位权重为16、14、12、10、8、6或4,并且长度权重为1、2、3、4、5或6。
[0105]
术语“核酸”在本文中可与术语“多核苷酸”互换使用,并且是指单链或双链形式的脱氧核糖核苷酸或核糖核苷酸及其聚合物。该术语涵盖含有已知的核苷酸类似物或经修饰的主链残基或连接的核酸,它们是合成的,天然存在的和非天然存在的,具有与参考核酸相似的结合特性,并且以与参考核苷酸相似的方式代谢。此类类似物的实例包括但不限于硫代磷酸酯、氨基磷酸酯、甲基膦酸酯、手性甲基膦酸酯、2-o-甲基核糖核苷酸、肽-核酸(pna)。
[0106]
在核酸的上下文中,术语“可操作地连接”是指两个或更多个多核苷酸(例如dna)区段之间的功能关系。典型地,它是指转录调节序列与转录序列的功能关系。例如,启动子或增强子序列如果在合适的宿主细胞或其他表达系统中刺激或调节编码序列的转录,则可操作地连接至编码序列。通常,可操作地连接至转录序列的启动子转录调节序列与转录序列在物理上邻接,即它们是顺式作用的。然而,一些转录调节序列(如增强子)不需要在物理上邻接或紧邻它们增强其转录的编码序列。
[0107]
在一些方面,本披露提供了组合物,例如药学上可接受的组合物,其包含与至少一种药学上可接受的赋形剂一起配制的本文所述的抗ox40抗体。如本文所用的,术语“药学上可接受的赋形剂”包括生理学上相容的任何和所有溶剂、分散介质、等渗剂和吸收延迟剂等。赋形剂可适于静脉内、肌内、皮下、肠胃外、直肠、脊柱或表皮施用(例如通过注射或输注)。
[0108]
本文披露的组合物可以是多种形式。这些包括例如液体、半固体和固体剂型,如液体溶液(例如可注射和输注溶液)、分散液或悬浮液、脂质体和栓剂。合适的形式取决于预期的施用方式和治疗应用。典型的合适组合物是可注射或输注溶液的形式。一种合适的施用方式是肠胃外(例如静脉内、皮下、腹膜内、肌内)。在一些实施例中,该抗体通过静脉内输注或注射来施用。在某些实施例中,该抗体通过肌内或皮下注射来施用。
[0109]
如本文所用的,术语“治疗有效量”是指当施用于受试者以治疗疾病、或疾病或障碍的至少一种临床症状时,足以影响该疾病、障碍或症状的治疗的抗体的量。“治疗有效量”可以随抗体,疾病,障碍,和/或疾病或障碍的症状,疾病、障碍、和/或疾病或障碍的症状的严重程度,待治疗的受试者的年龄,和/或待治疗的受试者的体重而变化。在任何给定情况下的合适量对于本领域技术人员而言是显而易见的,或者可以通过常规实验确定。在组合疗法的情况下,“治疗有效量”是指用于有效治疗疾病、障碍或病症的组合对象的总量。
[0110]
如本文所用的,短语“与
…
组合”意指将抗ox40抗体在施用多重激酶抑制剂的同时、就在该施用前或就在该施用后施用于受试者。在某些实施例中,多重激酶抑制剂作为与抗ox40抗体的共同配制品施用。
[0111]
如本文所用的,“多重酪氨酸激酶相关的癌症”是指其中至少一种酪氨酸激酶高度表达或具有组成型活性的癌症。此类酪氨酸激酶的实例包括但不限于vegf受体激酶(flt或flt1)和hgf/sf受体激酶。
具体实施方式
[0112]
本披露提供了特异性结合人ox40的抗体、抗原结合片段。此外,本披露提供了具有所需的药代动力学特征和其他期望的属性的抗体,并且因此可用于降低癌症的可能性或治疗癌症。本披露进一步提供了包含抗体的药物组合物以及制备和使用此类药物组合物用于预防和治疗癌症和相关障碍的方法。抗ox40抗体
[0113]
本披露提供了特异性结合ox40的抗体或其抗原结合片段。本披露的抗体或抗原结合片段包括但不限于如下所述产生的抗体或其抗原结合片段。
[0114]
本披露提供了特异性结合ox40的抗体或抗原结合片段,其中所述抗体或抗体片段(例如,抗原结合片段)包含具有seq id no:14、20或26的氨基酸序列(表3)的vh结构域。本披露还提供了特异性结合ox40的抗体或抗原结合片段,其中所述抗体或抗原结合片段包含具有表3中列出的vh cdr中的任一个的氨基酸序列的vh cdr。在一方面,本披露提供了特异性结合ox40的抗体或抗原结合片段,其中所述抗体包含(或可替代地,由以下组成:)具有表3中列出的vh cdr中的任一个的氨基酸序列的一个、两个、三个或更多个vh cdr。
[0115]
本披露提供了特异性结合ox40的抗体或抗原结合片段,其中所述抗体或抗原结合片段包含具有seq id no:16、22或28的氨基酸序列(表3)的vl结构域。本披露还提供了特异性结合ox40的抗体或抗原结合片段,其中所述抗体或抗原结合片段包含具有表3中列出的vl cdr中的任一个的氨基酸序列的vl cdr。特别地,本披露提供了特异性结合ox40的抗体或抗原结合片段,所述抗体或抗原结合片段包含(或可替代地,由以下组成:)具有表3中列出的vl cdr中的任一个的氨基酸序列的一个、两个、三个或更多个vl cdr。
[0116]
本披露的其他抗体或其抗原结合片段包括已经突变,但在cdr区中与表3中所述的
序列中描绘的cdr区具有至少60%、70%、80%、90%、95%或99%百分比同一性的氨基酸。在一些方面,其包括突变体氨基酸序列,其中当与表3中所述的序列中描绘的cdr区相比时,在cdr区中突变不超过1、2、3、4或5个氨基酸。
[0117]
本披露的其他抗体包括如下那些抗体,其中氨基酸或编码这些氨基酸的核酸已经突变;但与表3所述的序列具有至少60%、70%、80%、90%、95%或99%百分比同一性。在一些方面,其包括突变体氨基酸序列,其中与表3中所述的序列中描绘的可变区相比,在可变区中突变不超过1、2、3、4或5个氨基酸,同时保持基本上相同的治疗活性。
[0118]
本披露还提供了编码与ox40特异性结合的抗体的vh、vl、全长重链和全长轻链的核酸序列。可以优化此类核酸序列以在哺乳动物细胞中表达。表位和结合相同表位的抗体的鉴定
[0119]
本披露提供了与人ox40的表位结合的抗体及其抗原结合片段。在某些方面,该抗体和抗原结合片段可以与ox40的相同表位结合。
[0120]
本披露还提供了结合与表3中所述的抗ox40抗体相同的表位的抗体及其抗原结合片段。因此,其他抗体及其抗原结合片段可以基于它们在结合测定中与其他抗体交叉竞争(例如,以统计学显著的方式竞争性抑制其结合)的能力来鉴定。测试抗体抑制本披露的抗体及其抗原结合片段与ox40结合的能力证明测试抗体可与该抗体或其抗原结合片段竞争结合ox40。不受任一种理论的束缚,这种抗体可以与其竞争的抗体或其抗原结合片段结合ox40上的相同或相关(例如,在结构上相似或在空间上邻近)表位。在某些方面,与本披露的抗体或其抗原结合片段结合ox40上的相同表位的抗体是人或人源化单克隆抗体。这种人或人源化单克隆抗体可以如本文所述制备和分离。对fc区框架的进一步改变
[0121]
在其他方面,通过用不同的氨基酸残基替代至少一个氨基酸残基来改变fc区,以改变抗体的效应子功能。例如,可以用不同的氨基酸残基替代一个或多个氨基酸,使得抗体对效应配体具有改变的亲和力,但保留亲本抗体的抗原结合能力。亲和力改变的效应子配体可以是例如fc受体或补体的c1组分。此方法描述于例如winter等人的美国专利号5,624,821和5,648,260中。
[0122]
在另一方面,可以用一个或多个不同的氨基酸残基替代一个或多个氨基酸残基,使得抗体具有改变的c1q结合和/或降低的或消除的补体依赖性细胞毒性(cdc)。此方法描述于例如idusogie等人的美国专利号6,194,551中。
[0123]
在又另一方面,改变一个或多个氨基酸残基从而改变抗体固定补体的能力。该方法描述于例如bodmer等人的pct公开wo 94/29351中。在特定的方面,本披露的抗体或其抗原结合片段的一个或多个氨基酸被igg1亚类和κ同种型的一个或多个同种异型氨基酸残基替代。同种异型氨基酸残基还包括但不限于igg1、igg2和igg3亚类的重链恒定区以及κ同种型的轻链恒定区,如jefferis等人,mabs[单克隆抗体].1:332-338(2009)所述。
[0124]
在另一方面,通过修饰一个或多个氨基酸来修饰fc区以增加抗体介导抗体依赖性细胞毒性(adcc)的能力和/或增加抗体对fcγ受体的亲和力。此方法描述于例如presta的pct公开wo 00/42072中。此外,已经绘制了在人igg1上与fcγri、fcγrii、fcγriii和fcrn的结合位点,并且已经描述了具有改善的结合的变体(参见shields等人,j.biol.chem.[生物化学杂志]276:6591-6604,2001)。
[0125]
在仍另一方面,抗体的糖基化被修饰。例如,可以制备无糖基化抗体(即,抗体缺乏或具有降低的糖基化)。例如,可以改变糖基化以增加抗体对“抗原”的亲和力。这种碳水化合物修饰可以通过例如改变抗体序列内的一个或多个糖基化位点来实现。例如,可以进行一个或多个氨基酸取代,其导致消除一个或多个可变区框架糖基化位点,从而消除该位点的糖基化。这种无糖基化可以增加抗体对抗原的亲和力。这种方法描述于例如co等人的美国专利号5,714,350和6,350,861中。
[0126]
另外地或可替代地,可以制备具有改变的糖基化类型的抗体,如具有减少量的岩藻糖基残基的低岩藻糖基化抗体或具有增加的二等分glcnac结构的抗体。已经证明此类改变的糖基化模式增加抗体的adcc能力。可以通过例如在具有改变的糖基化机构的宿主细胞中表达抗体完成此类糖类修饰。在本领域中已经说明了具有改变的糖基化机构的细胞,并且这些细胞可以用作宿主细胞,在这些宿主细胞中表达重组抗体从而由此产生具有改变的糖基化的抗体。例如,hang等人的ep 1,176,195描述了具有功能破坏的fut8基因的细胞系,该基因编码岩藻糖基转移酶,使得在这种细胞系中表达的抗体显示出低岩藻糖基化。presta的pct公开wo 03/035835描述了变体cho细胞系、lecl3细胞,其具有降低的将岩藻糖连接至asn(297)-连接的碳水化合物的能力,也导致在该宿主细胞中表达的抗体的低岩藻糖基化(也参见shields等人,(2002)j.biol.chem.[生物化学杂志]277:26733-26740)。umana等人的pct公开wo 99/54342描述了被工程化以表达糖蛋白修饰的糖基转移酶(例如,β(1,4)-n乙酰氨基葡萄糖转移酶iii(gntiii))的细胞系,使得在工程化的细胞系中表达的抗体表现出增加的二等分glcnac结构,这导致抗体的adcc活性增加(还参见umana等人,nat.biotech.[自然生物技术]17:176-180,1999)。
[0127]
在另一方面,如果所需的adcc降低,许多先前的报道显示人抗体亚类igg4仅具有适度的adcc并且几乎没有cdc效应子功能(moore g l等人,2010mabs[单克隆抗体],2:181-189)。另一方面,发现天然igg4在应激条件下(如在酸性缓冲剂中或在升高的温度下)较不稳定(angal,s.1993mol immunol[分子免疫学],30:105-108;dall'acqua,w.等人,1998biochemistry[生物化学],37:9266-9273;aalberse等人,2002immunol[免疫学],105:9-19)。降低的adcc可以通过将抗体可操作地连接至用具有降低或无效的fcγr结合或c1q结合活性的改变的组合工程化的igg4,从而降低或消除adcc和cdc效应子功能来实现。考虑到抗体作为生物药物的物理化学性质,igg4的较不需要的固有特性之一是其两条重链在溶液中动态分离以形成半抗体,这导致通过称为“fab臂交换”的过程在体内产生双特异性抗体(van der neut kolfschoten m等人,2007science[科学],317:1554-157)。228位(eu编号系统)丝氨酸突变为脯氨酸表现出对igg4重链分离的抑制作用(angal,s.1993mol immunol[分子免疫学],30:105-108;aalberse等人,2002immunol[免疫学],105:9-19)。据报道,铰链区和γfc区中的一些氨基酸残基对抗体与fcγ受体的相互作用具有影响(chappel s m等人,1991proc.natl.acad.sci.usa[美国国家科学院学报],88:9036-9040;mukherjee,j.等人,1995faseb j[美国实验生物学学会联合会杂志],9:115-119;armour,k.l.等人,1999eur j immunol[欧洲免疫学杂志],29:2613-2624;clynes,r.a.等人,2000nature medicine[自然医学],6:443-446;arnold j.n.,2007annu rev immunol[免疫学年鉴],25:21-50)。此外,在人群中一些罕见的igg4同种型也可引起不同的物理化学特性(brusco,a.等人,1998eur j immunogenet[欧洲免疫遗传学杂志],25:349-55;aalberse等
人,2002immunol[免疫学],105:9-19)。为了产生具有低adcc、cdc和不稳定性的ox40抗体,可以修饰人igg4的铰链区和fc区并引入许多改变。这些经修饰的igg4 fc分子可在seq id no:83-88,li等人的美国专利号8,735,553中找到。ox40抗体生产
[0128]
抗ox40抗体和其抗原结合片段可通过本领域已知的任何方法产生,包括但不限于抗体四聚体的重组表达、化学合成和酶消化,而全长单克隆抗体可通过例如杂交瘤或重组产生获得。重组表达可以来自本领域已知的任何合适的宿主细胞,例如哺乳动物宿主细胞、细菌宿主细胞、酵母宿主细胞、昆虫宿主细胞等。
[0129]
本披露还提供了编码本文所述抗体的多核苷酸,例如编码包含本文所述的互补决定区的重链或轻链可变区或区段的多核苷酸。在一些方面,编码重链可变区的多核苷酸与选自由seq id no:15、21或27组成的组的多核苷酸具有至少85%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%核酸序列同一性。在一些方面,编码轻链可变区的多核苷酸与选自由seq id no:17、23或29组成的组的多核苷酸具有至少85%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%核酸序列同一性。
[0130]
本披露的多核苷酸可以编码抗ox40抗体的可变区序列。它们还可以编码抗体的可变区和恒定区。一些多核苷酸序列编码包含示例性抗ox40抗体之一的重链和轻链的可变区的多肽。一些其他多核苷酸编码分别与一种鼠抗体的重链和轻链的可变区基本上相同的两个多肽区段。
[0131]
本披露还提供了用于产生抗ox40抗体的表达载体和宿主细胞。表达载体的选择取决于表达载体的预期宿主细胞。典型地,表达载体含有可操作地连接至编码抗ox40抗体链或抗原结合片段的多核苷酸的启动子和其他调节序列(例如增强子)。在一些方面,除了在诱导条件的控制下,使用诱导型启动子来防止插入序列的表达。诱导型启动子包括例如阿拉伯糖、lacz、金属硫蛋白启动子或热激启动子。可以在非诱导条件下、而不在偏向宿主细胞更好耐受其表达产物的编码序列的群体的情况下扩大经转化的生物体的培养。除启动子外,其他调节元件也可以是有效表达抗ox40抗体或抗原结合片段所需要或期望的。这些元件典型地包括atg起始密码子和相邻的核糖体结合位点或其他序列。此外,通过包含适合于使用中的细胞系统的增强子,可以提高表达效率(参见,例如,scharf等人,results probl.cell differ.[细胞分化中的结果和问题]20:125,1994;和bittner等人,meth.enzymol.[酶学方法],153:516,1987)。例如,sv40增强子或cmv增强子可以用来增加哺乳动物宿主细胞中的表达。
[0132]
用于携带并表达抗ox40抗体链的宿主细胞可以是原核或真核的。大肠杆菌是一种可用于克隆和表达本披露多核苷酸的原核宿主。其他适用的微生物宿主包括杆菌,如枯草芽孢杆菌(bacillus subtilis),和其他肠杆菌科(enterobacteriaceae),如沙门氏菌属(salmonella)、沙雷氏菌属(serratia)和各种假单胞菌属(pseudomonas)物种。在这些原核宿主中,还可以制备表达载体,其典型地含有与宿主细胞相容的表达控制序列(例如复制起点)。此外,将存在任何数量的多种熟知的启动子,如乳糖启动子系统、色氨酸(trp)启动子系统、β-内酰胺酶启动子系统或来自噬菌体λ的启动子系统。启动子典型地任选地用操纵子序列控制表达,并具有核糖体结合位点序列等,用于启动和完成转录和翻译。其他微生物如酵母也可用于表达抗ox40多肽。也可以使用昆虫细胞与杆状病毒载体的组合。
[0133]
在其他方面,哺乳动物宿主细胞用于表达和产生本披露的抗ox40多肽。例如,它们可以是表达内源性免疫球蛋白基因的杂交瘤细胞系或携带外源性表达载体的哺乳动物细胞系。这些包括任何正常的必死或正常或异常的永生的动物或人细胞。例如,已经开发了许多能够分泌完整免疫球蛋白的合适宿主细胞系,包括cho细胞系、各种cos细胞系、hek293细胞、骨髓瘤细胞系、转化的b细胞和杂交瘤。使用哺乳动物组织细胞培养物来表达多肽一般在例如winnacker,from genes to clones[从基因到克隆],vch出版社,ny,n.y.,1987中讨论。用于哺乳动物宿主细胞的表达载体可以包括表达控制序列,如复制起点、启动子和增强子(参见例如queen等人,immunol.rev.[免疫学综述]89:49-68,1986)和必要的加工信息位点,如核糖体结合位点、rna剪接位点、聚腺苷酸化位点和转录终止子序列。这些表达载体通常含有衍生自哺乳动物基因或哺乳动物病毒的启动子。合适的启动子可以是组成型的、细胞类型特异性的、阶段特异性的、和/或可调控的或可调节的。有用的启动子包括但不限于金属硫蛋白启动子、组成型腺病毒主要晚期启动子、地塞米松诱导型mmtv启动子、sv40启动子、mrp poliii启动子、组成型mpsv启动子、四环素诱导型cmv启动子(如人立即早期cmv启动子)。化合物1的制备
[0004]
步骤1:n-((6-溴吡啶-3-基)甲基)-2-甲氧基乙-1-胺(化合物1a)
[0079]
在25℃
±
5℃下在氮气气氛下,向2-甲氧基乙胺(3.0当量)在二氯甲烷(dcm)(12体积)中的搅拌溶液中添加分子筛(0.3w/w)并搅拌2小时。通过卡尔-费歇尔(karl fischer)分析监测反应物质含水量直到含水量限度达到0.5%w/w。一旦达到含水量限度,将反应物质冷却至5℃
±
5℃,并在5℃
±
5℃下在30分钟内将6-溴烟醛(1.0当量)多次添加至上述反应物质中。在5℃
±
5℃下,将反应物质搅拌30
±
5分钟,并在5℃
±
5℃下逐滴添加乙酸(1.05当量)。添加完成后,将物质缓慢温热至25℃
±
5℃并搅拌8h以得到化合物1a。通过hplc来监测亚胺形成。
[0080]
步骤2:叔丁基((6-溴吡啶-3-基)甲基)(2-甲氧基乙基)氨基甲酸酯(化合物1b)
[0081]
添加thf(5.0体积)中加入的化合物1a(1.0当量)并在25℃
±
5℃下在氮气气氛下将反应物质搅拌30分钟。将反应物质冷却至约10℃
±
5℃的温度。在10℃
±
5℃下在氮气气氛下,将二碳酸二叔丁酯(1.2当量)添加至反应物质中并将反应物质温度升高至25℃
±
5℃并反应物质约2小时。通过hplc监测反应的进程。ipc完成后,加入制备的牛磺酸(1.5当量)在2m naoh水溶液(3.1体积)中的溶液并在10℃
±
5℃下搅拌16h至18h。将反应物质用1m naoh水溶液(3.7体积)进一步稀释并分离各层。将水层用dcm(2x4.7体积)萃取,并且将萃取物与有机层合并。将合并的有机层用1m naoh水溶液(3.94体积)洗涤,随后用水(2x4.4体
积)洗涤,并且经硫酸钠(2.0w/w)干燥。将滤液在低于40℃减压下浓缩直到不能观察到馏出物。顺序添加四氢呋喃(thf)(1x4体积和1x6体积),并在低于40℃的减压下浓缩,直到不能观察到馏出物,以获得呈浅黄色浆状液体的化合物1b。
[0082]
步骤3:叔丁基((6-(7-氯噻吩并[3,2-b]吡啶-2-基)吡啶-3-基)甲基)(2-甲氧基乙基)氨基甲酸酯(化合物1c)
[0083]
在-15℃
±
10℃下,向7-氯噻吩并[3,2-b]吡啶(1.05当量)在四氢呋喃(7体积)中的搅拌溶液中逐滴添加正丁基锂(2.5m在己烷中),并在相同温度下在氮气气氛下搅拌90分钟。在-15℃
±
10℃下,将氯化锌(1.05当量)添加至反应物质中。将反应物质缓慢温热至25℃
±
5℃并且在氮气气氛下搅拌45分钟以得到化合物1c。通过hplc监测反应的进程。
[0084]
步骤4:叔丁基((6-(7-(4-氨基-2-氟苯氧基)噻吩并[3,2-b]吡啶-2-基)吡啶-3-基)甲基)(2-甲氧基乙基)氨基甲酸酯(化合物1d)
[0085]
在25℃
±
5℃下在氮气气氛下,加入在dmso(3.9体积)中的3-氟-4-羟基苯胺鎓氯化物(1.2当量)并在25℃
±
5℃下将反应物质搅拌直到观察到澄清溶液。在氮气气氛下在25℃
±
10℃下,多次添加t-buok。将反应物质温度升高至45℃
±
5℃并在氮气气氛下维持30分钟。在氮气气氛下在45℃
±
5℃下,将化合物1c多次加入并在45℃
±
5℃下搅拌10分钟。将反应混合物加热至100℃
±
5℃并搅拌2小时。通过hplc监测反应物质。
[0086]
反应完成后,将反应物质冷却至10℃
±
5℃并在10℃
±
5℃下用冷水(20体积)淬灭。将物质温度升高至25℃
±
5℃并搅拌7-8h。将所得化合物1d粗品通过过滤收集并用2体积的水洗涤。将粗化合物1d材料放入水(10体积)中并在25℃
±
5℃下搅拌长达20分钟。将反应物质加热至45℃
±
5℃并在45℃
±
5℃下搅拌2-3h,过滤并真空干燥。
[0087]
在25℃
±
5℃下,将粗化合物1d放入mtbe(5体积)中并且在25℃
±
5℃下搅拌约20分钟。将反应物质温度升高至45℃
±
5℃,在45℃
±
5℃下搅拌3-4h并且然后冷却至20℃
±
5℃。在20℃
±
5℃下,将反应物质搅拌约20分钟,过滤,随后用水(0.5体积)进行床洗涤(bed wash)并真空干燥。
[0088]
在25℃
±
5℃下,将粗材料溶解于丙酮(10体积)并在25℃
±
5℃下搅拌约2h。将反应物质通过硅藻土床过滤并用丙酮(2.5体积)洗涤。在25℃
±
5℃下,将滤液用水(15体积)缓慢稀释。将反应物质在25℃
±
5℃下搅拌2-3h,过滤并用水(2体积)进行床洗涤,并真空干燥以得到呈棕色固体的化合物1d。
[0089]
步骤5:1-((4-((2-(5-(((叔丁氧基羰基)(2-甲氧基乙基)氨基)甲基)吡啶-2-基)噻吩并[3,2-b]吡啶-7-基)氧基)-3-氟苯基)氨基甲酰)环丙烷-1-甲酸(化合物1e)
[0090]
向化合物1d(1.0当量)在四氢呋喃(7体积)中的溶液中添加在水(8体积)中的碳酸钾水溶液(1.0当量)。将溶液冷却至5℃
±
5℃并搅拌约60min。搅拌的同时,单独将三乙胺(2.0当量)添加至1,1-环丙烷二甲酸(2.0当量)在四氢呋喃(8体积)中的溶液中(在5℃
±
5℃下),随后添加亚硫酰氯(2.0当量)并搅拌约60min。在5℃
±
5℃下,将酰氯物质缓慢添加至化合物1d溶液中。将温度升高至25℃
±
5℃并搅拌3.0h。通过hplc分析监测反应。
[0091]
反应完成后,将物质用乙酸乙酯(5.8体积)、水(5.1体积)、10%(w/w)盐酸水溶液(0.8体积)和25%(w/w)氯化钠水溶液(2体积)稀释。将水层分离并用乙酸乙酯萃取(2x5体积)。将合并的有机层用0.5m碳酸氢钠水溶液(7.5体积)洗涤。在25℃
±
5℃下,将有机层用darco活性炭(0.5w/w)和硫酸钠(0.3w/w)处理1.0h。将有机层通过硅藻土过滤并用四氢呋喃(5.0体积)洗涤。将滤液在低于50℃的真空下浓缩至约3体积并与乙酸乙酯(2x5体积)在低于50℃的真空下共蒸馏高达约3.0体积。将有机层冷却至15℃
±
5℃,搅拌约60min,过滤并将固体用乙酸乙酯(2.0体积)洗涤。将材料在40℃
±
5℃下在真空下干燥直到含水量低于1%以得到呈棕色固体的化合物1e。
[0092]
步骤6:叔丁基((6-(7-(2-氟-4-(1-((4-氟苯基)氨基甲酰)环丙烷-1-甲酰胺基)苯氧基)噻吩并[3,2-b]吡啶-2-基)吡啶-3-基)甲基)(2-甲氧基乙基)氨基甲酸酯(化合物1f)
[0093]
将吡啶(1.1当量)添加至化合物1e(1.0当量)在四氢呋喃(10体积)中的悬浮液中并冷却至5℃
±
5℃。添加亚硫酰氯(2.0当量)并搅拌约60min。在甲醇中淬灭样品后,通过hplc分析来确认所得酰氯形成。单独地,将碳酸钾(2.5当量)水溶液(7.0体积的水)添加至4-氟苯胺(3.5当量)在四氢呋喃(10体积)中的溶液中,冷却至5℃
±
5℃并搅拌约60min。在5℃
±
5℃下将酰氯物质的温度升高至约25℃
±
5℃的温度并搅拌3h。通过hplc分析监测反应。
[0094]
反应完成后,将溶液用乙酸乙酯(25体积)稀释,将有机层分离并用1m氢氧化钠水
溶液(7.5体积)、1m盐酸水溶液(7.5体积)和25%(w/w)氯化钠水溶液(7.5体积)洗涤。将有机层干燥并用硫酸钠(1.0w/w)过滤。将滤液在低于50℃的真空下浓缩约3体积并在低于50℃的真空下与乙酸乙酯(3x5体积)共蒸馏至约3.0体积。加入乙酸乙酯(5体积)和mtbe(10体积),加热至50℃
±
5℃并搅拌30-60min。将混合物冷却至15℃
±
5℃,搅拌约30min,过滤并将固体用乙酸乙酯(2.0体积)洗涤。通过hplc分析来分析mgb3含量。将材料在40℃
±
5℃下在真空下干燥直到含水量达到约3.0%以得到呈棕色固体的化合物1f。
[0095]
步骤7:n-(3-氟-4-((2-(5-(((2-甲氧基乙基)氨基)甲基)吡啶-2-基)噻吩并[3,2-b]吡啶-7-基)氧基)苯基)-n-(4-氟苯基)环丙烷-1,1-二甲酰胺(化合物1)
[0096]
向化合物1f在冰乙酸(3.5体积)中的混合物中添加浓盐酸(0.5体积)并在25℃
±
5℃下搅拌1.0h。通过hplc分析监测反应。
[0097]
反应完成后,将物质添加至水(11体积)中并在20℃
±
5℃下搅拌30min。使用10%(w/w)碳酸氢钠水溶液将ph调节至3.0
±
0.5并在20℃
±
5℃下搅拌大约3.0h。将物质过滤、用水(4x5.0体积)洗涤并在每次洗涤后检查滤液的ph。将材料在50℃
±
5℃下在真空下干燥直到含水量为约10%。
[0098]
将粗化合物1放入乙酸乙酯(30体积)中,加热至70℃
±
10℃,搅拌1.0h,冷却至25℃
±
5℃,过滤并用乙酸乙酯(2体积)洗涤。将材料在45℃
±
5℃下在真空下干燥6.0h。
[0099]
将粗化合物1放入精制过滤的四氢呋喃(30体积)和预洗涤的a-21离子交换树脂中并在25℃
±
5℃下搅拌直到溶液变澄清。得到澄清溶液后,将树脂过滤并用精制过滤的四氢呋喃(15体积)洗涤。将滤液在低于50℃的真空下浓缩约50%并与精制过滤ipa(3x15.0体积)共蒸馏并在低于50℃的真空下浓缩高达约50%。添加加入的精制过滤的ipa(15体积)并将溶液在低于50℃的真空下浓缩至约20体积。将反应物质加热至80℃
±
5℃,搅拌60min,并冷却至25℃
±
5℃。将所得反应物质在25℃
±
5℃下搅拌约20小时。将反应物质冷却至0
±
5℃,搅拌4-5小时,过滤并用精制过滤的ipa(2体积)洗涤。将材料在45℃
±
5℃下在真空下干燥,直到含水量为约2%,以获得所需产物化合物1。1h-nmr(400mhz,dmso-d6):δ10.40(s,1h),10.01(s,1h),8.59-8.55(m,1h),8.53(d,j=5.6hz,1h),8.32(s,1h),8.23(d,j=8.0hz,1h),7.96-7.86(m,2h),7.70-7.60(m,2h),7.56-7.43(m,2h),7.20-7.11(m,2h),6.66(d,j=5.6hz,1h),3.78(s,2h),3.41(t,j=5.6hz,2h),3.25(s,3h),2.66(t,j=5.6hz,2h),1.48(s,4h)ppm。ms:m/e 630(m 1)
。化合物1结晶形式d的制备
[0100]
向50l反应器中添加7.15kg的化合物1、40g的形式d(作为晶种)和21l丙酮(≥99%)。将混合物加热至回流(约56℃),持续1至2h。将混合物在20℃
±
5℃内部温度下搅拌至少24h。然后将悬浮液过滤并用7l丙酮洗涤滤饼。将湿饼在≤45℃下在真空下干燥,以获
得5.33kg所需形式d的化合物1。x射线粉末衍射(xrpd)
[0101]
用panalytical x'pert pro mpd衍射仪收集xrpd图,该衍射仪使用了使用optix长、细焦点源产生的cu辐射的入射光束。使用椭圆形渐变多层镜使cu ka x-射线聚焦通过标本和在探测器上。在分析之前,分析硅标本(nist srm 640e)来验证观察的si ill峰位置与nist认证的位置一致。将每个样品的标本夹在3μm厚的薄膜之间,并进行透射几何分析。使用光束截捕器、短防散射扩散、和防散射刀边将由空气产生的本底最小化。使用针对入射束和衍射束的索勒(soller)狭缝将来自轴向发散的增宽降低到最低限度。使用位于距标本240mm的扫描位置敏感检测器(x'celerator
tm
)和data collector软件v.2.2b收集衍射图。使用pattern match v2.3.6来创建xrpd图。
[0102]
使用x射线粉末衍射(xrpd)图表征获得的化合物1,该图显示化合物1呈化合物1的结晶形式d(化合物1形式d),参见图17。化合物1形式d的制备
[0103]
将427.0mg的化合物1溶解于5ml的thf以获得澄清棕色溶液。将所得溶液过滤,并将滤液在氮气流下蒸发。获得粘性固体,将其在真空下在室温中干燥约5min,直到获得粘性棕色固体。将该固体溶解于0.2ml的etoac并超声处理以溶解。将获得的溶液在室温下搅拌15min并沉淀固体。向所得固体添加0.4ml的etoac并在室温下搅拌21h 40min以获得悬浮液。将固体通过离心从母液分离,然后将所得固体重悬于0.6ml的etoac中并在室温下搅拌2天。通过离心分离固体,以获得所需形式d的化合物1。
[0104]
使用x射线粉末衍射(xrpd)图表征获得的化合物1,该图显示化合物1呈化合物1的结晶形式d(化合物1形式d)。可以在有或没有晶种的情况下完成实例1中的结晶。晶种可以来自先前所需结晶形式的任何批次。添加晶种可能不影响本披露中结晶形式的制备。检测和诊断方法
[0134]
本披露的抗体或抗原结合片段可用于多种应用,包括但不限于检测ox40的方法。在一方面,抗体或抗原结合片段可用于检测生物样品中ox40的存在。如本文所用的,术语“检测”包括定量或定性检测。在某些方面,生物样品包括细胞或组织。在其他方面,这些组织包括相对于其他组织以更高水平表达ox40的正常和/或癌性组织。
[0135]
在一方面,本披露提供了检测生物样品中ox40的存在的方法。在某些方面,该方法包括在允许抗体与抗原结合的条件下,将生物样品与抗ox40抗体接触,并且检测抗体和抗原之间是否形成复合物。生物样品可以包括但不限于尿液或血液样品。
[0136]
还包括诊断与ox40表达相关的障碍的方法。在某些方面,该方法包括使测试细胞与抗ox40抗体接触;通过检测抗ox40抗体与ox40多肽的结合来测定测试细胞中ox40的表达水平(定量或定性);并且将测试细胞中的表达水平与对照细胞(例如,与测试细胞相同组织来源的正常细胞或非ox40表达细胞)中的ox40表达水平进行比较,其中与对照细胞相比,测试细胞中较高水平的ox40表达表明存在与ox40表达相关的障碍。治疗方法
[0137]
本披露的抗体或抗原结合片段可用于多种应用,包括但不限于治疗ox40相关障碍或疾病的方法。在一方面,ox40相关障碍或疾病是癌症。
[0138]
在一方面,本披露提供了治疗癌症的方法。在某些方面,该方法包括向有需要的患者施用有效量的抗ox40抗体或抗原结合片段。癌症可包括但不限于乳腺癌、结肠癌、头颈癌、胃癌、肾癌、肝癌、小细胞肺癌、非小细胞肺癌、卵巢癌、皮肤癌、间皮瘤、淋巴瘤、白血病、骨髓瘤和肉瘤。
[0139]
本发明的抗体或抗原结合片段可以通过任何合适的方式施用,包括肠胃外、肺内和鼻内,并且如果需要用于局部治疗、病灶内施用。肠胃外输注包括肌内、静脉内、动脉内、腹膜内或皮下施用。给药可以通过任何合适的途径,例如通过注射,如静脉内或皮下注射,这部分取决于施用是短暂的还是长期的。本文考虑了多种给药方案,包括但不限于单次施用或在不同时间点的多次施用、推注施用、和脉冲输注。
[0140]
本发明的抗体或抗原结合片段可以以符合良好医学实践的方式配制、给药和施用。关于这点要考虑的因素包括治疗的特定障碍、治疗的特定哺乳动物、个体患者的临床病症、障碍的起因、药剂的递送位点、施用方法、施用方案、和医疗从业者已知的其他因素。抗体任选地与目前用于预防或治疗所研究的障碍的一种或多种药剂一起配制。此类其他药剂的有效量取决于配制品中存在的抗体的量、障碍或治疗的类型、以及上文讨论的其他因素。这些通常以与如本文所述相同的剂量和施用途径使用,或以本文所述剂量的约1%-99%使用,或以经验/临床确定为合适的任何剂量和任何途径使用。
[0141]
为预防或治疗疾病,本发明的抗体或抗原结合片段的合适的剂量将取决于待治疗的疾病的类型、抗体的类型、疾病的严重程度和病程、施用抗体是用于预防还是治疗目的、先前疗法、患者的临床病史和对抗体的应答、以及主治医生的判断。抗体适当地以一次或经一系列治疗施用于患者。取决于疾病的类型和严重性,约1μg/kg至100mg/kg的抗体可以是用于向患者施用的初始候选剂量,无论是例如通过一次或多次分开施用,还是通过连续输注。取决于上述因素,一个典型的日剂量可以为约1μg/kg至100mg/kg或更多。对于几天或更长时间内的重复施用,取决于病症,治疗通常会持续直到出现疾病症状的期望抑制。此类剂量可以间歇地施用,例如每周或每三周(例如使得患者接受约两个至约二十个,或例如约六个剂量的抗体)。可以施用初始高负载剂量,随后施用一个或多个较低剂量。但是,其他给药方案可以是有用的。通过常规技术和测定可以容易地监测此疗法的进展。组合疗法
[0142]
在一方面,本披露的ox40抗体可与其他治疗剂(例如,多重激酶抑制剂)组合使用。可以与本披露的ox40抗体一起使用的其他治疗剂包括但不限于化疗剂(例如,紫杉醇或紫杉醇药剂;(例如)、多西他赛;卡铂;拓扑替康;顺铂;伊立替康、多柔比星、来那度胺、5-氮杂胞苷、异环磷酰胺、奥沙利铂、培美曲塞二钠、环磷酰胺、依托泊苷、地西他滨、氟达拉滨、长春新碱、苯达莫司汀、苯丁酸氮芥、白消安、吉西他滨、美法仑、喷司他丁、米托蒽醌、培美曲塞二钠)、酪氨酸激酶抑制剂(例如egfr抑制剂(例如厄洛替尼)、多激酶抑制剂(例如mgcd265、rgb-286638)、cd-20靶向剂(例如利妥昔单抗、奥法木单抗、ro5072759、lfb-r603)、cd52靶向剂(例如阿仑单抗)、泼尼松龙、达贝泊汀α、来那度胺、bcl-2抑制剂(例如奥利默森钠)、极光激酶抑制剂(例如mln8237、tak-901)、蛋白酶体抑制剂(例如硼替佐米)、cd-19靶向剂(例如medi-551、mor208)、mek抑制剂(例如abt-348)、jak-2抑制剂(例如incb018424)、mtor抑制剂(例如坦罗莫司、依维莫司)、bcr/abl抑制剂(例如伊马替尼)、et-a受体拮抗剂(例如zd4054)、trail受体2(tr-2)激动剂(例如cs-1008)、hgf/sf抑制剂(例如
amg 102)、egen-001、polo样激酶1抑制剂(例如bi 672)。
[0143]
本披露的ox40抗体可与其他治疗剂组合使用。可以与本披露的ox40抗体一起使用的其他治疗剂包括多重酪氨酸激酶抑制剂,例如:n-(3-氟-4-((2-(5-(((2-甲氧基乙基)氨基)甲基)吡啶-2-基)噻吩并[3,2-b]吡啶-7-基)氧基)苯基)-n-(4-氟苯基)环丙烷-1,1-二甲酰胺(化合物1)。
[0144]
本文披露的抗ox40抗体和多重酪氨酸激酶抑制剂可按各种已知方式施用,如口服、局部、直肠、肠胃外、通过吸入喷雾或经由植入的储库施用,尽管任何给定的情况下,最合适的途径是都将取决于特定宿主、活性成分的所施用的病症的性质和严重程度。如本文所用的,术语“肠胃外”包括皮下、皮内、静脉内、肌肉内、关节内、动脉内、滑膜内、胸骨内、鞘内、病灶内、以及颅内注射或输注技术。
[0145]
抗ox40抗体和该多重酪氨酸激酶抑制剂的组合可以通过不同途径施用。在一个实施例中,多重酪氨酸激酶抑制剂口服施用,而抗ox40抗体肠胃外施用,如皮下、皮内、静脉内或腹膜内施用。
[0146]
在一个实施例中,多重酪氨酸激酶抑制剂每天施用一次(每日一次,qd)、每天两次(每日两次,bid)、每天三次、每天四次或每天五次,并且以约80mg/天至约640mg/天的剂量施用。在另一个实施例中,多重酪氨酸激酶抑制剂以从50mg qd至200qd的剂量施用。在又另一个实施例中,多重酪氨酸激酶抑制剂以从60mg qd至150mg qd的剂量施用。最后,该多重酪氨酸激酶抑制剂以120mg qd的剂量施用。药物组合物和配制品
[0147]
还提供了包含抗ox40抗体或抗原结合片段或包含编码抗ox40抗体或抗原结合片段的序列的多核苷酸的组合物,包括药物配制品。在某些实施例中,组合物包含与ox40结合的一种或多种抗体或抗原结合片段,或包含编码与ox40结合的一种或多种抗体或抗原结合片段的序列的一种或多种多核苷酸。这些组合物还可包含合适的载体,如本领域熟知的药学上可接受的赋形剂,包括缓冲剂。
[0148]
通过将具有所需纯度程度的这种抗体或抗原结合片段与一种或多种任选的药学上可接受的载体混合来制备本文所述的ox40抗体或抗原结合片段的药物配制品(remington's pharmaceutical sciences 16th edition[雷明顿药物科学第16版],osol,a.编辑(1980)),呈冻干配制品或水溶液的形式。药学上可接受的载体在所采用的剂量和浓度下对于接受者通常是无毒性的,并且包括但不限于:缓冲剂,如磷酸盐、柠檬酸盐、和其他有机酸;抗氧化剂,包括抗坏血酸和甲硫氨酸;防腐剂(如十八烷基二甲基苄基氯化铵;氯化六甲双铵;苯扎氯铵;苄索氯铵;苯酚、丁醇或苯甲醇;对羟基苯甲酸烷基酯,如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;儿茶酚;间苯二酚;环己醇;3-戊醇;和间甲酚);低分子量(少于约10个残基)的多肽;蛋白质,如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,如聚乙烯吡咯烷酮;氨基酸,如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖、二糖和其他碳水化合物,包括葡萄糖、甘露糖或糊精;螯合剂,如edta;糖,如蔗糖、甘露醇、海藻糖或山梨醇;成盐反离子,如钠;金属络合物(例如zn-蛋白络合物);和/或非离子型表面活性剂,如聚乙二醇(peg)。本文的示例性药学上可接受的载体还包括间质药物分散剂,例如可溶性中性活性透明质酸酶糖蛋白(shasegp),例如人可溶性ph-20透明质酸酶糖蛋白,如rhuph20(百特国际有限公司(baxter international,inc.))。在美国专利号
us 7,871,607和2006/0104968中描述了某些示例性shasegp和使用方法,包括rhuph20。在一方面,将shasegp与一种或多种另外的糖胺聚糖酶如软骨素酶组合。
[0149]
示例性冻干抗体配制品描述于美国专利号6,267,958中。水性抗体配制品包括美国专利号6,171,586和wo 2006/044908中所述的那些,后者包括组氨酸-乙酸盐缓冲液。
[0150]
可以制备缓释制剂。缓释制剂的合适实例包括含有该抗体的固体疏水性聚合物的半透性基质,该基质为成形制品的形式,例如膜或微胶囊。
[0151]
用于体内施用的配制品通常是无菌的。无菌性可以例如通过无菌过滤膜过滤而容易地实现。
[0152]
术语“药学上可接受的盐”包括但不限于与无机酸形成的盐,选自例如盐酸盐、磷酸盐、二磷酸盐、氢溴酸盐、硫酸盐、亚磺酸盐和硝酸盐;以及与有机酸形成的盐,选自例如马来酸盐、富马酸盐、乳酸盐、甲磺酸盐、对甲苯磺酸盐、2-羟乙基磺酸盐、苯甲酸盐,水杨酸盐、硬脂酸盐、链烷酸盐(如乙酸盐)以及与hooc-(ch2)
n-cooh形成的盐(其中n选自0至4)。类似地,药学上可接受的阳离子的实例包括但不限于钠、钾、钙、铝、锂以及铵。
[0153]
另外,如果以酸加成盐获得化合物,则可以通过碱化酸式盐的溶液来获得游离碱。相反,如果产物是游离碱,则可以按照由碱化合物制备酸加成盐的常规程序,通过将游离碱溶解在合适的有机溶剂中并用酸处理该溶液,来生产加成盐(如药学上可接受的加成盐)。本领域技术人员将识别可以用于制备无毒的药学上可接受的加成盐而无需过度实验的多种合成方法。实例实例1:抗ox40单克隆抗体的产生
[0154]
基于常规杂交瘤融合技术(略作修改)产生抗ox40单克隆抗体(de stgroth和sheidegger,1980j immunol methods[免疫学方法杂志]35:1;mechetner,2007methods mol biol[分子生物学方法]378:1)。选择在酶联免疫吸附测定(elisa)和荧光激活细胞分选(facs)测定中具有高结合活性的抗体用于进一步表征。用于免疫和结合测定的ox40重组蛋白
[0155]
编码全长人ox40(seq id no:1)的cdna由义翘神州公司(sino biological)(中国北京)基于genbank序列(登录号:x75962.1)合成。将由ox-40的氨基酸(aa)1-216(seq id no:2)组成的信号肽和细胞外结构域(ecd)的编码区进行pcr扩增,并克隆至内部开发的表达载体,其中将c-末端融合到小鼠igg2a的fc结构域、人igg1野生型重链的fc结构域或his-tag,以分别产生三种重组融合蛋白表达质粒ox40-migg2a、ox40-huigg1和ox40-his。ox40融合蛋白的示意图如图1所示。为了产生重组融合蛋白,将ox40-migg2a、ox40-huigg1和ox40-his表达质粒瞬时转染到293g细胞中,并在装备有旋转振荡器的co2培养箱中培养7天。收集含有重组蛋白的上清液并离心澄清。使用蛋白a柱(目录号:17-5438-02,通用生命科学公司(ge life sciences))纯化ox40-migg2a和ox40-huigg1。使用ni琼脂糖柱(目录号:17-5318-02,通用生命科学公司)纯化ox40-his。将ox40-migg2a、ox40-huigg和ox40-his蛋白用磷酸盐缓冲盐水(pbs)透析,并以小等分试样保存在-80℃冰箱中。稳定表达细胞系
[0156]
为了产生表达全长人ox40(ox40)或食蟹猴ox40(cynoox40)的稳定细胞系,将这些基因克隆到逆转录病毒载体pfb-neo(目录号:217561,美国安捷伦公司(agilent,usa))。基
于先前描述的方案进行逆转录病毒转导(zhang等人,2005)。分别用含有人ox40或cynoox40的病毒逆转录病毒转导hut78和hek293细胞,以产生hut78/ox40、hek293/ox40和hut78/cynoox40细胞系。免疫、杂交瘤融合和克隆
[0157]
用200μl含有10μg ox40-migg2a和快速抗体免疫佐剂(目录号kx0210041,康必泉公司(kangbiquan),中国北京)的混合物抗原腹膜内免疫8-12周龄balb/c小鼠(来自北京华阜康生物科技有限公司(hfk bioscience co.,ltd),中国北京)。在三周内重复进行该程序。第二次免疫后两周,通过elisa和facs评价小鼠血清的ox40结合。血清筛选后十天,通过i.p.注射10μg的ox40-migg2a加强具有最高抗ox40抗体血清滴度的小鼠。加强后三天,使用标准技术(somat cell genet[体细胞遗传学],1977 3:231),分离脾细胞并将其与鼠骨髓瘤细胞系sp2/0细胞(atcc,马纳萨斯,弗吉尼亚州)融合。通过elisa和facs评估抗体的ox40结合活性
[0158]
杂交瘤克隆的上清液最初通过(methods in molecular biology[分子生物学方法](2007)378:33-52)中所述的elisa(略作修改)进行筛选。简言之,将ox40-his蛋白在4℃下、在96孔板中包被过夜。在用pbs/0.05%吐温-20洗涤后,在室温下将板用pbs/3%bsa封闭2小时。随后,将板用pbs/0.05%吐温-20洗涤,并在室温下与细胞上清液孵育1小时。使用hrp连接的抗小鼠igg抗体(目录号:115035-008,杰克逊免疫研究公司(jackson immunoresearch inc),过氧化物酶亲和纯化的山羊抗小鼠igg,fcγ片段特异性)和底物(目录号:00-4201-56,伊生物技术公司(ebioscience),美国)来产生波长为450nm的颜色吸收信号,通过使用读板器(spectramax paradigm,分子设备公司(molecular devices)/pherastar,bmg labtech公司)测量。用间接elisa从融合筛选中挑选阳性亲本克隆。使用上述hut78/ox40和hut78/cynoox40细胞通过facs进一步验证elisa阳性克隆。将表达ox40的细胞(105个细胞/孔)与elisa阳性杂交瘤上清液一起孵育,随后与抗小鼠igg660抗体(目录号:50-4010-82,伊生物技术公司,美国)结合。使用流式细胞仪(guava easycyte 8ht,默克密理博公司(merck-millipore),美国)定量细胞荧光。
[0159]
对来自杂交瘤的在elisa和facs筛选中显示阳性信号的条件培养基进行功能测定,以鉴定在基于人免疫细胞的测定中具有良好功能活性的抗体(参见以下部分)。对具有所需功能活性的抗体进一步亚克隆和表征。杂交瘤亚克隆和对无血清或低血清培养基的适应
[0160]
通过如上所述的elisa、facs和功能测定进行初步筛选后,通过限制性稀释对阳性杂交瘤克隆进行亚克隆以确保克隆性。通过功能测定验证靠前的抗体亚克隆,并且其适于在含3%fbs的cdm4mab培养基(目录号:sh30801.02,hyclone公司,美国)中生长。单克隆抗体的表达和纯化
[0161]
将表达靠前抗体克隆的杂交瘤细胞在cdm4mab培养基(目录号:sh30801.02,hyclone公司)中培养,并在37℃下、在co2培养箱中孵育5至7天。通过离心收集条件培养基并在纯化前通过0.22μm膜过滤。按照制造商的指导,应用上清液中的鼠抗体,并结合到蛋白a柱(目录号:17-5438-02,通用生命科学公司)上。该程序通常产生纯度高于90%的抗体。将蛋白a亲和纯化的抗体用pbs透析,或如果需要的话,使用hiload 16/60superdex 200柱(目录号:28-9893-35,通用生命科学公司)进一步纯化以除去聚集体。通过测量280nm处的吸光
度来确定蛋白质浓度。将最终的抗体制剂以等分试样储存在-80℃冰箱中。实例2:抗ox40抗体的克隆和序列分析
[0162]
根据制造商的方案,使用ultrapure rna试剂盒(目录号:74104,凯杰公司(qiagen),德国)收获鼠杂交瘤克隆以制备总细胞rna。使用来自英杰公司的cdna合成试剂盒(目录号:18080-051)合成第一条链cdna,并使用pcr试剂盒(目录号:cw0686,康为世纪公司(cwbio),中国北京)进行杂交瘤抗体的vh和vl的pcr扩增。基于先前报道的序列(brocks等人,2001mol med[分子医学]7:461)通过英杰公司(中国北京)合成用于重链可变区(vh)和轻链可变区(vl)的抗体cdna克隆的寡核苷酸引物。将pcr产物直接用于测序,或亚克隆至peasy-blunt克隆载体(目录号:cb101,全式金公司(transgen),中国)中,然后通过金唯智公司(genewiz)(中国北京)测序。从dna测序结果推导出vh和vl区的氨基酸序列。
[0163]
基于卡巴特(wu和kabat 1970j.exp.med.[实验医学杂志]132:211-250)系统,通过序列注释和通过计算机程序序列分析定义鼠抗体的互补决定区(cdr)。代表性靠前克隆mu445的氨基酸序列(vh和vl)在表1中列出(seq id no:9和11)。mu445的cdr序列在表2中列出(seq id no:3-8)。表1.mu445 vh和vl区的氨基酸序列表2.小鼠单克隆抗体mu445 vh和vl区的cdr序列(氨基酸)实例3:鼠抗人ox40抗体445的人源化抗体人源化和工程化
[0164]
对于mu445的人源化,通过针对imgt中的人免疫球蛋白基因数据库进行序列比对,搜索人种系igg基因中与mu445可变区的cdna序列具有高度同源性的序列。选择以高频率存在于人抗体库(glanville等人,2009pnas[美国国家科学院院刊]106:20216-20221)中并且与mu445高度同源的人ighv和igkv基因作为人源化的模板。
[0165]
通过cdr移植进行人源化(methods in molecular biology[分子生物学方法],antibody engineering[抗体工程],methods and protocols[方法和方案],第248卷:humana出版社),并通过使用内部开发的表达载体将人源化抗体工程化为人igg1野生型形
式。在第一轮的人源化中,通过模拟的3d结构分析指导框架区中从鼠到人氨基酸残基的突变,并且在第一版的人源化抗体445中保留了对维持cdr的规范结构具有结构重要性的鼠框架残基(参见445-1,表3)。445-1的六个cdr具有hcdr1(seq id no:3)、hcdr2(seq id no:13)、hcdr3(seq id no:5)和lcdr1(seq id no:6)、lcdr2(seq id no:7)以及lcdr3(seq id no:8)的氨基酸序列。445-1的重链可变区具有由seq id no:15的核甘酸序列编码的(vh)seq id no:14的氨基酸序列,并且轻链可变区具有由seq id no:17的核甘酸序列编码的(vl)seq id no:16的氨基酸序列。特别地,将mu445的lcdr(seq id no:6-8)移植到保留了两个鼠框架残基(i
44
和y
71
)的人种系可变基因igvk1-39的框架(seq id no:16)中。将hcdr1(seq id no:3)、hcdr2(seq id no:13)和hcdr3(seq id no:5)移植到保留了两个鼠框架残基(l
70
和s
72
)的人种系可变基因ighv1-69的框架(seq id no:14)中。在445人源化变体(445-1)中,仅移植了卡巴特hcdr2的n-末端的一半,因为根据模拟的3d结构,仅预测该n末端的一半对抗原结合重要。
[0166]
使用内部开发的表达载体将445-1构建为人源化全长抗体,这些表达载体含有分别称为人野生型igg1(igg1wt)和κ链的恒定区,具有容易适应的亚克隆位点。通过将上述两种构建体共转染到293g细胞中来表达445-1抗体,并使用蛋白a柱(目录号:17-5438-02,通用生命科学公司)来纯化该抗体。将纯化的抗体在pbs中浓缩至0.5-10mg/ml并以等分试样储存在-80℃冰箱中。
[0167]
使用445-1抗体,进行几个单氨基酸改变,将vh和vl框架区中的保留的鼠残基转化为对应的人种系残基,如vl中的i44p和y71f以及vh中的l70i和s72a。此外,在cdr中进行了几个单氨基酸改变,以降低潜在的异构化风险并提高人源化水平。例如,在lcdr2中进行t51a和d50e改变,并在hcdr2中进行d56e、g57a和n61a改变。使用在特定位置含有突变的引物和定点诱变试剂盒(目录号:ap231-11,全式金公司,中国北京)进行所有人源化改变。通过测序验证这些所需的变化。
[0168]
评估445-1抗体中的氨基酸改变(针对其与ox40的结合和热稳定性)。由上述特异性改变的组合来构建抗体445-2(包含seq id no:3的hcdr1、seq id no:18的hcdr2、seq id no:5的hcdr3、seq id no:6的lcdr1、seq id no:19的lcdr2以及seq id no:8的lcdr3)(参见表3)。在比较两个抗体时,结果显示抗体445-2和445-1均表现出可比的结合亲和力(参见下表4和下表5)。
[0169]
从445-2抗体开始,进行了vl框架区中几个另外的氨基酸改变以进一步改善结合亲和力/动力学(例如,氨基酸g41d和k42g的改变)。此外,为了降低免疫原性风险并提高热稳定性,进行vh和vl两者的cdr中几个单氨基酸改变(例如,lcdr1中的s24r和hcdr2中的a61n)。与445-2相比,所得的改变显示出改善的结合活性或热稳定性。
[0170]
通过在cdr和框架区中引入特异性氨基酸改变以改善用于人类治疗用途的分子和生物物理特性来进一步工程化人源化445抗体。考虑因素包括除去有害的翻译后修饰、改善的热稳定性(tm)、表面疏水性和等电点(pi),同时保持结合活性。
[0171]
由上述成熟化过程构建人源化单克隆抗体445-3(包含seq id no:3的hcdr1、seq id no:24的hcdr2、seq id no:5的hcdr3、seq id no:25的lcdr1、seq id no:19的lcdr2和seq id no:8的lcdr3)(参见表3),并对其进行详细表征。还将抗体445-3制成包含人igg2野生型重链的fc结构域的igg2形式(445-3igg2),和包含具有s228p和r409k突变的人igg4的
fc结构域的igg4形式(445-3igg4)。结果表明445-3和445-2表现出可比的结合亲和力(参见表4和表5)。表3. 445抗体序列445抗体序列实例4:通过spr测定抗ox40抗体的结合动力学和亲和力
[0172]
通过使用biacore
tm
t-200(通用生命科学公司)的spr测定来表征抗ox40抗体的结合动力学和结合亲和力。简言之,将抗人igg抗体固定在活化的cm5生物传感器芯片(目录号:br100530,通用生命科学公司)上。将具有人igg fc区域的抗体流过芯片表面,并被抗人igg抗体捕获。然后将具有his标签的重组ox40蛋白(目录号:10481-h08h,义翘神州公司)的连续稀释液流过芯片表面,并通过使用一对一langmuir结合模型(bia评估软件,通用生命科学公司)分析表面等离子体共振信号的变化以计算缔合速率(ka)和解离速率(kd)。将平衡解离常数(kd)计算为kd/ka的比率。抗ox40抗体的spr测定的结合谱的结果总结于图2和表4中。抗体445-3的平均kd结合谱(9.47nm)略优于抗体445-2(13.5nm)和445-1(17.1nm),并且与ch445的相似。445-3igg4的结合谱与445-3(具有igg1 fc)相似,表明igg4和igg1之间fc的变化不改变445-3抗体的特异性结合。表4.通过spr的抗ox40抗体的结合亲和力*ch445由与人igg1wt/κ恒定区融合的mu445可变结构域构成实例5:测定抗ox40抗体对在hut78细胞上表达的ox40的结合亲和力
[0173]
为了评估抗ox40抗体与在活细胞的表面上表达的ox40的结合活性,用如实例1中所述的人ox40转染hut78细胞以创建ox40表达系。将hut78/ox40活细胞接种在96孔板中,并与连续稀释的不同抗ox40抗体一起孵育。将山羊抗人igg-fitc(目录号:a0556,碧云天公司(beyotime))用作二抗来检测抗体与细胞表面的结合。通过用graphpad prism将剂量应答数据与四参数逻辑模型拟合来确定与人ox40的剂量依赖性结合的ec
50
值。如图3和表5所示,ox40抗体对ox40具有高亲和力。还发现本披露的ox40抗体具有通过流式细胞术测量的相对较高的荧光强度的最大水平(参见表5的最后一列),表明抗体从ox40解离较慢,这是更理想的结合谱。表5.人源化445变体与ox40的剂量依赖性结合的ec
50
实例6:测定抗ox40抗体的交叉反应性
[0174]
为了评估抗体445-3对人和食蟹猴(cyno)ox40的交叉反应性,将表达人ox40(hut78/ox40)和cyno ox40(hut78/cynoox40)的细胞接种在96孔板上,并与一系列稀释的ox40抗体一起孵育。将山羊抗人igg-fitc(目录号:a0556,碧云天公司)用作检测的二抗。通过用graphpad prism将剂量应答数据与四参数逻辑模型拟合来确定与人和食蟹猴天然ox40的剂量依赖性结合的ec
50
值。结果示于图4和下表6中。抗体445-3与人和食蟹猴ox40两者交叉反应,具有如下所示相似的ec
50
值。表6.与人和食蟹猴ox40结合的抗体445-3的ec
50
细胞系445-3的ec
50
(ug/ml)最大(top)(mfi)hut78/ox400.174575hut78/cynoox400.171594实例7:具有445-3fab的ox40的共结晶和结构测定
[0175]
为理解ox40与本披露的抗体的结合机制,解析了ox40和445-3的fab的共晶体结构。引入位于残基t148和n160的突变以阻断ox40的糖基化并改善蛋白质的均匀性。将编码突变人ox40(具有两个突变位点t148a和n160a的残基m1-d170)的dna克隆至含有hexa-his标签的表达载体中,并且在37℃下将该构建体瞬时转染至用于蛋白表达的293g细胞,持续7天。收获细胞,并且将上清液收集并与his标签亲和树脂在4℃下孵育1小时。将树脂用含有20mm tris(ph 8.0)、300mm nacl和30mm咪唑的缓冲液漂洗三次。然后将ox40蛋白用含有20mm tris(ph 8.0)、300mm nacl和250mm咪唑的缓冲液洗脱,随后用superdex 200(通用医疗公司(ge healthcare))在含有20mm tris(ph 8.0)、100mm nacl的缓冲液中进一步纯化。
[0176]
将445-3fab的重链和轻链的编码序列克隆至含有位于重链的c-末端的hexa-his标签的表达载体中,并在37℃下将这些瞬时共转染至293g细胞(用于蛋白表达),持续7天。445-3fab的纯化步骤与用于以上突变ox40蛋白的相同。
[0177]
将纯化的ox40和445-3fab以1:1的摩尔比混合,并在冰上孵育30分钟,随后用superdex 200(通用医疗公司)在含有20mm tris(ph 8.0)、100mm nacl的缓冲液中进一步纯化。收集复合物峰,并浓缩至大约30mg/ml。
[0178]
通过将该蛋白复合物与储液以1:1的体积比混合来进行共晶体筛选。通过蒸汽扩散由在20℃下培养的悬滴与含有0.1m hepes(ph 7.0)、1%peg 2,000mme和0.95m琥珀酸钠的储液获得共晶体。
[0179]
将尼龙环用于收获共晶体,并将晶体浸入补充有20%甘油的储液中10秒。在bl17u1,上海同步辐射光源(shanghai synchrotron radiation facility)上收集衍射数
据,并用xds程序处理。使用igg fab的结构(pdb:5czx的链c和d)和ox40(pdb:2hev的链r)的结构作为分子置换搜索模型,用程序phaser解析该相。将phenix.refine图形界面用于进行x射线数据刚体、tls和限制性精修,随后用coot程序调整并在phenix.refine程序中进一步精修。将x射线的数据收集和精修统计结果总结于表7中。表7.数据收集和精修统计结果表7.数据收集和精修统计结果括号中的值是指最高分辨率壳层。
a rmerge=∑∑i|i(h)
i-《i(h)》|/∑∑i|i(h)i|,其中《i(h)》是等效平均强度。
b r
工作
=∑|fo-fc|/∑|fo|,其中fo和fc分别是观察到和计算出的结构因子振幅。
c r
游离
=∑|fo-fc|/∑|fo|,使用测试数据集,观察到的反射中随机抽取总数据的5%计算。实例8:通过spr鉴定抗体445-3的表位
[0180]
由ox40和抗体445-3fab的共结晶体结构指导,我们选择并产生了人ox40蛋白的一系列单突变,以进一步鉴定本披露的抗ox40抗体的关键表位。用定点诱变试剂盒(目录号:ap231-11,全式金公司)对人ox40/igg1融合构建体进行单点突变。通过测序验证所需的突
变。通过转染至293g细胞来实现ox40突变体的表达和制备并使用蛋白a柱(目录号:17-5438-02,通用生命科学公司)纯化这些突变体。
[0181]
通过使用biacore 8k(通用生命科学公司)的spr测定来表征ox40点突变体对445-3fab的结合亲和力。简言之,使用edc和nhs,将ox40突变体和野生型ox40固定在cm5生物传感器芯片(目录号:br100530,通用生命科学公司)上。然后将在hbs-ep 缓冲液(目录号:br-1008-26,通用生命科学公司)中的连续稀释的445-3fab以30μl/min流过芯片表面,接触时间为180s并且解离时间为600s。通过使用一对一langmuir结合模型(bia评估软件,通用生命科学公司)分析表面等离子体共振信号的改变以计算缔合速率(ka)和解离速率(kd)。将平衡解离常数(kd)计算为kd/ka的比率。将突变体的kd位移倍数计算为突变体kd/wt kd的比率。通过spr确定的表位鉴定谱总结于图5和表8中。这些结果表明ox40中残基h153、i165和e167突变为丙氨酸显著降低了抗体445-3与ox40结合,并且残基t154和d170突变为丙氨酸适度降低了抗体445-3与ox40结合。
[0182]
抗体445-3和ox40的残基h153、t154、i165、e167和d170的详细相互作用示于图6中。ox40上h153的侧链被相互作用界面上的445-3的小口袋包围,与
重
s31和
重
g102形成氢键并且与
重
y101形成π-π堆积。e167侧链与
重
y50和
重
n52形成氢键,同时d170分别与
重
s31和
重
k28形成氢键和盐桥,这可以进一步稳定复合物。t154和
重
y105、i165和
重
r59之间的范德华力(vdw)相互作用有助于抗体445-3对ox40的高亲和力。
[0183]
总之,将ox40的残基h153、i165和e167鉴定为与抗体445-3相互作用的重要残基。此外,ox40的氨基酸t154和d170也是对抗体445-3的重要接触残基。此数据表明抗体445-3的表位是ox40的残基h153、t154、i165、e167和d170。这些表位残基在序列htlqpasnssdaicedrd(seq id no:30)中,其中重要的接触残基以粗体加下划线表示。表8.通过spr确定抗体445-3的表位鉴定突变体突变体kd/wt kdh153a未检测到结合t154a8q156a1.9s161a1.1s162a0.6i165a28e167a135d170a8显著影响:未检测到结合,或突变体kd/wt kd的值大于10。适当影响:突变体kd/wt kd的值在5和10之间。无显著影响:突变体kd/wt kd的值小于5。实例9:抗ox40抗体445-3不阻断ox40-ox40l相互作用。
[0184]
为确定抗体445-3是否干扰ox40-ox40l相互作用,建立了基于细胞的流式细胞术测定。在此测定中,将抗体445-3、参考抗体1a7.gr1、对照huigg或单独的培养基与人ox40融合蛋白和鼠igg2a fc(ox40-migg2a)预孵育。然后将抗体和融合蛋白复合物添加至表达ox40l的hek293细胞中。如果ox40抗体不干扰ox40-ox40l相互作用,则ox40抗体-ox40 migg2a复合物仍将与表面ox40l结合,并且使用抗小鼠fc二抗可检测到此相互作用。
[0185]
如图7所示,抗体445-3(甚至在高浓度下)也不会降低ox40与ox40l的结合,表明445-3不干扰ox40-ox40l相互作用。这表明445-3不在ox40l结合位点结合,或不会结合地足够近以在空间上阻碍ox40l结合。相比之下,如图7所示,阳性对照抗体1a7.gr1完全阻断ox40与ox40l结合。
[0186]
此外,如图8所示,解析ox40与445-3fab复合物的共结晶体结构,并与ox40/ox40l复合物(pdb代码:2hev)对齐。ox40配体三聚体主要通过ox40的crd1(富含半胱氨酸的结构域)、crd2和部分crd3区域与ox40相互作用(compaan和hymowitz,2006),而抗体445-3仅通过crd4区域与ox40相互作用。总之,445-3抗体和ox40l三聚体在ox40的不同的对应区域结合,并且抗体445-3不干扰ox40/ox40l相互作用。此结果与以上实例中所述的表位作图数据相关。ox40的crd4位于氨基酸127-167,并且抗体445-3的表位与此区域部分重叠。ox40 crd4(氨基酸127-167)的序列如下所示,并且445-3表位的部分重叠以粗体加下划线表示:pcppghfspgdnqackpwtnctlagkhtlqpasnssdaice(seq id no:31)。实例10:抗ox40抗体445-3的激动性活性
[0187]
为了研究抗体445-3的激动性功能,将ox40阳性t细胞系,hut78/ox40与人工抗原呈递细胞(apc)系(hek293/os8
低-fcγri)在445-3或1a7.gr1存在或不存在下共培养过夜,并将il-2产量用作t-细胞刺激的读数。在hek293/os8
低-fcγri细胞中,将编码膜结合抗cd3抗体okt3(os8)(如美国专利号8,735,553中披露的)和人fcγri(cd64)的基因稳定共转染至hek293细胞中。由于抗ox40抗体诱导的免疫活化取决于抗体交联(voo等人,2013),因此在抗ox40抗体与ox40和fcγri两者的双重接合下,hek293/os8
低-fcγri上的fcγri为抗ox40抗体介导的ox40的交联提供基础。如图9所示,抗ox40抗体445-3在以剂量依赖性方式高效增强tcr信号传导,其中ec
50
为0.06ng/ml。还观察到参考ab1a7.gr1的活性略弱。相比之下,对照人igg(10μg/ml)或空白显示对il-2产生没有影响。实例11:抗ox40抗体445-3促进混合淋巴细胞反应(mlr)测定中的免疫应答
[0183]
为了确定抗体445-3是否可以刺激t细胞活化,如前所述建立了混合淋巴细胞反应(mlr)测定(tourkova等人,2001)。简言之,通过用gm-csf和il-4培养,来从人pbmc衍生的cd14
骨髓细胞中诱导成熟dc,随后进行lps刺激。接下来,在抗ox40 445-3抗体(0.1-10μg/ml)存在下,将丝裂霉素c处理的dc与同种异体cd4
t细胞共培养2天。通过elisa检测共培养物中的il-2产量,将其作为mlr应答的读数。
[0184]
如图10所示,抗体445-3显著促进il-2产生,表明445-3活化cd4
t细胞的能力。相比之下,参考抗体1a7.gr1在mlr测定中显示显著(p《0.05)较弱的活性。实例12:抗ox40抗体445-3显示adcc活性
[0185]
建立了基于乳酸脱氢酶(ldh)释放的adcc测定,以研究抗体445-3是否可以杀伤表达ox40
hi
的靶细胞。通过将cd16v158(v158等位基因)和fcrγ基因共转导至nk细胞系nk92mi(atcc,马纳萨斯,弗吉尼亚州)中,产生了作为效应细胞的nk92mi/cd16v细胞系。将表达ox40的t细胞系hut78/ox40用作靶细胞。在抗ox40抗体(0.004-3μg/ml)或对照ab存在下,将相同数量(3x104)的靶细胞和效应细胞共培养5小时。使用cytotox 96非放射性细胞毒性测定试剂盒(普洛麦格公司(promega),威斯康星州麦迪逊),通过ldh释放评估细胞毒性。通过如下所示的公式计算特异性裂解。
[0186]
如图11所示,抗体445-3在通过adcc以剂量依赖性方式杀伤ox40
hi
靶标中显示高效力(ec
50
:0.027μg/ml)。抗体445-3的adcc效应与1a7.grl对照抗体的相似。相比之下,与对照人igg或空白相比,具有s228p和r409k突变的igg4fc形式的445-3(445-3-igg4)未显示出任何显著的adcc效应。结果与先前发现一致,即igg4 fc对adcc较弱或沉默(an z等人mabs[单克隆抗体]2009)。实例13:抗ox40抗体445-3优先耗减cd4
treg,并增加体外cd8
teff/treg比率
[0187]
几种动物肿瘤模型中已显示,抗ox40抗体可以耗减肿瘤浸润ox40
hi treg,并增加cd8
t细胞与treg的比率(bulliard等人,2014;carboni等人,2003;jacquemin等人,2015;marabelle等人,2013b)。因此,增强免疫应答,导致肿瘤消退和改善的存活。
[0188]
鉴于体外活化的或肿瘤内cd4
foxp3
treg比其他t细胞亚群优先表达ox40(lai等人,2016;marabelle等人,2013b;montler等人,2016;soroosh等人,2007;timperi等人,2016),建立了基于人pbmc的测定以研究抗体445-3杀伤ox40
hi
细胞(特别地treg)的能力。简言之,将pbmc通过pha-l(1μg/ml)预活化1天以诱导ox40表达,并用作靶细胞。然后在抗ox40抗体(0.001-10μg/ml)或安慰剂存在下,将效应nk92mi/cd16v细胞(如实例12中所述,5x104)与相同数目靶细胞共培养过夜。通过流式细胞术确定每个t细胞亚群的百分比。如图12a和12b所示,用抗体445-3的处理以剂量依赖性方式诱导了cd8
t细胞的百分比增加和cd4
foxp3
treg的百分比降低。因此,cd8
t细胞与treg的比率大大提高(图12c)。用1a7.gr1处理得到较弱结果。此结果证明445-3通过增强cd8
t细胞功能但限制treg介导的免疫耐受,在诱导抗肿瘤免疫力中的治疗应用。实例14:抗ox40抗体445-3在小鼠肿瘤模型中发挥剂量依赖性抗肿瘤活性
[0189]
在小鼠肿瘤模型中显示了抗ox40抗体445-3的功效。将鼠mc38结肠肿瘤细胞皮下植入人ox40转基因的c57小鼠中(百奥赛图公司(biocytogen),中国北京)。植入肿瘤细胞后,每周测量两次肿瘤体积,并使用以下公式计算这些肿瘤体积(mm3):v=0.5(a x b2),其中a和b分别为肿瘤的长径和短径。当肿瘤达到大小为大约190mm3的平均体积时,将小鼠随机分配到7个组,并每周腹膜内注射445-3或1a7.gr1抗体一次,持续三周。将人igg作为同种型对照施用。将部分消退(pr)定义为在三次连续测量中,肿瘤体积小于第一天给药的起始肿瘤体积的50%。使用以下公式计算肿瘤生长抑制(tgi):治疗t=在时间t经治疗的肿瘤体积治疗t0=在时间0经治疗的肿瘤体积安慰剂t=在时间t安慰剂肿瘤体积安慰剂t0=在时间0安慰剂肿瘤体积
[0190]
结果证明,445-3在0.4mg/kg、2mg/kg和10mg/kg的剂量下腹膜内注射时具有剂量依赖性抗肿瘤功效。445-3的施用导致53%(0.4mg/kg)、69%(2mg/kg)和94%(10mg/kg)的肿瘤生长抑制,并导致从基线的0%(0.4mg/kg)、17%(2mg/kg)和33%(10mg/kg)的部分消
退。相比之下,未观察到抗体1a7.gr1的部分消退。体内数据表明,配体非阻断抗体445-3比ox40-ox40l阻断抗体1a7.gr1更适用于抗肿瘤疗法(图13a和13b,表9)。表9. 445-3和1a7.gr1在鼠mc38结肠肿瘤小鼠模型中的功效实例15:抗ox40抗体的氨基酸改变
[0191]
选择几个氨基酸进行改变,以改善ox40抗体。进行氨基酸改变以改善亲和力或以增加人源化。针对合适的氨基酸改变设计pcr引物集,合成并用于修饰抗ox40抗体。例如,重链中的k28t和轻链中的s24r的改变导致通过facs确定的ec
50
比原始445-2抗体增加1.7倍。重链中的y27g和轻链中的s24r的改变导致通过biacore确定的kd比原始445-2抗体增加1.7倍。这些改变总结于图14a-14b中。实例16:小鼠结肠肿瘤模型中用ox40抗体与多重酪氨酸激酶抑制剂的组合治疗
[0192]
在右侧腹部处向雌性balb/c小鼠皮下植入100μl pbs中的1
×
105个ct26wt细胞(鼠结肠癌细胞系)。接种后,根据接种顺序将小鼠随机分配到4个组中,每组20只动物。将用溶媒(盐水中peg400/0.1n hcl,40/60)治疗的小鼠作为阴性对照。
[0193]
ox86是先前在wo 2016/057667中披露的大鼠抗小鼠ox40抗体,将其用小鼠igg2a恒定区进一步工程化,以减少其免疫原性,并且还在小鼠研究中保持了其fc介导的功能。以下提供了ox86的vh和vl区。如先前科学文献中报道的,ox86具有与抗体445-3相似的作用机理,因为其不阻断ox40和ox40配体之间的相互作用(al-shamkhani al等人,euro j.immunol[欧洲免疫学杂志](1996)26(8);1695-9,zhang,p.等人cell reports[细胞报道]27,3117-3123)。
[0194]
作为单一疗法,通过腹膜内(i.p.)注射以0.08mg/kg每周一次(qw)施用ox86。
[0195]
作为单一疗法,通过口服管饲(p.o.)以15mg/kg每天一次(qd)施用化合物1。将ox86通过腹膜内(i.p.)注射以0.08mg/kg每周一次(qw)与化合物1通过口服管饲(p.o.)以15mg/kg每天一次(qd)组合施用。每周两次使用游标卡尺在两个维度上确定肿瘤体积,并使用如下公式以mm3表示:v=0.5(a
×
b2),其中a和b分别为肿瘤的长径和短径。数据表示为平均肿瘤体积
±
平均值的标准差(sem)。使用以下公式计算肿瘤生长抑制(tgi):
治疗t=在时间t经治疗的肿瘤体积治疗t0=在时间0经治疗的肿瘤体积安慰剂t=在时间t安慰剂肿瘤体积安慰剂t0=在时间0安慰剂肿瘤体积
[0196]
图15和表10显示ct26wt同基因模型对ox86与化合物1组合治疗的应答。在第24天,ox86(0.08mg/kg qw
×
4)、化合物1(15mg/kg qd
×
24)及其组合治疗分别导致84%、91%和98%的肿瘤生长抑制。然后,将溶媒组或肿瘤体积超过2000mm3的动物处死,并保留剩余的小鼠以进一步监测肿瘤生长。在研究结束时(第69天),用ox86治疗的50%小鼠是完全应答者,而用化合物1治疗的小鼠中只有5%完全应答。在用ox86与化合物1组合治疗的小鼠的组中,80%的小鼠没有肿瘤,表明完全应答。这证明,与单一药剂相比,抗ox40抗体(ox86)和化合物1的组合疗法在ct26wt小鼠模型中具有改善的功效。在整个治疗期间,没有观察到毒性。表10.ox86和化合物1在ct26wt同基因模型中的组合功效a不适用实例17:在小鼠结肠腺癌肿瘤模型中用ox40抗体与多重酪氨酸激酶抑制剂的组合治疗。
[0197]
在右侧腹部处向雌性c57bl/6小鼠皮下植入100μl pbs中的2
×
107个mc38细胞(鼠结肠腺癌系)。接种后,根据肿瘤体积将小鼠随机分配到4个组中。将用溶媒(盐水中peg400/0.1n hcl,40/60)治疗的小鼠作为对照。已确认1a7.gr1(先前披露于us 20150307617的序列)结合小鼠ox40(内部)。
[0198]
通过elisa表征抗体1a7.gr1与小鼠ox40的结合。简言之,将小鼠ox40-his(目录号:ab221028,艾博抗公司(abcam))蛋白在4℃下、在96孔板中包被过夜。在用pbs/0.05%吐温-20洗涤后,在室温下将板用pbs/3%bsa封闭2小时。随后,将板用pbs/0.05%吐温-20洗涤,并在室温下与1a7.gr1孵育1小时。使用hrp连接的抗小鼠igg抗体(目录号:115035-008,杰克逊免疫研究公司(jackson immunoresearch inc),过氧化物酶亲和纯化的山羊抗小鼠igg,fcγ片段特异性)和底物(目录号:00-4201-56,伊生物技术公司(ebioscience),美国)来产生波长为450nm的颜色吸收信号,通过使用读板器(spectramax paradigm,分子设备公司(molecular devices)/pherastar,bmg labtech公司)测量。通过用graphpad prism将剂量应答数据与四参数逻辑模型拟合来确定ec
50
值。抗体1a7.gr1与包被的小鼠ox40结合,ec50为0.11ug/ml。此结果示于图18中。
[0199]
将作为单一药剂的1a7.gr1抗体通过腹腔内注射以2mg/kg每周施用。通过口服管饲以15mg/kg qd施用化合物1,持续28天。以如上所述的相同剂量和施用途径来施用1a7.gr1抗体与化合物1的组合。每周确定两次肿瘤体积。
t cells.proceedings of the national academy of sciences of the united states of america 103,13138-13143.20.jacquemin,c.,schmitt,n.,contin-bordes,c.,liu,y.,narayanan,p.,seneschal,j.,maurouard,t.,dougall,d.,davizon,e.s.,dumortier,h.,et al.(2015).ox40 ligand contributes to human lupus pathogenesis by promoting t follicular helper response.immunity 42,1159-1170.21.kjaergaard,j.,tanaka,j.,kim,j.a.,rothchild,k.,weinberg,a.,and shu,s.(2000).therapeutic efficacy of ox-40 receptor antibody depends on tumor immunogenicity and anatomic site of tumor growth.cancer research 60,5514-5521.22.ladanyi,a.,somlai,b.,gilde,k.,fejos,z.,gaudi,i.,and timar,j.(2004).t-cell activation marker expression on tumor-infiltrating lymphocytes as prognostic factor in cutaneous malignant melanoma.clinical cancer research:an official journal of the american association for cancer research 10,521-530.23.lai,c.,august,s.,albibas,a.,behar,r.,cho,s.y.,polak,m.e.,theaker,j.,macleod,a.s.,french,r.r.,glennie,m.j.,et al.(2016).ox40 regulatory t cells in cutaneous squamous cell carcinoma suppress effector t-cell responses and associate with metastatic potential.clinical cancer research:an official journal of the american association for cancer research 22,4236-4248.24.marabelle,a.,kohrt,h.,and levy,r.(2013a).intratumoral anti-ctla-4 therapy:enhancing efficacy while avoiding toxicity.clinical cancer research:an official journal of the american association for cancer research 19,5261-5263.25.marabelle,a.,kohrt,h.,sagiv-barfi,i.,ajami,b.,axtell,r.c.,zhou,g.,rajapaksa,r.,green,m.r.,torchia,j.,brody,j.,et al.(2013b).depleting tumor-specific tregs at a single site eradicates disseminated tumors.the journal of clinical investigation 123,2447-2463.26.montler,r.,bell,r.b.,thalhofer,c.,leidner,r.,feng,z.,fox,b.a.,cheng,a.c.,bui,t.g.,tucker,c.,hoen,h.,and weinberg,a.(2016).ox40,pd-1 and ctla-4 are selectively expressed on tumor-infiltrating t cells in head and neck cancer.clinical&translational immunology 5,e70.27.morris,n.p.,peters,c.,montler,r.,hu,h.m.,curti,b.d.,urba,w.j.,and weinberg,a.d.(2007).development and characterization of recombinant human fc:ox40l fusion protein linked via a coiled-coil trimerization domain.molecular immunology 44,3112-3121.28.ohshima,y.,tanaka,y.,tozawa,h.,takahashi,y.,maliszewski,c.,and delespesse,g.(1997).expression and function of ox40 ligand on human dendritic cells.j immunol 159,3838-3848.
29.petty,j.k.,he,k.,corless,c.l.,vetto,j.t.,and weinberg,a.d.(2002).survival in human colorectal cancer correlates with expression of the t-cell costimulatory molecule ox-40(cd134).american journal of surgery 183,512-518.30.redmond,w.l.,and weinberg,a.d.(2007).targeting ox40 and ox40l for the treatment of autoimmunity and cancer.critical reviews in immunology 27,415-436.31.rogers,p.r.,song,j.,gramaglia,i.,killeen,n.,and croft,m.(2001).ox40 promotes bcl-xl and bcl-2 expression and is essential for long-term survival of cd4 t cells.immunity 15,445-455.32.ruby,c.e.,and weinberg,a.d.(2009).ox40-enhanced tumor rejection and effector t cell differentiation decreases with age.j immunol 182,1481-1489.33.sarff,m.,edwards,d.,dhungel,b.,wegmann,k.w.,corless,c.,weinberg,a.d.,and vetto,j.t.(2008).ox40(cd134)expression in sentinel lymph nodes correlates with prognostic features of primary melanomas.american journal of surgery 195,621-625;discussion 625.34.sato,t.,ishii,n.,murata,k.,kikuchi,k.,nakagawa,s.,ndhlovu,l.c.,and sugamura,k.(2002).consequences of ox40-ox40 ligand interactions in langerhans cell function:enhanced contact hypersensitivity responses in ox40l-transgenic mice.european journal of immunology 32,3326-3335.35.smyth,m.j.,ngiow,s.f.,and teng,m.w.(2014).targeting regulatory t cells in tumor immunotherapy.immunology and cell biology 92,473-474.36.song,a.,tang,x.,harms,k.m.,and croft,m.(2005a).ox40 and bcl-xl promote the persistence of cd8 t cells to recall tumor-associated antigen.j immunol 175,3534-3541.37.song,j.,so,t.,cheng,m.,tang,x.,and croft,m.(2005b).sustained survivin expression from ox40 costimulatory signals drives t cell clonal expansion.immunity 22,621-631.38.song,j.,so,t.,and croft,m.(2008).activation of nf-kappab1 by ox40 contributes to antigen-driven t cell expansion and survival.j immunol 180,7240-7248.39.soroosh,p.,ine,s.,sugamura,k.,and ishii,n.(2007).differential requirements for ox40 signals on generation of effector and central memory cd4 t cells.j immunol 179,5014-5023.40.st rose,m.c.,taylor,r.a.,bandyopadhyay,s.,qui,h.z.,hagymasi,a.t.,vella,a.t.,and adler,a.j.(2013).cd134/cd137 dual costimulation-elicited ifn-gamma maximizes effector t-cell function but limits treg expansion.immunology and cell biology 91,173-183.41.stuber,e.,neurath,m.,calderhead,d.,fell,h.p.,and strober,w.(1995)
ox40 antibodies mediate potent t cell-stimulatory and anti-tumor activity.cell reports 27,3117-3123.
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。