1.本发明涉及医疗器械领域,尤其是免疫类体外诊断试剂检测结果有效性确定方法及系统。
背景技术:
2.免疫类体外诊断试剂是一类是基于抗原和抗体的特异性反应进行检测的一种手段,由于其可以利用同位素、酶、荧光物质、化学发光物质等对被检测信号进行放大和显示。目前,应用于临床领域的免疫检测方主要有荧光免疫分析法、放射免疫法分析(radioimmunoassay,ria)法、酶联免疫测定(enzyme immunoassay,eia)法、化学发光免疫分析(chemi luminescence immunoassay,clia)法等。
3.因检测条件和被测物的不同,检测方法又可分为双抗夹心法,竞争法,间接法,捕获法等。以双抗夹心法为例,上述方法学都是基于在一定固相基质包被捕获抗体,以另外一个标记的抗体作为检测抗体,与样本中的抗原物质形成抗体-抗原-抗体的复合物,并通过标记抗体的多少,通过荧光、吸光度、发光值等物理信号手段来探知未知样本的结果或者含量。
4.在这类免疫检测结果中,普遍存在的问题即是单个检测结果的有效性。虽然各个方法学都会通过校准或者质控来控制系统检测结果的可控性,以此判定检测结果的有效性,但是其都是基于检测系统的整体是否正常,如果样本个体本身存在一些未知的或者罕见的特殊原因(如异嗜性抗体,人抗鼠抗体(hama),非特异性结合,外源性或者内源性干扰等),就有一定概率发生检测结果的异常,此时普通的质控手段无法发现此类异常结果,因而出现了结果的错误。
技术实现要素:
5.本发明的目的就是为了解决现有技术中存在的上述问题,提供一种免疫类体外诊断试剂检测结果有效性确定方法及系统。
6.本发明的目的通过以下技术方案来实现:
7.免疫类体外诊断试剂检测结果有效性确定方法,包括如下步骤:
8.s1,在获取到免疫检测的第一检测结果后,将经过免疫检测的检测探针通过洗脱液进行洗脱;
9.s2,将洗脱后的检测探针浸入读数孔中,通过读数设备进行读数,获得第二检测结果;
10.s3,根据第一检测结果及第二检测结果求出洗脱百分比;
11.s4,确定洗脱百分比是否在阈值范围内,若是,确定所述免疫类体外诊断试剂检测结果正常;反之,确定所述免疫类体外诊断试剂检测结果异常。
12.优选的,所述洗脱液是pbst缓冲液、tbst缓冲液、mes缓冲液、甘氨酸缓冲液中的至少一种。
13.优选的,所述洗脱液的ph值在2~8之间。
14.优选的,所述检测探针在洗脱液中洗脱的时间在30~180秒之间。
15.优选的,按照如下公式计算所述洗脱百分比p:
16.p=(q1-q2)/q1%
17.其中,q1为第一检测结果,q2为第二检测结果。
18.优选的,所述阈值范围在24.9%~44.3%之间。
19.优选的,所述第一检测结果按照如下步骤获取:
20.s01,准备免疫检测所需的检测探针、清洗液、生物素化的检测抗体、链霉亲和素-花青染料5及检测样本;
21.s02,通过清洗液对检测探针进行清洗;
22.s03,清洗后,将检测探针浸入检测样本中反应第一目标时间;
23.s04,将检测探针由检测样本中取出后通过清洗液进行清洗;
24.s05,清洗后,将检测探针浸入生物素化的检测抗体中反应第二目标时间;
25.s06,将检测探针由生物素化的检测抗体中取出后通过清洗液进行清洗;
26.s07,清洗后,将检测探针浸入链霉亲和素-花青染料5中反应第三目标时间;
27.s08,将检测探针由链霉亲和素-花青染料5中取出后通过清洗液进行清洗;
28.s09,清洗后,将检测探针放入读数孔内进行读数并获取第一检测结果。
29.优选的,所述检测探针在包被过程中经防潮液处理。
30.免疫类体外诊断试剂检测结果有效性确定方法,包括如下步骤:
31.s10,控制移动执行机构驱动检测探针按照常规免疫检测流程进行免疫检测并获得第一检测结果;
32.s20,控制移动执行机构将s10处理后的检测探针浸入到洗脱液中进行洗脱;
33.s30,控制移动执行机构将经过洗脱的检测探针移动到读数孔中,控制读数装置进行读数,获得第二检测结果;
34.s40,根据所述第二检测结果和第一检测结果确定洗脱百分比;
35.s50,判断所述洗脱百分比是否在预制范围内;若是,确定所述免疫类体外诊断试剂检测结果正常;反之,确定所述免疫类体外诊断试剂检测结果异常。
36.免疫类体外诊断试剂检测结果有效性确定系统,包括
37.免疫检测单元,用于控制移动执行机构驱动检测探针按照常规免疫检测方法进行免疫检测并获得第一检测结果;
38.洗脱单元,用于控制移动执行机构将免疫检测单元处理后的检测探针浸入到洗脱液中进行洗脱;
39.再读数单元,用于控制移动执行机构将经过洗脱的检测探针移动到读数孔中,控制读数装置进行读数,获得第二检测结果;
40.计算单元,用于根据所述第二检测结果和第一检测结果确定洗脱百分比;
41.判断单元,用于判断所述洗脱百分比是否在预制范围内;若是,确定所述免疫类体外诊断试剂检测结果正常;反之,确定所述免疫类体外诊断试剂检测结果异常。
42.本发明技术方案的优点主要体现在:
43.本发明通过在原有免疫检测流程的基础上增加洗脱流程,通过计算检测的洗脱百
分比来定量的确定检测结果的有效性,能够在不增加成本的基础上,轻易识别出在免疫检测中无法避免的个别异常结果。从而避免了因异嗜性抗体,人抗鼠抗体,非特异性结合,外源性或者内源性干扰等引起的结果误报。
44.本方案通过对洗脱时间及阈值的精确设计,能够保证最终确认的精度,避免误判的发生。
45.本方案的测试探针通过硅烷偶联剂进行表面改性,同时在包被过程中防潮液进行处理,经过表面改性和防潮处理后,能够有效地延长了测试探针表面的抗体对潮湿环境的抵抗的时间,使得抗体的活性寿命显著延长,从容保证免疫检测时的检测有效性。
附图说明
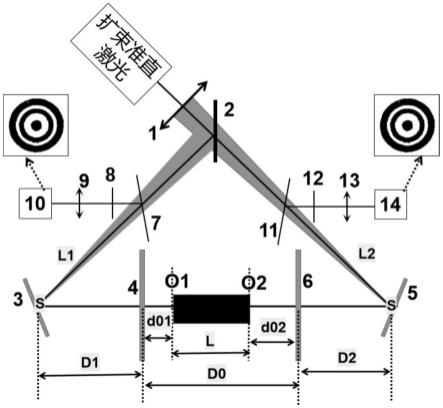
46.图1是本发明中对读数孔中的检测探针进行免疫测试反应读数的原理图。
具体实施方式
47.本发明的目的、优点和特点,将通过下面优选实施例的非限制性说明进行图示和解释。这些实施例仅是应用本发明技术方案的典型范例,凡采取等同替换或者等效变换而形成的技术方案,均落在本发明要求保护的范围之内。
48.在方案的描述中,需要说明的是,术语“中心”、“上”、“下”、“左”、“右”、“前”、“后”、“竖直”、“纯化水平”、“内”、“外”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明的限制。此外,术语“第一”、“第二”、“第三”仅用于描述目的,而不能理解为指示或暗示相对重要性。并且,在方案的描述中,以操作人员为参照,靠近操作者的方向为近端,远离操作者的方向为远端。
49.实施例1
50.下面对本发明揭示的免疫类体外诊断试剂检测结果有效性确定方法进行阐述,发明人经过研究发现,通过洗脱液来洗脱正常检测的免疫复合物后,由于特定抗体和抗原免疫亲和力是一定的,因而同浓度下免疫复合物被清洗下来的比例恒定在一定的范围,而如果是其他如非特异性结果,其他物质干扰,异嗜性抗体干扰等方式结合获得的检测信号,其洗脱比例会在很大程度上与正常的抗原抗体特异性结果区别,通过这个洗脱比例(洗脱百分比)可以区分反应的特异性,并以此来判定结果的有效性。
51.所述确定方法具体包括如下步骤:
52.s0,按照常规免疫检测方法进行免疫检测并获取第一检测结果,具体是按照石英探针模式的荧光免疫检测法进行免疫检测,具体过程如下
53.s01,准备免疫检测所需的检测探针、清洗液、生物素化的检测抗体、链霉亲和素-花青染料5及检测样本;所述检测探针可以是现成的已包被有pct捕获抗体的检测探针,或者也可以进行现场包被来制备检测探针。所述生物素化的检测抗体对应为生物素化的pct检测抗体。
54.s02,通过清洗液对检测探针进行清洗;具体清洗时,将检测探针依次浸入到两个清洗孔中的pbst清洗液中进行两次清洗,每次清洗的时间在45秒左右。
55.s03,清洗后,将检测探针浸入检测样本中反应第一目标时间,所述第一目标时间
在180秒左右。
56.s04,将检测探针由检测样本中取出后通过清洗液进行清洗;具体清洗时,将检测探针依次浸入到三个清洗孔中的pbst清洗液中进行三次清洗,每次清洗的时间在10秒左右。
57.s05,清洗后,将检测探针浸入生物素化的检测抗体中反应第二目标时间,所述第二目标时间在60秒左右。
58.s06,将检测探针由生物素化的检测抗体中取出后通过清洗液进行清洗,具体清洗时,将检测探针依次浸入到三个清洗孔中的pbst清洗液中进行三次清洗,每次清洗的时间在10秒左右。
59.s07,清洗后,将检测探针浸入链霉亲和素-花青染料5中反应第三目标时间,所述第三目标时间在30秒左右。
60.s08,将检测探针由链霉亲和素-花青染料5中取出后通过清洗液进行清洗,具体清洗时,将检测探针依次浸入到三个清洗孔中的pbst清洗液中进行三次清洗,每次清洗的时间在10秒左右。
61.s09,清洗后,将检测探针放入读数孔内进行读数,并获取所述第一检测结果,读数时按照附图1所示的结构和原理进行读数。
62.s1,在获取到免疫检测的第一检测结果后,将经过上述免疫检测的检测探针通过洗脱液进行洗脱;所述洗脱液是pbst缓冲液、tbst缓冲液、mes缓冲液、甘氨酸缓冲液中的至少一种,所述洗脱液的ph值在2~8之间。
63.所述检测探针在洗脱液中洗脱的时间在30~180秒之间。这是由于发明人发现,因不同抗原抗体之间的亲和力有差别,选择合适的时间至关重要,当洗脱低于30秒,则洗脱比例太低,所述检测探针在洗脱液中洗脱的时间超过180秒,则洗脱比例太大,这都会导致无法区别特异性或者非特异性结合,即失效判断。
64.s2,将洗脱后的检测探针浸入读数孔中,通过读数设备进行读数,获得第二检测结果。
65.s3,根据第一检测结果及第二检测结果求出洗脱百分比;具体计算时,按照如下公式计算所述洗脱百分比p:
66.p=(q1-q2)/q1%
67.其中,q1为第一检测结果,q2为第二检测结果。
68.s4,确定洗脱百分比是否在阈值范围内,若是,确定所述免疫类体外诊断试剂检测结果正常;反之,确定所述免疫类体外诊断试剂检测结果异常。
69.所述阈值范围优选在24.9%~44.3%之间,这一阈值范围是发明人通过比较正常样本,hama样本,高浓度血红蛋白干扰样本,异嗜性抗体样本在按照上述s0-s5的步骤确定的洗脱百分比并根据一定的标准差从而确定。不同测试样本按照上述s0-s5步骤进行检测后数据统计表如下:
70.[0071][0072]
表(1):不同浓度的正常样本按照上述s0-s5步骤进行检测后数据统表(2):不同特殊样本按照上述s0-s5步骤进行检测后数据统计表
[0073][0074]
表中,f表示检测结果异常。
[0075]
上述整个反应及确认过程可以由人工操作来实现,也可以通过自动化设备来实现整个反应及确认过程,例如可以通过星童医疗技术(上海)或(苏州)有限公司生产的pylon 3d全自动免疫分析系统或pyloniris高速全自动免疫分析系统来实现荧光免疫检测反应及有效性确定的全过程。
[0076]
实施例2
[0077]
本实施例相对于上述实施例1而言,主要创新在于:所述荧光免疫检测中所使用的检测探针在包被过程中经防潮液处理从而具有更强的防潮抗湿性能。
[0078]
所述检测探针按照如下步骤加工得到:
[0079]
步骤一,在石英探针表面沉积硅烷偶联剂;通过已知的气相沉积方法在所述纯石英探针的表面均匀沉积硅烷偶联剂,所述硅烷偶联剂例如是3-氨基丙基三甲氧基硅烷,其提高了探针表面的疏水性,从而可以更高效的吸附蛋白类物质,并且表面的氨基(nh2)可以作为共价偶联的有机基团与蛋白进行共价偶联。
[0080]
步骤二,准备石英探针包被所需的磷酸盐缓冲溶液、降钙素原(pct)抗体溶液、封闭液、一次清洗液、二次清洗液及防潮液。
[0081]
所述降钙素原(pct)的浓度为20ug/ml。所述封闭液可以是已知的可行材料,例如是bsa封闭液,此处不作限定。所述清洗液可以是已知的可行材料,例如是pbst溶液,此处不作限定。
[0082]
所述防潮液包括0.01~0.1m的缓冲液、0.01%~0.1%(v/v)的表面活性剂、0.01%~0.1%(v/v)防腐剂及1%~20%(m/v)的稳定剂。
[0083]
所述缓冲液主要用于保证该体系的ph值,使其具有一定的酸性,从而防潮液中带正电荷,以此保护硅烷偶联剂中的有机基团(如氨基、巯基等)不会被中和或者水解。所述缓冲液可以是醋酸-醋酸钠缓冲液或mes缓冲液,优选为醋酸-醋酸钠缓冲液。
[0084]
所述醋酸-醋酸钠缓冲液使所述防潮液的ph值保持在4.0~6.5左右,这是由于发明人研究发现:ph值超过6.5时,会导致硅烷类粘合剂水解或者被中和,从而导致其表面失去疏水性,无法固定蛋白等物质;而ph值低于4.0时,则会导致酸性过强,固定的蛋白类物质被变性从而失活。同时,在ph值较低时,例如ph值在大于4.0,小于5.5时,醋酸-醋酸钠缓冲液缓冲能力更强,可以更好抵抗大部分样品、空气或者水分等的干扰。
[0085]
所述表面活性剂主要是为了降低石英探针表面的张力,在石英探针表面形成束胶,对胶束内部的憎水基团产生保护作用,避免固定化的酶类或者蛋白类物质变性。较优的,所述表面活性剂是曲拉通x-100、曲拉通x-405及吐温-20中的至少一种,较优为吐温-20,其能够增加亲水性,阻止非特异结合,发明人经过研究发现,当所述吐温-20过少则无法起到抵抗非特异的作用,其过多则会影响蛋白质之间结合。
[0086]
所述稳定剂主要是为了使固定化的酶类或者蛋白类物质可以保持相对稳定,不会因为表面的处理措施而变性或者失活。所述稳定剂是海藻糖、甘露醇、蔗糖中的至少一种,优选是蔗糖,这是由于相比之下,蔗糖水溶性和稳定性更好,并且会在基质表面形成涂层隔绝空气,从而保护和硅烷粘合剂结合的蛋白类物质,防止被空气氧化变性。
[0087]
在进行所述防潮液配置时,按照以下过程操作:
[0088]
步骤a,准备蔗糖、冰醋酸、吐温-20、防腐剂、纯化水及氢氧化钠溶液;其中,蔗糖的纯度》98%,可以采用sigma品牌的相应产品;吐温-20,可以采用sigma品牌的相应产品;冰醋酸的纯度》99.9995%,采用国药集团生产的相应产品;氢氧化钠溶液的纯度》96%,可以采用ar,国药集团生产的相应产品;proclin300(防腐剂),可以采用sigma品牌的相应产品。
[0089]
步骤b,将预定量的蔗糖置于容器中,加入预定量的冰醋酸、吐温-20、防腐剂,然后加纯化水至指定体积得到混合物;
[0090]
步骤c,通过磁力搅拌器对s2得到混合物进行搅拌;
[0091]
步骤d,向经过搅拌的混合液中添加氢氧化钠溶液以将混合液的ph调节至目标范围后,定容至目标体积得到防潮液。
[0092]
以配制1l防潮液为例,不同配方的具体组分及含量如下表:
[0093][0094]
[0095]
具体配置时,以配方1防潮液的配置过程为例进行说明,其过程如下:
[0096]
用电子天平称取150g蔗糖,放入烧杯中;
[0097]
向烧杯中加入6ml冰醋酸,0.5ml吐温-20,0.5ml的proclin300,然后加纯化水至900ml得到混合物,
[0098]
通过磁力搅拌器将混合物搅拌混匀后,用10n的naoh溶液调节ph至相应范围,用容量瓶定容至1l后,得到所述防潮液。
[0099]
配方2、配方3的防潮液的制备过程同上述配方1,此处不作赘述。
[0100]
步骤三,在各种所需材料准备到位后,对所述石英探针进行包被处理,对应步骤如下:
[0101]
将上述的沉积有硅烷偶联剂的石英探针安装到探针托架中,石英探针在探针托架上的分布形式与96孔板的孔分布形式和孔间距一致。
[0102]
将包被用的磷酸盐缓冲溶液,pct抗体溶液,封闭液,一次清洗液、二次清洗液及防潮液分别按照250ul分装至96孔板内。
[0103]
将装有磷酸盐缓冲溶液的96孔板固定在晃动台上,将探针托架固定在晃动台上,并使探针托架上的石英探针浸没到所述96孔板的磷酸盐缓冲溶液中,晃动台以设定的速度晃动第一目标时间,所述第一目标时间可以根据需要设计,例如10秒。
[0104]
晃动台晃动第一目标时间后,从晃动台上取下探针托架及装有磷酸盐缓冲溶液的96孔板;将装有pct抗体溶液的96孔板固定在晃动台上,将探针托架固定在晃动台上,并使探针托架上的石英探针浸没到所述96孔板的磷酸盐缓冲溶液中,晃动台以设定的速度晃动第二目标时间,所述第二目标时间可以根据需要设计,此处优选在170-200秒之间,较优的在180秒左右。
[0105]
晃动台晃动第二目标时间后,从晃动台上取下探针托架及装有pct抗体溶液的96孔板;将装有封闭液的96孔板固定在晃动台上,将探针托架固定在晃动台上,并使探针托架上的石英探针浸没到所述96孔板的封闭液中,晃动台以设定的速度晃动第三目标时间,所述第三目标时间可以根据需要设计,此处优选在60秒左右。
[0106]
晃动台晃动第三目标时间后,从晃动台上取下探针托架及装有封闭液的96孔板;将装有一次清洗液(pbst溶液)的96孔板固定在晃动台上,将探针托架固定在晃动台上,并使探针托架上的石英探针浸没到所述96孔板的一次清洗液中,晃动台以设定的速度晃动第四目标时间,所述第四目标时间可以根据需要设计,此处优选在10秒左右。
[0107]
晃动台晃动第四目标时间后,从晃动台上取下探针托架及装有一次清洗液的96孔板;将装有二次清洗液(pbst溶液)的96孔板固定在晃动台上,将探针托架固定在晃动台上,并使探针托架上的石英探针浸没到所述96孔板的二次清洗液中,晃动台以设定的速度晃动第四目标时间,所述第四目标时间可以根据需要设计,此处优选在10秒左右。
[0108]
晃动台晃动第五目标时间后,从晃动台上取下探针托架及装有二次清洗液的96孔板;将装有防潮液的96孔板固定在晃动台上,将探针托架固定在晃动台上,并使探针托架上的石英探针浸没到所述96孔板的防潮液中,晃动台以设定的速度晃动第六目标时间,所述第六目标时间可以根据需要设计,此处优选在20-40秒之间,更优为30秒,处理完毕后,将探针托架从晃动台上取下,完成石英探针的包被。
[0109]
步骤四,将完成包被的石英探针烘干后得到检测探针并进行存储。烘干时,将检测
探针从探针托架上取出,在40℃温度条件下烘干4小时左右,烘干可以在烘干箱内进行。
[0110]
为了方便对比,将经普通缓冲液进行包被处理得到的检测探针分别与经上述三种配方的防潮液进行包被处理得到的检测探针分别裸露在饱和氯化钾制备的87%左右湿度的环境中约4小时,8小时,24小时,48小时后进行荧光免疫检测并对检测荧光信号进行比较。具体荧光免疫检测的过程和原理同上s0过程,此处不作赘述。
[0111]
免疫测试后,分析检测荧光信号的差异,具体如下表(3)、(4)、(5)。
[0112]
表(3):经配方1的防潮液与普通缓冲液处理的两种检测探针进行免疫测试的检测荧光信号数据表:
[0113][0114][0115]
表(4):经配方2的防潮液与普通缓冲液处理的两种检测探针进行免疫测试的检测荧光信号数据表:
[0116][0117][0118]
表(5):经配方3的防潮液与普通缓冲液处理的两种检测探针进行免疫测试的检测荧光信号数据表:
[0119][0120]
通过上述表(3)、(4)、(5)的数据可以看出,相对于未经防潮液处理的检测探针,经过防潮液处理的检测探针在较大潮湿环境中储存后,在免疫检测中使用时,读取到的检测荧光信号明显更多,检测结果更有效,精度更高;且不同次检测结果的偏差很小,一致性高。
[0121]
按照本实施例的包被方法获取的检测探针在通过硅烷偶联剂进行表面改性后,在包被过程中,增加了浸入防潮液的过程,从而在检测探针烘干后,显著延长了通过硅烷偶联剂固定与玻璃纤维类基质表面的抗原或抗体对湿度抵抗的时间,使得抗原或抗体的活性寿命显著延长。
[0122]
实施例3
[0123]
本实施例揭示了一种免疫类体外诊断试剂检测结果有效性确定方法,本方法是基于上述的pylon 3d全自动免疫分析系统或pylon iris高速全自动免疫分析系统,该方法包括如下步骤:
[0124]
s10,控制移动执行机构驱动检测探针按照常规免疫检测流程进行免疫检测并获得第一检测结果;所述免疫检测流程即通过移动执行机构驱动测试探针按照上述s0的检测
过程进行检测,此处不作赘述。
[0125]
s20,控制移动执行机构将s10处理后的检测探针浸入到洗脱液中进行洗脱;即将第一次读数后的检测探针进行洗脱。
[0126]
s30,控制移动执行机构将经过洗脱的检测探针移动到读数孔中,控制读数装置进行读数,获得第二检测结果。
[0127]
s40,根据所述第二检测结果和第一检测结果确定洗脱百分比;具体计算过程同实施例1,此处不作赘述。
[0128]
s50,判断所述洗脱百分比是否在预制范围内;若是,确定所述免疫类体外诊断试剂检测结果正常;反之,确定所述免疫类体外诊断试剂检测结果异常。
[0129]
实施例4
[0130]
本实施例揭示了一种免疫类体外诊断试剂检测结果有效性确定系统,包括
[0131]
免疫检测单元,用于控制移动执行机构驱动检测探针按照常规免疫检测方法进行免疫检测并获得第一检测结果;
[0132]
洗脱单元,用于控制移动执行机构将免疫检测单元处理后的检测探针浸入到洗脱液中进行洗脱;
[0133]
再读数单元,用于控制移动执行机构将经过洗脱的检测探针移动到读数孔中,控制读数装置进行读数,获得第二检测结果;
[0134]
计算单元,用于根据所述第二检测结果和第一检测结果确定洗脱百分比;
[0135]
判断单元,用于判断所述洗脱百分比是否在预制范围内;若是,确定所述免疫类体外诊断试剂检测结果正常;反之,确定所述免疫类体外诊断试剂检测结果异常。
[0136]
本发明尚有多种实施方式,凡采用等同变换或者等效变换而形成的所有技术方案,均落在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。