一种d-阿洛酮糖3-差向异构酶突变体的筛选方法及其应用
技术领域
1.本发明涉及一种d-阿洛酮糖3-差向异构酶突变体的筛选方法及其应用,属于酶工程技术领域。
背景技术:
2.近年来,因为过度食用高糖、高脂肪类食物导致人们体重过度增长,导致肥胖症、糖尿病、高血压和高血脂等慢性疾病的发病率激增。因此,具有特殊功效的低能量稀少糖逐渐成为研究热点。d-阿洛酮糖作为一种新型功能性稀少糖,日本厚生省批准可应用于食品生产中,并于2011年3月注册了阿洛酮糖的商标并正式申请了特定保健食品。美国食品药物管理局(fda)也认定d-阿洛酮糖为食品安全级gras。
3.d-阿洛酮糖,具有高甜度(蔗糖甜度的70%)和极低能量(蔗糖热量的0.3%),且不易被消化吸收。此外,临床和动物研究表明,d-阿洛酮糖可以降低饭后血糖升高;还可以通过竞争糖转运蛋白从而减少果糖和葡萄糖的吸收,改善胰岛素敏感性,减少脂肪堆积;d-阿洛酮糖还具有降血糖,降血脂,抗炎,清除活性氧自由基,保护神经等重要功效,是一种有效抗肥胖和糖尿病的重要甜味剂,同时它还能改善食物质地,提高食品凝胶的持水能力并通过美拉德反应提供令人愉悦的风味,所以其在医学、营养保健、食品生产等方面具有较高的生产价值。
4.d-阿洛酮糖在自然界中含量极少,仅存在于少量植物(小麦和鼠刺属植物)中。因此,从自然界中分离提取产量低,成本高,难以满足人们对低热量健康甜味剂日益增长的需求。而化学合成制备法易形成副产物,并且易造成环境污染。因此,高效环保的生物酶法收到越老越多的关注。
5.目前能够将d-果糖转化为d-阿洛酮糖的酮糖3-差向异构酶主要有d-塔格糖3-差向异构酶(d-tagatose 3-epimerase,dtease)以及d-阿洛酮糖3-差向异构酶(d-psicose 3-epimerase,dpease),因为dpease相比于dtease通常具有更高的d-果糖转化率,因此dpease是常用的d-阿洛酮糖制备用酶。dpease可催化d-果糖c3位上的可逆的羟基差向异构化反应,生产d-阿洛酮糖。目前已发现agrobacterium tumefaciens、clostridium cellulolyticum、desmospora sp.、ruminococcus sp.等来源的dpease。目前对提高dpease热稳定性的研究较多,对提高dpease比活的研究较少,为了降低d-阿洛酮糖制备过程中的生产成本,研究如何有效提高dpease的比活具有重要意义。
技术实现要素:
6.基于研究现状,本发明通过酶的定向进化技术对clostridium cellulolyticum来源的dpease进行分子改造,获得比酶活提高的突变体。
7.本发明的第一个目的是提供一种重组质粒,所述重组质粒携带编码阻遏蛋白psir的基因、启动子ppsir、编码荧光蛋白egfp的基因和编码野生型d-阿洛酮糖3-差向异构酶的基因dpe。
8.在一种实施方式中,所述启动子ppsir位于阻遏蛋白psir的下游,所述egfp基因连接在ppsir启动子下游,所述dpease位于egfp基因的下游并由启动子ptac i启动。
9.在一种实施方式中,所述阻遏蛋白psir可与启动子ppsir特异性结合,抑制下游egfp的表达;d-果糖经dpease转化成d-阿洛酮糖后,可与psir特异性结合,继而解除其对ppsir启动子的抑制作用,荧光蛋白egfp得以表达。
10.在一种实施方式中,所述重组质粒以大肠杆菌表达载体为骨架,包括但不限于pet系列,或psb1c3,或prsfduet,或pcdfduet质粒。
11.在一种实施方式中,所述基因dpe核苷酸序列如seq id no.2所示,所述编码阻遏蛋白psir的核苷酸序列如seq id no.3所示、启动子ppsir的核苷酸序列如seq id no.4所示。
12.本发明第二个目的是提供一种dpease突变体的筛选方法,主要包括以下步骤:
13.(1)以上述重组质粒为模板进行针对dpe的易错pcr,并将得到的pcr产物连接至重组质粒;将所述产物转化至大肠杆菌中,并涂布抗性平板上,洗板并提取混合质粒,构建突变体基因文库;
14.(2)将突变体基因文库转化至大肠杆菌中,诱导表达重组大肠杆菌细胞,进行流式细胞分选,将分选得到的荧光值高的单细胞分别涂布至抗性平板上;
15.(3)挑取单克隆接种至多孔培养板中培养,诱导表达突变体,测定荧光值;
16.(4)将步骤(3)筛选到的荧光值高于野生型的突变体进行测序。
17.在一种实施方式中,步骤(2)中将种子液转入培养基中培养至od
600
达到0.5-0.6,加入诱导剂后诱导表达4h获得发酵液;将发酵液离心去上清,用鞘液稀释至od
600
为0.1-0.3,进行流式细胞分选,将分选得到的荧光值高的单细胞分别涂布至抗性平板上,于37℃培养8-10h。
18.在一种实施方式中,步骤(3),具体是在多孔培养板中培养10-12h,再以5%的接种量转接至多孔培养板的对应位置,在37℃、750r
·
min-1
下培养3h后,加入诱导剂,继续37℃、750r
·
min-1
下表达8h;离心取上清,使用缓冲液重悬菌体,测定488/507nm处的荧光值。
19.在一种实施方式中,所述诱导表达重组大肠杆菌细胞为添加终浓度1mm iptg以及终浓度1m的果糖。
20.在一种实施方式中,步骤(1)所述大肠杆菌为e.coli jm109,步骤(2)所述大肠杆菌为e.coli bl21(de3)。
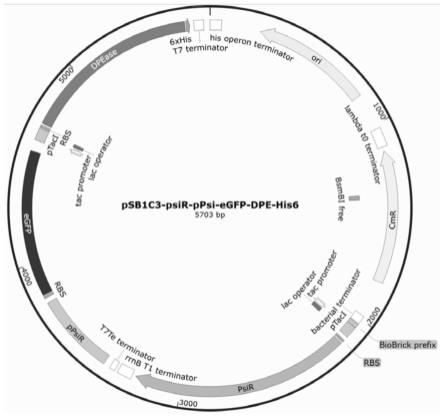
21.本发明还保护上述重组质粒或dpease突变体筛选方法在筛选dpease突变体方面的应用。
22.本发明的第三个目的是提供一种d-阿洛酮糖3-差向异构酶突变体,所述突变体是对氨基酸序列为seq id no.1所示的dpease的第206位甘氨酸或第207位组氨酸突变得到的。
23.在一种实施方式中,所述突变体是以氨基酸序列为seq id no.1所示的dpease的第206位的甘氨酸突变成组氨酸;或第206位的甘氨酸突变成天冬酰胺;或第206位的甘氨酸突变成天冬氨酸;或第206位的甘氨酸突变成精氨酸;第206位的甘氨酸突变成丙氨酸;第206位的甘氨酸突变成丝氨酸;或第207位的组氨酸突变成亮氨酸;或第207位的组氨酸突变成赖氨酸;或第207位的组氨酸突变成异亮氨酸;或第207位的组氨酸突变成精氨酸;或第
207位的组氨酸突变成缬氨酸;或第207位的组氨酸突变成丙氨酸。
24.在一种实施方式中,所述dpease来源于clostridium cellulolyticum。
25.本发明第四个目的是提供含有所述dpease突变体的重组质粒。
26.本发明第五个目的是提供表达上述dpease突变体或上述重组质粒的重组菌。
27.在一种实施方式中,所述重组菌的宿主细胞包括但不限于大肠杆菌、枯草芽孢杆菌、毕赤酵母。
28.本发明第六个目的是提供一种制备d-阿洛酮糖的方法,所述方法为以d-果糖为底物,将上述dpease突变体或上述重组菌加入含有d-果糖的反应体系中,得到d-阿洛酮糖。
29.在一种实施方式中,所述方法的反应条件为:以300~500g
·
l-1
d-果糖为底物,向缓冲液中加入上述dpease突变体或上述重组菌,转速120~180rpm,45℃~70℃反应3~12h。
30.在一种实施方式中,所述缓冲液为20mm hepes,0.1mm co
2
。
31.本发明第七个目的是提供一种dpease突变体或上述重组质粒或上述重组菌在制备d-阿洛酮糖中的应用。
32.本发明还保护所述方法制备的d-阿洛酮糖在食品、医药和保健品领域的应用。
33.有益效果:本发明的超高通量筛选方法的通量为108/天,有效提高了dpease突变体的筛选效率。将clostridium cellulolyticum来源的dpease(氨基酸序列为seq id no.1所示)通过定向进化获得比活提高的突变体,当第206位甘氨酸或第207位组氨酸发生突变能有效改善dpease的比活,其比活是野生型的1.03-1.83倍,具有极高的工业应用潜力。
附图说明
34.图1超高通量筛选质粒图谱。
具体实施方式
35.实施例1:dpease突变体文库的建立
36.分别合成阻遏蛋白psir的基因、启动子ppsir、编码荧光蛋白egfp的基因以及编码dpease的dpe基因序列,通过megawhop将各个序列按相应顺序串联在载体psb1c3上,构建超高通量筛选质粒psb1c3-psir-ppsir-egfp-dpe-his6(如图1所示)。同时,优化易错pcr体系中的mn
2
浓度:0.05mm、0.08mm、0.1mm、0.15mm。
37.根据优化后的易错pcr反应条件,以psb1c3-psir-ppsi-egfp-dpe-his6为模板,以f1、r1为引物对dpe基因进行易错pcr,pcr产物用1%琼脂糖凝胶电泳验证,正确后胶回收易错pcr产物作为megaprimer,通过megawhop连接至psb1c3-psir-egfp-dpe-his6。
38.引物序列如下:
39.f1:5
′‑
atgaaacatggcatctatta-3
′
;
40.r1:5
′‑
gctatgtttatgacattcta-3
′
。
41.megawhop产物经dpn i消化处理后转化至e.coli jm109感受态细胞中,并涂布lb氯霉素抗性平板上洗板并提取混合质粒,构建突变体基因文库。
42.实施例2:dpease突变体的超高通量筛选
43.本研究采用经过优化的超高通量(108/天)筛选技术对突变文库进行筛选,具体实
验方案如下:
44.将实施例1构建的突变体基因文库转化至e.coli bl21(de3)感受态细胞中,复苏1h后接种至10ml lb(30μg
·
ml-1
氯霉素)在37℃、200r
·
min-1
下过夜培养。取种子液转入10ml lb培养基中。在37℃、200r
·
min-1
下培养至od
600
达到0.5-0.6,加入终浓度为1mm iptg以及终浓度为1m的果糖后继续在37℃、200r
·
min-1
摇床中表达4h。
45.流式细胞仪分选样品制备:将上述诱导表达后的发酵液12000rpm,1min离心去上清,用鞘液(pbs溶液,ph 7.4)洗涤三遍后稀释至od
600
为0.1-0.3,进行流式细胞分选,将分选得到的荧光值前3%的细胞分别涂布至lb氯霉素抗性平板上,于37℃培养箱中倒置培养8-10h。
46.实施例3:突变体的96孔板复筛
47.种子培养:从上述含有流式细胞术分选得到的单细胞的lb氯霉素抗性平板上挑选单克隆接种到含有150μl lb液体培养基的96孔平底浅孔板中(30μg
·
ml-1
氯霉素),同时接来源于clostridium cellulolyticum的野生型dpease(a1,a2,d6,d7,h11,h12孔),在37℃、750r
·
min-1
下振荡培养10-12h。
48.96孔板表达:无菌条件下,将上述96孔平底浅孔板中的种子液以5%的接种量转接至每孔装有750μl lb培养基的96孔深孔板中的对应位置(30μg
·
ml-1
氯霉素),在37℃、750r
·
min-1
下培养3h后,加入终浓度为1mm的iptg以及终浓度为1m的果糖后,继续37℃、750r
·
min-1
下表达8h。96孔平底浅孔板中剩余的菌液加入等体积30%甘油振荡混匀后于-80℃保菌。
49.诱导表达8h后,4000r
·
min-1
离心20min后去上清,用ph7.4 pbs缓冲液洗涤两次后用400μl的pbs缓冲液重悬后用荧光酶标仪测定488/507nm处的荧光值。对数据进行处理分析后,将荧光值高于野生型的突变体进行测序。
50.实施例4:dpease的表达纯化与蛋白浓度测定
51.(1)蛋白表达纯化
52.种子培养:按照2
‰
的接种量,取-80摄氏度下冻存的甘油管,吸取20μl甘油菌至10ml的lb液体培养基中(30μg
·
ml-1
氯霉素),在37℃、200r
·
min-1
下过夜培养。
53.摇瓶发酵:将上述种子液转接至50ml的tb培养基中。在37℃、200r
·
min-1
下培养至od
600
达到0.5-0.6,加入终浓度为1mm iptg,25℃、200r
·
min-1
下诱导表达24h。
54.发酵液8000rpm,离心15min去上清,用buffer 1(50mm ph 7.4pbs缓冲液)重悬菌体。高压匀浆机预先用20%酒精清洗三次,再用去离子水洗三次后破壁重悬后的菌体,压力在800-900bar之间。将细胞破碎液在4℃、8000rpm下离心15min,收集上清液,并用0.22μm的滤膜过滤处理。
55.预先使用至少10倍柱体积buffer 1冲洗ni
2
层析柱,然后使过滤后的粗酶液缓慢上样,重复挂柱三次。分别用300ml 10mm咪唑溶液(用buffer 1配置)、150ml 50mm咪唑溶液、75ml 100mm咪唑溶液洗脱杂蛋白,然后用40ml 200mm以及40ml 300mm咪唑溶液洗脱目的蛋白,最后用buffer 2(500mm咪唑溶液)充分洗脱残余蛋白。
56.在4℃下,用10kda超滤管对洗脱液进行超滤,并用20mm hepes,ph 7.5,0.1mm co
2
缓冲液置换pbs缓冲液。
57.(2)蛋白浓度的测定
58.缓冲液:20mm hepes,ph 7.5,0.1mm co
2
。
59.蛋白浓度标准曲线的绘制:用缓冲液将5mg
·
ml-1
蛋白标准品稀释成0、0.125、0.25、0.5、0.75、1、1.5mg
·
ml-1
,各取5μl不同浓度的蛋白标准样品加到96孔板中,各孔加入250μl g250染色液,用酶标仪测定595nm下的吸光值。以蛋白浓度(mg
·
ml-1
)为横坐标,以吸光值为纵坐标绘制蛋白浓度标曲线。
60.蛋白浓度的测定:将纯化后的样品倍比稀释并测定系列浓度:取5μl稀释至不同浓度的样品加到96孔板中,各孔加入250μl g250染色液,用酶标仪测定595nm下的吸光值。将吸光值代入蛋白浓度标准曲线计算得到纯化后样品未稀释的原始浓度。
61.实施例5:突变体酶活测定
62.酶活测定:以20mm hepes,ph 7.5,0.1mm co
2
为缓冲液配置100g
·
l-1
d-果糖作为底物,取800μl底物溶液置于1.5ml ep管中,于60℃下预热10min。加入200μl用缓冲液适当稀释的实施例4获得的纯化后的dpease突变体,混合均匀后准确反应10min,沸水浴10min终止反应。将样品离心后用0.22μm水系滤膜过滤,经高效液相色谱(hplc)检测d-阿洛酮糖的含量。
63.酶活力单位定义:在ph 7.5,60℃下,每分钟产生1μmol的d-阿洛酮糖即为一个酶活力单位(u)。
64.酶活与蛋白浓度的比值即为酶的比活。
65.表1野生型dpease及突变体发酵酶活及比活
[0066][0067]
实施例6dpease突变体发酵生产d-阿洛酮糖
[0068]
反应体系:以300g
·
l-1
d-果糖为底物,加入实施例4制备的30u
·
ml-1
dpease突变
体,55℃,150rpm,发酵4h。使用hplc方法检测样品中d-阿洛酮糖的含量为84g
·
l-1
,转化率为28%
[0069]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。