基于CRISPR技术的光电化学-比色双模式传感器检测Cry1Ab的方法
- 国知局
- 2024-07-30 11:12:48
本发明属于生物传感器,具体涉及基于crispr技术的光电化学-比色双模式传感器检测cry1ab的方法。
背景技术:
1、以转cry1ab基因抗虫玉米为代表的转基因作物在我国正处于批准商业化种植的关键时期,转基因作物安全评估和监管工作十分紧迫,但cry1ab蛋白检测存在基质复杂、环境因素干扰多等难题。因此,依据农业实际检测需求,有必要开发精准的生物传感器检测转基因作物中的cry1ab蛋白,应用于农产品质量监测领域。
2、在光学生物传感器中,通过耦合不同半导体的优点形成的异质结是光动力材料研究的一个热点。由于异质结有效可行的电子-空穴分离特性,异质结工程是改善光学生物传感器中光收集、电荷分离和电荷转移的一种有前途的方法。异质结的界面参数,如扩散距离、接触面积和界面驱动力,主导着载流子的分离效率。因此,改善异质结的界面参数以调节界面载流子的迁移,对于驱动高性能光学生物传感器的信号响应至关重要。
技术实现思路
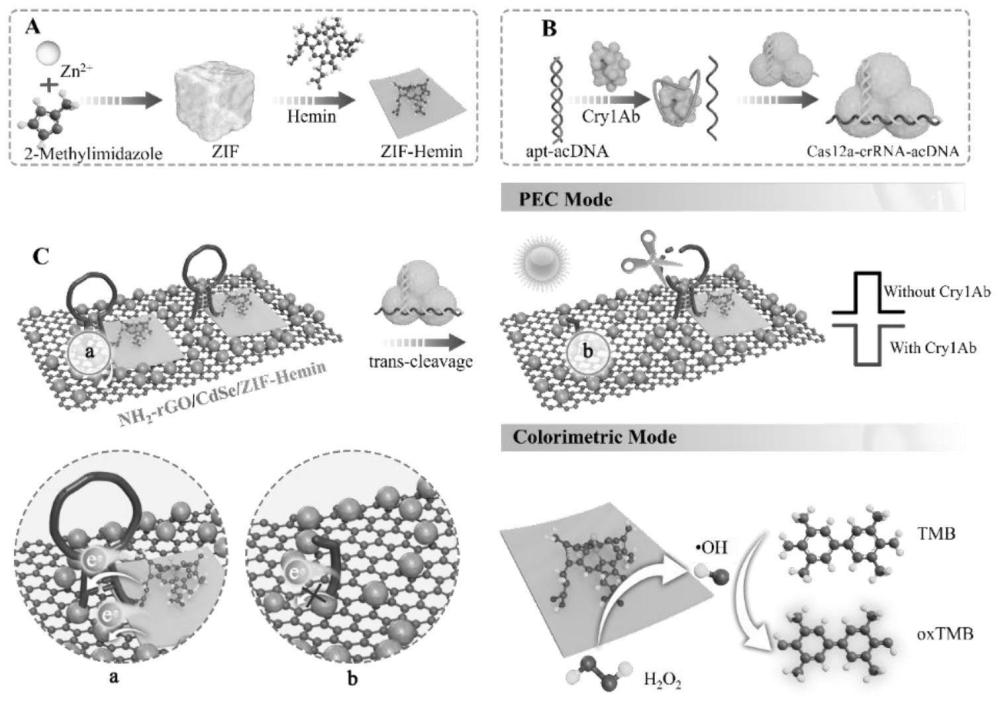
1、针对现有技术的不足,本发明提供了基于crispr技术的光电化学-比色双模式传感器检测cry1ab的方法,具体涉及一种基于crispr-cas12a剪切zif基异质结的光电化学-比色双模式传感器用于转基因作物中cry1ab蛋白的检测方法。
2、提供一种极性切换的光电化学(pec)和纳米酶赋能的比色双模生物传感器,利用茎环dna(slp)的类“加强筋”作用和crispr-cas12a的高效切割去调控沸石咪唑酯骨架(zif)基异质结的界面载流子迁移,用于cry1ab蛋白的精准检测。基于slp的类“加强筋”作用,增强了zif基异质结的结合和加速zif基异质结的界面载流子迁移。cry1ab蛋白存在时,crispr-cas12a系统被激活去切割zif基异质结,使异质结解体和其界面载流子迁移消失。此时,光电流方向发生极性切换,由阳极光电流转换为阴极光电流。同时,zif基异质结的解体释放二维超薄片状zif-hemin,zif-hemin作为纳米酶加速3,3′,5,5′-四甲基联苯胺(tmb)氧化为oxtmb,产生比色信号。本发明提供了一种通过调控异质结中界面载流子的迁移以提高光学生物传感器性能的通用策略。
3、为了实现以上目的,本发明包括以下技术方案:
4、(1)nh2-rgo溶液的制备:
5、首先,将还原氧化石墨烯(rgo)加入到乙醇水溶液中,超声分散均匀;并在搅拌条件下,依次加入(3-氨基丙基)三乙氧基硅烷(aptes)、乙二胺和盐酸(hcl),继续搅拌一段时间,得到混合溶液;然后经离心收集沉淀物,分别用乙醇和超纯水离心洗涤,洗涤后的沉淀物再经干燥,得到氨基化rgo,记为nh2-rgo;最后,将nh2-rgo重新分散到超纯水中,得到nh2-rgo溶液;
6、(2)cdse qds溶液的制备:
7、(a)在氮气保护下,将硒粉和硼氢化钠溶解于超纯水中,获得硒氢化钠前驱体;
8、(b)在氮气保护下,将氯化铬溶于超纯水中,然后加入3-巯基丙酸,形成混合液;调节ph后的混合液记为溶液a;在溶液a中通氮气一段时间后,再加入步骤(a)制备的硒氢化钠前驱体,所得混合溶液在微波合成仪中反应,反应后的溶液记为溶液b;将无水乙醇与溶液b混合,静置一段时间后经离心收集沉淀物,用无水乙醇离心洗涤,洗涤后的沉淀物经烘干后重新分散在超纯水中,得到cdse qds溶液;
9、(3)nh2-rgo/cdse溶液的制备:
10、将步骤(1)制备的nh2-rgo溶液与步骤(2)制备的cdse qds溶液混合,搅拌过夜,获得nh2-rgo/cdse溶液;
11、(4)zif-hemin-slp溶液的制备:
12、(a)将zn(no3)2·6h2o和2-甲基咪唑分别溶于超纯水中,超声分散均匀,得到zn(no3)2溶液和2-甲基咪唑溶液;在搅拌条件下,将zn(no3)2溶液加入2-甲基咪唑溶液中,继续搅拌一段时间,然后经离心收集沉淀物,再将沉淀物分别用超纯水和乙醇离心洗涤、真空干燥后获得zif固体粉末;
13、(b)将zif固体粉末加入超纯水中,超声分散均匀,得到zif溶液;将溶于二甲基亚砜的血红素(hemin)加入到zif溶液中,搅拌反应一段时间后,经离心收集沉淀物;用二甲基亚砜离心洗涤,将洗涤后的产物重新分散于超纯水中,获得zif-hemin溶液;
14、(c)将zif-hemin溶液与含1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)和n-羟基琥珀酰亚胺(nhs)的磷酸盐缓冲溶液(pbs)混合,进行第一次搅拌反应(以激活hemin的羧基),反应后加入茎环dna(slp)继续搅拌反应,反应后经离心获得产物为zif-hemin-slp;最后,将zif-hemin-slp重新分散在超纯水中,获得zif-hemin-slp溶液;
15、(5)活化crispr-cas12a溶液的制备:
16、将cry1ab蛋白的适配体与激活dna(acdna)进行杂交反应生成双链dna记为dsdna;然后在dsdna中加入cry1ab蛋白标准液,所得到的混合液记为混合液a;
17、然后将cas12a、crrna和1×buffer混合后,记为混合液b,经孵育后得到未活化的crispr-cas12a;最后将混合液a添加到未活化的crispr-cas12a中,在一定温度下活化,获得活化crispr-cas12a溶液;
18、(6)将步骤(3)制备的nh2-rgo/cdse溶液修饰到ito电极表面,经孵育后的产品标记为ito/nh2-rgo/cdse;
19、(7)将步骤(4)制备的zif-hemin-slp溶液修饰到步骤(6)所获得的传感器表面,经孵育后的产品标记为ito/nh2-rgo/cdse/zif-hemin-slp;
20、(8)将步骤(5)制备的活化crispr-cas12a溶液修饰到步骤(7)所获得的传感器表面,经孵育后的产品标记为ito/nh2-rgo/cdse/zif-hemin-slp/crispr-cas12a;
21、(9)用hepes缓冲溶液冲洗步骤(8)制备的ito/nh2-rgo/cdse/zif-hemin-slp/crispr-cas12a电极表面,收集清洗后的hepes缓冲溶液;然后将h2o2和tmb依次加入清洗后的hepes缓冲溶液中,反应一段时间后,得到混合液c,采集混合液c的比色信号,并以cry1ab蛋白标准液的浓度作为横坐标,比色信号作为纵坐标,建立标准曲线;
22、(10)将步骤(9)用hepes缓冲溶液冲洗过的传感器进行光电化学测试,得到光电化学信号;以cry1ab蛋白标准液的浓度作为横坐标,光电化学信号作为纵坐标,建立标准曲线;
23、(11)实际样品cry1ab蛋白的检测:首先获取待测液,然后按照步骤(5)-(10)的操作,区别是将不同浓度的cry1ab蛋白标准液替换为待测液,最后获取比色信号和光电化学信号,代入对应的标准曲线,即可实现未知样品中cry1ab蛋白的检测。
24、优选的,步骤(1)中,所述rgo、乙醇水溶液、aptes、乙二胺和hcl的用量比为5mg:15ml:1g:10μl:20μl;其中乙醇水溶液是乙醇与水以2:1体积比的混合溶液;所述超声分散的时间为1h,继续搅拌的时间为7h;干燥的温度为60℃,时间为24h;nh2-rgo溶液的浓度为0.02mg ml-1。
25、优选的,步骤(2)的(a)中,所述硒粉、硼氢化钠和超纯水的用量关系为7.9mg:7.6mg:5ml;(b)中所述氯化铬、超纯水和3-巯基丙酸的用量关系为45.7mg:50ml:44μl;所述溶液a中3-巯基丙酸与硒氢化钠前驱体中超纯水的体积比为11:1250;
26、所述调节ph是用1m氢氧化钠将溶液ph调至11;所述在溶液a中通氮气一段时间为30min;所述在微波合成仪中反应的温度为100℃,时间为4h;溶液b与无水乙醇的体积比为1:1,静置一段时间为10~60min;cdse qds溶液的浓度为0.4mg ml-1。
27、优选的,步骤(3)中,所述nh2-rgo溶液与cdse qds溶液的体积比为1:1。
28、优选的,步骤(4)中,(a)中所述zn(no3)2·6h2o和超纯水的用量关系为0.1487g:4ml;所述2-甲基咪唑和超纯水的用量关系为0.6586g:4ml;zn(no3)2溶液与2-甲基咪唑溶液混合的体积比为1:1;继续搅拌一段时间为30min;离心的转速和时间为8000rpm,5min;真空干燥条件为60℃,-0.8mpa;
29、(b)中所述zif固体粉末和超纯水的用量关系为25mg:100ml;所述hemin在二甲基亚砜中的终浓度为10mm,zif溶液中的zif固体粉末与二甲基亚砜的用量关系为25mg:1ml,搅拌反应条件为室温、避光、12h;离心转速和时间为8000rpm,15min;
30、(c)中所述zif-hemin溶液与pbs、茎环dna的体积比为1:1:1,其中pbs的浓度为10mm,ph为7.4,edc和nhs在pbs中的终浓度分别为10mm和5mm;所述zif-hemin溶液的浓度为2.5mg ml-1,茎环dna的浓度为5μm;
31、第一次搅拌反应的时间为15min;加入茎环dna继续搅拌反应的时间为2h;离心转速和时间为13000rpm,10min;zif-hemin-slp溶液的浓度为0.5mg ml-1。
32、优选的,步骤(5)中所述cry1ab蛋白的适配体、激活dna(acdna)和cry1ab蛋白标准液的体积比为1:1:1,其中cry1ab蛋白的适配体和激活dna的浓度均为0.1μm;cry1ab蛋白标准液的浓度为0.1pg ml-1~100ng ml-1;所述杂交反应的条件为:37℃,30min;
33、所述混合液b中cas12a的终浓度为100nm,crrna的终浓度为120nm;孵育的条件为37℃,10min;混合液a与未活化的crispr-cas12a混合的体积比为1:3;在一定温度下活化的条件为37℃,20min。
34、优选的,步骤(6)中所述nh2-rgo/cdse溶液修饰的用量为20μl;孵育的条件为37℃,40min;
35、优选的,步骤(7)中所述zif-hemin-slp溶液修饰的用量为20μl;孵育的条件为4℃,6h;
36、优选的,步骤(8)中所述活化crispr-cas12a溶液修饰的用量为20μl,孵育的条件为37℃,80min。
37、优选的,步骤(9)中所述hepes缓冲溶液ph为7.0,浓度为50mm,并含有终浓度为0.1m的kcl;h2o2和tmb的浓度均为10mm;反应一段时间为10min;所述清洗后的hepes缓冲溶液、h2o2和tmb的体积比为7:1:1。
38、优选的,步骤(10)中所述光电化学测试条件为含10mm抗坏血酸的pbs(0.1m,ph7.4)溶液,偏置电压为-0.4v。
39、本发明的有益效果为:
40、(1)本发明首次合成了一种尺寸均匀、表面粗糙的三维立方结构的新型zif。
41、(2)本发明首次合成了一种二维zif-hemin纳米片,其同时具有优异的光电化学和纳米酶催化特性。
42、(3)本发明引入具有加强筋效应的茎环dna,增强了zif基异质结中载流子的结合并加速其界面迁移。
43、(4)本发明基于crispr-cas12a技术对zif基异质结的剪切,导致内在异质结被破坏,界面载流子迁移消失,实现了极性切换的pec信号和纳米酶赋能的比色信号的双信号获取。
44、(5)本发明构建的pec-比色双模式传感器实现了cry1ab蛋白的精准检测,选择性好、线性范围宽(pec:0.1pg ml-1~100ng ml-1;比色:1pg ml-1~30ng ml-1),检测限低(pec:0.05pg ml-1;比色:0.4pg ml-1)。
本文地址:https://www.jishuxx.com/zhuanli/20240730/155786.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表