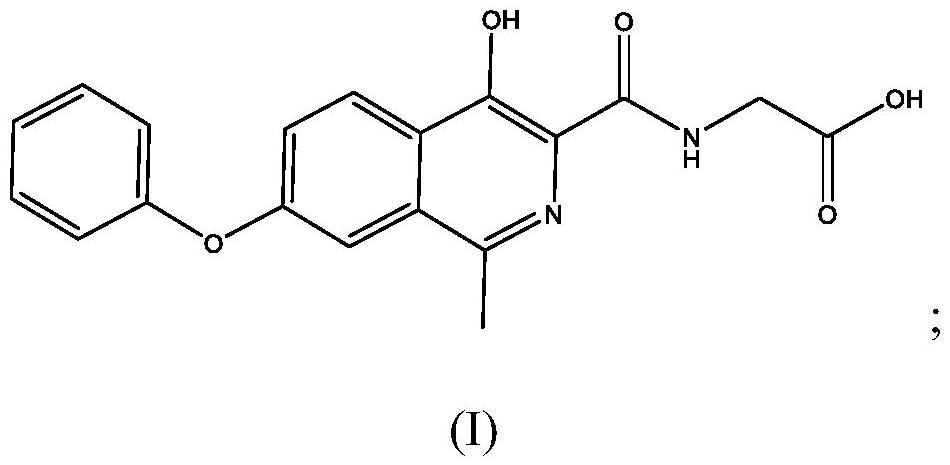
[(4-羟基-1-甲基-7-苯氧基异喹啉-3-羰基)氨基]乙酸(罗沙司他)用于治疗化疗诱导的贫血(CIA)的制作方法
- 国知局
- 2024-09-11 14:25:39
背景技术:
0、发明背景
1、化疗诱导的贫血(cia)是化疗剂的骨髓抑制所致的骨髓产生的红细胞(rbc)减少的结果,从而降低了血红蛋白(hb)水平。虽然一些化疗药物,如顺铂和异环磷酰胺,也可能产生肾毒性,导致内源性促红细胞生成素的产生减少,但是大多数cia患者具有有活跃的肾脏,可以响应化疗药物引起的rbc减少而生成促红细胞生成素。尽管这些患者是贫血的,但是他们往往表现出已经很高的血清促红细胞生成素循环水平,这表明仅增加内源性促红细胞生成素的产生通常不足以治疗cia。因此,不同于由ckd引起的促红细胞生成素缺乏性贫血,化疗诱导的贫血主要是由骨髓中的红系祖细胞增殖缺陷所导致的。
2、据报道,接受骨髓抑制化疗的实体瘤患者中cia的患病率为86-98%,在患有晚期疾病的患者和接受多个治疗周期的患者中患病率更高(xu et al.(2016)clin epidemiol8:61-71)。cia是一个重大的健康负担,与发病率、死亡率和医疗费用的增加以及生活质量的下降相关(xu et al.,supra;busti et al.(2018)pharmaceuticals(basel,switzerland)11:94)。目前cia的处置选择包括促红细胞生成素刺激剂(esa)、红细胞(rbc)输注和铁补充(escobar et al.(2021)clin transl oncol 23:931–939)。然而,由于esa与静脉血栓栓塞和低或慢hb响应率相关,因此建议仅在避免rbc输注所需的最低剂量下用于症状性贫血治疗(escobar et al.,supra;abdel-razeq and hashem(2020)crit revoncol hematol 145:102837;samaras and bennett(2008)am j hematol oncol 7:327–332)。此外,正在接受细胞毒性化疗的患者应避免进行铁补充(escobar et al.,同上)。
3、罗沙司他,一种缺氧诱导因子脯氨酰羟化酶(hif-ph)抑制剂,通过增加内源性促红细胞生成素、提高铁利用率和减少铁调素来促进协调的红细胞生成。在慢性肾病(ckd)患者的多个亚群中,已证明罗沙司他的施用在增加红细胞生成同时将血浆促红细胞生成素水平维持在正常生理范围内或接近正常生理范围内,包括存在炎症的情况下,并且不需要补充的静脉铁剂。ckd患者中的贫血基本上是由于患病肾脏的内源性促红细胞生成素产生减少所致,即,ckd导致促红细胞生成素缺乏性贫血。尽管促红细胞生成素几乎完全由肾脏产生,罗沙司他令人惊讶地展现出增加内源性促红细胞生成素产生的能力,甚至在晚期肾病患者中也是如此。
4、罗沙司他在中国、欧洲、日本和许多其他国家被批准用于治疗接受透析和未接受透析的ckd患者的贫血。在美国进行的一项关于罗沙司他治疗非髓系恶性肿瘤化疗患者贫血的非盲2期研究中,罗沙司他被报告在患者中有效,无论肿瘤类型和化疗方案如何(glaspy et al.(2023)am j hematol 98(5):703-711)。然而,该研究没有将罗沙司他与促红细胞生成素刺激剂(esa)进行比较,也没有试图确定哪些患者会从罗沙司他而不是esa中受益。该研究还受到所涉及受试者的人口统计特征的限制,从而限制了可能得出的针对无代表或代表不足的类别的结论。
5、因此,需要改进在接受骨髓抑制化疗的患者中处置贫血的治疗选择。
技术实现思路
1、本文公开了罗沙司他在制备用于在接受针对非髓系恶性肿瘤的多周期铂类或非铂类骨髓抑制化疗的受试者中治疗化疗诱导的贫血的药物中的用途,其中所述受试者在治疗前具有≤100g/l的血红蛋白水平,并且在化疗开始后所述受试者的血液血红蛋白水平降低至少10g/l。在一些实施方案中,所述受试者在罗沙司他治疗前具有≥20%的转铁蛋白饱和度(tsat)和≥100ng/ml的铁蛋白。在一些实施方案中,所述受试者在罗沙司他治疗前具有≤uln(正常上限,upper limit of normal)的c反应蛋白(crp)水平。在一些实施方案中,所述受试者在罗沙司他治疗前具有≥20%的tsat、≥100ng/ml的铁蛋白和≤uln的crp。在一些实施方案中,所述受试者在罗沙司他治疗前具有≥200u/l的血清促红细胞生成素(epo)水平。在一些实施方案中,所述受试者在罗沙司他治疗前具有≥60ml/min/1.73m2的估算肾小球滤过率(egfr)。在一些实施方案中,所述受试者在罗沙司他治疗前具有≥200u/l的epo水平和≥60ml/min/1.73m2的egfr。在一些实施方案中,所述受试者在罗沙司他治疗前具有≥200u/l的epo水平、≥60ml/min/1.73m2的egfr、≥20%的tsat、≥100ng/ml的铁蛋白和≤uln的crp。
2、在一些实施方案中,所述受试者正在接受多周期铂类骨髓抑制化疗。在一些实施方案中,所述受试者正在接受多周期非铂类骨髓抑制化疗。在一些实施方案中,所述非髓系恶性肿瘤选自乳腺癌、肺癌、胃肠癌、妇科癌症、胰腺癌和头颈癌。在一些实施方案中,所述受试者在治疗开始后接受化疗至少8周。
3、在一些实施方案中,所述受试者在治疗前为≥18岁。在一些实施方案中,所述受试者在治疗前重量≥40kg。在一些实施方案中,所述受试者在治疗前具有为0、1或2的东部肿瘤协作组体能状态(ecog ps)。在一些实施方案中,所述受试者在治疗开始时具有≥6个月的预期寿命。在一些实施方案中,所述受试者年逾18岁、诊断为非髓系恶性肿瘤、体重超过40kg、具有为0、1或2的ecogps;并且在罗沙司他治疗前具有≥6个月的预期寿命。
4、在一些实施方案中,所述药物被说明为以相对于所述受试者体重的罗沙司他剂量为基础施予所述患者。在一些实施方案中,所述受试者具有40至<50kg的体重,并且所述罗沙司他剂量为50-150mg,特别是约100mg。在一些实施方案中,所述受试者具有50至60kg的体重,并且所述罗沙司他剂量为70-200mg,特别是约120mg。在一些实施方案中,所述受试者具有>60kg的体重,并且所述罗沙司他剂量为100-250mg,特别是约150mg。在一些实施方案中,所述受试者具有>60至<80kg的体重,并且所述罗沙司他剂量为100-200mg,特别是约150mg。在一些实施方案中,所述受试者具有≥80kg的体重,并且所述罗沙司他剂量为150-250mg,特别是约200mg。在一些实施方案中,所述剂量为每千克所述受试者体重约1至4mg罗沙司他。在一些实施方案中,所述剂量为每千克所述受试者体重约1至3.5mg罗沙司他。在一些实施方案中,所述剂量为每千克所述受试者体重约1.5至3.5mg罗沙司他。在一些实施方案中,所述剂量为每千克所述受试者体重约2.0至3.5mg罗沙司他。在一些实施方案中,所述剂量为每千克所述受试者体重约2.0至2.5mg罗沙司他,特别是约2.15±0.33mg/kg。
5、在一些实施方案中,所述药物被说明为每周三次施用罗沙司他剂量。在一些实施方案中,所述受试者具有40至<50kg的体重,并且所述罗沙司他以50-150mg、特别是约100mg每周三次施用。在一些实施方案中,所述受试者具有50至60kg的体重,并且所述罗沙司他以70-200mg、特别是约120mg每周三次施用。在一些实施方案中,所述受试者具有>60kg的体重,并且所述罗沙司他以100-250mg、特别是约150mg每周三次施用。在一些实施方案中,所述受试者具有>60至<80kg的体重,并且所述罗沙司他以100-200mg、特别是约150mg每周三次施用。在一些实施方案中,所述受试者具有≥80kg的体重,并且所述罗沙司他以150-250mg、特别是约200mg每周三次施用。
6、在一些实施方案中,所述罗沙司他为结晶形式a,其特征在于x射线粉末衍射图谱包括在8.5、12.8、16.2、21.6、22.9和27.4°2θ±0.2°2θ处的峰。在一些实施方案中,所述罗沙司他为具有21μm至29μm的d90、12μm至17μm的d50和6μm至10μm的d10的单峰粒度分布的固体。在一些实施方案中,所述药物被配制为用于口服施用。在一些实施方案中,所述药物还包含药学上可接受的赋形剂。在一些实施方案中,所述药物被配制在胶囊中。在一些实施方案中,所述胶囊包含20mg罗沙司他。在一些实施方案中,所述胶囊包含50mg罗沙司他。在一些实施方案中,所述胶囊包含胶囊填充物和胶囊壳,其中所述胶囊填充物包含20mg罗沙司他和药学上可接受的赋形剂,所述药学上可接受的赋形剂包含乳糖一水合物、微晶纤维素、聚维酮、交联羧甲基纤维素钠和硬脂酸镁;并且所述胶囊壳为包含二氧化钛、氧化铁黄和明胶的明胶壳。在一些实施方案中,所述胶囊包含胶囊填充物和胶囊壳,其中所述胶囊填充物包含50mg罗沙司他和药学上可接受的赋形剂,所述药学上可接受的赋形剂包含乳糖一水合物、微晶纤维素、聚维酮、交联羧甲基纤维素钠和硬脂酸镁;并且所述胶囊壳为包含诱惑红ac、二氧化钛、氧化铁黄和明胶的明胶壳。
7、在一些实施方案中,所述药物旨在相比于所述药物施用前所述受试者的血红蛋白水平在施用后增加所述受试者中的所述血液血红蛋白水平。在一些实施方案中,所述受试者在治疗期间达到并维持>100g/l至高达130g/l的血红蛋白水平。在一些实施方案中,相比于所述药物施用前所述受试者的血红蛋白水平,施用所述药物后所述受试者的所述血液血红蛋白水平增加≥10g/l,条件是所述血液血红蛋白水平不超过130g/l。在一些实施方案中,相比于所述药物施用前所述受试者的血红蛋白水平,施用所述药物后所述受试者的所述血液血红蛋白水平增加≥15g/l,条件是所述血液血红蛋白水平不超过130g/l。在一些实施方案中,相比于所述药物施用前所述受试者的血红蛋白水平,施用所述药物后所述受试者的所述血液血红蛋白水平增加≥20g/l,条件是所述血液血红蛋白水平不超过130g/l。在一些实施方案中,所述受试者在治疗前具有≤100g/l的血液血红蛋白水平,并且所述受试者在治疗后实现≥100g/l至高达130g/l的血红蛋白水平。
8、在具体的实施方案中,所述药物被说明为用于在接受针对非髓系恶性肿瘤的多周期铂类或非铂类骨髓抑制化疗的受试者中治疗贫血,其中所述受试者在治疗前具有≤100g/l的血液血红蛋白水平,并且包括每周三次口服施予所述受试者100mg至150mg罗沙司他,其中所述受试者在治疗期间实现≥110g/l至130g/l的血红蛋白水平。在一些实施方案中,所述药物被配制在胶囊中,其中所述胶囊包含胶囊填充物和胶囊壳;其中所述胶囊填充物包含20mg罗沙司他、101.84mg乳糖一水合物310、9.36mg微晶纤维素ph101、6.48mg聚维酮k30、5.76mg交联羧甲基纤维素钠和0.56mg硬脂酸镁;并且所述胶囊壳为包含二氧化钛、氧化铁黄和明胶的明胶壳,其中所述二氧化钛以重量计占所述胶囊壳的1%且所述氧化铁黄以重量计占所述胶囊壳的2%。在一些实施方案中,所述药物被配制在胶囊中,其中所述胶囊包含胶囊填充物和胶囊壳;其中所述胶囊填充物包含50mg罗沙司他、254.6mg乳糖一水合物(310)、23.4mg微晶纤维素ph101、16.20mg聚维酮k30、14.40mg交联羧甲基纤维素钠和1.4mg硬脂酸镁;并且所述胶囊壳为包含诱惑红ac、二氧化钛、氧化铁黄和明胶的明胶壳,其中所述诱惑红ac以重量计占所述胶囊壳的1%、所述二氧化钛以重量计占所述胶囊壳的1%且所述氧化铁黄以重量计占所述胶囊壳的1%。在一些实施方案中,所述罗沙司他为结晶形式a,其特征在于x射线粉末衍射图谱包括在8.5、12.8、16.2、21.6、22.9和27.4°2θ±0.2°2θ处的峰。在一些实施方案中,所述罗沙司他具有21μm至29μm的d90、12μm至17μm的d50和6μm至10μm的d10的单峰粒度分布。
9、在具体的实施方案中,所述药物被说明为用于在接受针对非髓系恶性肿瘤的多周期铂类或非铂类骨髓抑制化疗的受试者中治疗贫血,其中所述受试者在治疗前具有≤100g/l的血液血红蛋白水平,并且包括每周三次口服施予所述受试者50mg至400mg罗沙司他,其中,相比于所述罗沙司他施用前所述受试者的血红蛋白水平,所述受试者中的所述血液血红蛋白水平在所述罗沙司他的施用后增加,条件是所述血液血红蛋白水平不超过130g/l;条件是间隔至少2天且间隔不超过4天施用所述罗沙司他;并且在如果所述受试者正在接受紫杉醇作为所述骨髓抑制化疗的一部分,条件是罗沙司他剂量在所述受试者接受所述紫杉醇之前或之后保持24小时。在多个实施方案中,所述药物被说明为提供如本文所公开的基于所述受试者的重量施予所述受试者的罗沙司他的量。
10、在具体的实施方案中,所述药物被说明为用于在接受针对非髓系恶性肿瘤的多周期铂类或非铂类骨髓抑制化疗的受试者中治疗贫血,其中所述受试者在治疗前具有<100g/l的血液血红蛋白水平,并且包括每周三次口服施予所述受试者每千克所述受试者体重2.0至3.5mg罗沙司他,其中,相比于所述罗沙司他施用前所述受试者的血红蛋白水平,所述受试者中的所述血液血红蛋白水平在所述罗沙司他的施用后增加,条件是所述血液血红蛋白水平不超过130g/l;条件是间隔至少2天且间隔不超过4天施用所述罗沙司他;条件是所述剂量不超过400mg;并且在如果所述受试者正在接受紫杉醇作为所述骨髓抑制化疗的一部分,条件是罗沙司他剂量在所述受试者接受所述紫杉醇之前或之后保持24小时。
11、在具体的实施方案中,所述药物还被说明为任选地增加或减少所述罗沙司他剂量直至所述受试者实现并维持100至120g/l的血液血红蛋白水平,条件是所述剂量不超过400mg。在一些实施方案中,所述增加或减少所述罗沙司他剂量导致为50mg、70mg、100mg、120mg、150mg、200mg、250mg、300mg或400mg的剂量。
本文地址:https://www.jishuxx.com/zhuanli/20240911/290731.html
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请发送邮件至 YYfuon@163.com 举报,一经查实,本站将立刻删除。
下一篇
返回列表