1.本发明属于食品安全免疫检测技术领域,具体涉及一株分泌抗菌核净单克隆抗体的杂交瘤细胞株及其应用。
背景技术:
2.菌核净(dimethachlone,dmt)属于二羰基亚胺类广谱杀菌剂,具有低毒、高效、持效期长等优势,广泛应用于防治水稻纹枯病,油菜、向日葵、大豆菌核病和烟草赤星病。农药使用量的增加不仅增加了人类通过食物链接触农药的风险,而且对环境和非目标生物产生了毒性影响。人体可以通过摄入食物、水果和蔬菜、吸收皮肤化学物质和吸入灰尘颗粒暴露于菌核净杀菌剂。因此,建立快速有效的检测菌核净含量的方法具有重要意义及市场价值。
3.目前的检测方法包括仪器分析法和免疫分析法。仪器分析法如高效液相色谱法([1]东保柱,王振,景岚,周洪友.hplc法同时检测土壤中多菌灵、菌核净、速克灵、咪鲜胺4种杀菌剂[j].农药,2016,55(03):205
‑
207.)、气相色谱串联质谱法([2]刘建平,骆洪,连海飞,崔艳,聂晶.quechers法萃取
‑
气相色谱
‑
三重四级杆串联质谱法检测大葱等鳞茎类蔬菜中6种杀菌剂的分析方法[j].分析仪器,2020(06):40
‑
45.)检测范围在0.04~10.0μg ml
‑1。由于对样品前处理繁琐,干扰物较多及仪器工作条件的限制,同时对操作人员的技术要求较高,因此仪器方法并不适用于现场检测。
[0004]
免疫分析方法相对于仪器检测方法,具有低成本、高通量、高灵敏、对技术人员要求低等特点,因此适用于大量样品的快速筛查。因此免疫检方法对菌核净的检测具有重要意义。刘蓉蓉于2009年至2012年先后报道了针对菌核净的多克隆抗体制备([3]刘媛,刘贤金,张存政,刘蓉蓉.菌核净的多克隆抗体及其制备和应用[p].江苏:cn101691404a,2010
‑
04
‑
07.),及时间分辨荧光免疫检测([4]刘媛,刘蓉蓉,刘贤金,方敦煌,宋春满,huovinen tuomas,vehni inen markus,l vgren timo.时间分辨荧光免疫分析方法检测烟草中菌核净残留[j].分析化学,2012,40(07):1114
‑
1117;[5]刘媛,刘贤金,张霄,王冬兰.由间接竞争时间分辨荧光免疫分析体系检测烟草中菌核净残留的方法[p].江苏:cn102590499a,2012
‑
07
‑
18.),但检测灵敏度均不高,其中灵敏度最优的为间接竞争时间分辨荧光免疫分析,ic
50
为32ng ml
‑1。
[0005]
酶联免疫法(elisa)是一种低成本、快速且便携的免疫学检测方法,检测时对样本的纯度要求不高而且操作简便,适用于大量样本的现场快速检测出结果。建立高效的免疫学检测方法,筛选高特异性的单克隆抗体是其重要前提,因此,开发一种针对菌核净的高效灵敏的检测方法是亟待解决的问题。
技术实现要素:
[0006]
发明目的:为了克服现有技术中存在的不足,本发明提供一株分泌菌核净单克隆抗体的杂交瘤细胞株及其应用,由该细胞株分泌的抗体针对菌核净具有较高的检测灵敏度,可以用来建立针对菌核净的免疫学检测方法。
[0007]
技术方案:为实现上述目的,本发明采用的技术方案为:
[0008]
本发明的一个目的是,提供一株分泌菌核净单克隆抗体的杂交瘤细胞株,已保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏名为单克隆细胞株sls 2g5,保藏编号为cgmcc no.20792,地址为:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,保藏日期2020年09月27日。
[0009]
本发明的第二个目的是,提供一种菌核净单克隆抗体,它由所述保藏编号为cgmcc no.20792的菌核净单克隆抗体的杂交瘤细胞株sls 2g5分泌产生。
[0010]
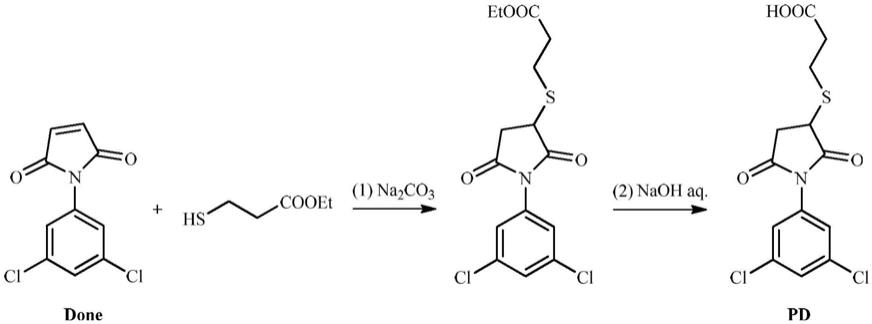
本发明的第三个目的是,提供一种菌核净半抗原,所述菌核净半抗原的结构式如下:
[0011][0012]
本发明的第四个目的是,提供一种菌核净半抗原的合成方法,所述菌核净半抗原由1
‑
(3,5
‑
二氯苯基)
‑
1h
‑
吡咯
‑
2,5
‑
二酮与3
‑
巯基丙酸乙酯的加成反应产物水解后得到,所述方法包括步骤如下:
[0013]
将1
‑
(3,5
‑
二氯苯基)
‑
1h
‑
吡咯
‑
2,5
‑
二酮溶于二甲亚砜,加入na2co3,搅拌下加入3
‑
巯基丙酸乙酯,加热至50℃~70℃搅拌反应20~30h,待反应完全,降至室温,浓缩;加入naoh溶液加热至70℃~90℃搅拌反应0.5~2h;加入适量纯水,并调节ph至酸性,经萃取、纯化、干燥,得褐色固体即为半抗原。
[0014]
在本发明实施方式中,按物质的量比计,所述1
‑
(3,5
‑
二氯苯基)
‑
1h
‑
吡咯
‑
2,5
‑
二酮与na2co3、3
‑
巯基丙酸乙酯的比例为1∶1~3∶1~2。
[0015]
在本发明实施方式中,所述1
‑
(3,5
‑
二氯苯基)
‑
1h
‑
吡咯
‑
2,5
‑
二酮与na2co3、3
‑
巯基丙酸乙酯的比例为1∶1.2∶1.2。
[0016]
在本发明实施方式中,所述1
‑
(3,5
‑
二氯苯基)
‑
1h
‑
吡咯
‑
2,5
‑
二酮溶于所述二甲亚砜中的浓度为0.01~0.05g/ml。
[0017]
在本发明实施方式中,所述1
‑
(3,5
‑
二氯苯基)
‑
1h
‑
吡咯
‑
2,5
‑
二酮溶于所述二甲亚砜中的浓度为0.02g/ml。
[0018]
在本发明的实施方式中,所述加入3
‑
巯基丙酸乙酯后,加热至60℃搅拌24h。
[0019]
在本发明的实施方式中,所述加入naoh溶液加热搅拌反应为,加入1mol l
‑1naoh溶液加热至80℃搅拌反应1h。
[0020]
在本发明实施方式中,所述naoh与所述1
‑
(3,5
‑
二氯苯基)
‑
1h
‑
吡咯
‑
2,5
‑
二酮的物质的量比为1~6∶1。
[0021]
在本发明实施方式中,所述naoh与所述1
‑
(3,5
‑
二氯苯基)
‑
1h
‑
吡咯
‑
2,5
‑
二酮的
物质的量比为5∶1。
[0022]
在本发明实施方式中,所述调节ph至酸性为,用hcl溶液调节ph至4~5。
[0023]
在本发明实施方式中,所述半抗原的制备方法为,按物质的量计,将1equ.1
‑
(3,5
‑
二氯苯基)
‑
1h
‑
吡咯
‑
2,5
‑
二酮溶于二甲亚砜,加入1.2equ.na2co3,搅拌下加入1.2equ.3
‑
巯基丙酸乙酯,加热至60℃左右搅拌,待反应完全,降至室温,浓缩;加入二甲亚砜5倍体积的naoh溶液加热至80℃搅拌反应1h;加入适量纯水,用hcl溶液调节ph至4~5,经萃取、纯化、干燥,得褐色固体即为半抗原。
[0024]
本发明的第五个目的是,提供一种菌核净完全抗原,所述菌核净完全抗原的结构式如下:
[0025][0026]
其中,carrier protein为载体蛋白。
[0027]
本发明的第六个目的是,提供一种菌核净完全抗原的制备方法,所述完全抗原包括菌核净免疫原和菌核净包被原,所述完全抗原由pd半抗原与载体蛋白偶联获得,其中,所述载体蛋白包括牛血清蛋白bsa、卵清蛋白ova,所述pd半抗原的结构式为
[0028][0029]
在本发明实施方式中,所述方法包括步骤如下:半抗原pd溶于无水n,n
‑
二甲基甲酰胺,依次加入1
‑
乙基
‑
(3
‑
二甲基氨基丙基)碳二亚胺盐酸盐edci,n
‑
羟基琥珀酰亚胺nhs,室温搅拌反应0.3~1h,称为a液;称取牛血清蛋白bsa,加入硼酸缓冲溶液,称为b液;搅拌下,缓慢将a液逐滴加至b液中,室温反应1~3h,得到含有pd
‑
bsa的混合液;透析,即得菌核净完全抗原。
[0030]
在本发明实施方式中,所述半抗原pd与所述edci、nhs的物质的量比为1∶1~1.5∶1~1.5所述半抗原pd在无水n,n
‑
二甲基甲酰胺中的浓度为10~15g l
‑1。
[0031]
在本发明实施方式中,所述半抗原pd与所述edci、nhs的物质的量比为1∶1.2∶1.2,所述半抗原pd在无水n,n
‑
二甲基甲酰胺中的浓度为13g l
‑1。
[0032]
在本发明实施方式中,所述半抗原pd与所述载体蛋白的物质的量比为30~80∶1。
[0033]
在本发明实施方式中,所述半抗原pd与所述载体蛋白的物质的量比为50∶1。
[0034]
在本发明实施方式中,所述无水n,n
‑
二甲基甲酰胺与所述硼酸缓冲溶液的体积比为1∶5~15。
[0035]
在本发明实施方式中,所述无水n,n
‑
二甲基甲酰胺与所述硼酸缓冲溶液的体积比为1∶10。
[0036]
本发明的一种菌核净单克隆抗体杂交瘤细胞株的制备方法,菌核净完全抗原免疫小鼠通过细胞融合、hat选择性培养基培养后,建立得到所述菌核净单克隆抗体杂交瘤细胞株。其中,所述菌核净完全抗原包括免疫原和包被原,由半抗原pd与载体蛋白偶联获得,其中,所述载体蛋白包括牛血清蛋白(bsa)、卵清蛋白(ova),对应的菌核净免疫原包括pd
‑
bsa、pd
‑
ova;所述半抗原pd由1
‑
(3,5
‑
二氯苯基)
‑
1h
‑
吡咯
‑
2,5
‑
二酮与3
‑
巯基丙酸乙酯的加成反应产物纯化后得到。
[0037]
以pd
‑
bsa免疫原为例,基本步骤为:
[0038]
(1)免疫原的制备与鉴定:1
‑
(3,5
‑
二氯苯基)
‑
1h
‑
吡咯
‑
2,5
‑
二酮与3
‑
巯基丙酸乙酯的加成反应产物水解后得到pd,以所述pd为半抗原,采用碳二亚胺法将半抗原分别与包括bsa、ova在内的载体蛋白偶联,制备得到免疫原与包被原,通过透析分离完全抗原和未偶联的半抗原、nhs及反应产生的尿素,分离出的完全抗原就是菌核净免疫原和包被原,其中,免疫原pd
‑
bsa用于小鼠免疫制备杂交瘤细胞株,包被原pd
‑
ova用于后续的试剂盒检测时使用;
[0039]
(2)小鼠的免疫:使用弗氏佐剂、弗氏不完全佐剂、pd
‑
bsa免疫原,通过颈背部皮下注射白变种实验室老鼠即balb/c小鼠,进行小鼠的免疫,获得菌核净免疫小鼠。首次免疫(100μg/只)用弗氏完全佐剂与菌核净免疫原的等体积混合乳化液作为注射剂,数次加强免疫用(50μg/只)弗氏不完全佐剂与菌核净免疫原的等体积混合乳化液作为注射剂,首次免疫与第一次加强免疫之间间隔一个月,多次加强免疫之间间隔21天;最后一次用50μl经生理盐水稀释至0.5mg/ml的pd
‑
bsa免疫原(25μg/只,不含佐剂)冲刺免疫;通过间接竞争酶联免疫法(icelisa)检测血清效价和抑制率;数次加强免疫为4~6次,优选为5次;
[0040]
(3)细胞融合与细胞株建立:通过聚乙二醇(peg4000)法将菌核净免疫小鼠的脾细胞和骨髓瘤细胞融合,通过hat培养基培养,利用间接elisa检测阳性细胞孔,并进一步利用icelisa法测定阳性细胞孔的抑制效果,通过有限稀释法对有最好抑制的阳性细胞孔进行三次亚克隆,最终筛选获得杂交瘤细胞株sls 2g5;
[0041]
(4)杂交瘤细胞株性质的鉴定:抗体亚型的鉴定采用小鼠单克隆抗体免疫胶体金亚型试剂盒方法,ic
50
值、交叉反应率和亲和力常数采用elisa法测定。
[0042]
本发明的另一个目的是,提供上述菌核净单克隆抗体的应用,所述菌核净单克隆抗体用于食品安全检测中菌核净残留的分析检测。
[0043]
在本发明实施方式中,所述菌核净单克隆抗体用于制备食品安全检测中菌核净残留量的分析检测用的检测主体。
[0044]
在本发明实施方式中,所述检测主体包括试剂、检测板、试剂盒。
[0045]
在本发明实施方式中,菌核净免疫原为pd
‑
bsa时,对应的菌核净包被原优选为pd
‑
ova,具有更好的特异性和检测灵敏度。
[0046]
本发明的有益效果:首先,本发明弥补了目前对于菌核净检测领域的技术空白,首次提出了能够分泌菌核净单克隆抗体的细胞株的制备方法,尤其是所用到的半抗原及该半抗原的制备方法。其次,本发明提供的细胞株sls 2g5分泌的单克隆抗体,对菌核净具有较好的特异性和检测灵敏度(ic
50
值为3.2μg l
‑1),可实现对菌核净残留量的检测,为食品中菌核净残留的免疫检测提供了原料,具有实际应用价值。
附图说明
[0047]
图1为菌核净单克隆抗体的亚型鉴定;
[0048]
图2为单克隆抗体亲和力测定;
[0049]
图3为单克隆抗体对菌核净的抑制标准曲线。
具体实施方式
[0050]
下面结合附图和实施例对本发明作更进一步的说明。
[0051]
本发明实施例中所用试剂:
[0052]
碳酸盐缓冲液(cbs):称取na2co
3 1.59g,nahco
3 2.93g,分别溶于少量双蒸水后混合,加双蒸水至约800ml混匀,调ph值至9.6,加双蒸水定容至1000ml,4℃贮存备用;
[0053]
磷酸盐缓冲液(pbs):8.0g nacl,0.2g kcl,0.2g kh2po4,2.9g na2hpo4·
12h2o,溶于800ml纯水中,用naoh或hcl调ph到7.2~7.4,定容至1000ml;
[0054]
pbst:含0.05%吐温
‑
20的pbs;
[0055]
tmb显色液:a液:na2hpo4·
12h2o 18.43g,柠檬酸9.33g,纯水定容至1000ml;b液:60mg tmb溶于100ml乙二醇中。a、b液按1∶5混合即为tmb显色液,现用现混。
[0056]
实施例
[0057]
根据下述实施例,可以更好的理解本发明。然而,本领域的技术人员容易理解,实施例所描述的具体的物料配比、工艺条件及其结果仅用于说明本发明,而不应当也不会限制权利要求书中所详细描述的本发明。
[0058]
本发明通过将菌核净完全抗原免疫小鼠,通过细胞融合,hat选择性培养基培养,通过icelisa筛选细胞上清,最终得到了对菌核净有较高灵敏度的单克隆抗体杂交瘤细胞株。
[0059]
1.半抗原的合成
[0060]
半抗原pd的合成路线如下:
[0061][0062]
将0.10g(0.4mmol)1
‑
(3,5
‑
二氯苯基)
‑
1h
‑
吡咯
‑
2,5
‑
二二酮溶于5ml二甲亚砜,加入0.05g(0.48mmol)na2co3,搅拌0.5h。然后,搅拌下加入0.065g(0.48mmol)3
‑
巯基乙酯,加热至60℃搅拌反应24h,tlc监测。待反应完全,停止加热,直至反应液温度降至室温,浓缩;加入2ml 1mol l
‑1naoh溶液加热至80℃搅拌反应1h;待反应液温度降至室温,加入3ml纯水,用1mol l
‑1hcl调节ph至4,用乙酸乙酯萃取,无水na2so4干燥,浓缩;经硅胶柱纯化,浓缩,干燥,得到褐色固体,即半抗原pd。
[0063]
2.完全抗原的制备:步骤1制备的半抗原pd,与牛血清蛋白(bsa)偶联得到完全抗原pd
‑
bsa。
[0064]
完全抗原pd
‑
bsa制备方法如下:
[0065]
a、称取步骤1制得的半抗原pd 2.6mg(0.0075mmol)溶于200μl无水n,n
‑
二甲基甲酰胺,依次加入1.7mg(0.009mmol)1
‑
乙基
‑
(3
‑
二甲基氨基丙基)碳二亚胺盐酸盐(edci),n
‑
羟基琥珀酰亚胺(nhs)1.0mg(0.009mmol),室温搅拌反应0.5h,称为a液;称取牛血清蛋白bsa 10mg(0.00015mmol),加入2ml硼酸缓冲溶液,称为b液;搅拌下,缓慢将a液逐滴加至b液中,室温反应2h,得到含有pd
‑
bsa的混合液;
[0066]
b、透析:取10cm的透析袋,于沸水中煮沸5min,再用60℃的去离子水冲洗3min,保存在4℃去离子水中备用;将步骤(a)中含有pd
‑
bsa的混合液置于透析袋,用0.01mol l
‑1pbs作为透析液,4℃透析3d,每天更换三次透析液,以分离完全抗原与未偶联的半抗原及其他小分子物质,即得完全抗原,结构如下:
[0067][0068]
制得的完全抗原包括免疫原和包被原,其中免疫原pd
‑
bsa用作下一步的小鼠免疫。
[0069]
包被原pd
‑
ova的制法与pd
‑
bsa相同,用于后续步骤7应用于检测时使用。
[0070]
3.小鼠的免疫:pd
‑
bsa免疫原与等体积弗氏佐剂混合乳化后,获得注射剂,通过颈背部皮下注射balb/c小鼠。
[0071]
首次免疫(100μg/只)用弗氏完全佐剂与pd
‑
bsa免疫原的等体积混合乳化液作为注射剂,5次加强免疫(50μg/只)用弗氏不完全佐剂与pd
‑
bsa免疫原的等体积混合乳化液作为注射剂。首次免疫与第一次加强免疫之间间隔一个月,多次加强免疫之间间隔21天。最后一次用经生理盐水稀释至浓度为0.5mg/ml的pd
‑
bsa免疫原(25μg/只,不含佐剂)冲刺免疫;通过间接竞争酶联免疫法(icelisa)检测血清效价和抑制率。
[0072]
4.细胞融合
[0073]
在冲刺免疫三天后,按照常规peg法进行细胞融合,具体步骤如下:
[0074]
a、摘眼球取血,颈椎脱臼法处死菌核净免疫小鼠后,立即放入75%酒精中消毒,浸泡5min左右,无菌操作取出该小鼠的脾脏,用注射器的胶头适度研磨并通过200目细胞筛网得到脾细胞悬液,收集,离心(1200rpm,8min),用rpmi
‑
1640培养基洗涤脾细胞三次,最后一次离心后,将脾细胞稀释到一定体积,计数,备用;
[0075]
b、收集鼠源骨髓瘤sp2/0细胞:融合前7
‑
10天,将sp2/0瘤细胞用含10%fbs(胎牛血清)rpmi
‑
1640培养基在5%c02培养箱中。融合前要求sp2/0瘤细胞数量达到1~4
×
107,保证融合前sp2/0瘤细胞处于对数生长期。融合时,收集瘤细胞,悬浮于rpmi
‑
1640基础培养液中,进行细胞计数;
[0076]
c、融合过程7min。第1min,将1ml的peg 1500由慢到快滴加到细胞中;第2min,静置。第3min和第4min,在1min内滴加1ml rpmi
‑
1640培养基;第5min和第6min,在1min内滴加2ml rpmi
‑
1640培养基;第7min,每10s滴加1ml的rpmi
‑
1640培养基。然后37℃温浴5min。离心(800rpm,8min),弃上清,重悬入含20%胎牛血清,2%的50
×
hat的rpmi
‑
1640筛选培养液中,按照200μl/孔加到96孔细胞板,置于37℃,5%co2培养箱中培养。
[0077]
5.细胞筛选与细胞株建立
[0078]
在细胞融合的第3天对融合细胞进行2%的50
×
hat的rpmi
‑
1640筛选培养液半换液,第5天进行用含20%胎牛血清,1%的100xht的rpmi
‑
1640过渡培养液进行全换液,在第7天取细胞上清进行筛选。筛选分两步:第一步先用icelisa筛选出阳性细胞孔,第二步选用对菌核净为标准品,用icelisa对阳性细胞进行抑制效果测定。选择对菌核净标准品均有较好抑制的细胞孔,采用有限稀释法进行亚克隆,用同样的方法进行检测。重复三次,获得单克隆杂交瘤细胞株sls 2g5。
[0079]
6.菌核净单克隆抗体的制备与鉴定
[0080]
取8
‑
10周龄菌核净免疫balb/c小鼠,每只小鼠腹腔注射无菌石蜡油1ml;7天后每只小鼠腹腔注射1
×
106杂交瘤细胞,从第七天开始收集腹水,将腹水通过辛酸
‑
硫酸铵法纯化。最终得到纯化后的菌核净单克隆抗体,
‑
20℃贮存。
[0081]
使用小鼠单抗亚型鉴定试剂盒对腹水纯化获得的菌核净单克隆抗体进行免疫球蛋白亚型鉴定,其亚型为igg2b型,经小鼠单抗亚型鉴定试剂盒检测得轻链类型为κ型,如图1所示。
[0082]
采用间接elisa测定,亲和力常数的计算方法:以抗体浓度
‑
od 450nm值作图,计算不同抗原浓度时od 450nm对应的抗体浓度,当od450nm值为50%时单克隆抗体的浓度,代入
公式ka=(n
‑
1)/2(nab
’‑
ab)计算亲和力常数ka(l mol
‑1)。ab和ab’分别表示当抗原浓度为ag和ag’时,od 450nm对应的抗体浓度(mol l
‑1),n=ag/ag’。如图2所示,菌核净单克隆抗体的亲和力为9.73
×
108l mol
‑1。
[0083]
以上结果说明所制备的菌核净单克隆抗体具有较高的亲和力和灵敏度,可用于菌核净免疫分析检测和亲和柱的制备。
[0084]
7.抗体应用
[0085]
将杂交瘤细胞株sls 2g5通过体内腹水制备的菌核净单克隆抗体应用于菌核净的添加回收试验,具体步骤如下:
[0086]
7.1包被:将前述步骤2中得到的包被原pd
‑
ova用0.05mol l
‑1ph 9.6碳酸盐缓冲液稀释至0.1μg/ml,100μl/孔,37℃反应2h。
[0087]
7.2洗涤:将板内溶液倾去,并用洗涤液洗涤3次,每次3min.
[0088]
7.3封闭:加入200μl/孔封闭液,37℃反应2h。洗涤后烘干备用。
[0089]
7.4加样:在阳性对照孔加入100μl pbs;检测孔加入100μl浓度为0.3~50μgl
‑1菌核净标准溶液。然后,将菌核净单克隆抗体用0.01mol l
‑1pbs稀释至0.10.1μg/ml,并加入到各稀释度的包被孔中,100μl/孔,37℃反应30min;充分洗涤后,加入1∶3000稀释的hrp
‑
羊抗鼠igg,100μl/孔,37℃反应30min。
[0090]
7.5显色:将酶标板取出,充分洗涤后,每孔加入100μl的tmb显色液,37℃避光反应15min.
[0091]
7.6终止和测定:每孔加入50μl终止液以终止反应,然后用酶标仪测定各孔的od
450
值。
[0092]
采用icelisa检测对菌核净的灵敏度,如图3所示,根据标准方程y=0.01424 (1.6311
‑
0.01424)(1 x/2.8444)
0.96092
(r2=0.9981),计算出ic
50
为3.2μg l
‑1。
[0093]
用icelisa测定菌核净单克隆抗体的ic
50
为3.2μg l
‑1,说明对菌核净有很高的灵敏度,可用于菌核净免疫分析检测。
[0094]
以上所述仅是本发明的优选实施方式,应当指出:对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。