1.本发明涉及生物技术领域,具体涉及荧光定量方法检测人体母乳内10属细菌的试剂盒及其应用。
背景技术:
2.近年来二代测序研究表明母乳中存在近千种细菌,已经分离并鉴定的人乳中微生物主要有葡萄球菌属、链球菌属、肠球菌属、乳酸杆菌属、双歧杆菌属和明串珠菌属等。越来越多的证据支持人乳中含有的微生物来源于环境污染之外的途径,即母亲肠道中的细菌通过内源性途径迁移到乳腺(肠道
‑
乳腺途径),再通过哺乳进入婴儿体内。同时,母乳内的相关菌也是婴儿肠道中的第一批定殖细菌,帮助婴儿建立肠道共生菌系统。
3.母乳中微生物对母婴健康的影响备受关注。母乳喂养有助于婴儿肠道益生菌群的生长与定植,母乳中某些条件性微生物在新生儿内源性免疫系统激活过程、编程新生儿的免疫系统、肠道免疫功能发育成熟及降低疾病易感性轨迹方面发挥作用。与此同时,这些条件性微生物还与乳腺炎的发生风险及治疗效果有关,影响母婴远期罹患慢性病的风险。
4.有研究专门调查了中国城市中生活的哺乳期母亲的母乳菌群组成,发现无论用标准非无菌取样还是用无菌取样,链球菌、不动杆菌和葡萄球菌都是优势属。母乳菌群的组成可能受到遗传因素、母亲健康及营养状况、分娩方式、哺乳期以及地理位置等很多因素的影响。
5.目前,人乳汁中微生物的检测方法基本为16s二代测序技术。16s rrna基因是细菌上编码rrna相对应的dna序列,存在于所有细菌的基因组中,一般由保守区和高变区组成,保守区在细菌间无显著差异,可用于构建所有生命的统一进化树,而高变区在不同细菌中存在一定的差异,可将菌群鉴定精确到分类学上属、甚至种水平。16s rrna基因测序,通常是选择某个或某几个高变区域,利用保守区设计通用引物进行pcr扩增,然后对高变区进行测序分析和菌种鉴定,从而获得母乳中微生物群落的多样性。二代测序具有大样本量测序时成本低、易于操作,可以获得样本中的全部微生物信息,能在一定程度还原母乳中微生态系统的细菌种类和细菌丰度分布情况的优点。同时二代测序还具有小样本量测序时,周期较长的缺点:因为建库和测序过程要经过多次pcr扩增,在一定程度上会因pcr扩增中的偏差导致测序结果不能有效还原样本原始信息。
技术实现要素:
6.现有的二代测序技术中存在的问题是:小样本量的测序周期长。
7.为解决上述问题,第一个方面,本发明提供鉴定或辅助鉴定母乳中细菌的多重pcr引物探针组合物,所述细菌为双歧杆菌属、不动杆菌属、棒状杆菌属、链球菌属、葡萄球菌属、摩根氏菌属、普罗维登斯菌属、芽孢杆菌属、寡养单胞菌属和水栖菌属这10属细菌中的10属以下的细菌,所述多重pcr引物探针组合物包括1
‑
frp、2
‑
frp、3
‑
frp、5
‑
frp、6
‑
frp、7
‑
frp、8
‑
frp、9
‑
frp、10
‑
frp和11
‑
frp;
所述1
‑
frp为不动杆菌属的特异引物和探针,由引物1
‑
fp、引物1
‑
rp和探针1
‑
probe组成,引物1
‑
fp是seq id no.2所示的单链dna,引物1
‑
rp是seq id no.3所示的单链dna,探针1
‑
probe是seq id no.4所示的单链dna;所述2
‑
frp为双歧杆菌属的特异引物和探针,由引物2
‑
fp、引物2
‑
rp和探针2
‑
probe组成,引物2
‑
fp是seq id no.5所示的单链dna,引物2
‑
rp是seq id no.6所示的单链dna,探针2
‑
probe是seq id no.7所示的单链dna;所述3
‑
frp为棒状杆菌属的特异引物和探针,由引物3
‑
fp、引物3
‑
rp和探针3
‑
probe组成,引物3
‑
fp是seq id no.8所示的单链dna,引物3
‑
rp是seq id no.9所示的单链dna,探针3
‑
probe是seq id no.10所示的单链dna;所述5
‑
frp为寡养单胞菌属的特异引物和探针,由引物5
‑
fp、引物5
‑
rp组和探针5
‑
probe组成,引物5
‑
fp是seq id no.11所示的单链dna,引物5
‑
rp是seq id no.12所示的单链dna,探针5
‑
probe是seq id no.13所示的单链dna;所述6
‑
frp为链球菌属的特异引物和探针,由引物6
‑
fp、引物6
‑
rp和探针6
‑
probe组成,引物6
‑
fp是seq id no.14所示的单链dna,引物6
‑
rp是seq id no.15所示的单链dna,探针6
‑
probe是seq id no.16所示的单链dna;所述7
‑
frp为芽孢杆菌属的特异引物和探针,由引物7
‑
fp、引物7
‑
rp和探针7
‑
probe组成,引物7
‑
fp是seq id no.17所示的单链dna,引物7
‑
rp是seq id no.18所示的单链dna,7
‑
probe是seq id no.19所示的单链dna;所述8
‑
frp为水栖菌属的特异引物和探针,由引物8
‑
fp、引物8
‑
rp和探针8
‑
probe组成,引物8
‑
fp是seq id no.20所示的单链dna,引物8
‑
rp是seq id no.21所示的单链dna,探针8
‑
probe是seq id no.22所示的单链dna;所述9
‑
frp为摩根氏菌属的特异引物和探针,由引物9
‑
fp、引物9
‑
rp和探针9
‑
probe组成,引物9
‑
fp是seq id no.23所示的单链dna,引物9
‑
rp是seq id no.24所示的单链dna,探针9
‑
probe是seq id no.25所示的单链dna;所述10
‑
frp为普罗维登斯菌属的特异引物和探针,由引物10
‑
fp、引物10
‑
rp和探针10
‑
probe组成,引物10
‑
fp是seq id no.26所示的单链dna,引物10
‑
rp是seq id no.27所示的单链dna,探针10
‑
probe是seq id no.28所示的单链dna;所述11
‑
frp为葡萄球菌属的特异引物和探针,由引物11
‑
fp、引物11
‑
rp和探针11
‑
probe组成,引物11
‑
fp是seq id no.29所示的单链dna,引物11
‑
rp是seq id no.30所示的单链dna,探针11
‑
probe是seq id no.31所示的单链dna。
8.进一步地,上述的多重pcr引物探针组合物中,所述引物1
‑
fp、所述引物1
‑
rp、所述探针1
‑
probe、所述引物2
‑
fp、所述引物2
‑
rp、所述探针2
‑
probe、所述引物3
‑
fp、所述引物3
‑
rp、所述探针3
‑
probe、所述引物5
‑
fp、所述引物5
‑
rp、所述探针5
‑
probe、所述引物6
‑
fp、所述引物6
‑
rp、所述探针6
‑
probe、所述引物7
‑
fp、所述引物7
‑
rp、所述探针7
‑
probe、所述引物8
‑
fp、所述引物8
‑
rp、所述探针8
‑
probe、所述引物9
‑
fp、所述引物9
‑
rp、所述探针9
‑
probe、所述引物10
‑
fp、所述引物10
‑
rp、所述探针10
‑
probe、所述引物11
‑
fp、所述引物11
‑
rp和所述探针11
‑
probe的物质的量相同。
9.进一步地,上述的多重pcr引物探针组合物中,所述组合物还包括内参
‑
frp,所述内参
‑
frp是由引物内参
‑
fp、引物内参
‑
rp和探针内参
‑
probe组成,引物内参
‑
fp是seq id no.32所示的单链dna,引物内参
‑
rp是seq id no.33所示的单链dna,探针内参
‑
probe是seq id no.34所示的单链dna。
10.进一步地,上述的多重pcr引物探针组合物中,所述引物内参
‑
fp、所述引物内参
‑
rp和所述探针内参
‑
probe的物质的量与所述引物1
‑
fp的物质的量相同。
11.上述多重pcr引物探针组合物中,所述1
‑
frp、所述2
‑
frp和所述3
‑
frp包装在一起
(该包装简称frp
‑ꢀ
mix 1)。所述5
‑
frp、所述6
‑
frp、所述7
‑
frp和所述8
‑
frp包装在一起(该包装简称frp
‑ꢀ
mix 2)。所述9
‑
frp、10
‑
frp、11
‑
frp和内参
‑
frp包装在一起(该包装简称frp
‑ꢀ
mix 3)。
12.上述多重pcr引物探针组合物中,所述多重pcr可为:所述1
‑
frp、所述2
‑
frp和所述3
‑
frp用于进行三重pcr(即所述1
‑
frp、所述2
‑
frp和所述3
‑
frp在一个体系中进行pcr),所述5
‑
frp、所述6
‑
frp、所述7
‑
frp和所述8
‑
frp用于进行四重pcr(即所述5
‑
frp、所述6
‑
frp、所述7
‑
frp和所述8
‑
frp在一个体系中进行pcr),所述9
‑
frp、10
‑
frp、11
‑
frp和内参
‑
frp用于进行四重pcr(即所述9
‑
frp、10
‑
frp、11
‑
frp和内参
‑
frp在一个体系中进行pcr)。
13.第二个方面,本发明提供鉴定或辅助鉴定母乳中细菌的试剂或试剂盒,所述试剂或试剂盒含有上述的多重pcr引物探针组合物。
14.进一步地,上述的试剂或试剂盒还包括阳性标准品,所述阳性标准品可为含有核苷酸序列如seq id no.1第4287
‑
5862位所示的dna片段的载体。
15.在本发明的一个实施例中,所述阳性标准品为核苷酸序列是seq id no.1的质粒。
16.第三个方面,本发明提供上述的多重pcr引物探针组合物在制备鉴定或辅助鉴定母乳中细菌产品(试剂或试剂盒)中的应用。
17.第四个方面,本发明提供上述的多重pcr引物探针组合物在鉴定或辅助鉴定母乳中细菌中的应用。
18.第五个方面,本发明提供上述的鉴定或辅助鉴定母乳中微生物种属的试剂或试剂盒在鉴定或辅助鉴定母乳中细菌中的应用。
19.第六个方面,本发明还提供鉴定母乳中细菌的方法,所述方法包括以待测母乳基因组dna为模板,用上述的多重pcr引物探针组合物或上述的试剂或试剂盒进行实时荧光定量pcr检测,确定所述待测母乳含有上述10属细菌中的哪个或哪些属的细菌。
20.本文中,所述母乳中细菌为下述10个属中10个、任意9个、任意8个、任意7个、任意6个、任意5个、任意4个、任意3个、任意2个或任意1个的属的细菌:双歧杆菌属(bifidobacterium)、不动杆菌属(acinetobacter)、棒状杆菌属(corynebacterium)、链球菌属(streptococcus)、葡萄球菌属(staphylococcus)、摩根氏菌属(morganella)、普罗维登斯菌属(providencia)、芽孢杆菌属(bacillus)、寡养单胞菌属(stenotrophomonas)和水栖菌属(enhydrobacter)。
21.本发明提供的方法具有下述优点:
①
待测样本为小样本量时,方法简便,周期快;
②
探针法实时荧光定量pcr(qrt
‑
pcr)能实时监测检测过程,还原样本原始菌群状态;
③
靶向性高;可单种属检测;或多种属属联合检测,还可以根据荧光标记任意组合几个种属的联合检测;
④
可同时实现种属定性检测和定量检测,定量更准确。本发明提供的检测方法准确、快速,可同时对人母乳内10个种属进行定性检测和定量检测,同时检测结果会对婴幼儿益生菌补充有指导意义。
附图说明
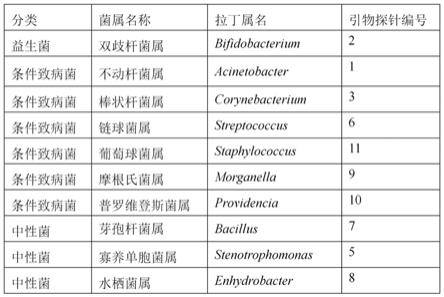
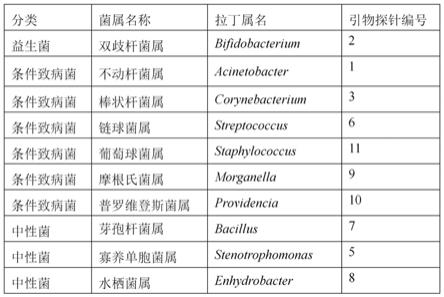
22.图1为本发明提供的多重pcr引物探针组合物检测的10属细菌的信息。
23.图2为多重pcr引物探针组合物的核苷酸序列及探针的荧光标记信息。
24.图3为多重pcr引物探针组合物灵敏性检测的第一部分数据。
25.图4为多重pcr引物探针组合物灵敏性检测的第二部分数据。
26.图5为多重pcr引物探针组合物的标准曲线信息。
27.图6为多重pcr引物探针组合物测定10例母乳样本中细菌的扩增循环数。
28.图7为多重pcr引物探针组合物测定3例母乳样本、阴性对照和阳性标准品质粒中细菌的测定结果。
29.图8为二代测序测定的3例母乳样本细菌的检测数据。
30.图9为二代测序测定的3例母乳样本中细菌的物种丰度。
具体实施方式
31.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
32.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
33.本发明通过艾德范思医学检验实验室自有的母乳16srdna二代测序数据500例进行配套的生物信息分析筛选出10个母乳中细菌的特征性属,并针对这10个属设计特异性引物和探针、内源性内参的引物和探针,设计和构建阳性标准品。配套的生物信息分析方法,具体步骤如下:步骤1.基于高通量测序(ngs)原始序列使用fastp软件进行数据质控,fastp下载https://github.com/opengene/fastp;步骤2.使用qiime2分析软件进行asv(amplicon sequence variant)分析及物种注释(silva数据库),qiime2官网https://qiime2.org;步骤3.过滤注释到蓝细菌/线粒体/叶绿体等的asv以及在所有样本中总reads数小于20的asv;步骤4.选择在95%样本中平均丰度不小于0.5%的asv作为核心asv,对应菌为最终筛选识别结果。
34.经过生物信息分析筛选出10个细菌的特征性属,其中:益生菌1属、条件致病菌7属、中性菌3属,属的具体信息及对应的引物和探针的编号如图1所示。针对10属细菌设计的特异性引物和探针、内源性内参的引物和探针的核苷酸序列如图2所示。
35.阳性标准品质粒构建:根据引物和探针组检测区域,设计阳性标准品,全长共1576个核苷酸,其核苷酸序列如seq id no.1第4287
‑
5862位所示。委托上海生工将阳性标准品序列构建至puc57载体,获得阳性标准品重组质粒puc57
‑
positive。puc57
‑
positive的核苷酸序列如seo id no.1所示,其中seo id no.1第1
‑
4286位为骨架载体puc57上的核苷酸序列、seq id no.1第4286
‑
5862位为阳性标准品序列。
36.实施例1.阳性标准品与引物探针组合物的特异性验证实验1.1.验证方法阳性标准品与引物探针组合物的特异性验证包括以下步骤:1)将取2μl浓度为2.0
×
104个拷贝/μl的阳性标准品质粒puc57
‑
positive溶液作
为模板进行特异性检测;2)将引物和探针组根据荧光基团不同分成3组(图2),三组引物探针组溶液分别是:frp
‑
mix 1、frp
‑
mix 2和frp
‑
mix 3。
37.frp
‑
mix 1溶液由名称分别为1
‑
frp、2
‑
frp和3
‑
frp的3种引物探针组合物和无核酸酶水组成,1
‑
frp由引物1
‑
fp、引物1
‑
rp和探针1
‑
probe组成,1
‑
fp是seq id no.2所示的单链dna,1
‑
rp是seq id no.3所示的单链dna,1
‑
probe的核苷酸序列如seq id no.4所示,1
‑
probe 的5'端连接有接荧光基团6
‑
fam、3'端连接有淬灭基团bhq1;2
‑
frp由引物2
‑
fp、引物2
‑
rp和探针2
‑
probe组成,2
‑
fp是seq id no.5所示的单链dna,2
‑
rp是seq id no.6所示的单链dna,2
‑
probe的核苷酸序列如seq id no.7所示,2
‑
probe的5'端连接有接荧光基团hex、3'端连接有淬灭基团bhq1;3
‑
frp由引物3
‑
fp、引物3
‑
rp和探针3
‑
probe组成,3
‑
fp是seq id no.8所示的单链dna,3
‑
rp是seq id no.9所示的单链dna,3
‑
probe的核苷酸序列如seq id no.10所示,3
‑
probe的5'端连接有接荧光基团rox、3'端连接有淬灭基团bhq2。
38.frp
‑
mix 2溶液由名称分别为5
‑
frp、6
‑
frp、7
‑
frp和8
‑
frp的4种引物探针组合物和无核酸酶水组成,5
‑
frp由引物5
‑
fp、引物5
‑
rp和探针5
‑
probe组成,5
‑
fp是seq id no.11所示的单链dna,5
‑
rp是seq id no.12所示的单链dna,5
‑
probe的核苷酸序列如seq id no.13所示,5
‑
probe的5'端连接有接荧光基团6
‑
fam、3'端连接有淬灭基团bhq1;6
‑
frp由引物6
‑
fp、引物6
‑
rp和探针6
‑
probe组成,6
‑
fp是seq id no.14所示的单链dna,6
‑
rp是seq id no.15所示的单链dna,6
‑
probe的核苷酸序列如seq id no.16所示,6
‑
probe的5'端连接有接荧光基团hex、3'端连接有淬灭基团bhq1;7
‑
frp由引物7
‑
fp、引物7
‑
rp和探针7
‑
probe组成,7
‑
fp是seq id no.17所示的单链dna,7
‑
rp是seq id no.18所示的单链dna,7
‑
probe的核苷酸序列如seq id no.19所示,7
‑
probe的5'端连接有接荧光基团rox、3'端连接有淬灭基团bhq2;8
‑
frp由引物8
‑
fp、引物8
‑
rp和探针8
‑
probe组成,8
‑
fp是seq id no.20所示的单链dna,8
‑
rp是seq id no.21所示的单链dna,8
‑
probe的核苷酸序列如seq id no.22所示,6
‑
probe的5'端连接有接荧光基团cy5、3'端连接有淬灭基团bhq2。
39.frp
‑
mix 3溶液由名称分别为9
‑
frp、10
‑
frp、11
‑
frp和内参
‑
frp的4种引物探针组合物和无核酸酶水组成,9
‑
frp由引物9
‑
fp、引物9
‑
rp和探针9
‑
probe组成,9
‑
fp是seq id no.23所示的单链dna,9
‑
rp是seq id no.24所示的单链dna,9
‑
probe的核苷酸序列如seq id no.25所示,9
‑
probe的5'端连接有接荧光基团6
‑
fam、3'端连接有淬灭基团bhq1;10
‑
frp由引物10
‑
fp、引物10
‑
rp和探针10
‑
probe组成,10
‑
fp是seq id no.26所示的单链dna,10
‑
rp是seq id no.27所示的单链dna,10
‑
probe的核苷酸序列如seq id no.28所示,10
‑
probe的5'端连接有接荧光基团hex、3'端连接有淬灭基团bhq1;11
‑
frp由引物11
‑
fp、引物11
‑
rp和探针11
‑
probe组成,11
‑
fp是seq id no.29所示的单链dna,11
‑
rp是seq id no.30所示的单链dna,11
‑
probe的核苷酸序列如seq id no.31所示,11
‑
probe的5'端连接有接荧光基团rox、3'端连接有淬灭基团bhq2;内参
‑
frp由引物内参
‑
fp、引物内参
‑
rp和探针内参
‑
probe组成,内参
‑
fp是seq id no.32所示的单链dna,内参
‑
rp是seq id no.33所示的单链dna,内参
‑
probe的核苷酸序列如seq id no.34所示,内参
‑
probe的5'端连接有接荧光基团cy5、3'端连接有淬灭基团bhq2。
40.frp
‑
mix 1中,引物1
‑
fp、引物1
‑
rp、探针1
‑
probe、引物2
‑
fp、引物2
‑
rp、探针3
‑
probe、引物3
‑
fp、引物3
‑
rp和探针3
‑
probe的含量均为0.5μm。frp
‑
mix 2中,引物5
‑
fp、引物
5
‑
rp、探针5
‑
probe、引物6
‑
fp、引物6
‑
rp、探针6
‑
probe、引物7
‑
fp、引物7
‑
rp、探针7
‑
probe、引物8
‑
fp、引物8
‑
rp和探针8
‑
probe的含量均为0.5μm。frp
‑
mix 3中,引物9
‑
fp、引物9
‑
rp、探针9
‑
probe、引物10
‑
fp、引物10
‑
rp、探针10
‑
probe、引物11
‑
fp、引物11
‑
rp、探针11
‑
probe、引物内参
‑
fp、引物内参
‑
rp和探针内参
‑
probe的含量均为0.5μm。单份样本如需检测10个种属,需要进行3管检测反应(包含一个内参基因)。
41.3)取2μl阳性标准品质粒puc57
‑
positive溶液作为模板,配置3个反应体系frp
‑
mix 1体系、frp
‑
mix 2体系和frp
‑
mix3体系。
42.frp
‑
mix 1体系、frp
‑
mix 2体系和frp
‑ꢀ
mix3体系的区别仅在于引物探针组溶液不同,frp
‑
mix 1体系、frp
‑ꢀ
mix 2体系和frp
‑
mix3体系的引物探针组溶液分别为frp
‑
mix 1溶液、frp
‑
mix 2溶液和frp
‑
mix 3溶液。frp
‑
mix 1体系、frp
‑
mix 2体系和frp
‑
mix3体系的组成均为:2
×ꢀ
probe mixture(康为世纪,货号cw0932m) 10 μl,引物探针组溶液 5 μl,阳性标准品质粒puc57
‑
positive溶液 2 μl,无酶核酸水 3 μl,合计 20 μl。
43.frp
‑
mix 1体系、frp
‑
mix 2体系和frp
‑
mix3体系均按照如下反应程序,进行荧光定量检测:95 ℃预变性10分钟;95℃变性15s,65℃退火/延伸60s,共40个循环,反应结束后采集荧光。
44.1.2.检测结果及结果分析将基线作为阈值(threshold)。rn(normalized reporter)是荧光报告基团的荧光发射强度与参比染料的荧光发射强度的比值。
△
rn是rn扣除基线后得到的标准化结果(
△
rn=rn
‑
基线),代表pcr扩增产物的量。ct(cycle threshold)指反应管内的荧光信号达到设定的阈值时所经历的循环数。
45.对阳性标准品质粒puc57
‑
positive检测的ct值如下:第1组ct值15.87,第2组ct值16.01,第3组ct值15.42,第5组ct值15.87,第6组ct值17.03,第7组ct值15.7,第8组ct值15.05,第9组ct值15.74,第10组ct值15.75,第11组ct值16.20,内参ct值17.49。
46.该特异性实验表明本试剂盒研发的引物探针组合物和内参引物探针组合物可以有效地扩增阳性标准品质粒puc57
‑
positive溶液待检种属的特定区域,特异性高(ct值基本接近但并不完全相同是由于引物和探针的扩增效率有差别)。
47.实施例2.灵敏性检测及标准曲线建立2.1.灵敏性检测使用阳性标准品质粒puc57
‑
positive检测实施例1中提供的引物和探针组合物的灵敏性。按照换算公式“(6.02
×
1023)
×
(ng/μl
×
10
‑9)/(质粒长度(bp)
×
660)=拷贝数/μl”将阳性标准品质粒puc57
‑
positive用无核酸酶水配制成浓度(拷贝数/ μl)为1e8的溶液。取阳性标准品倍比稀释,获得7个浓度梯度(拷贝数/ μl)的标准品溶液:1e2、1e3、1e4、1e5、1e6、1e7和1e8。以此7个浓度梯度的标准品作为扩增模板,分别取2μl用于扩增反应,反应体系和反应程序同实施例1。检测结果如图3和图4所示,显示阳性标准品浓度(拷贝数/ μl)为1e2时,部分目标属没有检测到相对应的荧光信号(图3中用
“‑”
表示未检测到荧光信号);所以在制作标准曲线时,取1e3、1e4、1e5、1e6、1e7和1e8中的6个连续浓度的测定数据。
48.2.2.标准曲线建立选取2.1中所述阳性质粒浓度(浓度单位为拷贝数/μl)分别为1e8、1e7、1e6、1e5、1e4、1e3,以标准品起始拷贝数的对数(log(模板dna初始拷贝数))为横坐标、以ct值为纵坐
标制做标准曲线。10个引物探针组对应的检测细菌及标准曲线的斜率和y轴截距以及r2数据如图5所示,本实验最多可建立10个属细菌的标准曲线和1个内参的标准曲线,且相关系数r2均大于0.98。
49.实施例3.特异性验证实验使用商品化的模拟微生物群落(zymbiomicstm,d6300)对本发明的方法进行验证。该模拟微生物群落的组成包括八种细菌菌株和两种真菌菌株。它包括三种易于裂解的革兰氏阴性菌(例如大肠杆菌)、五种难以裂解的革兰氏阳性菌(例如单核细胞增生李斯特菌)和两种难以裂解的酵母菌(例如新型隐球菌)。该模拟微生物群落含有的微生物有铜绿假单胞菌(pseudomonas aeruginosa)、大肠杆菌(escherichia coli)、沙门氏菌(salmonella enterica)、发酵乳杆菌(lactobacillus fermentum)、粪肠球菌(enterococcus faecalis)、金黄色葡萄球菌(staphylococcus aureus)、李斯特菌(listeria monocytogenes)、枯草芽孢杆菌(bacillus subtilis)、酿酒酵母(saccharomyces cerevisiae)、新型隐球菌(cryptococcus neoformans),其中七种菌株是已知的人类病原体,并已被 dna/rna shield
™
完全灭活。
50.该模拟微生物群落中的金黄色葡萄球菌和枯草芽孢杆菌属于本发明所提供的引物探针组合物的可检测的种属。其余8种不属于本发明引物探针组合物可检测的种属。
51.检测方法如下:提取模拟微生物群落(zymbiomicstm,d6300)的基因组dna,检测核酸浓度为9.1ng/μl。分别使用引物探针组frp
‑ꢀ
mix 1、frp
‑ꢀ
mix 2、frp
‑ꢀ
mix 3进行检测,每个检测孔取2μl作为模板进行检测;反应程序同实施例1。
52.检测的具体结果为:第7组ct值为17.6,换算浓度为5.402e 06拷贝数/μl,第11组ct值为36.8,换算浓度为2.158e 02拷贝数/μl。结果表明:芽孢杆菌属和葡萄球菌属的引物探针组结果为阳性,其他引物探针组的结果为阴性,说明本发明提供的引物探针组合物具有良好的特异性。
53.实施例4.样品检测随机选取10例母乳样本基因组dna进行测试,具体样本信息如下:s1母乳的基因组dna浓度为15.4 ng/μl,s2母乳的基因组dna浓度为2.2 ng/μl,s3母乳的基因组dna浓度为13.9 ng/μl,s4母乳的基因组dna浓度为102.4 ng/μl,s5母乳的基因组dna浓度为1.9 ng/μl,s6母乳的基因组dna浓度为172.3ng/μl,s7母乳的基因组dna浓度为19.9ng/μl,s8母乳的基因组dna浓度为69.3 ng/μl,s9母乳的基因组dna浓度为8.4 ng/μl,s10母乳的基因组dna浓度为45.6 ng/μl。引物和探针组,以及反应体系和反应程序同实施例1,检测结果如图6所示,图6中“/”表示未检测到数值。
54.根据阴性样本的检测结果,待检样本的定性检测判定规则为:ct值大于36为阴性;小于36为阳性。图6结果表明:s1样本中探针3、探针7、探针8和内参的结果呈阳性;s2样本中探针3、探针7、探针8、探针11和内参的结果呈阳性;s3样本中探针7、探针8、探针11和内参的结果呈阳性;s4样本中探针3、探针5、探针7、探针8和内参的结果呈阳性;s5样本中探针5、探针7、探针8和内参的结果呈阳性;s6样本中探针5、探针7、探针8和内参的结果呈阳性;s7样本中探针3、探针5、探针7、探针8和内参的结果呈阳性;s8样本中探针7、探针8和内参的结果呈阳性;s9样本中探针7、探针8和内参的结果呈阳性;s10样本中探针7、探针8和内参的结果呈阳性。
55.实施例5.样品中细菌的属拷贝数定量5.1.样品中细菌的属拷贝数定量选取实施例4中的s4、s6和s7作为待检样本,另分别设阴性对照,阳性对照。引物和探针组反应体系和反应程序同实例1。本次检测实验的质检中阴性对照没有扩增曲线,阳性对照的内参均有正常扩增曲线,说明本实验质量控制通过。
56.样本s4,s6和s7的定量结果:样本内部质控:3个样本s4、s6和s7的内参均有ct值,说明样本提取合格,并且有扩增反应,样本质控通过;根据标准曲线得到3个样本的定量结果如图7所示,图7中
ꢀ“‑”
表示未检测到荧光信号。图7中s4为待测母乳样本s4、s6和s7为待测母乳样本,ntc表示阴性对照,pc表示阳性对照。阴性对照均没有扩增,阳性对照和内参基因均有扩增,每个样本可同时定性检测10种目标种属是否含有,并可对阳性种属进行定量分析。
57.5.2.二代测序验证5.2.1.二代测序文库构建5.2.1.1.16sv4区扩增将s4、s6和s7基因组作为模板,使用细菌16sv4区引物universal 519f(10μm)和universal 806r(10μm)对其进行扩增。
58.引物在上海生工合成,具体序列如下:universal_519f:5'
‑ꢀ
cagcmgccgcggtaatwc
‑
3'(seq id no.35);universal_806r:5'
‑ꢀ
ggactacvsgggtatctaat
‑
3'(seq id no.36);上述序列中,m为a或c,w为a或t,v为a或g或c,s为g或c;扩增体系为:2*phanta max master mix(诺唯赞,货号为p515
‑
02),15 μl;universal_519f(10μm),1 μl;universal_806r(10μm),1 μl;基因组dna约50ng;无核酸酶水补齐至30 μl。
59.扩增程序为:第一阶段:95℃变性3min,1个循环;第二阶段:95℃变性15s,60℃退火20s,72℃延伸30s, 30个循环;第三阶段:72℃延伸5min,1个循环;第四阶段:4℃保存。
60.5.2.1.2.磁珠纯化取5.2.1.1收获的pcr产物使用dna分选磁珠(诺唯赞,货号n411
‑
02)进行纯化。纯化步骤如下:1)磁珠混匀后,室温平衡30min,备用;2)取20μl磁珠加到上步的扩增产物中,短暂涡旋混匀;3)瞬时离心,室温静置5min,使dna与磁珠充分结合;4)将pcr管置于磁力架上,静置待溶液变澄清(约2min),吸弃上清液,避免触碰磁珠;5)加170μl新鲜配置的80%无水乙醇,孵育30s,吸弃上清液,避免触碰磁珠;6)重复步骤5);7)开盖挥发乙醇(从反光到磨砂状),约3min;
8)从磁力架上取下,加42.5μl无核酸酶水,涡旋混匀,瞬时离心,室温静置5min;9)将pcr管置于磁力架上,静置待溶液变澄清(约2min),取40μl上清至新的pcr管,避免触碰磁珠。
61.5.2.2.文库富集(添加接头序列)5.2.2.1.pcr扩增取上一步纯化产物8μl作为模板进行扩增,扩增体系为:2*kapa hifi hotstart readymix(kapa,货号kk2602),25 μl;i5(诺唯赞,货号n322),1.5μl;i7(诺唯赞,货号n322),1.5μl;5.2.1的产物,8μl;无酶核酸水补齐至50 μl。
62.扩增程序为:第一阶段:95℃变性3min,1个循环;第二阶段:95℃变性15s,60℃退火20s,72℃延伸30s, 6个循环;第三阶段:72℃延伸5min,1个循环;第四阶段:4℃保存。
63.5.2.2.2.pcr产物纯化取5.2.2.1收获的pcr产物使用dna分选磁珠(诺唯赞,货号n411
‑
02)进行纯化。纯化步骤如下:1)磁珠混匀后,室温平衡30min,备用;2)向pcr体系中加50μl无核酸酶水补足至100μl;3)取60μl磁珠加到100μl的扩增产物中,涡旋混匀;4)瞬时离心,室温静置5min,使dna与磁珠充分结合;5)将pcr管置于磁力架上,静置待溶液变澄清(约2min),转移上清液至新的pcr管中,避免触碰磁珠;6)取20μl磁珠加到上清液中,涡旋混匀;7)瞬时离心,室温静置5min,使dna与磁珠充分结合;8)将pcr管置于磁力架上,静置待溶液变澄清(约2min),吸弃上清;9)加170μl新鲜配置的80%无水乙醇,室温静置30s,吸弃上清液,避免触碰磁珠;10)重复步骤9);11)开盖挥发乙醇(从反光到磨砂状),约3min,避免磁珠过分干燥;12)从磁力架上取下,加42μl无核酸酶水,涡旋混匀,瞬时离心,室温静置5min;13)将pcr管置于磁力架上,静置待溶液变澄清(约3min),取40μl上清至新的1.5ml ep管,避免触碰磁珠。
64.5.2.2.3.qubit文库定量取invitrogen预混液(invitrogen,货号q33231)198μl,加入2μl文库,在qubit4.0测定文库浓度。
65.5.2.2.4.文库测序测序仪器:illumina novaseq;测序策略:pe150;测序数据量:每个样本不低于20000reads。
66.5.2.3.二代测序数据分析
5.2.3.1.数据分析测序得到的原始数据(raw data),存在一定比例的干扰数据(dirty data),为了使信息分析的结果更加准确、可靠,首先对原始数据进行拼接、过滤,得到有效数据(clean data)。
67.原始测序数据中会包含接头信息,低质量碱基,未测出的碱基(以n表示),这些信息会对后续的信息分析造成很大的干扰,通过精细的过滤方法将这些干扰信息去除掉,最终得到的数据即为有效数据,称为clean data或clean reads。检测结果如图8所示,其中,有效率(effective rate(%))=clean reads/raw reads;q20指碱基质量值大于20(即每个碱基测序错误率小于0.01的数据占比)。
68.5.2.3.2.物种相对丰度根据信息比对生成物种相对丰度,其中三份母乳样品中待检细菌属的分度比例如图9所示。图9中,表格的第一列表示样本编号,第一行表示检出细菌属,表中数值表示细菌属的丰度(即在所有数据中的百分比)。
69.s4样本的二代测序结果显示棒状杆菌属丰度5.00%,寡养单胞菌属丰度为6.09%,芽孢杆菌属丰度为28.08%,水栖菌属丰度为4.52%;s6样本的二代测序结果显示寡养单胞菌属丰度为5.59%,芽孢杆菌属丰度为38.54%,水栖菌属丰度为25.48%;s7样本的二代测序结果显示棒状杆菌属丰度6.70%,寡养单胞菌属丰度为6.36%,芽孢杆菌属丰度为27.39%,水栖菌属丰度为5.45%。经过上述分析可得出使用本发明提供的引物探针组合物测定的样本结果与二代测序结果基本一致。
70.以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。