一种提高有效微珠比例的delisa样品及其制备与检测方法
技术领域
1.本发明属于免疫分析领域,是一种酶联免疫测定技术,具体涉及一种提高有效微珠比例的数字化酶联免疫吸附分析(digital enzyme-linked immunosorbent assay,delisa)样品,以及该样品的制备与检测方法。
背景技术:
2.elisa是在特异性免疫反应的基础上结合了酶反应的高效分析检测手段,广泛应用于肿瘤、传染病等疾病以及食品、环境等检测。rissin等人在2010年提出了数字化elisa(delisa)方法(rissin et al.,single-molecule enzyme-linked immunosorbent assay detects serum proteins at subfemtomolar concentrations.nature biotechnology,28:595-599,2010),在直径为2.7微米的微珠表面附着特异性捕获抗体,捕获抗原(对比文献中具体采用的为前列腺特异性抗原psa)后,将生物素标记的检测抗体与抗原绑定,进一步将亲和素连接的报告分子(酶分子)与检测抗体绑定,最后形成双抗体夹心的免疫复合物。将这些微珠装载到直径4.5μm、深度3.25μm的微米坑的阵列中,根据微珠和微米坑的尺度关系,可以保证每个微米坑中含≤1个微珠。然后,加入酶底物并密封微米坑,底物经酶分子催化,生成荧光产物,在激发光源激发下发出荧光,并通过光学系统检测。微米坑的容积大约为数十飞升,极小体积保证了局部高浓度的荧光分子,极大地降低了背景光的干扰。这种delisa方法对psa的检测限达到了~50am(1am=1
×
10-18
m),远低于常规的elisa。
3.一个微珠只连接一个标志物(对比文献中是psa抗原)分子并形成酶联免疫复合体是delisa的前提,根据poisson分布理论,要实现一个微珠只连接一个标志物,需要用过量的微珠与标志物结合,这样,对每个微珠,要么只有一次绑定标志物的机会,要么没有机会绑定。因此只有很少比例(1.5%)的微珠上可以形成一个酶联免疫复合体,属于有效微珠,而绝大部分微珠上(98.5%)未连接标志物,也就形不成酶联免疫复合体,属于无效微珠。
4.由于无法将有效微珠与无效微珠分离,在将微珠装载到微米坑阵列形成检测芯片时,必须同时将有效微珠和无效微珠一起装载,芯片利用率极低。
技术实现要素:
5.针对现有技术的不足,本发明的目的在于提供一种提高有效微珠比例的数字化酶联免疫吸附分析(delisa)样品,以及该样品的制备与检测方法。即提供一种对delisa检测过程中有效微珠进行富集的方法,该方法可以大幅度提高芯片检测效率。
6.该方法将待测标志物转换为有效的报告物,并定量检测,最后,将报告物数目转换为标志物数。报告物可以采用多种方式检测。如果转换的报告物是微珠携带的酶联免疫复合物,将这些有效微珠装载到微米坑阵列,将大幅度提高芯片检测效率(如果按同等微珠装载效率计,本发明的有效微珠约为100%,对比文件的有效微珠为1.5%,芯片检测效率约为对比文件的100
÷
1.5≈66倍)。
7.本发明的目的是通过如下所述的技术方案实现的:
8.本发明一方面提供了一种提高有效微珠比例的delisa样品的制备方法,包括以下步骤:
9.(1)将捕获物固定于容器内表面的活化位点,并用钝化剂封阻剩余的活化位点,再加入待检测的标志物,与捕获物结合形成捕获物-标志物免疫复合物;
10.(2)使亲和素变体结合于生物素包被的磁性微珠表面,然后使之与生物素标记的检测抗体结合,使亲和素标记的报告物酶分子与磁性微珠表面的生物素结合,形成(检测抗体
n-磁性微珠-报告物酶分子m)复合物;其中所述生物素与所述亲和素变体通过可逆的方式结合;
11.(3)将(检测抗体
n-磁性微珠-报告物酶分子m)复合物与步骤(1)中固定在容器内表面的捕获物-标志物免疫复合物特异性结合,洗去未发生特异性结合的游离态(检测抗体
n-磁性微珠-报告物酶分子m)复合物,得到(捕获物-标志物-检测抗体
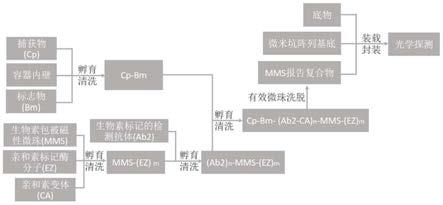
n-磁性微珠-报告物酶分子m)免疫复合物;
12.(4)解离(捕获物-标志物-检测抗体
n-磁性微珠-报告物酶分子m)免疫复合物中亲和素变体与检测抗体和/或磁性微珠上与生物素的连接,得到游离态的(磁性微珠-报告物酶分子m)和/或(检测抗体-磁性微珠-报告物酶分子m)报告复合物;
13.(5)将步骤(4)中游离态的(磁性微珠-报告物酶分子m)和/或(检测抗体-磁性微珠-报告物酶分子m)报告复合物装载到微米坑阵列中,使得每个微米坑中只容纳一个(磁性微珠-报告物酶分子m)报告复合物,再加入底物,后油封,得到所述数字化酶联免疫吸附分析样品;
14.其中,所述捕获物为抗原或抗体,n和m为不小于1的整数。
15.具体为:
16.(1)捕获物-标志物免疫复合物的制备:容器内表面经清洗后,根据其化学性质,用相应的试剂活化,用清洗缓冲液洗去未发生反应的多余活化试剂;再将捕获物(抗体或抗原)做化学修饰,使捕获物的修饰位点可以与载体内表面活化位点通过共价键或非共价键连接,据此将捕获物固定于容器内表面的活化位点,再经清洗缓冲液洗去未固定的自由捕获物,并再用钝化剂封阻剩余的活化位点,清洗缓冲液洗去多余的钝化剂;加入一定量含待测标志物(抗原或抗体)的样品,与捕获物结合形成捕获物-标志物免疫复合物,备用;
17.(2)检测抗体
n-磁性微珠-报告物酶分子m复合物的制备:用常规生化方法,将生物素包被在直径为d的磁性微珠表面,平均每个磁性微珠的生物素载量为x,x≥检测抗体分子数n 报告酶分子m,缓冲液洗去未反应的多余生物素分子,再将n个亲和素变体分子与磁性微珠表面的生物素分子绑定,清洗缓冲液洗去未反应的亲和素变体,然后用生物素标记的检测抗体与亲和素变体绑定,清洗缓冲液洗去多余未反应的检测抗体;再向磁性微珠中加入亲和素标记的报告酶分子,实现m个报告酶分子的固定,清洗缓冲液洗去多余未绑定报告酶分子,形成(检测抗体
n-磁性微珠-报告物酶分子m)复合物,所述生物素与所述亲和素变体的绑定,可以在特定条件下发生解离;
18.(3)“捕获物-标志物-检测抗体
n-磁性微珠-报告物酶分子
m”免疫复合物的富集:将步骤(2)制备的(检测抗体
n-磁性微珠-报告物酶分子m)复合物溶液添加到步骤(1)中容器内,与固定在容器内表面的捕获物-标志物免疫复合物充分地特异性结合,清洗缓冲液洗去未发生特异性结合的多余“检测抗体
n-磁性微珠-报告酶分子
m”复合物,得到固定在容器内
表面的(捕获物-标志物-检测抗体
n-磁性微珠-报告物酶分子m)免疫复合物;
19.(4)“磁性微珠-报告酶分子
m”复合物的洗脱:根据亲和素变体的特性,在利于生物素解离的条件下,使(捕获物-标志物-检测抗体
n-磁性微珠-报告物酶分子m)免疫复合物中亲和素变体与检测抗体上标记的生物素和/或磁性微珠上的生物素发生解离,得到游离态的(磁性微珠-报告物酶分子m)和/或(检测抗体-磁性微珠-报告物酶分子m)报告复合物;
20.(5)delisa检测芯片的样品制备:将单坑直径为的微米坑阵列固定到扫描仪镜头下的微流室中并密封,只留有1个进样口和1个出样口运行液体的流入和流出;将步骤(4)中游离态的(磁性微珠-报告物酶分子m)和/或(检测抗体-磁性微珠-报告物酶分子m)报告复合物通过进样口注入微米坑阵列中,其中,微米坑直径和磁性微珠直径d的关系为:使得每个微米坑中只能容纳一个报告复合物,在外加磁铁辅助下,将报告复合物装载到微米坑阵列中,得到所述delisa检测芯片样品;
21.其中,n和m为不小于1的整数。优选的,n和m平均≥1000个分子。
22.在某些具体操作方式中,上述步骤可以通过以下方式进行操作。
23.步骤(1),制备捕获物(cp)与标志物(bm)的免疫复合物(cp-bm):
24.①
首先对容器的内表面进行表面活化处理,使其携带能和cp发生特异性绑定的活性基团,然后用清洗缓冲液清洗容器;
25.②
向容器中加入cp溶液,充分孵育,使cp与容器内表面的活性基团结合,实现cp在容器内表面的固定,然后用清洗缓冲液清洗容器;
26.③
向容器中加入钝化剂溶液,封阻容器内表面上未与cp发生反应的活性位点,避免其他蛋白的绑定或非特异性吸附反应,然后用清洗缓冲液清洗容器;
27.④
加入待检测的bm溶液,容器中cp的量远大于bm的量,经充分孵育后,使bm全部和cp结合,在容器内表面形成cp-bm免疫复合物。
28.步骤(2),检测抗体(ab2)
n-磁性微珠(mms)-报告物酶分子(ez)m复合物的制备:
29.①
在一个新的容器中将适量生物素包被的mms充分分散,用一定比例的亲和素变体(am)与磁性微珠表面的生物素分子绑定,清洗缓冲液洗去未反应的am,然后用加入亲和素标记的ez与之混合,充分孵育后清洗,mms表面包被ez和am;
30.②
向容器中加入生物素标记的ab2,充分孵育,使之与表面am上的自由位点绑定。由于mms的表面积较大,一个mms上可以固定的生物素或亲和素约为5.8
×
104/μm2,直径约3.5μm磁珠的表面积为38μm2,可固定2.2
×
106个生物素或亲和素分子,足以连接多个ab2和ez。通过控制二者之间的摩尔比,能保证形成(检测抗体
n-磁性微珠-报告物酶分子m),简称(ab2)
n-mms-ezm复合物(n和m分别为ab2和ez的数量,且n≥1、m≥1);
31.③
在磁力架辅助下,移除容器中未和mms结合的游离态ab2及ez,使容器中只剩下(ab2)
n-mms-ezm复合物。
32.步骤(3),“cp-bm-(ab2)
n-mms-ez
m”免疫复合物的富集:
33.将步骤(2)中制备的(ab2)
n-mms-ezm复合物加入步骤(1)中的容器内(内含cp-bm复合物),充分孵育,使ab2与bm发生特异性结合,形成“cp-bm-(ab2)
n-mms-ez
m”免疫复合物。此步骤中要使(ab2)
n-mms-(ez)m复合物的数量大于cp-bm免疫复合物的数量,以保证每一个bm分子结合一个(ab2)
n-mms-(ez)m复合物,形成cp-bm-(ab2)
n-mms-(ez)m免疫复合物。由于
(ab2)
n-mms-ezm复合物的数量大于cp-bm免疫复合物的数量,所以,溶液中尚有大量游离的(ab2)
n-mms-ezm复合物。通过清洗去除无效微珠,容器内只剩下被固定的有效微珠(ab2与bm绑定的微珠)。
34.步骤(4),有效微珠的洗脱:
35.在步骤(3)之后,给反应系统施加利于洗脱的条件,使am与ab2和/或mms上生物素之间解离,mms释放到溶液中,获得游离态(mms-ezm)报告复合物,简称mms报告复合物,实现bm的和mms的等摩尔转换。其中,利于洗脱的条件包括但不限于改变反应体系的ph值、加入过量生物素等措施,例:对于captavidin这种am,利于洗脱的条件是将反应体系的ph值调至8~12,优选的,ph值为10;对于tamavidin 2-rev这种am,利于洗脱的条件是加入生物素,且生物素的分子数量≥4倍的tamavidin 2-rev分子数量,加入的生物素,与已与tamavidin 2-rev绑定的生物素竞争结合位点,达到洗脱的目的。由于分子间反应的力学、各清洗、溶液/容器更换等步骤造成的分子/磁性微珠的丢失和洗脱步骤的反应不彻底,所以,如此将bm分子数转换为mms数,所得到的实际mms数量小于样品的bm数量,也称为近等摩尔转换。需经标准曲线矫正,才能比较真实地反应出样品的实际bm的浓度。
36.其中,上述的充分孵育是为了使反应充分,没有指代的特定条件,可以是37℃下孵育2小时,也可以是25℃孵育10小时;适当的震荡也可以进一步缩短孵育时间。
37.在某些具体实施方式中,在步骤(1)中需要对容器的内表面积做出限定其与mms实际所占面积(即为mms直径的平方,)比值不小于6.02
×
10
10
(以待分析物的最高浓度为10pm计算,样品体积为100μl时,待测物分子数为6.02
×
10
8
个,所需有效的磁性微珠为6.02
×
10
8
个,当容器的内表面积是有效的磁性微珠总面积的100倍时,λ=1/100=0.01,根据poisson分布的计算公式,则每个面积内同时存在2个磁性微珠(k=2)的概率约为0.452%,因此可忽略一个待测物分子结合两个微米磁珠的情况),也就是所谓的容器的表面积需要足够大。
38.p(k)=λk/k! e-λ
(k=0,1,2...)
39.作为优选,步骤(1)中所述捕获物的数量不小于标志物数量的100倍。
40.在某些具体实施方式中,am包括但不限于captavidin、tamavidin 2-rev;所述亲和素变体与检测抗体的数量比值范围是2.2
×
10-6-2.2
×
106。。亲和素变体是一种特殊的亲和素,即亲和素特定位置的氨基酸发生了改变,形成了亲和素变体,这是亲和素不具备的特性;步骤五就利用了am与生物素的结合的可逆性进行洗脱。
41.优选地,所述亲和素变体(am),为captavidin,在低ph条件下利于绑定生物素。所述施加利于洗脱的条件,可以是提供溶液的酸碱度,即ph=10,或提高反应温度,有利于am与生物素解离。
42.步骤(3)中所述(检测抗体
n-磁性微珠-报告物酶分子m)复合物与所述捕获物-标志物免疫复合物的数量比值不小于1。
43.在某些具体实施方式中,所述容器的材质包括但不限于聚苯乙烯、聚乙烯、聚丙烯、玻璃等;所述钝化剂包括但不限于牛血清蛋白。
44.在某些具体实施方式中,所述报告物酶分子包括但不限于辣根过氧化物酶(hrp)、β-半乳糖苷酶(β-gal)、碱性磷酸酶(alp)中的一种;步骤(2)中所述mms与ez及ab2的固定顺
序,可以先经am将生物素标记的ab2固定到mms,然后,再将亲和素标记的ez固定到磁性微珠。也可以将次序互换,先固定ez,再固定ab2。
45.优选地,所述mms报告复合物的探测,采用光学系统。所述酶分子,hrp、β-gal、alp或其他酶类,可以有效地将底物催化生成另一种与底物颜色不同的产物,或受激发可发射与底物波长不同荧光的产物,或自动发光的产物。
46.在某些具体操作方式中,步骤(3)中所述(ab2)
n-mms-ezm复合物与所述cp-bm免疫复合物的数量比值不小于1。
47.本发明另一方面还提供了一种上述方法制备得到的delisa样品。
48.本发明另一方面还提供了一种使用上述样品进行elisa检测的方法,包括以下步骤:
49.制备若干组抗原浓度梯度不同的delisa样品,以及bm浓度未知的待测delisa样品;待所述delisa样品酶催化后,记录阳性(即有可检测底物,包括颜色、荧光或自动发光)的微米坑数量,根据bm浓度与阳性微米坑数量建立标准曲线;根据待测delisa样品的阳性微米坑数量确定其bm分子数或浓度。
50.需要指出,由于分子间的反应动力学影响,活性基团对之间的反应效率低于100%,每次更换溶液步骤的死体积效应,以及溶液清洗和溶液转移以及洗脱反应等步骤的不彻底,都会造成一定程度的分子和/或磁性微珠的丢失,需要建立标准曲线予以校正。
51.具体的检测方法为:
52.delisa检测:明场下,扫描仪扫描并记载芯片中有效报告复合物数量;暗场下,将报告物酶分子的底物经进样口加入芯片后油封,充分酶促反应后,利用光学扫描系统收集检测芯片中各微米坑中酶促产物的发射波长并记录;
53.标准曲线的建立与检测结果的转换:将浓度已知标准品稀释,配制成从1皮摩尔(1
×
10-12
摩尔)到埃摩尔(1
×
10-18
摩尔)10倍递减稀释的溶液,重复步骤(1)-(6),绘制标准曲线。根据标准曲线,将待测样品的检测结果转换为实际标志物浓度。
54.在某些具体操作方式中,上述步骤可以通过以下方式进行具体操作。
55.将上述得到的游离态报告复合物进行光学检测用于定量。将容器内的游离态mms报告复合物装载到预先制备好的微米坑阵列中。具体做法:从内含微米坑阵列的微流室的样品入口,加入mms报告复合物,利用磁铁在微米坑基底下方来回穿梭数次,通过磁力将mms报告复合物装载载到微米坑中。微米坑的直径只能容纳1个mms报告复合物,微米坑的数目远大于mms报告复合物数,因此,基本保证全部mms报告复合物都能装载到微米坑中。注入酶底物后油封,酶催化一定时间后,在光学显微镜下检测和记录。每个有亮光的微米坑即为一个阳性分子。理论上,所有阳性亮点的总和接近待测的bm数量,即近等摩尔。
56.配置不少于7个从pm至am浓度梯度的已知bm标准样本,通过上述样品制备方法得到样品,再通过上述光学检测测量不同浓度梯度的bm待测样本的最终信号响应值。此处信号响应值即为阳性微米坑数量的总和。每个样本至少重复3次,计算每个样本最终信号响应的平均值及标准偏差(sd)。以样本浓度为横坐标,样本最终信号响应的平均值为纵坐标,绘制散点图,对散点图进行线性拟合以建立标准曲线,并计算拟合度r2。根据惯例,将背景信号加上背景信号的3倍sd确定未检出限(lod)。
57.作为优选,上述的elisa方法,适用于人类和动物疾病、食品卫生及环境污染的标
志物检测。
58.一种提高有效微珠比例的delisa样品制备方法,将待测标志物(bm)转换成附载有报告物(酶分子)的微珠,通过对酶催化底物产生光学可检测产物的探测,实现对待测bm的精确定量,与传统方法相比,本方法具备以下优点:
59.(1)对有效微珠进行了富集
60.传统方法为了实现一个微珠只连接一个待测标志物,需要用过量的微珠与标志物结合,这导致最终只有很少比例的微珠上连接了报告复合物,最终形成的有效微珠比例约为总微珠数的1.5%。本方法中,步骤(1)表面积足够大的内壁表面作为固相支持载体固定捕获抗体(cp),步骤(2)中使用在不同ph、温度条件下结合能力有显著差异的亲和素变体(am)替代链霉亲和素或亲和素,为步骤(4)中的am脱吸附并将微珠分离出反应容器提供的保证;步骤(3)中将未发生特异性结合的无效微珠分离,即对有效微珠进行了富集,提高了检测过程中微米坑阵列的装载效率,理论上装载效率相当于对比文件的66倍(100
÷
1.5≈66)。
61.(2)增加了单个微珠连接的酶分子数量
62.传统方法使亲和素标记的ez和生物素标记的检测抗体(ab2)结合,ab2与bm、cp形成免疫复合体,ab2只结合一个ez分子。本方法的步骤(2)将ez直接结合在生物素包被的磁性微珠表面,生物素包被的磁性微珠提供的结合位点更多,在优选条件下结合的ez数量可提高1000倍以上,这可以进一步将delisa方法的灵敏度提高。
附图说明
63.图1是本发明的elisa检测方法的具体操作流程图;
64.图2是本发明中游离态(磁性微珠-报告物酶分子m)报告复合物的制备图示。
具体实施方式
65.以下将通过实施例来详细说明本技术的实施方式,借此对本技术如何应用技术手段来解决技术问题并达成技术功效的实现过程能充分理解并据以实施。
66.本技术中所用原料、设备,若无特别说明,均为本领域的常用原料、设备,均来自市售产品。本技术中所用方法,若无特别说明,均为本领域的常规方法。
67.本技术还存在其它多种可实施的技术方案,在此不做一一列举,本技术权利要求中要求保护的技术方案都是可以实施的。
[0068]“包含”或“包括”旨在表示组合物(例如介质)和方法包括所列举的要素,但不排除其他要素。当用于定义组合物和方法时,“基本上由
……
组成”意味着排除对于所述目的的组合具有任何重要意义的其他要素。因此,基本上由本文定义的元素组成的组合物不排除不会实质上影响要求保护的本技术的基本和新颖特征的其他材料或步骤。“由
……
组成”是指排除其他组成部分的微量元素和实质性的方法步骤。由这些过渡术语中的每一个定义的实施方案都在本技术的范围内。
[0069]
下面结合附图对本发明做进一步说明。
[0070]
其中实施例分别是使用不同的体系,制备得到了能够提高有效微珠比例的delisa样品,并对其进行了检测,以验证本方法具有普适性。
(ez)m免疫复合物。此步骤中要使(ab2)
n-mms-(ez)m复合物的数量大于cp-bm的数量,以保证每一个bm分子结合一个(ab2)
n-mms-(ez)m复合物,形成cp-bm-(ab2)
n-mms-(ez)m免疫复合物。
[0086]
步骤四,有效mms报告复合物的富集:
[0087]
上述步骤中的mms有两种存在形式,即被固定的cp-bm-(ab2)
n-mms-(ez)m免疫复合物(有效微珠)和未绑定的游离态(ab2)
n-mms-(ez)m复合物(无效微珠)。将容器内的溶液倒出并用pbst清洗3次。通过清洗去除无效微珠,容器内只剩下有效微珠。
[0088]
步骤五,有效微珠的洗脱:
[0089]
在上一步骤完成后,向反应容器内加入ph=10的缓冲溶液,使am与ab2、mms之间的结合力变弱,进而分离,使mms重新回到溶液中,获得游离态mms报告复合物,实现标志物的与微珠转换。
[0090]
步骤六,mms报告复合物的光学探测:
[0091]
(1)将步骤五中产生的游离态报告复合物进行荧光检测用于定量。将容器内的游离态mms报告复合物装载到预先制备好的微米坑阵列中。具体做法:从内含微米坑阵列的微流室的样品入口,加入mms报告复合物,利用磁铁在微米坑基底下方来回穿梭数次,通过磁力将mms报告复合物装载载到微米坑中。微米坑的直径只能容纳1个mms报告复合物,微米坑的数目远大于mms报告复合物数,因此,基本保证全部mms报告复合物都能装载到微米坑中。
[0092]
(2)滴加底物(试卤灵-β-d-吡喃半乳糖苷)后油封,酶催化一定时间后,在荧光显微镜下观察荧光反应并记录(激发波长558nm;发射波长577nm)。每个有亮光即为一个阳性分子。理论上,所有亮点的总和约等于待测的bm数量。
[0093]
步骤七,建立标准曲线:
[0094]
配置不少于5个fm及fm以下浓度梯度的bm(人cd40抗原)待测样本,分别通过步骤一至步骤六测量不同浓度梯度的bm待测样本的最终信号响应值,每个样本至少重复3次,计算每个样本最终信号响应的平均值及标准偏差(sd)。以样本浓度为横坐标,样本最终信号响应的平均值为纵坐标,绘制散点图,对散点图进行线性拟合以建立标准曲线,并计算拟合度r2。通过外推法计算检测限(lod),lod等于背景信号加上背景信号的3倍sd。
[0095]
实施例2
[0096]
本实施例提供一种新冠抗原标志物转换至辣根过氧化物酶(hrp)报告物的方法,具体如下:
[0097]
步骤一,制备捕获抗体(cp,重组小鼠抗sars-cov-2n单克隆抗体)与抗原(bm,新冠病毒n重组蛋白)的免疫复合物(cp-bm):
[0098]
(1)聚乙烯材质的容器内表面活化处理:用pbst(含0.1%吐温20的0.01m的磷酸盐缓冲液)溶液清洗容器内壁两次;将25%戊二醛溶液用pbs(磷酸盐缓冲液)稀释为8%(v/v)的戊二醛溶液,向容器内加入300μl 8%的戊二醛溶液,室温下振荡5h,用pbst重复清洗固相载体表面两次。
[0099]
(2)在容器内表面固定cp(重组小鼠抗sars-cov-2n单克隆抗体):向容器内加入300μl 8%的戊二醛溶液,使抗体室温下平衡至少15分钟,将1.00μg的cp加入容器,室温下振荡反应过夜,使cp固定在容器内表面,再用pbst溶液重复清洗容器内表面两次。
[0100]
(3)容器内表面上未反应活性位点钝化处理:剩余液体倒出,再加入0.2m乙醇胺,
室温下孵育30min使固相载体上未反应的戊二醛位点失活。用10%牛血清蛋白(bsa)溶液作封闭缓冲液,室温下孵育容器内壁30min,以确保在固相载体表面上蛋白质的非活性区域的钝化。用pbst清洗容器内表面三次,最后一次用去离子水清洗。
[0101]
(4)cp与bm特异性结合:向容器内加入bm(新冠病毒n重组蛋白),室温下振荡反应5h,与cp特异性结合形成cp-bm,bm的量要小于cp的量(1<bm的分子数<cp的分子数),确保bm全部和cp结合。
[0102]
步骤二,生物素包被的磁性微珠(mms)表面固定检测抗体(ab2,兔抗sars-cov-2n多克隆抗体)和作为报告物的酶分子(ez):
[0103]
(1)mms的分散及活化:取适量直径约3.5μm的mms放置于一支新的试管中,在室温下放置10min,漩涡震荡20s使mms充分扩散;室温下8000g离心5min,去上清(mms在ph=7.4的pbs缓冲液中扩散,mms扩散于缓冲液后形成悬浮液,静置一段时间mms会沉淀);用pbst清洗mms两次,去上清;将25%戊二醛溶液用pbs稀释为8%(v/v)的戊二醛溶液,向mms中加入350μl 8%的戊二醛溶液,室温下振荡混合5h,8000g室温下离心5min,去上清;用pbst重复清洗mms两次,弃去上清。
[0104]
(2)向试管中加入摩尔比例为1:1的tamaavidin 2-rev(亲和素变体,am)和亲和素标记的辣根过氧化物酶(ez),室温下振荡混合5h,充分孵育后,mms表面包被ez和am。用pbst重复清洗mms三次,利用磁力架分离mms和游离态的am和ez,分离之后试管中几乎不含游离态的am和ez。
[0105]
(3)向试管中加入生物素标记的ab2(兔抗sars-cov-2n多克隆抗体),室温下振荡反应5h,充分孵育,使ab2与mms表面am上的自由位点绑定。由于mms的表面积较大,一个mms上可以连接多个ab2和ez。
[0106]
(4)用磁力架分离mms和游离态的ab2,8000g室温下离心5min,去上清;用pbst重复清洗三次,弃去上清,容器中只剩下(ab2)
n-mms-(ez)m复合物。
[0107]
步骤三,(ab2)
n-mms-(ez)m与bm的特异性结合:
[0108]
将步骤二中制备的(ab2)
n-mms-(ez)m复合物加入步骤一中的容器内(内含cp-bm复合物),室温下振荡混合2h,充分孵育,使ab2与bm发生特异性结合,形成cp-bm-(ab2)
n-mms-(ez)m免疫复合物。此步骤中要使(ab2)
n-mms-(ez)m复合物的数量大于cp-bm的数量,以保证每一个bm分子结合一个(ab2)
n-mms-(ez)m复合物,形成cp-bm-(ab2)
n-mms-(ez)m免疫复合物。
[0109]
步骤四,有效mms报告复合物的富集:
[0110]
上述步骤中的mms有两种存在形式,即被固定的cp-bm-(ab2)
n-mms-(ez)m免疫复合物(有效微珠)和未绑定的游离态(ab2)
n-mms-(ez)m复合物(无效微珠)。将容器内的溶液倒出并用pbst清洗3次。通过清洗去除无效微珠,容器内只剩下有效微珠。
[0111]
步骤五,有效微珠的洗脱:
[0112]
在上一步骤完成后,向反应容器内加入0.1nm的生物素溶液(保证加入的生物素的浓度是容器内生物素浓度的105倍以上),加入的生物素与am结合,使得原来通过生物素和am结合的ab2分离,使mms重新回到溶液中,获得游离态mms报告复合物,实现标志物的与微珠转换。
[0113]
步骤六,mms报告复合物的光学探测:
[0114]
(1)将步骤五中产生的游离态报告复合物进行光学检测用于定量。将容器内的游离态mms报告复合物装载到预先制备好的微米坑阵列中。具体做法:从内含微米坑阵列的微流室的样品入口,加入mms报告复合物,利用磁铁在微米坑基底下方来回穿梭数次,通过磁力将mms报告复合物装载载到微米坑中。微米坑的直径只能容纳1个mms报告复合物,微米坑的数目远大于mms报告复合物数,因此,基本保证全部mms报告复合物都能装载到微米坑中。
[0115]
(2)滴加底物(鲁米诺)后油封,酶催化一定时间后,在显微镜下观察化学发光现象并记录(发射波长为425nm)。每个有亮光即为一个阳性分子。理论上,所有亮点的总和约等于待测的bm数量。
[0116]
步骤七,建立标准曲线:
[0117]
配置不少于5个fm及fm以下浓度梯度的bm(新冠病毒n重组蛋白)待测样本,分别通过步骤一至步骤六测量不同浓度梯度的bm待测样本的最终信号响应值,每个样本至少重复3次,计算每个样本最终信号响应的平均值及标准偏差(sd)。以样本浓度为横坐标,样本最终信号响应的平均值为纵坐标,绘制散点图,对散点图进行线性拟合以建立标准曲线,并计算拟合度r2。通过外推法计算检测限(lod),lod等于背景信号加上背景信号的3倍sd。
[0118]
实施例3
[0119]
本实施例提供一种人前列腺特异性抗原(psa)转换至辣根过氧化物酶(hrp)报告物的方法,具体如下:
[0120]
步骤一,制备捕获抗体(cp,psa单克隆抗体,来源于小鼠)与抗原(bm,psa)的免疫复合物(cp-bm):
[0121]
(1)聚丙烯材质的容器内表面活化处理:用pbst(含0.1%吐温20的0.01m的磷酸盐缓冲液)溶液清洗容器内壁两次;将25%戊二醛溶液用pbs(磷酸盐缓冲液)稀释为8%(v/v)的戊二醛溶液,向容器内加入300μl 8%的戊二醛溶液,室温下振荡5h,用pbst重复清洗容器内表面两次。
[0122]
(2)在容器内表面固定cp(psa单克隆抗体,来源于小鼠):向容器内加入300μl 8%的戊二醛溶液,使抗体室温下平衡至少15分钟,将1.00μg的cp加入容器,室温下振荡反应过夜,使cp固定在固相载体表面,再用pbst溶液重复清洗容器内表面两次。
[0123]
(3)容器内表面上未反应活性位点钝化处理:剩余液体倒出,再加入0.2m乙醇胺,室温下孵育30min使容器内表面上未反应的戊二醛位点失活。用10%牛血清蛋白(bsa)溶液作封闭缓冲液,室温下孵育容器内壁30min,以确保在容器内表面上蛋白质的非活性区域的钝化。用pbst清洗容器内表面三次,最后一次用去离子水清洗。
[0124]
(4)cp与bm特异性结合:向容器内加入bm(psa),室温下振荡反应5h,与cp特异性结合形成cp-bm,bm的量要小于cp的量(1<bm的分子数<cp的分子数),确保bm全部和cp结合。
[0125]
步骤二,生物素包被的磁性微珠(mms)表面固定检测抗体(ab2,psa多克隆抗体,来源于兔)和作为报告物的酶分子(ez):
[0126]
(1)mms的分散及活化:取适量直径约3.5μm的mms放置于一支新的试管中,在室温下放置10min,漩涡震荡20s使mms充分扩散;室温下8000g离心5min,去上清(mms在ph=7.4的pbs缓冲液中扩散,mms扩散于缓冲液后形成悬浮液,静置一段时间mms会沉淀);用pbst清洗mms两次,去上清;将25%戊二醛溶液用pbs稀释为8%(v/v)的戊二醛溶液,向mms中加入350μl 8%的戊二醛溶液,室温下振荡混合5h,8000g室温下离心5min,去上清;用pbst重复
清洗mms两次,弃去上清。
[0127]
(2)向试管中加入摩尔比例为1:1的tamaavidin 2-rev(亲和素变体,am)和亲和素标记的辣根过氧化物酶(ez),室温下振荡混合5h,充分孵育后,mms表面包被ez和am。用pbst重复清洗mms三次,利用磁力架分离mms和游离态的am和ez,分离之后试管中几乎不含游离态的am和ez。
[0128]
(3)向试管中加入生物素标记的ab2(psa多克隆抗体,来源于兔),室温下振荡反应5h,充分孵育,使ab2与mms表面am上的自由位点绑定。由于mms的表面积较大,一个mms上可以连接多个ab2和ez。
[0129]
(4)用磁力架分离mms和游离态的ab2,8000g室温下离心5min,去上清;用pbst重复清洗三次,弃去上清,容器中只剩下(ab2)
n-mms-(ez)m复合物。
[0130]
步骤三,(ab2)
n-mms-(ez)m与bm的特异性结合:
[0131]
将步骤二中制备的(ab2)
n-mms-(ez)m复合物加入步骤一中的容器内(内含cp-bm复合物),室温下振荡混合2h,充分孵育,使ab2与bm发生特异性结合,形成cp-bm-(ab2)
n-mms-(ez)m免疫复合物。此步骤中要使(ab2)
n-mms-(ez)m复合物的数量大于cp-bm的数量,以保证每一个bm分子结合一个(ab2)
n-mms-(ez)m复合物,形成cp-bm-(ab2)
n-mms-(ez)m免疫复合物。
[0132]
步骤四,有效mms报告复合物的富集:
[0133]
上述步骤中的mms有两种存在形式,即被固定的cp-bm-(ab2)
n-mms-(ez)m免疫复合物(有效微珠)和未绑定的游离态(ab2)
n-mms-(ez)m复合物(无效微珠)。将容器内的溶液倒出并用pbst清洗3次。通过清洗去除无效微珠,容器内只剩下有效微珠。
[0134]
步骤五,有效微珠的洗脱:
[0135]
在上一步骤完成后,向反应容器内加入0.1nm的生物素溶液(保证加入的生物素的浓度是容器内生物素浓度的105倍以上),加入的生物素与am结合,使得原来通过生物素和am结合的ab2分离,使mms重新回到溶液中,获得游离态mms报告复合物,实现标志物的与微珠转换。
[0136]
步骤六,mms报告复合物的光学探测:
[0137]
(1)将步骤五中产生的游离态报告复合物进行光学检测用于定量。将容器内的游离态mms报告复合物装载到预先制备好的微米坑阵列中。具体做法:从内含微米坑阵列的微流室的样品入口,加入mms报告复合物,利用磁铁在微米坑基底下方来回穿梭数次,通过磁力将mms报告复合物装载载到微米坑中。微米坑的直径只能容纳1个mms报告复合物,微米坑的数目远大于mms报告复合物数,因此,基本保证全部mms报告复合物都能装载到微米坑中。
[0138]
(2)滴加底物(鲁米诺)后油封,酶催化一定时间后,在显微镜下观察化学发光现象并记录(发射波长为425nm)。每个有亮光即为一个阳性分子。理论上,所有亮点的总和约等于待测的bm数量。
[0139]
步骤七,建立标准曲线:
[0140]
配置不少于5个fm及fm以下浓度梯度的bm(psa)待测样本,分别通过步骤一至步骤六测量不同浓度梯度的bm待测样本的最终信号响应值,每个样本至少重复3次,计算每个样本最终信号响应的平均值及标准偏差(sd)。以样本浓度为横坐标,样本最终信号响应的平均值为纵坐标,绘制散点图,对散点图进行线性拟合以建立标准曲线,并计算拟合度r2。通
过外推法计算检测限(lod),lod等于背景信号加上背景信号的3倍sd。
[0141]
实施例4
[0142]
本实施例提供一种新冠的sars-cov-2spike蛋白igm抗体标志物转换至碱性磷酸酶(alp)报告物的方法,具体如下:
[0143]
步骤一,制备捕获物(cp,sars-cov-2spike蛋白)与标志物(bm,sars-cov-2spike蛋白igm抗体)的免疫复合物(cp-bm):
[0144]
(1)玻璃材质的容器内表面活化处理:用pbst(含0.1%吐温20的0.01m的磷酸盐缓冲液)溶液清洗容器内壁两次;将25%戊二醛溶液用pbs(磷酸盐缓冲液)稀释为8%(v/v)的戊二醛溶液,向容器内加入300μl 8%的戊二醛溶液,室温下振荡5h,用pbst重复清洗容器内表面两次。
[0145]
(2)在容器内表面固定cp(sars-cov-2spike蛋白):向容器内加入300μl 8%的戊二醛溶液,使抗体室温下平衡至少15分钟,将1.00μg的cp加入容器,室温下振荡反应过夜,使cp固定在容器内表面,再用pbst溶液重复清洗容器内表面两次。
[0146]
(3)容器内表面上未反应活性位点钝化处理:剩余液体倒出,再加入0.2m乙醇胺,室温下孵育30min使容器内表面上未反应的戊二醛位点失活。用10%牛血清蛋白(bsa)溶液作封闭缓冲液,室温下孵育容器内壁30min,以确保在容器内表面上蛋白质的非活性区域的钝化。用pbst清洗容器内表面表面三次,最后一次用去离子水清洗。
[0147]
(4)cp与bm特异性结合:向容器内加入bm(sars-cov-2spike蛋白igm抗体),室温下振荡反应5h,与cp特异性结合形成cp-bm,bm的量要小于cp的量(1<bm的分子数<cp的分子数),确保bm全部和cp结合。
[0148]
步骤二,生物素包被的磁性微珠(mms)表面固定检测抗体(ab2,抗igm抗体)和作为报告物的酶分子(ez):
[0149]
(1)mms的分散及活化:取适量直径约3.5μm的mms放置于一支新的试管中,在室温下放置10min,漩涡震荡20s使mms充分扩散;室温下8000g离心5min,去上清(mms在ph=7.4的pbs缓冲液中扩散,mms扩散于缓冲液后形成悬浮液,静置一段时间mms会沉淀);用pbst清洗mms两次,去上清;将25%戊二醛溶液用pbs稀释为8%(v/v)的戊二醛溶液,向mms中加入350μl 8%的戊二醛溶液,室温下振荡混合5h,8000g室温下离心5min,去上清;用pbst重复清洗mms两次,弃去上清。
[0150]
(2)向试管中加入摩尔比例为1:1的tamaavidin 2-rev(亲和素变体,am)和亲和素标记的辣根过氧化物酶(ez),室温下振荡混合5h,充分孵育后,mms表面包被ez和am。用pbst重复清洗mms三次,利用磁力架分离mms和游离态的am和ez,分离之后试管中几乎不含游离态的am和ez。
[0151]
(3)向试管中加入生物素标记的ab2(抗igm抗体),室温下振荡反应5h,充分孵育,使ab2与mms表面am上的自由位点绑定。由于mms的表面积较大,一个mms上可以连接多个ab2和ez。
[0152]
(4)用磁力架分离mms和游离态的ab2,8000g室温下离心5min,去上清;用pbst重复清洗三次,弃去上清,容器中只剩下(ab2)n-mms-(ez)m复合物。
[0153]
步骤三,(ab2)
n-mms-(ez)m与bm的特异性结合:
[0154]
将步骤二中制备的(ab2)
n-mms-(ez)m复合物加入步骤一中的容器内(内含cp-bm复
合物),室温下振荡混合2h,充分孵育,使ab2与cp发生特异性结合,形成cp-bm-(ab2)
n-mms-(ez)m免疫复合物。此步骤中要使(ab2)n-mms-(ez)m复合物的数量大于cp-bm的数量,以保证每一个cp分子结合一个(ab2)n-mms-(ez)m复合物,形成cp-bm-(ab2)n-mms-(ez)m免疫复合物。
[0155]
步骤四,有效mms报告复合物的富集:
[0156]
上述步骤中的mms有两种存在形式,即被固定的cp-bm-(ab2)
n-mms-(ez)m免疫复合物(有效微珠)和未绑定的游离态(ab2)
n-mms-(ez)m复合物(无效微珠)。将容器内的溶液倒出并用pbst清洗3次。通过清洗去除无效微珠,容器内只剩下有效微珠。
[0157]
步骤五,有效微珠的洗脱:
[0158]
在上一步骤完成后,向反应容器内加入0.1nm的生物素溶液(保证加入的生物素的浓度是容器内生物素浓度的105倍以上),加入的生物素与am结合,使得原来通过生物素和am结合的ab2分离,使mms重新回到溶液中,获得游离态mms报告复合物,实现标志物的与微珠转换。
[0159]
步骤六,mms报告复合物的光学探测:
[0160]
(1)将步骤五中产生的游离态报告复合物进行光学检测用于定量。将容器内的游离态mms报告复合物装载到预先制备好的微米坑阵列中。具体做法:从内含微米坑阵列的微流室的样品入口,加入mms报告复合物,利用磁铁在微米坑基底下方来回穿梭数次,通过磁力将mms报告复合物装载载到微米坑中。微米坑的直径只能容纳1个mms报告复合物,微米坑的数目远大于mms报告复合物数,因此,基本保证全部mms报告复合物都能装载到微米坑中。
[0161]
(2)滴加底物(cdp-star)后油封,酶催化一定时间后,在显微镜下观察化学发光现象并记录(发射波长为475nm)。每个有亮光即为一个阳性分子。理论上,所有亮点的总和约等于待测的bm数量。
[0162]
步骤七,建立标准曲线:
[0163]
配置不少于5个fm及fm以下浓度梯度的bm(psa)待测样本,分别通过步骤一至步骤六测量不同浓度梯度的bm待测样本的最终信号响应值,每个样本至少重复3次,计算每个样本最终信号响应的平均值及标准偏差(sd)。以样本浓度为横坐标,样本最终信号响应的平均值为纵坐标,绘制散点图,对散点图进行线性拟合以建立标准曲线,并计算拟合度r2。通过外推法计算检测限(lod),lod等于背景信号加上背景信号的3倍sd。
[0164]
本技术说明书中未作详细描述的内容属于本领域技术人员的公知常识。
[0165]
如在通篇说明书及权利要求当中所提及的“包含”为一开放式用语,故应解释成“包含但不限定于”。“大致”是指在可接收的误差范围内,本领域技术人员能够在一定误差范围内解决所述技术问题,基本达到所述技术效果。
[0166]
还需要说明的是,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的商品或者系统不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种商品或者系统所固有的要素。在没有更多限制的情况下,由语句“包括一个
……”
限定的要素,并不排除在包括所述要素的商品或者系统中还存在另外的相同要素。
[0167]
上述说明示出并描述了本技术的若干优选实施例,但如前所述,应当理解本技术并非局限于本文所披露的形式,不应看作是对其他实施例的排除,而可用于各种其他组合、
修改和环境,并能够在本文所述发明构想范围内,通过上述教导或相关领域的技术或知识进行改动。而本领域人员所进行的改动和变化不脱离本技术的精神和范围,则都应在本技术所附权利要求的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
