1.本发明涉及肿瘤治疗制剂领域,尤其涉及一种基于免疫佐剂的水凝胶组合物及其应用。
背景技术:
2.肿瘤是威胁人类生存的一种恶性疾病。随着世界人口的老龄化以及生活环境和日常生活习惯的变化,因肿瘤死亡的人数每年都在急剧增加。现在,化疗和放疗是临床上除手术切外肿瘤治疗的主要方法。近年来许多研究发现,某些化疗药(蒽环类药物和奥沙利铂)以及电离辐射可以诱导肿瘤细胞免疫原性死亡,这是一种与细胞凋亡相关的独特细胞死亡途径,死亡细胞释放出内源性危险信号。在免疫原性死亡的过程中,肿瘤细胞将发生自噬,导致钙网蛋白(一种内质网钙结合蛋白)暴露在细胞表面,从而刺激树突状细胞吞噬肿瘤抗原。同时,高迁移率族蛋白b1(hmgb1)从细胞中释放,从而促进树突状细胞和垂死的肿瘤细胞之间形成稳定连接。免疫原性死亡的过程中肿瘤细胞代谢产生的高浓度三磷酸腺苷(atp)也会大量释放,atp可将树突状细胞招募到肿瘤灶中。上述事件将引发抗肿瘤免疫反应。由于上述机制,在一些临床病例中,放疗有时可能显示出远端效果,即局部肿瘤放疗后远处转移的肿瘤自发消退。
3.目前在临床开发或使用的化疗药物有很多问题,这些问题包括疏水性强,生物利用度低,不稳定,毒性更大和副作用效果,缺乏针对性等,无法完全满足肿瘤治疗的临床需求等。基于上述问题,原位水凝胶给药系统在肿瘤治疗中的应用近年来引起了越来越多的研究人员兴趣。原位水凝胶制剂一般呈溶液,悬浮液或半固体的状态,被注射到给药部位后水凝胶系统会立即发生相变,由溶液或悬浮液转变成半固体或固态。这个系统的优势包括局部和定点效应,延长的药物输送,减少药物剂量,提高生物利用度,减少副作用,改善患者的舒适度和依从性。当前,研究人员已经开发出响应于ph,温度,离子,声波或光而成胶的水凝胶系统。
4.海藻酸钠水凝胶系统是一种比较理想的肿瘤原位给药系统,属于离子介导成胶的水凝胶系统。海藻酸钠是海藻酸的钠盐,海藻酸由a-l-甘露糖醛酸(m单元)与b-d-古罗糖醛酸(g单元)依靠1,4-糖苷键连接并由不同比例的gm、mm和gg片段组成的共聚物。海藻酸钠的稳定性、溶解性、粘性和安全性,使其成为良好的药物制剂辅料。在水相中海藻酸钠的羧基可以与钙离子,铜离子等二价金属离子配位,从而形成凝胶。海藻酸钠水凝胶系统作为肿瘤原位给药系统的一个重要优势在于,其可以利用肿瘤局部组织液中的钙离子等二价金属离子成胶,相比于由ph,温度或光介导成胶,更加容易操作。目前利用海藻酸钠水凝胶直接包裹化疗药和免疫佐剂等进行肿瘤局部给药在动物肿瘤模型中表现出良好的疗效。但是,将包裹免疫佐剂的水凝胶用于增效局部放疗和放射免疫治疗目前还没有报道,特别是具有放射治疗响应性免疫佐剂释放功能的水凝胶体系还有待开发。
5.免疫佐剂可以通过增强抗原呈递细胞的抗原加工和呈递效率来增强免疫反应,从而显着提高抗原的免疫原性。现已证明在能够诱导肿瘤细胞免疫原性死亡的治疗中将免疫
佐剂引入肿瘤可有效增强抗肿瘤免疫反应并产生协同治疗效果。由于免疫佐剂的全身给药可能导致严重的副作用,例如细胞因子风暴,因此经常采用局部注射(例如通过经皮穿刺)直接将免疫佐剂给药至肿瘤。但是,在多数临床肿瘤治疗过程中,都是重复使用低剂量的化疗药或射线,以减少副作用。但是在一个疗程的化疗或放疗中,多次经皮穿刺将免疫佐剂施用于肿瘤患者会给患者造成身体和心理上的压力,而且难以在最佳时间点给于免疫佐剂。因此,需要一种智能载体,一方面实现免疫佐剂在肿瘤内的长时间滞留,另一方面又能在施加放疗/化疗的同时实现免疫佐剂的同步释放,从而达到最理想的免疫刺激效果。
技术实现要素:
6.为解决上述技术问题,本发明的目的是提供一种基于免疫佐剂的水凝胶组合物及其应用,本发明的基于免疫佐剂的水凝胶组合物能够在体内钙离子的作用下原位成胶,在肿瘤放疗过程中具有肿瘤细胞死亡标志物响应性且同步实现免疫佐剂的释放,而在放疗的间隙能够保持免疫佐剂的长时间瘤内滞留。
7.本发明的第一个目的是公开基于免疫佐剂的水凝胶组合物在制备外科放疗增敏制剂中的应用,基于免疫佐剂的水凝胶组合物包括海藻酸钠以及包裹于海藻酸钠中的水溶性免疫佐剂。
8.进一步地,基于免疫佐剂的水凝胶组合物包括海藻酸钠、肿瘤细胞死亡标志物适配体及带有延长序列的水溶性免疫佐剂,海藻酸钠与肿瘤细胞死亡标志物适配体通过肽键共价连接,延长序列与肿瘤细胞死亡标志物适配体的至少一部分序列碱基互补。
9.进一步地,肿瘤细胞死亡标志物适配体包括atp核酸适配体,atp核酸适配体的核苷酸序列包括如seq id no.1所示的序列。放疗是分多次低剂量处理,该基于免疫佐剂的水凝胶组合物的放疗增敏制剂,其对施加于肿瘤的放射治疗具有响应功能,在肿瘤放疗的同步实现免疫佐剂的释放,而在放疗的间隙能够保持免疫佐剂的长时间瘤内滞留。
10.进一步地,延长序列的核苷酸序列包括如seq id no.2所示的序列。
11.进一步地,水溶性免疫佐剂包括多聚核苷酸、cpg寡聚脱氧核苷酸、聚肌胞苷酸、polyiclc、脂多糖、胞壁肽、类脂a以及细胞因子中的一种或几种。优选地,水溶性免疫佐剂包括cpg寡聚脱氧核苷酸。
12.进一步地,外科放疗增敏制剂用于治疗实体肿瘤。优选地,实体肿瘤为结肠癌、黑色素瘤、乳腺癌、肺癌、头颈部中的一种或几种。
13.进一步地,放疗增敏制剂在单次照射0.5-10gray放射线的照射剂量下使用,总放射剂量5-80gray。
14.进一步地,放疗增敏制剂的给药方式为静脉注射给药。
15.进一步地,海藻酸钠的粘度为5-1000cp。优选地,海藻酸钠的粘度为50-200cp。
16.本发明的第二个目的是提供一种基于免疫佐剂的水凝胶组合物,包括海藻酸钠、肿瘤细胞死亡标志物适配体及带有延长序列的水溶性免疫佐剂,海藻酸钠与肿瘤细胞死亡标志物适配体通过肽键共价连接,延长序列与肿瘤细胞死亡标志物适配体的至少一部分序列碱基互补。
17.进一步地,肿瘤细胞死亡标志物适配体包括atp核酸适配体,atp核酸适配体的核苷酸序列包括如seq id no.1所示的序列。
18.进一步地,延长序列的核苷酸序列包括如seq id no.2所示的序列。
19.进一步地,水溶性免疫佐剂包括多聚核苷酸、cpg寡聚脱氧核苷酸、聚肌胞苷酸、polyiclc、脂多糖、胞壁肽、类脂a以及细胞因子中的一种或几种。
20.优选地,水溶性免疫佐剂包括cpg寡聚脱氧核苷酸(cpg-odn)。cpg-odn是一种能够提高抗原呈递细胞功能的寡聚脱氧核糖核酸(dna)序列。
21.进一步地,海藻酸钠的粘度为5-1000cp。其结构式如下:
[0022][0023]
本发明的基于免疫佐剂的水凝胶组合物中包括海藻酸钠,海藻酸钠的羧基可在肿瘤原位由钙离子介导形成水凝胶,免疫佐剂被包裹在凝胶中。利用水凝胶可以在肿瘤局部缓释免疫佐剂,减少给药次数。然而,只有在肿瘤细胞死亡(肿瘤抗原释放)的同时存在较高浓度的免疫佐剂,才能引发最佳的抗肿瘤免疫反应。常规的水凝胶体系虽然能够使免疫佐剂缓慢释放,但是这种释放不受控制,难以保证在最佳的时间点使得肿瘤局部存在合适浓度得免疫佐剂。由于本发明的组合物中利用肿瘤细胞死亡标志物适配体通过碱基配对连接水溶性免疫佐剂,在对肿瘤施加放射治疗时,放射治疗使得肿瘤细胞死亡并释放处肿瘤细胞死亡标志物(如atp),肿瘤细胞死亡标志物与肿瘤细胞死亡标志物适配体的结合力更强,使得水溶性免疫佐剂从水凝胶中释放,从而在肿瘤抗原产生的同时,使得肿瘤局部存在较高浓度的免疫佐剂,原位产生内源性肿瘤疫苗。在没有接受放疗的时候,免疫佐剂不释放而在肿瘤内长时间滞留。因此,该基于免疫佐剂的水凝胶组合物可应用于制备放疗增敏制剂以辅助增强多次低剂量放疗引发的抗肿瘤免疫反应。
[0024]
本发明的第三个目的是提供一种上述基于免疫佐剂的水凝胶组合物的制备方法,包括以下步骤:
[0025]
(1)将海藻酸钠和氨基修饰的肿瘤细胞死亡标志物适配体在溶液中进行反应,得到海藻酸钠-三磷酸腺苷核酸适配体耦联物;优选肿瘤细胞死亡标志物适配体为atp核酸适配体,其核苷酸序列包括如seq id no.1所示的序列;
[0026]
(2)将海藻酸钠-三磷酸腺苷核酸适配体耦联物与带有延长序列的水溶性免疫佐剂在缓冲液中进行dna杂交反应,得到基于免疫佐剂的水凝胶组合物,其中,延长序列与肿瘤细胞死亡标志物适配体的至少一部分序列碱基互补。
[0027]
进一步地,在步骤(1)中,海藻酸钠中的羧基和氨基修饰的肿瘤细胞死亡标志物适配体中的氨基的摩尔比为100-5000:1。优选地,海藻酸钠中的羧基和氨基修饰的肿瘤细胞死亡标志物适配体中的氨基的摩尔比为1000-1100:1。
[0028]
进一步地,在步骤(1)中,将海藻酸钠活化后再与氨基修饰的肿瘤细胞死亡标志物适配体反应。
[0029]
进一步地,采用edc在酸性条件下活化海藻酸钠,再将活化的海藻酸钠在碱性条件下与氨基修饰的肿瘤细胞死亡标志物适配体反应。具体地,步骤(1)包括如下步骤:
[0030]
(s1)将海藻酸钠的水溶液和氨基修饰的肿瘤细胞死亡标志物适配体的水溶液混匀,并调节混合溶液的ph值为4-6,然后向混合溶液中加入edc,在37℃下反应;
[0031]
(s2)向步骤(s1)的产物中加入乙酸钠溶液,混匀后加入乙醇,随后在-80℃下反应,得到海藻酸钠-三磷酸腺苷核酸适配体耦联物。
[0032]
进一步地,在步骤(s1)中,海藻酸钠的水溶液浓度为0.1-0.2mg/ml。
[0033]
进一步地,在步骤(s1)中,氨基修饰的肿瘤细胞死亡标志物适配体的水溶液浓度为0.1mmol/l。
[0034]
本发明的基于免疫佐剂的水凝胶组合物的制备过程中,通过氨基修饰的肿瘤细胞死亡标志物适配体上的氨基和海藻酸钠上的羧基形成共价键而连接到海藻酸钠上,该反应由活化剂介导。水溶性免疫佐剂通过延长序列与肿瘤细胞死亡标志物适配体发生dna杂交而组装到海藻酸钠上。水溶性免疫佐剂从海藻酸钠上释放是由于肿瘤细胞死亡标志物与肿瘤细胞死亡标志物适配体特异性结合,进而打开水溶性免疫佐剂与肿瘤细胞死亡标志物适配体形成的dna双链。
[0035]
进一步地,在步骤(1)中,氨基连接于肿瘤细胞死亡标志物适配体的5’端。优选地,在步骤(1)中,氨基修饰的肿瘤细胞死亡标志物适配体包括肿瘤细胞死亡标志物适配体及其一端的单个氨基,肿瘤细胞死亡标志物适配体是一段经由指数富集的配体系统进化(selex)技术筛选得到的寡聚脱氧核糖核酸(dna)序列,具体序列为5
’-
acctgggggagtattgcggaggaaggt-3’(seq id no.1),该序列能够与atp发生特异性的结合形成特定三维结构。
[0036]
在步骤(2)中,带有延长序列的水溶性免疫佐剂优选为带有延长序列的cpg-odn,其中cpg-odn是一种能够提高抗原呈递细胞功能的寡聚脱氧核糖核酸(dna)序列,其序列为:5
’-
tccatgacgttcctgacgtt-3’(seq id no.3),其3’端来延长一段延长序列,该延长序列由与atp核酸适配体部分互补的序列:5
’-
accttcctccgcaa-3’(seq id no.2)组成。
[0037]
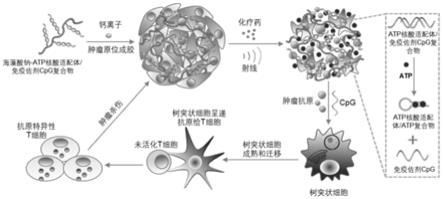
以肿瘤细胞死亡标志物适配体为atp核酸适配体为例,如图1所示,带有延长序列的cpg-odn通过dna杂交与海藻酸钠-atp核酸适配体形成具有三磷酸腺苷(atp)响应性免疫佐剂缓释功能的智能海藻酸钠水凝胶制剂,该制剂注射到肿瘤中,由肿瘤内的钙离子介导形成水凝胶,将免疫佐剂包裹其中,肿瘤接受化疗或放疗后,一方面释放大量atp,一方面形成肿瘤疫苗。肿瘤释放的atp与atp核酸适配体结合,从而将免疫佐剂释放。肿瘤内的树突状细胞摄取肿瘤疫苗和免疫佐剂后成熟,并随后迁移到淋巴结去刺激抗原特异性t细胞活化,活化的抗原特异性t细胞进而杀伤肿瘤。
[0038]
借由上述方案,本发明至少具有以下优点:
[0039]
本发明提供了一种具有免疫佐剂缓释功能的水凝胶组合物,其可以在水相中由钙离子介导迅速形成凝胶,并响应于肿瘤细胞死亡标志物以缓慢释放出水溶性免疫佐剂。
[0040]
本发明的基于免疫佐剂的水凝胶组合物可用于制备放疗增敏制剂,相比较系统给药,利用水凝胶进行肿瘤局部免疫佐剂缓释可以延长佐剂在肿瘤部位的存在时间,减少佐剂用量,提高佐剂生物利用度率,减少副作用,从而更好的增强局部放疗引发的抗肿瘤免疫反应。免疫佐剂的释放是由肿瘤细胞死亡释放的信号分子控制的,从而在肿瘤抗原产生的同时使得局部具有较高浓度的免疫佐剂,抗原加免疫佐剂可以更好的刺激抗原呈递细胞,从而激发更强的抗肿瘤免疫反应,达到1 1大于2的效果。
[0041]
上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,并可依照说明书的内容予以实施,以下以本发明的较佳实施例并配合详细附图说明如后。
附图说明
[0042]
图1是具有三磷酸腺苷(atp)响应性免疫佐剂缓释功能的智能海藻酸钠水凝胶制剂的工作原理图。
[0043]
图2是实施例1包裹免疫佐剂cpg-odn的海藻酸钠水凝胶放疗/化疗增敏制剂用于小鼠结肠癌皮下瘤模型化疗增敏结果图;
[0044]
图3是实施例2海藻酸钠-三磷酸腺苷核酸适配体耦联物电泳分析结果图:泳道1为三磷酸腺苷核酸适配体,泳道2-7为海藻酸钠-三磷酸腺苷核酸适配体耦联物;
[0045]
图4是实施例2具有三磷酸腺苷(atp)响应性免疫佐剂缓释功能的智能海藻酸钠水凝胶制剂电泳分析结果图:泳道1为三磷酸腺苷核酸适配体(a-apt),泳道2为cpg-odn,泳道3为三磷酸腺苷核酸适配体和cpg-odn形成的双链(a-apt/cpg),泳道4、5、6依次为海藻酸钠-三磷酸腺苷核酸适配体耦联物和cpg-odn以不同比例杂交后产物(alg-a-apt/cpg(apt:cpg=2:1)、alg-a-apt/cpg(apt:cpg=1:1)、alg-a-apt/cpg(apt:cpg=1:2)),泳道7为海藻酸钠-三磷酸腺苷核酸适配体耦联物(alg-a-apt);
[0046]
图5是实施例2中atp响应性免疫佐剂cpg-odn释放测试结果图;
[0047]
图6是实施例3中具有三磷酸腺苷(atp)响应性免疫佐剂缓释功能的智能海藻酸钠水凝胶制剂用于小鼠结肠癌皮下瘤模型的化疗增敏结果图;
[0048]
图7是实施例4中具有三磷酸腺苷(atp)响应性免疫佐剂缓释功能的智能海藻酸钠水凝胶制剂用于小鼠结肠癌皮下瘤模型的化疗增敏中免疫反应评价结果图;
[0049]
图8为实施例5中具有三磷酸腺苷(atp)响应性免疫佐剂缓释功能的智能海藻酸钠水凝胶制剂用于小鼠结肠癌皮下瘤模型化疗增敏中治愈小鼠的免疫记忆功能评价结果图;
[0050]
图9为实施例6中具有三磷酸腺苷(atp)响应性免疫佐剂缓释功能的智能海藻酸钠水凝胶制剂用于小鼠结肠癌皮下瘤模型的放疗增敏结果图;
[0051]
图10为实施例7中具有三磷酸腺苷(atp)响应性免疫佐剂缓释功能的智能海藻酸钠水凝胶制剂用于小鼠黑色素瘤模型的放疗增敏结果图;
[0052]
图11为实施例8中具有三磷酸腺苷(atp)响应性免疫佐剂缓释功能的智能海藻酸钠水凝胶制剂联合免疫检查点抑制剂用于增强外放射治疗的远端瘤抑制效应结果图;
[0053]
图12为实施例9中具有三磷酸腺苷(atp)响应性免疫佐剂缓释功能的智能海藻酸钠水凝胶制剂联合免疫检查点抑制剂用于增强乳腺癌原位瘤放射治疗效果的结果图。
具体实施方式
[0054]
下面结合实施例,对本发明的具体实施方式作进一步详细描述。以下实施例用于说明本发明,但不用来限制本发明的范围。
[0055]
实施例1、一种包裹免疫佐剂cpg-odn的海藻酸钠水凝胶放疗/化疗增敏制剂的制备及应用
[0056]
(1)称取400mg海藻酸钠,溶解于9.6ml无菌去离子水中,反复震荡溶解,制成4%海藻酸钠水溶液。
[0057]
(2)cpg寡聚脱氧核苷酸(cpg-odn,核苷酸序列如seq id no.3所示)干粉用无菌去离子水溶解,终浓度1mmol/l。
[0058]
(3)将步骤(1)和步骤(2)中的溶液按照一定比例混合,并加去离子水调整海藻酸酸钠的终浓度为10-20mg/ml,得到包裹免疫佐剂cpg-odn的海藻酸钠水凝胶放疗/化疗增敏制剂。
[0059]
包裹免疫佐剂cpg-odn的海藻酸钠水凝胶放疗/化疗增敏制剂用于小鼠结肠癌皮下瘤模型化疗增敏:小鼠ct26结肠癌肿瘤接种后第7天开始进行治疗。将携带肿瘤的balb/c小鼠随机分为以下4组(每组6只):第1组,对照组(不治疗,untreated);第2组,瘤内注射海藻酸钠,静脉注射奥沙利铂(alg oxpt);第3组,瘤内注射包裹免疫佐剂cpg-odn的海藻酸钠水凝胶放疗/化疗增敏制剂(alg/cpg);第4组,瘤内注射包裹免疫佐剂cpg-odn的海藻酸钠水凝胶放疗/化疗增敏制剂,静脉注射奥沙利铂(alg/cpg oxpt);每组治疗中海藻酸钠终浓度为10mg/ml,瘤内注射体积为25μl,每只小鼠的cpg-odn剂量为15μg。在第7、10、13和16天以3mg/kg体重的剂量静脉注射奥沙利铂。对小鼠进行相应的治疗后,测量其肿瘤的生长。
[0060]
图2(a)(b)分别为实验过程中肿瘤体积随时间变化情况及小鼠存活率随时间变化情况。结果表明(图2),相比较对照组,第3组肿瘤生长仅得到了部分抑制,第2组肿瘤生长得到了较明显的抑制,而第4组的肿瘤生长则得到更为明显的抑制,有1/6肿瘤完全清除。表明包裹免疫佐剂cpg-odn的海藻酸钠水凝胶放疗/化疗增敏制剂能够在一定程度上增强化疗地效果。
[0061]
实施例2、具有三磷酸腺苷(atp)响应性免疫佐剂缓释功能的智能海藻酸钠水凝胶制剂的制备
[0062]
(1)海藻酸钠与atp核酸适配体耦联物的制备:将0.2mg/ml低粘度海藻酸钠(粘度为20-100cp)和0.1mmol/l5’端修饰单个氨基的atp核酸适配体(seq id no.1:5
’-
acctgggggagtattgcggaggaaggt-3’)混合,其中海藻酸钠中的羧基与atp核酸适配体耦联物中的氨基的摩尔比等于1000:1,用5倍浓缩mes缓冲液将ph调至5。
[0063]
(2)称所需质量的edc
·
hcl粉末迅速加入上述混合物溶液,其中edc
·
hcl与海藻酸钠羧基的摩尔比等于100:1,反应在37℃下进行,期间不断震荡反应。
[0064]
(3)加入3m乙酸钠溶液,其体积为上述步骤(2)得到的反应混合物体积的1/8,然后加入乙醇,其体积为前述混合物体积的3.75倍,随后在-80℃下放置10分钟,然后在4℃下以10,000g离心10分钟。
[0065]
(4)离心所得沉淀用去离子水溶解,重复步骤(3)1次,所得沉淀即海藻酸钠-三磷酸腺苷核酸适配体耦联物,用磷酸盐缓冲液溶解。反应原理如图3a所示。
[0066]
对海藻酸钠-三磷酸腺苷核酸适配体耦联物进行非变性聚丙烯酰胺凝胶电泳分析,结果显示(图3b),与三磷酸腺苷核酸适配体相比,实施例1制备的海藻酸钠-三磷酸腺苷核酸适配体耦联物表现出明显的电泳迁移滞后现象,表明海藻酸钠与三磷酸腺苷核酸适配体发生耦联,分子量变大,导致电泳迁移率变慢。
[0067]
(5)带有延长序列的cpg-odn与海藻酸钠-三磷酸腺苷核酸适配体耦联物组装:其中,带有延长序列的cpg-odn的序列如seq id no.4所示:5
’-
tccatgacgttcctgacgttaccttcctccgcaa-3’。将延长序列的cpg-odn溶解于磷酸盐缓冲液,浓度为0.1mm。将得到的溶液与海藻酸钠-三磷酸腺苷核酸适配体耦联物混合,放4℃冰箱中反应2小时以上,其中带有延长
序列的cpg-odn与三磷酸腺苷核酸适配体的摩尔比为1:2。所得样品即为具有三磷酸腺苷(atp)响应性免疫佐剂缓释功能的智能海藻酸钠水凝胶制剂。反应原理如图4a所示。
[0068]
将智能海藻酸钠水凝胶制剂进行非变性聚丙烯酰胺凝胶电泳分析,结果显示(图4b),与海藻酸钠-三磷酸腺苷核酸适配体耦联物相比,智能海藻酸钠水凝胶制剂表现出明显的电泳迁移滞后现象,表明带有延长序列的cpg-odn与三磷酸腺苷核酸适配体发生杂交而组装到海藻酸钠分子上,从而智能海藻酸钠水凝胶制剂分子量更大,导致电泳迁移率变慢。
[0069]
(6)atp响应性免疫佐剂cpg-odn释放测试:为了能够监测cpg-odn从水凝胶中的释放,采用一端修饰有荧光团的cpg-odn,根据实施例1和3,制备具有三磷酸腺苷(atp)响应性免疫佐剂缓释功能的智能海藻酸钠水凝胶制剂。制备好的智能海藻酸钠水凝胶制剂与质量浓度为4%的海藻酸钠溶液混合,至海藻酸钠的最终浓度为1%。将混合物缓慢转入浓度为10mmol/l的氯化钙溶液中,5分钟后,移出氯化钙溶液,加入含有一定浓度atp溶液的氯化钙溶液,每隔1小时取出溶液进行荧光定量,然后再次补充相同体积的含有一定浓度atp溶液的氯化钙溶液。释放原理如图5a所示。
[0070]
测试结果显示(图5b),atp可以引发cpg-odn从海藻酸钠水凝胶中的释放,而且atp浓度越高,释放速率越快。
[0071]
实施例3、一种具有三磷酸腺苷(atp)响应性免疫佐剂缓释功能的智能海藻酸钠水凝胶制剂用于小鼠结肠癌皮下瘤模型的化疗增敏
[0072]
小鼠ct26结肠癌肿瘤接种后第7天开始进行治疗。将携带肿瘤的balb/c小鼠随机分为以下6组(每组6只):第1组,对照组(不治疗,untreated);第2组,瘤内注射海藻酸钠,静脉注射奥沙利铂(alg oxpt);第3组,瘤内注射海藻酸钠和cpg-odn的混合物(alg/cpg);第4组,瘤内注射海藻酸钠和cpg-odn的混合物,静脉注射奥沙利铂(alg/cpg oxpt);第5组,瘤内注射实施例2步骤(5)得到的具有三磷酸腺苷(atp)响应性免疫佐剂缓释功能的智能海藻酸钠水凝胶制剂(alg-aapt/cpg);第6组,瘤内注射具有实施例2步骤(5)得到的三磷酸腺苷(atp)响应性免疫佐剂缓释功能的智能海藻酸钠水凝胶制剂,静脉注射奥沙利铂(alg-aapt/cpg oxpt)。每组治疗中海藻酸钠终浓度为10mg/ml,瘤内注射体积为25μl,每只小鼠的cpg-odn剂量为15μg。在第7、10、13和16天以3mg/kg体重的剂量静脉注射奥沙利铂。对小鼠进行相应的治疗后,测量其肿瘤的生长,治疗流程示意图如图6(a)所示。
[0073]
图6(b)(c)分别为实验过程中肿瘤体积随时间变化情况及小鼠存活率随时间变化情况。结果表明(图6),相比较对照组,第2组、第3组、第4组和第5组的肿瘤生长仅得到了部分抑制,而第6组的肿瘤生长则得到了有效的抑制,部分小鼠肿瘤完全消退。表明具有三磷酸腺苷(atp)响应性免疫佐剂缓释功能的智能海藻酸钠水凝胶制剂联合低剂量化疗能够实现对肿瘤的高效协同杀灭。
[0074]
实施例4、一种具有三磷酸腺苷(atp)响应性免疫佐剂缓释功能的智能海藻酸钠水凝胶制剂用于小鼠结肠癌皮下瘤模型的化疗增敏中免疫反应评价
[0075]
小鼠ct26结肠癌肿瘤接种后第7天开始进行治疗。将携带肿瘤的balb/c小鼠随机分为以下4组(每组6只):第1组,对照组(不治疗,untreated);第2组,瘤内注射海藻酸钠,静脉注射奥沙利铂(oxpt);第3组,瘤内注射实施例2步骤(5)得到的具有三磷酸腺苷(atp)响应性免疫佐剂缓释功能的智能海藻酸钠水凝胶制剂(alg-a-apt/cpg);第4组,瘤内注射实
施例2步骤(5)得到的具有三磷酸腺苷(atp)响应性免疫佐剂缓释功能的智能海藻酸钠水凝胶制剂,静脉注射奥沙利铂(alg-a-apt/cpg@oxpt)。每组治疗中海藻酸钠终浓度为10mg/ml,瘤内注射体积为25μl,每只小鼠的cpg-odn剂量为15μg。在第7、10、13和16天以3mg/kg体重的剂量静脉注射奥沙利铂。治疗开始后第5天,处死每组小鼠,鉴定腹股沟淋巴结中树突状细胞的成熟度,肿瘤中cd8阳性t细胞的百分比,以及cd8阳性t细胞和调节性t细胞的比例。
[0076]
评价结果显示(图7),相比较对照组,第2组和第3组治疗没有明显提高淋巴结中树突状细胞(dc)的成熟度,肿瘤中cd8阳性t细胞的百分比,以及cd8阳性t细胞和调节性t细胞的比例,而第4组治疗明显提高了淋巴结中树突状细胞的成熟度,肿瘤中cd8阳性t细胞的百分比,以及cd8阳性t细胞和调节性t细胞的比例。表明具有三磷酸腺苷(atp)响应性免疫佐剂缓释功能的智能海藻酸钠水凝胶制剂能够显著增强多次低剂量化疗引发的抗肿瘤免疫反应。
[0077]
实施例5、一种具有三磷酸腺苷(atp)响应性免疫佐剂缓释功能的智能海藻酸钠水凝胶制剂用于小鼠结肠癌皮下瘤模型化疗增敏中治愈小鼠的免疫记忆功能评价
[0078]
实施例4中的各组小鼠在开始治疗后70天,从肿瘤完全消退的小鼠(cured group)中收集了外周血,鉴定记忆性cd8阳性t细胞。然后再次将小鼠ct26结肠肿瘤重新接种到肿瘤完全消退小鼠的皮下,以及未治疗的小鼠(naive group)作为对照,接种肿瘤后监测肿瘤生长状态。
[0079]
图8(a1)(a2)(b)为免疫评价结果,图8(c)(d)分别为实验过程中肿瘤体积随时间变化情况及小鼠存活率随时间变化情况。评价显示,肿瘤完全消退的小鼠(图8(a2)(b))外周血中cd8阳性效应记忆t细胞的百分比显着高于相同周龄的未治疗小鼠(图8(a1)(b))。肿瘤完全消退的小鼠的身上也未发现明显的肿瘤生长,而未经过治疗的小鼠身上肿瘤迅速生长。表明化疗联合具有三磷酸腺苷(atp)响应性免疫佐剂缓释功能的智能海藻酸钠水凝胶制剂治愈的小鼠会产生有效的免疫记忆。
[0080]
实施例6、一种具有三磷酸腺苷(atp)响应性免疫佐剂缓释功能的智能海藻酸钠水凝胶制剂用于小鼠结肠癌皮下瘤模型的放疗增敏
[0081]
小鼠ct26结肠癌肿瘤接种后第7天开始进行治疗。将携带肿瘤的balb/c小鼠随机分为以下4组(每组6只):第1组,对照组(不治疗,unteated);第2组,瘤内注射海藻酸钠,肿瘤局部x射线照射(剂量为8gray)(rt);第3组,瘤内注射实施例2步骤(5)得到的具有三磷酸腺苷(atp)响应性免疫佐剂缓释功能的智能海藻酸钠水凝胶制剂(alg-aapt/cpg);第4组,瘤内注射实施例2步骤(5)得到的具有三磷酸腺苷(atp)响应性免疫佐剂缓释功能的智能海藻酸钠水凝胶制剂,肿瘤局部x射线照射(剂量为8gray)(alg-aapt/cpg rt)。每组治疗中海藻酸钠终浓度为10mg/ml,瘤内注射体积为25μl,每只小鼠的cpg-odn剂量为15μg。在第7、9、11和13天以2gray每个肿瘤的剂量进行照射。治疗流程示意图如图9(a)所示。
[0082]
图9(b)(c)分别为实验过程中肿瘤体积随时间变化情况及小鼠存活率随时间变化情况。实验结果显示(图9),相比较对照组,第2组和第3组的肿瘤生长仅得到了部分抑制,而第4组的肿瘤生长则得到了有效的抑制,全部小鼠肿瘤都完全消退。表明具有三磷酸腺苷(atp)响应性免疫佐剂缓释功能的智能海藻酸钠水凝胶制剂联合低剂量放疗能够实现对肿瘤的高效协同杀灭。
[0083]
实施例7、一种具有三磷酸腺苷(atp)响应性免疫佐剂缓释功能的智能海藻酸钠水凝胶制剂用于小鼠黑色素瘤模型的放疗增敏
[0084]
小鼠b16黑色素瘤接种后第7天开始进行治疗。将携带肿瘤的c57小鼠随机分为以下4组(每组6只):第1组,对照组(不治疗,untreated);第2组,瘤内注射海藻酸钠,肿瘤局部采用8gray剂量的x射线照射(rt);第3组,瘤内注射实施例2步骤(5)得到的具有三磷酸腺苷(atp)响应性免疫佐剂缓释功能的智能海藻酸钠水凝胶制剂(alg-aapt/cpg);第4组,瘤内注射实施例2步骤(5)得到的具有三磷酸腺苷(atp)响应性免疫佐剂缓释功能的智能海藻酸钠水凝胶制剂,肿瘤局部采用8gray剂量的x射线照射(alg-aapt/cpg rt)。每组治疗中海藻酸钠终浓度为10mg/ml,瘤内注射体积为25μl,每只小鼠的cpg-odn剂量为15μg。在第7、9、11和13天以2gray每个肿瘤的剂量进行照射。治疗流程示意图如图10(a)所示。
[0085]
图10(b)(c)分别为实验过程中肿瘤体积随时间变化情况及小鼠存活率随时间变化情况。实验结果显示(图10),相比较对照组,第2组和第3组的肿瘤生长仅得到了部分抑制,而第4组的肿瘤生长则得到了有效的抑制,小鼠生存期有效延长。表明具有三磷酸腺苷(atp)响应性免疫佐剂缓释功能的智能海藻酸钠水凝胶制剂联合低剂量放疗能够实现对黑色素瘤的有效抑制。
[0086]
实施例8、一种具有三磷酸腺苷(atp)响应性免疫佐剂缓释功能的智能海藻酸钠水凝胶制剂用于增强外放射治疗的远端瘤抑制效应
[0087]
如图所示,在小鼠背部两侧皮下分别接种两个结肠癌肿瘤,接种后第7天开始进行治疗。将携带肿瘤的balb/c小鼠随机分为以下6组(每组6只):第1组,对照组(不治疗,unteated);第2组,静脉注射免疫检查点抑制剂pd1抗体(apd1);第3组,肿瘤局部x射线照射(剂量为8gray)(rt);第4组,瘤内注射实施例2步骤(5)得到的具有三磷酸腺苷(atp)响应性免疫佐剂缓释功能的智能海藻酸钠水凝胶制剂(alg-aapt/cpg),肿瘤局部x射线照射(剂量为8gray)(rt);第5组,静脉注射免疫检查点抑制剂pd1抗体(apd1),肿瘤局部x射线照射(剂量为8gray)(rt);第6组,瘤内注射实施例2步骤(5)得到的具有三磷酸腺苷(atp)响应性免疫佐剂缓释功能的智能海藻酸钠水凝胶制剂,肿瘤局部x射线照射(剂量为8gray),静脉注射免疫检查点抑制剂pd1抗体(alg-aapt/cpg rt)。每组治疗中海藻酸钠终浓度为10mg/ml,瘤内注射体积为25μl,每只小鼠的cpg-odn剂量为15μg。在第7、9、11和13天以2gray每个肿瘤的剂量进行照射。在第8天和第11天以10ug每只小鼠的剂量进行静脉注射免疫检查点抑制剂pd1抗体。治疗流程示意图如图11a所示。
[0088]
图11(b)(c)(d)分别为实验过程中原位瘤(b)和远端肿瘤体(c)积随时间变化情况及小鼠存活率随时间变化情况(d)。实验结果显示(图11),肿瘤生长曲线和相应的统计数据表明,单独的apd1或单独的rt在抑制两侧肿瘤生长方面显示出有限的功效。由于通过alg-aapt/cpg增强了rt诱导的抗肿瘤免疫反应,rt alg-aapt/cpg处理可消除右侧6个局部肿瘤中的4个,并明显延迟了远处肿瘤(左侧)的生长。然而,该组中大多数远处的肿瘤以后仍显示出快速的生长。值得注意的是,apd1进一步增强了rt alg-aapt/cpg的功效,消除了右侧的所有局部肿瘤以及消除了左侧的6个远处肿瘤中的5个。
[0089]
实施例9、一种具有三磷酸腺苷(atp)响应性免疫佐剂缓释功能的智能海藻酸钠水凝胶制剂用于增强乳腺癌原位瘤放射治疗效果
[0090]
如图所示,在小鼠腹部两侧皮下接种乳腺癌肿瘤,接种后第7天开始进行治疗。将
携带肿瘤的balb/c小鼠随机分为以下6组(每组6只):第1组,对照组(不治疗,unteated);第2组,静脉注射免疫检查点抑制剂pd1抗体(apd1);第3组,肿瘤局部x射线照射(剂量为8gray)(rt);第4组,静脉注射免疫检查点抑制剂pd1抗体(apd1),肿瘤局部x射线照射(剂量为8gray)(rt);第5组,瘤内注射实施例2步骤(5)得到的具有三磷酸腺苷(atp)响应性免疫佐剂缓释功能的智能海藻酸钠水凝胶制剂(alg-aapt/cpg),肿瘤局部x射线照射(剂量为8gray)(rt);第6组,瘤内注射实施例2步骤(5)得到的具有三磷酸腺苷(atp)响应性免疫佐剂缓释功能的智能海藻酸钠水凝胶制剂,肿瘤局部x射线照射(剂量为8gray),静脉注射免疫检查点抑制剂pd1抗体(alg-aapt/cpg rt)。每组治疗中海藻酸钠终浓度为10mg/ml,瘤内注射体积为25μl,每只小鼠的cpg-odn剂量为15μg。在第7、9、11和13天以2gray每个肿瘤的剂量进行照射。在第8天和第11天以10ug每只小鼠的剂量进行静脉注射免疫检查点抑制剂pd1抗体。治疗流程示意图如图12(a)所示。
[0091]
结果如图12所示,单独的apd1或单独的rt导致抑制肿瘤生长的功效有限(图12b)。如预期的那样,rt alg-aapt/cpg apd1治疗导致最显着的肿瘤生长抑制以及大大延长的动物存活,与rt apd1或rt alg-aapt/cpg相比,具有更好的治疗反应(图12b-c)。在第27天进一步获得了原发肿瘤体积超过1000mm3的小鼠肺,用于统计转移性结节。代表性的肺部照片显示,尽管未治疗的小鼠的肺中有致密的转移性结节(黑色箭头所示),但rt alg-aapt/cpg apd1的治疗可显着抑制肿瘤转移(图12d)。在苏木精-曙红(h&e)染色中进一步观察到代表性肺组织的病理变化,这也证实了rt alg-aapt/cpg apd1的治疗可以显着抑制4t1肿瘤的肺转移。
[0092]
以上仅是本发明的优选实施方式,并不用于限制本发明,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和变型,这些改进和变型也应视为本发明的保护范围。
[0093][0094]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。