light chain,vl)的单链抗体可变区片段(scfv)区的胞外域,(ii)跨膜结构域;以及(iii)内结构域(endodomain),其中当所述scfv与磷脂酰肌醇蛋白聚糖2接合时,所述内结构域包含信号转导功能。
12.受体的特征可在于分别为seq id no:5和6的vh和vl序列;在于分别为seq id no:7和8的vh和vl序列,或在于分别为seq id no:9和10的vh和vl序列。
13.scfv的特征可在于分别与seq id no:5和6具有80%的同源性,并且具有seq id no:11至13的vh cdr和seq id no:14至16的vl cdr的vh和vl序列;或在于分别与seq id no:7和8具有80%的同源性,并且具有seq id no:17至19的vh cdr和seq id no:20至22的vl cdr的vh和vl序列;或在于分别与seq id no:9和10具有80%的同源性,并且具有seq id no:23至25的vh cdr和seq id no:26至28的vl cdr的vh和vl序列。
14.受体的特征可在于分别与seq id no:5和6具有90%的同源性,并且具有seq id no:11至13的vh cdr和seq id no:14至16的vl cdr的vh和vl序列;或在于分别与seq id no:7和8具有90%的同源性,并且具有seq id no:17至19的vh cdr和seq id no:20至22的vl cdr的vh和vl序列;或在于分别与seq id no:9和10具有90%的同源性,并且具有seq id no:23至25的vh cdr和seq id no:26至28的vl cdr的vh和vl序列。
15.受体可包含选自seq id no:1、2和3的序列;或者可包含与seq id no:1、2或3具有80%的同源性,并且分别具有seq id no:11至13、17至19和23至25的vh cdr以及分别具有seq id no:14至16、20至22和26至28的vl cdr的序列,或者可包含与seq id no:1、2或3具有90%的同源性,并且分别具有seq id no:11至13、17至19和23至25的vh cdr以及分别具有seq id no:14至16、20至22和26至28的vl cdr的序列。
16.跨膜和内结构域可来源于同一分子。内结构域可包含cd3-ζ结构域或高亲和力fcεri。scfv可包含位于所述vh和vl之间的柔性接头,例如其中该柔性接头来自cd8α、ig或seq id no:4。scfv可排列为vh-接头-vl或vl-接头-vh。
17.还提供了编码如上限定的嵌合抗原受体的核酸,例如mrna或dna,或表达如上限定的嵌合抗原受体的细胞,例如原核细胞或真核细胞,并且特别是经改造的t细胞。
18.在另一个实施方案中,提供了治疗患有表达或过表达磷脂酰肌醇蛋白聚糖2的癌症的对象的方法,其包括向所述对象施用如上限定的嵌合抗原受体、如上限定的核酸或如上限定的细胞,例如t细胞,例如所述对象自体的t细胞。
19.该方法还可包括向所述对象施用第二抗癌治疗。第二癌症治疗可以是辐射、化学治疗、放射治疗、激素治疗、免疫治疗、毒素治疗或手术。免疫治疗可以是检查点抑制剂治疗。第二癌症治疗可与所述受体、核酸或细胞同时施用,或者可在所述受体、核酸或细胞之前或之后施用。第二癌症治疗可施用多于一次。受体、核酸或细胞可施用多于一次。
20.癌症可具有药物抗性、转移性或复发性。对象可以是人或非人哺乳动物。癌症可以是小儿癌症或成人癌症。癌症可以是白血病,例如选自以下的白血病:急性淋巴细胞白血病(acute lymphoblastic leukemia,all)、急性淋巴细胞b细胞白血病、急性淋巴细胞t细胞白血病、急性髓细胞性白血病(acute myeloblastic leukemia,aml)、急性早幼粒细胞白血病(acute promyelocytic leukemia,apl)、急性单核细胞白血病、急性红白血病(acute erythroleukemic leukemia)、急性巨核细胞白血病、急性粒单核细胞白血病、急性非淋巴细胞白血病、急性未分化白血病、慢性髓细胞白血病(chronic myelocytic leukemia,
cml)、慢性淋巴细胞白血病(chronic lymphocytic leukemia,cll)和毛细胞白血病。
21.癌症可以是实体瘤癌症,例如肺癌、肝癌、胰腺癌、胃癌、结肠癌、肾癌、脑癌、头颈癌、乳腺癌、皮肤癌、直肠癌、子宫癌、宫颈癌、卵巢癌、睾丸癌、皮肤癌或食管癌。癌症还可包括肉瘤细胞、横纹肌样癌细胞、神经母细胞瘤细胞、视网膜母细胞瘤细胞或髓母细胞瘤细胞。癌症可以是子宫癌肉瘤(uterine carcinosarcoma,ucs)、脑低级别胶质瘤(brain lower grade glioma,lgg)、胸腺瘤(thymoma,thym)、睾丸生殖细胞肿瘤(testicular germ cell tumor,tgct)、多形性胶质母细胞瘤(glioblastoma multiforme,gbm)和皮肤的皮肤黑素瘤(skin cutaneous melanoma,skcm)、肝细胞肝癌(liver hepatocellular carcinoma,lihc)、葡萄膜黑素瘤(uveal melanoma,uvm)、肾嫌色细胞癌(kidney chromophobe,kich)、甲状腺癌(thyroid cancer,thca)、肾透明细胞肾癌(kidney renal clear cell carcinoma,kirc)、肾乳头状细胞肾癌(kidney renal papillary cell carcinoma,kirp)、胃腺癌(stomach adenocarcinoma,stad)、胆管癌(cholangiocarcinoma,chol)、腺样囊性癌(adenoid cystic carcinoma,acc)、前列腺腺癌(prostate adenocarcinoma,prad)、嗜铬细胞瘤和副神经节瘤(pheochromocytoma and paraganglioma,pcpg)、dlbc、肺腺癌(lung adenocarcinoma,luad)、头颈部鳞状细胞癌(head-neck squamous cell carcinoma,hnsc)、胰腺腺癌(pancreatic adenocarcinoma,paad)、乳腺癌(breast cancer,brca)、间皮瘤(mesothelioma,meso)、结肠和直肠腺癌(colon and rectal adenocarcinoma,coad)、直肠腺癌(rectum adenocarcinoma,read)、食管癌(esophageal carcinoma,esca)、卵巢癌(ovarian cancer,ov)、肺鳞状细胞癌(lung squamous cell carcinoma,lusc)、膀胱尿路上皮癌(bladder urothelial carcinoma,blca)、肉瘤(sarcoma,sarc)或子宫体子宫内膜癌(uterine corpus endometrial carcinoma,ucec)。
22.还提供了编码嵌合抗原受体(car)的分离的核酸分子,其中car包含抗原结合结构域、柔性铰链结构域、跨膜结构域、共刺激信号传导区和胞内信号传导结构域,并且其中抗原结合结构域选择性地与癌细胞相关磷脂酰肌醇蛋白聚糖2(gpc2)结合。抗原结合结构域可包含抗体或其抗原结合片段。抗原结合片段可以是fab、单链可变片段(scfv)或单域抗体。编码的抗原结合结构域可包含(a)包含seq id no:30的氨基酸序列的重链可变结构域和包含seq id no:32的氨基酸序列的轻链可变结构域;或者(b)包含seq id no:34的氨基酸序列的重链可变结构域,和包含seq id no:36的氨基酸序列的轻链可变结构域,或者(c)包含seq id no:38的氨基酸序列的重链可变结构域和包含seq id no:40的氨基酸序列的轻链可变结构域。
23.编码的抗原结合结构域可包含(a)包含以下的重链可变结构域:含有seq id no:11的氨基酸序列的cdr1、含有seq id no:12的氨基酸序列的cdr2和含有seq id no:13的氨基酸序列的cdr3,以及包含以下的轻链可变结构域:含有seq id no:14的氨基酸序列的cdr1、含有seq id no:15的氨基酸序列的cdr2和含有seq id no:16的氨基酸序列的cdr3;或者(b)包含以下的重链可变结构域:含有seq id no:17的氨基酸序列的cdr1、含有seq id no:18的氨基酸序列的cdr2和含有seq id no:19的氨基酸序列的cdr3,以及包含以下的轻链可变结构域:含有seq id no:20的氨基酸序列的cdr1、含有seq id no:21的氨基酸序列的cdr2和含有seq id no:22的氨基酸序列的cdr3;或者(c)包含以下的重链可变结构域:含
有seq id no:23的氨基酸序列的cdr1、含有seq id no:24的氨基酸序列的cdr2和含有seq id no:25的氨基酸序列的cdr3,以及包含以下的轻链可变结构域:含有seq id no:26的氨基酸序列的cdr1、含有seq id no:27的氨基酸序列的cdr2和含有seq id no:28的氨基酸序列的cdr3。
24.编码的抗原结合结构域可包含含有seq id no:30的氨基酸序列的重链可变结构域和含有seq id no:32的氨基酸序列的轻链可变结构域;并且该轻链可变结构域的c端可通过柔性接头与重链可变结构域的n端融合。接头可以是肽接头,例如长度为至少15个氨基酸,和/或肽接头可以是甘氨酸-丝氨酸接头。
25.分离的核酸分子可具有(a)来自cd8α、cd28或免疫球蛋白(ig)的柔性铰链结构域,(b)包含cd28跨膜结构域的跨膜结构域,(c)包含来自cd28、41bb(cd137)、ox40或icos的结构域的共刺激信号传导区,以及(d)包含cd3-ζ结构域或高亲和力fcεri的胞内信号传导结构域。
26.在另一个实施方案中,提供了嵌合抗原受体(car)多肽,其中(a)car包含抗原结合结构域、柔性铰链结构域、跨膜结构域、共刺激信号传导区和胞内信号传导结构域;并且(b)抗原结合结构域选择性地与癌细胞相关磷脂酰肌醇蛋白聚糖2(gpc2)结合。抗原结合片段可以是fab、单链可变片段(scfv)或单域抗体。
27.编码的抗原结合结构域可包含(a)包含seq id no:30的氨基酸序列的重链可变结构域和包含seq id no:32的氨基酸序列的轻链可变结构域;或者(b)包含seq id no:34的氨基酸序列的重链可变结构域,和包含seq id no:36的氨基酸序列的轻链可变结构域,或者(c)包含seq id no:38的氨基酸序列的重链可变结构域和包含seq id no:40的氨基酸序列的轻链可变结构域。
28.编码的抗原结合结构域可包含(a)包含以下的重链可变结构域:含有seq id no:11的氨基酸序列的cdr1、含有seq id no:12的氨基酸序列的cdr2和含有seq id no:13的氨基酸序列的cdr3,以及包含以下的轻链可变结构域:含有seq id no:14的氨基酸序列的cdr1、含有seq id no:15的氨基酸序列的cdr2和含有seq id no:16的氨基酸序列的cdr3;或者(b)包含以下的重链可变结构域:含有seq id no:17的氨基酸序列的cdr1、含有seq id no:18的氨基酸序列的cdr2和含有seq id no:19的氨基酸序列的cdr3,以及包含以下的轻链可变结构域:含有seq id no:20的氨基酸序列的cdr1、含有seq id no:21的氨基酸序列的cdr2和含有seq id no:22的氨基酸序列的cdr3;或者(c)包含以下的重链可变结构域:含有seq id no:23的氨基酸序列的cdr1、含有seq id no:24的氨基酸序列的cdr2和含有seq id no:25的氨基酸序列的cdr3,以及包含以下的轻链可变结构域:含有seq id no:26的氨基酸序列的cdr1、含有seq id no:27的氨基酸序列的cdr2和含有seq id no:28的氨基酸序列的cdr3。
29.嵌合抗原受体多肽可包含(a)包含含有seq id no:30的氨基酸序列的重链可变结构域和含有seq id no:32的氨基酸序列的轻链可变结构域的编码的抗原结合结构域;以及(b)通过柔性接头与重链可变结构域的n端融合的轻链可变结构域的c端。
30.还提供了包含编码嵌合抗原受体(car)的核酸序列的经遗传修饰的t细胞,或者包含如本文中限定的分离的核酸分子或包含如本文中限定的嵌合抗原受体的经遗传修饰的t细胞。经遗传修饰的t细胞可具有以下特征:
rna car t细胞构建体的gpc2特异性结合的gpc2rna car,通过流式细胞术来测量。(图5b)每个构建体的car随时间的持久性,通过流式细胞术来测量。(图5c)在转染之后四天每个构建体的负检查点调节物表达pd1和lag3。
45.图6a至d.d3v3和d3v4 mrna gpc2 car t细胞在体外产生最强的细胞毒性。(图6a)四种gpc2 car t细胞构建体针对sms-san、内源性高表达gpc2的神经母细胞瘤细胞系的细胞毒性。e∶t比10∶1。(图6b)通过gpc2 car t细胞构建体的干扰素γ脱颗粒通过elisa跨多个在不同的e∶t比下具有不同的gpc2表达的细胞系来测量。(图6c)由d3v3和d3v4 car t细胞针对daoy髓母细胞瘤细胞系释放的细胞毒性和干扰素γ。e∶t比10∶1。(图6d)由d3v3和d3v4 car t细胞针对7316-913高级别胶质瘤细胞系释放的细胞毒性和干扰素γ。e∶t比5∶1。
46.图7a至c.d3v3 mrna gpc2 car t细胞在nb-1643患者来源的异种移植(patient-derived xenograft,pdx)模型中显示出最大的体内细胞毒性。(图7a)与cd19car对照相比,用iv递送的d3v3 car治疗的小鼠中随时间的肿瘤生长。每条线表示一只小鼠。(图7b)与cd19 car对照相比,用iv递送的d3v4 car治疗的小鼠中随时间的肿瘤生长。每条线表示一只小鼠。(图7c)与cd19 car对照(左)和kaplan-meier无进展存活(右)相比,用瘤内递送的d3v3和d3v4 car治疗的小鼠随时间的肿瘤生长。
47.图8.用于car-t细胞治疗和gpc2 rna car构建体设计的示意图。
48.图9a至c.gpc2单链可变片段的氨基酸序列的比对和衍生的gpc2car构建体的表达。(图9a)gpc2靶向的单链可变片段(scfv)在gpc2.d4(seq id no:1)和gpc2.d3(seq id no:2)的可变重链(vh)-接头-可变轻链(vl)取向上的氨基酸序列比对。互补决定区(complementarity-determining region,cdr)以灰色示出。(图9b)用于测试可变重链-接头-可变轻链和可变轻链-接头-可变重链取向的2种不同scfv的car t细胞构建体的示意图。(图9c)原代人t细胞表面上gpc2car t细胞构建体的表达通过结合荧光标记的可溶性重组人gpc2的能力来评估。
49.图10.gpc2在神经母细胞瘤细胞系上的表达。gpc2在神经母细胞瘤细胞系和cho阴性对照上的细胞表面表达用d3-igg(用dylight650标记)来染色。
50.图11a至d.在不存在抗原的情况下,用于驱动细胞因子产生、杀伤和低强直信号传导的迹象的抗原暴露的car t细胞的基于黏合剂优先级的能力。(图11a)对具有过表达(kelly-gpc2)和天然gpc2位点密度(nbsd)的肿瘤细胞有响应的所有构建体的ifny分泌,以及(图11b)在不存在抗原的情况下car t细胞的基线ifny分泌。(图11c)gpc2 car t细胞在1∶1效应物的肿瘤细胞比下针对过表达(kelly-gpc2)和天然gpc2位点密度(nbsd)的杀伤能力。(图11d)对过表达(kelly-gpc2)和天然gpc2位点密度(nbsd)有响应的gpc2 car t细胞的il-2分泌。
51.图12a至d.经改造的car构建体对表达内源性gpc2抗原密度的肿瘤无效。(图12a)在过表达的经改造的等基因kelly-gpc2以及表达内源性gpc2的神经母细胞瘤细胞系nbsd和sms-san上的gpc2的位点密度使用quantibrite珠来测量。(图12b)对过表达和内源性gpc2位点密度有响应的gpc2 car构建体的ifny分泌。(图12c)当用5x过量的肿瘤细胞攻击时,gpc2 car t细胞杀伤等基因kelly-gpc2和(图12d)天然gpc2细胞系的能力。
52.图13a至e.包含ch2ch3间隔结构域的car t细胞无法改善gpc2 car功能。(图13a)
包含igg4来源的ch2ch3间隔结构域的gpc2 car构建体的示意图。(图13b)d3vlvh.gpc2长和短car t细胞的表达通过用可溶性重组gpc2染色来评估。(图13c)短和长gpc2.19car t细胞的体外扩增显示为活化后天数。(图13d)短和长gpc2 car t细胞针对神经母细胞瘤细胞系的杀伤能力。(图13e)短和长gpc2 car t细胞针对神经母细胞瘤细胞系的细胞因子产生。
53.图14a至b.并入28个跨膜和信号传导结构域的gpc2 car t细胞构建体有效靶向天然gpc2位点密度。(图14a)与并入cd28铰链/跨膜结构域和41bbz或cd28信号传导结构域的构建体相比,gpc2.d3vlvh car t细胞的细胞因子产生(左侧为ifny,右侧为il-2)。(图14b)与并入cd28铰链/跨膜结构域和41bbz或cd28信号传导结构域的构建体相比,gpc2.d3vlvh car t细胞的杀伤能力。
54.图15a至f.基于d3(m201)的gpc2 dna car t细胞对神经母细胞瘤临床前模型具有强效的细胞毒性。(图15a)t细胞上的gpc2 car表达。d3(m201)长接头28/28/41bb,为具有基于cd28的铰链/基于cd28的tm结构域/41bb共刺激结构域和长接头的基于d3(m201)的gpc2 car;28/28/28,为具有基于cd28的铰链/基于cd28的tm结构域/cd28共刺激结构域和长接头的基于d3(m201)的gpc2 car。(图15b)与utd t细胞对照相比,8种不同的基于d3的car构建体的sy5y-gpc2细胞的细胞毒性百分比。(图15c至d)与sy5y-gpc2细胞共孵育后使用8种不同的基于d3(m201)的car构建体的infg(图15c)和cd107a(图15d)阳性gpc2 car t细胞百分比。(图15e)在用基于d3/m201的gpc2 car t细胞治疗之后的神经母细胞瘤cog-n-421x患者来源的异种移植肿瘤生长。(图15f)小鼠治疗组群的平均重量在图15e中示出。utd,未经转导的t细胞。
55.图16a至b.基于d3(m201)-vlvh的car t细胞在sms-san转移性异种移植模型中的抗肿瘤效力。(图16a)研究方案。(图16b)sms-san转移性模型中基于不同d3(m201)-vlvh的bli数据(与肿瘤体积相关)。*,p<0.05’;**,p<0.005;***,p<0.0005;****,p<0.00005。
具体实施方式
56.最近将磷脂酰肌醇蛋白聚糖-2(gpc2)鉴定为神经母细胞瘤、高级别胶质瘤(high grade glioma,hgg)和髓母细胞瘤中的细胞表面癌蛋白,为开发靶向免疫治疗提供了机会。发明人假设,针对gpc2的嵌合抗原受体(car)t细胞治疗可通过使用经体外转录的rna或通过稳定转导表达靶向gpc2的car分子的dna构建体来实现。
57.发明人使用具有经操纵的重链和轻链取向的d3和d4 gpc2黏合剂创建了多个car t细胞构建体。结果数据显示了使用mrna或dna有效设计和测试新car t细胞的效用,为临床测试提供了用于证明效力和筛查毒性的平台。
58.下文更详细地描述了本公开内容的这些和其他方面。
59.i.磷脂酰肌醇蛋白聚糖2
60.磷脂酰肌醇蛋白聚糖-2(gpc2)是硫酸乙酰肝素(heparan sulfate,hs)蛋白聚糖的六成员磷脂酰肌醇蛋白聚糖家族的成员,其通过糖基磷脂酰肌醇(gpi)锚附着在细胞表面,并且在生长因子信号传导和癌细胞生长中发挥多种作用。gpc2也称为脑蛋白聚糖蛋白聚糖和磷脂酰肌醇蛋白聚糖蛋白聚糖2。gpc2基因组、mrna和蛋白质序列是可公开获得的。另外,人磷脂酰肌醇蛋白聚糖2mrna和蛋白质序列也可在公共数据库中找到,例如如ncbi gene id 221914、登录号分别为nm_152742和np_689955,其在此通过引用并入。细胞表面
gpc2蛋白已显示在发育中的神经系统中表达,参与细胞黏附,并被认为调节轴突的生长和引导。
61.gpc2最近被鉴定为数种癌症的细胞表面蛋白,所述癌症包括小儿癌症例如神经母细胞瘤、高级别胶质瘤(hgg)、髓母细胞瘤,以及数种其他小儿癌症和成人恶性肿瘤,这表示用于开发新靶向免疫治疗的机会。例如,在小儿癌症中,gpc2已显示出在神经母细胞瘤、视网膜母细胞瘤和髓母细胞瘤上以相当的水平表达,同时显示出受限的正常组织表达。另外,急性淋巴细胞白血病、高级别胶质瘤和横纹肌肉瘤的子集表达gpc2。gpc2在小细胞肺癌上也高度表达,小细胞肺癌是常见且几乎普遍致死的癌症。另外,许多成人恶性肿瘤可从gpc2靶向免疫治疗中受益,如利用来源于癌症基因组图谱(the cancer genome atlas,tcga)的数据评价成人癌症中的gpc2表达。由于这种优先表达,gpc2代表了靶向免疫治疗的潜在候选物。其存在于许多儿童和成人恶性肿瘤的细胞表面上,并表现出肿瘤与正常组织之间的高度差异表达。
62.ii.产生单克隆抗体
63.a.一般方法
64.针对磷脂酰肌醇蛋白聚糖2的抗体可通过本领域中公知的标准方法产生(参见,例如,antibodies:a laboratory manual,cold spring harbor laboratory,1988;美国专利4,196,265)。用于产生单克隆抗体(mab)的方法通常沿着与用于制备多克隆抗体的那些路线相同的路线开始。这两种方法的第一步是对合适的宿主进行免疫接种或鉴定由于之前的自然感染而免疫接种的对象。如本领域中公知的,用于免疫接种的给定组合物的免疫原性可不同。因此,通常有必要加强宿主的免疫系统,如可通过使肽或多肽免疫原与载体偶联来实现。示例性且优选的载体是钥孔戚血蓝蛋白(keyhole limpet hemocyanin,klh)和牛血清白蛋白(bovine serum albumin,bsa)。其他白蛋白例如卵白蛋白、小鼠血清白蛋白或兔血清白蛋白也可用作载体。用于使多肽与载体蛋白缀合的方式是本领域中公知的,并且包括戊二醛、间马来酰亚胺基苯甲酰基-n-羟基琥珀酰亚胺酯(m-maleimidobencoyl-n-hydroxysuccinimide ester)、碳二亚胺和双-重氮联苯胺(bis-biazotized benzidine)。同样如本领域中公知的,特定免疫原组合物的免疫原性可通过使用称为佐剂的免疫应答的非特异性刺激剂来增强。示例性且优选的佐剂包括完全弗氏佐剂(包含经杀伤结核分枝杆菌(mycobacterium tuberculosis)的免疫应答的非特异性刺激剂)、不完全弗氏佐剂和氢氧化铝佐剂。
65.用于产生多克隆抗体的免疫原组合物的量根据免疫原的性质以及用于免疫接种的动物而变化。可使用多种途径来施用免疫原(皮下、肌内、皮内、静脉内和腹膜内)。可通过在免疫接种之后的不同点对经免疫接种的动物采血来监测多克隆抗体的产生。也可给予第二加强注射。重复加强和效价测定过程直到达到合适的效价。当获得期望的免疫原性水平时,可对经免疫接种的动物取血,分离血清并储存,和/或可将动物用于产生mab。
66.在免疫接种之后,选择具有产生抗体之潜力的体细胞,特别是b淋巴细胞(b细胞)用于mab产生方案。这些细胞可从活检脾或淋巴结或者从循环血液中获得。然后,使来自经免疫接种动物之产生抗体的b淋巴细胞与永生化骨髓瘤细胞的细胞融合,其通常是与经免疫接种动物为同一物种的永生化骨髓瘤细胞或者是人或人/小鼠嵌合细胞。适合用于产生杂交瘤的融合程序的骨髓瘤细胞系优选地不产生抗体、具有高融合效率且具有酶缺陷,这
随后使其不能在仅支持期望的融合细胞(杂交瘤)生长的某些选择培养基中生长。
67.如本领域技术人员已知的,可使用多种骨髓瘤细胞中的任一种(goding,第65至66页,1986;campbell,第75至83页,1984)。例如,在免疫接种动物为小鼠的情况下,可使用p3-x63/ag8、x63-ag8.653、ns1/1.ag 4 1、sp210-ag14、fo、nso/u、mpc-11、mpc11-x45-gtg 1.7和s194/5xx0 bul;对于大鼠,可使用r210.rcy3、y3-ag 1.2.3、ir983f和4b210;并且u-266、gm1500-grg2、licr-lon-hmy2和uc729-6全部均可与人细胞融合联合使用。一种特定的鼠骨髓瘤细胞是ns-1骨髓瘤细胞系(也称为p3-ns-1-ag4-1),其容易地可通过请求细胞系储库号gm3573从nigms人遗传突变细胞储库(human genetic mutant cell repository)获得。另一种可使用的小鼠骨髓瘤细胞系是8-氮杂鸟嘌呤抗性小鼠鼠骨髓瘤sp2/0非生产细胞系。最近,已经描述了用于人b细胞的另外的融合配偶体系,包括kr12(atcc crl-8658;k6h6/b5(atcc crl-1823shm-d33(atcc crl-1668)和hmma2.5(posner et al.,1987)。本公开内容中的抗体使用sp2/0/mil-6细胞系(sp2/0系的分泌il-6的衍生物)产生。
68.用于产生抗体产生脾细胞或淋巴结细胞与骨髓瘤细胞的杂合体的方法通常包括:在存在促进细胞膜融合的试剂(化学或电学)的情况下使体细胞与骨髓瘤细胞以2∶1的比例混合,但是该比例可分别从约20∶1至约1∶1而变化。kohler和milstein(1975;1976)已经描述了使用仙台病毒(sendai virus)的融合方法,并且gefter et al.(1977)已经描述了使用聚乙二醇(peg)例如37%(v/v)peg的融合方法。使用电诱导融合方法也是合适的(goding,第71至74页,1986)。
69.融合程序通常以约1
×
10-6
至1
×
10-8
的低频率产生活的杂合体。然而,这并不造成问题,因为通过在选择培养基中培养,活的融合杂合体与亲本未融合细胞(特别是在正常情况下将持续无限分裂的未融合骨髓瘤细胞)区分开来。选择培养基通常是在组织培养基中包含阻断核苷酸从头合成的试剂的培养基。示例性且优选的试剂是氨基蝶呤、甲氨蝶呤和重氮丝氨酸。氨基蝶呤和甲氨蝶呤阻断嘌呤和嘧啶二者的从头合成,而重氮丝氨酸仅阻断嘌呤合成。当使用氨基蝶呤或甲氨蝶呤时,向培养基中补充次黄嘌呤和胸苷作为核苷酸的来源(hat培养基)。当使用重氮丝氨酸时,向培养基中补充次黄嘌呤。如果b细胞来源是eb病毒(epstein barr virus,ebv)转化的人b细胞系,则添加哇巴因(ouabain)以清除未与骨髓瘤融合的ebv转化系。
70.优选的选择培养基是hat或具有哇巴因的hat。只有能够进行核苷酸补救途径的细胞才能在hat培养基中存活。骨髓瘤细胞在补救途径的关键酶(例如,次黄嘌呤磷酸核糖基转移酶(hypoxanthine phosphoribosyl transferase,hprt))中有缺陷,因此其不能存活。b细胞可进行该途径,但是其在培养中具有有限的寿命并且通常在约两周内死亡。因此,只有可在选择培养基中存活的细胞才是由骨髓瘤和b细胞形成的那些杂合体。当用于融合的b细胞的来源是ebv转化的b细胞系时,此时还将哇巴因用于杂合体的药物选择,因为ebv转化的b细胞对药物杀伤易感,而选择所使用的骨髓瘤配偶体对哇巴因具有抗性。
71.培养提供了从中选择特定杂交瘤的杂交瘤群体。通常如下进行杂交瘤的选择:通过在微量滴定板中进行单克隆稀释来培养细胞,随后针对期望反应性测试单个克隆上清液(在约两至三周之后)。测定应灵敏、简单并且迅速,例如放射免疫测定、酶免疫测定、细胞毒性测定、噬菌斑测定、斑点免疫结合测定等。
72.然后将选择的杂交瘤连续稀释或通过流式细胞术分选进行单细胞分选,并克隆到
单独抗体产生细胞系中,所述克隆然后可无限增殖以提供mab。细胞系可以以两种基本方式用于mab产生。可将杂交瘤样品注射(通常注射到腹膜腔中)到动物(例如,小鼠)中。任选地,在注射之前将动物用烃,特别是油(例如,姥鲛烷(pristane)(四甲基十五烷))致敏(prime)。当以这种方式使用人杂交瘤时,注射免疫缺损的小鼠(例如scid小鼠)是最佳的,以防止肿瘤排斥。经注射动物出现分泌由融合细胞杂合体产生的特异性单克隆抗体的肿瘤。然后,可放出动物的体液例如血清或腹水以提供高浓度mab。也可在体外培养单个细胞系,其中mab自然地分泌到培养基中,从中可容易地获得高浓度的mab。或者,可在体外使用人杂交瘤细胞系以在细胞上清液中产生免疫球蛋白。可将细胞系调整为在不含血清的培养基中生长,以优化回收高纯度人单克隆免疫球蛋白的能力。
73.如果期望的话,以任一种方式产生的mab可进一步使用过滤、离心和多种色谱方法(例如fplc或亲和色谱法)纯化。本公开内容的单克隆抗体的片段可通过以下方法由经纯化的单克隆抗体获得:其包括用酶(例如胃蛋白酶或木瓜蛋白酶)消化,和/或通过经化学还原切割二硫键。或者,本公开内容所涵盖的单克隆抗体片段可使用自动化肽合成仪合成。
74.还在考虑之中的是,可使用分子克隆方法来产生单克隆。为此,可从杂交瘤系分离rna,通过rt-pcr获得抗体基因,并将其克隆到免疫球蛋白表达载体中。或者,由从细胞系分离的rna制备组合的免疫球蛋白噬菌粒文库,并使用病毒抗原通过淘选选择表达合适抗体的噬菌粒。这种方法相对于常规杂交瘤技术的优点是:可在单轮中产生和筛选多达约104倍的抗体,并且通过h链和l链组合产生了新的特异性,这进一步提高了发现合适抗体的机会。
75.各自通过引用并入本文的教导产生可用于本公开内容的抗体的其他美国专利包括美国专利5,565,332,其描述了使用组合方法产生嵌合抗体;美国专利4,816,567,其描述了重组免疫球蛋白制备;以及美国专利4,867,973,其描述了抗体-治疗剂缀合物。
76.b.单链/单域抗体
77.单链可变片段(scfv)是用短(通常丝氨酸、甘氨酸)接头连接在一起的免疫球蛋白重链和轻链可变区的融合物。这种嵌合分子也称为单域抗体,其虽然去除了恒定区并且引入了接头肽但是保留了原始免疫球蛋白的特异性。这种修饰通常不改变特异性。历史上产生这些分子是为了有利于噬菌体展示,其中将抗原结合结构域表达为单个肽非常方便。或者,可由来源于杂交瘤的亚克隆重链和轻链直接产生scfv。单域或单链可变片段缺少存在于完全抗体分子中的恒定fc区,并且因此缺少用于纯化抗体(包含fc区的单链抗体)的常见结合位点(例如,蛋白a/g)。这些片段通常可使用蛋白l纯化/固定,因为蛋白l与κ轻链的可变区相互作用。
78.柔性接头通常由促进螺旋和转角的氨基酸残基(例如丙氨酸、丝氨酸和甘氨酸)构成。然而,其他残基也可很好地发挥作用。噬菌体展示可用作从蛋白质接头文库中快速选择用于单链抗体(scfv)的专用接头的方式。构建随机接头文库,其中用于重链和轻链可变结构域的基因通过编码具有可变组成的18-氨基酸多肽的区段连接。在丝状噬菌体上展示scfv库(约5
×
106个不同成员)并且用半抗原进行亲和选择。所选择变体的群体表现出结合活性显著提高,但是保留了相当大的序列多样性。随后筛选1054个单独变体产生了以可溶性形式有效产生的催化活性scfv。序列分析揭示,所选择栓系物(tether)的仅有的共同特征是:vhc末端之后的两个残基是接头中的保守脯氨酸以及在其他位置处有大量的精氨酸和脯氨酸。
79.本公开内容的重组抗体还可涉及允许受体二聚化或多聚化的序列或部分。这样的序列包括来源于iga的那些,其允许与j链联合形成多聚体。另一个多聚化结构域是gal4二聚化结构域。在另一些实施方案中,可用允许两个抗体组合的试剂(例如生物素/抗生物素蛋白)对链进行修饰。
80.在一个独立的实施方案中,可通过使用非肽接头或化学单元连接受体轻链和重链来产生单链抗体。通常来说,使轻链和重链在不同细胞中产生,纯化,并且随后以合适的方式连接在一起(即,通过合适的化学桥将重链的n端与轻链的c端连接)。
81.使用交联试剂形成将两个不同分子的官能团系住的分子桥,例如,稳定和凝结剂。然而,可预期的是,可产生相同类似物的二聚体或多聚体或者包含不同类似物的异聚复合体。为了以逐步方式连接两个不同化合物,可使用异-双官能交联剂,其消除了不想要的均聚物形成。
82.一种示例性的异-双官能交联剂包含两个反应性基团:一个与伯胺基(例如,n-羟基琥珀酰亚胺)反应并且另一个与硫醇基团(例如,吡啶基二硫化物、马来酰亚胺、卤素等)反应。通过伯胺反应性基团,交联剂可与一个蛋白质(例如,所选择的抗体或片段)的赖氨酸残基反应,并且通过硫醇反应性基团,已经系在第一蛋白质上的交联剂与另一蛋白质(例如,选择剂)的半胱氨酸残基(游离巯基)反应。
83.优选地,使用在血液中具有合理稳定性的交联剂。已知多种类型含二硫键的接头可成功用于使靶向剂和治疗剂/预防剂缀合。包含在空间上受阻的二硫键的接头可证明在体内提供更高稳定性,从而防止靶向肽在到达作用位点之前释放。因此,这些接头是一组连接剂。
84.另一种交联试剂是smpt,这是一种包含二硫键的双官能交联剂,该二硫键由于邻近的苯环和甲基而在“空间上受阻”。认为二硫键的空间位阻发挥了保护键不被可存在于组织和血液中的硫醇盐阴离子(例如谷胱甘肽)攻击的功能,并且从而有助于防止缀合物在连接的药剂递送到靶部位之前解偶联。
85.与许多其他已知的交联试剂一样,smpt交联试剂也能够使官能团例如半胱氨酸的sh或伯胺(例如,赖氨酸的ε氨基)交联。另一种可能的交联剂类型包括含有可切割二硫键的异-双官能光反应性叠氮基苯,例如磺基琥珀酰亚胺基-2-(对叠氮基水杨酰氨基)乙基-1,3
’‑
二硫代丙酸酯。n-羟基-琥珀酰亚胺基与伯氨基反应,并且叠氮基苯(光分解之后)非选择性地与任何氨基酸残基反应。
86.除了受阻交联剂,非受阻交联剂也可据此使用。不考虑包含或产生被保护的二硫化物的话,其他有用的交联剂包括sata、spdp和2-亚氨基硫烷。这样的交联剂的使用是本领域中非常了解的。另一个实施方案涉及使用柔性接头。
87.美国专利4,680,338描述了可用于产生配体与含胺聚合物和/或蛋白质的缀合物,特别是用于与螯合剂、药物、酶、可检测标记等形成抗体缀合物的双官能接头。美国专利5,141,648和5,563,250公开了包含在多种温和条件下可切割之不稳定键的可切割缀合物。这种接头特别可用,因为目的药剂可直接与接头键合,并且其切割导致活性剂的释放。特别的用途包括向蛋白质例如抗体或药物添加游离氨基或游离巯基。
88.美国专利5,856,456提供了用于连接多肽成分以制备融合蛋白(例如,单链抗体)的肽接头。接头的长度为多至约50个氨基酸;包含出现至少一次的带电氨基酸(优选精氨酸
或赖氨酸)接着是脯氨酸,并且以更高的稳定性和聚集降低为特征。美国专利5,880,270公开了可用于多种免疫诊断和分离技术的包含氨基氧基的接头。
89.c.嵌合抗原受体及其编码核酸序列
90.人工t细胞受体(也称为嵌合t细胞受体、嵌合免疫受体、嵌合抗原受体(car))是经改造的受体,其可将任意特异性移植到免疫效应细胞上。通常,这些受体用于将单克隆抗体的特异性移植到t细胞上,并且通过逆转录病毒载体促进其编码序列的转移。以这种方式,可产生大量的癌症特异性t细胞以用于过继细胞转移。这种方法的i期临床研究显示了效力。
91.这些分子的最常见形式是来源于单克隆抗体的单链可变片段(scfv)的融合,其与cd3-ζ跨膜和内结构域融合。这样的分子导致ζ信号的传递以响应由scfv对其靶标的识别。这样的构建体的一个实例是14g2a-ζ,其是来源于杂交瘤14g2a(识别二唾液酸神经节苷脂gd2)的scfv的融合体。当t细胞表达这种分子(通常通过癌逆转录病毒载体转导实现)时,其识别并杀伤表达gd2的靶细胞(例如神经母细胞瘤细胞)。为了靶向恶性b细胞,研究者使用对b谱系分子cd19具有特异性的嵌合免疫受体重定向了t细胞的特异性。
92.免疫球蛋白重链和轻链的可变部分通过柔性接头融合以形成scfv。该scfv之前是信号肽,以将新生蛋白定向至内质网并随后进行表面表达(这是经切割的)。柔性间隔允许scfv在不同方向上取向,以使抗原能够结合。跨膜结构域是通常来源于信号传导内结构域的原始分子的典型疏水α螺旋,信号传导内结构域突入细胞中并传递所期望的信号。
93.i型蛋白质实际上是其之间通过跨膜α螺旋连接的两个蛋白质结构域。跨膜结构域通过的细胞膜脂质双层起到将内部部分(内结构域)与外部部分(胞外域)分离的作用。并不出人意料的是,将来自一种蛋白质的胞外域与另一种蛋白质的内结构域连接以产生将前者的识别与后者的信号组合的分子。
94.胞外域。将新生蛋白定向至内质网的信号肽。如果受体待糖基化并锚定在细胞膜中,这是必不可少的。任何真核信号肽序列通常均很好地工作。通常,使用与最氨基末端组分天然连接的信号肽(例如,在具有轻链-接头-重链取向的scfv中,使用轻链的天然信号。
95.抗原识别结构域通常是scfv。然而,有很多替代物。已描述了来自天然t细胞受体(t-cell receptor,tcr)α和β单链的抗原识别结构域,如具有简单的胞外域(例如识别hiv感染细胞的cd4胞外域)和更独特的识别组分例如经连接的细胞因子(其导致识别带有细胞因子受体的细胞)。实际上,几乎以高亲和力结合给定靶标的任何事物均可用作抗原识别区域。
96.间隔区将抗原结合结构域与跨膜结构域连接。它应有足够柔性以允许抗原结合结构域在不同方向上取向以促进抗原识别。最简单的形式是来自igg1的铰链区。替代物包括免疫球蛋白的ch2ch3区域和部分cd3。对于大部分基于scfv的构建体,igg1铰链就足够了。然而,最好的间隔物通常必须凭经验确定。
97.跨膜结构域。跨膜结构域是跨越膜的疏水α螺旋。通常,使用来自内结构域最靠近膜的组分的跨膜结构域。令人感兴趣的是,使用cd3-ζ跨膜结构域可导致将人工tcr并入到天然tcr,该因素取决于天然cd3-ζ跨膜带电天冬氨酸残基的存在。不同的跨膜结构域导致不同的受体稳定性。cd28跨膜结构域产生明亮表达的稳定受体。
98.内结构域。这是受体的“行使功能的一端(business-end)”。在抗原识别之后,受体
聚集并将信号传递至细胞。最常用的内结构域组分是包含3个itam的cd3-ζ。这在抗原结合之后将活化信号传递至t细胞。cd3-ζ可不提供完全有效的活化信号并且需要另外的共刺激信号传导。例如,嵌合cd28和ox40可与cd3-ζ一起使用以传递增殖/存活信号,或者所有这三种可一起使用。
[0099]“第一代”car通常具有来自cd3ξ-链的胞内结构域,其是来自内源性tcr的信号的主要传递器。“第二代”car将来自多种共刺激蛋白受体(例如cd28、41bb、icos)的胞内信号传导结构域添加至car的胞质尾以为t细胞提供另外的信号。临床前研究表明,第二代car设计改善了t细胞的抗肿瘤活性。最近,“第三代”car组合了多种信号传导结构域,例如cd3z-cd28-41bb或cd3z-cd28-ox40,以进一步增强效力。
[0100]
表达嵌合抗原受体的t细胞的过继转移是有希望的抗癌治疗,因为可将经car修饰的t细胞改造以靶向几乎任何肿瘤相关抗原。这种方法有大的潜力以深刻的方式改善患者特异性癌症治疗。在收集患者的t细胞之后,将细胞进行遗传改造以表达特别地针对患者肿瘤细胞上的抗原的car,随后输回患者中。尽管经car修饰的t细胞的过继转移是独特且有希望的癌症治疗,但存在重大的安全问题。这种治疗的临床试验揭示,当健康组织表达与肿瘤细胞相同的靶抗原时,这些car的潜在毒性作用导致与移植物抗宿主病(graft-versus-host disease,gvhd)类似的结局。该问题的一个潜在解决方案是将自杀基因改造到经修饰的t细胞中。以这种方式,设计以在gvhd期间活化自杀基因的前药的施用会触发自杀基因活化的car t细胞中的凋亡。该方法已安全且有效地用于造血干细胞移植(hematopoietic stem cell transplantation,hsct)。将自杀基因治疗应用于经car修饰的t细胞过继细胞转移的临床应用有可能减轻gvhd,同时改善整体抗肿瘤效力。
[0101]
在本文中公开的靶向gpc2的car的一些实施方案中,vh序列在下游与vl序列可操作地连接。在一些实施方案中,vh序列在上游与vl序列可操作地连接。本文中使用的提及氨基酸序列的术语“上游”是指在氨基酸序列的n端至c端方向上远离参考点的位置。类似地,术语“下游”是指在氨基酸序列的c端至n端方向上远离参考点的位置。
[0102]
通常,适合于本文中公开的靶向gpc2的car的跨膜结构域可以是本领域已知的任何一种跨膜结构域。合适的跨膜结构域的一些非限制性实例包括来源于cd28跨膜结构域、cd8a跨膜结构域、ctla4跨膜结构域或pd-i跨膜结构域的跨膜结构域。因此,在一些实施方案中,本公开内容的靶向gpc2的car包括来源于cd28跨膜结构域、cd8a跨膜结构域、ctla4跨膜结构域或pd-i跨膜结构域的跨膜结构域。在一些实施方案中,靶向gpc2的car包括来源于cd28跨膜结构域的跨膜结构域。
[0103]
在一些实施方案中,本文中公开的靶向gpc2的car的胞内信号传导结构域包含共刺激结构域。通常,适合于本文中公开的靶向gpc2的car的共刺激结构域可以是本领域已知的任何一种共刺激结构域。合适的共刺激结构域的一些实例包括但不限于来源于4-ibb(cd137)、cd27、cd28、ox40(cd 134)和共刺激诱导型t细胞共刺激(icos)多肽序列的共刺激多肽序列。因此,在一些实施方案中,本文中公开的靶向gpc2的car的共刺激结构域选自共刺激4-ibb(cd137)多肽序列、共刺激cd27多肽序列、共刺激cd28多肽序列、共刺激ox40(cd134)多肽序列和共刺激诱导型t细胞共刺激(icos)多肽序列。在一些实施方案中,靶向gpc2的car包含来源于共刺激4-1bb(cd137)多肽序列的共刺激结构域。在一些实施方案中,靶向gpc2的car包含来源于共刺激cd28多肽序列的共刺激结构域。
[0104]
在一些实施方案中,靶向gpc2的car还包含胞外铰链结构域(例如铰链区)或“接头”。术语“铰链结构域”通常是指位于靶向部分与跨膜结构域之间的柔性多肽连接区或“接头”。这些序列一般来源于igg亚类(例如igg 1和igg4)、igd和cd8结构域,其中igg 1已被最广泛地使用。在一些实施方案中,铰链/接头结构域为侧翼多肽区提供结构柔性。铰链/接头结构域可由天然或合成多肽组成。本领域技术人员将理解,铰链/接头结构域可通过促进抗原结合部分相对于由其识别的抗原部分的最佳定位来改善car的功能。应理解,在一些实施方案中,对于最佳car活性,可不需要铰链/接头结构域。在一些实施方案中,包含短氨基酸序列的有益铰链/接头结构域通过例如通过降低可另外改变抗体结合动力学的任何空间约束从而促进抗原结合来促进car活性。编码铰链/接头结构域的序列可位于抗原识别部分与跨膜结构域之间。在一些实施方案中,铰链/接头结构域可操作地连接在抗原结合部分的下游和跨膜结构域的上游。
[0105]
铰链/接头序列可以是来源于或获得自任何合适分子的任何部分或序列。例如,在一些实施方案中,铰链/接头序列可来源于人cd8a分子或cd28分子以及在向侧翼区域提供柔性方面提供类似功能的任何其他受体。铰链/接头结构域的长度可为约4个氨基酸(aa)至约50aa,例如约4aa至约10aa、约10aa至约15aa、约aa至约20aa、约20aa至约25aa、约25aa至约30aa、约30aa至约40aa、或约40aa至约50aa。合适的铰链/接头结构域可容易地选择并且可具有多种合适长度中的任何一种,例如1个氨基酸(例如,gly)至20aa,2aa至15aa,3aa至12aa,包括4aa至10aa、5aa至9aa、6aa至8aa、或7aa至8aa,并且可以是1、2、3、4、5、6或7aa。
[0106]
术语“长接头”和“短接头”在整个申请中使用,并且意指以下:
[0107]“长接头”氨基酸序列:ggggsggggsggggs(seq id no:4)
[0108]“短接头”氨基酸序列:ggggs(seq id no:41)。
[0109]
合适的铰链/接头结构域的一些非限制性实例包括cd8铰链结构域、cd28铰链结构域、ctla4铰链结构域或igg4铰链结构域。在一些实施方案中,铰链/接头结构域可包括来源于人cd8a(a.k.a.cd8a)分子或cd28分子以及在向侧翼区域提供柔性方面提供类似功能的任何其他受体的区域。在一些实施方案中,本文中公开的靶向gpc2的car包含来源于cd8a铰链结构域的铰链结构域。在一些实施方案中,本文中公开的靶向gpc2的car包含来源于cd28铰链结构域的铰链结构域。
[0110]
在一些实施方案中,本文中公开的car还包含含有位于抗gpc2scfv区与胞外铰链/接头结构域之间的一个或更多个中间氨基酸残基的胞外间隔结构域。在一些实施方案中,胞外铰链/接头结构域在下游与抗gpc2 scfv区并且在上游与铰链/接头结构域可操作地连接。原则上,对胞外间隔的长度和/或氨基酸组成无特别限制。在一些实施方案中,包含约1至约300个氨基酸残基(例如,2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20等个氨基酸残基)的任何任意单链肽可用作胞外间隔。在一些实施方案中,胞外间隔包含约5至50、约10至60、约20至70、约30至80、约40至90、约50至100、约60至120、约70至150、约100至200、约150至250、约200至300、约30至60、约20至80、约30至90个氨基酸残基。在一些实施方案中,胞外间隔包含约1至10、约50至100、约100至150、约150至200、约200至300、约20至80、约40至120、约200至250个氨基酸残基。在一些实施方案中,胞外铰链/接头包含约40至70、约50至80、约60至80、约70至90、或约80至100个氨基酸残基。在一些实施方案中,胞外铰链/接头包含约1至10、约5至15、约10至20、约15至25个氨基酸残基。在一些实施方案中,胞外铰
链/接头包含约220、225、230、235或240个氨基酸残基。在一些实施方案中,胞外铰链/接头包含229个氨基酸残基。在一些实施方案中,可优化胞外铰链/接头的长度和氨基酸组成以改变抗gpc2 scfv区和胞外铰链/接头结构域彼此的取向和/或接近度,以实现靶向gpc2的car的期望活性。在一些实施方案中,抗gpc2 scfv区和胞外铰链/接头结构域彼此的取向和/或接近度可作为“调节”工具或作用来改变和/或优化,其增强或降低gpc2 car的效力。在一些实施方案中,抗gpc2 scfv区和胞外铰链/接头结构域彼此的取向和/或接近度可改变和/或优化以产生gpc2 car的部分功能或部分功能形式。在一些实施方案中,胞外铰链/接头结构域包含对应于igg4铰链结构域和igg4 ch2-ch3结构域的氨基酸序列。
[0111]
在一些实施方案中,本文中公开的靶向gpc2的car的胞内信号传导结构域包括cd3ζ胞内信号传导结构域。在本公开内容的一些实施方案中,靶向gpc2的car包含a)抗gpc2 scfv区;b)cd28铰链结构域;c)cd28跨膜结构域;和d)包含来源于4-1bbz共刺激结构域或cd28共刺激结构域的共刺激结构域的胞内信号传导结构域。
[0112]
在一个方面,本公开内容的一些实施方案涉及重组核酸分子,该重组核酸分子包括编码如本文所公开的靶向gpc2的car,或如本文所公开的抗体的核酸序列。
[0113]
术语“核酸分子”和“多核苷酸”在本文中可互换地使用,并指rna和dna分子二者,其包括包含cdna、基因组dna、合成dna和包含核酸类似物的dna或rna分子的核酸分子。核酸分子可以是双链的或单链的(例如,有义链或反义链)。核酸分子可含有非常规或经修饰的核苷酸。如本文所用的术语“多核苷酸序列”和“核酸序列”可互换地指多核苷酸分子的序列。
[0114]
本公开内容的核酸分子可以是任何长度的核酸分子,其包括通常为约5kb至约50kb,例如约5kb至约40kb、约5kb至约30kb、约5kb至约20kb或约10kb至约50kb的核酸分子,例如,为约15kb至30kb、约20kb至约50kb、约20kb至约40kb、约5kb至约25kb,或者约30kb至约50kb的核酸分子。
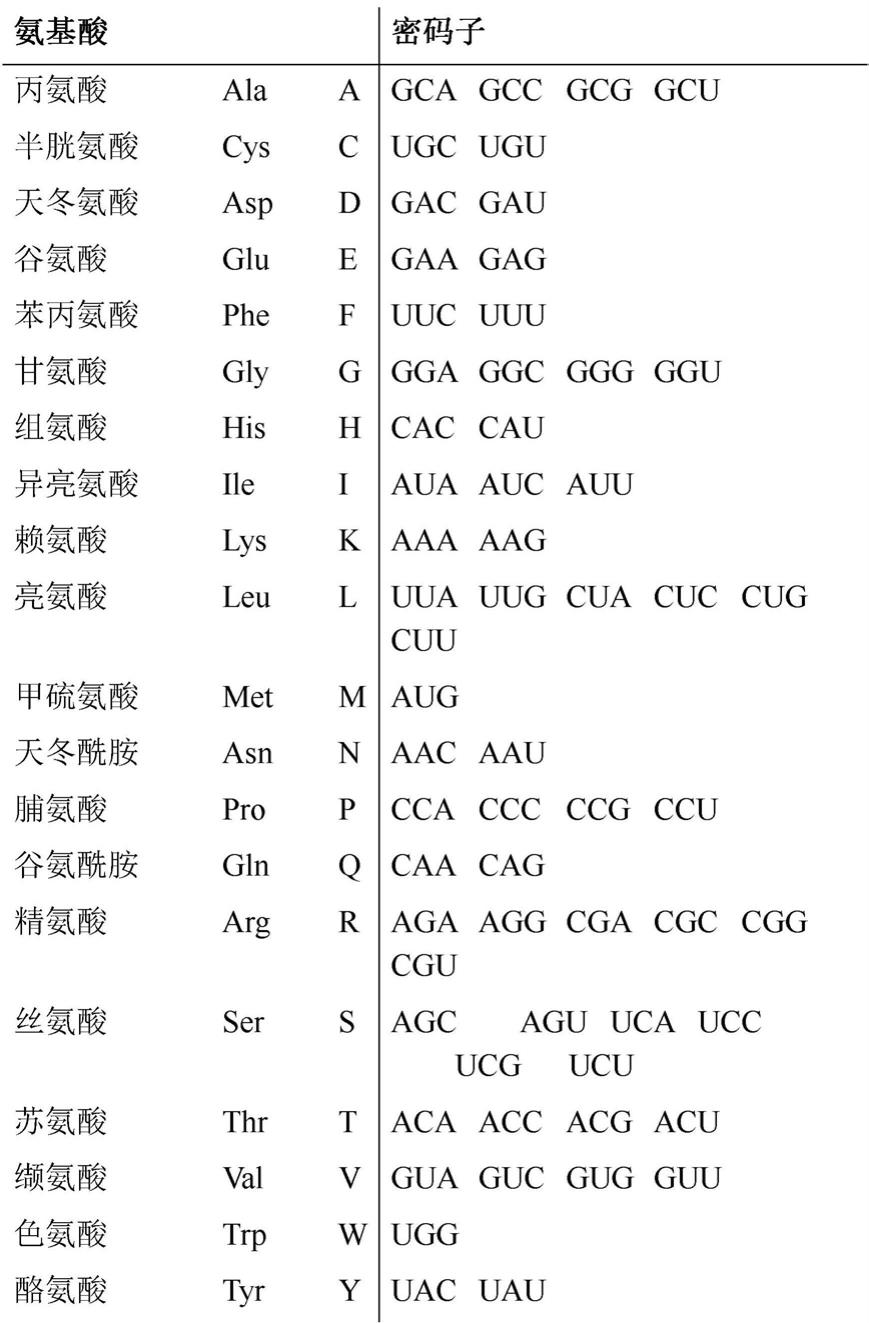
[0115]
在一些实施方案中,重组核酸分子与异源核酸序列可操作地连接,异源核酸序列例如编码目标蛋白质或调节序列(例如,启动子序列)的结构基因。在一些实施方案中,将重组核酸分子进一步限定为表达盒或载体。在一些实施方案中,载体为慢病毒载体、腺病毒载体、腺相关病毒载体或逆转录病毒载体。
[0116]
本文所公开的一些实施方案涉及包括如本文所公开的重组核酸分子的载体或表达盒。如本文所用,术语“表达盒”是指包含编码序列和足够调节信息以在体内和/或离体指导接受体细胞中编码序列的正确转录和/或翻译的遗传材料构建体。可将表达盒插入载体中,用于靶向期望宿主细胞和/或进入对象。因此,术语表达盒可与术语“表达构建体”可互换使用。
[0117]
根据本公开内容的嵌合抗原受体(car)可首先通过其结合特异性来限定,在本例中,其是对于磷脂酰肌醇蛋白聚糖2的。还可以通过本文公开的序列来限定car,或者可以与上面提供的序列不同,任选地使用下面更详细讨论的方法。例如,氨基酸序列可与上面列出的那些不同,在于(a)可变区可与轻链的恒定结构域分开,(b)氨基酸可与上面列出的那些不同,同时因此不显著影响残基的化学性质(所谓的保守替换),(c)氨基酸可与上面列出的那些以给定的百分比变化,例如80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同源性。或者,编码抗体的核酸可(a)与轻链的恒定结构域分开,(b)在不改变由
此编码的残基的情况下与上面列出的那些不同,(c)可与上面列出的那些以给定的百分比变化,例如70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同源性,或者(d)由于在高严格性条件下杂交的能力而与上面列出的那些不同,如通过低盐和/或高温条件所举例说明,例如在约50℃至约70℃的温度下由约0.02m至约0.15m nacl提供。
[0118]
在进行保守改变氨基酸序列时,可以考虑氨基酸的亲水性指数。亲水性氨基酸指数在赋予蛋白质交互性生物功能方面的重要性是本领域中通常了解的(kyte和doolittle,1982)。已接受的是,氨基酸的相对亲水特性有助于所得蛋白质的二级结构,而其又限定了蛋白质与另一些分子(例如酶、底物、受体、dna、抗体、抗原等)的相互作用。
[0119]
在本领域中还应理解,可基于亲水性有效地进行类似氨基酸的替换。通过引用并入本文的美国专利4,554,101声称,蛋白质的最大局部平均亲水性(如受其邻近氨基酸的亲水性控制)与蛋白质的生物学特性相关。如美国专利4,554,101中所详述的,已向氨基酸残基分配了以下亲水性值:碱性氨基酸:精氨酸( 3.0)、赖氨酸( 3.0)和组氨酸(-0.5);酸性氨基酸:天冬氨酸( 3.0
±
1)、谷氨酸( 3.0
±
1)、天冬酰胺( 0.2)和谷氨酰胺( 0.2);亲水性非离子氨基酸:丝氨酸( 0.3)、天冬酰胺( 0.2)、谷氨酰胺( 0.2)和苏氨酸(-0.4),含硫氨基酸:半胱氨酸(-1.0)和甲硫氨酸(-1.3);疏水性非芳香性氨基酸:缬氨酸(-1.5)、亮氨酸(-1.8)、异亮氨酸(-1.8)、脯氨酸(-0.5
±
1)、丙氨酸(-0.5)和甘氨酸(0);疏水性芳香性氨基酸:色氨酸(-3.4)、苯丙氨酸(-2.5)和酪氨酸(-2.3)。
[0120]
应理解的是,氨基酸可被具有类似亲水性的另一种氨基酸所替换,并产生在生物学或免疫学上修饰的蛋白质。在这样的变化中,亲水性值在
±
2之内的氨基酸的替换是优选的,在
±
1之内的那些是特别优选的,并且在
±
0.5之内的那些是甚至更特别优选的。
[0121]
如上文概括的,氨基酸替换通常基于氨基酸侧链取代基的相对相似性,例如,其疏水性、亲水性、电荷、大小等。本领域技术人员公知考虑到上述多种特征的示例性替换,并且包括精氨酸和赖氨酸;谷氨酸和天冬氨酸;丝氨酸和苏氨酸;谷氨酰胺和天冬酰胺;以及缬氨酸、亮氨酸和异亮氨酸。
[0122]
d.表达
[0123]
根据本公开内容的核酸将编码car。如在本技术中使用的术语“编码磷脂酰肌醇蛋白聚糖2car的核酸”是指已分离的不含总细胞核酸的核酸分子。在某些实施方案中,本公开内容涉及由本文所述的任何序列编码的受体。
[0124]
表2-密码子
[0125][0126]
本公开内容的dna区段包括上述序列的编码生物功能性等效蛋白质的那些。这样的序列可由于已知在核酸序列和由此编码的蛋白质中天然存在的密码子冗余和氨基酸功能等同而产生。或者,可通过应用重组dna技术来产生功能上等同的蛋白质,其中可基于对
所交换氨基酸的性质的考虑来改造蛋白质结构的变化。如下文所述,可通过应用定点诱变技术引入人为设计的变化,或可随机引入并随后筛选期望的功能。
[0127]
在本技术通篇,术语“表达构建体”意在包括包含编码基因产物的核酸的任何类型的遗传构建体,其中部分或全部的核酸编码序列能够被转录。转录物可以翻译成蛋白质,但不是必须的。在某些实施方案中,表达包括基因转录和mrna翻译成基因产物二者。在另一些实施方案中,表达仅包括编码目的基因的核酸的转录。
[0128]
术语“载体”用于指载体核酸分子,其中可插入核酸序列以引入到其可在那里进行复制的细胞中。核酸序列可以是“外源的”,这意味着其对引入载体的细胞是外来的,或者该序列与细胞中的序列同源但处于宿主细胞核酸内该序列通常不存在的位置中。载体包括质粒、黏粒、病毒(噬菌体、动物病毒和植物病毒)以及人工染色体(例如,yac)。本领域技术人员通过标准重组技术将很熟练地构建载体,所述技术描述于sambrook et al.(1989)和ausubel et al.(1994)中,二者均通过引用并入本文。
[0129]
术语“表达载体”是指包含编码能够被转录的基因产物的至少一部分之核酸序列的载体。在一些情况下,随后将rna分子翻译成蛋白质、多肽或肽。在另一些情况下,这些序列不翻译,例如在反义分子或核酶的产生中。表达载体可包含多种“控制序列”,其是指在特定宿主生物体中转录并可以翻译可操作地连接的编码序列所需的核酸序列。除控制转录和翻译的控制序列之外,载体和表达载体还可包含用于其他功能的核酸序列,并且在下文中进行描述。
[0130]
1.调控元件
[0131]“启动子”是控制序列,其是控制转录的起始和速率的核酸序列的区域。启动子可包含调节蛋白和分子(例如rna聚合酶和其他转录因子)可结合的基因元件。短语“可操作地定位”、“可操作地连接”、“在控制下”和“在转录控制下”意指启动子处于相对于核酸序列的正确的功能位置和/或取向以控制该序列的转录起始和/或表达。启动子可与或可不与“增强子”结合使用,“增强子”是指参与核酸序列的转录激活的顺式作用调控序列。
[0132]
启动子可以是与基因或序列自然缔合的启动子,因为其可通过分离位于编码区段和/或外显子上游的5’非编码序列获得。这样的启动子可被称为“内源性”的。类似地,增强子可以是与核酸序列自然缔合、位于该序列的上游或下游的增强子。或者,通过将编码核酸区段定位在重组或异源启动子的控制下将获得某些优势,所述启动子指在其自然环境中通常不与核酸序列缔合的启动子。
[0133]
重组或异源增强子也是指在其自然环境中通常不与核酸序列缔合的增强子。这样的启动子或增强子可包括其他基因的启动子或增强子,从任何其他原核、病毒或真核细胞中分离的启动子或增强子以及非“天然存在”的启动子或增强子(即包含不同转录调节区的不同元件和/或改变表达的突变)。除了合成地产生启动子和增强子的核酸序列之外,可结合本文中公开的组合物使用重组克隆和/或核酸扩增技术(包括pcr
tm
)产生序列(参见美国专利4,683,202、美国专利5,928,906,各自通过引用并入本文)。此外,考虑到也可以使用指导在非核细胞器(例如线粒体、叶绿体等)内的序列转录和/或表达的控制序列。
[0134]
当然,利用有效指导dna区段在选择用于表达的细胞类型、细胞器和生物体中进行表达的启动子和/或增强子将是非常重要的。分子生物学领域的技术人员通常知道使用启动子、增强子和细胞类型组合来进行蛋白质表达,例如参见sambrook et al.(1989),通过
引用并入本文。所使用的启动子可以是组成型、组织特异性、诱导型和/或在合适的条件下有用的以指导引入的dna区段的高水平表达,例如有利于大规模生产重组蛋白和/或肽。启动子可以是异源的或内源的。组织特异性启动子或元件的特性以及表征其活性的测定是本领域技术人员公知的。这样的区域的一些实例包括:人limk2基因(nomoto et al.1999)、生长抑素受体2基因(kraus et al.,1998)、鼠附睾视黄酸结合基因(lareyre et al.,1999)、人cd4(zhao-emonet et al.,1998)、小鼠α2(xi)胶原蛋白(tsumaki,et al.,1998)、d1a多巴胺受体基因(lee,et al.,1997)、胰岛素样生长因子ii(wu et al.,1997)、人血小板内皮细胞黏附分子-1(almendro et al.,1996)。
[0135]
编码序列的有效翻译也可需要特定的起始信号。这些信号包括atg起始密码子或邻近序列。可能需要提供包括atg起始密码子的外源翻译控制信号。本领域普通技术人员将能够容易地对此进行确定并提供所需信号。众所周知,起始密码子必须与期望的编码序列的阅读框“同框”以确保整个插入物的翻译。外源翻译控制信号和起始密码子可以是天然的或合成的。通过包含合适的转录增强子元件可增强表达效率。
[0136]
2.ires
[0137]
在本公开内容的某些实施方案中,使用内部核糖体进入位点(internal ribosome entry site,ires)元件用来产生多基因或多顺反子信息(message)。ires元件能够绕过5’甲基化cap依赖性翻译的核糖体扫描模型并在内部位点开始翻译(pelletier和sonenberg,1988)。已经描述了来自小核糖核酸病毒科的两个成员(脊髓灰质炎和脑心肌炎)的ires元件(pelletier和sonenberg,1988),以及来自哺乳动物信息的ires(macejak和sarnow,1991)。ires元件可与异源开放阅读框连接。多个开放阅读框架可以一起转录,每个由ires分隔开,从而产生多顺反子信息。凭借ires元件,每个开放阅读框是核糖体可及的以进行有效翻译。使用单个启动子/增强子转录单个信息,多基因可以有效表达(参见美国专利5,925,565和5,935,819,通过引用并入本文)。
[0138]
3.多用途克隆位点
[0139]
载体可包含多克隆位点(multiple cloning site,mcs),其是包含多个限制酶位点的核酸区域,其中任一个可与标准重组技术结合使用来消化载体。参见carbonelli et al.,1999;levenson et al.,1998;和cocea,1997,通过引用并入本文。“限制酶消化”是指用仅在核酸分子中的特定位置发挥功能的酶对核酸分子进行催化切割。这些限制酶中的许多是可商购的。这样的酶的使用是本领域技术人员广泛理解的。通常,使用在mcs内切割的限制酶将载体线性化或片段化,以使外源序列能够连接至载体。“连接”是指在两个核酸片段之间形成磷酸二酯键的过程,所述两个核酸片段可彼此连续或可不连续。涉及限制酶和连接反应的技术是重组技术领域技术人员公知的。
[0140]
4.剪接位点
[0141]
大多数转录的真核生物rna分子将经历rna剪接以从初级转录物除去内含子。包含基因组真核序列的载体可需要供体和/或接受体剪接位点以确保转录物的正确加工用于蛋白质表达(参见chandler et al.,1997,通过引用并入本文)。
[0142]
5.终止信号
[0143]
本公开内容的载体或构建体将通常包含至少一种终止信号。“终止信号”或“终止子”由通过rna聚合酶参与rna转录物的特异性终止的dna序列构成。因此,在某些实施方案
中,考虑了结束rna转录物产生的终止信号。终止子可能是在体内达到期望信使水平所必需的。
[0144]
在真核生物系统中,终止子区域还可包含特异性dna序列,该序列允许新转录物的位点特异性切割以暴露多腺苷酸化位点。其发出信号使特化的内源聚合酶将一段约200个a残基(polya)添加至转录物的3’端。用这种poly a尾修饰的rna分子显示出更稳定并且更有效地翻译。因此,在涉及真核生物的另一些实施方案中,优选地,终止子包含用于rna切割的信号,并且更优选地,终止子信号促进信使的多腺苷酸化。终止子和/或多腺苷酸化位点元件可用来提高信使水平和/或使从该盒通读到其他序列中减至最小。
[0145]
考虑用于本公开内容的终止子包括本文中所述或本领域普通技术人员已知的任何已知的转录终止子,包括但不限于例如基因的终止序列,例如牛生长激素终止子或病毒终止序列,例如sv40终止子。在某些实施方案中,终止信号可缺少可转录或可翻译的序列,例如由于序列截短。
[0146]
6.多腺苷酸化信号
[0147]
在表达中,特别是在真核生物表达中,通常将包含多腺苷酸化信号以实现转录物合适的多腺苷酸化。不认为多腺苷酸化信号的性质是成功实践本公开内容的关键,和/或可采用任何这样的序列。一些优选实施方案包括sv40多腺苷酸化信号和/或牛生长激素多腺苷酸化信号,其在多种靶细胞中是方便的和/或已知能发挥良好的功能。多腺苷酸化可提高转录物的稳定性或可促进胞质运输。
[0148]
7.复制的起始
[0149]
为了在宿主细胞中增殖载体,其可包含一个或更多个复制起始位点(一般称为“ori”),其是在此处起始复制的特异性核酸序列。或者,如果宿主细胞是酵母,则可以使用自主复制序列(autonomously replicating sequence,ars)。
[0150]
8.选择标志物和筛选标志物
[0151]
在本公开内容的某些实施方案中,可通过在表达载体中包含标志物来体外或体内鉴定包含本公开内容的核酸构建体的细胞。这样的标志物将赋予细胞可鉴定的变化,从而允许容易地鉴定包含表达载体的细胞。一般来说,选择标志物是赋予允许选择的特性的标志物。阳性选择标志物是其中标志物的存在允许其选择的标志物,而阴性选择标志物是其中标志物的存在阻止其选择的标志物。阳性选择标志物的一个实例是抗药性标志物。
[0152]
通常包含药物选择标志物有助于转化体的克隆和鉴定,例如赋予针对新霉素、嘌呤霉素、潮霉素、dhfr、gpt、博来霉素(zeocin)和组氨醇之抗性的基因是有用的选择标志物。除赋予允许基于条件实施来区分转化体之表型的标志物之外,还考虑了其他类型的标志物,包括筛选标志物,例如gfp,其基础是比色分析。或者,可利用筛选酶,例如单纯疱疹病毒胸苷激酶(tk)或氯霉素乙酰转移酶(chloramphenicol acetyltransferase,cat)。本领域技术人员还知晓如何使用免疫标志物,可能与facs分析结合。认为所使用的标志物不重要,只要其能够与编码基因产物的核酸同时表达即可。选择标志物和筛选标志物的另外的实例是本领域技术人员公知的。
[0153]
9.病毒载体
[0154]
某些病毒载体有效感染或进入细胞、整合到宿主细胞基因组中并稳定表达病毒基因的能力已导致许多不同病毒载体系统的开发和应用(robbins et al.,1998)。目前正在
开发的病毒系统用作离体和体内基因转移的载体。例如,目前正在评价腺病毒、单纯疱疹病毒、逆转录病毒和腺相关病毒载体用于治疗疾病,例如癌症、囊性纤维化、戈谢病(gaucher disease)、肾病和关节炎(robbins和ghivizzani,1998;imai et al.,1998;美国专利5,670,488)。其他病毒载体,例如痘病毒;例如痘苗病毒(gnant et al.,1999;gnant et al.,1999),α病毒;例如辛德毕斯病毒、塞姆利基森林病毒(lundstrom,1999)、呼肠孤病毒(coffey et al.,1998)和甲型流感病毒(neumann et al.,1999)预期用于本公开内容,并可根据目标系统的必要特性进行选择。
[0155]
10.非病毒转化
[0156]
认为用于转化用于本公开内容的细胞器、细胞、组织或生物体的核酸递送的合适方法实际上包括可将核酸(例如dna)引入到细胞器、细胞、组织或生物体中的任何方法,如本文中所述或本领域普通技术人员已知的。这样的方法包括但不限于直接递送dna,例如通过注射(美国专利5,994,624、5,981,274、5,945,100、5,780,448、5,736,524、5,702,932、5,656,610、5,589,466和5,580,859,各自通过引用并入本文),包括显微注射(harland和weintraub,1985;美国专利5,789,215,通过引用并入本文);通过电穿孔(美国专利5,384,253,通过引用并入本文);通过磷酸钙沉淀(graham和van der eb,1973;chen和okayama,1987;rippe et al.,1990);通过使用deae-葡聚糖,随后使用聚乙二醇(gopal,1985);通过直接声加载(fechheimer et al.,1987);通过脂质体介导的转染(nicolau和sene,1982;fraley et al.,1979;nicolau et al.,1987;wong et al.,1980;kaneda et al.,1989;kato et al.,1991);通过微粒轰击(pct申请号wo 94/09699和95/06128;美国专利5,610,042;5,322,783、5,563,055、5,550,318、5,538,877和5,538,880,并且各自通过引用并入本文);通过与碳化硅纤维一起搅拌(kaeppler et al.,1990;美国专利5,302,523和5,464,765,各自通过引用并入本文);或者通过peg介导的原生质体的转化(omirulleh et al.,1993;美国专利4,684,611和4,952,500,各自通过引用并入本文);通过干燥/抑制介导的dna摄取(potrykus et al.,1985)。通过应用诸如这些的技术,细胞器、细胞、组织或生物体可被稳定或瞬时转化。
[0157]
11.表达系统
[0158]
存在许多表达系统,其包含以上所讨论组合物的至少部分或全部。基于原核生物和/或真核生物的系统可用于与本公开内容一起使用以产生核酸序列或其同源多肽、蛋白质和肽。许多这样的系统是可商购的并且可广泛获得的。
[0159]
昆虫细胞/杆状病毒系统可产生高水平的异源核酸区段的蛋白表达,例如在美国专利5,871,986和4,879,236中所述,二者均通过引用并入本文,并且其可例如从以名称2.0和从以bacpack
tm baculovirus expression system购买。
[0160]
表达系统的另一些实例包括的complete control
tm
诱导型哺乳动物表达系统,其涉及合成的蜕皮激素诱导型受体,或其pet表达系统,该系统是大肠杆菌(e.coli)表达系统。诱导型表达系统的另一个实例可从获得,其携带t-rex
tm
(四环素调节的表达)系统,该系统是使用全长cmv启动子的诱导型哺乳动物表达系统。还提供了称为甲醇毕赤酵母(pichia methanolica)表达系统的酵母表达系
统,其设计用于在甲基营养型酵母甲醇毕赤酵母中高水平产生重组蛋白。本领域技术人员将知道如何表达载体,例如表达构建体,以产生核酸序列或其同源多肽、蛋白质或肽。
[0161]
原代哺乳动物细胞培养物可以以多种方式制备。为了使细胞在体外并与表达构建体接触时保持活力,必需确保细胞维持与正确比例的氧气和二氧化碳和营养物接触,但要保护其免受微生物污染。细胞培养技术已有充分地文献记载。
[0162]
前述的一个实施方案涉及使用基因转移使细胞永生化以用于产生蛋白质。可如上所述将目的蛋白质的基因转移到合适的宿主细胞中,随后在合适的条件下培养细胞。实际上,任何多肽的基因都可以以该方式使用。以上讨论了重组表达载体的产生以及其中包含的元件。或者,待产生的蛋白质可以是通常由所讨论细胞合成的内源性蛋白质。
[0163]
可用哺乳动物宿主细胞系的一些实例是vero和hela细胞以及中国仓鼠卵巢细胞系、w138、bhk、cos-7、293、hepg2、nih3t3、rin和mdck细胞。另外,可选择调节插入序列的表达或以所期望方式修饰和加工基因产物的宿主细胞株。蛋白质产物的这样的修饰(例如,糖基化)和加工(例如,切割)对于蛋白质的功能可以是重要的。不同的宿主细胞具有用于蛋白质的翻译后加工和修饰的特征性和特定机制。可选择合适的细胞系或宿主系统以确保表达的外来蛋白质的正确修饰和加工。
[0164]
可使用许多选择系统,包括但不限于分别在tk-、hgprt-或aprt-细胞中的hsv胸苷激酶、次黄嘌呤-鸟嘌呤磷酸核糖基转移酶和腺嘌呤磷酸核糖基转移酶基因。同样,抗代谢物抗性可用作选择以下的基础:dhfr,其赋予抗性;gpt,其赋予对霉酚酸的抗性;neo,其赋予对氨基糖苷g418的抗性;和hygro,其赋予对潮霉素的抗性。
[0165]
iii.药物制剂和癌症治疗
[0166]
a.癌症
[0167]
癌症由来自组织的细胞的克隆群的外生长所致。癌症的发生(称为致癌作用)可以以多种方式进行建模和表征。早已认识到癌症的发生与炎症之间的关联。炎性应答涉及宿主针对微生物感染的防御,并且还驱动组织修复和再生。相当多的证据表明炎症与癌症发生风险之间存在联系,即,慢性炎症可导致发育异常。
[0168]
可应用本公开内容方法的癌细胞通常包括表达磷脂酰肌醇蛋白聚糖2的任何细胞,更具体地说,过表达磷脂酰肌醇蛋白聚糖2的细胞。可根据本公开内容处理的癌细胞包括但不限于来自以下的细胞:膀胱、血液、骨、骨髓、脑、乳腺、结肠、食管、胃肠道、牙龈(gum)、头、肾、肝、肺、鼻咽、颈、卵巢、前列腺、皮肤、胃、胰腺、睾丸、舌、子宫颈或子宫。除此之外,癌症可具体地是以下组织学类型,尽管其不限于这些:恶性赘生物;癌;未分化的癌;巨细胞和梭形细胞癌;小细胞癌;乳头状癌;鳞状细胞癌;淋巴上皮癌;基底细胞癌;毛母质癌;移行细胞癌;乳头状移行细胞癌;腺癌;恶性胃泌素瘤;胆管癌;肝细胞癌;组合肝细胞癌和胆管癌;小梁腺癌;腺样囊性癌;腺瘤性息肉中的腺癌;腺癌,家族性结肠息肉病;实体癌;恶性类癌肿瘤;支气管肺泡腺癌;乳头状腺癌;嫌色细胞癌;嗜酸性癌;嗜酸性腺癌;嗜碱性粒细胞癌;透明细胞腺癌;颗粒细胞癌;滤泡状腺癌;乳头状和滤泡状腺癌;无包膜硬化性癌;肾上腺皮质癌;子宫内膜样癌(endometroid carcinoma);皮肤附属器癌;大汗腺腺癌(apocrine adenocarcinoma);皮脂腺癌;耵聍腺癌;黏液表皮样癌;囊腺癌;乳头状囊腺癌;乳头状浆液性囊腺癌;黏液性囊腺癌;黏液腺癌;印戒细胞癌;浸润性导管癌;髓样癌;小叶癌;炎性癌;乳房佩吉特病(paget’s disease);腺泡细胞癌;腺鳞癌;腺癌w/鳞状化生;恶性
胸腺瘤;恶性卵巢间质肿瘤;恶性泡膜细胞瘤;恶性粒层细胞瘤;恶性男性母细胞瘤;sertoli细胞癌;恶性莱迪希细胞瘤(leydig cell tumor);恶性脂质细胞瘤;恶性神经节细胞瘤;恶性乳房外副神经节瘤;嗜铬细胞瘤;血管球肉瘤(glomangiosarcoma);恶性黑素瘤;无黑素性黑素瘤;浅表扩散性黑素瘤;巨大色素痣内恶性黑素瘤;上皮样细胞黑素瘤;恶性蓝痣;肉瘤;纤维肉瘤;恶性纤维组织细胞瘤;黏液肉瘤;脂肪肉瘤;平滑肌肉瘤;横纹肌肉瘤;胚胎性横纹肌肉瘤;肺泡横纹肌肉瘤;间质肉瘤;恶性混合瘤;苗勒管混合瘤(mullerian mixed tumor);肾胚细胞瘤;肝母细胞瘤;癌肉瘤;恶性间叶瘤;恶性布伦纳瘤(brenner tumor);恶性叶状肿瘤;滑膜肉瘤;恶性间皮瘤;无性细胞瘤;胚胎性癌;恶性畸胎瘤;恶性卵巢甲状腺肿;绒毛膜癌;恶性中肾瘤;血管肉瘤;恶性血管内皮瘤;卡波西肉瘤(kaposi’s sarcoma);恶性血管外皮细胞瘤;淋巴管肉瘤;骨肉瘤;皮质旁骨肉瘤;软骨肉瘤;恶性成软骨细胞瘤;间质软骨肉瘤;骨巨细胞瘤;尤因肉瘤(ewing’s sarcoma);恶性牙源性肿瘤;成釉细胞牙肉瘤;恶性成釉细胞瘤;成釉细胞纤维肉瘤;恶性松果体瘤;脊索瘤;恶性神经胶质瘤;室管膜瘤;星形细胞瘤;原浆性星形细胞瘤;纤维性星形细胞瘤;星形母细胞瘤;成胶质细胞瘤;少突神经胶质瘤;成少突神经胶质细胞瘤;原发性神经外胚层;小脑肉瘤;成神经节细胞瘤;成神经细胞瘤;视网膜母细胞瘤;嗅神经源性肿瘤;恶性脑膜瘤;神经纤维肉瘤;恶性神经鞘瘤;恶性颗粒细胞瘤;恶性淋巴瘤;霍奇金病(hodgkin’s disease);副肉芽肿;恶性淋巴瘤,小淋巴细胞性;恶性淋巴瘤,大细胞,弥散性;恶性淋巴瘤,滤泡性;蕈样霉菌病;其他特定的非霍奇金淋巴瘤;恶性组织细胞增生症;多发性骨髓瘤;肥大细胞肉瘤;免疫增生性小肠疾病;白血病;淋巴性白血病;浆细胞白血病;红白血病;淋巴肉瘤细胞白血病;髓性白血病;嗜碱细胞性白血病;嗜酸细胞性白血病;单核细胞白血病;肥大细胞白血病;巨核母细胞白血病;髓样肉瘤;和毛细胞白血病。在某些方面中,肿瘤可包括骨肉瘤、血管肉瘤、横纹肌肉瘤、平滑肌肉瘤、尤因肉瘤、胶质母细胞瘤、髓母细胞瘤、神经母细胞瘤或白血病。
[0169]
另外,本公开内容的方法可应用于多种物种,例如人、非人灵长类(例如猴、狒狒或黑猩猩)、马、牛、猪、绵羊、山羊、狗、猫、兔、豚鼠、沙鼠、仓鼠、大鼠和小鼠。癌症还可以是复发性的、转移性的和/或多重抗药性的,并且本公开内容的方法可特别地应用于这样的癌症以使其可切除、延长或重新诱导缓解、抑制血管生成、预防或限制转移,和/或治疗多重抗药性癌症。在细胞水平上,这可转化为杀伤癌细胞、抑制癌细胞生长或以其他方式逆转或减少肿瘤细胞的恶性表型。
[0170]
b.制剂和施用
[0171]
本公开内容提供了药物组合物,其包含抗磷脂酰肌醇蛋白聚糖2受体和其表达细胞。在一个具体实施方案中,术语“可药用”意指由联邦或州政府的监管机构批准或者在美国药典或其他公认的药典中列出用于动物并且更特别是用于人。术语“载体”是指借助其施用治疗剂的稀释剂、赋形剂或载剂。这样的药用载体可以是无菌液体,例如水和油,包括石油、动物、植物或合成来源的那些,例如花生油、豆油、矿物油、芝麻油等。另一些合适的药用赋形剂包括淀粉、葡萄糖、乳糖、蔗糖、盐水、右旋糖、明胶、麦芽、稻、面粉、白垩、硅胶、硬脂酸钠、单硬脂酸甘油酯、滑石、氯化钠、脱脂乳粉、甘油、丙二醇、水、乙醇等。
[0172]
所述组合物可以配制为中性或盐形式。可药用盐包括与阴离子形成的那些,所述阴离子例如来源于盐酸、磷酸、乙酸、草酸、酒石酸等的那些;以及与阳离子形成的那些,所述阳离子例如来源于钠、钾、铵、钙、氢氧化铁、异丙胺、三乙胺、2-乙基氨基乙醇、组氨酸、普
鲁卡因等的那些。
[0173]
本公开内容的受体、核酸和细胞可包括经典药物制剂。根据本公开内容的这些组合物的施用将通过任何常见途径进行,只要靶组织通过该途径可及即可。这包括经口、经鼻、含服、经直肠、经阴道或表面。或者,施用可通过皮内、皮下、肌内、腹膜内或静脉内注射来进行。这样的组合物通常作为上述的可药用组合物施用。特别感兴趣的是直接瘤内施用、肿瘤输注或者局部或区域性施用到肿瘤,例如在局部或区域性脉管系统或淋巴系统中,或者在切除的肿瘤床中。
[0174]
活性化合物还可肠胃外或腹膜内施用。作为游离碱或者药理学上可接受的盐的活性化合物的溶液可在与表面活性剂(例如羟丙基纤维素)适当混合的水中制备。也可在甘油、液体聚乙二醇、及其混合物中和在油中制备分散体。在普通储存和使用条件下,这些制剂包含防腐剂以防止微生物的生长。
[0175]
c.组合治疗
[0176]
在本公开内容的上下文中,还考虑了本文中所述的抗磷脂酰肌醇蛋白聚糖2 car t细胞可类似地与免疫、化学或放射治疗干预或其他治疗结合使用。特别是将抗磷脂酰肌醇蛋白聚糖2 car t细胞与靶向磷脂酰肌醇蛋白聚糖2功能不同方面的其他治疗组合也可被证明是有效的。
[0177]
为了使用本公开内容的方法和组合物杀伤细胞、抑制细胞生长、抑制转移、抑制血管生成或以其他方式逆转或减少肿瘤细胞的恶性表型,通常使“靶”细胞与根据本公开内容的抗磷脂酰肌醇蛋白聚糖2 car t细胞和至少一种其他药剂接触。这些组合物将以有效杀伤或抑制细胞增殖的组合量提供。该过程可包括使细胞与根据本公开内容的抗磷脂酰肌醇蛋白聚糖2 car t细胞和其他药剂或因素同时接触。这可通过使细胞与包含这两种药剂的单一组合物或药理制剂接触,或者通过使细胞与两种不同的组合物或制剂同时接触来实现,其中一种组合物包含根据本公开内容的抗磷脂酰肌醇蛋白聚糖2 car t细胞并且另一种包含其他药剂。
[0178]
或者,抗磷脂酰肌醇蛋白聚糖2 car t细胞治疗可以在其他药剂治疗之前或之后间隔数分钟至数周进行。在其中向细胞单独施加其他药剂和抗磷脂酰肌醇蛋白聚糖2 car t细胞的一些实施方案中,通常应确保每次递送之间的重要时间段没有期满,以使得药剂和表达构建体仍将能够对细胞发挥有利的组合作用。在这样的情况下,考虑在彼此约12至24小时内使细胞与这两种形式接触,并且该时间更优选地在彼此约6至12小时内,并且最优选的是延迟时间为仅约12小时。然而,在一些情况下,可期望显著延长治疗期,其中各施用之间的时间相隔数天(2、3、4、5、6或7天)至数周(1、2、3、4、5、6、7或8周)。
[0179]
还可以想到,抗磷脂酰肌醇蛋白聚糖2 car t细胞或另一种药剂的多于一次施用是期望的。可采用多种组合,其中根据本公开内容的抗磷脂酰肌醇蛋白聚糖2 car t细胞为“a”,并且另一种治疗为“b”,如下所示:
[0180]
a/b/a b/a/b b/b/a a/a/b b/a/a a/b/b b/b/b/a b/b/a/b
[0181]
a/a/b/b a/b/a/b a/b/b/a b/b/a/a b/a/b/a b/a/a/b b/b/b/a
[0182]
a/a/a/b b/a/a/a a/b/a/a a/a/b/a a/b/b/b b/a/b/b b/b/a/b
[0183]
考虑其他组合。再次,为了实现细胞杀伤,将这两种药剂以有效杀伤细胞的组合量递送至细胞。适合于癌症治疗的药剂或因素包括在向细胞施加时诱导损伤的任何化学化合
物或治疗方法。这样的药剂和因素包括诱导dna损伤的辐射和波,例如辐照、微波、电子发射等。可使用多种化学化合物,其也描述为“化学治疗剂”或“遗传毒性剂”。这可通过照射局部肿瘤部位来实现;或者,可通过向对象施用治疗有效量的药物组合物来使肿瘤细胞与药剂接触。组合治疗也可包括手术。下面讨论了这些治疗的多种模式。
[0184]
1.化学治疗
[0185]
术语“化学治疗”是指使用药物治疗癌症。“化学治疗剂”用于表示在癌症治疗中施用的化合物或组合物。这些药剂或药物通过其在细胞内的活性模式(例如其是否影响细胞周期和在什么阶段影响细胞周期)进行分类。或者,可基于其直接交联dna、嵌入dna或通过影响核酸合成来诱导染色体和有丝分裂畸变的能力来表征药剂。大多数化学治疗药剂落入以下类别:烷化剂、抗代谢剂、抗肿瘤抗生素、有丝分裂抑制剂和亚硝基脲。
[0186]
化学治疗剂的一些实例包括烷化剂类,例如噻替派和环磷酰胺;烷基磺酸酯类,例如白消安、英丙舒凡和哌泊舒凡;氮杂环丙烷类,例如苯佐替哌(benzodopa)、卡波醌、美妥替哌(meturedopa)和乌瑞替派(uredopa);乙撑亚胺类(ethylenimines)和甲基蜜胺类,包括六甲蜜胺、三乙撑蜜胺(triethylenemelamine)、三乙撑磷酰胺(trietylenephosphoramide)、三乙撑硫代磷酰胺(triethiylenethiophosphoramide)和三甲蜜胺;番荔枝内酯类(acetogenins)(尤其是布拉他辛和布拉他辛酮);喜树碱类(包括合成的类似物拓扑替康);苔藓虫素;卡利他汀(callystatin);cc-1065(包括其阿多来新、卡折来新和比折来新合成类似物);念珠藻素(特别是念珠藻素1和念珠藻素8);海兔毒素;倍癌霉素(包括合成类似物kw-2189和cb1-tm1);五加素;水鬼蕉碱;匍枝珊瑚醇类;海绵抑制素;氮芥类,例如苯丁酸氮芥、萘氮芥、氯磷酰胺、雌莫司汀、异环磷酰胺、氮芥、盐酸甲氧氮芥、美法仑、新恩比兴、苯芥胆甾醇、泼尼莫司汀、曲磷胺、尿嘧啶氮芥;亚硝基脲类,例如卡莫司汀、氯脲霉素、福莫司汀、洛莫司汀、尼莫司汀和雷莫司汀;抗生素,例如烯二炔类抗生素(例如,加利车霉素,尤其是加利车霉素γ1i和加利车霉素ωi1);达因霉素,包括达因霉素auncialamycin及其衍生物;二膦酸盐类,例如氯膦酸盐;埃斯培拉霉素类;以及新制癌菌素发色团和相关色蛋白烯二炔抗生素发色团、阿克拉霉素、放线菌素、安曲霉素、重氮丝氨酸、博来霉素、放线菌素c(cactinomycin)、卡柔比星、洋红霉素、嗜癌菌素、色霉素、更生霉素、柔红霉素、地托比星、6-重氮-5-氧代-l-正亮氨酸、多柔比星(包括吗啉代-多柔比星、氰基吗啉代-多柔比星、2-吡咯啉基-多柔比星和脱氧多柔比星)、表柔比星、依索比星、伊达比星、麻西罗霉素、丝裂霉素类(例如丝裂霉素c)、霉酚酸、诺加霉素、橄榄霉素类、培洛霉素、泼非霉素、嘌呤霉素、三铁阿霉素、罗多比星、链黑菌素、链脲霉素、杀结核菌素、乌苯美司、净司他丁、佐柔比星;抗代谢物类,例如甲氨蝶呤和5-氟脲嘧啶(5-fu);叶酸类似物,例如二甲叶酸、氨甲蝶呤、蝶罗呤、三甲曲沙;嘌呤类似物,例如氟达拉滨、6-巯基嘌呤、硫咪嘌呤、硫鸟嘌呤;嘧啶类似物,例如安西他滨、阿扎胞苷、6-氮尿苷、卡莫氟、阿糖胞苷、二脱氧尿苷、去氧氟尿苷、依诺他滨、氟尿苷;雄激素,例如卡鲁睾酮、丙酸屈他雄酮、环硫雄醇、美雄烷、睾内酯;抗肾上腺类,例如氨鲁米特、米托坦、曲洛司坦;叶酸补充剂,例如亚叶酸;醋葡醛内酯;醛磷酰胺糖苷;氨基乙酰丙酸;恩尿嘧啶;安吖啶;贝斯布西;比生群;依达曲沙;地磷酰胺(defofamine);秋水仙胺;地吖醌;依洛尼塞;依利醋铵;埃博霉素类;依托格鲁;硝酸镓;羟基脲;香菇多糖;氯尼达明;美登木素生物碱类,例如美登素和安丝菌素;米托胍腙;米托蒽醌;莫哌达醇;尼曲吖啶;喷司他丁;蛋氨氮芥(phenamet);吡柔比星;洛索蒽醌;鬼臼
酸;2-乙酰肼;丙卡巴肼;psk多糖复合物);雷佐生;根霉素;西佐喃;锗螺胺(spirogermanium);细交链孢菌酮酸(tenuazonic acid);三亚胺醌;2,2’,2
”‑
三氯三乙胺;单端孢霉烯类(尤其是t-2毒素、疣孢菌素a、漆斑菌素a和蛇形菌素);乌拉坦;长春地辛;达卡巴嗪;甘露莫司汀;二溴甘露醇;二溴卫矛醇;哌泊溴烷;加西托星;阿拉伯糖苷(“ara-c”);环磷酰胺;噻替哌;紫杉烷类,例如紫杉醇和多西他赛;苯丁酸氮芥;吉西他滨;6-硫鸟嘌呤;巯基嘌呤;氨甲喋呤;铂配位络合物,例如顺铂、奥沙利铂和卡铂;长春碱;铂;依托泊苷(vp-16);异环磷酰胺;米托蒽醌;长春新碱;长春瑞滨;诺消灵(novantrone);替尼泊苷;依达曲沙;道诺霉素;氨基喋呤;希罗达;伊班膦酸盐;伊立替康(例如,cpt-11);拓扑异构酶抑制剂rfs 2000;二氟甲基鸟氨酸(dfmo);类视黄醇,例如视黄酸;卡培他滨;顺铂(cddp);卡铂、丙卡巴肼、氮芥、环磷酰胺、喜树碱、异环磷酰胺、美法仑、苯丁酸氮芥、白消安、亚硝基脲、更生霉素、柔红霉素、多柔比星、博来霉素、普卡霉素、丝裂霉素、依托泊苷(vp-16)、他莫昔芬、雷洛昔芬、雌激素受体结合剂、紫杉醇(taxol)、紫杉醇(paclitaxel)、多西他赛、吉西他滨、诺维本、法尼基-蛋白质转移酶抑制剂、反铂、5-氟脲嘧啶、长春新碱、长春碱和甲氨蝶呤,以及上述任意一种的可药用的盐、酸或衍生物。
[0187]
2.放射治疗
[0188]
放射治疗(radiotherapy),也称辐射治疗(radiation therapy),是用电离辐射治疗癌症和其他疾病。电离辐射沉积能量,这通过损坏正被治疗的区域中细胞的遗传物质使得这些细胞不可能继续生长来损伤或破坏所述细胞。尽管辐射损伤癌细胞和正常细胞二者,但后者能够自我修复并正确发挥功能。
[0189]
根据本公开内容使用的辐射治疗可包括但不限于使用γ-射线、x射线和/或向肿瘤细胞定向递送的放射性同位素。还考虑了其他形式的dna损伤因素,例如微波和uv辐照。最可能的是所有这些因素诱导对dna、dna的前体、dna的复制和修复以及对染色体的组装和维持的广泛的损伤。x射线的剂量范围为从50至200伦琴的日剂量持续延长的一段时间(3至4周)到2000至6000伦琴的单剂量。放射性同位素的剂量范围变化很大,并且取决于同位素的半衰期、所发射的放射的强度和类型以及赘生性细胞的摄取。
[0190]
放射治疗可包括使用经放射性标记的抗体将辐射剂量直接递送至癌症部位(放射免疫治疗)。抗体是由身体响应于抗原(被免疫系统识别为外源的物质)之存在而产生的高度特异性蛋白质。一些肿瘤细胞含有触发产生肿瘤特异性抗体的特异性抗原。大量的这些抗体可在实验室中制备并且与放射性物质连接(称为放射性标记的过程)。一旦注射到体内,抗体就会主动寻找癌细胞,其被辐射的细胞杀伤(细胞毒性)作用破坏。这种方法可使对健康细胞的辐射损伤的风险最小化。
[0191]
适形放射治疗与常规放射治疗使用相同的放射治疗机、直线加速器,但是金属块被放置在x射线束的路径中以改变其形状从而匹配癌症的形状。这确保了向肿瘤给予更高的辐射剂量。健康的周围细胞和附近的结构接受较低剂量的辐射,因此降低了副作用的可能性。已经开发了称为多叶准直器的装置并且其可用作金属块的替代物。多叶准直器由固定于直线加速器的多个金属片组成。可调整各层,以使得放射治疗束可成形为治疗区域,而不需要金属块。放射治疗机的精确定位对于适形放射治疗非常重要,并且可在每次治疗开始时使用特殊的扫描机检查内脏的位置。
[0192]
高分辨率强度调制的放射治疗也使用多叶准直器。在该治疗期间,在给予治疗的
al.,1992;mitchell et al.,1990;mitchell et al.,1993)。
[0200]
在过继性免疫治疗中,在体外分离患者的循环淋巴细胞或肿瘤浸润的淋巴细胞,通过淋巴因子(例如il-2)激活或用肿瘤坏死基因转导,并再施用(rosenberg et al.,1988;1989)。
[0201]
4.手术
[0202]
约60%患有癌症的人将经历某种类型的手术,其包括预防性、诊断性或分期、治愈性和姑息性手术。治愈性手术是可与其他治疗(例如本公开内容的治疗、化学治疗、放射治疗、激素治疗、基因治疗、免疫治疗和/或替代治疗)联合使用的癌症治疗。
[0203]
治愈性手术包括其中物理去除、切除和/或破坏全部或一部分癌组织的切除术。肿瘤切除术是指物理去除至少一部分肿瘤。除肿瘤切除术之外,通过手术的治疗还包括激光手术、冷冻手术、电外科手术和用显微控制的手术(莫氏手术(mohs’surgery))。还预期的是,本公开内容可与浅表癌、初癌或伴随量的正常组织的去除联合使用。
[0204]
在切除一部分或所有癌细胞、组织或肿瘤之后,可在体内形成腔。治疗可通过向该区域灌注、直接注射或局部施用另外的抗癌治疗来完成。可重复这样的治疗,例如每1、2、3、4、5、6或7天,或者每1、2、3、4和5周或者每1、2、3、4、5、6、7、8、9、10、11或12个月重复。这些治疗也可具有多种剂量。
[0205]
在一些具体实施方案中,在去除肿瘤之后,用本公开内容的化合物进行辅助治疗被认为在降低肿瘤的复发方面特别有效。另外,本公开内容的化合物还可用于新辅助情况。
[0206]
还应该指出的是,任何前述治疗可证明自身可用于治疗癌症中。熟练技术人员请参阅“remington’s pharmaceutical sciences”第15版第33章,特别是第624-652页。根据治疗对象的情况,剂量必然会发生一些变化。在任何情况下,负责施用的人员将确定个体对象的适当剂量。此外,对于人体施用,制剂应符合fda生物制品标准办公室要求的无菌性、热原性、一般安全性和纯度标准。
[0207]
iv.试剂盒
[0208]
在另一些实施方案中,提供了用于上述方法的试剂盒。因此,试剂盒将在适当的容器装置中包含car、编码car的核酸或首先表达结合磷脂酰肌醇蛋白聚糖2抗原的car的细胞。
[0209]
试剂盒的容器装置通常包括至少一个小瓶、试管、烧瓶、瓶、注射器或其他容器装置,其中可放置细胞,或者优选将细胞适当地等分。试剂盒还包括用于封闭限制式容纳car、核酸或细胞和任何其他试剂以用于商业销售的装置。这样的容器可包括其中保持期望小瓶的注塑或吹塑的塑料容器。
[0210]
v.实施例
[0211]
包括以下实例以演示一些优选的实施方案。本领域技术人员应当理解,在下面的实例中公开的技术代表了发明人发现的在实施方案的实践中很好地发挥作用的技术,因此可以被认为是构成其实践的优选模式。然而,根据本发明的公开内容,本领域技术人员应当理解,在不脱离本公开内容的精神和范围的情况下,可以在所公开的特定实施方案中进行许多改变,并且仍然获得相同或类似的结果。
[0212]
实施例1
[0213]
从噬菌体展示抗体文库中分离出一组特异性靶向癌细胞相关gpc2的三种全人抗
体(m201、m202和m203),并使其亲和力成熟。体外表征表明,这些抗体在用于癌症治疗的car-t、抗体药物缀合物(adc)和双特异性抗体开发中具有有前景的治疗活性。抗体序列在图1至3中示出。
[0214]
gpc2最近被鉴定为神经母细胞瘤和髓母细胞瘤中的新癌基因和免疫治疗靶标。发明人使用与4-1bb和cd3ζ共刺激结构域配对的gpc2特异性scfv,以不同的重链和轻链取向以及链之间的接头长度,创建了多个不同的rna car构建体。它们评价了car持久性、t细胞耗竭标志物以及针对四种原发性和两种等基因神经母细胞瘤细胞系以及三种原发性hgg细胞系的细胞毒性。通过流式细胞术,所有四种构建体均显示>80%的car表达和gpc2特异性结合。轻到重(vl-vh)构型的car分子显示在表面上持续存在超过七天,并且与重到轻(vh-vl)构型相比,细胞毒性增加。带有长接头的vh-vl构型提供了最弱的细胞毒性作用,并且阴性检查点调节物的评价揭示pd1和lag3的表达最高(在其他构建体中为62%相比于17至40%,p<0.0001)。基于体外数据,选择了两种vl-vh car构建体,以用于在用iv gpc2 car t细胞处理(每周一次,共三个剂量)的神经母细胞瘤的鼠胁腹模型中进行测试。在第14天时,与cd19 car对照相比,用这两种vl-vh car构建体处理的动物具有降低的肿瘤负荷(p<0.01),有数只动物显示出完全应答。目前正在进行评价使用局部递送在小儿hgg原位模型中的效力的研究。
[0215]
多种car t细胞构建体的稳定表达是通过改造基于dna的第二代car载体来实现的,其基于2种已报道的gpc2 scfv(d3和d4),并接下来在原代人t细胞中进行逆转录病毒转导。具有cd8a铰链和跨膜结构域和41bbz信号传导结构域的改造的初始构建体,在两个取向上具有n端可变重链或n端可变轻链(图9b),显示稳定的细胞表面表达和结合的可溶性重组gpc2(图9c)。这些构建体显示出针对等基因靶细胞的高效体外效力和细胞因子产生(ifny,il2),这些靶细胞被改造为以与gpc2(kelly-gpc2)的体内水平相当的水平表达gpc2,效应物与靶标的比例为1∶1(图11a至d)。此外,发明人证明了将cd28-h/tm和共刺激结构域并入到这些car构建体中在靶向表达gpc2的肿瘤时表现出另外的car t细胞潜能优势(图14a至b)。综上所述,这些数据显示,利用基于dna的car载体和病毒转导,可以改造稳定的靶向gpc2的car t细胞,其对表达gpc2的癌细胞产生高效的杀伤作用。
[0216]
这些数据显示,mrna为测试新的car t细胞提供了快速和重复的(iterative)方法,并且gpc2是神经母细胞瘤、髓母细胞瘤以及高级胶质瘤和其他小儿恶性脑肿瘤的子集中有前景的car t细胞靶标。在鼠模型中,呈具有长接头构型的轻至重d3 scfv链的rna gpc2 car t细胞提供最强的细胞毒性作用,且没有毒性的证据。
[0217]
通过慢病毒(图15a至f)和逆转录病毒(图16a至b)转导的基于d3(m201)的gpc2 dna car t细胞对神经母细胞瘤临床前模型也具有高效的细胞毒性。gpc2 car在t细胞上稳健表达(图15a),并且对等基因sy5y-gpc2神经母细胞瘤细胞具有细胞毒性(图15b),共培养导致同时的t细胞活化以及增加的infγ和cd107a t细胞表达(图15c至d)。d3(m201)长接头28/28/41bb(基于d3(m201)的gpc2 car,其具有基于cd28的铰链/基于cd28的tm/41bb共刺激结构域)和长接头28/28/28(基于d3(m201)的gpc2 car,其具有基于cd28的铰链/基于cd28的tm/cd28共刺激结构域)显示出高效的体内活性,其诱导稳健的cog-n-421x神经母细胞瘤患者来源的异种移植肿瘤消退,并且耐受性非常好(图15e至f)。在转移性sms-san神经母细胞瘤模型中,基于d3(m201)的gpc2 car t细胞也诱导肿瘤消退(图16a至b)
[0218]
*****************
[0219]
根据本公开内容,无需过度实验即可制备和实施本文中公开和要求保护的所有组合物和方法。尽管已根据一些优选实施方案描述了本公开内容的组合物和方法,但是对于本领域技术人员而言明显的是,在不脱离本公开内容的概念、精神和范围的情况下,可对本文中描述的组合物和方法以及方法的步骤或步骤顺序进行变化。更具体地,明显的是,可用化学和生理学二者相关的某些试剂替代本文中描述的试剂,同时将获得相同或相似的结果。对于本领域技术人员明显的所有这样的类似替代和修改被认为是在如所附权利要求书限定的本公开内容的精神、范围和概念内。
[0220]
vii.参考文献
[0221]
以下参考文献就其提供补充本文中阐述内容的示例性程序或其他细节而言特别地通过引用并入本文。
[0222]
美国专利3,817,837
[0223]
美国专利3,850,752
[0224]
美国专利3,939,350
[0225]
美国专利3,996,345
[0226]
美国专利4,196,265
[0227]
美国专利4,275,149
[0228]
美国专利4,277,437
[0229]
美国专利4,366,241
[0230]
美国专利4,472,509
[0231]
美国专利4,554,101
[0232]
美国专利4,680,338
[0233]
美国专利4,683,202
[0234]
美国专利4,684,611
[0235]
美国专利4,816,567
[0236]
美国专利4,867,973
[0237]
美国专利4,879,236
[0238]
美国专利4,938,948
[0239]
美国专利4,952,500
[0240]
美国专利5,021,236
[0241]
美国专利5,141,648
[0242]
美国专利5,196,066
[0243]
美国专利5,302,523
[0244]
美国专利5,322,783
[0245]
美国专利5,384,253
[0246]
美国专利5,464,765
[0247]
美国专利5,538,877
[0248]
美国专利5,538,880
[0249]
美国专利5,550,318
[0250]
美国专利5,563,055
[0251]
美国专利5,563,250
[0252]
美国专利5,565,332
[0253]
美国专利5,580,859
[0254]
美国专利5,589,466
[0255]
美国专利5,610,042
[0256]
美国专利5,656,610
[0257]
美国专利5,670,488
[0258]
美国专利5,702,932
[0259]
美国专利5,736,524
[0260]
美国专利5,780,448
[0261]
美国专利5,789,215
[0262]
美国专利5,824,544
[0263]
美国专利5,856,456
[0264]
美国专利5,858,744
[0265]
美国专利5,871,982
[0266]
美国专利5,871,986
[0267]
美国专利5,880,270
[0268]
美国专利5,925,565
[0269]
美国专利5,928,906
[0270]
美国专利5,935,819
[0271]
美国专利5,945,100
[0272]
美国专利5,981,274
[0273]
美国专利5,994,624
[0274]“antibodies:a laboratory manual,”cold spring harbor press,cold spring harbor,ny,1988.
[0275]
abbondanzo et al.,am.j.pediatr.hematol.oncol.,12(4),480-489,1990.
[0276]
allred et al.,arch.surg.,125(1),107-113,1990.
[0277]
almendro et al.,j.immunol.,157(12):5411-5421,1996.
[0278]
atherton et al.,biol.of reproduction,32,155-171,1985.
[0279]
ausubel et al.,current protocols in molecular biology,greene publishing associates and wiley interscience,n.y.,1994.
[0280]
beidler et al.,j.immunol.,141(11):4053-4060,1988.
[0281]
bosse et al.,cancer cell,32:295-309,e212,2017
[0282]
brown et al.,j.immunol.meth.,12;130(1),:111-121,1990.
[0283]
campbell,in:monoclonal antibody technology,laboratory techniques in biochemistry and molecular biology,vol.13,burden and von knippenberg,eds.pp.75-83,amsterdam,elsevier,1984.
[0284]
capaldi et al.,biochem.biophys.res.comm.,74(2):425-433,1977.
[0285]
carbonelli et al.,fems microbiol.lett.,177(1):75-82,1999.
[0286]
chandler et al.,proc.natl.acad.sci.usa,94(8):3596-601,1997.
[0287]
chen and okayama,mol.cell biol.,7(8):2745-2752,1987.
[0288]
cocea,biotechniques,23(5):814-816,1997.
[0289]
coffey et al.,science,282(5392):1332-1334,1998.
[0290]
de jager et al.,semin.nucl.med.23(2),165-179,1993.
[0291]
dholakia et al.,j.biol.chem.,264,20638-20642,1989.
[0292]
doolittle and ben-zeev,methods mol.biol.,109,215-237,1999.
[0293]
欧洲申请125,023
[0294]
欧洲申请171,496
[0295]
欧洲申请173,494
[0296]
欧洲申请184,187
[0297]
欧洲申请273,085
[0298]
fechheimer et al.,proc natl.acad.sci.usa,84:8463-8467,1987.
[0299]
fraley et al.,proc.natl.acad.sci.usa,76:3348-3352,1979.
[0300]
gefter et al.,somatic cell genet.,3:231-236,1977.
[0301]
gnant et al.,cancer res.,59(14):3396-403,1999.
[0302]
gnant et al.,j.natl.cancer inst.,91(20):1744-1750,1999.
[0303]
goding,in:monoclonal antibodies:principles and practice,2d ed.,orlando,fla.,academic press,60-61,65-66,71-74,1986.
[0304]
gopal,mol.cell biol.,5:1188-1190,1985.
[0305]
graham and van der eb,virology,52:456-467,1973.
[0306]
greene et al.,immunology today,10:272,1989.
[0307]
gulbis and galand,hum.pathol.24(12),1271-1285,1993.
[0308]
harland and weintraub,j.cell biol.,101(3):1094-1099,1985.
[0309]
imai et al.,nephrologie,19(7):397-402,1998.
[0310]
jones et al.,nature,321:522-525,1986.
[0311]
kaeppler et al.,plant cell rep.,8:415-418,1990.
[0312]
kaneda et al.,science,243:375-378,1989.
[0313]
kato et al,j.biol.chem.,266:3361-3364,1991.
[0314]
khatoon et al.,ann.of neurology,26,210-219,1989.
[0315]
king et al.,j.biol.chem.,269,10210-10218,1989.
[0316]
kohler and milstein,eur.j.immunol.,6,511-519,1976.
[0317]
kohler and milstein,nature,256,495-497,1975.
[0318]
kraus et al.febs lett.,428(3):165-170,1998.
[0319]
kyte and doolittle,j.mol.biol.,157(1):105-132,1982.
[0320]
lareyre et al.,j.biol.chem.,274(12):8282-8290,1999.
[0321]
levenson et al.,hum.gene ther.,9(8):1233-1236,1998.
[0322]
lundstrom,j.recept signal transduct.res.,19(1-4):673-686,1999.
[0323]
macejak and sarnow,nature,353:90-94,1991.
[0324]
morrison,science,229(4719):1202-1207,1985.
[0325]
nakamura et al.,in:enzyme immunoassays:heterogeneous and homogeneous systems,chapter 27,1987.
[0326]
neumann et al.,proc.natl.acad.sci.usa,96(16):9345-9350,1999.
[0327]
nicolau and sene,biochim.biophys.acta,721:185-190,1982.
[0328]
nicolau et al.,methods enzymol.,149:157-176,1987.
[0329]
nomoto et al.,gene,236(2):259-271,1999.
[0330]
omirulleh et al.,plant mol.biol.,21(3):415-428,1993.
[0331]o′
shannessy et al.,j.immun.meth.,99,153-161,1987.
[0332]
owens and haley,j.biol.chem.,259,14843-14848,1987.
[0333]
pct申请pct/us86/02269
[0334]
pct申请wo 86/01533
[0335]
pct申请wo 94/09699
[0336]
pct申请wo 95/06128
[0337]
pelletier and sonenberg,nature,334(6180):320-325,1988.
[0338]
posner et al.,hybridoma 6,611-625,1987.
[0339]
potrykus et al.,mol.gen.genet.,199(2):169-177,1985.
[0340]
potter and haley,meth.enzymol.,91,613-633,1983.
[0341]
remington’s pharmaceutical sciences,15
th
ed.,33:624-652,1990.
[0342]
rippe,et al.,mol.cell biol.,10:689-695,1990.
[0343]
robbins and ghivizzani,pharmacol ther,80(1):35-47,1998.
[0344]
robbins et al.,trends biotechnol.,16(1):35-40,1998.
[0345]
sambrook et al.,in:molecular cloning:a laboratory manual,2
nd ed.,cold spring harbor laboratorypress,cold spring harbor,ny,1989.
[0346]
shaw et al.,j.natl.cancer inst.,80(19):1553-1559,1988.
[0347]
sun et al.,j.steroid biochem.,26(1):83-92,1987.
[0348]
tsumaki et al.,j.biol.chem.,273(36):22861-2286
[0349]
verhoeyen et al.,science,239(4847):1534-1536,1988.
[0350]
wawrzynczak&thorpe,cancer treat res.,37:239-51,1988.
[0351]
wong et al.,gene,10:87-94,1980.
[0352]
wood et al.,j.clin.lab.immunol.,17(4):167-171,1985.
[0353]
wu et al.,biochem.biophys.res.commun.,233(1):221-226,1997.
[0354]
zhao-emonet et al.,biochim.biophys.acta,1442(2-3):109-119,1998.
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。